लेजर कैप्चर माइक्रोडिसेक्शन: Difference between revisions
No edit summary |
|||
| Line 1: | Line 1: | ||
[[Image:Laser capture microdissection transfer of pure breast duct epithelial cells.jpg|thumb|300 पीएक्स | शुद्ध [[दूधिया वाहिनी]] एपिथेलियल कोशिकाओं का लेज़र कैप्चर माइक्रो-विच्छेदन स्थानांतरण। बायां पैनल चयनित कोशिकाओं को हटाए जाने के साथ ऊतक अनुभाग दिखाता है। दायाँ पैनल स्थानांतरण फिल्म पर पृथक उपकला कोशिकाओं को दिखाता है।]]लेज़र अधिकृत सूक्ष्मविच्छेदन (LCM), जिसे सूक्ष्मविच्छेदन, लेज़र सूक्ष्मविच्छेदन (LMD), या लेज़र-सहाय प्रदत्त सूक्ष्मविच्छेदन (एलएमडी (LMD) या एलएएम (LAM)) भी कहा जाता है, ऊतक/कोशिकाओं/[[जीव|जीवों]]<ref name="pmid8875945">{{cite journal |vauthors=Emmert-Buck MR, Bonner RF, Smith PD, Chuaqui RF, Zhuang Z, Goldstein SR, Weiss RA, Liotta LA |title = लेजर कैप्चर माइक्रोडिसेक्शन|journal = Science|volume = 274|issue = 5289|pages = 998–1001|year = 1996|pmid = 8875945|doi = 10.1126/science.274.5289.998| bibcode=1996Sci...274..998E |citeseerx = 10.1.1.462.2914| s2cid=32921237 }}{{Closed access}}</ref><ref name="pmid17892370">{{cite journal |vauthors=Espina V, Heiby M, Pierobon M, Liotta LA |title = लेजर कैप्चर माइक्रो-विच्छेदन तकनीक|journal = Expert Rev. Mol. Diagn.|volume = 7|issue = 5|pages = 647–57|year = 2007|pmid = 17892370|doi = 10.1586/14737159.7.5.647| s2cid=46548538 }}{{Closed access}}</ref> के सूक्ष्मदर्शीय क्षेत्रों ([[लेज़र|लेजर]] की मदद से [[माइक्रोस्कोपी|सूक्ष्मदर्शीय]] पैमाने पर [[विच्छेदन]]) से विशिष्ट कोशिकाओं को अलग करने की एक विधि है। | [[Image:Laser capture microdissection transfer of pure breast duct epithelial cells.jpg|thumb|300 पीएक्स | शुद्ध [[दूधिया वाहिनी]] एपिथेलियल कोशिकाओं का लेज़र कैप्चर माइक्रो-विच्छेदन स्थानांतरण। बायां पैनल चयनित कोशिकाओं को हटाए जाने के साथ ऊतक अनुभाग दिखाता है। दायाँ पैनल स्थानांतरण फिल्म पर पृथक उपकला कोशिकाओं को दिखाता है।]]'''लेज़र अधिकृत सूक्ष्मविच्छेदन''' ('''LCM'''), जिसे '''सूक्ष्मविच्छेदन''', '''लेज़र सूक्ष्मविच्छेदन''' ('''LMD'''), या '''लेज़र-सहाय प्रदत्त सूक्ष्मविच्छेदन''' ('''एलएमडी''' ('''LMD''') या '''एलएएम''' ('''LAM''')) भी कहा जाता है, ऊतक/कोशिकाओं/[[जीव|जीवों]]<ref name="pmid8875945">{{cite journal |vauthors=Emmert-Buck MR, Bonner RF, Smith PD, Chuaqui RF, Zhuang Z, Goldstein SR, Weiss RA, Liotta LA |title = लेजर कैप्चर माइक्रोडिसेक्शन|journal = Science|volume = 274|issue = 5289|pages = 998–1001|year = 1996|pmid = 8875945|doi = 10.1126/science.274.5289.998| bibcode=1996Sci...274..998E |citeseerx = 10.1.1.462.2914| s2cid=32921237 }}{{Closed access}}</ref><ref name="pmid17892370">{{cite journal |vauthors=Espina V, Heiby M, Pierobon M, Liotta LA |title = लेजर कैप्चर माइक्रो-विच्छेदन तकनीक|journal = Expert Rev. Mol. Diagn.|volume = 7|issue = 5|pages = 647–57|year = 2007|pmid = 17892370|doi = 10.1586/14737159.7.5.647| s2cid=46548538 }}{{Closed access}}</ref> के सूक्ष्मदर्शीय क्षेत्रों ([[लेज़र|लेजर]] की मदद से [[माइक्रोस्कोपी|सूक्ष्मदर्शीय]] पैमाने पर [[विच्छेदन]]) से विशिष्ट कोशिकाओं को अलग करने की एक विधि है। | ||
== सिद्धांत == | == सिद्धांत == | ||
लेज़र-अधिकृत सूक्ष्मविच्छेदन (एलसीएम) प्रत्यक्ष सूक्ष्मदर्शीय दृश्य के तहत ऊतक कोशिकाओं की उप-जनसंख्या प्राप्त करने की एक विधि है। एलसीएम (LCM) तकनीक प्रेरित कोशिकाओं को सीधे प्राप्त कर सकती है या विशिष्ट कोशिकाओं को हिस्टोलॉजिकल रूप से शुद्ध समृद्ध सेल सरंध्रता देने के लिए अवांछित कोशिकाओं को काटकर अलग कर सकती है। विभिन्न प्रकार के अनुप्रवाह अनुप्रयोग उपस्थित हैं- डीएनए (DNA) जीनोटाइपिंग और विषमयुग्मजता (एलओएच(LOH)) विश्लेषण, [[आरएनए प्रतिलेख|आरएनए(RNA) प्रतिलेख]] रूपरेखा, [[ सीडीएनए पुस्तकालय |सीडीएनए (cDNA) लाइब्रेरी]] जनरेशन, [[प्रोटियोमिक|प्रोटीन संजीनिकी (प्रोटिओमिक्स)]] खोज और संकेत-मार्ग रूपरेखा। इस प्रोटोकॉल को पूरा करने के लिए आवश्यक कुल समय प्रायः 1-1.5 घंटे होता है।<ref>{{Cite journal|title = लेजर-कैप्चर माइक्रोडिसेक्शन|journal = [[Nat. Protoc.|Nature Protocols]]|date = 2006-07-01|issn = 1754-2189|pages = 586–603|volume = 1|issue = 2|doi = 10.1038/nprot.2006.85|language = en|vauthors = Espina V, Wulfkhule JD, Calvert VS, VanMeter A, Zhou W, Coukos G, Geho DH, Petricoin III EF, Liotta LA|pmid=17406286|citeseerx = 10.1.1.462.2914| s2cid=1134441 }}{{Closed access}}</ref> | |||
== निष्कर्षण == | == निष्कर्षण == | ||
| Line 10: | Line 10: | ||
संपर्क के बिना परिवहन के लिए। तीन अलग-अलग दृष्टिकोण हैं। एक ईमानदार माइक्रोस्कोप (जीएएम, [[गुरुत्वाकर्षण]]-सहायता प्राप्त माइक्रोडिसेक्शन कहा जाता है) या लेजर दबाव गुलेल द्वारा परिवहन का उपयोग करके गुरुत्वाकर्षण द्वारा परिवहन; सबसे हालिया पीढ़ी [[लेजर प्रेरित फॉरवर्ड ट्रांसफर]] (एलआईएफटी) पर आधारित तकनीक का उपयोग करती है। कट-एंड-कैप्चर के साथ, चिपकने वाली परत वाली टोपी को सीधे पतले कटे (5-8 माइक्रोन) ऊतक खंड पर रखा जाता है, अनुभाग स्वयं एक पतली झिल्ली (पॉलीइथाइलीन नेफ़थलीन) पर टिका होता है। एक आईआर लेजर धीरे-धीरे टोपी पर चिपकने वाले को अंतर्निहित ऊतक में फ्यूज कर देता है और एक यूवी लेजर ऊतक और अंतर्निहित झिल्ली के माध्यम से कट जाता है। झिल्ली-ऊतक इकाई अब टोपी का पालन करती है और टोपी पर कोशिकाओं का उपयोग डाउनस्ट्रीम अनुप्रयोगों (डीएनए, आरएनए, प्रोटीन विश्लेषण) में किया जा सकता है।<ref>{{cite web|url = http://www.bmbio.com/file/201759.pdf|title = Optimized Protocol for Mounting Tissue Sections onto Metal-Framed PEN Membrane Slides (Protocol #9)|access-date = 19 February 2016|website = BM Equipment|publisher = Arcturus BioScience|last = Staff|id = PN 14191-00 Rev A}}</ref> | संपर्क के बिना परिवहन के लिए। तीन अलग-अलग दृष्टिकोण हैं। एक ईमानदार माइक्रोस्कोप (जीएएम, [[गुरुत्वाकर्षण]]-सहायता प्राप्त माइक्रोडिसेक्शन कहा जाता है) या लेजर दबाव गुलेल द्वारा परिवहन का उपयोग करके गुरुत्वाकर्षण द्वारा परिवहन; सबसे हालिया पीढ़ी [[लेजर प्रेरित फॉरवर्ड ट्रांसफर]] (एलआईएफटी) पर आधारित तकनीक का उपयोग करती है। कट-एंड-कैप्चर के साथ, चिपकने वाली परत वाली टोपी को सीधे पतले कटे (5-8 माइक्रोन) ऊतक खंड पर रखा जाता है, अनुभाग स्वयं एक पतली झिल्ली (पॉलीइथाइलीन नेफ़थलीन) पर टिका होता है। एक आईआर लेजर धीरे-धीरे टोपी पर चिपकने वाले को अंतर्निहित ऊतक में फ्यूज कर देता है और एक यूवी लेजर ऊतक और अंतर्निहित झिल्ली के माध्यम से कट जाता है। झिल्ली-ऊतक इकाई अब टोपी का पालन करती है और टोपी पर कोशिकाओं का उपयोग डाउनस्ट्रीम अनुप्रयोगों (डीएनए, आरएनए, प्रोटीन विश्लेषण) में किया जा सकता है।<ref>{{cite web|url = http://www.bmbio.com/file/201759.pdf|title = Optimized Protocol for Mounting Tissue Sections onto Metal-Framed PEN Membrane Slides (Protocol #9)|access-date = 19 February 2016|website = BM Equipment|publisher = Arcturus BioScience|last = Staff|id = PN 14191-00 Rev A}}</ref> | ||
== प्रक्रिया == | == प्रक्रिया == | ||
[[File:Laser Capture Microdissection.jpg|thumb|लेजर कैप्चर माइक्रोडिसेक्शन]]एक सॉफ्टवेयर इंटरफ़ेस का उपयोग करके एक [[माइक्रोस्कोप]] के तहत, एक ऊतक खंड (आमतौर पर 5-50 माइक्रोमीटर मोटा) देखा जाता है और अलग-अलग कोशिकाओं या कोशिकाओं के समूहों को या तो मैन्युअल रूप से या अर्ध-स्वचालित या अधिक पूरी तरह से स्वचालित तरीकों से पहचाना जाता है जिससे इमेजिंग और फिर स्वत: चयन की अनुमति मिलती है। अलगाव के लिए लक्ष्य। वर्तमान में सेल आइसोलेशन के लिए माइक्रोस्कोप और डिवाइस का उपयोग करके छह प्राथमिक अलगाव/संग्रह प्रौद्योगिकियां मौजूद हैं। इनमें से चार आमतौर पर सीधे ऊतकों या झिल्लियों/फिल्म को काटने के लिए एक पराबैंगनी स्पंदित लेजर (355 एनएम) का उपयोग करते हैं, और कभी-कभी एक [[ अवरक्त ]] लेजर के संयोजन में जो सेलुलर आसंजन और अलगाव के लिए एक चिपचिपा बहुलक को गर्म करने/पिघलने के लिए जिम्मेदार होता है। आईआर लेजर माइक्रोडिसेक्शन के लिए अधिक कोमल दृष्टिकोण प्रदान करता है। पांचवीं पराबैंगनी लेजर आधारित तकनीक ऊर्जा हस्तांतरण कोटिंग के साथ लेपित विशेष स्लाइड्स का उपयोग करती है, जो लेजर पल्स द्वारा सक्रिय होने पर, ऊतक या कोशिकाओं को एक संग्रह टोपी में ले जाती है। | [[File:Laser Capture Microdissection.jpg|thumb|लेजर कैप्चर माइक्रोडिसेक्शन]]एक सॉफ्टवेयर इंटरफ़ेस का उपयोग करके एक [[माइक्रोस्कोप]] के तहत, एक ऊतक खंड (आमतौर पर 5-50 माइक्रोमीटर मोटा) देखा जाता है और अलग-अलग कोशिकाओं या कोशिकाओं के समूहों को या तो मैन्युअल रूप से या अर्ध-स्वचालित या अधिक पूरी तरह से स्वचालित तरीकों से पहचाना जाता है जिससे इमेजिंग और फिर स्वत: चयन की अनुमति मिलती है। अलगाव के लिए लक्ष्य। वर्तमान में सेल आइसोलेशन के लिए माइक्रोस्कोप और डिवाइस का उपयोग करके छह प्राथमिक अलगाव/संग्रह प्रौद्योगिकियां मौजूद हैं। इनमें से चार आमतौर पर सीधे ऊतकों या झिल्लियों/फिल्म को काटने के लिए एक पराबैंगनी स्पंदित लेजर (355 एनएम) का उपयोग करते हैं, और कभी-कभी एक [[ अवरक्त ]] लेजर के संयोजन में जो सेलुलर आसंजन और अलगाव के लिए एक चिपचिपा बहुलक को गर्म करने/पिघलने के लिए जिम्मेदार होता है। आईआर लेजर माइक्रोडिसेक्शन के लिए अधिक कोमल दृष्टिकोण प्रदान करता है। पांचवीं पराबैंगनी लेजर आधारित तकनीक ऊर्जा हस्तांतरण कोटिंग के साथ लेपित विशेष स्लाइड्स का उपयोग करती है, जो लेजर पल्स द्वारा सक्रिय होने पर, ऊतक या कोशिकाओं को एक संग्रह टोपी में ले जाती है। | ||
Revision as of 21:46, 7 April 2023
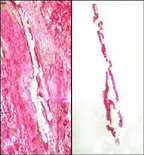
लेज़र अधिकृत सूक्ष्मविच्छेदन (LCM), जिसे सूक्ष्मविच्छेदन, लेज़र सूक्ष्मविच्छेदन (LMD), या लेज़र-सहाय प्रदत्त सूक्ष्मविच्छेदन (एलएमडी (LMD) या एलएएम (LAM)) भी कहा जाता है, ऊतक/कोशिकाओं/जीवों[1][2] के सूक्ष्मदर्शीय क्षेत्रों (लेजर की मदद से सूक्ष्मदर्शीय पैमाने पर विच्छेदन) से विशिष्ट कोशिकाओं को अलग करने की एक विधि है।
सिद्धांत
लेज़र-अधिकृत सूक्ष्मविच्छेदन (एलसीएम) प्रत्यक्ष सूक्ष्मदर्शीय दृश्य के तहत ऊतक कोशिकाओं की उप-जनसंख्या प्राप्त करने की एक विधि है। एलसीएम (LCM) तकनीक प्रेरित कोशिकाओं को सीधे प्राप्त कर सकती है या विशिष्ट कोशिकाओं को हिस्टोलॉजिकल रूप से शुद्ध समृद्ध सेल सरंध्रता देने के लिए अवांछित कोशिकाओं को काटकर अलग कर सकती है। विभिन्न प्रकार के अनुप्रवाह अनुप्रयोग उपस्थित हैं- डीएनए (DNA) जीनोटाइपिंग और विषमयुग्मजता (एलओएच(LOH)) विश्लेषण, आरएनए(RNA) प्रतिलेख रूपरेखा, सीडीएनए (cDNA) लाइब्रेरी जनरेशन, प्रोटीन संजीनिकी (प्रोटिओमिक्स) खोज और संकेत-मार्ग रूपरेखा। इस प्रोटोकॉल को पूरा करने के लिए आवश्यक कुल समय प्रायः 1-1.5 घंटे होता है।[3]
निष्कर्षण
एक लेज़र को एक माइक्रोस्कोप में जोड़ा जाता है और स्लाइड पर ऊतक पर ध्यान केंद्रित किया जाता है। प्रकाशिकी या मंच द्वारा लेजर की गति से फोकस एक प्रक्षेपवक्र का अनुसरण करता है जो उपयोगकर्ता द्वारा पूर्वनिर्धारित होता है। यह प्रक्षेपवक्र, जिसे तत्व भी कहा जाता है, को काट दिया जाता है और आसन्न ऊतक से अलग कर दिया जाता है। काटने की प्रक्रिया के बाद, निष्कर्षण प्रक्रिया वांछित होने पर निष्कर्षण प्रक्रिया का पालन करना पड़ता है। अधिक हाल की प्रौद्योगिकियां गैर-संपर्क माइक्रोडिसेक्शन का उपयोग करती हैं।
ऊतकविकृतिविज्ञानी के नमूने के साथ माइक्रोस्कोप स्लाइड से ऊतक निकालने के कई तरीके हैं। नमूने पर एक चिपचिपी सतह को दबाएं और फाड़ दें। यह वांछित क्षेत्र को निकालता है, लेकिन सतह पर कणों या अवांछित ऊतक को भी हटा सकता है, क्योंकि सतह चयनात्मक नहीं है। नमूने पर एक प्लास्टिक झिल्ली को पिघलाएं और फाड़ दें। उष्मा, उदाहरण के लिए, लाल या इन्फ्रारेड (IR) लेज़र द्वारा अवशोषित रंजक से सना हुआ झिल्ली पर डाली जाती है। जैसा कि यह झिल्ली पर वांछित नमूने का पालन करता है, जैसा कि किसी भी झिल्ली के साथ होता है जिसे हिस्टोपैथोलॉजी नमूना सतह के करीब रखा जाता है, वहां से कुछ मलबा निकाला जा सकता है। एक और खतरा शुरू की गई गर्मी है: डीएनए, आरएनए, या प्रोटीन जैसे कुछ अणु जितना संभव हो उतना शुद्ध रूप से पृथक होने के लक्ष्य के लिए बहुत अधिक गर्म होने की अनुमति नहीं देते हैं।
संपर्क के बिना परिवहन के लिए। तीन अलग-अलग दृष्टिकोण हैं। एक ईमानदार माइक्रोस्कोप (जीएएम, गुरुत्वाकर्षण-सहायता प्राप्त माइक्रोडिसेक्शन कहा जाता है) या लेजर दबाव गुलेल द्वारा परिवहन का उपयोग करके गुरुत्वाकर्षण द्वारा परिवहन; सबसे हालिया पीढ़ी लेजर प्रेरित फॉरवर्ड ट्रांसफर (एलआईएफटी) पर आधारित तकनीक का उपयोग करती है। कट-एंड-कैप्चर के साथ, चिपकने वाली परत वाली टोपी को सीधे पतले कटे (5-8 माइक्रोन) ऊतक खंड पर रखा जाता है, अनुभाग स्वयं एक पतली झिल्ली (पॉलीइथाइलीन नेफ़थलीन) पर टिका होता है। एक आईआर लेजर धीरे-धीरे टोपी पर चिपकने वाले को अंतर्निहित ऊतक में फ्यूज कर देता है और एक यूवी लेजर ऊतक और अंतर्निहित झिल्ली के माध्यम से कट जाता है। झिल्ली-ऊतक इकाई अब टोपी का पालन करती है और टोपी पर कोशिकाओं का उपयोग डाउनस्ट्रीम अनुप्रयोगों (डीएनए, आरएनए, प्रोटीन विश्लेषण) में किया जा सकता है।[4]
प्रक्रिया
एक सॉफ्टवेयर इंटरफ़ेस का उपयोग करके एक माइक्रोस्कोप के तहत, एक ऊतक खंड (आमतौर पर 5-50 माइक्रोमीटर मोटा) देखा जाता है और अलग-अलग कोशिकाओं या कोशिकाओं के समूहों को या तो मैन्युअल रूप से या अर्ध-स्वचालित या अधिक पूरी तरह से स्वचालित तरीकों से पहचाना जाता है जिससे इमेजिंग और फिर स्वत: चयन की अनुमति मिलती है। अलगाव के लिए लक्ष्य। वर्तमान में सेल आइसोलेशन के लिए माइक्रोस्कोप और डिवाइस का उपयोग करके छह प्राथमिक अलगाव/संग्रह प्रौद्योगिकियां मौजूद हैं। इनमें से चार आमतौर पर सीधे ऊतकों या झिल्लियों/फिल्म को काटने के लिए एक पराबैंगनी स्पंदित लेजर (355 एनएम) का उपयोग करते हैं, और कभी-कभी एक अवरक्त लेजर के संयोजन में जो सेलुलर आसंजन और अलगाव के लिए एक चिपचिपा बहुलक को गर्म करने/पिघलने के लिए जिम्मेदार होता है। आईआर लेजर माइक्रोडिसेक्शन के लिए अधिक कोमल दृष्टिकोण प्रदान करता है। पांचवीं पराबैंगनी लेजर आधारित तकनीक ऊर्जा हस्तांतरण कोटिंग के साथ लेपित विशेष स्लाइड्स का उपयोग करती है, जो लेजर पल्स द्वारा सक्रिय होने पर, ऊतक या कोशिकाओं को एक संग्रह टोपी में ले जाती है।
लेजर काटने की चौड़ाई आमतौर पर 1 माइक्रोन से कम होती है, इस प्रकार लक्ष्य कोशिकाएं लेजर बीम से प्रभावित नहीं होती हैं। यहां तक कि जीवित कोशिकाएं भी लेजर कटिंग से क्षतिग्रस्त नहीं होती हैं और क्लोनिंग और रीकल्चरिंग के लिए काटने के बाद उपयुक्त रूप से व्यवहार्य होती हैं।[5] विभिन्न प्रौद्योगिकियां संग्रह प्रक्रिया, संभावित इमेजिंग विधियों (फ्लोरेसेंस माइक्रोस्कोप/उज्ज्वल क्षेत्र माइक्रोस्कोपी /डिफरेंशियल इंटरफेरेंस कंट्रास्ट माइक्रोस्कोपी/फेज कंट्रास्ट माइक्रोस्कोपी/आदि) और इमेजिंग और अलगाव से पहले आवश्यक धारकों और ऊतक की तैयारी में भिन्न होती हैं। अधिकांश मुख्य रूप से समर्पित सूक्ष्म-विच्छेदन प्रणालियां हैं, और कुछ का उपयोग अनुसंधान सूक्ष्मदर्शी के रूप में भी किया जा सकता है, केवल एक तकनीक (यहां #2, लेइका) एक प्रतिदीप्ति माइक्रोस्कोप का उपयोग करती है, कुछ नमूना हैंडलिंग क्षमताओं को कुछ हद तक सीमित करती है, विशेष रूप से लाइव सेल कार्य के लिए।
पहली तकनीक (कार्ल ज़ीस पाम द्वारा प्रयुक्त) नमूने के चारों ओर काटती है और फिर इसे एक गुलेल तकनीक द्वारा एकत्र करती है। नमूने को एक स्लाइड या विशेष कल्चर डिश से डिफोकस किए गए यूवी लेजर पल्स द्वारा गुलेल किया जा सकता है जो स्लाइड/डिश से सामग्री को आगे बढ़ाने के लिए एक फोटोनिक बल उत्पन्न करता है, एक तकनीक जिसे कभी-कभी लेजर माइक्रो-डिसेक्शन प्रेशर कैटापुलिंग (एलएमपीसी) कहा जाता है। विच्छेदित सामग्री को एक माइक्रोफ्यूज ट्यूब कैप या अन्य कलेक्टर में ऊपर की ओर (कई मिलीमीटर तक) भेजा जाता है जिसमें या तो एक बफर या ट्यूब कैप में एक विशेष चिपचिपा सामग्री होती है जिसका ऊतक पालन करेगा। झिल्ली-लेपित स्लाइड का उपयोग करते समय यह सक्रिय गुलेल लगाने की प्रक्रिया कुछ स्थिर समस्याओं से बचाती है।[6] एक अन्य प्रक्रिया गुरुत्वाकर्षण-सहायता प्राप्त माइक्रोडिसेक्शन विधि का अनुसरण करती है जो इस्तेमाल की गई स्लाइड के तहत ट्यूब कैप में नमूने एकत्र करने के लिए गुरुत्वाकर्षण को चालू करती है (आयन एलएमडी सिस्टम, जुंगवू एफ एंड बी द्वारा उपयोग किया जाता है)। इस प्रणाली के मामले में, यह लेजर बीम को स्थिर रखते हुए, हितों की कोशिकाओं को काटने के लिए मोटरयुक्त चरण को स्थानांतरित करता है। और सिस्टम 355 एनएम सॉलिड-स्टेट लेजर (यूवी-ए) का उपयोग करता है जो आरएनए या डीएनए क्षति के बिना ऊतकों को काटने का सबसे सुरक्षित तरीका है।[7][failed verification]
एक अन्य बारीकी से संबंधित एलसीएम प्रक्रिया (लीका द्वारा प्रयुक्त) ऊपर से नमूना काटती है और नमूना नमूना के नीचे एक कैप्चर डिवाइस में गुरुत्वाकर्षण (गुरुत्वाकर्षण-सहायता प्राप्त माइक्रोडिसेक्शन) के माध्यम से गिरता है।[8] ऊपरी एक के साथ अलग बिंदु है, यहाँ लेजर बीम डाइक्रोइक दर्पण को घुमाकर ऊतक को काटने के लिए जा रहा है।
जब पसंद के सेल (स्लाइड या विशेष कल्चर डिश पर) देखने के क्षेत्र के केंद्र में होते हैं, तो ऑपरेटर इंस्ट्रूमेंट सॉफ्टवेयर का उपयोग करके रुचि के सेल का चयन करता है। क्षेत्र को अलग किया जाना चाहिए जब एक निकट-आईआर लेजर ऊतक के नमूने पर रखी एक टोपी पर स्थानांतरण फिल्म को सक्रिय करने के लिए, चिपकने वाला पिघलता है जो फिल्म को पसंद की अंतर्निहित कोशिकाओं के साथ फ़्यूज़ करता है (आर्कटुरस सिस्टम देखें); और/या ब्याज की कोशिका को काटने के लिए यूवी लेजर को सक्रिय करके। कोशिकाओं को तब पतले ऊतक खंड से हटा दिया जाता है, जिससे सभी अवांछित कोशिकाएं पीछे रह जाती हैं। ब्याज की कोशिकाओं को तब निष्कर्षण से पहले देखा और प्रलेखित किया जाता है।[9] चौथी यूवी आधारित तकनीक (आण्विक मशीनों और उद्योगों एजी द्वारा उपयोग की जाती है) यहां तीसरी तकनीक के लिए थोड़ा अंतर प्रदान करती है, जिसमें अनिवार्य रूप से स्लाइड> नमूना> और झिल्ली के साथ एक प्रकार का सैंडविच बनाकर एक फ्रेम स्लाइड के उपयोग से नमूना पर निर्भर करता है जिसकी झिल्ली सतह लेजर द्वारा काटा जाता है और अंततः एक विशेष चिपकने वाली टोपी द्वारा ऊपर से उठाया जाता है।[10] पाँचवीं यूवी आधारित तकनीक एक निष्क्रिय ऊर्जा हस्तांतरण कोटिंग और एक यूवी आधारित लेजर माइक्रोडिसेक्शन सिस्टम (आमतौर पर एक लीका एलएमडी या पाम ज़ीस मशीन) के साथ लेपित मानक ग्लास स्लाइड का उपयोग करती है। ऊर्जा हस्तांतरण कोटिंग के शीर्ष पर ऊतक खंड लगाए गए हैं। एक यूवी लेजर से ऊर्जा को कोटिंग पर प्रहार करने, इसे वाष्पीकृत करने, संग्रह ट्यूब में चयनित ऊतक सुविधाओं को तुरंत आगे बढ़ाने पर गतिज ऊर्जा में परिवर्तित किया जाता है। एक्सप्रेशन पैथोलॉजी इंक. (रॉकविले, एमडी) द्वारा ट्रेड नाम DIRECTOR स्लाइड्स के तहत व्यावसायीकृत एनर्जी ट्रांसफर कोटेड स्लाइड्स, प्रोटिओमिक कार्य के लिए कई फायदे प्रदान करती हैं। वे ऑटोफ्लोरेस भी नहीं करते हैं, इसलिए उनका उपयोग फ्लोरोसेंट दाग, डीआईसी या ध्रुवीकृत प्रकाश का उपयोग करने वाले अनुप्रयोगों के लिए किया जा सकता है।[11] ऊतक वर्गों के अलावा, एलसीएम जीवित कोशिकाओं/जीवों, सेल स्मीयर, क्रोमोसोम की तैयारी और पौधे के ऊतकों पर किया जा सकता है।
अनुप्रयोग
लेजर कैप्चर माइक्रोडिसेक्शन प्रक्रिया एकत्र किए गए नमूने की आकृति विज्ञान और रसायन विज्ञान को न तो बदलती है और न ही आसपास की कोशिकाओं को नुकसान पहुंचाती है। इस कारण से, एलसीएम डीएनए, आरएनए और/या प्रोटीन विश्लेषण के लिए चयनित कोशिकाओं को इकट्ठा करने का एक उपयोगी तरीका है। एलसीएम का उपयोग अकोशिकीय संरचनाओं को अलग करने के लिए भी किया गया है, जैसे एमिलॉयड सजीले टुकड़े।[12] LCM को विभिन्न प्रकार के ऊतक (जीव विज्ञान) के नमूनों पर प्रदर्शित किया जा सकता है, जिसमें पूर्ण रक्त गणना # विधियाँ, साइटोलॉजिकल तैयारी शामिल हैं।[13] सेल संस्कृतियों और ठोस ऊतक के विभाज्य। जमे हुए और पैराफिन एम्बेडेड अभिलेखीय ऊतक का भी उपयोग किया जा सकता है।[14]
संदर्भ
- ↑ Emmert-Buck MR, Bonner RF, Smith PD, Chuaqui RF, Zhuang Z, Goldstein SR, Weiss RA, Liotta LA (1996). "लेजर कैप्चर माइक्रोडिसेक्शन". Science. 274 (5289): 998–1001. Bibcode:1996Sci...274..998E. CiteSeerX 10.1.1.462.2914. doi:10.1126/science.274.5289.998. PMID 8875945. S2CID 32921237.

- ↑ Espina V, Heiby M, Pierobon M, Liotta LA (2007). "लेजर कैप्चर माइक्रो-विच्छेदन तकनीक". Expert Rev. Mol. Diagn. 7 (5): 647–57. doi:10.1586/14737159.7.5.647. PMID 17892370. S2CID 46548538.

- ↑ Espina V, Wulfkhule JD, Calvert VS, VanMeter A, Zhou W, Coukos G, Geho DH, Petricoin III EF, Liotta LA (2006-07-01). "लेजर-कैप्चर माइक्रोडिसेक्शन". Nature Protocols (in English). 1 (2): 586–603. CiteSeerX 10.1.1.462.2914. doi:10.1038/nprot.2006.85. ISSN 1754-2189. PMID 17406286. S2CID 1134441.

- ↑ Staff. "Optimized Protocol for Mounting Tissue Sections onto Metal-Framed PEN Membrane Slides (Protocol #9)" (PDF). BM Equipment. Arcturus BioScience. PN 14191-00 Rev A. Retrieved 19 February 2016.
- ↑ Staff. "General FAQs MMI CellCut Plus/MMI SmartCut Plus". Molecular Machines & Industries. Will the laser damage the surrounding tissue?. Archived from the original on 12 February 2013.
- ↑ "लेजर माइक्रोडिसेक्शन और प्रेशर कैटापल्टिंग (एलएमपीसी)". Centre for Cellular Imaging (CCI). University of Gothenburg. 25 November 2010. Retrieved 2011-10-27.
- ↑ "Why prescribe ACUVUE?".
- ↑ "कन्फोकल इमेजिंग सुविधा". KU Medical Center. Archived from the original on July 11, 2011. Retrieved 2011-10-28.
- ↑ "एलसीएम". joepham004. Archived from the original on 2021-12-19. Retrieved 2012-06-27.
- ↑ "एमएमआई सिस्टम के साथ लेजर माइक्रोडिसेक्शन". Molecular Machines and Industries AG. Archived from the original on 2021-12-19. Retrieved 2012-06-27.
- ↑ "पतली फिल्म्स लिफ्ट के तरीके". web.psi. Archived from the original on April 25, 2012. Retrieved 2012-06-27.
- ↑ Larochelle S (December 2015). "बिट्स पर पेट भरना". Nature Methods. 12 (12): 1114. doi:10.1038/nmeth.3679. PMID 26962581. S2CID 42051029.(registration required)
- ↑ Orba Y, Tanaka S, Nishihara H, Kawamura N, Itoh T, Shimizu M, Sawa H, Nagashima K (2003). "घातक लिंफोमा वाले रोगियों में इम्युनोग्लोबुलिन भारी श्रृंखला जीन पुनर्व्यवस्था का पता लगाने के लिए साइटोलॉजिकल नमूनों के लिए लेजर कैप्चर माइक्रोडिसेक्शन का अनुप्रयोग". Cancer. 99 (4): 198–204. doi:10.1002/cncr.11331. PMID 12925980.
- ↑ Kihara AH, Moriscot AS, Ferreira PJ, Hamassaki DE (2005). "Protecting RNA in fixed tissue: an alternative method for LCM users". J Neurosci Methods. 148 (2): 103–7. doi:10.1016/j.jneumeth.2005.04.019. PMID 16026852. S2CID 20606196.
बाहरी संबंध
- East Carolina University: LCM for "Dummies"
- Yale Rice Transcriptional Atlas Project employing Laser Capture Microdissection
