रसायन शास्त्र: Difference between revisions
(text) |
|||
| (18 intermediate revisions by 6 users not shown) | |||
| Line 1: | Line 1: | ||
रसायन विज्ञान किसी पदार्थ के गुणों और व्यवहार का वैज्ञानिक अध्ययन है।<ref name="brown2018">{{cite book | last1 = Brown| first1 = Theodore L. | last2 = LeMay, Jr. | first2 = H. Eugene | last3 = Bursten | first3 = Bruce E. | last4 = Murphey | first4 = Catherine J. | last5 = Woodward | first5 = Patrick M. | last6 = Stoltzfus | first6 = Matthew W. | last7 = Lufaso | first7 = Michael W. | chapter = Introduction: Matter, energy, and measurement | title = Chemistry: The Central Science | publisher = Pearson | edition = 14th | date = 2018 | location = New York | pages = 46–85 | isbn = 9780134414232}}</ref> | '''रसायन शास्त्र या रसायन विज्ञान''' किसी पदार्थ के गुणों और व्यवहार का वैज्ञानिक अध्ययन है।<ref name="brown2018">{{cite book | last1 = Brown| first1 = Theodore L. | last2 = LeMay, Jr. | first2 = H. Eugene | last3 = Bursten | first3 = Bruce E. | last4 = Murphey | first4 = Catherine J. | last5 = Woodward | first5 = Patrick M. | last6 = Stoltzfus | first6 = Matthew W. | last7 = Lufaso | first7 = Michael W. | chapter = Introduction: Matter, energy, and measurement | title = Chemistry: The Central Science | publisher = Pearson | edition = 14th | date = 2018 | location = New York | pages = 46–85 | isbn = 9780134414232}}</ref> यह एक प्राकृतिक विज्ञान है जो परमाणुओं, अणुओं और आयनों से बने यौगिकों को बनाने वाले तत्वों को सम्मिलित करता है, वे उनकी बनावट, संरचना, गुण, व्यवहार और अन्य पदार्थों के साथ प्रतिक्रिया के दौरान परिवर्तन करते हैं।<ref name="definition">{{cite web |url=http://chemweb.ucc.ie/what_is_chemistry.htm |title=What is Chemistry? |publisher=Chemweb.ucc.ie |access-date=12 June 2011 |archive-date=3 October 2018 |archive-url=https://web.archive.org/web/20181003061822/http://chemweb.ucc.ie/what_is_chemistry.htm |url-status=dead }}</ref><ref>{{cite web |title=Definition of CHEMISTRY |url=https://www.merriam-webster.com/dictionary/chemistry |website=www.merriam-webster.com |access-date=24 August 2020 |language=en}}</ref><ref>{{cite web |title=Definition of chemistry {{!}} Dictionary.com |url=http://dictionary.reference.com/browse/Chemistry |website=www.dictionary.com |access-date=24 August 2020 |language=en}}</ref><ref>{{Cite web|title=Chemistry Is Everywhere|url=https://www.acs.org/content/acs/en/education/whatischemistry/everywhere.html|website=[[American Chemical Society]]}}</ref> | ||
अपने विषय में, रसायन विज्ञान भौतिकी और जीव विज्ञान एक मध्यवर्ती स्थान रखता है।<ref>Carsten Reinhardt. ''Chemical Sciences in the 20th Century: Bridging Boundaries''. Wiley-VCH, 2001. {{ISBN|3-527-30271-9}}. pp. 1–2.</ref> इसे कभी-कभी केंद्रीय विज्ञान भी कहा जाता है क्योंकि यह मौलिक स्तर पर बुनियादी और अनुप्रयुक्त वैज्ञानिक विषयों दोनों को समझने के लिए एक आधार प्रदान करता है।<ref>Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. ''Chemistry: The Central Science''. Prentice Hall; 8 edition (1999). {{ISBN|0-13-010310-1}}. pp. 3–4.</ref> रसायन विज्ञान पौधों की वृद्धि (वनस्पति विज्ञान), आग्नेय चट्टानों (भूविज्ञान) के निर्माण, वायुमंडलीय ओजोन कैसे बनता है और पर्यावरण प्रदूषकों का क्षरण कैसे होता है (पारिस्थितिकी), चंद्रमा पर मिट्टी के गुण (कॉस्मोकेमिस्ट्री) के पहलुओं की व्याख्या करता है, दवाएं कैसे काम करती हैं (फार्माकोलॉजी), और अपराध स्थल पर डीएनए साक्ष्य कैसे एकत्र करें (फोरेंसिक) ये सब इसके उदहारण है। | |||
रसायन विज्ञान इस तरह के विषयों को संबोधित करता है जैसे नए रासायनिक यौगिक बनाने के लिए परमाणु और अणु रासायनिक बंधों के माध्यम से कैसे परस्पर क्रिया करते हैं। रासायनिक बंधन दो प्रकार के होते हैं: | रसायन विज्ञान इस तरह के विषयों को संबोधित करता है जैसे नए रासायनिक यौगिक बनाने के लिए परमाणु और अणु रासायनिक बंधों के माध्यम से कैसे परस्पर क्रिया करते हैं। रासायनिक बंधन दो प्रकार के होते हैं: | ||
1. प्राथमिक रासायनिक बंधन, ऐसे सहसंयोजक बंधन, जिनमें परमाणु एक या अधिक इलेक्ट्रॉन साझा करते हैं | 1. प्राथमिक रासायनिक बंधन, ऐसे सहसंयोजक बंधन, जिनमें परमाणु एक या अधिक इलेक्ट्रॉन साझा करते हैं, आयनिक बंधन, जिसमें एक परमाणु आयनों (धनायनों और आयनों) का उत्पादन करने के लिए एक या एक से अधिक इलेक्ट्रॉनों को दूसरे परमाणु को दान करता है, धात्विक बंध। | ||
2. सेकेंडरी केमिकल बॉन्ड्स- जैसे, हाइड्रोजन बॉन्ड | 2. सेकेंडरी केमिकल बॉन्ड्स- जैसे, हाइड्रोजन बॉन्ड,वैन डेर वाल्स फोर्स बॉन्ड,आयन-आयन इंटरैक्शन,आयन-द्विध्रुवीय बातचीत हैं। | ||
== व्युत्पत्ति विज्ञान == | == व्युत्पत्ति विज्ञान == | ||
रसायन विज्ञान शब्द कीमिया शब्द के पुनर्जागरण के दौरान एक संशोधन से आया है, जो कि रसायन विज्ञान, धातु विज्ञान, दर्शन, ज्योतिष, खगोल विज्ञान, रहस्यवाद और चिकित्सा के तत्वों को | रसायन विज्ञान शब्द कीमिया शब्द के पुनर्जागरण के दौरान एक संशोधन से आया है, जो कि रसायन विज्ञान, धातु विज्ञान, दर्शन, ज्योतिष, खगोल विज्ञान, रहस्यवाद और चिकित्सा के तत्वों को सम्मिलित करने वाली प्रथाओं के पहले समुच्चय को संदर्भित करता है। कीमिया को अक्सर सीसा या अन्य आधार धातुओं को सोने में बदलने की खोज से जुड़ा हुआ माना जाता है, हालांकि रसायनविद् आधुनिक रसायन विज्ञान के कई सवालों में भी रुचि रखते थे।<ref>{{cite web|url=http://www.alchemylab.com/history_of_alchemy.htm |title=History of Alchemy |publisher=Alchemy Lab |access-date=12 June 2011}}</ref> | ||
आधुनिक शब्द कीमिया बदले में अरबी शब्द अल-किमा से लिया गया है। इसका मूल मिस्र का हो सकता है क्योंकि अल-किमा प्राचीन ग्रीक χημία से लिया गया है, जो बदले में केमेट शब्द से लिया गया है, जो मिस्र की भाषा में मिस्र का प्राचीन नाम है।<ref name="oed">"alchemy", entry in ''The Oxford English Dictionary'', J.A. Simpson and E.S.C. Weiner, vol. 1, 2nd ed., 1989, {{ISBN|0-19-861213-3}}.</ref> वैकल्पिक रूप से, अल-किमा μεία 'एक साथ संचयन' से प्राप्त होता है।<ref>Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. {{ISBN|0-486-21873-2}}</ref> | आधुनिक शब्द कीमिया बदले में अरबी शब्द अल-किमा से लिया गया है। इसका मूल मिस्र का हो सकता है क्योंकि अल-किमा प्राचीन ग्रीक χημία से लिया गया है, जो बदले में केमेट शब्द से लिया गया है, जो मिस्र की भाषा में मिस्र का प्राचीन नाम है।<ref name="oed">"alchemy", entry in ''The Oxford English Dictionary'', J.A. Simpson and E.S.C. Weiner, vol. 1, 2nd ed., 1989, {{ISBN|0-19-861213-3}}.</ref> वैकल्पिक रूप से, अल-किमा μεία 'एक साथ संचयन' से प्राप्त होता है।<ref>Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. {{ISBN|0-486-21873-2}}</ref> | ||
== <big>आधुनिक सिद्धांत</big> == | |||
[[File:Lab bench.jpg|thumb|upright=1.15|प्रयोगशाला, बायोकेमिस्ट्री इंस्टीट्यूट, जर्मनी में कोलोन विश्वविद्यालय।]] | [[File:Lab bench.jpg|thumb|upright=1.15|प्रयोगशाला, बायोकेमिस्ट्री इंस्टीट्यूट, जर्मनी में कोलोन विश्वविद्यालय।]] | ||
परमाणु संरचना का वर्तमान प्रतिरूप क्वांटम मैकेनिकल प्रतिरूप है।<ref>{{cite encyclopedia|title=chemical bonding|url=https://www.britannica.com/EBchecked/topic/684121/chemical-bonding/43383/The-quantum-mechanical-model|encyclopedia=Britannica|publisher=Encyclopædia Britannica|access-date=1 November 2012}}</ref> पारंपरिक रसायन विज्ञान प्राथमिक कणों, परमाणुओं, अणुओं, <ref>[http://www.visionlearning.com/library/module_viewer.php?mid=49 Matter: Atoms from Democritus to Dalton] by Anthony Carpi, Ph.D.</ref> पदार्थों, धातुओं, क्रिस्टल और पदार्थ के अन्य समुच्चय के अध्ययन से प्रारम्भ होता है। पदार्थ का अध्ययन ठोस, तरल, गैस और प्लाज्मा अवस्थाओं में, अलगाव में या संयोजन में किया जा सकता है।रसायन शास्त्र में अध्ययन की जाने वाली पारस्परिक प्रभाव, प्रतिक्रियाएं और परिवर्तन आम तौर पर परमाणुओं के बीच प्रभाव का परिणाम होते हैं, जिससे रासायनिक बंधनों की पुनर्व्यवस्था होती है जो परमाणुओं को एक साथ रखती हैं। ऐसे व्यवहारों का अध्ययन रसायन विज्ञान प्रयोगशाला में किया जाता है। | परमाणु संरचना का वर्तमान प्रतिरूप क्वांटम मैकेनिकल प्रतिरूप है।<ref>{{cite encyclopedia|title=chemical bonding|url=https://www.britannica.com/EBchecked/topic/684121/chemical-bonding/43383/The-quantum-mechanical-model|encyclopedia=Britannica|publisher=Encyclopædia Britannica|access-date=1 November 2012}}</ref> पारंपरिक रसायन विज्ञान प्राथमिक कणों, परमाणुओं, अणुओं, <ref>[http://www.visionlearning.com/library/module_viewer.php?mid=49 Matter: Atoms from Democritus to Dalton] by Anthony Carpi, Ph.D.</ref> पदार्थों, धातुओं, क्रिस्टल और पदार्थ के अन्य समुच्चय के अध्ययन से प्रारम्भ होता है। पदार्थ का अध्ययन ठोस, तरल, गैस और प्लाज्मा अवस्थाओं में, अलगाव में या संयोजन में किया जा सकता है।रसायन शास्त्र में अध्ययन की जाने वाली पारस्परिक प्रभाव, प्रतिक्रियाएं और परिवर्तन आम तौर पर परमाणुओं के बीच प्रभाव का परिणाम होते हैं, जिससे रासायनिक बंधनों की पुनर्व्यवस्था होती है जो परमाणुओं को एक साथ रखती हैं। ऐसे व्यवहारों का अध्ययन रसायन विज्ञान प्रयोगशाला में किया जाता है। | ||
| Line 20: | Line 20: | ||
रसायन विज्ञान प्रयोगशाला स्टीरियोटाइपिक रूप से प्रयोगशाला कांच के बने पदार्थ के विभिन्न रूपों का उपयोग करती है।हालांकि ग्लासवेयर रसायन विज्ञान के लिए केंद्रीय नहीं है, और इसके बिना प्रयोगात्मक (साथ ही लागू/औद्योगिक) रसायन विज्ञान का एक बड़ा सौदा किया जाता है। | रसायन विज्ञान प्रयोगशाला स्टीरियोटाइपिक रूप से प्रयोगशाला कांच के बने पदार्थ के विभिन्न रूपों का उपयोग करती है।हालांकि ग्लासवेयर रसायन विज्ञान के लिए केंद्रीय नहीं है, और इसके बिना प्रयोगात्मक (साथ ही लागू/औद्योगिक) रसायन विज्ञान का एक बड़ा सौदा किया जाता है। | ||
[[File:Chemicals in flasks.jpg|thumb|right|अभिकर्मक बोतलों में पदार्थों के समाधान, जिसमें अमोनियम हाइड्रॉक्साइड और नाइट्रिक एसिड | [[File:Chemicals in flasks.jpg|thumb|right|अभिकर्मक बोतलों में पदार्थों के समाधान, जिसमें अमोनियम हाइड्रॉक्साइड और नाइट्रिक एसिड सम्मिलित हैं, विभिन्न रंगों में रोशन]] | ||
कुछ पदार्थों का एक या अधिक विभिन्न पदार्थों में परिवर्तन को रासायनिक प्रतिक्रिया कहते है। <ref>IUPAC [[Gold Book]] [http://goldbook.iupac.org/C01033.html Definition]</ref> रासायनिक परिवर्तन का आधार इलेक्ट्रॉनों की पुनर्व्यवस्था परमाणुओं के बीच रासायनिक बंधों में होती है। इसे प्रतीकात्मक रूप से एक रासायनिक समीकरण के माध्यम से दर्शाया जा सकता है, जिसमें आमतौर पर परमाणुओं को विषयों के रूप में | कुछ पदार्थों का एक या अधिक विभिन्न पदार्थों में परिवर्तन को रासायनिक प्रतिक्रिया कहते है। <ref>IUPAC [[Gold Book]] [http://goldbook.iupac.org/C01033.html Definition]</ref> रासायनिक परिवर्तन का आधार इलेक्ट्रॉनों की पुनर्व्यवस्था परमाणुओं के बीच रासायनिक बंधों में होती है। इसे प्रतीकात्मक रूप से एक रासायनिक समीकरण के माध्यम से दर्शाया जा सकता है, जिसमें आमतौर पर परमाणुओं को विषयों के रूप में सम्मिलित किया जाता है।रासायनिक परिवर्तन के समीकरण में बायीं और दायीं ओर परमाणुओं की संख्या बराबर होती है। (जब दोनों तरफ परमाणुओं की संख्या असमान होती है, तो परिवर्तन को परमाणु प्रतिक्रिया या रेडियोधर्मी क्षय कहा जाता है।) पदार्थ किसी भी प्रकार की रासायनिक प्रतिक्रियाओं से गुजर सकता है और इसके साथ होने वाले ऊर्जा परिवर्तन कुछ बुनियादी नियमों से विवश होते हैं, जिन्हें रासायनिक कानूनों के रूप में जाना जाता है। | ||
लगभग सभी रासायनिक अध्ययनों में ऊर्जा और परिक्षय विचार अनिवार्य रूप से महत्वपूर्ण हैं। रासायनिक पदार्थों को उनकी संरचना, चरण, साथ ही साथ उनकी रासायनिक संरचना के आधार पर वर्गीकृत किया जाता है। रासायनिक विश्लेषण के उपकरणों का उपयोग करके उनका विश्लेषण किया जा सकता है, उदाहरण स्पेक्ट्रोस्कोपी और क्रोमैटोग्राफी है। रासायनिक अनुसंधान में लगे वैज्ञानिकों को रसायनज्ञ के रूप में जाना जाता है।<ref>{{cite web |url=http://www.calmis.ca.gov/file/occguide/CHEMIST.HTM |title=California Occupational Guide Number 22: Chemists |publisher=Calmis.ca.gov |date=29 October 1999 |access-date=12 June 2011 |archive-url=https://web.archive.org/web/20110610111332/http://www.calmis.ca.gov/file/occguide/CHEMIST.HTM |archive-date=10 June 2011 |url-status=dead }}</ref> अधिकांश रसायनज्ञ एक या इससे अधिक उप-विषयों के विशेषज्ञ होते हैं। रसायन विज्ञान के अध्ययन के लिए कई अवधारणाएँ आवश्यक हैं, उनमें से कुछ हैं:<ref>{{cite web|url=http://antoine.frostburg.edu/chem/senese/101/matter/ |title=General Chemistry Online – Companion Notes: Matter |publisher=Antoine.frostburg.edu |access-date=12 June 2011}}</ref> | लगभग सभी रासायनिक अध्ययनों में ऊर्जा और परिक्षय विचार अनिवार्य रूप से महत्वपूर्ण हैं। रासायनिक पदार्थों को उनकी संरचना, चरण, साथ ही साथ उनकी रासायनिक संरचना के आधार पर वर्गीकृत किया जाता है। रासायनिक विश्लेषण के उपकरणों का उपयोग करके उनका विश्लेषण किया जा सकता है, उदाहरण स्पेक्ट्रोस्कोपी और क्रोमैटोग्राफी है। रासायनिक अनुसंधान में लगे वैज्ञानिकों को रसायनज्ञ के रूप में जाना जाता है।<ref>{{cite web |url=http://www.calmis.ca.gov/file/occguide/CHEMIST.HTM |title=California Occupational Guide Number 22: Chemists |publisher=Calmis.ca.gov |date=29 October 1999 |access-date=12 June 2011 |archive-url=https://web.archive.org/web/20110610111332/http://www.calmis.ca.gov/file/occguide/CHEMIST.HTM |archive-date=10 June 2011 |url-status=dead }}</ref> अधिकांश रसायनज्ञ एक या इससे अधिक उप-विषयों के विशेषज्ञ होते हैं। रसायन विज्ञान के अध्ययन के लिए कई अवधारणाएँ आवश्यक हैं, उनमें से कुछ निम्नलिखित हैं:<ref>{{cite web|url=http://antoine.frostburg.edu/chem/senese/101/matter/ |title=General Chemistry Online – Companion Notes: Matter |publisher=Antoine.frostburg.edu |access-date=12 June 2011}}</ref> | ||
'''<big>द्रव्य</big>''' | '''<big>द्रव्य</big>''' | ||
रसायन विज्ञान में, पदार्थ को किसी भी चीज़ के रूप में परिभाषित किया जाता है जिसमें | रसायन विज्ञान में, पदार्थ को किसी भी चीज़ के रूप में परिभाषित किया जाता है, जिसमें शेष द्रव्यमान और आयतन होता है (यह स्थान लेता है) और कणों से बना होता है। पदार्थ बनाने वाले कणों में भी शेष द्रव्यमान होता है सभी कणों में शेष द्रव्यमान नहीं होता है, जैसे कि फोटॉन। पदार्थ एक शुद्ध रासायनिक पदार्थ या पदार्थों का मिश्रण हो सकता है।<ref>{{cite book |last=Armstrong |first=James |title=General, Organic, and Biochemistry: An Applied Approach |publisher=[[Brooks/Cole]] |year=2012 |isbn=978-0-534-49349-3 |page=48}}</ref> | ||
'''<big>परमाणु</big>''' | '''<big>परमाणु</big>''' | ||
[[File:Atom Diagram.svg|thumb|upright=0.75|left|बोहर मॉडल पर आधारित एक परमाणु का आरेख]] | [[File:Atom Diagram.svg|thumb|upright=0.75|left|बोहर मॉडल पर आधारित एक परमाणु का आरेख]] | ||
परमाणु रसायन विज्ञान की मूल इकाई | परमाणु रसायन विज्ञान की मूल इकाई है। इसमें घने आन्तरक होते है जिसे परमाणु नाभिक कहा जाता है जो एक इलेक्ट्रॉन बादल के कब्जे वाले स्थान से घिरा होता है। नाभिक धनात्मक आवेशित प्रोटॉन और अनावेशित न्यूट्रॉन (एक साथ न्यूक्लियॉन कहलाते हैं) से बना होता है, जबकि इलेक्ट्रॉन बादल में ऋणात्मक रूप से आवेशित इलेक्ट्रॉन होते हैं जो नाभिक की परिक्रमा करते हैं। तटस्थ परमाणु में, ऋणात्मक रूप से आवेशित इलेक्ट्रॉन प्रोटॉन के धनात्मक आवेश को संतुलित करते हैं। नाभिक घने है इसलिए एक न्यूक्लियॉन का द्रव्यमान एक इलेक्ट्रॉन के द्रव्यमान का लगभग 1,836 गुना होता है, फिर भी एक परमाणु की त्रिज्या उसके नाभिक से लगभग 10,000 गुना होती है।{{sfn|Burrows|Holman|Parsons|Pilling|2008|p=13}}{{sfn|Housecroft|Sharpe|2008|p=2}} | ||
परमाणु भी सबसे छोटी इकाई है जिसे तत्व के रासायनिक गुणों को बनाए रखने के लिए परिकल्पित किया जा सकता है, जैसे कि वैद्युतीयऋणात्मकता (इलेक्ट्रोनगेटिविटी), आयनीकरण क्षमता, | परमाणु भी सबसे छोटी इकाई है जिसे तत्व के रासायनिक गुणों को बनाए रखने के लिए परिकल्पित किया जा सकता है, जैसे कि वैद्युतीयऋणात्मकता (इलेक्ट्रोनगेटिविटी), आयनीकरण क्षमता, अधिमानित ऑक्सीकरण अवस्था (एस), समन्वय संख्या, और अधिमानित प्रकार के अनुबंध बनाने के लिए (जैसे, धातु, आयनिक, सहसंयोजक)। | ||
==== <big>तत्व</big> ==== | ==== <big>तत्व</big> ==== | ||
| Line 68: | Line 68: | ||
<big>'''मोल और पदार्थ की मात्रा'''</big> | <big>'''मोल और पदार्थ की मात्रा'''</big> | ||
मोल माप की एक इकाई है जो पदार्थ की मात्रा (जिसे रासायनिक राशि भी कहा जाता है) को दर्शाता है। एक मोल में ठीक 6.02214076×1023 कण (परमाणु, अणु, आयन या इलेक्ट्रॉन) होते हैं, जहां प्रति मोल कणों की संख्या अवोगाद्रो स्थिरांक के रूप में जानी जाती है। मोलर सांद्रण एक विशेष पदार्थ की मात्रा प्रति घोल की मात्रा है, और आमतौर पर मोल/डीएम<sup>3 </sup>(mol/dm<sup>3</sup> ) में सूचित किया जाता | मोल माप की एक इकाई है जो पदार्थ की मात्रा (जिसे रासायनिक राशि भी कहा जाता है) को दर्शाता है। एक मोल में ठीक 6.02214076×1023 कण (परमाणु, अणु, आयन या इलेक्ट्रॉन) होते हैं, जहां प्रति मोल कणों की संख्या अवोगाद्रो स्थिरांक के रूप में जानी जाती है। मोलर सांद्रण एक विशेष पदार्थ की मात्रा प्रति घोल की मात्रा है, और आमतौर पर मोल/डीएम<sup>3 </sup>(mol/dm<sup>3</sup> ) में सूचित किया जाता है।{{sfn|Atkins|de Paula|2009|p=9}} | ||
'''<big>चरण</big>''' | '''<big>चरण</big>''' | ||
[[File:Phase changes.svg|thumb|upright=1.25|चरण परिवर्तनों का वर्णन करने के लिए उपयोग किए जाने वाले चरणों और शब्दों के बीच संबंध दिखाते हुए आरेख।]]विभिन्न रासायनिक वर्गीकरणों को अलग करने वाले विशिष्ट रासायनिक गुणों के अलावा, रसायन कई चरणों में मौजूद हो सकते हैं। अधिकांश भाग के लिए, रासायनिक वर्गीकरण इन थोक चरण वर्गीकरणों से स्वतंत्र हैं; हालांकि, कुछ और विदेशी चरण कुछ रासायनिक गुणों के साथ असंगत हैं। एक चरण एक रासायनिक प्रणाली के राज्यों का एक सेट है जिसमें | [[File:Phase changes.svg|thumb|upright=1.25|चरण परिवर्तनों का वर्णन करने के लिए उपयोग किए जाने वाले चरणों और शब्दों के बीच संबंध दिखाते हुए आरेख।]]विभिन्न रासायनिक वर्गीकरणों को अलग करने वाले विशिष्ट रासायनिक गुणों के अलावा, रसायन कई चरणों में मौजूद हो सकते हैं। अधिकांश भाग के लिए, रासायनिक वर्गीकरण इन थोक चरण वर्गीकरणों से स्वतंत्र हैं; हालांकि, कुछ और विदेशी चरण कुछ रासायनिक गुणों के साथ असंगत हैं। एक चरण एक रासायनिक प्रणाली के राज्यों का एक सेट है जिसमें अधिकांश संरचनात्मक गुण होते हैं, जैसे कि दबाव या तापमान जैसी स्थितियों की एक सीमा पर। | ||
भौतिक गुण, जैसे कि घनत्व और अपवर्तक सूचकांक चरण के मूल्यों की विशेषता के भीतर आते हैं। पदार्थ के चरण को चरण संक्रमण द्वारा परिभाषित किया जाता है, जो तब होता है जब ऊर्जा को | भौतिक गुण, जैसे कि घनत्व और अपवर्तक सूचकांक चरण के मूल्यों की विशेषता के भीतर आते हैं। पदार्थ के चरण को चरण संक्रमण द्वारा परिभाषित किया जाता है, जो तब होता है जब ऊर्जा को प्रणाली से बाहर ले जाया जाता है या अधिकांश स्थितियों को बदलने के बजाय प्रणाली की संरचना को फिर से व्यवस्थित करने में चला जाता है। | ||
कभी -कभी इस मामले में असतत सीमा होने के बजाय चरणों के बीच का अंतर निरंतर हो सकता है 'इस मामले को एक | कभी -कभी इस मामले में असतत सीमा होने के बजाय चरणों के बीच का अंतर निरंतर हो सकता है 'इस मामले को एक अतिक्रांतिक अवस्था में माना जाता है। जब तीन अवस्था स्थितियों के आधार पर मिलते हैं, तो इसे एक ट्रिपल पॉइंट के रूप में जाना जाता है और चूंकि यह अपरिवर्तनीय है, इसलिए यह शर्तों के एक सेट को परिभाषित करने का एक सुविधाजनक तरीका है। | ||
चरणों के सबसे जाना माना उदाहरण ठोस, तरल और गैस हैं। बहुत से पदार्थ कई ठोस चरणों का प्रदर्शन करते हैं। उदाहरण के लिए, ठोस लोहे (अल्फा, गामा और डेल्टा) के तीन चरण होते हैं जो तापमान और दाब के आधार पर भिन्न होते हैं। ठोस चरणों के बीच एक प्रमुख अंतर परमाणुओं की स्फटिक संरचना या व्यवस्था है। रसायन विज्ञान के अध्ययन में आम तौर पर एक अन्य चरण जलीय चरण है, जो जलीय (अर्थात पानी में) घोल में घुलने वाले पदार्थों की स्थिति है। | चरणों के सबसे जाना माना उदाहरण ठोस, तरल और गैस हैं। बहुत से पदार्थ कई ठोस चरणों का प्रदर्शन करते हैं। उदाहरण के लिए, ठोस लोहे (अल्फा, गामा और डेल्टा) के तीन चरण होते हैं जो तापमान और दाब के आधार पर भिन्न होते हैं। ठोस चरणों के बीच एक प्रमुख अंतर परमाणुओं की स्फटिक संरचना या व्यवस्था है। रसायन विज्ञान के अध्ययन में आम तौर पर एक अन्य चरण जलीय चरण है, जो जलीय (अर्थात पानी में) घोल में घुलने वाले पदार्थों की स्थिति है। | ||
कम परिचित चरणों में प्लाविक, बोस-आइंस्टीन संघनित और फ़र्मोनिक संघनित, चुंबकीय सामग्री के अनुचुंबकीय और लोह चुंबकीय चरण | कम परिचित चरणों में प्लाविक, बोस-आइंस्टीन संघनित और फ़र्मोनिक संघनित, चुंबकीय सामग्री के अनुचुंबकीय और लोह चुंबकीय चरण सम्मिलित हैं। जबकि अधिकांश परिचित चरण त्रि-आयामी प्रणालियों से निपटते हैं, द्वि-आयामी प्रणालियों में अनुरूप को परिभाषित करना भी संभव है, जिसने जीव विज्ञान में प्रणालियों के लिए इसकी प्रासंगिकता के लिए ध्यान आकर्षित किया है। | ||
=== आबन्धन === | === आबन्धन === | ||
[[File:Ionic bonding animation.gif|thumb|right|upright=1.15|सोडियम क्लोराइड, या सामान्य टेबल नमक बनाने के लिए सोडियम (एनए) और क्लोरीन (सीएल) के बीच आयनिक संबंध की प्रक्रिया का एक एनीमेशन।आयनिक बॉन्डिंग में एक परमाणु | [[File:Ionic bonding animation.gif|thumb|right|upright=1.15|सोडियम क्लोराइड, या सामान्य टेबल नमक बनाने के लिए सोडियम (एनए) और क्लोरीन (सीएल) के बीच आयनिक संबंध की प्रक्रिया का एक एनीमेशन।आयनिक बॉन्डिंग में एक परमाणु सम्मिलित होता है जो दूसरे से वैलेंस इलेक्ट्रॉनों को ले जाता है (साझा करने के विपरीत, जो सहसंयोजक संबंध में होता है)]] | ||
अणुओं या स्फटिक में एक साथ चिपके रहने वाले परमाणुओं को एक दूसरे के साथ बंधित कहा जाता है। रासायनिक बंधन को नाभिक में धनात्मक आवेशों और उनके बारे में दोलन करने वाले ऋणात्मक आवेशों के बीच बहुध्रुवीय संतुलन के रूप में देखा जा सकता है। <ref>{{cite web|author=Visionlearning |url=http://www.visionlearning.com/library/module_viewer.php?mid=55 |title=Chemical Bonding by Anthony Carpi, Ph |publisher=visionlearning |access-date=12 June 2011}}</ref>साधारण आकर्षण और प्रतिकर्षण से अधिक, ऊर्जा और वितरण एक इलेक्ट्रॉन की उपलब्धता को दूसरे परमाणु से बंधने की विशेषता बताते हैं। | अणुओं या स्फटिक में एक साथ चिपके रहने वाले परमाणुओं को एक दूसरे के साथ बंधित कहा जाता है। रासायनिक बंधन को नाभिक में धनात्मक आवेशों और उनके बारे में दोलन करने वाले ऋणात्मक आवेशों के बीच बहुध्रुवीय संतुलन के रूप में देखा जा सकता है। <ref>{{cite web|author=Visionlearning |url=http://www.visionlearning.com/library/module_viewer.php?mid=55 |title=Chemical Bonding by Anthony Carpi, Ph |publisher=visionlearning |access-date=12 June 2011}}</ref>साधारण आकर्षण और प्रतिकर्षण से अधिक, ऊर्जा और वितरण एक इलेक्ट्रॉन की उपलब्धता को दूसरे परमाणु से बंधने की विशेषता बताते हैं। | ||
रासायनिक बंधन सहसंयोजक बंधन, आयनिक बंधन, हाइड्रोजन बंधन या सिर्फ वैनडेर वाल्स बल के कारण हो सकता है। इस प्रकार के प्रत्येक बंधन को किसी न किसी क्षमता के लिए जिम्मेदार ठहराया जाता है। ये क्षमताएं बातचीत का निर्माण करती हैं जो अणुओं या स्फटिक में परमाणुओं को एक साथ रखती हैं। कई सरल यौगिकों में, | रासायनिक बंधन सहसंयोजक बंधन, आयनिक बंधन, हाइड्रोजन बंधन या सिर्फ वैनडेर वाल्स बल के कारण हो सकता है। इस प्रकार के प्रत्येक बंधन को किसी न किसी क्षमता के लिए जिम्मेदार ठहराया जाता है। ये क्षमताएं बातचीत का निर्माण करती हैं जो अणुओं या स्फटिक में परमाणुओं को एक साथ रखती हैं। कई सरल यौगिकों में, संयोजकता आबन्ध सिद्धांत, संयोजकता खोल इलेक्ट्रॉन जोड़ी प्रतिकर्षण मॉडल (वीएसईपीआर), और ऑक्सीकरण संख्या की अवधारणा का उपयोग आणविक संरचना और संरचना को समझाने के लिए किया जा सकता है। | ||
आयनिक बंधन तब बनता है जब कोई धातु अपने एक या अधिक इलेक्ट्रॉनों को खो देता है, एक धनात्मक आवेशित धनायन बन जाता है, और इलेक्ट्रॉनों को तब गैर-धातु परमाणु द्वारा प्राप्त किया जाता है, जो ऋणात्मक रूप से आवेशित आयन बन जाता है। दो विपरीत आवेशित आयन एक दूसरे को आकर्षित करते हैं, और आयनिक बंधन उनके बीच | आयनिक बंधन तब बनता है जब कोई धातु अपने एक या अधिक इलेक्ट्रॉनों को खो देता है, एक धनात्मक आवेशित धनायन बन जाता है, और इलेक्ट्रॉनों को तब गैर-धातु परमाणु द्वारा प्राप्त किया जाता है, जो ऋणात्मक रूप से आवेशित आयन बन जाता है। दो विपरीत आवेशित आयन एक दूसरे को आकर्षित करते हैं, और आयनिक बंधन उनके बीच स्थिर वैद्युत विक्षेप आकर्षण बल है। दो विपरीत रूप से चार्ज किए गए आयन एक दूसरे को आकर्षित करते हैं, और आयनिक बंधन उनके बीच आकर्षण का स्थिर वैद्युत विक्षेप बल है। उदाहरण के लिए, सोडियम (Na), धातु, Na धनायन बनने के लिए एक इलेक्ट्रॉन खो देता है जबकि क्लोरीन (Cl), एक गैर-धातु, इस इलेक्ट्रॉन को Cl- बन जाता है। स्थिर वैद्युत विक्षेप आकर्षण के कारण आयनों को एक साथ रखा जाता है, और वह यौगिक सोडियम क्लोराइड (NaCl), या सामान्य टेबल सॉल्ट बनता है। | ||
[[File:Elektronenformel Punkte CH4.svg|thumb|upright=0.75|left|मीथेन अणु में (सीएच)<sub>4</sub>), कार्बन परमाणु चार हाइड्रोजन परमाणुओं में से प्रत्येक के साथ वैलेंस इलेक्ट्रॉनों की एक जोड़ी साझा करता है।इस प्रकार, ऑक्टेट नियम सी-एटम के लिए संतुष्ट है (इसके वैलेंस शेल में आठ इलेक्ट्रॉन हैं) और डुएट नियम एच-एटम्स के लिए संतुष्ट है (उनके वैलेंस गोले में दो इलेक्ट्रॉन हैं)।]] | [[File:Elektronenformel Punkte CH4.svg|thumb|upright=0.75|left|मीथेन अणु में (सीएच)<sub>4</sub>), कार्बन परमाणु चार हाइड्रोजन परमाणुओं में से प्रत्येक के साथ वैलेंस इलेक्ट्रॉनों की एक जोड़ी साझा करता है।इस प्रकार, ऑक्टेट नियम सी-एटम के लिए संतुष्ट है (इसके वैलेंस शेल में आठ इलेक्ट्रॉन हैं) और डुएट नियम एच-एटम्स के लिए संतुष्ट है (उनके वैलेंस गोले में दो इलेक्ट्रॉन हैं)।]] | ||
सहसंयोजक बंधन में, | सहसंयोजक बंधन में, संयोजन इलेक्ट्रॉनों के एक या अधिक जोड़े दो परमाणुओं द्वारा साझा किए जाते हैं, बंधुआ परमाणुओं के परिणामस्वरूप विद्युत रूप से तटस्थ समूह को अणु कहा जाता है। परमाणु संयोजन इलेक्ट्रॉनों को इस तरह साझा करेंगे कि प्रत्येक परमाणु के लिए एक उत्कृष्ट गैस इलेक्ट्रॉन विन्यास (उनके सबसे बाहरी कोश में आठ इलेक्ट्रॉन) का निर्माण होगा। परमाणु जो इस तरह से संयोजित होते हैं कि उनमें से प्रत्येक के संयोजकता में आठ इलेक्ट्रॉन होते हैं, ये ऑक्टेट नियम का पालन करते हैं। हालांकि, कुछ तत्वों जैसे हाइड्रोजन और लिथियम को इस स्थिर विन्यास को प्राप्त करने के लिए अपने सबसे बाहरी कोश में केवल दो इलेक्ट्रॉनों की आवश्यकता होती है, इन परमाणुओं को युगल नियम का पालन करने के लिए कहा जाता है, और इस तरह वे महान गैस हीलियम के इलेक्ट्रॉन विन्यास तक पहुँच रहे हैं, जिसके बाहरी आवरण में दो इलेक्ट्रॉन हैं। | ||
इसी तरह, शास्त्रीय भौतिकी के सिद्धांतों का उपयोग कई आयनिक संरचनाओं की भविष्यवाणी करने के लिए किया जा सकता है। धातु परिसरों पे जैसे अधिक जटिल यौगिकों के साथ, संयोजकता बंधन सिद्धांत कम लागू होता है और वैकल्पिक दृष्टिकोण, जैसे कि आणविक कक्षीय सिद्धांत, आमतौर पर उपयोग किए जाते हैं। इलेक्ट्रॉनिक ऑर्बिटल्स पर आरेख देख सकते है। | इसी तरह, शास्त्रीय भौतिकी के सिद्धांतों का उपयोग कई आयनिक संरचनाओं की भविष्यवाणी करने के लिए किया जा सकता है। धातु परिसरों पे जैसे अधिक जटिल यौगिकों के साथ, संयोजकता बंधन सिद्धांत कम लागू होता है और वैकल्पिक दृष्टिकोण, जैसे कि आणविक कक्षीय सिद्धांत, आमतौर पर उपयोग किए जाते हैं। इलेक्ट्रॉनिक ऑर्बिटल्स पर आरेख देख सकते है। | ||
=== ऊर्जा === | ==== ऊर्जा ==== | ||
रसायन विज्ञान के संदर्भ में, ऊर्जा किसी पदार्थ की परमाणु, आणविक या समग्र संरचना की एक विशेषता है। रासायनिक परिवर्तन के साथ एक या अधिक संरचनाओं में परिवर्तन होता है, यह हमेशा | रसायन विज्ञान के संदर्भ में, ऊर्जा किसी पदार्थ की परमाणु, आणविक या समग्र संरचना की एक विशेषता है। रासायनिक परिवर्तन के साथ एक या अधिक संरचनाओं में परिवर्तन होता है, यह हमेशा सम्मिलित पदार्थों की ऊर्जा में वृद्धि या कमी के साथ होता है। ऊर्जा परिवेश और प्रतिक्रिया के अभिकारकों के बीच ऊष्मा या प्रकाश के रूप में स्थानांतरित होती है, इस प्रकार प्रतिक्रिया के उत्पादों में अभिकारकों की तुलना में अधिक या कम ऊर्जा हो सकती है। | ||
यदि अंतिम अवस्था प्रारंभिक अवस्था की तुलना में ऊर्जा पैमाने पर कम हो तो इस प्रतिक्रिया को अतिशयोक्तिपूर्ण कहा जाता है, अंतर्जात प्रतिक्रियाओं के मामले में स्थिति विपरीत है। यदि प्रतिक्रिया परिवेश को गर्मी छोड़ती है तो इस प्रतिक्रिया को | यदि अंतिम अवस्था प्रारंभिक अवस्था की तुलना में ऊर्जा पैमाने पर कम हो तो इस प्रतिक्रिया को अतिशयोक्तिपूर्ण कहा जाता है, अंतर्जात प्रतिक्रियाओं के मामले में स्थिति विपरीत है। यदि प्रतिक्रिया परिवेश को गर्मी छोड़ती है तो इस प्रतिक्रिया को ऊष्माक्षेपी कहा जाता है, ऊष्माशोषी प्रतिक्रियाओं के मामले में, प्रतिक्रिया परिवेश से गर्मी को अवशोषित करती है। | ||
रासायनिक प्रतिक्रियाएं तब तक संभव नहीं हैं जब तक कि अभिकारक सक्रिय ऊर्जा के रूप में ज्ञात ऊर्जा अवरोध को पार नहीं कर लेते | रासायनिक प्रतिक्रियाएं तब तक संभव नहीं हैं जब तक कि अभिकारक सक्रिय ऊर्जा के रूप में ज्ञात ऊर्जा अवरोध को पार नहीं कर लेते है। बोल्ट्जमैन के जनसंख्या कारक<math>e^{-E/kT} </math> द्वारा एक रासायनिक प्रतिक्रिया की गति (दिए गए तापमान टी पर) सक्रियण ऊर्जा ई से संबंधित है यही प्रायिकता है दिए गए तापमान टी पर एक अणु की ऊर्जा ई से अधिक या उसके बराबर होती है। तापमान पर प्रतिक्रिया दर की इस घातीय निर्भरता को अरहेनियस समीकरण के रूप में जाना जाता है। रासायनिक प्रतिक्रिया होने के लिए आवश्यक सक्रियण ऊर्जा अल्ट्रासाउंड के रूप में गर्मी, प्रकाश, बिजली या यांत्रिक बल के रूप में हो सकती है।<ref>Reilly, Michael. (2007). [https://www.newscientist.com/article/dn11427-mechanical-force-induces-chemical-reaction.html#.Uy6ySlendfA Mechanical force induces chemical reaction], NewScientist.com news service, Reilly</ref> | ||
संबंधित अवधारणा मुक्त ऊर्जा में परिक्षय विचार भी | संबंधित अवधारणा मुक्त ऊर्जा में परिक्षय विचार भी सम्मिलित हैं, रासायनिक ऊष्मागतिकी में प्रतिक्रिया की व्यवहार्यता की भविष्यवाणी करने और रासायनिक प्रतिक्रिया के संतुलन की स्थिति का निर्धारण करने के लिए एक बहुत ही उपयोगी साधन है। प्रतिक्रिया तभी संभव है जब गिब्स मुक्त ऊर्जा में कुल परिवर्तन ऋणात्मक हो, <math> \Delta G \le 0 \,</math>,यदि यह शून्य के बराबर है तो रासायनिक प्रतिक्रिया को संतुलन में कहा जाता है। | ||
इलेक्ट्रॉनों, परमाणुओं और अणुओं के लिए ऊर्जा की केवल सीमित संभव अवस्थाएँ मौजूद हैं। ये क्वांटम यांत्रिकी के नियमों द्वारा निर्धारित होते हैं, जिसके लिए एक बाध्य प्रणाली की ऊर्जा के परिमाणीकरण की आवश्यकता होती है। उच्च ऊर्जा अवस्था में परमाणुओं/अणुओं को उत्तेजित कहा जाता है। उत्तेजित ऊर्जा अवस्था में पदार्थ के अणु/परमाणु अक्सर अधिक प्रतिक्रियाशील होते हैं, यानी रासायनिक प्रतिक्रियाओं के लिए अधिक उत्तरदायी होते है। | इलेक्ट्रॉनों, परमाणुओं और अणुओं के लिए ऊर्जा की केवल सीमित संभव अवस्थाएँ मौजूद हैं। ये क्वांटम यांत्रिकी के नियमों द्वारा निर्धारित होते हैं, जिसके लिए एक बाध्य प्रणाली की ऊर्जा के परिमाणीकरण की आवश्यकता होती है। उच्च ऊर्जा अवस्था में परमाणुओं/अणुओं को उत्तेजित कहा जाता है। उत्तेजित ऊर्जा अवस्था में पदार्थ के अणु/परमाणु अक्सर अधिक प्रतिक्रियाशील होते हैं, यानी रासायनिक प्रतिक्रियाओं के लिए अधिक उत्तरदायी होते है। | ||
| Line 117: | Line 117: | ||
जब कोई रासायनिक पदार्थ किसी अन्य पदार्थ के साथ या ऊर्जा के साथ पारस्परिक प्रभाव के परिणामस्वरूप रूपांतरित होता है, तो एक रासायनिक प्रतिक्रिया होती है। इसलिए रासायनिक प्रतिक्रिया एक पदार्थ की "प्रतिक्रिया" से संबंधित अवधारणा है जब यह दूसरे के साथ संपर्क में निकट आता है, चाहे मिश्रण या समाधान के रूप में या किसी प्रकार की ऊर्जा, या दोनों के संपर्क में आता है।यह प्रतिक्रिया घटकों के साथ-साथ प्रणाली पर्यावरण के साथ कुछ ऊर्जा विनिमय में परिणत होता है, जिसे जहाजों के रूप में अक्सर प्रयोगशाला कांच के बने पदार्थ डिजाइन किया जा सकता है। | जब कोई रासायनिक पदार्थ किसी अन्य पदार्थ के साथ या ऊर्जा के साथ पारस्परिक प्रभाव के परिणामस्वरूप रूपांतरित होता है, तो एक रासायनिक प्रतिक्रिया होती है। इसलिए रासायनिक प्रतिक्रिया एक पदार्थ की "प्रतिक्रिया" से संबंधित अवधारणा है जब यह दूसरे के साथ संपर्क में निकट आता है, चाहे मिश्रण या समाधान के रूप में या किसी प्रकार की ऊर्जा, या दोनों के संपर्क में आता है।यह प्रतिक्रिया घटकों के साथ-साथ प्रणाली पर्यावरण के साथ कुछ ऊर्जा विनिमय में परिणत होता है, जिसे जहाजों के रूप में अक्सर प्रयोगशाला कांच के बने पदार्थ डिजाइन किया जा सकता है। | ||
रासायनिक प्रतिक्रियाओं के परिणामस्वरूप अणुओं का निर्माण या पृथक्करण हो सकता है, अर्थात अणु टूटकर दो या दो से अधिक अणु बनाते हैं या अणुओं के भीतर या उनके पार परमाणुओं की पुनर्व्यवस्था करते हैं। रासायनिक प्रतिक्रियाओं में आमतौर पर रासायनिक बंधन बनाना या तोड़ना | रासायनिक प्रतिक्रियाओं के परिणामस्वरूप अणुओं का निर्माण या पृथक्करण हो सकता है, अर्थात अणु टूटकर दो या दो से अधिक अणु बनाते हैं या अणुओं के भीतर या उनके पार परमाणुओं की पुनर्व्यवस्था करते हैं। रासायनिक प्रतिक्रियाओं में आमतौर पर रासायनिक बंधन बनाना या तोड़ना सम्मिलित होता है। ऑक्सीकरण, अवकरण, पृथक्करण, एसिड-बेस निष्प्रभावन और आणविक पुनर्व्यवस्था कुछ सामान्य रूप से उपयोग की जाने वाली रासायनिक प्रतिक्रियाएं हैं। | ||
रासायनिक अभिक्रिया को प्रतीकात्मक रूप से रासायनिक समीकरण द्वारा दर्शाया जा सकता है। जबकि एक गैर-परमाणु रासायनिक प्रतिक्रिया में समीकरण के दोनों किनारों पर परमाणुओं की संख्या और प्रकार समान होते हैं, परमाणु प्रतिक्रिया के लिए प्रोटॉन और न्यूट्रॉन ही केवल परमाणु कणों के लिए सही होता है।<ref>[http://goldbook.iupac.org/C01034.html Chemical Reaction Equation] – IUPAC Goldbook</ref> | रासायनिक अभिक्रिया को प्रतीकात्मक रूप से रासायनिक समीकरण द्वारा दर्शाया जा सकता है। जबकि एक गैर-परमाणु रासायनिक प्रतिक्रिया में समीकरण के दोनों किनारों पर परमाणुओं की संख्या और प्रकार समान होते हैं, परमाणु प्रतिक्रिया के लिए प्रोटॉन और न्यूट्रॉन ही केवल परमाणु कणों के लिए सही होता है।<ref>[http://goldbook.iupac.org/C01034.html Chemical Reaction Equation] – IUPAC Goldbook</ref> | ||
| Line 123: | Line 123: | ||
रासायनिक प्रतिक्रिया के दौरान रासायनिक बंधों के पुनर्गठन के चरणों का क्रम इसकी क्रियाविधि कहलाता है। एक रासायनिक प्रतिक्रिया कई चरणों में होने की कल्पना की जा सकती है, जिनमें से प्रत्येक की एक अलग गति हो सकती है। परिवर्तनशील स्थिरता वाले कई प्रतिक्रिया मध्यवर्ती इस प्रकार प्रतिक्रिया के दौरान परिकल्पित किए जा सकते हैं। प्रतिक्रिया तंत्र को गतिकी और प्रतिक्रिया के सापेक्ष उत्पाद मिश्रण की व्याख्या करने का प्रस्ताव है। कई भौतिक रसायनज्ञ विभिन्न रासायनिक प्रतिक्रियाओं के तंत्र की खोज और प्रस्ताव में विशेषज्ञ हैं। कई अनुभवजन्य नियम, जैसे वुडवर्ड-हॉफमैन नियम अक्सर रासायनिक प्रतिक्रिया के लिए एक तंत्र का प्रस्ताव करते समय काम आते हैं। | रासायनिक प्रतिक्रिया के दौरान रासायनिक बंधों के पुनर्गठन के चरणों का क्रम इसकी क्रियाविधि कहलाता है। एक रासायनिक प्रतिक्रिया कई चरणों में होने की कल्पना की जा सकती है, जिनमें से प्रत्येक की एक अलग गति हो सकती है। परिवर्तनशील स्थिरता वाले कई प्रतिक्रिया मध्यवर्ती इस प्रकार प्रतिक्रिया के दौरान परिकल्पित किए जा सकते हैं। प्रतिक्रिया तंत्र को गतिकी और प्रतिक्रिया के सापेक्ष उत्पाद मिश्रण की व्याख्या करने का प्रस्ताव है। कई भौतिक रसायनज्ञ विभिन्न रासायनिक प्रतिक्रियाओं के तंत्र की खोज और प्रस्ताव में विशेषज्ञ हैं। कई अनुभवजन्य नियम, जैसे वुडवर्ड-हॉफमैन नियम अक्सर रासायनिक प्रतिक्रिया के लिए एक तंत्र का प्रस्ताव करते समय काम आते हैं। | ||
आईयुपीऐसी गोल्ड बुक के अनुसार, रासायनिक प्रतिक्रिया में रासायनिक प्रजातियों का अंतःरूपण होता है।<ref>[[Gold Book]] [http://goldbook.iupac.org/C01033.html Chemical Reaction] IUPAC Goldbook</ref> | आईयुपीऐसी गोल्ड बुक के अनुसार, रासायनिक प्रतिक्रिया में रासायनिक प्रजातियों का अंतःरूपण होता है।<ref>[[Gold Book]] [http://goldbook.iupac.org/C01033.html Chemical Reaction] IUPAC Goldbook</ref> तदनुसार, रासायनिक प्रतिक्रिया प्राथमिक प्रतिक्रिया या एक चरणबद्ध प्रतिक्रिया हो सकती है। एक अतिरिक्त चेतावनी दी गई है, जिसमें इस परिभाषा में ऐसे मामले सम्मिलित हैं जहां सरूपी का अंतरापरिणमन प्रयोगात्मक रूप से देखने योग्य है। इस तरह पता लगाने योग्य रासायनिक प्रतिक्रियाओं में आम तौर पर इस परिभाषा के अनुसार आणविक संस्थाओं के समुच्चय सम्मिलित होते हैं, लेकिन एकल आणविक संस्थाओं (यानी 'सूक्ष्म रासायनिक घटनाओं') से जुड़े परिवर्तनों के लिए भी शब्द का उपयोग करना अक्सर अवधारणात्मक रूप से सुविधाजनक होता है। | ||
=== आयन और लवण === | === आयन और लवण === | ||
[[File:Potassium-chloride-3D-ionic.png|thumb|upright=0.75|पोटेशियम क्लोराइड (KCL) की क्रिस्टल जाली संरचना, एक नमक जो k के आकर्षण के कारण बनती है<sup>+</sup> cations और cl<sup>- </sup> आयनों।ध्यान दें कि आयनिक यौगिक का समग्र आवेश शून्य है।]] | [[File:Potassium-chloride-3D-ionic.png|thumb|upright=0.75|पोटेशियम क्लोराइड (KCL) की क्रिस्टल जाली संरचना, एक नमक जो k के आकर्षण के कारण बनती है<sup>+</sup> cations और cl<sup>- </sup> आयनों।ध्यान दें कि आयनिक यौगिक का समग्र आवेश शून्य है।]] | ||
आयन एक आवेशित प्रजाति है, परमाणु या अणु, ने एक या अधिक इलेक्ट्रॉनों को खो दिया है या प्राप्त कर लिया है। जब एक परमाणु एक इलेक्ट्रॉन खो देता है और इस प्रकार इलेक्ट्रॉनों की तुलना में अधिक प्रोटॉन होता है, तो परमाणु एक सकारात्मक रूप से आवेशित आयन या धनायन होता है। जब एक परमाणु एक इलेक्ट्रॉन प्राप्त करता है और इस प्रकार प्रोटॉन की तुलना में अधिक इलेक्ट्रॉन होता है, तो परमाणु एक नकारात्मक रूप से आवेशित आयन या आयन होता है। धनायन और ऋणायन उदासीन लवणों की एक पारदर्शी जाली बना सकते हैं, जैसे Na और Cl− आयन सोडियम क्लोराइड या NaCl बनाते हैं। बहुपरमाण्विक आयनों के उदाहरण जो | आयन एक आवेशित प्रजाति है, परमाणु या अणु, ने एक या अधिक इलेक्ट्रॉनों को खो दिया है या प्राप्त कर लिया है। जब एक परमाणु एक इलेक्ट्रॉन खो देता है और इस प्रकार इलेक्ट्रॉनों की तुलना में अधिक प्रोटॉन होता है, तो परमाणु एक सकारात्मक रूप से आवेशित आयन या धनायन होता है। जब एक परमाणु एक इलेक्ट्रॉन प्राप्त करता है और इस प्रकार प्रोटॉन की तुलना में अधिक इलेक्ट्रॉन होता है, तो परमाणु एक नकारात्मक रूप से आवेशित आयन या आयन होता है। धनायन और ऋणायन उदासीन लवणों की एक पारदर्शी जाली बना सकते हैं, जैसे Na और Cl− आयन सोडियम क्लोराइड या NaCl बनाते हैं। बहुपरमाण्विक आयनों के उदाहरण जो अम्ल-क्षार प्रतिक्रियाओं के दौरान विभाजित नहीं होते हैं, वे हाइड्रॉक्साइड (OH-) ओएच) और फॉस्फेट (पीओ<sub>4</sub><sup>3 - </sup>) हैं। | ||
प्लाज्मा गैसीय पदार्थ से बना होता है जो आमतौर पर उच्च तापमान के माध्यम से पूरी तरह से आयनित हो जाता है। | प्लाज्मा गैसीय पदार्थ से बना होता है जो आमतौर पर उच्च तापमान के माध्यम से पूरी तरह से आयनित हो जाता है। | ||
| Line 133: | Line 133: | ||
=== अम्लता और बुनियादीता === | === अम्लता और बुनियादीता === | ||
[[File:Hydrogen-bromide-3D-vdW.svg|thumb|left|upright=0.75|हाइड्रोजन ब्रोमाइड गैस चरण में डायटोमिक अणु के रूप में मौजूद है]] | [[File:Hydrogen-bromide-3D-vdW.svg|thumb|left|upright=0.75|हाइड्रोजन ब्रोमाइड गैस चरण में डायटोमिक अणु के रूप में मौजूद है]] | ||
एक पदार्थ को | एक पदार्थ को अक्सर अम्ल या क्षार के रूप में वर्गीकृत किया जा सकता है। कई अलग-अलग सिद्ध। त हैं जो अम्ल-क्षार व्यवहार की व्याख्या करते हैं। सबसे सरल अरहेनियस सिद्धांत है, जिसमें कहा गया है कि अम्ल एक ऐसा पदार्थ है जो पानी में घुलने पर हाइड्रोनियम आयन पैदा करता है, और एक क्षार वह होता है जो पानी में घुलने पर हाइड्रॉक्साइड आयन पैदा करता है। ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत के अनुसार, अम्ल ऐसे पदार्थ होते हैं जो रासायनिक प्रतिक्रिया में किसी अन्य पदार्थ को एक सकारात्मक हाइड्रोजन आयन दान करते हैं, क्षार वह पदार्थ है जो उस हाइड्रोजन आयन को प्राप्त करता है। | ||
एक तीसरा सामान्य सिद्धांत लुईस अम्ल-क्षार सिद्धांत है, जो नए रासायनिक बंधों के निर्माण पर आधारित है। लुईस सिद्धांत बताता है कि एक अम्ल एक पदार्थ है जो बंधन गठन की प्रक्रिया के दौरान किसी अन्य पदार्थ से इलेक्ट्रॉनों की एक जोड़ी को स्वीकार करने में सक्षम है, जबकि क्षार वह पदार्थ है जो एक नया बंधन बनाने के लिए इलेक्ट्रॉनों की एक जोड़ी प्रदान कर सकता है।इस सिद्धांत के अनुसार, जिन महत्वपूर्ण चीजों का आदान-प्रदान किया जा रहा है, वे प्रभार हैं।<ref>{{cite web|url=http://www.apsidium.com/theory/lewis_acid.htm |title=The Lewis Acid–Base Concept |access-date=31 July 2010 |date=19 May 2003 |work=Apsidium |archive-url=https://web.archive.org/web/20080527132328/http://www.apsidium.com/theory/lewis_acid.htm |archive-date=27 May 2008 |url-status=dead }}</ref>{{Unreliable source?|date=July 2010}}ऐसे कई अन्य तरीके हैं जिनसे किसी पदार्थ को अम्ल या क्षार के रूप में वर्गीकृत किया जा सकता है, जैसा कि इस अवधारणा के इतिहास में स्पष्ट है।<ref>{{cite web|url=https://www.bbc.co.uk/dna/h2g2/A708257 |title=History of Acidity |publisher=Bbc.co.uk |date=27 May 2004 |access-date=12 June 2011}}</ref> | एक तीसरा सामान्य सिद्धांत लुईस अम्ल-क्षार सिद्धांत है, जो नए रासायनिक बंधों के निर्माण पर आधारित है। लुईस सिद्धांत बताता है कि एक अम्ल एक पदार्थ है जो बंधन गठन की प्रक्रिया के दौरान किसी अन्य पदार्थ से इलेक्ट्रॉनों की एक जोड़ी को स्वीकार करने में सक्षम है, जबकि क्षार वह पदार्थ है जो एक नया बंधन बनाने के लिए इलेक्ट्रॉनों की एक जोड़ी प्रदान कर सकता है।इस सिद्धांत के अनुसार, जिन महत्वपूर्ण चीजों का आदान-प्रदान किया जा रहा है, वे प्रभार हैं।<ref>{{cite web|url=http://www.apsidium.com/theory/lewis_acid.htm |title=The Lewis Acid–Base Concept |access-date=31 July 2010 |date=19 May 2003 |work=Apsidium |archive-url=https://web.archive.org/web/20080527132328/http://www.apsidium.com/theory/lewis_acid.htm |archive-date=27 May 2008 |url-status=dead }}</ref>{{Unreliable source?|date=July 2010}}ऐसे कई अन्य तरीके हैं जिनसे किसी पदार्थ को अम्ल या क्षार के रूप में वर्गीकृत किया जा सकता है, जैसा कि इस अवधारणा के इतिहास में स्पष्ट है।<ref>{{cite web|url=https://www.bbc.co.uk/dna/h2g2/A708257 |title=History of Acidity |publisher=Bbc.co.uk |date=27 May 2004 |access-date=12 June 2011}}</ref> | ||
| Line 140: | Line 140: | ||
=== अपोपचयन === | === अपोपचयन === | ||
अपोपचयन (अपचयन-ऑक्सीकरण) प्रतिक्रियाओं में वे सभी रासायनिक प्रतिक्रियाएं | अपोपचयन (अपचयन-ऑक्सीकरण) प्रतिक्रियाओं में वे सभी रासायनिक प्रतिक्रियाएं सम्मिलित होती हैं जिनमें परमाणुओं की ऑक्सीकरण अवस्था या तो इलेक्ट्रॉनों को प्राप्त करने (कमी) या इलेक्ट्रॉनों को खोने (ऑक्सीकरण) द्वारा बदल जाती है। वे पदार्थ जिनमें अन्य पदार्थों का ऑक्सीकरण करने की क्षमता होती है, उन्हें ऑक्सीकर कहा जाता है और उन्हें ऑक्सीकरण एजेंट, ऑक्सीकारक या ऑक्सीडाइज़र के रूप में जाना जाता है। ऑक्सीकारक दूसरे पदार्थ से इलेक्ट्रॉनों को हटा देता है। इसी तरह, जिन पदार्थों में अन्य पदार्थों को कम करने की क्षमता होती है, उन्हें अपचायक कहा जाता है और उन्हें अपचायक कारक, अपचायक के रूप में जाना जाता है। | ||
अपचायक इलेक्ट्रॉनों को दूसरे पदार्थ में स्थानांतरित करता है और इस प्रकार स्वयं ऑक्सीकृत हो जाता है। क्योंकि यह इलेक्ट्रॉनों को "दान" करता है, इसे इलेक्ट्रॉन दाता भी कहा जाता है। ऑक्सीकरण और कमी ठीक से ऑक्सीकरण संख्या में बदलाव को संदर्भित करती है - इलेक्ट्रॉनों का वास्तविक स्थानांतरण कभी नहीं हो सकता है। इस प्रकार, ऑक्सीकरण को ऑक्सीकरण संख्या में वृद्धि और ऑक्सीकरण संख्या में कमी के रूप में कमी के रूप में बेहतर परिभाषित किया गया है। | अपचायक इलेक्ट्रॉनों को दूसरे पदार्थ में स्थानांतरित करता है और इस प्रकार स्वयं ऑक्सीकृत हो जाता है। क्योंकि यह इलेक्ट्रॉनों को "दान" करता है, इसे इलेक्ट्रॉन दाता भी कहा जाता है। ऑक्सीकरण और कमी ठीक से ऑक्सीकरण संख्या में बदलाव को संदर्भित करती है - इलेक्ट्रॉनों का वास्तविक स्थानांतरण कभी नहीं हो सकता है। इस प्रकार, ऑक्सीकरण को ऑक्सीकरण संख्या में वृद्धि और ऑक्सीकरण संख्या में कमी के रूप में कमी के रूप में बेहतर परिभाषित किया गया है। | ||
| Line 167: | Line 167: | ||
* राउल्ट का नियम | * राउल्ट का नियम | ||
{{div col end}} | {{div col end}} | ||
== इतिहास == | == इतिहास == | ||
रसायन विज्ञान का इतिहास बहुत पुराने समय से लेकर आज तक का है। कई सहस्राब्दी ईसा पूर्व से, सभ्यताएं प्रौद्योगिकियों का उपयोग कर रही थीं जो अंततः रसायन शास्त्र की विभिन्न शाखाओं का आधार बनेंगी। उदाहरणों में अयस्कों से धातु निकालना, मिट्टी के बर्तन बनाना और चमकाना, बीयर और वाइन को किण्वित करना, दवा और इत्र के लिए पौधों से रसायन निकालना, वसा को साबुन में बदलना, कांच बनाना और कांस्य जैसे मिश्र धातु बनाना | रसायन विज्ञान का इतिहास बहुत पुराने समय से लेकर आज तक का है। कई सहस्राब्दी ईसा पूर्व से, सभ्यताएं प्रौद्योगिकियों का उपयोग कर रही थीं जो अंततः रसायन शास्त्र की विभिन्न शाखाओं का आधार बनेंगी। उदाहरणों में अयस्कों से धातु निकालना, मिट्टी के बर्तन बनाना और चमकाना, बीयर और वाइन को किण्वित करना, दवा और इत्र के लिए पौधों से रसायन निकालना, वसा को साबुन में बदलना, कांच बनाना और कांस्य जैसे मिश्र धातु बनाना सम्मिलित हैं। रसायन विज्ञान इसके प्रोटोसाइंस, कीमिया से पहले था, जो पदार्थ के घटकों और उनकी बातचीत को समझने के लिए गैर-वैज्ञानिक दृष्टिकोण है। यह पदार्थ की प्रकृति और उसके परिवर्तनों की व्याख्या करने में असफल रहा, लेकिन, प्रयोग करके और परिणामों को रिकॉर्ड करके, कीमियागर ने आधुनिक रसायन विज्ञान के लिए मंच तैयार किया गया था। कीमिया से अलग ज्ञान के एक निकाय के रूप में रसायन विज्ञान का उदय तब शुरू हुआ जब रॉबर्ट बॉयल ने अपने काम द स्केप्टिकल चिमिस्ट (1661) में उनके बीच एक स्पष्ट अंतर किया। जबकि कीमिया और रसायन विज्ञान दोनों का संबंध पदार्थ और उसके परिवर्तनों से है, महत्वपूर्ण अंतर उस वैज्ञानिक पद्धति द्वारा दिया गया था जिसे रसायनज्ञ अपने काम में लगाते थे। माना जाता है कि रसायन विज्ञान एंटोनी लावोज़ियर के काम के साथ एक स्थापित विज्ञान बन गया है, जिसने द्रव्यमान के संरक्षण का एक कानून विकसित किया है जिसमें सावधानीपूर्वक माप और रासायनिक घटनाओं की मात्रात्मक टिप्पणियों की मांग की गई है। रसायन विज्ञान का इतिहास ऊष्मागतिकी के इतिहास, विशेष रूप से विलार्ड गिब्स के काम के माध्यम से से जुड़ा हुआ है।<ref>[http://web.lemoyne.edu/~giunta/papers.html Selected Classic Papers from the History of Chemistry]</ref> | ||
'''<big>परिभाषा</big>''' | '''<big>परिभाषा</big>''' | ||
| Line 194: | Line 193: | ||
[[File:David - Portrait of Monsieur Lavoisier (cropped).jpg|thumb|right|upright=0.9|एंटोनी-लॉरेंट डी लावोइसियर को आधुनिक रसायन विज्ञान का पिता माना जाता है।<ref>{{Cite journal|last=Eagle |first=Cassandra T. |author2=Jennifer Sloan |title=Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry |journal=The Chemical Educator |year=1998 |volume=3 |issue=5 |pages=1–18 |doi=10.1007/s00897980249a |s2cid=97557390 }}</ref>]] | [[File:David - Portrait of Monsieur Lavoisier (cropped).jpg|thumb|right|upright=0.9|एंटोनी-लॉरेंट डी लावोइसियर को आधुनिक रसायन विज्ञान का पिता माना जाता है।<ref>{{Cite journal|last=Eagle |first=Cassandra T. |author2=Jennifer Sloan |title=Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry |journal=The Chemical Educator |year=1998 |volume=3 |issue=5 |pages=1–18 |doi=10.1007/s00897980249a |s2cid=97557390 }}</ref>]] | ||
फ्लॉजिस्टन (सभी दहन के मूल में एक पदार्थ) का सिद्धांत 18 वीं शताब्दी की शुरुआत में जर्मन जॉर्ज अर्नस्ट स्टाल द्वारा प्रतिपादित किया गया था और शताब्दी के अंत तक केवल फ्रांसीसी रसायनज्ञ एंटोनी लावोसियर, न्यूटन के रासायनिक एनालॉग द्वारा उलट दिया गया था। भौतिक विज्ञान, जिन्होंने द्रव्यमान के संरक्षण के सिद्धांत को स्पष्ट करके और आज तक इस्तेमाल की जाने वाली रासायनिक नामकरण की एक नई प्रणाली विकसित करके उचित सैद्धांतिक आधार पर नए विज्ञान को स्थापित करने के लिए किया गया था।<ref>{{Cite book|title = Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution |url = https://archive.org/details/affinitythatelus00kimm_807 |url-access = limited | author = Mi Gyung Kim | publisher = MIT Press | year = 2003 |page = [https://archive.org/details/affinitythatelus00kimm_807/page/n454 440]|isbn = 978-0-262-11273-4}}</ref> | |||
हालांकि, उनके काम से पहले, कई महत्वपूर्ण खोजें की गई थीं, विशेष रूप से 'वायु' की प्रकृति से संबंधित, जिसे कई अलग-अलग गैसों से बना पाया गया था। स्कॉटिश केमिस्ट जोसेफ ब्लैक (प्रथम प्रयोगात्मक रसायनज्ञ) और फ्लेमिश जेन बैपटिस्ट वैन हेलमोंट ने कार्बन डाइऑक्साइड की खोज की, या जिसे ब्लैक ने 1754 में 'फिक्स्ड एयर' कहा था, हेनरी कैवेंडिश ने हाइड्रोजन की खोज की और इसके गुणों को स्पष्ट किया और जोसेफ प्रीस्टली और स्वतंत्र रूप से, कार्ल विल्हेम शीले ने शुद्ध ऑक्सीजन को अलग किया था। | |||
रासायनिक संयोजनों के विद्युत रासायनिक सिद्धांत का विकास 19 वीं शताब्दी की शुरुआत में दो वैज्ञानिकों के काम के | अंग्रेजी वैज्ञानिक जॉन डाल्टन ने परमाणुओं के आधुनिक सिद्धांत का प्रस्ताव रखा, कि सभी पदार्थ के अविभाज्य 'परमाणुओं' से बने होते हैं और विभिन्न परमाणुओं के अलग-अलग परमाणु भार होते हैं। | ||
रासायनिक संयोजनों के विद्युत रासायनिक सिद्धांत का विकास 19 वीं शताब्दी की शुरुआत में दो वैज्ञानिकों के काम के परिणाम के रूप में हुआ, विशेष रूप से, जोंस जैकब बर्ज़ेलियस और हम्फ्री डेवी, एलेसेंड्रो वोल्टा द्वारा वोल्टाइक पाइल के पूर्व आविष्कार से संभव हुआ था। डेवी ने क्षार धातुओं सहित नौ नए तत्वों को उनके ऑक्साइड से विद्युत प्रवाह के साथ निकालकर खोजा था।<ref>{{cite journal|first=Humphry|last=Davy|title=On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases|pages=1–45|year=1808|volume=98|journal=Philosophical Transactions of the Royal Society|url=https://books.google.com/books?id=Kg9GAAAAMAAJ|doi=10.1098/rstl.1808.0001|doi-access=free}}</ref> | |||
[[File:Дмитрий Иванович Менделеев 4.gif|thumb|left|अपनी आवर्त सारणी में, दिमित्री मेंडेलीव ने 7 नए तत्वों के अस्तित्व की भविष्यवाणी की,<ref>{{cite web|author=Chemistry 412 course notes|title=A Brief History of the Development of Periodic Table|publisher=Western Oregon University|url=https://people.wou.edu/~courtna/ch412/perhist.htm|access-date=20 July 2015}}</ref> और अपने सही स्थानों पर उस समय ज्ञात सभी 60 तत्वों को रखा।<ref>[http://www.rsc.org/education/teachers/resources/periodictable/pre16/develop/index.htm Note]: ...it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table and {{cite web|url=http://www.rsc.org/education/teachers/resources/periodictable/pre16/develop/mendeleev.htm|title=Dmitri Mendeleev|publisher=Royal Society of Chemistry|access-date=18 July 2015}}</ref>]] | [[File:Дмитрий Иванович Менделеев 4.gif|thumb|left|अपनी आवर्त सारणी में, दिमित्री मेंडेलीव ने 7 नए तत्वों के अस्तित्व की भविष्यवाणी की,<ref>{{cite web|author=Chemistry 412 course notes|title=A Brief History of the Development of Periodic Table|publisher=Western Oregon University|url=https://people.wou.edu/~courtna/ch412/perhist.htm|access-date=20 July 2015}}</ref> और अपने सही स्थानों पर उस समय ज्ञात सभी 60 तत्वों को रखा।<ref>[http://www.rsc.org/education/teachers/resources/periodictable/pre16/develop/index.htm Note]: ...it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table and {{cite web|url=http://www.rsc.org/education/teachers/resources/periodictable/pre16/develop/mendeleev.htm|title=Dmitri Mendeleev|publisher=Royal Society of Chemistry|access-date=18 July 2015}}</ref>]] | ||
ब्रिटिश विलियम प्राउट ने पहले | ब्रिटिश विलियम प्राउट ने सबसे पहले सभी तत्वों को उनके परमाणु भार के आधार पर क्रमबद्ध करने का प्रस्ताव रखा क्योंकि सभी परमाणुओं का भार हाइड्रोजन के परमाणु भार का एक सटीक गुणक था। जे ए आर न्यूलैंड्स ने तत्वों की एक प्रारंभिक तालिका तैयार की, जिसे 1860 के दशक में दिमित्री मेंडेलीव द्वारा और स्वतंत्र रूप से जूलियस लोथर मेयर सहित कई अन्य वैज्ञानिकों द्वारा तत्वों की आधुनिक आवर्त सारणीमें विकसित किया गया था।<ref name="WebElements_dot_com">{{cite web | ||
| url = http://www.webelements.com/ | | url = http://www.webelements.com/ | ||
| title = WebElements: the periodic table on the web | | title = WebElements: the periodic table on the web | ||
| Line 212: | Line 212: | ||
| archive-url = https://web.archive.org/web/20140104110225/http://webelements.com/ | | archive-url = https://web.archive.org/web/20140104110225/http://webelements.com/ | ||
| url-status = live | | url-status = live | ||
}}</ref> <ref>"What makes these family likenesses among the elements? In the 1860s everyone was scratching their heads about that, and several scientists moved towards rather similar answers. The man who solved the problem most triumphantly was a young Russian called Dmitri Ivanovich Mendeleev, who visited the salt mine at Wieliczka in 1859." {{cite book|title=The Ascent of Man|author=Bronowski, Jacob|publisher=Little, Brown and Company|isbn=978-0-316-10930-7|year=1973|page=[https://archive.org/details/ascentofmanbron00bron/page/322 322]|url=https://archive.org/details/ascentofmanbron00bron/page/322}}</ref>अक्रिय गैस, जिन्हें बाद में नोबल गैस कहा जाता है, की खोज विलियम रामसे ने सदी के अंत में लॉर्ड रेले के सहयोग से की थी, जिससे तालिका की मूल संरचना भर गई थी। | |||
[[File:Rutherford gold foil experiment results.svg|right|upright|thumb|शीर्ष: अपेक्षित परिणाम: अल्फा कण परमाणु के प्लम पुडिंग मॉडल से गुजरने वाले अल्फा कण। | [[File:Rutherford gold foil experiment results.svg|right|upright|thumb|शीर्ष: अपेक्षित परिणाम: अल्फा कण परमाणु के प्लम पुडिंग मॉडल से गुजरने वाले अल्फा कण। | ||
नीचे: अवलोकन किए गए परिणाम: कणों के एक छोटे से हिस्से को विक्षेपित किया गया था, जो एक छोटे, केंद्रित चार्ज को दर्शाता है।]] | नीचे: अवलोकन किए गए परिणाम: कणों के एक छोटे से हिस्से को विक्षेपित किया गया था, जो एक छोटे, केंद्रित चार्ज को दर्शाता है।]] | ||
बीसवीं शताब्दी के मोड़ पर रसायन विज्ञान के सैद्धांतिक | बीसवीं शताब्दी के मोड़ पर रसायन विज्ञान के सैद्धांतिक आधार को अंततः उल्लेखनीय खोजों की एक श्रृंखला के कारण समझा गया जो परमाणुओं की आंतरिक संरचना की प्रकृति की जांच और खोज करने में सफल रहे थे। 1897 में, जे.जे. कैम्ब्रिज विश्वविद्यालय के थॉमसन ने इलेक्ट्रॉन की खोज की और इसके तुरंत बाद फ्रांसीसी वैज्ञानिक बेकरेल के साथ-साथ पियरे और मैरी क्यूरी ने रेडियोधर्मिता की घटना की जांच की थी। मैनचेस्टर विश्वविद्यालय में अग्रगमन बिखराव के प्रयोगों की एक श्रृंखला में अर्नेस्ट रदरफोर्ड ने परमाणु की आंतरिक संरचना और प्रोटॉन के अस्तित्व की खोज की, विभिन्न प्रकार की रेडियोधर्मिता को वर्गीकृत और समझाया और अल्फा कणों के साथ नाइट्रोजन पर बमबारी करके पहले तत्व को सफलतापूर्वक प्रसारित किया था। | ||
परमाणु संरचना पर उनके काम में उनके छात्रों, डेनिश भौतिक विज्ञानी नील्स बोहर, हेनरी मोसले और ओटो हैन | परमाणु संरचना पर उनके काम में उनके छात्रों, डेनिश भौतिक विज्ञानी नील्स बोहर, हेनरी मोसले और ओटो हैन ने सुधार किया, जो उभरते हुए परमाणु रसायन विज्ञान के पिता थे। रासायनिक बंधों और आणविक कक्षकों के इलेक्ट्रॉनिक सिद्धांत को अमेरिकी वैज्ञानिक लिनुस पॉलिंग और गिल्बर्ट एन. लुईस द्वारा विकसित किया गया था। | ||
वर्ष 2011 को संयुक्त राष्ट्र द्वारा रसायन विज्ञान के अंतर्राष्ट्रीय वर्ष के रूप में घोषित किया गया था।<ref>{{cite web |url=http://www.chemistry2011.org |title=Chemistry |publisher=Chemistry2011.org |access-date=10 March 2012 |archive-url=https://web.archive.org/web/20111008032346/http://www.chemistry2011.org/ |archive-date=8 October 2011 |url-status=dead }}</ref> यह इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री और संयुक्त राष्ट्र | वर्ष 2011 को संयुक्त राष्ट्र द्वारा रसायन विज्ञान के अंतर्राष्ट्रीय वर्ष के रूप में घोषित किया गया था।<ref>{{cite web |url=http://www.chemistry2011.org |title=Chemistry |publisher=Chemistry2011.org |access-date=10 March 2012 |archive-url=https://web.archive.org/web/20111008032346/http://www.chemistry2011.org/ |archive-date=8 October 2011 |url-status=dead }}</ref>यह शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ (इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री), और संयुक्त राष्ट्र शैक्षिक, वैज्ञानिक और सांस्कृतिक संगठन की एक पहल थी और इसमें दुनिया भर में रासायनिक समाज, शिक्षाविद और संस्थान सम्मिलित थे और स्थानीय और क्षेत्रीय गतिविधियों को व्यवस्थित करने के लिए व्यक्तिगत पहल पर निर्भर थे। | ||
यूरिया के फ्रेडरिक वोहलर के संश्लेषण के बाद, जस्टस वॉन लिबिग और अन्य द्वारा कार्बनिक रसायन का विकास किया गया था।<ref>{{Cite book| title = The Development of Modern Chemistry | author = Ihde, Aaron John | publisher = Courier Dover Publications | year = 1984 | page = 164 | isbn = 978-0-486-64235-2}}</ref>19वीं सदी के अन्य महत्वपूर्ण विकास वैलेंस बॉन्डिंग की समझ थे (1852 में एडवर्ड फ्रैंकलैंड) और रसायन विज्ञान के लिए थर्मोडायनामिक्स का अनुप्रयोग (1870 के दशक में जे. डब्ल्यू. गिब्स और स्वंते अरहेनियस) था। | |||
'''<big>अभ्यास</big>''' | |||
=== | === उपविषयों === | ||
रसायन विज्ञान को | रसायन विज्ञान को आम तौर पर कई प्रमुख उप-विषयों में विभाजित किया जाता है। रसायन विज्ञान के कई मुख्य पार-अनुशासनिक और अधिक विशिष्ट क्षेत्र भी हैं।<ref>{{cite encyclopedia|author1=W.G. Laidlaw|author2=D.E. Ryan|author3=Gary Horlick|author4=H.C. Clark|author5=Josef Takats|author6=Martin Cowie|author7=R.U. Lemieux|url=http://www.thecanadianencyclopedia.com/articles/chemistry-subdisciplines|title=Chemistry Subdisciplines|encyclopedia=[[The Canadian Encyclopedia]]|date=10 December 1986|access-date=12 June 2011|url-status=dead|archive-url=https://web.archive.org/web/20120312005238/http://www.thecanadianencyclopedia.com/articles/chemistry-subdisciplines|archive-date=12 March 2012}}</ref> | ||
* विश्लेषणात्मक रसायन विज्ञान उनकी रासायनिक संरचना और संरचना की समझ हासिल करने के लिए सामग्री के नमूनों का विश्लेषण है। विश्लेषणात्मक रसायन विज्ञान रसायन विज्ञान में मानकीकृत प्रयोगात्मक तरीकों को | * विश्लेषणात्मक रसायन विज्ञान उनकी रासायनिक संरचना और संरचना की समझ हासिल करने के लिए सामग्री के नमूनों का विश्लेषण है। विश्लेषणात्मक रसायन विज्ञान रसायन विज्ञान में मानकीकृत प्रयोगात्मक तरीकों को सम्मिलित करता है।विशुद्ध रूप से सैद्धांतिक रसायन विज्ञान को छोड़कर, इन विधियों का उपयोग रसायन विज्ञान के सभी उप-विषयों में किया जा सकता है। | ||
* जैव रसायन रसायनों, रासायनिक प्रतिक्रियाओं और रासायनिक बातचीत का अध्ययन है जो जीवित जीवों में होते हैं। | * जैव रसायन रसायनों, रासायनिक प्रतिक्रियाओं और रासायनिक बातचीत का अध्ययन है जो जीवित जीवों में होते हैं। औषधीय रसायन विज्ञान या तंत्रिका रसायन के रूप में जैव रसायन और कार्बनिक रसायन विज्ञान निकट से संबंधित हैं। जैव रसायन आणविक जीव विज्ञान और आनुवंशिकी से भी जुड़ा है। | ||
* अकार्बनिक रसायन | * अकार्बनिक रसायन अकार्बनिक यौगिकों के गुणों और प्रतिक्रियाओं का अध्ययन है। कार्बनिक और अकार्बनिक विषयों के बीच का अंतर सबसे महत्वपूर्ण रूप से कार्बधात्विक रसायन विज्ञान के उप-अनुशासन में पूर्ण नहीं है और बहुत अधिक ओवरलैप है। | ||
* सामग्री रसायन विज्ञान | * सामग्री रसायन विज्ञान पदार्थों की तैयारी, लक्षण वर्णन और समझ है। क्षेत्र स्नातक कार्यक्रमों में अध्ययन की एक गुंजाइश है, और यह सामग्री के लिए अद्वितीय मौलिक मुद्दों पर ध्यान देने के साथ रसायन विज्ञान के सभी शास्त्रीय क्षेत्रों के तत्वों को एकीकृत करता है। अध्ययन की प्राथमिक प्रणालियों में संघनित प्रावस्थाओं (ठोस, द्रव, बहुलक) के रसायन विज्ञान और विभिन्न प्रावस्थाओं के बीच अंतरापृष्ठ सम्मिलित हैं। | ||
* | * तंत्रिका रसायन न्यूरोकेमिकल्स का अध्ययन है, प्रेषित्र, पेप्टाइड्स, प्रोटीन, लिपिड, शर्करा और न्यूक्लिइक कोशिका अम्ल सहित उनका पारस्परिक प्रभाव, और तंत्रिका तंत्र को बनाने, बनाए रखने और संशोधित करने में भूमिका निभाते हैं। | ||
* परमाणु रसायन विज्ञान इस बात का अध्ययन है कि कैसे उप -परमाणु कण एक साथ आते हैं और नाभिक बनाते हैं। आधुनिक | * परमाणु रसायन विज्ञान इस बात का अध्ययन है कि कैसे उप-परमाणु कण एक साथ आते हैं और नाभिक बनाते हैं। आधुनिक रूपांतरण परमाणु रसायन विज्ञान का एक बड़ा घटक है, और न्यूक्लाइड की तालिका इस क्षेत्र के लिए एक महत्वपूर्ण परिणाम और उपकरण है। | ||
* कार्बनिक रसायन विज्ञान संरचना, | * कार्बनिक रसायन विज्ञान कार्बनिक यौगिकों की संरचना, गुणों, संरचना, तंत्र और प्रतिक्रियाओं का अध्ययन है। एक कार्बनिक यौगिक को कार्बन ढ़ाँचा के आधार पर किसी भी यौगिक के रूप में परिभाषित किया जाता है। | ||
* भौतिक रसायन विज्ञान रासायनिक प्रणालियों और प्रक्रियाओं के भौतिक और मौलिक आधार का अध्ययन है। विशेष रूप से, ऐसी प्रणालियों और प्रक्रियाओं | * भौतिक रसायन विज्ञान रासायनिक प्रणालियों और प्रक्रियाओं के भौतिक और मौलिक आधार का अध्ययन है। विशेष रूप से, ऐसी प्रणालियों और प्रक्रियाओं की ऊर्जा और गतिकी भौतिक रसायनज्ञों के लिए रुचिकर हैं। अध्ययन के महत्वपूर्ण क्षेत्रों में रासायनिक उष्मागतिकी, रासायनिक गतिकी, विद्युत रसायन, सांख्यिकीय यांत्रिकी, स्पेक्ट्रोमिकी, और हाल ही में, खगोल रसायन सम्मिलित हैं।<ref>{{Cite journal| author = Herbst, Eric | title = Chemistry of Star-Forming Regions | journal = Journal of Physical Chemistry A | date = 12 May 2005 | volume = 109 | pages = 4017–4029 | issue = 18 | doi = 10.1021/jp050461c | pmid = 16833724| bibcode = 2005JPCA..109.4017H }}</ref> भौतिक रसायन विज्ञान का आणविक भौतिकी के साथ बड़ा अतिव्यापन है। भौतिक रसायन विज्ञान में समीकरणों को प्राप्त करने में अति सूक्ष्म कलन का उपयोग सम्मिलित है। यह आमतौर पर क्वांटम रसायन विज्ञान और सैद्धांतिक रसायन विज्ञान से जुड़ा होता है। भौतिक रसायन विज्ञान रासायनिक भौतिकी से एक अलग अनुशासन है, लेकिन फिर से, बहुत मजबूत अतिव्यापन है। | ||
* सैद्धांतिक रसायन विज्ञान मौलिक सैद्धांतिक तर्क (आमतौर पर गणित या भौतिकी के भीतर) के माध्यम से रसायन विज्ञान का अध्ययन है। विशेष रूप से रसायन विज्ञान के लिए क्वांटम यांत्रिकी के | * सैद्धांतिक रसायन विज्ञान मौलिक सैद्धांतिक तर्क (आमतौर पर गणित या भौतिकी के भीतर) के माध्यम से रसायन विज्ञान का अध्ययन होता है। विशेष रूप से रसायन विज्ञान के लिए क्वांटम यांत्रिकी के अनुप्रयोग को क्वांटम रसायन विज्ञान कहा जाता है। द्वितीय विश्व युद्ध की समाप्ति के बाद से, संगणक के विकास ने संगणनात्मक रसायन विज्ञान के एक व्यवस्थित विकास की अनुमति दी, जो कि रासायनिक समस्याओं को हल करने के लिए अभिकलित्र क्रमादेश विकसित करने और लागू करने की कला है। सैद्धांतिक रसायन विज्ञान में (सैद्धांतिक और प्रायोगिक) संघनित पदार्थ भौतिकी और आणविक भौतिकी के साथ बड़ा अतिव्यापन है। | ||
इनमें अकार्बनिक रसायन विज्ञान, अकार्बनिक पदार्थ का अध्ययन सम्मिलित है, कार्बनिक रसायन विज्ञान, कार्बनिक (कार्बन-आधारित) पदार्थ का अध्ययन, जैव रसायन, जैविक जीवों में पाए जाने वाले पदार्थों का अध्ययन, भौतिक रसायन विज्ञान, ऊष्मप्रवैगिकी और क्वांटम यांत्रिकी जैसे भौतिक अवधारणाओं का उपयोग करके रासायनिक प्रक्रियाओं का अध्ययन, और विश्लेषणात्मक रसायन विज्ञान, सामग्री के नमूनों का विश्लेषण उनकी रासायनिक संरचना और संरचना की समझ हासिल करने के लिए किया जाता है। हाल के वर्षों में कई और विशिष्ट विषय सामने आए हैं, उदाहरण न्यूरोकैमिस्ट्री तंत्रिका तंत्र का रासायनिक अध्ययन (उपविषय देखें) है। | |||
अन्य | अन्य में वैद्युतरसायन, फेमटोकेमिस्ट्री, फ्लेवर केमिस्ट्री, स्वाद रसायन, प्रवाह रसायन, ऊतकरसायनविज्ञान, रसायन का इतिहास, हाइड्रोजनीकरण रसायन, गणितीय रसायन शास्त्र, आणविक यांत्रिकी, प्राकृतिक उत्पाद रसायन, ऑर्गोमेटेलिक रसायन, पेट्रोरसायनिकी, प्रकाश रसायन, भौतिक कार्बनिक रसायन, बहुलक रसायन, रेडियोकेमिस्ट्री, सोनोकेमिस्ट्री, सुपरमॉलेक्यूलर सम्मिलित हैं। रसायन विज्ञान, सिंथेटिक रसायन शास्त्र, और कई अन्य है। | ||
=== अंतःविषय === | === अंतःविषय === | ||
अंतःविषय क्षेत्रों में कृषिरसायन, एस्ट्रोकेमिस्ट्री (और ब्रह्वमांड रसायन), वायुमंडलीय रसायन विज्ञान, रासायनिक अभियांट्रिकी, रासायनिक जीव विज्ञान, रसायन-सूचना विज्ञान, पर्यावरण रसायन विज्ञान, भू-रसायन विज्ञान, हरित रसायन विज्ञान, इम्यूनोकेमिस्ट्री, समुद्री रसायन विज्ञान, सामग्री विज्ञान, यांत्रिक रसायन, औषधीय रसायन विज्ञान, आणविक जीव विज्ञान, अतिसूक्ष्म प्रौद्योगिकी सम्मिलित हैं। ओएनोलॉजी, औषध विज्ञान, पादपरसायन, ठोस अवस्था रसायन, भूतल विज्ञान, ऊष्मारसायन, और कई अन्य है। | |||
=== उद्योग === | === उद्योग === | ||
रासायनिक उद्योग दुनिया भर में एक महत्वपूर्ण आर्थिक गतिविधि का प्रतिनिधित्व करता है। 2013 में वैश्विक शीर्ष 50 रासायनिक उत्पादकों ने 10.3% के लाभ मार्जिन के साथ 980.5 बिलियन अमेरिकी डॉलर की बिक्री की थी।<ref name="c&en2013">{{cite news |last=Tullo |first=Alexander H. |date=28 July 2014 |title=C&EN's Global Top 50 Chemical Firms For 2014 |url=https://cen.acs.org/articles/92/i30/CENs-Global-Top-50-Chemical.html |newspaper=Chemical & Engineering News |publisher=[[American Chemical Society]] |access-date=22 August 2014}}</ref> | |||
रासायनिक उद्योग दुनिया भर में एक महत्वपूर्ण आर्थिक गतिविधि का प्रतिनिधित्व करता | |||
'''<big>पेशेवर समाज</big>''' | |||
{{div col|colwidth=25em}} | {{div col|colwidth=25em}} | ||
* अमेरिकन केमिकल सोसाइटी | * अमेरिकन केमिकल सोसाइटी | ||
| Line 264: | Line 262: | ||
* केमिस्ट्री सोसाइटीज की सूची | * केमिस्ट्री सोसाइटीज की सूची | ||
{{div col end}} | {{div col end}} | ||
== यह भी देखें == | == यह भी देखें == | ||
| Line 281: | Line 278: | ||
* विज्ञान पर्यटन | * विज्ञान पर्यटन | ||
{{div col end}} | {{div col end}} | ||
==संदर्भ== | ==संदर्भ== | ||
{{reflist}} | {{reflist}} | ||
==ग्रन्थसूची== | ==ग्रन्थसूची== | ||
{{Refbegin}} | {{Refbegin}} | ||
* {{cite book |last1=Atkins |first1=Peter | * {{cite book |last1=Atkins |first1=Peter |last2=de Paula |first2=Julio |title=Elements of Physical Chemistry |edition=5th |year=2009 |orig-year=1992 |publisher=Oxford University Press |location=New York |isbn=978-0-19-922672-6}} | ||
* {{cite book |last1=Burrows |first1=Andrew |last2=Holman |first2=John |last3=Parsons |first3=Andrew |last4=Pilling |first4=Gwen |last5=Price |first5=Gareth |title=Chemistry<sup>3</sup> |year=2009 |publisher= | * {{cite book |last1=Burrows |first1=Andrew |last2=Holman |first2=John |last3=Parsons |first3=Andrew |last4=Pilling |first4=Gwen |last5=Price |first5=Gareth |title=Chemistry<sup>3</sup> |year=2009 |publisher=Oxford University Press |location=Italy |isbn=978-0-19-927789-6}} | ||
* {{cite book |last1=Housecroft |first1=Catherine E. |last2=Sharpe |first2=Alan G. |title=Inorganic Chemistry |edition=3rd |year=2008 |orig-year=2001 |publisher= | * {{cite book |last1=Housecroft |first1=Catherine E. |last2=Sharpe |first2=Alan G. |title=Inorganic Chemistry |edition=3rd |year=2008 |orig-year=2001 |publisher=Pearson Education |location=Harlow, Essex |isbn=978-0-13-175553-6 }} | ||
{{Refend}} | {{Refend}} | ||
==अग्रिम पठन== | ==अग्रिम पठन== | ||
'''Popular reading''' | '''Popular reading''' | ||
* Atkins, P.W. ''Galileo's Finger'' ( | * Atkins, P.W. ''Galileo's Finger'' (Oxford University Press) {{ISBN|0-19-860941-8}} | ||
* Atkins, P.W. ''Atkins' Molecules'' (Cambridge University Press) {{ISBN|0-521-82397-8}} | * Atkins, P.W. ''Atkins' Molecules'' (Cambridge University Press) {{ISBN|0-521-82397-8}} | ||
* Kean, Sam. ''The Disappearing Spoon – and Other True Tales from the Periodic Table'' (Black Swan) London, 2010 {{ISBN|978-0-552-77750-6}} | * Kean, Sam. ''The Disappearing Spoon – and Other True Tales from the Periodic Table'' (Black Swan) London, 2010 {{ISBN|978-0-552-77750-6}} | ||
* | * Levi, Primo ''The Periodic Table'' (Penguin Books) [1975] translated from the Italian by Raymond Rosenthal (1984) {{ISBN|978-0-14-139944-7}} | ||
* Stwertka, A. ''A Guide to the Elements'' (Oxford University Press) {{ISBN|0-19-515027-9}} | * Stwertka, A. ''A Guide to the Elements'' (Oxford University Press) {{ISBN|0-19-515027-9}} | ||
* {{cite web|title=Dictionary of the History of Ideas |url=http://etext.lib.virginia.edu/cgi-local/DHI/dhi.cgi?id=dv1-04 |url-status=dead |archive-url=https://web.archive.org/web/20080310214753/http://etext.lib.virginia.edu/cgi-local/DHI/dhi.cgi?id=dv1-04 |archive-date=10 March 2008 }} | * {{cite web|title=Dictionary of the History of Ideas |url=http://etext.lib.virginia.edu/cgi-local/DHI/dhi.cgi?id=dv1-04 |url-status=dead |archive-url=https://web.archive.org/web/20080310214753/http://etext.lib.virginia.edu/cgi-local/DHI/dhi.cgi?id=dv1-04 |archive-date=10 March 2008 }} | ||
| Line 320: | Line 314: | ||
* Smart and Moore. ''Solid State Chemistry: An Introduction'' (Chapman and Hall) {{ISBN|0-412-40040-5}} | * Smart and Moore. ''Solid State Chemistry: An Introduction'' (Chapman and Hall) {{ISBN|0-412-40040-5}} | ||
* Stephenson, G. ''Mathematical Methods for Science Students'' (Longman) {{ISBN|0-582-44416-0}} | * Stephenson, G. ''Mathematical Methods for Science Students'' (Longman) {{ISBN|0-582-44416-0}} | ||
==बाहरी संबंध== | ==बाहरी संबंध== | ||
* [http://www.saylor.org/site/textbooks/General%20Chemistry%20Principles,%20Patterns,%20and%20Applications.pdf General Chemistry principles, patterns and applications]. | * [http://www.saylor.org/site/textbooks/General%20Chemistry%20Principles,%20Patterns,%20and%20Applications.pdf General Chemistry principles, patterns and applications]. | ||
[[Category:Machine Translated Page]] | |||
[[Category: | |||
[[Category: | [[Category:AC with 0 elements]] | ||
[[Category:All articles lacking reliable references]] | |||
[[Category:Articles lacking reliable references from July 2010]] | |||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:CS1]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:CS1 maint]] | |||
[[Category:Harv and Sfn no-target errors]] | |||
[[Category:Pages using Sister project links with default search|b]] | |||
[[Category:Pages with empty portal template]] | |||
[[Category:Portal templates with redlinked portals]] | |||
[[Category:Wikipedia articles incorporating a citation from the 1911 Encyclopaedia Britannica with Wikisource reference]] | |||
[[Category:रसायन विज्ञान| रसायन विज्ञान ]] | |||
Latest revision as of 13:13, 11 September 2022
रसायन शास्त्र या रसायन विज्ञान किसी पदार्थ के गुणों और व्यवहार का वैज्ञानिक अध्ययन है।[1] यह एक प्राकृतिक विज्ञान है जो परमाणुओं, अणुओं और आयनों से बने यौगिकों को बनाने वाले तत्वों को सम्मिलित करता है, वे उनकी बनावट, संरचना, गुण, व्यवहार और अन्य पदार्थों के साथ प्रतिक्रिया के दौरान परिवर्तन करते हैं।[2][3][4][5]
अपने विषय में, रसायन विज्ञान भौतिकी और जीव विज्ञान एक मध्यवर्ती स्थान रखता है।[6] इसे कभी-कभी केंद्रीय विज्ञान भी कहा जाता है क्योंकि यह मौलिक स्तर पर बुनियादी और अनुप्रयुक्त वैज्ञानिक विषयों दोनों को समझने के लिए एक आधार प्रदान करता है।[7] रसायन विज्ञान पौधों की वृद्धि (वनस्पति विज्ञान), आग्नेय चट्टानों (भूविज्ञान) के निर्माण, वायुमंडलीय ओजोन कैसे बनता है और पर्यावरण प्रदूषकों का क्षरण कैसे होता है (पारिस्थितिकी), चंद्रमा पर मिट्टी के गुण (कॉस्मोकेमिस्ट्री) के पहलुओं की व्याख्या करता है, दवाएं कैसे काम करती हैं (फार्माकोलॉजी), और अपराध स्थल पर डीएनए साक्ष्य कैसे एकत्र करें (फोरेंसिक) ये सब इसके उदहारण है।
रसायन विज्ञान इस तरह के विषयों को संबोधित करता है जैसे नए रासायनिक यौगिक बनाने के लिए परमाणु और अणु रासायनिक बंधों के माध्यम से कैसे परस्पर क्रिया करते हैं। रासायनिक बंधन दो प्रकार के होते हैं:
1. प्राथमिक रासायनिक बंधन, ऐसे सहसंयोजक बंधन, जिनमें परमाणु एक या अधिक इलेक्ट्रॉन साझा करते हैं, आयनिक बंधन, जिसमें एक परमाणु आयनों (धनायनों और आयनों) का उत्पादन करने के लिए एक या एक से अधिक इलेक्ट्रॉनों को दूसरे परमाणु को दान करता है, धात्विक बंध।
2. सेकेंडरी केमिकल बॉन्ड्स- जैसे, हाइड्रोजन बॉन्ड,वैन डेर वाल्स फोर्स बॉन्ड,आयन-आयन इंटरैक्शन,आयन-द्विध्रुवीय बातचीत हैं।
व्युत्पत्ति विज्ञान
रसायन विज्ञान शब्द कीमिया शब्द के पुनर्जागरण के दौरान एक संशोधन से आया है, जो कि रसायन विज्ञान, धातु विज्ञान, दर्शन, ज्योतिष, खगोल विज्ञान, रहस्यवाद और चिकित्सा के तत्वों को सम्मिलित करने वाली प्रथाओं के पहले समुच्चय को संदर्भित करता है। कीमिया को अक्सर सीसा या अन्य आधार धातुओं को सोने में बदलने की खोज से जुड़ा हुआ माना जाता है, हालांकि रसायनविद् आधुनिक रसायन विज्ञान के कई सवालों में भी रुचि रखते थे।[8]
आधुनिक शब्द कीमिया बदले में अरबी शब्द अल-किमा से लिया गया है। इसका मूल मिस्र का हो सकता है क्योंकि अल-किमा प्राचीन ग्रीक χημία से लिया गया है, जो बदले में केमेट शब्द से लिया गया है, जो मिस्र की भाषा में मिस्र का प्राचीन नाम है।[9] वैकल्पिक रूप से, अल-किमा μεία 'एक साथ संचयन' से प्राप्त होता है।[10]
आधुनिक सिद्धांत
परमाणु संरचना का वर्तमान प्रतिरूप क्वांटम मैकेनिकल प्रतिरूप है।[11] पारंपरिक रसायन विज्ञान प्राथमिक कणों, परमाणुओं, अणुओं, [12] पदार्थों, धातुओं, क्रिस्टल और पदार्थ के अन्य समुच्चय के अध्ययन से प्रारम्भ होता है। पदार्थ का अध्ययन ठोस, तरल, गैस और प्लाज्मा अवस्थाओं में, अलगाव में या संयोजन में किया जा सकता है।रसायन शास्त्र में अध्ययन की जाने वाली पारस्परिक प्रभाव, प्रतिक्रियाएं और परिवर्तन आम तौर पर परमाणुओं के बीच प्रभाव का परिणाम होते हैं, जिससे रासायनिक बंधनों की पुनर्व्यवस्था होती है जो परमाणुओं को एक साथ रखती हैं। ऐसे व्यवहारों का अध्ययन रसायन विज्ञान प्रयोगशाला में किया जाता है।
रसायन विज्ञान प्रयोगशाला स्टीरियोटाइपिक रूप से प्रयोगशाला कांच के बने पदार्थ के विभिन्न रूपों का उपयोग करती है।हालांकि ग्लासवेयर रसायन विज्ञान के लिए केंद्रीय नहीं है, और इसके बिना प्रयोगात्मक (साथ ही लागू/औद्योगिक) रसायन विज्ञान का एक बड़ा सौदा किया जाता है।
कुछ पदार्थों का एक या अधिक विभिन्न पदार्थों में परिवर्तन को रासायनिक प्रतिक्रिया कहते है। [13] रासायनिक परिवर्तन का आधार इलेक्ट्रॉनों की पुनर्व्यवस्था परमाणुओं के बीच रासायनिक बंधों में होती है। इसे प्रतीकात्मक रूप से एक रासायनिक समीकरण के माध्यम से दर्शाया जा सकता है, जिसमें आमतौर पर परमाणुओं को विषयों के रूप में सम्मिलित किया जाता है।रासायनिक परिवर्तन के समीकरण में बायीं और दायीं ओर परमाणुओं की संख्या बराबर होती है। (जब दोनों तरफ परमाणुओं की संख्या असमान होती है, तो परिवर्तन को परमाणु प्रतिक्रिया या रेडियोधर्मी क्षय कहा जाता है।) पदार्थ किसी भी प्रकार की रासायनिक प्रतिक्रियाओं से गुजर सकता है और इसके साथ होने वाले ऊर्जा परिवर्तन कुछ बुनियादी नियमों से विवश होते हैं, जिन्हें रासायनिक कानूनों के रूप में जाना जाता है।
लगभग सभी रासायनिक अध्ययनों में ऊर्जा और परिक्षय विचार अनिवार्य रूप से महत्वपूर्ण हैं। रासायनिक पदार्थों को उनकी संरचना, चरण, साथ ही साथ उनकी रासायनिक संरचना के आधार पर वर्गीकृत किया जाता है। रासायनिक विश्लेषण के उपकरणों का उपयोग करके उनका विश्लेषण किया जा सकता है, उदाहरण स्पेक्ट्रोस्कोपी और क्रोमैटोग्राफी है। रासायनिक अनुसंधान में लगे वैज्ञानिकों को रसायनज्ञ के रूप में जाना जाता है।[14] अधिकांश रसायनज्ञ एक या इससे अधिक उप-विषयों के विशेषज्ञ होते हैं। रसायन विज्ञान के अध्ययन के लिए कई अवधारणाएँ आवश्यक हैं, उनमें से कुछ निम्नलिखित हैं:[15]
द्रव्य
रसायन विज्ञान में, पदार्थ को किसी भी चीज़ के रूप में परिभाषित किया जाता है, जिसमें शेष द्रव्यमान और आयतन होता है (यह स्थान लेता है) और कणों से बना होता है। पदार्थ बनाने वाले कणों में भी शेष द्रव्यमान होता है सभी कणों में शेष द्रव्यमान नहीं होता है, जैसे कि फोटॉन। पदार्थ एक शुद्ध रासायनिक पदार्थ या पदार्थों का मिश्रण हो सकता है।[16]
परमाणु
परमाणु रसायन विज्ञान की मूल इकाई है। इसमें घने आन्तरक होते है जिसे परमाणु नाभिक कहा जाता है जो एक इलेक्ट्रॉन बादल के कब्जे वाले स्थान से घिरा होता है। नाभिक धनात्मक आवेशित प्रोटॉन और अनावेशित न्यूट्रॉन (एक साथ न्यूक्लियॉन कहलाते हैं) से बना होता है, जबकि इलेक्ट्रॉन बादल में ऋणात्मक रूप से आवेशित इलेक्ट्रॉन होते हैं जो नाभिक की परिक्रमा करते हैं। तटस्थ परमाणु में, ऋणात्मक रूप से आवेशित इलेक्ट्रॉन प्रोटॉन के धनात्मक आवेश को संतुलित करते हैं। नाभिक घने है इसलिए एक न्यूक्लियॉन का द्रव्यमान एक इलेक्ट्रॉन के द्रव्यमान का लगभग 1,836 गुना होता है, फिर भी एक परमाणु की त्रिज्या उसके नाभिक से लगभग 10,000 गुना होती है।[17][18]
परमाणु भी सबसे छोटी इकाई है जिसे तत्व के रासायनिक गुणों को बनाए रखने के लिए परिकल्पित किया जा सकता है, जैसे कि वैद्युतीयऋणात्मकता (इलेक्ट्रोनगेटिविटी), आयनीकरण क्षमता, अधिमानित ऑक्सीकरण अवस्था (एस), समन्वय संख्या, और अधिमानित प्रकार के अनुबंध बनाने के लिए (जैसे, धातु, आयनिक, सहसंयोजक)।
तत्व
रासायनिक तत्व एक शुद्ध पदार्थ है जो एक ही प्रकार के परमाणु से बना होता है, इसके परमाणुओं के नाभिक में प्रोटॉन की विशेष संख्या की विशेषता होती है, जिसे परमाणु संख्या के रूप में जाना जाता है और प्रतीक Z द्वारा दर्शाया जाता है। द्रव्यमान संख्या नाभिक में प्रोटॉन और न्यूट्रॉन की संख्या का योग है। यद्यपि एक तत्व से संबंधित सभी परमाणुओं के नाभिकों की परमाणु संख्या समान हो सकती है लेकिन, हो सकता है कि उनका द्रव्यमान संख्या समान न हो, किसी तत्व के परमाणु जिनकी द्रव्यमान संख्या भिन्न-भिन्न होती है, वो समस्थानिक कहलाते हैं। उदाहरण के लिए, सभी परमाणु जिनके नाभिक में 6 प्रोटॉन होते हैं, रासायनिक तत्व कार्बन के परमाणु होते हैं, लेकिन कार्बन के परमाणुओं की द्रव्यमान संख्या 12 या 13 हो सकती है।[18]
रासायनिक तत्वों की मानक प्रस्तुति आवर्त सारणी में है, जो तत्वों को परमाणु क्रमांक के अनुसार क्रमित करती है। आवर्त सारणी को समूहों, या स्तंभों, और आवर्तों, या पंक्तियों में व्यवस्थित किया जाता है। आवर्त सारणी आवधिक प्रवृत्तियों की पहचान करने में उपयोगी है।[19]
यौगिक
यौगिक एक शुद्ध रासायनिक पदार्थ है जो एक से अधिक तत्वों से बना होता है। यौगिक के गुण और उसके तत्वों के गुणों में समानता बहुत कम होती हैं। [20] यौगिकों का मानक नामकरण इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (आईयूपीएसी) द्वारा निर्धारित किया गया है। कार्बनिक यौगिकों का नामकरण कार्बनिक नामकरण प्रणाली के अनुसार किया जाता है।[21] अकार्बनिक यौगिकों के नाम अकार्बनिक नामकरण प्रणाली के अनुसार बनाए गए हैं। जब किसी यौगिक में एक से अधिक घटक होते हैं, तो उन्हें दो वर्गों में विभाजित किया जाता है, विद्युत धनात्मक और विद्युत ऋणात्मक घटक। [22] इसके अलावा रासायनिक सार सेवा ने रासायनिक पदार्थों को अनुक्रमित करने के लिए एक विधि तैयार की है। इस योजना में प्रत्येक रासायनिक पदार्थ को उसके सीएएस रजिस्ट्री संख्या के रूप में ज्ञात संख्या से पहचाना जाता है।
अणु
अणु एक शुद्ध रासायनिक पदार्थ का सबसे छोटा अविभाज्य भाग होता है जिसमें रासायनिक गुणों का अपना अनूठा समुच्चय होता है, जो कि अन्य पदार्थों के साथ रासायनिक प्रतिक्रियाओं के एक निश्चित समुच्चय से गुजरने की क्षमता रखता है। हालांकि, यह परिभाषा केवल उन पदार्थों के लिए अच्छी तरह से काम करती है जो अणुओं से बने होते हैं, जो कि कई पदार्थों के लिए सही नहीं है (नीचे देखें)। अणु आमतौर पर सहसंयोजक बंधों द्वारा एक साथ बंधे हुए परमाणुओं का एक समूह होता है, जैसे संरचना विद्युत रूप से तटस्थ होती है और सभी संयोजन क्षमता इलेक्ट्रॉनों को अन्य इलेक्ट्रॉनों के साथ या तो बांड में या एकाकी जोड़े में जोड़ा जाता है।
इस प्रकार, अणु आयनों के विपरीत, विद्युत रूप से तटस्थ इकाइयों के रूप में मौजूद होते हैं। जब इस नियम को तोड़ा जाता है, तो "अणु" को अभियुक्ति देते हुए, परिणाम को कभी-कभी आणविक आयन या बहुपरमाणुक आयन कहा जाता है। हालांकि, आणविक अवधारणा की असतत और अलग प्रकृति के लिए आमतौर पर आवश्यकता होती है कि आणविक आयन केवल अच्छी तरह से अलग रूप में मौजूद हों, जैसे कि मास स्पेक्ट्रोमीटर में निर्वात में निर्देशित बीम होता है। ठोस पदार्थों में रहने वाले आवेशित बहुपरमाणुक संग्रह (उदाहरण के लिए, सामान्य सल्फेट या नाइट्रेट आयन) को आमतौर पर रसायन विज्ञान में "अणु" नहीं माना जाता है। कुछ अणुओं में एक या एक से अधिक अयुग्मित इलेक्ट्रॉन होते हैं, जो रेडिकल बनाते हैं। अधिकांश रेडिकल तुलनात्मक रूप से प्रतिक्रियाशील होते हैं, लेकिन कुछ, जैसे नाइट्रिक ऑक्साइड (NO) स्थिर हो सकते हैं।
"निष्क्रिय" या उतम गैस तत्व (हीलियम, नियॉन, आर्गन, क्रिप्टन, क्सीनन और रेडॉन) अपनी सबसे छोटी असतत इकाई के रूप में अकेले परमाणुओं से बने होते हैं, लेकिन ये किसी तरह अन्य पृथक रासायनिक तत्वों में अणु या एक दूसरे से बंधे परमाणुओं के नेटवर्क होते हैं। अणु पानी, हवा और कई कार्बनिक यौगिकों जैसे शराब, चीनी, गैसोलीन और विभिन्न औषधीय जैसे परिचित पदार्थों की रचना करते हैं।
हालांकि, सभी पदार्थों या रासायनिक यौगिकों में असतत अणु नहीं होते हैं, और वास्तव में अधिकांश ठोस पदार्थ जो ठोस क्रस्ट, मेंटल और पृथ्वी के कोर बनाते हैं, अणुओं के बिना रासायनिक यौगिक होते हैं। इन अन्य प्रकार के पदार्थ, जैसे कि आयनिक यौगिक और नेटवर्क ठोस, को इस तरह से व्यवस्थित किया जाता है कि प्रति पहचान योग्य अणुओं के अस्तित्व का अभाव हो। इसके बजाय, इन पदार्थों की चर्चा सूत्र इकाइयों या इकाई कोशिकाओं के संदर्भ में पदार्थ के भीतर सबसे छोटी दोहराव वाली संरचना के रूप में की जाती है। ऐसे पदार्थों के उदाहरण खनिज लवण (जैसे टेबल नमक), कार्बन और हीरा जैसे ठोस पदार्थ, धातु, और परिचित सिलिका और सिलिकेट खनिज जैसे क्वार्ट्ज और ग्रेनाइट हैं।
अणु की मुख्य विशेषताओं में से एक इसकी ज्यामिति है जिसे अक्सर इसकी संरचना कहा जाता है। जबकि द्विपरमाणुक, त्रिपरमाण्विक या टेट्रा-परमाणु अणुओं की संरचना तुच्छ हो सकती है, (रैखिक, कोणीय पिरामिड आदि) बहुपरमाणुक अणुओं की संरचना, जो छह से अधिक परमाणुओं (कई तत्वों के) से बने होते हैं, इसकी रासायनिक प्रकृति के लिए महत्वपूर्ण हो सकते हैं। .
पदार्थ और मिश्रण
  | |
  | |
  | |
| Examples of pure chemical substances. From left to right: the elements tin (Sn) and sulfur (S), diamond (an allotrope of carbon), sucrose (pure sugar), and sodium chloride (salt) and sodium bicarbonate (baking soda), which are both ionic compounds. |
रासायनिक पदार्थ एक निश्चित संरचना और गुणों के समूह का एक पदार्थ है।[23] पदार्थों के समूह को मिश्रण कहते हैं। मिश्रण के उदाहरण वायु और मिश्र धातु हैं।[24]
मोल और पदार्थ की मात्रा
मोल माप की एक इकाई है जो पदार्थ की मात्रा (जिसे रासायनिक राशि भी कहा जाता है) को दर्शाता है। एक मोल में ठीक 6.02214076×1023 कण (परमाणु, अणु, आयन या इलेक्ट्रॉन) होते हैं, जहां प्रति मोल कणों की संख्या अवोगाद्रो स्थिरांक के रूप में जानी जाती है। मोलर सांद्रण एक विशेष पदार्थ की मात्रा प्रति घोल की मात्रा है, और आमतौर पर मोल/डीएम3 (mol/dm3 ) में सूचित किया जाता है।[25]
चरण
विभिन्न रासायनिक वर्गीकरणों को अलग करने वाले विशिष्ट रासायनिक गुणों के अलावा, रसायन कई चरणों में मौजूद हो सकते हैं। अधिकांश भाग के लिए, रासायनिक वर्गीकरण इन थोक चरण वर्गीकरणों से स्वतंत्र हैं; हालांकि, कुछ और विदेशी चरण कुछ रासायनिक गुणों के साथ असंगत हैं। एक चरण एक रासायनिक प्रणाली के राज्यों का एक सेट है जिसमें अधिकांश संरचनात्मक गुण होते हैं, जैसे कि दबाव या तापमान जैसी स्थितियों की एक सीमा पर।
भौतिक गुण, जैसे कि घनत्व और अपवर्तक सूचकांक चरण के मूल्यों की विशेषता के भीतर आते हैं। पदार्थ के चरण को चरण संक्रमण द्वारा परिभाषित किया जाता है, जो तब होता है जब ऊर्जा को प्रणाली से बाहर ले जाया जाता है या अधिकांश स्थितियों को बदलने के बजाय प्रणाली की संरचना को फिर से व्यवस्थित करने में चला जाता है।
कभी -कभी इस मामले में असतत सीमा होने के बजाय चरणों के बीच का अंतर निरंतर हो सकता है 'इस मामले को एक अतिक्रांतिक अवस्था में माना जाता है। जब तीन अवस्था स्थितियों के आधार पर मिलते हैं, तो इसे एक ट्रिपल पॉइंट के रूप में जाना जाता है और चूंकि यह अपरिवर्तनीय है, इसलिए यह शर्तों के एक सेट को परिभाषित करने का एक सुविधाजनक तरीका है।
चरणों के सबसे जाना माना उदाहरण ठोस, तरल और गैस हैं। बहुत से पदार्थ कई ठोस चरणों का प्रदर्शन करते हैं। उदाहरण के लिए, ठोस लोहे (अल्फा, गामा और डेल्टा) के तीन चरण होते हैं जो तापमान और दाब के आधार पर भिन्न होते हैं। ठोस चरणों के बीच एक प्रमुख अंतर परमाणुओं की स्फटिक संरचना या व्यवस्था है। रसायन विज्ञान के अध्ययन में आम तौर पर एक अन्य चरण जलीय चरण है, जो जलीय (अर्थात पानी में) घोल में घुलने वाले पदार्थों की स्थिति है।
कम परिचित चरणों में प्लाविक, बोस-आइंस्टीन संघनित और फ़र्मोनिक संघनित, चुंबकीय सामग्री के अनुचुंबकीय और लोह चुंबकीय चरण सम्मिलित हैं। जबकि अधिकांश परिचित चरण त्रि-आयामी प्रणालियों से निपटते हैं, द्वि-आयामी प्रणालियों में अनुरूप को परिभाषित करना भी संभव है, जिसने जीव विज्ञान में प्रणालियों के लिए इसकी प्रासंगिकता के लिए ध्यान आकर्षित किया है।
आबन्धन
अणुओं या स्फटिक में एक साथ चिपके रहने वाले परमाणुओं को एक दूसरे के साथ बंधित कहा जाता है। रासायनिक बंधन को नाभिक में धनात्मक आवेशों और उनके बारे में दोलन करने वाले ऋणात्मक आवेशों के बीच बहुध्रुवीय संतुलन के रूप में देखा जा सकता है। [26]साधारण आकर्षण और प्रतिकर्षण से अधिक, ऊर्जा और वितरण एक इलेक्ट्रॉन की उपलब्धता को दूसरे परमाणु से बंधने की विशेषता बताते हैं।
रासायनिक बंधन सहसंयोजक बंधन, आयनिक बंधन, हाइड्रोजन बंधन या सिर्फ वैनडेर वाल्स बल के कारण हो सकता है। इस प्रकार के प्रत्येक बंधन को किसी न किसी क्षमता के लिए जिम्मेदार ठहराया जाता है। ये क्षमताएं बातचीत का निर्माण करती हैं जो अणुओं या स्फटिक में परमाणुओं को एक साथ रखती हैं। कई सरल यौगिकों में, संयोजकता आबन्ध सिद्धांत, संयोजकता खोल इलेक्ट्रॉन जोड़ी प्रतिकर्षण मॉडल (वीएसईपीआर), और ऑक्सीकरण संख्या की अवधारणा का उपयोग आणविक संरचना और संरचना को समझाने के लिए किया जा सकता है।
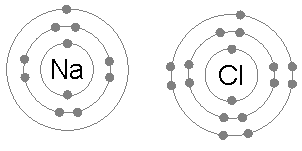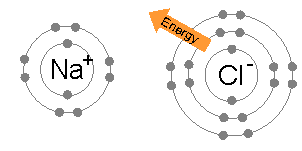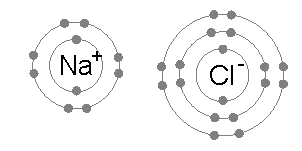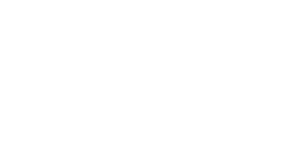
आयनिक बंधन तब बनता है जब कोई धातु अपने एक या अधिक इलेक्ट्रॉनों को खो देता है, एक धनात्मक आवेशित धनायन बन जाता है, और इलेक्ट्रॉनों को तब गैर-धातु परमाणु द्वारा प्राप्त किया जाता है, जो ऋणात्मक रूप से आवेशित आयन बन जाता है। दो विपरीत आवेशित आयन एक दूसरे को आकर्षित करते हैं, और आयनिक बंधन उनके बीच स्थिर वैद्युत विक्षेप आकर्षण बल है। दो विपरीत रूप से चार्ज किए गए आयन एक दूसरे को आकर्षित करते हैं, और आयनिक बंधन उनके बीच आकर्षण का स्थिर वैद्युत विक्षेप बल है। उदाहरण के लिए, सोडियम (Na), धातु, Na धनायन बनने के लिए एक इलेक्ट्रॉन खो देता है जबकि क्लोरीन (Cl), एक गैर-धातु, इस इलेक्ट्रॉन को Cl- बन जाता है। स्थिर वैद्युत विक्षेप आकर्षण के कारण आयनों को एक साथ रखा जाता है, और वह यौगिक सोडियम क्लोराइड (NaCl), या सामान्य टेबल सॉल्ट बनता है।
सहसंयोजक बंधन में, संयोजन इलेक्ट्रॉनों के एक या अधिक जोड़े दो परमाणुओं द्वारा साझा किए जाते हैं, बंधुआ परमाणुओं के परिणामस्वरूप विद्युत रूप से तटस्थ समूह को अणु कहा जाता है। परमाणु संयोजन इलेक्ट्रॉनों को इस तरह साझा करेंगे कि प्रत्येक परमाणु के लिए एक उत्कृष्ट गैस इलेक्ट्रॉन विन्यास (उनके सबसे बाहरी कोश में आठ इलेक्ट्रॉन) का निर्माण होगा। परमाणु जो इस तरह से संयोजित होते हैं कि उनमें से प्रत्येक के संयोजकता में आठ इलेक्ट्रॉन होते हैं, ये ऑक्टेट नियम का पालन करते हैं। हालांकि, कुछ तत्वों जैसे हाइड्रोजन और लिथियम को इस स्थिर विन्यास को प्राप्त करने के लिए अपने सबसे बाहरी कोश में केवल दो इलेक्ट्रॉनों की आवश्यकता होती है, इन परमाणुओं को युगल नियम का पालन करने के लिए कहा जाता है, और इस तरह वे महान गैस हीलियम के इलेक्ट्रॉन विन्यास तक पहुँच रहे हैं, जिसके बाहरी आवरण में दो इलेक्ट्रॉन हैं।
इसी तरह, शास्त्रीय भौतिकी के सिद्धांतों का उपयोग कई आयनिक संरचनाओं की भविष्यवाणी करने के लिए किया जा सकता है। धातु परिसरों पे जैसे अधिक जटिल यौगिकों के साथ, संयोजकता बंधन सिद्धांत कम लागू होता है और वैकल्पिक दृष्टिकोण, जैसे कि आणविक कक्षीय सिद्धांत, आमतौर पर उपयोग किए जाते हैं। इलेक्ट्रॉनिक ऑर्बिटल्स पर आरेख देख सकते है।
ऊर्जा
रसायन विज्ञान के संदर्भ में, ऊर्जा किसी पदार्थ की परमाणु, आणविक या समग्र संरचना की एक विशेषता है। रासायनिक परिवर्तन के साथ एक या अधिक संरचनाओं में परिवर्तन होता है, यह हमेशा सम्मिलित पदार्थों की ऊर्जा में वृद्धि या कमी के साथ होता है। ऊर्जा परिवेश और प्रतिक्रिया के अभिकारकों के बीच ऊष्मा या प्रकाश के रूप में स्थानांतरित होती है, इस प्रकार प्रतिक्रिया के उत्पादों में अभिकारकों की तुलना में अधिक या कम ऊर्जा हो सकती है।
यदि अंतिम अवस्था प्रारंभिक अवस्था की तुलना में ऊर्जा पैमाने पर कम हो तो इस प्रतिक्रिया को अतिशयोक्तिपूर्ण कहा जाता है, अंतर्जात प्रतिक्रियाओं के मामले में स्थिति विपरीत है। यदि प्रतिक्रिया परिवेश को गर्मी छोड़ती है तो इस प्रतिक्रिया को ऊष्माक्षेपी कहा जाता है, ऊष्माशोषी प्रतिक्रियाओं के मामले में, प्रतिक्रिया परिवेश से गर्मी को अवशोषित करती है।
रासायनिक प्रतिक्रियाएं तब तक संभव नहीं हैं जब तक कि अभिकारक सक्रिय ऊर्जा के रूप में ज्ञात ऊर्जा अवरोध को पार नहीं कर लेते है। बोल्ट्जमैन के जनसंख्या कारक द्वारा एक रासायनिक प्रतिक्रिया की गति (दिए गए तापमान टी पर) सक्रियण ऊर्जा ई से संबंधित है यही प्रायिकता है दिए गए तापमान टी पर एक अणु की ऊर्जा ई से अधिक या उसके बराबर होती है। तापमान पर प्रतिक्रिया दर की इस घातीय निर्भरता को अरहेनियस समीकरण के रूप में जाना जाता है। रासायनिक प्रतिक्रिया होने के लिए आवश्यक सक्रियण ऊर्जा अल्ट्रासाउंड के रूप में गर्मी, प्रकाश, बिजली या यांत्रिक बल के रूप में हो सकती है।[27]
संबंधित अवधारणा मुक्त ऊर्जा में परिक्षय विचार भी सम्मिलित हैं, रासायनिक ऊष्मागतिकी में प्रतिक्रिया की व्यवहार्यता की भविष्यवाणी करने और रासायनिक प्रतिक्रिया के संतुलन की स्थिति का निर्धारण करने के लिए एक बहुत ही उपयोगी साधन है। प्रतिक्रिया तभी संभव है जब गिब्स मुक्त ऊर्जा में कुल परिवर्तन ऋणात्मक हो, ,यदि यह शून्य के बराबर है तो रासायनिक प्रतिक्रिया को संतुलन में कहा जाता है।
इलेक्ट्रॉनों, परमाणुओं और अणुओं के लिए ऊर्जा की केवल सीमित संभव अवस्थाएँ मौजूद हैं। ये क्वांटम यांत्रिकी के नियमों द्वारा निर्धारित होते हैं, जिसके लिए एक बाध्य प्रणाली की ऊर्जा के परिमाणीकरण की आवश्यकता होती है। उच्च ऊर्जा अवस्था में परमाणुओं/अणुओं को उत्तेजित कहा जाता है। उत्तेजित ऊर्जा अवस्था में पदार्थ के अणु/परमाणु अक्सर अधिक प्रतिक्रियाशील होते हैं, यानी रासायनिक प्रतिक्रियाओं के लिए अधिक उत्तरदायी होते है।
किसी पदार्थ का चरण उसकी ऊर्जा और उसके परिवेश की ऊर्जा से हमेशा निर्धारित होता है। जब किसी पदार्थ के अंतर-आणविक बल ऐसे होते हैं कि परिवेश की ऊर्जा उन पर काबू पाने के लिए पर्याप्त नहीं होती है, तो यह तरल या ठोस जैसे क्रमबद्ध चरण में अधिक होता है जैसा कि पानी (H2O) के मामले में होता है, कमरे के तापमान पर एक तरल होता है क्योंकि इसके अणु हाइड्रोजन आबंध से बंधे होते हैं।[28] जबकि हाइड्रोजन सल्फाइड (H2S) एक गैस है जो कमरे के तापमान और मानक दबाव पर होता है , क्योंकि इसके अणु कमजोर द्विध्रुवीय-द्विध्रुवीय अंतःक्रियाओं से बंधे होते हैं।
रासायनिक पदार्थ में एक पदार्थ से दूसरे में ऊर्जा का स्थानांतरण उत्सर्जित ऊर्जा क्वांटा के आकार पर निर्भर करता है। हालाँकि, ऊष्मा ऊर्जा को अक्सर लगभग किसी भी पदार्थ से दूसरे में आसानी से स्थानांतरित किया जाता है क्योंकि किसी पदार्थ में कंपन और घूर्णी ऊर्जा स्तरों के लिए जिम्मेदार ध्वनि क्वान्टम में इलेक्ट्रॉनिक ऊर्जा हस्तांतरण के लिए लगाए गए फोटॉन की तुलना में बहुत कम ऊर्जा होती है। क्योंकि कंपन और घूर्णी ऊर्जा स्तर इलेक्ट्रॉनिक ऊर्जा स्तरों की तुलना में अधिक निकट होते हैं, इसलिए प्रकाश या इलेक्ट्रॉनिक ऊर्जा के अन्य रूपों के सापेक्ष पदार्थों के बीच गर्मी अधिक आसानी से स्थानांतरित हो जाती है। उदाहरण के लिए, पराबैंगनी विद्युत चुम्बकीय विकिरण को एक पदार्थ से दूसरे पदार्थ में उतनी प्रभावोत्पादकता के साथ स्थानांतरित नहीं किया जाता जितना कि तापीय या विद्युत ऊर्जा से किया जाता है।
विभिन्न रासायनिक पदार्थों के लिए विशिष्ट ऊर्जा स्तरों का अस्तित्व वर्णक्रमीय रेखाओं के विश्लेषण द्वारा उनकी पहचान के लिए उपयोगी है। रासायनिक स्पेक्ट्रोमिकी में अक्सर विभिन्न प्रकार के स्पेक्ट्रा का उपयोग किया जाता है, उदाहरण आई आर, माइक्रोवेव, एन एम आर , ई एस आर, आदि। स्पेक्ट्रोमिकी का उपयोग दूरस्थ वस्तुओं की संरचना की पहचान करने के लिए भी किया जाता है - जैसे तारे और दूर की आकाशगंगाएँ - उनके विकिरण स्पेक्ट्रा का विश्लेषण करके किया जाता है।
रासायनिक ऊर्जा शब्द का प्रयोग अक्सर रासायनिक पदार्थ की रासायनिक प्रतिक्रिया के माध्यम से परिवर्तन से गुजरने या अन्य रासायनिक पदार्थों को बदलने की क्षमता को इंगित करने के लिए किया जाता है।
प्रतिक्रिया

जब कोई रासायनिक पदार्थ किसी अन्य पदार्थ के साथ या ऊर्जा के साथ पारस्परिक प्रभाव के परिणामस्वरूप रूपांतरित होता है, तो एक रासायनिक प्रतिक्रिया होती है। इसलिए रासायनिक प्रतिक्रिया एक पदार्थ की "प्रतिक्रिया" से संबंधित अवधारणा है जब यह दूसरे के साथ संपर्क में निकट आता है, चाहे मिश्रण या समाधान के रूप में या किसी प्रकार की ऊर्जा, या दोनों के संपर्क में आता है।यह प्रतिक्रिया घटकों के साथ-साथ प्रणाली पर्यावरण के साथ कुछ ऊर्जा विनिमय में परिणत होता है, जिसे जहाजों के रूप में अक्सर प्रयोगशाला कांच के बने पदार्थ डिजाइन किया जा सकता है।
रासायनिक प्रतिक्रियाओं के परिणामस्वरूप अणुओं का निर्माण या पृथक्करण हो सकता है, अर्थात अणु टूटकर दो या दो से अधिक अणु बनाते हैं या अणुओं के भीतर या उनके पार परमाणुओं की पुनर्व्यवस्था करते हैं। रासायनिक प्रतिक्रियाओं में आमतौर पर रासायनिक बंधन बनाना या तोड़ना सम्मिलित होता है। ऑक्सीकरण, अवकरण, पृथक्करण, एसिड-बेस निष्प्रभावन और आणविक पुनर्व्यवस्था कुछ सामान्य रूप से उपयोग की जाने वाली रासायनिक प्रतिक्रियाएं हैं।
रासायनिक अभिक्रिया को प्रतीकात्मक रूप से रासायनिक समीकरण द्वारा दर्शाया जा सकता है। जबकि एक गैर-परमाणु रासायनिक प्रतिक्रिया में समीकरण के दोनों किनारों पर परमाणुओं की संख्या और प्रकार समान होते हैं, परमाणु प्रतिक्रिया के लिए प्रोटॉन और न्यूट्रॉन ही केवल परमाणु कणों के लिए सही होता है।[29]
रासायनिक प्रतिक्रिया के दौरान रासायनिक बंधों के पुनर्गठन के चरणों का क्रम इसकी क्रियाविधि कहलाता है। एक रासायनिक प्रतिक्रिया कई चरणों में होने की कल्पना की जा सकती है, जिनमें से प्रत्येक की एक अलग गति हो सकती है। परिवर्तनशील स्थिरता वाले कई प्रतिक्रिया मध्यवर्ती इस प्रकार प्रतिक्रिया के दौरान परिकल्पित किए जा सकते हैं। प्रतिक्रिया तंत्र को गतिकी और प्रतिक्रिया के सापेक्ष उत्पाद मिश्रण की व्याख्या करने का प्रस्ताव है। कई भौतिक रसायनज्ञ विभिन्न रासायनिक प्रतिक्रियाओं के तंत्र की खोज और प्रस्ताव में विशेषज्ञ हैं। कई अनुभवजन्य नियम, जैसे वुडवर्ड-हॉफमैन नियम अक्सर रासायनिक प्रतिक्रिया के लिए एक तंत्र का प्रस्ताव करते समय काम आते हैं।
आईयुपीऐसी गोल्ड बुक के अनुसार, रासायनिक प्रतिक्रिया में रासायनिक प्रजातियों का अंतःरूपण होता है।[30] तदनुसार, रासायनिक प्रतिक्रिया प्राथमिक प्रतिक्रिया या एक चरणबद्ध प्रतिक्रिया हो सकती है। एक अतिरिक्त चेतावनी दी गई है, जिसमें इस परिभाषा में ऐसे मामले सम्मिलित हैं जहां सरूपी का अंतरापरिणमन प्रयोगात्मक रूप से देखने योग्य है। इस तरह पता लगाने योग्य रासायनिक प्रतिक्रियाओं में आम तौर पर इस परिभाषा के अनुसार आणविक संस्थाओं के समुच्चय सम्मिलित होते हैं, लेकिन एकल आणविक संस्थाओं (यानी 'सूक्ष्म रासायनिक घटनाओं') से जुड़े परिवर्तनों के लिए भी शब्द का उपयोग करना अक्सर अवधारणात्मक रूप से सुविधाजनक होता है।
आयन और लवण
आयन एक आवेशित प्रजाति है, परमाणु या अणु, ने एक या अधिक इलेक्ट्रॉनों को खो दिया है या प्राप्त कर लिया है। जब एक परमाणु एक इलेक्ट्रॉन खो देता है और इस प्रकार इलेक्ट्रॉनों की तुलना में अधिक प्रोटॉन होता है, तो परमाणु एक सकारात्मक रूप से आवेशित आयन या धनायन होता है। जब एक परमाणु एक इलेक्ट्रॉन प्राप्त करता है और इस प्रकार प्रोटॉन की तुलना में अधिक इलेक्ट्रॉन होता है, तो परमाणु एक नकारात्मक रूप से आवेशित आयन या आयन होता है। धनायन और ऋणायन उदासीन लवणों की एक पारदर्शी जाली बना सकते हैं, जैसे Na और Cl− आयन सोडियम क्लोराइड या NaCl बनाते हैं। बहुपरमाण्विक आयनों के उदाहरण जो अम्ल-क्षार प्रतिक्रियाओं के दौरान विभाजित नहीं होते हैं, वे हाइड्रॉक्साइड (OH-) ओएच) और फॉस्फेट (पीओ43 - ) हैं।
प्लाज्मा गैसीय पदार्थ से बना होता है जो आमतौर पर उच्च तापमान के माध्यम से पूरी तरह से आयनित हो जाता है।
अम्लता और बुनियादीता
एक पदार्थ को अक्सर अम्ल या क्षार के रूप में वर्गीकृत किया जा सकता है। कई अलग-अलग सिद्ध। त हैं जो अम्ल-क्षार व्यवहार की व्याख्या करते हैं। सबसे सरल अरहेनियस सिद्धांत है, जिसमें कहा गया है कि अम्ल एक ऐसा पदार्थ है जो पानी में घुलने पर हाइड्रोनियम आयन पैदा करता है, और एक क्षार वह होता है जो पानी में घुलने पर हाइड्रॉक्साइड आयन पैदा करता है। ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत के अनुसार, अम्ल ऐसे पदार्थ होते हैं जो रासायनिक प्रतिक्रिया में किसी अन्य पदार्थ को एक सकारात्मक हाइड्रोजन आयन दान करते हैं, क्षार वह पदार्थ है जो उस हाइड्रोजन आयन को प्राप्त करता है।
एक तीसरा सामान्य सिद्धांत लुईस अम्ल-क्षार सिद्धांत है, जो नए रासायनिक बंधों के निर्माण पर आधारित है। लुईस सिद्धांत बताता है कि एक अम्ल एक पदार्थ है जो बंधन गठन की प्रक्रिया के दौरान किसी अन्य पदार्थ से इलेक्ट्रॉनों की एक जोड़ी को स्वीकार करने में सक्षम है, जबकि क्षार वह पदार्थ है जो एक नया बंधन बनाने के लिए इलेक्ट्रॉनों की एक जोड़ी प्रदान कर सकता है।इस सिद्धांत के अनुसार, जिन महत्वपूर्ण चीजों का आदान-प्रदान किया जा रहा है, वे प्रभार हैं।[31][unreliable source?]ऐसे कई अन्य तरीके हैं जिनसे किसी पदार्थ को अम्ल या क्षार के रूप में वर्गीकृत किया जा सकता है, जैसा कि इस अवधारणा के इतिहास में स्पष्ट है।[32]
अम्ल की ताकत आमतौर पर दो तरीकों से मापी जाती है। अम्लता की अरहेनियस परिभाषा के आधार पर पीएच एक माप है, जो समाधान में हाइड्रोनियम आयन एकाग्रता का माप है, जैसा कि नकारात्मक लॉगरिदमिक पैमाने पर व्यक्त किया गया है। इस प्रकार, कम पीएच वाले समाधानों में उच्च हाइड्रोनियम आयन सांद्रता होती है और इसे अधिकांश अम्लीय कहा जाता है। ब्रोंस्टेड-लोरी परिभाषा के आधार पर अन्य माप, अम्ल पृथक्करण स्थिरांक (Ka) है, जो एक अम्ल की ब्रोंस्टेड-लोरी परिभाषा के तहत अम्ल के रूप में कार्य करने के लिए किसी पदार्थ की सापेक्ष क्षमता को मापता है। अर्थात्, उच्च Ka वाले पदार्थ कम Ka मान वाले पदार्थों की तुलना में रासायनिक प्रतिक्रियाओं में हाइड्रोजन आयनों को दान करने की अधिक संभावना रखते हैं।
अपोपचयन
अपोपचयन (अपचयन-ऑक्सीकरण) प्रतिक्रियाओं में वे सभी रासायनिक प्रतिक्रियाएं सम्मिलित होती हैं जिनमें परमाणुओं की ऑक्सीकरण अवस्था या तो इलेक्ट्रॉनों को प्राप्त करने (कमी) या इलेक्ट्रॉनों को खोने (ऑक्सीकरण) द्वारा बदल जाती है। वे पदार्थ जिनमें अन्य पदार्थों का ऑक्सीकरण करने की क्षमता होती है, उन्हें ऑक्सीकर कहा जाता है और उन्हें ऑक्सीकरण एजेंट, ऑक्सीकारक या ऑक्सीडाइज़र के रूप में जाना जाता है। ऑक्सीकारक दूसरे पदार्थ से इलेक्ट्रॉनों को हटा देता है। इसी तरह, जिन पदार्थों में अन्य पदार्थों को कम करने की क्षमता होती है, उन्हें अपचायक कहा जाता है और उन्हें अपचायक कारक, अपचायक के रूप में जाना जाता है।
अपचायक इलेक्ट्रॉनों को दूसरे पदार्थ में स्थानांतरित करता है और इस प्रकार स्वयं ऑक्सीकृत हो जाता है। क्योंकि यह इलेक्ट्रॉनों को "दान" करता है, इसे इलेक्ट्रॉन दाता भी कहा जाता है। ऑक्सीकरण और कमी ठीक से ऑक्सीकरण संख्या में बदलाव को संदर्भित करती है - इलेक्ट्रॉनों का वास्तविक स्थानांतरण कभी नहीं हो सकता है। इस प्रकार, ऑक्सीकरण को ऑक्सीकरण संख्या में वृद्धि और ऑक्सीकरण संख्या में कमी के रूप में कमी के रूप में बेहतर परिभाषित किया गया है।
संतुलन
यद्यपि संतुलन की अवधारणा का व्यापक रूप से विज्ञान में उपयोग किया जाता है, रसायन विज्ञान के संदर्भ में, यह तब उत्पन्न होता है जब रासायनिक संरचना के कई अलग-अलग अवस्था संभव होते हैं, उदाहरण कई रासायनिक यौगिकों के मिश्रण में जो एक दूसरे के साथ प्रतिक्रिया कर सकते हैं, या जब कोई पदार्थ एक से अधिक प्रकार की अवस्थाओं में उपस्थित हो सकता है।
संतुलन पर रासायनिक पदार्थों की प्रणाली और परिवर्तनीय संरचना होने के बावजूद, अक्सर स्थिर नहीं होती है, पदार्थों के अणु एक दूसरे के साथ प्रतिक्रिया करना जारी रखते हैं और इस प्रकार एक गतिशील संतुलन को जन्म देते हैं। इस प्रकार अवधारणा उस स्थिति का वर्णन करती है जिसमें समय के साथ रासायनिक संरचना जैसे पैरामीटर अपरिवर्तित रहते हैं।
रासायनिक कानून
रासायनिक प्रतिक्रियाएं कुछ कानूनों द्वारा शासित होती हैं, जो रसायन विज्ञान में मौलिक अवधारणाएं बन गई हैं।उनमें से कुछ हैं:
- एवोगैड्रो का नियम
- बीयर -अल्बर्ट लॉ
- बॉयल का नियम (1662, दबाव और मात्रा से संबंधित)
- चार्ल्स लॉ (1787, वॉल्यूम और तापमान से संबंधित)
- फिक के प्रसार के नियम
- गे-लुसाक का नियम (1809, दबाव और तापमान से संबंधित)
- ले चेटेलियर का सिद्धांत
- हेनरी का नियम
- हेस का नियम
- ऊर्जा के संरक्षण का नियम संतुलन, ऊष्मप्रवैगिकी और कैनेटीक्स की महत्वपूर्ण अवधारणाओं की ओर जाता है।
- आधुनिक भौतिकी में भी बड़े पैमाने पर संरक्षण का कानून अलग -अलग प्रणालियों में संरक्षित है। हालांकि, विशेष सापेक्षता से पता चलता है कि द्रव्यमान-ऊर्जा समतुल्यता के कारण, जब भी गैर-भौतिक ऊर्जा (गर्मी, प्रकाश, गतिज ऊर्जा) को एक गैर-पृथक प्रणाली से हटा दिया जाता है, तो कुछ द्रव्यमान इसके साथ खो जाएगा। उच्च ऊर्जा हानि के परिणामस्वरूप द्रव्यमान की मात्रा में नुकसान होता है, जो परमाणु रसायन विज्ञान में एक महत्वपूर्ण विषय है।
- निश्चित रचना का नियम, हालांकि कई प्रणालियों में (विशेष रूप से बायोमैक्रोमोलेक्यूलस और खनिज) अनुपात में बड़ी संख्या में आवश्यकता होती है, और अक्सर एक अंश के रूप में प्रतिनिधित्व किया जाता है।
- कई अनुपातों का नियम
- राउल्ट का नियम
इतिहास
रसायन विज्ञान का इतिहास बहुत पुराने समय से लेकर आज तक का है। कई सहस्राब्दी ईसा पूर्व से, सभ्यताएं प्रौद्योगिकियों का उपयोग कर रही थीं जो अंततः रसायन शास्त्र की विभिन्न शाखाओं का आधार बनेंगी। उदाहरणों में अयस्कों से धातु निकालना, मिट्टी के बर्तन बनाना और चमकाना, बीयर और वाइन को किण्वित करना, दवा और इत्र के लिए पौधों से रसायन निकालना, वसा को साबुन में बदलना, कांच बनाना और कांस्य जैसे मिश्र धातु बनाना सम्मिलित हैं। रसायन विज्ञान इसके प्रोटोसाइंस, कीमिया से पहले था, जो पदार्थ के घटकों और उनकी बातचीत को समझने के लिए गैर-वैज्ञानिक दृष्टिकोण है। यह पदार्थ की प्रकृति और उसके परिवर्तनों की व्याख्या करने में असफल रहा, लेकिन, प्रयोग करके और परिणामों को रिकॉर्ड करके, कीमियागर ने आधुनिक रसायन विज्ञान के लिए मंच तैयार किया गया था। कीमिया से अलग ज्ञान के एक निकाय के रूप में रसायन विज्ञान का उदय तब शुरू हुआ जब रॉबर्ट बॉयल ने अपने काम द स्केप्टिकल चिमिस्ट (1661) में उनके बीच एक स्पष्ट अंतर किया। जबकि कीमिया और रसायन विज्ञान दोनों का संबंध पदार्थ और उसके परिवर्तनों से है, महत्वपूर्ण अंतर उस वैज्ञानिक पद्धति द्वारा दिया गया था जिसे रसायनज्ञ अपने काम में लगाते थे। माना जाता है कि रसायन विज्ञान एंटोनी लावोज़ियर के काम के साथ एक स्थापित विज्ञान बन गया है, जिसने द्रव्यमान के संरक्षण का एक कानून विकसित किया है जिसमें सावधानीपूर्वक माप और रासायनिक घटनाओं की मात्रात्मक टिप्पणियों की मांग की गई है। रसायन विज्ञान का इतिहास ऊष्मागतिकी के इतिहास, विशेष रूप से विलार्ड गिब्स के काम के माध्यम से से जुड़ा हुआ है।[33]
परिभाषा
समय के साथ रसायन शास्त्र की परिभाषा बदल गई है, क्योंकि नई खोजों और सिद्धांतों ने विज्ञान की कार्यक्षमता को जोड़ा है। 1661 में विख्यात वैज्ञानिक रॉबर्ट बॉयल के विचार में "काइमिस्ट्री" शब्द का अर्थ मिश्रित निकायों के भौतिक सिद्धांतों का विषय था।[34] 1663 में, केमिस्ट क्रिस्टोफर ग्लेसर ने "काइमिस्ट्री" को एक वैज्ञानिक कला के रूप में वर्णित किया, जिसके द्वारा व्यक्ति शरीर को भंग करना सीखता है, और उनसे उनकी संरचना पर विभिन्न पदार्थों को आकर्षित करता है, और उन्हें फिर से कैसे एकजुट करता है, और उन्हें एक उच्च पूर्णता तक बढ़ाता है।[35]
जॉर्ज अर्न्स्ट स्टाल द्वारा प्रयुक्त शब्द "रसायन विज्ञान" की 1730 की परिभाषा का अर्थ मिश्रित, या समग्र निकायों को उनके सिद्धांतों में हल करने और उन सिद्धांतों से ऐसे निकायों की रचना करनाकी कला है।[36] 1837 में, जीन-बैप्टिस्ट डुमास ने आणविक बलों के कानूनों और प्रभावों से संबंधित विज्ञान को संदर्भित करने के लिए "रसायन विज्ञान" शब्द पर विचार किया था।[37]यह परिभाषा आगे तब तक विकसित हुई, जब तक कि 1947 में, इसका अर्थ पदार्थों का विज्ञान हो गया उनकी संरचना, उनके गुण, और प्रतिक्रियाएं जो उन्हें अन्य पदार्थों में बदल देती हैं - लिनुस पॉलिंग द्वारा स्वीकार किया गया एक लक्षण वर्णन स्वीकार किया गया था।[38] अभी हाल ही में, 1998 में, प्रोफेसर रेमंड चांग ने "रसायन विज्ञान" की परिभाषा को व्यापक बनाया, जिसका अर्थ पदार्थ का अध्ययन और उसमें होने वाले परिवर्तन है।[39]
अनुशासन
प्रारंभिक सभ्यताएं, जैसे कि मिस्र के लोग[40] बेबीलोनियन और भारतीय[41] धातु विज्ञान, मिट्टी के बर्तनों और रंगों की कलाओं से संबंधित व्यावहारिक ज्ञान को एकत्रित किया, लेकिन एक व्यवस्थित सिद्धांत विकसित नहीं किया।
रासायनिक परिकल्पना पहली बार शास्त्रीय ग्रीस में चार तत्वों के सिद्धांत के साथ उभरी थी, जैसा कि अरस्तू ने निश्चित रूप से प्रतिपादित किया था कि अग्नि, वायु, पृथ्वी और जल मौलिक तत्व थे जिनसे सब कुछ एक संयोजन के रूप में बनता है। ग्रीक परमाणुवाद 440 ईसा पूर्व का है, जो डेमोक्रिटस और एपिकुरस जैसे दार्शनिकों के कार्यों में उत्पन्न हुआ है। 50 ईसा पूर्व में, रोमन दार्शनिक ल्यूक्रेटियस ने अपनी पुस्तक डे रेरम नेचुरा (ऑन द नेचर ऑफ थिंग्स) में इस सिद्धांत का विस्तार किया था।[42][43]विज्ञान की आधुनिक अवधारणाओं के विपरीत, ग्रीक परमाणुवाद प्रकृति में विशुद्ध रूप से दार्शनिक था, जिसमें अनुभवजन्य टिप्पणियों के लिए संबंध बहुत कम थी और रासायनिक प्रयोगों के लिए कोई संबंध नहीं था।[44]
द्रव्यमान के संरक्षण के विचार की धारणा है कि प्राचीन यूनानी दर्शन में "कुछ भी नहीं से आता है", जो एम्पेडोकल्स (लगभग चौथी शताब्दी ईसा पूर्व) में पाया जा सकता है "क्योंकि किसी भी चीज का होना असंभव है। जो नहीं है, और जो कुछ है, उसके बारे में सुना या सुना नहीं जा सकता है, जो पूरी तरह से नष्ट हो जाना चाहिए।"[45] और एपिकुरस (तीसरी शताब्दी ईसा पूर्व), जिन्होंने ब्रह्मांड की प्रकृति का वर्णन करते हुए लिखा है कि "चीजों की समग्रता हमेशा वैसी ही थी जैसी अभी है, और हमेशा रहेगी।[46]
हेलेनिस्टिक दुनिया में कीमिया की कला ने सबसे पहले प्राकृतिक पदार्थों के अध्ययन में जादू और गूढ़ता का प्रसार किया, तत्वों को सोने में बदलने और अनन्त जीवन के अमृत की खोज के अंतिम लक्ष्य के साथ प्रसार किया था।[47] काम में विशेष रूप से आसवन का विकास, प्रारंभिक बीजान्टिन काल में जारी रहा, जिसमें सबसे प्रसिद्ध व्यवसायी पैनोपोलिस के चौथी शताब्दी ग्रीक-मिस्र के ज़ोसिमोस थे।[48] मुस्लिम विजय के बाद पूरे अरब दुनिया भर में कीमिया का विकास और अभ्यास पूरे अरब दुनिया में जारी रहा था।,[49] और वहाँ से, और बीजान्टिन अवशेषों से,[50] लैटिन अनुवादों के माध्यम से मध्ययुगीन और पुनर्जागरण यूरोप में फैल गया था।
जाबिर इब्न हेयान के लिए जिम्मेदार अरबी कार्यों ने रासायनिक पदार्थों का एक व्यवस्थित वर्गीकरण पेश किया, और रासायनिक माध्यमों से कार्बनिक पदार्थों (जैसे पौधों, रक्त और बालों) से एक अकार्बनिक यौगिक (साल अमोनियाक या अमोनियम क्लोराइड) प्राप्त करने के निर्देश प्रदान किए थे।[51] कुछ अरबी जाबिरियन कृतियों (उदाहरण "द बुक ऑफ मर्सी", और "बुक ऑफ सेवेंटी") को बाद में लैटिन में "गेबर" नाम से लैटिन में अनुवादित किया गया, [52] और 13 वीं शताब्दी के यूरोप में एक गुमनाम लेखक, जिसे आमतौर पर संदर्भित किया गया था। छद्म गेबर के रूप में, इस नाम के तहत रसायन विज्ञान और धातुकर्म लेखन का उत्पादन शुरू किया गया था।[53] बाद में प्रभावशाली मुस्लिम दार्शनिक, जैसे कि अबू अल-रेहान अल-बिरन[54] और एविसेना[55] ने कीमिया के सिद्धांतों, विशेष रूप से धातुओं के रूपांतरण के सिद्धांत पर विवाद किया था।
सर फ्रांसिस बेकन और अन्य लोगों द्वारा प्रतिपादित नए अनुभवजन्य तरीकों के प्रभाव में, ऑक्सफोर्ड, रॉबर्ट बॉयल, रॉबर्ट हुक और जॉन मेव के रसायनज्ञों के एक समूह ने पुरानी कीमिया परंपराओं को एक वैज्ञानिक अनुशासन में बदलना शुरू कर दिया था।विशेष रूप से बॉयल को उनके सबसे महत्वपूर्ण काम के कारण रसायन विज्ञान के संस्थापक पिता के रूप में माना जाता है, शास्त्रीय रसायन विज्ञान टेक्स्ट द स्केप्टिकल चिमिस्ट जहां कीमिया के दावों और नए रसायन विज्ञान की अनुभवजन्य वैज्ञानिक खोजों के बीच अंतर किया जाता है।[56] उन्होंने बॉयल के नियम को तैयार किया, शास्त्रीय "चार तत्वों" को खारिज कर दिया और परमाणुओं और रासायनिक प्रतिक्रियाओं का एक यंत्रवत विकल्प प्रस्तावित किया जो कठोर प्रयोग के अधीन हो सकता है।[57]

फ्लॉजिस्टन (सभी दहन के मूल में एक पदार्थ) का सिद्धांत 18 वीं शताब्दी की शुरुआत में जर्मन जॉर्ज अर्नस्ट स्टाल द्वारा प्रतिपादित किया गया था और शताब्दी के अंत तक केवल फ्रांसीसी रसायनज्ञ एंटोनी लावोसियर, न्यूटन के रासायनिक एनालॉग द्वारा उलट दिया गया था। भौतिक विज्ञान, जिन्होंने द्रव्यमान के संरक्षण के सिद्धांत को स्पष्ट करके और आज तक इस्तेमाल की जाने वाली रासायनिक नामकरण की एक नई प्रणाली विकसित करके उचित सैद्धांतिक आधार पर नए विज्ञान को स्थापित करने के लिए किया गया था।[59]
हालांकि, उनके काम से पहले, कई महत्वपूर्ण खोजें की गई थीं, विशेष रूप से 'वायु' की प्रकृति से संबंधित, जिसे कई अलग-अलग गैसों से बना पाया गया था। स्कॉटिश केमिस्ट जोसेफ ब्लैक (प्रथम प्रयोगात्मक रसायनज्ञ) और फ्लेमिश जेन बैपटिस्ट वैन हेलमोंट ने कार्बन डाइऑक्साइड की खोज की, या जिसे ब्लैक ने 1754 में 'फिक्स्ड एयर' कहा था, हेनरी कैवेंडिश ने हाइड्रोजन की खोज की और इसके गुणों को स्पष्ट किया और जोसेफ प्रीस्टली और स्वतंत्र रूप से, कार्ल विल्हेम शीले ने शुद्ध ऑक्सीजन को अलग किया था।
अंग्रेजी वैज्ञानिक जॉन डाल्टन ने परमाणुओं के आधुनिक सिद्धांत का प्रस्ताव रखा, कि सभी पदार्थ के अविभाज्य 'परमाणुओं' से बने होते हैं और विभिन्न परमाणुओं के अलग-अलग परमाणु भार होते हैं।
रासायनिक संयोजनों के विद्युत रासायनिक सिद्धांत का विकास 19 वीं शताब्दी की शुरुआत में दो वैज्ञानिकों के काम के परिणाम के रूप में हुआ, विशेष रूप से, जोंस जैकब बर्ज़ेलियस और हम्फ्री डेवी, एलेसेंड्रो वोल्टा द्वारा वोल्टाइक पाइल के पूर्व आविष्कार से संभव हुआ था। डेवी ने क्षार धातुओं सहित नौ नए तत्वों को उनके ऑक्साइड से विद्युत प्रवाह के साथ निकालकर खोजा था।[60]
ब्रिटिश विलियम प्राउट ने सबसे पहले सभी तत्वों को उनके परमाणु भार के आधार पर क्रमबद्ध करने का प्रस्ताव रखा क्योंकि सभी परमाणुओं का भार हाइड्रोजन के परमाणु भार का एक सटीक गुणक था। जे ए आर न्यूलैंड्स ने तत्वों की एक प्रारंभिक तालिका तैयार की, जिसे 1860 के दशक में दिमित्री मेंडेलीव द्वारा और स्वतंत्र रूप से जूलियस लोथर मेयर सहित कई अन्य वैज्ञानिकों द्वारा तत्वों की आधुनिक आवर्त सारणीमें विकसित किया गया था।[63] [64]अक्रिय गैस, जिन्हें बाद में नोबल गैस कहा जाता है, की खोज विलियम रामसे ने सदी के अंत में लॉर्ड रेले के सहयोग से की थी, जिससे तालिका की मूल संरचना भर गई थी।
बीसवीं शताब्दी के मोड़ पर रसायन विज्ञान के सैद्धांतिक आधार को अंततः उल्लेखनीय खोजों की एक श्रृंखला के कारण समझा गया जो परमाणुओं की आंतरिक संरचना की प्रकृति की जांच और खोज करने में सफल रहे थे। 1897 में, जे.जे. कैम्ब्रिज विश्वविद्यालय के थॉमसन ने इलेक्ट्रॉन की खोज की और इसके तुरंत बाद फ्रांसीसी वैज्ञानिक बेकरेल के साथ-साथ पियरे और मैरी क्यूरी ने रेडियोधर्मिता की घटना की जांच की थी। मैनचेस्टर विश्वविद्यालय में अग्रगमन बिखराव के प्रयोगों की एक श्रृंखला में अर्नेस्ट रदरफोर्ड ने परमाणु की आंतरिक संरचना और प्रोटॉन के अस्तित्व की खोज की, विभिन्न प्रकार की रेडियोधर्मिता को वर्गीकृत और समझाया और अल्फा कणों के साथ नाइट्रोजन पर बमबारी करके पहले तत्व को सफलतापूर्वक प्रसारित किया था।
परमाणु संरचना पर उनके काम में उनके छात्रों, डेनिश भौतिक विज्ञानी नील्स बोहर, हेनरी मोसले और ओटो हैन ने सुधार किया, जो उभरते हुए परमाणु रसायन विज्ञान के पिता थे। रासायनिक बंधों और आणविक कक्षकों के इलेक्ट्रॉनिक सिद्धांत को अमेरिकी वैज्ञानिक लिनुस पॉलिंग और गिल्बर्ट एन. लुईस द्वारा विकसित किया गया था।
वर्ष 2011 को संयुक्त राष्ट्र द्वारा रसायन विज्ञान के अंतर्राष्ट्रीय वर्ष के रूप में घोषित किया गया था।[65]यह शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ (इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री), और संयुक्त राष्ट्र शैक्षिक, वैज्ञानिक और सांस्कृतिक संगठन की एक पहल थी और इसमें दुनिया भर में रासायनिक समाज, शिक्षाविद और संस्थान सम्मिलित थे और स्थानीय और क्षेत्रीय गतिविधियों को व्यवस्थित करने के लिए व्यक्तिगत पहल पर निर्भर थे।
यूरिया के फ्रेडरिक वोहलर के संश्लेषण के बाद, जस्टस वॉन लिबिग और अन्य द्वारा कार्बनिक रसायन का विकास किया गया था।[66]19वीं सदी के अन्य महत्वपूर्ण विकास वैलेंस बॉन्डिंग की समझ थे (1852 में एडवर्ड फ्रैंकलैंड) और रसायन विज्ञान के लिए थर्मोडायनामिक्स का अनुप्रयोग (1870 के दशक में जे. डब्ल्यू. गिब्स और स्वंते अरहेनियस) था।
अभ्यास
उपविषयों
रसायन विज्ञान को आम तौर पर कई प्रमुख उप-विषयों में विभाजित किया जाता है। रसायन विज्ञान के कई मुख्य पार-अनुशासनिक और अधिक विशिष्ट क्षेत्र भी हैं।[67]
- विश्लेषणात्मक रसायन विज्ञान उनकी रासायनिक संरचना और संरचना की समझ हासिल करने के लिए सामग्री के नमूनों का विश्लेषण है। विश्लेषणात्मक रसायन विज्ञान रसायन विज्ञान में मानकीकृत प्रयोगात्मक तरीकों को सम्मिलित करता है।विशुद्ध रूप से सैद्धांतिक रसायन विज्ञान को छोड़कर, इन विधियों का उपयोग रसायन विज्ञान के सभी उप-विषयों में किया जा सकता है।
- जैव रसायन रसायनों, रासायनिक प्रतिक्रियाओं और रासायनिक बातचीत का अध्ययन है जो जीवित जीवों में होते हैं। औषधीय रसायन विज्ञान या तंत्रिका रसायन के रूप में जैव रसायन और कार्बनिक रसायन विज्ञान निकट से संबंधित हैं। जैव रसायन आणविक जीव विज्ञान और आनुवंशिकी से भी जुड़ा है।
- अकार्बनिक रसायन अकार्बनिक यौगिकों के गुणों और प्रतिक्रियाओं का अध्ययन है। कार्बनिक और अकार्बनिक विषयों के बीच का अंतर सबसे महत्वपूर्ण रूप से कार्बधात्विक रसायन विज्ञान के उप-अनुशासन में पूर्ण नहीं है और बहुत अधिक ओवरलैप है।
- सामग्री रसायन विज्ञान पदार्थों की तैयारी, लक्षण वर्णन और समझ है। क्षेत्र स्नातक कार्यक्रमों में अध्ययन की एक गुंजाइश है, और यह सामग्री के लिए अद्वितीय मौलिक मुद्दों पर ध्यान देने के साथ रसायन विज्ञान के सभी शास्त्रीय क्षेत्रों के तत्वों को एकीकृत करता है। अध्ययन की प्राथमिक प्रणालियों में संघनित प्रावस्थाओं (ठोस, द्रव, बहुलक) के रसायन विज्ञान और विभिन्न प्रावस्थाओं के बीच अंतरापृष्ठ सम्मिलित हैं।
- तंत्रिका रसायन न्यूरोकेमिकल्स का अध्ययन है, प्रेषित्र, पेप्टाइड्स, प्रोटीन, लिपिड, शर्करा और न्यूक्लिइक कोशिका अम्ल सहित उनका पारस्परिक प्रभाव, और तंत्रिका तंत्र को बनाने, बनाए रखने और संशोधित करने में भूमिका निभाते हैं।
- परमाणु रसायन विज्ञान इस बात का अध्ययन है कि कैसे उप-परमाणु कण एक साथ आते हैं और नाभिक बनाते हैं। आधुनिक रूपांतरण परमाणु रसायन विज्ञान का एक बड़ा घटक है, और न्यूक्लाइड की तालिका इस क्षेत्र के लिए एक महत्वपूर्ण परिणाम और उपकरण है।
- कार्बनिक रसायन विज्ञान कार्बनिक यौगिकों की संरचना, गुणों, संरचना, तंत्र और प्रतिक्रियाओं का अध्ययन है। एक कार्बनिक यौगिक को कार्बन ढ़ाँचा के आधार पर किसी भी यौगिक के रूप में परिभाषित किया जाता है।
- भौतिक रसायन विज्ञान रासायनिक प्रणालियों और प्रक्रियाओं के भौतिक और मौलिक आधार का अध्ययन है। विशेष रूप से, ऐसी प्रणालियों और प्रक्रियाओं की ऊर्जा और गतिकी भौतिक रसायनज्ञों के लिए रुचिकर हैं। अध्ययन के महत्वपूर्ण क्षेत्रों में रासायनिक उष्मागतिकी, रासायनिक गतिकी, विद्युत रसायन, सांख्यिकीय यांत्रिकी, स्पेक्ट्रोमिकी, और हाल ही में, खगोल रसायन सम्मिलित हैं।[68] भौतिक रसायन विज्ञान का आणविक भौतिकी के साथ बड़ा अतिव्यापन है। भौतिक रसायन विज्ञान में समीकरणों को प्राप्त करने में अति सूक्ष्म कलन का उपयोग सम्मिलित है। यह आमतौर पर क्वांटम रसायन विज्ञान और सैद्धांतिक रसायन विज्ञान से जुड़ा होता है। भौतिक रसायन विज्ञान रासायनिक भौतिकी से एक अलग अनुशासन है, लेकिन फिर से, बहुत मजबूत अतिव्यापन है।
- सैद्धांतिक रसायन विज्ञान मौलिक सैद्धांतिक तर्क (आमतौर पर गणित या भौतिकी के भीतर) के माध्यम से रसायन विज्ञान का अध्ययन होता है। विशेष रूप से रसायन विज्ञान के लिए क्वांटम यांत्रिकी के अनुप्रयोग को क्वांटम रसायन विज्ञान कहा जाता है। द्वितीय विश्व युद्ध की समाप्ति के बाद से, संगणक के विकास ने संगणनात्मक रसायन विज्ञान के एक व्यवस्थित विकास की अनुमति दी, जो कि रासायनिक समस्याओं को हल करने के लिए अभिकलित्र क्रमादेश विकसित करने और लागू करने की कला है। सैद्धांतिक रसायन विज्ञान में (सैद्धांतिक और प्रायोगिक) संघनित पदार्थ भौतिकी और आणविक भौतिकी के साथ बड़ा अतिव्यापन है।
इनमें अकार्बनिक रसायन विज्ञान, अकार्बनिक पदार्थ का अध्ययन सम्मिलित है, कार्बनिक रसायन विज्ञान, कार्बनिक (कार्बन-आधारित) पदार्थ का अध्ययन, जैव रसायन, जैविक जीवों में पाए जाने वाले पदार्थों का अध्ययन, भौतिक रसायन विज्ञान, ऊष्मप्रवैगिकी और क्वांटम यांत्रिकी जैसे भौतिक अवधारणाओं का उपयोग करके रासायनिक प्रक्रियाओं का अध्ययन, और विश्लेषणात्मक रसायन विज्ञान, सामग्री के नमूनों का विश्लेषण उनकी रासायनिक संरचना और संरचना की समझ हासिल करने के लिए किया जाता है। हाल के वर्षों में कई और विशिष्ट विषय सामने आए हैं, उदाहरण न्यूरोकैमिस्ट्री तंत्रिका तंत्र का रासायनिक अध्ययन (उपविषय देखें) है।
अन्य में वैद्युतरसायन, फेमटोकेमिस्ट्री, फ्लेवर केमिस्ट्री, स्वाद रसायन, प्रवाह रसायन, ऊतकरसायनविज्ञान, रसायन का इतिहास, हाइड्रोजनीकरण रसायन, गणितीय रसायन शास्त्र, आणविक यांत्रिकी, प्राकृतिक उत्पाद रसायन, ऑर्गोमेटेलिक रसायन, पेट्रोरसायनिकी, प्रकाश रसायन, भौतिक कार्बनिक रसायन, बहुलक रसायन, रेडियोकेमिस्ट्री, सोनोकेमिस्ट्री, सुपरमॉलेक्यूलर सम्मिलित हैं। रसायन विज्ञान, सिंथेटिक रसायन शास्त्र, और कई अन्य है।
अंतःविषय
अंतःविषय क्षेत्रों में कृषिरसायन, एस्ट्रोकेमिस्ट्री (और ब्रह्वमांड रसायन), वायुमंडलीय रसायन विज्ञान, रासायनिक अभियांट्रिकी, रासायनिक जीव विज्ञान, रसायन-सूचना विज्ञान, पर्यावरण रसायन विज्ञान, भू-रसायन विज्ञान, हरित रसायन विज्ञान, इम्यूनोकेमिस्ट्री, समुद्री रसायन विज्ञान, सामग्री विज्ञान, यांत्रिक रसायन, औषधीय रसायन विज्ञान, आणविक जीव विज्ञान, अतिसूक्ष्म प्रौद्योगिकी सम्मिलित हैं। ओएनोलॉजी, औषध विज्ञान, पादपरसायन, ठोस अवस्था रसायन, भूतल विज्ञान, ऊष्मारसायन, और कई अन्य है।
उद्योग
रासायनिक उद्योग दुनिया भर में एक महत्वपूर्ण आर्थिक गतिविधि का प्रतिनिधित्व करता है। 2013 में वैश्विक शीर्ष 50 रासायनिक उत्पादकों ने 10.3% के लाभ मार्जिन के साथ 980.5 बिलियन अमेरिकी डॉलर की बिक्री की थी।[69]
पेशेवर समाज
- अमेरिकन केमिकल सोसाइटी
- न्यूरोकेमिस्ट्री के लिए अमेरिकन सोसाइटी
- कनाडा का रासायनिक संस्थान
- पेरू की केमिकल सोसाइटी
- शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ
- रॉयल ऑस्ट्रेलियन केमिकल इंस्टीट्यूट
- रॉयल नीदरलैंड्स केमिकल सोसाइटी
- रॉयल सोसाइटी ऑफ केमिस्ट्री
- रासायनिक उद्योग सोसायटी
- सैद्धांतिक और कम्प्यूटेशनल रसायनज्ञों का विश्व संघ
- केमिस्ट्री सोसाइटीज की सूची
यह भी देखें
- आणविक यांत्रिकी मॉडलिंग के लिए सॉफ्टवेयर की तुलना
- रसायन विज्ञान की शब्दावली
- रसायन विज्ञान का अंतर्राष्ट्रीय वर्ष
- रसायनज्ञों की सूची
- यौगिकों की सूची
- रसायन विज्ञान में महत्वपूर्ण प्रकाशनों की सूची
- रसायन विज्ञान में अनसुलझी समस्याओं की सूची
- रसायन विज्ञान की रूपरेखा
- छोटे अणुओं की आवधिक प्रणाली
- रसायन विज्ञान का दर्शन
- विज्ञान पर्यटन
संदर्भ
- ↑ Brown, Theodore L.; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Murphey, Catherine J.; Woodward, Patrick M.; Stoltzfus, Matthew W.; Lufaso, Michael W. (2018). "Introduction: Matter, energy, and measurement". Chemistry: The Central Science (14th ed.). New York: Pearson. pp. 46–85. ISBN 9780134414232.
- ↑ "What is Chemistry?". Chemweb.ucc.ie. Archived from the original on 3 October 2018. Retrieved 12 June 2011.
- ↑ "Definition of CHEMISTRY". www.merriam-webster.com (in English). Retrieved 24 August 2020.
- ↑ "Definition of chemistry | Dictionary.com". www.dictionary.com (in English). Retrieved 24 August 2020.
- ↑ "Chemistry Is Everywhere". American Chemical Society.
- ↑ Carsten Reinhardt. Chemical Sciences in the 20th Century: Bridging Boundaries. Wiley-VCH, 2001. ISBN 3-527-30271-9. pp. 1–2.
- ↑ Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. Chemistry: The Central Science. Prentice Hall; 8 edition (1999). ISBN 0-13-010310-1. pp. 3–4.
- ↑ "History of Alchemy". Alchemy Lab. Retrieved 12 June 2011.
- ↑ "alchemy", entry in The Oxford English Dictionary, J.A. Simpson and E.S.C. Weiner, vol. 1, 2nd ed., 1989, ISBN 0-19-861213-3.
- ↑ Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. ISBN 0-486-21873-2
- ↑ "chemical bonding". Britannica. Encyclopædia Britannica. Retrieved 1 November 2012.
- ↑ Matter: Atoms from Democritus to Dalton by Anthony Carpi, Ph.D.
- ↑ IUPAC Gold Book Definition
- ↑ "California Occupational Guide Number 22: Chemists". Calmis.ca.gov. 29 October 1999. Archived from the original on 10 June 2011. Retrieved 12 June 2011.
- ↑ "General Chemistry Online – Companion Notes: Matter". Antoine.frostburg.edu. Retrieved 12 June 2011.
- ↑ Armstrong, James (2012). General, Organic, and Biochemistry: An Applied Approach. Brooks/Cole. p. 48. ISBN 978-0-534-49349-3.
- ↑ Burrows et al. 2008, p. 13.
- ↑ 18.0 18.1 Housecroft & Sharpe 2008, p. 2.
- ↑ Burrows et al. 2009, p. 110.
- ↑ Burrows et al. 2008, p. 12.
- ↑ "IUPAC Nomenclature of Organic Chemistry". Acdlabs.com. Retrieved 12 June 2011.
- ↑ Connelly, Neil G.; Damhus, Ture; Hartshom, Richard M.; Hutton, Alan T. (2005). Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. Cambridge, United Kingdom: Royal Society of Chemistry Publishing / IUPAC. ISBN 0854044388. Retrieved 13 June 2022.
- ↑ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4th ed.). Upper Saddle River, New Jersey: Pearson Prentice Hall. p. 37.
- ↑ M.M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
- ↑ Atkins & de Paula 2009, p. 9.
- ↑ Visionlearning. "Chemical Bonding by Anthony Carpi, Ph". visionlearning. Retrieved 12 June 2011.
- ↑ Reilly, Michael. (2007). Mechanical force induces chemical reaction, NewScientist.com news service, Reilly
- ↑ Changing States of Matter – Chemforkids.com
- ↑ Chemical Reaction Equation – IUPAC Goldbook
- ↑ Gold Book Chemical Reaction IUPAC Goldbook
- ↑ "The Lewis Acid–Base Concept". Apsidium. 19 May 2003. Archived from the original on 27 May 2008. Retrieved 31 July 2010.
- ↑ "History of Acidity". Bbc.co.uk. 27 May 2004. Retrieved 12 June 2011.
- ↑ Selected Classic Papers from the History of Chemistry
- ↑ Boyle, Robert (1661). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 978-0-486-42825-3.
- ↑ Glaser, Christopher (1663). Traite de la chymie. Paris. as found in: Kim, Mi Gyung (2003). Affinity, That Elusive Dream – A Genealogy of the Chemical Revolution. The MIT Press. ISBN 978-0-262-11273-4.
- ↑ Stahl, George, E. (1730). Philosophical Principles of Universal Chemistry. London.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Dumas, J.B. (1837). 'Affinite' (lecture notes), vii, p 4. "Statique chimique", Paris: Académie des Sciences
- ↑ Pauling, Linus (1947). General Chemistry. Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ↑ Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill. ISBN 978-0-07-115221-1.
- ↑ First chemists, February 13, 1999, New Scientist
- ↑ Barnes, Ruth (2004). Textiles in Indian Ocean Societies. Routledge. p. 1. ISBN 9780415297660.
- ↑ Lucretius. "de Rerum Natura (On the Nature of Things)". The Internet Classics Archive. Massachusetts Institute of Technology. Retrieved 9 January 2007.
- ↑ Simpson, David (29 June 2005). "Lucretius (c. 99–55 BCE)". The Internet History of Philosophy. Retrieved 10 November 2020.
- ↑ Strodach, George K. (2012). The Art of Happiness. New York: Penguin Classics. pp. 7–8. ISBN 978-0-14-310721-7.
- ↑ Fr. 12; see pp.291–2 of Kirk, G. S.; J. E. Raven; Malcolm Schofield (1983). The Presocratic Philosophers (2 ed.). Cambridge: Cambridge University Press. ISBN 978-0-521-27455-5.
- ↑ Long, A. A.; D. N. Sedley (1987). "Epicureanism: The principals of conservation". The Hellenistic Philosophers. Vol 1: Translations of the principal sources with philosophical commentary. Cambridge: Cambridge University Press. pp. 25–26. ISBN 978-0-521-27556-9.
- ↑ "International Year of Chemistry – The History of Chemistry". G.I.T. Laboratory Journal Europe. 25 February 2011. Archived from the original on 15 June 2013. Retrieved 12 March 2013.
- ↑ Bryan H. Bunch & Alexander Hellemans (2004). The History of Science and Technology. Houghton Mifflin Harcourt. p. 88. ISBN 978-0-618-22123-3.
- ↑ Morris Kline (1985) Mathematics for the nonmathematician. Courier Dover Publications. p. 284. ISBN 0-486-24823-2
- ↑ Marcelin Berthelot, Collection des anciens alchimistes grecs (3 vol., Paris, 1887–1888, p. 161); F. Sherwood Taylor, "The Origins of Greek Alchemy," Ambix 1 (1937), 40.
- ↑ Stapleton, Henry E. and Azo, R. F. and Hidayat Husain, M. 1927. "Chemistry in Iraq and Persia in the Tenth Century A.D" in: Memoirs of the Asiatic Society of Bengal, vol. VIII, no. 6, pp. 317-418, pp. 338–340; Kraus, Paul 1942-1943. Jâbir ibn Hayyân: Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque. Cairo: Institut français d'archéologie orientale, vol. II, pp. 41–42.
- ↑ Darmstaedter, Ernst. "Liber Misericordiae Geber: Eine lateinische Übersetzung des gröβeren Kitâb l-raḥma", Archiv für Geschichte der Medizin, 17/4, 1925, pp. 181–197; Berthelot, Marcellin. "Archéologie et Histoire des sciences", Mémoires de l’Académie des sciences de l’Institut de France, 49, 1906, pp. 308–363; see also Forster, Regula. "Jābir b. Ḥayyān", Encyclopaedia of Islam, Three.
- ↑ Newman, William R. "New Light on the Identity of Geber", Sudhoffs Archiv, 1985, 69, pp. 76–90; Newman, William R. The Summa perfectionis of Pseudo-Geber: A critical edition, translation and study, Leiden: Brill, 1991, pp. 57–103. It has been argued by Ahmad Y. Al-Hassan that the pseudo-Geber works were actually translated into Latin from the Arabic (see Al-Hassan, Ahmad Y. "The Arabic Origin of the Summa and Geber Latin Works: A Refutation of Berthelot, Ruska, and Newman Based on Arabic Sources", in: Ahmad Y. Al-Hassan. Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry. Hildesheim: Georg Olms Verlag, 2009, pp. 53–104; also available online).
- ↑ Marmura, Michael E.; Nasr, Seyyed Hossein (1965). "An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr". Speculum. 40 (4): 744–746. doi:10.2307/2851429. JSTOR 2851429.
- ↑ Robert Briffault (1938). The Making of Humanity, pp. 196–197.
- ↑ "Robert Boyle, Founder of Modern Chemistry" Harry Sootin (2011)
- ↑ "History – Robert Boyle (1627–1691)". BBC. Retrieved 12 June 2011.
- ↑ Eagle, Cassandra T.; Jennifer Sloan (1998). "Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry". The Chemical Educator. 3 (5): 1–18. doi:10.1007/s00897980249a. S2CID 97557390.
- ↑ Mi Gyung Kim (2003). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. p. 440. ISBN 978-0-262-11273-4.
- ↑ Davy, Humphry (1808). "On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases". Philosophical Transactions of the Royal Society. 98: 1–45. doi:10.1098/rstl.1808.0001.
- ↑ Chemistry 412 course notes. "A Brief History of the Development of Periodic Table". Western Oregon University. Retrieved 20 July 2015.
- ↑ Note: ...it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table and "Dmitri Mendeleev". Royal Society of Chemistry. Retrieved 18 July 2015.
- ↑ Winter, Mark. "WebElements: the periodic table on the web". The University of Sheffield. Archived from the original on 4 January 2014. Retrieved 27 January 2014.
- ↑ "What makes these family likenesses among the elements? In the 1860s everyone was scratching their heads about that, and several scientists moved towards rather similar answers. The man who solved the problem most triumphantly was a young Russian called Dmitri Ivanovich Mendeleev, who visited the salt mine at Wieliczka in 1859." Bronowski, Jacob (1973). The Ascent of Man. Little, Brown and Company. p. 322. ISBN 978-0-316-10930-7.
- ↑ "Chemistry". Chemistry2011.org. Archived from the original on 8 October 2011. Retrieved 10 March 2012.
- ↑ Ihde, Aaron John (1984). The Development of Modern Chemistry. Courier Dover Publications. p. 164. ISBN 978-0-486-64235-2.
- ↑ W.G. Laidlaw; D.E. Ryan; Gary Horlick; H.C. Clark; Josef Takats; Martin Cowie; R.U. Lemieux (10 December 1986). "Chemistry Subdisciplines". The Canadian Encyclopedia. Archived from the original on 12 March 2012. Retrieved 12 June 2011.
- ↑ Herbst, Eric (12 May 2005). "Chemistry of Star-Forming Regions". Journal of Physical Chemistry A. 109 (18): 4017–4029. Bibcode:2005JPCA..109.4017H. doi:10.1021/jp050461c. PMID 16833724.
- ↑ Tullo, Alexander H. (28 July 2014). "C&EN's Global Top 50 Chemical Firms For 2014". Chemical & Engineering News. American Chemical Society. Retrieved 22 August 2014.
ग्रन्थसूची
- Atkins, Peter; de Paula, Julio (2009) [1992]. Elements of Physical Chemistry (5th ed.). New York: Oxford University Press. ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, John; Parsons, Andrew; Pilling, Gwen; Price, Gareth (2009). Chemistry3. Italy: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry (3rd ed.). Harlow, Essex: Pearson Education. ISBN 978-0-13-175553-6.
अग्रिम पठन
Popular reading
- Atkins, P.W. Galileo's Finger (Oxford University Press) ISBN 0-19-860941-8
- Atkins, P.W. Atkins' Molecules (Cambridge University Press) ISBN 0-521-82397-8
- Kean, Sam. The Disappearing Spoon – and Other True Tales from the Periodic Table (Black Swan) London, 2010 ISBN 978-0-552-77750-6
- Levi, Primo The Periodic Table (Penguin Books) [1975] translated from the Italian by Raymond Rosenthal (1984) ISBN 978-0-14-139944-7
- Stwertka, A. A Guide to the Elements (Oxford University Press) ISBN 0-19-515027-9
- "Dictionary of the History of Ideas". Archived from the original on 10 March 2008.
- . Encyclopædia Britannica (in English). Vol. 6 (11th ed.). 1911. pp. 33–76.
Introductory undergraduate textbooks
- Atkins, P.W., Overton, T., Rourke, J., Weller, M. and Armstrong, F. Shriver and Atkins Inorganic Chemistry (4th edition) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Chang, Raymond. Chemistry 6th ed. Boston: James M. Smith, 1998. ISBN 0-07-115221-0.
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- Voet and Voet. Biochemistry (Wiley) ISBN 0-471-58651-X
Advanced undergraduate-level or graduate textbooks
- Atkins, P. W. Physical Chemistry (Oxford University Press) ISBN 0-19-879285-9
- Atkins, P. W. et al. Molecular Quantum Mechanics (Oxford University Press)
- McWeeny, R. Coulson's Valence (Oxford Science Publications) ISBN 0-19-855144-4
- Pauling, L. The Nature of the chemical bond (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L., and Wilson, E.B. Introduction to Quantum Mechanics with Applications to Chemistry (Dover Publications) ISBN 0-486-64871-0
- Smart and Moore. Solid State Chemistry: An Introduction (Chapman and Hall) ISBN 0-412-40040-5
- Stephenson, G. Mathematical Methods for Science Students (Longman) ISBN 0-582-44416-0