हाइड्रोजन आयन: Difference between revisions
No edit summary |
No edit summary |
||
| (7 intermediate revisions by 5 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|A hydrogen atom that has gained or lost an electron}} | {{Short description|A hydrogen atom that has gained or lost an electron}} | ||
[[हाइड्रोजन]] आयन तब बनता है जब हाइड्रोजन परमाणु एक [[इलेक्ट्रॉन]] (अतिसूक्ष्म परमाणु) खोता या प्राप्त करता है। एक सकारात्मक रूप से आवेशित हाइड्रोजन आयन (या [[प्रोटॉन]]) आसानी से अन्य कणों के साथ संयोजन कर सकता है और इसलिए इसे केवल तभी पृथक देखा जाता है जब यह गैसीय अवस्था या लगभग कण-मुक्त स्थान में होता है।<ref>{{cite web|url=https://www.britannica.com/science/hydrogen-ion|title=हाइड्रोजन आयन - रसायन|website=britannica.com|access-date=18 March 2018}}</ref> क्षारातु आयन की तुलना में लगभग 2×10<sup>10</sup> गुना अत्यधिक उच्च आवेश घनत्व के कारण, अरक्षित हाइड्रोजन आयन समाधान में स्वतंत्र रूप से उपस्थित नहीं हो सकते क्योंकि यह आसानी से जलयोजित करता है, अर्थात, जल्दी से बंध जाता है।<ref>due to its extremely high charge density of approximately 2×10<sup>10</sup> times that of a [[sodium]] ion</ref> हाइड्रोजन और इसके समस्थानिकों के सभी [[आयन]]ों के लिए एक सामान्य शब्द के रूप में [[शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ|अंतराष्ट्रीय संस्था शुद्ध और अनुप्रयुक्त रसायन]] द्वारा हाइड्रोजन आयन को संस्तुत किया जाता है।<ref>''Compendium of Chemical Terminology'', 2nd edition McNaught, A.D. and Wilkinson, A. Blackwell Science, 1997 {{ISBN|0-86542-684-8}}, also [http://www.iupac.org/publications/compendium/index.html online] {{webarchive|url=https://web.archive.org/web/20051212164525/http://www.iupac.org/publications/compendium/index.html |date=2005-12-12 }}</ref> आयन के विद्युत आवेश के आधार पर, दो अलग-अलग वर्गों को प्रतिष्ठित किया जा सकता है: सकारात्मक रूप से आवेशित आयन और ऋणात्मक रूप से आवेशित आयन। | |||
== धनायन (सकारात्मक आवेशित) == | == धनायन (सकारात्मक आवेशित) == | ||
{{Main article| | {{Main article|हाइड्रॉन (रसायन विज्ञान)}} | ||
[[Image:Zundel-cation.JPG|thumb|ज़ुंडेल कटियन]] | [[Image:Zundel-cation.JPG|thumb|ज़ुंडेल कटियन]]हाइड्रोजन परमाणु +1 आवेश वाले एक नाभिक और एक इलेक्ट्रॉन से बना होता है। इसलिए, केवल सकारात्मक रूप से आवेश किए गए आयन का आवेश +1 है। H<sup>+</sup> उल्लेखनीय है। | ||
प्रश्न में | प्रश्न में समस्थानिक के आधार पर, हाइड्रोजन धनायन के अलग-अलग नाम हैं: | ||
* [[हाइड्रोन (रसायन विज्ञान)]]: | * [[हाइड्रोन (रसायन विज्ञान)]]: किसी भी हाइड्रोजन समस्थानिक (H+) के धनात्मक आयन का सामान्य नाम है। | ||
* प्रोटॉन: <sup>1</sup> | * प्रोटॉन: <sup>1</sup>H<sup>+</sup> (अर्थात [[हाइड्रोजन परमाणु]] का धनायन) | ||
* ड्युटेरॉन: <sup>2</sup> | * ड्युटेरॉन: <sup>2</sup>H<sup>+</sup>, D<sup>+</sup> | ||
* [[ट्राइटन (भौतिकी)]]: <sup>3</sup> | * [[ट्राइटन (भौतिकी)]]: <sup>3</sup>H<sup>+</sup>, T<sup>+</sup> | ||
इसके | इसके अतिरिक्त, पानी के साथ-साथ उनके हाइड्रेट्स के साथ इन धनायनों की प्रतिक्रिया से उत्पन्न आयनों को हाइड्रोजन आयन कहा जाता है: | ||
* [[हाइड्रोनियम]] आयन: | * [[हाइड्रोनियम]] आयन: H<sub>3</sub>O<sup>+</sup> | ||
* [[ ज़ुंडेल कटियन ]]: | * [[ ज़ुंडेल कटियन |ज़ुंडेल कटियन]] : H<sub>5</sub>O<sub>2</sub><sup>+</sup> ([[जॉर्ज ज़ुंडेल]] के नाम पर) | ||
* [[खुद का धनायन]]: | * [[खुद का धनायन|अतिलक्षणिक धनायन]]: H<sub>9</sub>O<sub>4</sub><sup>+</sup> (या H<sub>3</sub>O<sup>+</sup> •3H<sub>2</sub>O)) ([[मैनफ्रेड ईजेन]] के नाम पर) | ||
[[ग्रोथस तंत्र]] के अनुसार, ज़ुंडेल | [[ग्रोथस तंत्र|ग्रोथस प्रक्रिया]] के अनुसार, ज़ुंडेल धनायन और ईजेन धनायन प्रोटॉन प्रसार में महत्वपूर्ण भूमिका निभाते हैं। | ||
अम्ल के संबंध में, हाइड्रोजन आयन सामान्यतः हाइड्रोन को संदर्भित करते हैं। | |||
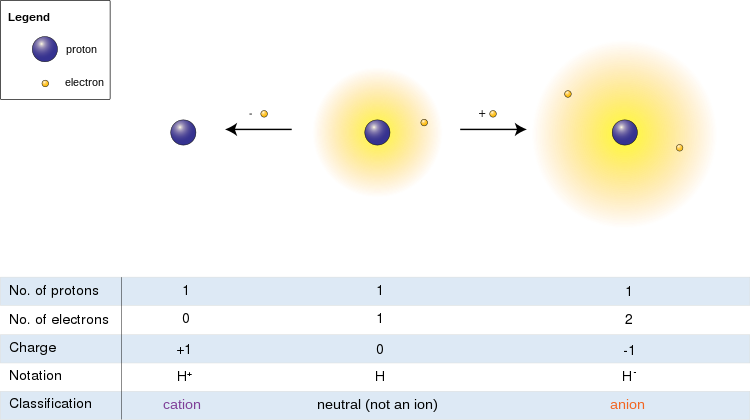
[[Image:Ions.svg|thumb|left|upright=2.5]]बाईं ओर की छवि में हाइड्रोजन परमाणु (केंद्र) में एक प्रोटॉन और एक इलेक्ट्रॉन होता है। इलेक्ट्रॉन को हटाने से | [[Image:Ions.svg|thumb|left|upright=2.5]]बाईं ओर की छवि में हाइड्रोजन परमाणु (केंद्र) में एक प्रोटॉन और एक इलेक्ट्रॉन होता है। इलेक्ट्रॉन को हटाने से धनायन (बाएं) मिलता है, जबकि एक इलेक्ट्रॉन के जुड़ने से ऋणायन (दाएं) मिलता है। हाइड्रोजन आयन, अपने शिथिल दो-इलेक्ट्रॉन अभ्र के साथ, तटस्थ परमाणु की तुलना में एक बड़ा त्रिज्या है, जो बदले में कटियन के अरक्षित प्रोटॉन से बहुत बड़ा है। हाइड्रोजन एकमात्र ऐसा धनायन बनाता है जिसमें कोई इलेक्ट्रॉन नहीं होता है, लेकिन यहां तक कि (हाइड्रोजन के विपरीत) अभी भी एक या एक से अधिक इलेक्ट्रॉनों को बनाए रखने वाले धनायन तटस्थ परमाणुओं या अणुओं से छोटे होते हैं जिनसे वे व्युत्पन्न होते हैं। | ||
{{clear}} | {{clear}} | ||
== ऋणायन (नकारात्मक रूप से आवेशित) == | == ऋणायन (नकारात्मक रूप से आवेशित) == | ||
अतिरिक्त इलेक्ट्रॉन प्राप्त होने पर हाइड्रोजन आयन बनते हैं: | अतिरिक्त इलेक्ट्रॉन प्राप्त होने पर हाइड्रोजन आयन बनते हैं: | ||
* [[हाइड्राइड]]: सामान्य नाम किसी भी हाइड्रोजन समस्थानिक (H<sup>−</sup>) | * [[हाइड्राइड]]: सामान्य नाम किसी भी हाइड्रोजन समस्थानिक (H<sup>−</sup>) | ||
* प्रोटाइड: <sup>1</sup> | * प्रोटाइड: <sup>1</sup>H<sup>-</sup> | ||
* ड्युटेराइड : <sup>2</sup> | * ड्युटेराइड : <sup>2</sup>H<sup>-</sup>, डी <sup>-</sup> | ||
* ट्राइटाइड : <sup>3</sup> | * ट्राइटाइड : <sup>3</sup>H<sup>-</sup>, टी <sup>-</sup> | ||
== उपयोग | == उपयोग == | ||
हाइड्रोजन आयन [[प्रकाश संश्लेषण]] में [[एटीपी सिंथेज़]] चलाते हैं। ऐसा तब होता है जब हाइड्रोजन आयन झिल्ली के आर-पार धकेले जाते हैं जिससे [[थायलाकोइड झिल्ली]] के अंदर एक उच्च सांद्रता और साइटोप्लाज्म में कम सांद्रता बनती है। हालांकि, ऑस्मोसिस के कारण, | हाइड्रोजन आयन [[प्रकाश संश्लेषण]] में [[एटीपी सिंथेज़]] चलाते हैं। ऐसा तब होता है जब हाइड्रोजन आयन झिल्ली के आर-पार धकेले जाते हैं जिससे [[थायलाकोइड झिल्ली|चिपिटाशय झिल्ली]] के अंदर एक उच्च सांद्रता और साइटोप्लाज्म में कम सांद्रता बनती है। हालांकि, ऑस्मोसिस के कारण, H<sup>+</sup> एटीपी सिंथेज़ के माध्यम से खुद को झिल्ली से बाहर कर देगा। बचने के लिए अपनी [[गतिज ऊर्जा]] का उपयोग करते हुए, प्रोटॉन एटीपी सिंथेज़ को प्रचक्रण करेंगे जो बदले में [[ एडेनोसाइन ट्रायफ़ोस्फेट |एडेनोसाइन ट्रायफ़ोस्फेट]] का निर्माण करेगा। यह कोशिकीय श्वसन में भी होता है, हालांकि केंद्रित झिल्ली इसके स्थान पर [[माइटोकॉन्ड्रिया|सूत्रकणिका]] की आंतरिक झिल्ली होगी। | ||
हाइड्रोजन आयनों की सांद्रता, जिसे | हाइड्रोजन आयनों की सांद्रता, जिसे pH के रूप में मापा जाता है, एक यौगिक की [[अम्लीय]] या [[बुनियादी (रसायन विज्ञान)]] प्रकृति के लिए भी जिम्मेदार है। पानी के अणु विभाजित होकर H<sup>+</sup> और हाइड्रोक्साइड आयन बनाते हैं। इस प्रक्रिया को जल का स्व-आयनीकरण कहते हैं। | ||
== महासागर अम्लीकरण == | == महासागर अम्लीकरण == | ||
हाइड्रोजन आयनों और | हाइड्रोजन आयनों और pH की सांद्रता व्युत्क्रमानुपाती होती है; एक जलीय घोल में, हाइड्रोजन आयनों की बढ़ी हुई सांद्रता एक कम pH और बाद में एक अम्लीय उत्पाद उत्पन्न करती है। परिभाषा के अनुसार, अम्ल एक आयन या अणु है जो प्रोटॉन दान कर सकता है, और जब एक समाधान के लिए प्रस्तुत किया जाता है तो यह पानी के अणुओं (H<sub>2</sub>O) के साथ हाइड्रोनियम आयन (H<sub>3</sub>O<sup>+</sup>), पानी का एक संयुग्मित अम्ल बनाने के लिए प्रतिक्रिया करेगा।<ref>OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.</ref> सरलीकृत तर्क के लिए, हाइड्रोजन आयन (H<sup>+</sup>) प्रायः हाइड्रोनियम आयन को संक्षिप्त करने के लिए प्रयोग किया जाता है। | ||
कार्बन डाइऑक्साइड ( | कार्बन डाइऑक्साइड (CO<sub>2</sub>) के महत्वपूर्ण अवशोषण से हाइड्रोजन आयनों और कार्बोनेट संतृप्ति की उच्च सांद्रता का प्रत्यक्ष परिणाम महासागर अम्लीकरण है। दुनिया के महासागरों द्वारा<ref>W.S. Broecker, T. Takahashi (1997) Neutralization of fossil fuel CO<sub>2</sub> by marine calcium carbonate</ref> समुद्र के कार्बोनेट रसायन की पूर्व-औद्योगिक स्थिति उल्लेखनीय रूप से स्थिर रही है, जिसमें इसके pH का संतुलन भी सम्मिलित है।<ref>P.N. Pearson, M.R. Palmer (2000) Atmospheric carbon dioxide concentrations over the past 60 million years Nature, 406, pp. 695-699</ref> औद्योगिक क्रांति के बाद, जलते हुए जीवाश्म ईंधन के मानवजनित उत्सर्जन, सीमेंट उत्पादन और भूमि उपयोग में परिवर्तन ने महासागरों को वायुमंडल से कार्बन डाइऑक्साइड के अवशोषण में 30% की वृद्धि की है।<ref>C.L. Sabine, et al. (2004). The oceanic sink for anthropogenic CO<sub>2</sub> | ||
Science, 305 (5682), pp. 367-371</ref> समुद्र में [[नीला कार्बन]] वातावरण की तुलना में 59 गुना अधिक है;<ref>Lal R. (2008). Carbon sequestration. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 363(1492), 815–830. https://doi.org/10.1098/rstb.2007.2185</ref> महासागर ग्रह पर सबसे बड़े [[कार्बन सिंक]] के रूप में कार्य करता है, जो जलवायु नियमन में महत्वपूर्ण भूमिका निभाता है।<ref>Ben I. Mcneil & Richard J. Matear (2007). Climate change feedbacks on future oceanic acidification, Tellus B: Chemical and Physical Meteorology, 59:2, 191-198</ref> कार्बन | Science, 305 (5682), pp. 367-371</ref> समुद्र में [[नीला कार्बन]] वातावरण की तुलना में 59 गुना अधिक है;<ref>Lal R. (2008). Carbon sequestration. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 363(1492), 815–830. https://doi.org/10.1098/rstb.2007.2185</ref> महासागर ग्रह पर सबसे बड़े [[कार्बन सिंक|कार्बन विलयगर्त]] के रूप में कार्य करता है, जो जलवायु नियमन में महत्वपूर्ण भूमिका निभाता है।<ref>Ben I. Mcneil & Richard J. Matear (2007). Climate change feedbacks on future oceanic acidification, Tellus B: Chemical and Physical Meteorology, 59:2, 191-198</ref> कार्बन अपशिष्टों के अतिरिक्त, वातावरण से गहरे समुद्र में कार्बन पृथक्करण की प्राकृतिक प्रक्रिया को दो प्रणालियों, जैविक पंप और घुलनशीलता पंप द्वारा सुगम बनाया जाता है। घुलनशीलता पंप एक भौतिक-रासायनिक प्रक्रिया है जो सीओ को हवा-समुद्र अंतरापृष्ठ पर स्थानांतरित करती है।<ref>Hessen, D., Ågren, G., Anderson, T., Elser, J., & De Ruiter, P. (2004). Carbon Sequestration in Ecosystems: The Role of Stoichiometry. Ecology, 85(5), 1179-1192. Retrieved November 22, 2020, from http://www.jstor.org/stable/3450161</ref> हेनरी के नियम के आधार पर, भंग CO<sub>2</sub> की मात्रा एक जलीय घोल में CO<sub>2</sub> वातावरण में आंशिक दबाव के सीधे आनुपातिक है।<ref>Avishay DM, Tenny KM. Henry's Law. [Updated 2020 Sep 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK544301/</ref> संतुलन बनाए रखने के लिए, CO<sub>2</sub> के उच्च वायुमंडलीय आंशिक दबाव की स्थिति आणविक प्रसार द्वारा इस गैस के बढ़ते समुद्री आदान-प्रदान की ओर जाता है। | ||
सतह के पानी में, भंग वायुमंडलीय कार्बन डाइऑक्साइड (CO<sub>2(aq)</sub>) कार्बोनिक | सतह के पानी में, भंग वायुमंडलीय कार्बन डाइऑक्साइड (CO<sub>2(aq)</sub>) कार्बोनिक अम्ल (H<sub>2</sub>CO<sub>3</sub>) बनाने के लिए पानी के अणुओं के साथ प्रतिक्रिया करता है, एक कमजोर द्विप्रोटोनी अम्ल में प्रत्येक अणु में दो आयनीकरण योग्य हाइड्रोजन परमाणु होते हैं।<ref>OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.</ref> एक जलीय घोल में, कार्बोनिक अम्ल का आंशिक पृथक्करण एक हाइड्रोजन प्रोटॉन (H<sup>+</sup>) और बाइकार्बोनेट आयन (HCO<sub>3</sub><sup>−</sup>), और बाद में, बाइकार्बोनेट आयन एक अतिरिक्त हाइड्रोजन प्रोटॉन और एक कार्बोनेट आयन (CO<sub>3</sub><sup>2-</sup> द्विप्रोटोनी अम्ल) में अलग हो जाता है)।<ref>OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.</ref> इन अकार्बनिक कार्बन प्रजातियों के घुलने और अलग होने से हाइड्रोजन आयनों की सांद्रता में वृद्धि होती है और परिवेश की सतह के 11pH को विपरीत रूप से कम करता है। कार्बोनेट रोधन प्रणाली रासायनिक संतुलन में भंग अकार्बनिक कार्बन प्रजातियों को बनाए रखते हुए समुद्री जल की अम्लता को नियंत्रित करता है। | ||
रासायनिक समीकरण में अभिकारक और उत्पाद होते हैं जो किसी भी दिशा में प्रतिक्रिया कर सकते हैं। एक प्रणाली में अधिक अभिकारकों को जोड़ने से अधिक उत्पाद उत्पादन होता है (रासायनिक प्रतिक्रिया दाईं ओर शिफ्ट होती है) और यदि अधिक उत्पाद जोड़े जाते हैं, तो अतिरिक्त अभिकारक बनेंगे, रासायनिक प्रतिक्रिया को बाईं ओर स्थानांतरित कर देंगे। इसलिए, इस | रासायनिक समीकरण में अभिकारक और उत्पाद होते हैं जो किसी भी दिशा में प्रतिक्रिया कर सकते हैं। एक प्रणाली में अधिक अभिकारकों को जोड़ने से अधिक उत्पाद उत्पादन होता है (रासायनिक प्रतिक्रिया दाईं ओर शिफ्ट होती है) और यदि अधिक उत्पाद जोड़े जाते हैं, तो अतिरिक्त अभिकारक बनेंगे, रासायनिक प्रतिक्रिया को बाईं ओर स्थानांतरित कर देंगे। इसलिए, इस प्रतिरूप में, प्रारंभिक अभिकारक, कार्बन डाइऑक्साइड की एक उच्च सांद्रता, अंत-उत्पाद (HH<sup>+</sup> और CO<sub>3</sub><sup>2-</sup>) की बढ़ी हुई मात्रा का उत्पादन), इस प्रकार PH को कम करता है और अधिक अम्लीय घोल बनाता है। समुद्र की प्राकृतिक रोधन प्रणाली कार्बोनेट आयनों के साथ अभिक्रिया करके क्षारीय वर्ण बनाने के लिए मुक्त अम्ल प्रोटॉनों द्वारा उत्पन्न अधिक बाइकार्बोनेट आयनों का उत्पादन करके pH में परिवर्तन का विरोध करती है।<ref>Middelburg, J. J., Soetaert, K., & Hagens, M. (2020). Ocean Alkalinity, Buffering and Biogeochemical Processes. Reviews of geophysics (Washington, D.C. : 1985), 58(3), e2019RG000681. https://doi.org/10.1029/2019RG000681</ref> हालांकि, बढ़ते वायुमंडलीय CO<sub>2</sub> सांद्रता रोधन क्षमता सीमा से अधिक हो सकती है, जिसके परिणामस्वरूप समुद्र के अम्लीकरण की उच्च दर होती है। समुद्र के कार्बोनेट रसायन में बदलाव में कई तत्वों और यौगिकों के लिए समुद्री जैव-रासायनिक चक्रों में क्रमभंग करने की क्षमता है, जिससे समुद्री पारिस्थितिक तंत्र पर गहरा प्रभाव पड़ता है। CO<sub>2</sub> के वायुमंडलीय आंशिक दबाव में निरंतर वृद्धि संभावित रूप से महासागर को गर्त (समुद्र की गहराई तक कार्बन का लंबवत परिवहन) के रूप में कार्य करने से एक स्रोत (समुद्र से CO<sub>2</sub> विगैसन) में परिवर्तित कर सकती है, जिससे वैश्विक तापमान में और वृद्धि हो सकती है।<ref>Matsumoto, K. (2007). Biology-mediated temperature control on atmosphericpCO2and ocean biogeochemistry. Geophysical Research Letters, 34(20). doi:10.1029/2007gl031301</ref> | ||
| Line 67: | Line 64: | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | [[Category:Articles with hatnote templates targeting a nonexistent page]] | ||
[[Category:Created On 22/03/2023]] | [[Category:Created On 22/03/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | [[Category:Machine Translated Page]] | ||
[[Category:Pages with script errors|Short description/doc]] | [[Category:Pages with script errors|Short description/doc]] | ||
| Line 74: | Line 72: | ||
[[Category:Templates Vigyan Ready]] | [[Category:Templates Vigyan Ready]] | ||
[[Category:Templates that add a tracking category]] | [[Category:Templates that add a tracking category]] | ||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Webarchive template wayback links]] | |||
Latest revision as of 11:31, 20 April 2023
हाइड्रोजन आयन तब बनता है जब हाइड्रोजन परमाणु एक इलेक्ट्रॉन (अतिसूक्ष्म परमाणु) खोता या प्राप्त करता है। एक सकारात्मक रूप से आवेशित हाइड्रोजन आयन (या प्रोटॉन) आसानी से अन्य कणों के साथ संयोजन कर सकता है और इसलिए इसे केवल तभी पृथक देखा जाता है जब यह गैसीय अवस्था या लगभग कण-मुक्त स्थान में होता है।[1] क्षारातु आयन की तुलना में लगभग 2×1010 गुना अत्यधिक उच्च आवेश घनत्व के कारण, अरक्षित हाइड्रोजन आयन समाधान में स्वतंत्र रूप से उपस्थित नहीं हो सकते क्योंकि यह आसानी से जलयोजित करता है, अर्थात, जल्दी से बंध जाता है।[2] हाइड्रोजन और इसके समस्थानिकों के सभी आयनों के लिए एक सामान्य शब्द के रूप में अंतराष्ट्रीय संस्था शुद्ध और अनुप्रयुक्त रसायन द्वारा हाइड्रोजन आयन को संस्तुत किया जाता है।[3] आयन के विद्युत आवेश के आधार पर, दो अलग-अलग वर्गों को प्रतिष्ठित किया जा सकता है: सकारात्मक रूप से आवेशित आयन और ऋणात्मक रूप से आवेशित आयन।
धनायन (सकारात्मक आवेशित)
हाइड्रोजन परमाणु +1 आवेश वाले एक नाभिक और एक इलेक्ट्रॉन से बना होता है। इसलिए, केवल सकारात्मक रूप से आवेश किए गए आयन का आवेश +1 है। H+ उल्लेखनीय है।
प्रश्न में समस्थानिक के आधार पर, हाइड्रोजन धनायन के अलग-अलग नाम हैं:
- हाइड्रोन (रसायन विज्ञान): किसी भी हाइड्रोजन समस्थानिक (H+) के धनात्मक आयन का सामान्य नाम है।
- प्रोटॉन: 1H+ (अर्थात हाइड्रोजन परमाणु का धनायन)
- ड्युटेरॉन: 2H+, D+
- ट्राइटन (भौतिकी): 3H+, T+
इसके अतिरिक्त, पानी के साथ-साथ उनके हाइड्रेट्स के साथ इन धनायनों की प्रतिक्रिया से उत्पन्न आयनों को हाइड्रोजन आयन कहा जाता है:
- हाइड्रोनियम आयन: H3O+
- ज़ुंडेल कटियन : H5O2+ (जॉर्ज ज़ुंडेल के नाम पर)
- अतिलक्षणिक धनायन: H9O4+ (या H3O+ •3H2O)) (मैनफ्रेड ईजेन के नाम पर)
ग्रोथस प्रक्रिया के अनुसार, ज़ुंडेल धनायन और ईजेन धनायन प्रोटॉन प्रसार में महत्वपूर्ण भूमिका निभाते हैं।
अम्ल के संबंध में, हाइड्रोजन आयन सामान्यतः हाइड्रोन को संदर्भित करते हैं।
बाईं ओर की छवि में हाइड्रोजन परमाणु (केंद्र) में एक प्रोटॉन और एक इलेक्ट्रॉन होता है। इलेक्ट्रॉन को हटाने से धनायन (बाएं) मिलता है, जबकि एक इलेक्ट्रॉन के जुड़ने से ऋणायन (दाएं) मिलता है। हाइड्रोजन आयन, अपने शिथिल दो-इलेक्ट्रॉन अभ्र के साथ, तटस्थ परमाणु की तुलना में एक बड़ा त्रिज्या है, जो बदले में कटियन के अरक्षित प्रोटॉन से बहुत बड़ा है। हाइड्रोजन एकमात्र ऐसा धनायन बनाता है जिसमें कोई इलेक्ट्रॉन नहीं होता है, लेकिन यहां तक कि (हाइड्रोजन के विपरीत) अभी भी एक या एक से अधिक इलेक्ट्रॉनों को बनाए रखने वाले धनायन तटस्थ परमाणुओं या अणुओं से छोटे होते हैं जिनसे वे व्युत्पन्न होते हैं।
ऋणायन (नकारात्मक रूप से आवेशित)
अतिरिक्त इलेक्ट्रॉन प्राप्त होने पर हाइड्रोजन आयन बनते हैं:
- हाइड्राइड: सामान्य नाम किसी भी हाइड्रोजन समस्थानिक (H−)
- प्रोटाइड: 1H-
- ड्युटेराइड : 2H-, डी -
- ट्राइटाइड : 3H-, टी -
उपयोग
हाइड्रोजन आयन प्रकाश संश्लेषण में एटीपी सिंथेज़ चलाते हैं। ऐसा तब होता है जब हाइड्रोजन आयन झिल्ली के आर-पार धकेले जाते हैं जिससे चिपिटाशय झिल्ली के अंदर एक उच्च सांद्रता और साइटोप्लाज्म में कम सांद्रता बनती है। हालांकि, ऑस्मोसिस के कारण, H+ एटीपी सिंथेज़ के माध्यम से खुद को झिल्ली से बाहर कर देगा। बचने के लिए अपनी गतिज ऊर्जा का उपयोग करते हुए, प्रोटॉन एटीपी सिंथेज़ को प्रचक्रण करेंगे जो बदले में एडेनोसाइन ट्रायफ़ोस्फेट का निर्माण करेगा। यह कोशिकीय श्वसन में भी होता है, हालांकि केंद्रित झिल्ली इसके स्थान पर सूत्रकणिका की आंतरिक झिल्ली होगी।
हाइड्रोजन आयनों की सांद्रता, जिसे pH के रूप में मापा जाता है, एक यौगिक की अम्लीय या बुनियादी (रसायन विज्ञान) प्रकृति के लिए भी जिम्मेदार है। पानी के अणु विभाजित होकर H+ और हाइड्रोक्साइड आयन बनाते हैं। इस प्रक्रिया को जल का स्व-आयनीकरण कहते हैं।
महासागर अम्लीकरण
हाइड्रोजन आयनों और pH की सांद्रता व्युत्क्रमानुपाती होती है; एक जलीय घोल में, हाइड्रोजन आयनों की बढ़ी हुई सांद्रता एक कम pH और बाद में एक अम्लीय उत्पाद उत्पन्न करती है। परिभाषा के अनुसार, अम्ल एक आयन या अणु है जो प्रोटॉन दान कर सकता है, और जब एक समाधान के लिए प्रस्तुत किया जाता है तो यह पानी के अणुओं (H2O) के साथ हाइड्रोनियम आयन (H3O+), पानी का एक संयुग्मित अम्ल बनाने के लिए प्रतिक्रिया करेगा।[4] सरलीकृत तर्क के लिए, हाइड्रोजन आयन (H+) प्रायः हाइड्रोनियम आयन को संक्षिप्त करने के लिए प्रयोग किया जाता है।
कार्बन डाइऑक्साइड (CO2) के महत्वपूर्ण अवशोषण से हाइड्रोजन आयनों और कार्बोनेट संतृप्ति की उच्च सांद्रता का प्रत्यक्ष परिणाम महासागर अम्लीकरण है। दुनिया के महासागरों द्वारा[5] समुद्र के कार्बोनेट रसायन की पूर्व-औद्योगिक स्थिति उल्लेखनीय रूप से स्थिर रही है, जिसमें इसके pH का संतुलन भी सम्मिलित है।[6] औद्योगिक क्रांति के बाद, जलते हुए जीवाश्म ईंधन के मानवजनित उत्सर्जन, सीमेंट उत्पादन और भूमि उपयोग में परिवर्तन ने महासागरों को वायुमंडल से कार्बन डाइऑक्साइड के अवशोषण में 30% की वृद्धि की है।[7] समुद्र में नीला कार्बन वातावरण की तुलना में 59 गुना अधिक है;[8] महासागर ग्रह पर सबसे बड़े कार्बन विलयगर्त के रूप में कार्य करता है, जो जलवायु नियमन में महत्वपूर्ण भूमिका निभाता है।[9] कार्बन अपशिष्टों के अतिरिक्त, वातावरण से गहरे समुद्र में कार्बन पृथक्करण की प्राकृतिक प्रक्रिया को दो प्रणालियों, जैविक पंप और घुलनशीलता पंप द्वारा सुगम बनाया जाता है। घुलनशीलता पंप एक भौतिक-रासायनिक प्रक्रिया है जो सीओ को हवा-समुद्र अंतरापृष्ठ पर स्थानांतरित करती है।[10] हेनरी के नियम के आधार पर, भंग CO2 की मात्रा एक जलीय घोल में CO2 वातावरण में आंशिक दबाव के सीधे आनुपातिक है।[11] संतुलन बनाए रखने के लिए, CO2 के उच्च वायुमंडलीय आंशिक दबाव की स्थिति आणविक प्रसार द्वारा इस गैस के बढ़ते समुद्री आदान-प्रदान की ओर जाता है।
सतह के पानी में, भंग वायुमंडलीय कार्बन डाइऑक्साइड (CO2(aq)) कार्बोनिक अम्ल (H2CO3) बनाने के लिए पानी के अणुओं के साथ प्रतिक्रिया करता है, एक कमजोर द्विप्रोटोनी अम्ल में प्रत्येक अणु में दो आयनीकरण योग्य हाइड्रोजन परमाणु होते हैं।[12] एक जलीय घोल में, कार्बोनिक अम्ल का आंशिक पृथक्करण एक हाइड्रोजन प्रोटॉन (H+) और बाइकार्बोनेट आयन (HCO3−), और बाद में, बाइकार्बोनेट आयन एक अतिरिक्त हाइड्रोजन प्रोटॉन और एक कार्बोनेट आयन (CO32- द्विप्रोटोनी अम्ल) में अलग हो जाता है)।[13] इन अकार्बनिक कार्बन प्रजातियों के घुलने और अलग होने से हाइड्रोजन आयनों की सांद्रता में वृद्धि होती है और परिवेश की सतह के 11pH को विपरीत रूप से कम करता है। कार्बोनेट रोधन प्रणाली रासायनिक संतुलन में भंग अकार्बनिक कार्बन प्रजातियों को बनाए रखते हुए समुद्री जल की अम्लता को नियंत्रित करता है।
रासायनिक समीकरण में अभिकारक और उत्पाद होते हैं जो किसी भी दिशा में प्रतिक्रिया कर सकते हैं। एक प्रणाली में अधिक अभिकारकों को जोड़ने से अधिक उत्पाद उत्पादन होता है (रासायनिक प्रतिक्रिया दाईं ओर शिफ्ट होती है) और यदि अधिक उत्पाद जोड़े जाते हैं, तो अतिरिक्त अभिकारक बनेंगे, रासायनिक प्रतिक्रिया को बाईं ओर स्थानांतरित कर देंगे। इसलिए, इस प्रतिरूप में, प्रारंभिक अभिकारक, कार्बन डाइऑक्साइड की एक उच्च सांद्रता, अंत-उत्पाद (HH+ और CO32-) की बढ़ी हुई मात्रा का उत्पादन), इस प्रकार PH को कम करता है और अधिक अम्लीय घोल बनाता है। समुद्र की प्राकृतिक रोधन प्रणाली कार्बोनेट आयनों के साथ अभिक्रिया करके क्षारीय वर्ण बनाने के लिए मुक्त अम्ल प्रोटॉनों द्वारा उत्पन्न अधिक बाइकार्बोनेट आयनों का उत्पादन करके pH में परिवर्तन का विरोध करती है।[14] हालांकि, बढ़ते वायुमंडलीय CO2 सांद्रता रोधन क्षमता सीमा से अधिक हो सकती है, जिसके परिणामस्वरूप समुद्र के अम्लीकरण की उच्च दर होती है। समुद्र के कार्बोनेट रसायन में बदलाव में कई तत्वों और यौगिकों के लिए समुद्री जैव-रासायनिक चक्रों में क्रमभंग करने की क्षमता है, जिससे समुद्री पारिस्थितिक तंत्र पर गहरा प्रभाव पड़ता है। CO2 के वायुमंडलीय आंशिक दबाव में निरंतर वृद्धि संभावित रूप से महासागर को गर्त (समुद्र की गहराई तक कार्बन का लंबवत परिवहन) के रूप में कार्य करने से एक स्रोत (समुद्र से CO2 विगैसन) में परिवर्तित कर सकती है, जिससे वैश्विक तापमान में और वृद्धि हो सकती है।[15]
यह भी देखें
संदर्भ
- ↑ "हाइड्रोजन आयन - रसायन". britannica.com. Retrieved 18 March 2018.
- ↑ due to its extremely high charge density of approximately 2×1010 times that of a sodium ion
- ↑ Compendium of Chemical Terminology, 2nd edition McNaught, A.D. and Wilkinson, A. Blackwell Science, 1997 ISBN 0-86542-684-8, also online Archived 2005-12-12 at the Wayback Machine
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ W.S. Broecker, T. Takahashi (1997) Neutralization of fossil fuel CO2 by marine calcium carbonate
- ↑ P.N. Pearson, M.R. Palmer (2000) Atmospheric carbon dioxide concentrations over the past 60 million years Nature, 406, pp. 695-699
- ↑ C.L. Sabine, et al. (2004). The oceanic sink for anthropogenic CO2 Science, 305 (5682), pp. 367-371
- ↑ Lal R. (2008). Carbon sequestration. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 363(1492), 815–830. https://doi.org/10.1098/rstb.2007.2185
- ↑ Ben I. Mcneil & Richard J. Matear (2007). Climate change feedbacks on future oceanic acidification, Tellus B: Chemical and Physical Meteorology, 59:2, 191-198
- ↑ Hessen, D., Ågren, G., Anderson, T., Elser, J., & De Ruiter, P. (2004). Carbon Sequestration in Ecosystems: The Role of Stoichiometry. Ecology, 85(5), 1179-1192. Retrieved November 22, 2020, from http://www.jstor.org/stable/3450161
- ↑ Avishay DM, Tenny KM. Henry's Law. [Updated 2020 Sep 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK544301/
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ Middelburg, J. J., Soetaert, K., & Hagens, M. (2020). Ocean Alkalinity, Buffering and Biogeochemical Processes. Reviews of geophysics (Washington, D.C. : 1985), 58(3), e2019RG000681. https://doi.org/10.1029/2019RG000681
- ↑ Matsumoto, K. (2007). Biology-mediated temperature control on atmosphericpCO2and ocean biogeochemistry. Geophysical Research Letters, 34(20). doi:10.1029/2007gl031301