मीथेन मोनोऑक्सीजिनेज: Difference between revisions
No edit summary |
No edit summary |
||
| Line 21: | Line 21: | ||
</ref> मीथेन मोनोऑक्सीजिनेज [[ऑक्सीडोरडक्टेस]] एंजाइम के वर्ग से संबंधित है ({{EC number|1.14.13.25}}). | </ref> मीथेन मोनोऑक्सीजिनेज [[ऑक्सीडोरडक्टेस]] एंजाइम के वर्ग से संबंधित है ({{EC number|1.14.13.25}}). | ||
MMO के दो रूप हैं: अच्छी तरह से अध्ययन किया | MMO के दो रूप हैं: अच्छी तरह से अध्ययन किया गये घुलनशील रूप (sMMO) और कण रूप (pMMO)।<ref>{{cite journal | vauthors = Ross MO, Rosenzweig AC | title = A tale of two methane monooxygenases | journal = Journal of Biological Inorganic Chemistry | volume = 22 | issue = 2-3 | pages = 307–319 | date = April 2017 | pmid = 27878395 | pmc = 5352483 | doi = 10.1007/s00775-016-1419-y }}</ref> sMMO में सक्रिय स्थान में एक ऑक्सीजन परमाणु (Fe-O-Fe) द्वारा ब्रिज किया गया एक डाय-लौह केंद्र होता है, जबकि pMMO में सक्रिय स्थान तांबे का उपयोग करता है। एक्स-रे क्रिस्टलोग्राफी द्वारा दोनों प्रोटीनों की संरचनाएं निर्धारित की गई हैं,यद्यपि, pMMO में सक्रिय स्थान का स्थान और तंत्र अभी भी खराब समझा जाता है और सक्रिय अनुसंधान का एक क्षेत्र है। | ||
मीथेन मोनोऑक्सीजिनेज (पार्टिकुलेट) और संबंधित अमोनिया मोनोऑक्सीजिनेज पूर्ण मेम्ब्रेन प्रोटीन हैं, जो क्रमशः मीथेनोट्रॉफ़्स और अमोनिया ऑक्सीकारक में होते हैं, जिन्हें संबंधित माना जाता है।<ref name="PUB00016963">{{cite journal | vauthors = Holmes AJ, Costello A, Lidstrom ME, Murrell JC | title = Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related | journal = FEMS Microbiology Letters | volume = 132 | issue = 3 | pages = 203–208 | date = October 1995 | pmid = 7590173 | doi = 10.1111/j.1574-6968.1995.tb07834.x | doi-access = free }}</ref> इन एंजाइमों में अपेक्षाकृत व्यापक क्रियाधार विशिष्टता होती है और अमोनिया, मीथेन, हैलोजेनेटेड हाइड्रोकार्बन और सुगंधित अणुओं सहित कई प्रकार के क्रियाधार के ऑक्सीकरण को उत्प्रेरित कर सकते हैं।<ref name="PUB00016964">{{cite journal | vauthors = Arp DJ, Sayavedra-Soto LA, Hommes NG | title = Molecular biology and biochemistry of ammonia oxidation by Nitrosomonas europaea | journal = Archives of Microbiology | volume = 178 | issue = 4 | pages = 250–255 | date = October 2002 | pmid = 12209257 | doi = 10.1007/s00203-002-0452-0 | s2cid = 27432735 }}</ref> ये एंजाइम 3 उपइकाइयों - | मीथेन मोनोऑक्सीजिनेज (पार्टिकुलेट) और संबंधित अमोनिया मोनोऑक्सीजिनेज पूर्ण मेम्ब्रेन प्रोटीन हैं, जो क्रमशः मीथेनोट्रॉफ़्स और अमोनिया ऑक्सीकारक में होते हैं, जिन्हें संबंधित माना जाता है।<ref name="PUB00016963">{{cite journal | vauthors = Holmes AJ, Costello A, Lidstrom ME, Murrell JC | title = Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related | journal = FEMS Microbiology Letters | volume = 132 | issue = 3 | pages = 203–208 | date = October 1995 | pmid = 7590173 | doi = 10.1111/j.1574-6968.1995.tb07834.x | doi-access = free }}</ref> इन एंजाइमों में अपेक्षाकृत व्यापक क्रियाधार विशिष्टता होती है और अमोनिया, मीथेन, हैलोजेनेटेड हाइड्रोकार्बन और सुगंधित अणुओं सहित कई प्रकार के क्रियाधार के ऑक्सीकरण को उत्प्रेरित कर सकते हैं।<ref name="PUB00016964">{{cite journal | vauthors = Arp DJ, Sayavedra-Soto LA, Hommes NG | title = Molecular biology and biochemistry of ammonia oxidation by Nitrosomonas europaea | journal = Archives of Microbiology | volume = 178 | issue = 4 | pages = 250–255 | date = October 2002 | pmid = 12209257 | doi = 10.1007/s00203-002-0452-0 | s2cid = 27432735 }}</ref> ये एंजाइम 3 उपइकाइयों - ए ({{InterPro|IPR003393}}), बी ({{InterPro|IPR006833}}) और सी({{InterPro|IPR006980}}) और अधिकांश में दो मोनोकॉपर केंद्र होते हैं।<ref name="PUB00016965">{{cite journal | vauthors = Lieberman RL, Rosenzweig AC | title = Crystal structure of a membrane-bound metalloenzyme that catalyses the biological oxidation of methane | journal = Nature | volume = 434 | issue = 7030 | pages = 177–182 | date = March 2005 | pmid = 15674245 | doi = 10.1038/nature03311 | s2cid = 30711411 | bibcode = 2005Natur.434..177L }}</ref><ref>{{cite journal | vauthors = Ross MO, MacMillan F, Wang J, Nisthal A, Lawton TJ, Olafson BD, Mayo SL, Rosenzweig AC, Hoffman BM | display-authors = 6 | title = Particulate methane monooxygenase contains only mononuclear copper centers | journal = Science | volume = 364 | issue = 6440 | pages = 566–570 | date = May 2019 | pmid = 31073062 | pmc = 6664434 | doi = 10.1126/science.aav2572 | doi-access = free }}</ref> | ||
मेथिलोकोकस कैप्सूलेटस (बाथ) से ए उपइकाई मुख्य रूप से झिल्ली के भीतर रहता है और इसमें 7 ट्रांसमेम्ब्रेन हेलिक्स और एक बीटा-हेयरपिन होता है, जो बी उपइकाई के घुलनशील क्षेत्र के साथ संपर्क करता है। माना जाता है कि एक संरक्षित ग्लूटामेट अवशेष धातु केंद्र में योगदान देता है।<ref name="PUB00016965" /> | मेथिलोकोकस कैप्सूलेटस (बाथ) से ए उपइकाई मुख्य रूप से झिल्ली के भीतर रहता है और इसमें 7 ट्रांसमेम्ब्रेन हेलिक्स और एक बीटा-हेयरपिन होता है, जो बी उपइकाई के घुलनशील क्षेत्र के साथ संपर्क करता है। माना जाता है कि एक संरक्षित ग्लूटामेट अवशेष धातु केंद्र में योगदान देता है।<ref name="PUB00016965" /> | ||
मीथेन मोनोऑक्सीजिनेज [[मीथेनोट्रोफिक]] बैक्टीरिया में पाए जाते हैं, बैक्टीरिया का एक वर्ग जो एरोबिक (ऑक्सीजन युक्त) और एनारोबिक (ऑक्सीजन रहित) परिवेश के अंतरपृष्ठ में उपस्थित होता है। इस प्रकार के अधिक व्यापक रूप से अध्ययन किए गए [[जीवाणु]]ओं में से एक मेथिलोकोकस कैप्सूलैटस (बाथ) है। यह जीवाणु बाथ, इंग्लैंड के गर्म झरनों में खोजा गया था।<ref name="BathSpringDiscovery">{{cite journal | vauthors = Dalton H, Whittenbury R |date=August 1976 |title=The acetylene reduction technique as an assay for nitrogenase activity in the methane oxidizing bacterium Methylococcus capsulatus strain bath |journal=Archives of Microbiology |volume=109 |issue=1 |pages=147–151 |doi=10.1007/BF00425127 |s2cid=21926661 }}</ref> विशेष रूप से, सख्ती से अवायवीय मेथनोट्रॉफ़्स भी मीथेन मोनोऑक्सीजिनेस को बंद कर सकते हैं, सामान्यतः जीन में महत्वपूर्ण बेमेल हैं जो सामान्य मेथनोट्रोफ़ की मांग करने वाले [[पीसीआर प्राइमर|प्राइमर]] को मिलान से रोकते हैं।<ref>{{cite journal | vauthors = Luesken FA, Zhu B, van Alen TA, Butler MK, Diaz MR, Song B, Op den Camp HJ, Jetten MS, Ettwig KF | display-authors = 6 | title = pmoA Primers for detection of anaerobic methanotrophs | language = EN | journal = Applied and Environmental Microbiology | volume = 77 | issue = 11 | pages = 3877–3880 | date = June 2011 | pmid = 21460105 | pmc = 3127593 | doi = 10.1128/AEM.02960-10 }}</ref> | मीथेन मोनोऑक्सीजिनेज [[मीथेनोट्रोफिक]] बैक्टीरिया में पाए जाते हैं, बैक्टीरिया का एक वर्ग जो एरोबिक (ऑक्सीजन युक्त) और एनारोबिक (ऑक्सीजन रहित) परिवेश के अंतरपृष्ठ में उपस्थित होता है। इस प्रकार के अधिक व्यापक रूप से अध्ययन किए गए [[जीवाणु]]ओं में से एक मेथिलोकोकस कैप्सूलैटस (बाथ) है। यह जीवाणु बाथ, इंग्लैंड के गर्म झरनों में खोजा गया था।<ref name="BathSpringDiscovery">{{cite journal | vauthors = Dalton H, Whittenbury R |date=August 1976 |title=The acetylene reduction technique as an assay for nitrogenase activity in the methane oxidizing bacterium Methylococcus capsulatus strain bath |journal=Archives of Microbiology |volume=109 |issue=1 |pages=147–151 |doi=10.1007/BF00425127 |s2cid=21926661 }}</ref> विशेष रूप से, सख्ती से अवायवीय मेथनोट्रॉफ़्स भी मीथेन मोनोऑक्सीजिनेस को बंद कर सकते हैं, यद्यपि सामान्यतः जीन में महत्वपूर्ण बेमेल हैं जो सामान्य मेथनोट्रोफ़ की मांग करने वाले [[पीसीआर प्राइमर|प्राइमर]] को मिलान से रोकते हैं।<ref>{{cite journal | vauthors = Luesken FA, Zhu B, van Alen TA, Butler MK, Diaz MR, Song B, Op den Camp HJ, Jetten MS, Ettwig KF | display-authors = 6 | title = pmoA Primers for detection of anaerobic methanotrophs | language = EN | journal = Applied and Environmental Microbiology | volume = 77 | issue = 11 | pages = 3877–3880 | date = June 2011 | pmid = 21460105 | pmc = 3127593 | doi = 10.1128/AEM.02960-10 }}</ref> | ||
== घुलनशील मीथेन मोनोऑक्सीजिनेज प्रणाली == | == घुलनशील मीथेन मोनोऑक्सीजिनेज प्रणाली == | ||
| Line 44: | Line 44: | ||
[[Image:MMOstates.JPG|right|thumb|डायरॉन कोर की विराम, ऑक्सीकृत और अपचयित अवस्था।]]MMO के एक्स-रे क्रिस्टलोग्राफी से पता चलता है कि यह तीन उपइकाइयों α2β2γ2 से बना एक मंदक है। 2.2 A रिज़ॉल्यूशन के साथ, क्रिस्टलोग्राफी से पता चलता है कि MMO 60 x 100 x 120 A के आयामों के साथ एक अपेक्षाकृत सपाट अणु है। इसके अलावा, अणु के केंद्र में एक मुख के साथ डिमर अंतरफलक के साथ एक विस्तृत कैनियन चल रहा है। अधिकांश प्रोटोमर्स में α और β उपइकाइयों से हेलिक्स सम्मिलित होते हैं जिनमें γ उपइकाई से कोई भागीदारी नहीं होती है। इसके अलावा, प्रोटोमर्स के साथ अंतःक्रिया राइबोन्यूक्लियोटाइड रिडक्टेस R2 प्रोटीन डिमर पारस्परिक क्रिया के समान होती है, जो हृदय के समान होती है।<ref name="MMOheart1">{{cite journal | vauthors = Nordlund P, Sjöberg BM, Eklund H | title = Three-dimensional structure of the free radical protein of ribonucleotide reductase | journal = Nature | volume = 345 | issue = 6276 | pages = 593–598 | date = June 1990 | pmid = 2190093 | doi = 10.1038/345593a0 | s2cid = 4233134 | bibcode = 1990Natur.345..593N }}</ref><ref name="MMOheart2">{{cite journal | vauthors = Nordlund P, Eklund H | title = Structure and function of the Escherichia coli ribonucleotide reductase protein R2 | journal = Journal of Molecular Biology | volume = 232 | issue = 1 | pages = 123–164 | date = July 1993 | pmid = 8331655 | doi = 10.1006/jmbi.1993.1374 }}</ref> प्रत्येक लोहे में छह समन्वयित अष्टफलकीय परिवेश होता है। डाइन्यूक्लियर आयरन केंद्र α उपइकाई में स्थित हैं। प्रत्येक लोहे के परमाणुओं को हिस्टडीन δN परमाणु, Fe 1 से His 147 और Fe 2 से His 246 तक समन्वित किया जाता है, Fe 1 एक मोनोदंतुर कार्बोक्सिलेट, Glu 114, एक सेमी ब्रिजिंग कैबोक्सिलेट, Glu 144, और एक पानी के अणु से जुड़ा होता है। .<ref name="NatureMMO" /> | [[Image:MMOstates.JPG|right|thumb|डायरॉन कोर की विराम, ऑक्सीकृत और अपचयित अवस्था।]]MMO के एक्स-रे क्रिस्टलोग्राफी से पता चलता है कि यह तीन उपइकाइयों α2β2γ2 से बना एक मंदक है। 2.2 A रिज़ॉल्यूशन के साथ, क्रिस्टलोग्राफी से पता चलता है कि MMO 60 x 100 x 120 A के आयामों के साथ एक अपेक्षाकृत सपाट अणु है। इसके अलावा, अणु के केंद्र में एक मुख के साथ डिमर अंतरफलक के साथ एक विस्तृत कैनियन चल रहा है। अधिकांश प्रोटोमर्स में α और β उपइकाइयों से हेलिक्स सम्मिलित होते हैं जिनमें γ उपइकाई से कोई भागीदारी नहीं होती है। इसके अलावा, प्रोटोमर्स के साथ अंतःक्रिया राइबोन्यूक्लियोटाइड रिडक्टेस R2 प्रोटीन डिमर पारस्परिक क्रिया के समान होती है, जो हृदय के समान होती है।<ref name="MMOheart1">{{cite journal | vauthors = Nordlund P, Sjöberg BM, Eklund H | title = Three-dimensional structure of the free radical protein of ribonucleotide reductase | journal = Nature | volume = 345 | issue = 6276 | pages = 593–598 | date = June 1990 | pmid = 2190093 | doi = 10.1038/345593a0 | s2cid = 4233134 | bibcode = 1990Natur.345..593N }}</ref><ref name="MMOheart2">{{cite journal | vauthors = Nordlund P, Eklund H | title = Structure and function of the Escherichia coli ribonucleotide reductase protein R2 | journal = Journal of Molecular Biology | volume = 232 | issue = 1 | pages = 123–164 | date = July 1993 | pmid = 8331655 | doi = 10.1006/jmbi.1993.1374 }}</ref> प्रत्येक लोहे में छह समन्वयित अष्टफलकीय परिवेश होता है। डाइन्यूक्लियर आयरन केंद्र α उपइकाई में स्थित हैं। प्रत्येक लोहे के परमाणुओं को हिस्टडीन δN परमाणु, Fe 1 से His 147 और Fe 2 से His 246 तक समन्वित किया जाता है, Fe 1 एक मोनोदंतुर कार्बोक्सिलेट, Glu 114, एक सेमी ब्रिजिंग कैबोक्सिलेट, Glu 144, और एक पानी के अणु से जुड़ा होता है। .<ref name="NatureMMO" /> | ||
अभिक्रिया होने के लिए क्रियाधार को सक्रिय स्थान के पास बांधना चाहिए। लोहे के केंद्रों के पास हाइड्रोफोबिक पॉकेट हैं। ऐसा माना जाता है कि यहां मीथेन बंधी रहती है और जरूरत पड़ने तक बनी रहती है। एक्स-रे क्रिस्टलोग्राफी से इन पैकेटों का कोई सीधा रास्ता नहीं है। यद्यपि, Phe 188 या The 213 साइड-चेन्स में थोड़ा सा रचना परिवर्तन प्रवेश की अनुमति दे सकता है।<ref name="NatureMMO" />युग्मन प्रोटीन और सक्रियता के बंधन से इस गठनात्मक परिवर्तन को | अभिक्रिया होने के लिए क्रियाधार को सक्रिय स्थान के पास बांधना चाहिए। लोहे के केंद्रों के पास हाइड्रोफोबिक पॉकेट हैं। ऐसा माना जाता है कि यहां मीथेन बंधी रहती है और जरूरत पड़ने तक बनी रहती है। एक्स-रे क्रिस्टलोग्राफी से इन पैकेटों का कोई सीधा रास्ता नहीं है। यद्यपि, Phe 188 या The 213 साइड-चेन्स में थोड़ा सा रचना परिवर्तन प्रवेश की अनुमति दे सकता है।<ref name="NatureMMO" />युग्मन प्रोटीन और सक्रियता के बंधन से इस गठनात्मक परिवर्तन को प्रेरित किया जा सकता है। | ||
अपचयित करने पर, कार्बोक्जिलेट लिगैंड्स में से एक टर्मिनल मोनोदंतुर लिगैंड के पीछे से "1,2 कार्बोक्जिलेट" स्थानान्तरण से गुजरता है, दो लोहे के लिए ब्रिजिंग लिगैंड के साथ, दूसरा ऑक्सीजन Fe 2 के लिए समन्वित होता है।MMOH<sub>red</sub> के अपचयित रूप में, Fe के लिए लिगैंड परिवेश प्रभावी रूप से पांच समन्वित हो जाता है, एक ऐसा रूप जो क्लस्टर को डाइऑक्सीजन को सक्रिय करने की अनुमति देता है।<ref name="MMOcat" />दो आयरन इस बिंदु पर FeIV में ऑक्सीकृत हैं और निम्न प्रचक्रण [[लौह-चुंबकीय]] से उच्च प्रचक्रण प्रतिलौहचुम्बकीय में बदल गए हैं। | अपचयित करने पर, कार्बोक्जिलेट लिगैंड्स में से एक टर्मिनल मोनोदंतुर लिगैंड के पीछे से "1,2 कार्बोक्जिलेट" स्थानान्तरण से गुजरता है, दो लोहे के लिए ब्रिजिंग लिगैंड के साथ, दूसरा ऑक्सीजन Fe 2 के लिए समन्वित होता है।MMOH<sub>red</sub> के अपचयित रूप में, Fe के लिए लिगैंड परिवेश प्रभावी रूप से पांच समन्वित हो जाता है, एक ऐसा रूप जो क्लस्टर को डाइऑक्सीजन को सक्रिय करने की अनुमति देता है।<ref name="MMOcat" />दो आयरन इस बिंदु पर FeIV में ऑक्सीकृत हैं और निम्न प्रचक्रण [[लौह-चुंबकीय]] से उच्च प्रचक्रण प्रतिलौहचुम्बकीय में बदल गए हैं। | ||
Revision as of 13:57, 18 February 2023
| पार्टिकुलेट मीथेन मोनोऑक्सीजिनेज | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
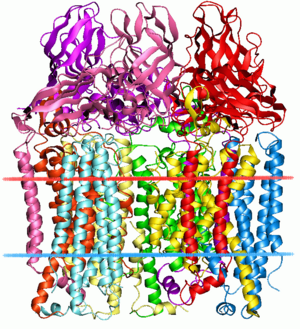 | |||||||||||
| Identifiers | |||||||||||
| Symbol | pMMO | ||||||||||
| Pfam | PF02461 | ||||||||||
| InterPro | IPR003393 | ||||||||||
| OPM superfamily | 23 | ||||||||||
| OPM protein | 1yew | ||||||||||
| |||||||||||
मीथेन मोनोऑक्सीजिनेज (MMO) एक एंजाइम है जो मीथेन के साथ-साथ अन्य अल्केन्स में C-H बॉन्ड को ऑक्सीडाइज़ करने में सक्षम है।[1] मीथेन मोनोऑक्सीजिनेज ऑक्सीडोरडक्टेस एंजाइम के वर्ग से संबंधित है (EC 1.14.13.25).
MMO के दो रूप हैं: अच्छी तरह से अध्ययन किया गये घुलनशील रूप (sMMO) और कण रूप (pMMO)।[2] sMMO में सक्रिय स्थान में एक ऑक्सीजन परमाणु (Fe-O-Fe) द्वारा ब्रिज किया गया एक डाय-लौह केंद्र होता है, जबकि pMMO में सक्रिय स्थान तांबे का उपयोग करता है। एक्स-रे क्रिस्टलोग्राफी द्वारा दोनों प्रोटीनों की संरचनाएं निर्धारित की गई हैं,यद्यपि, pMMO में सक्रिय स्थान का स्थान और तंत्र अभी भी खराब समझा जाता है और सक्रिय अनुसंधान का एक क्षेत्र है।
मीथेन मोनोऑक्सीजिनेज (पार्टिकुलेट) और संबंधित अमोनिया मोनोऑक्सीजिनेज पूर्ण मेम्ब्रेन प्रोटीन हैं, जो क्रमशः मीथेनोट्रॉफ़्स और अमोनिया ऑक्सीकारक में होते हैं, जिन्हें संबंधित माना जाता है।[3] इन एंजाइमों में अपेक्षाकृत व्यापक क्रियाधार विशिष्टता होती है और अमोनिया, मीथेन, हैलोजेनेटेड हाइड्रोकार्बन और सुगंधित अणुओं सहित कई प्रकार के क्रियाधार के ऑक्सीकरण को उत्प्रेरित कर सकते हैं।[4] ये एंजाइम 3 उपइकाइयों - ए (InterPro: IPR003393), बी (InterPro: IPR006833) और सी(InterPro: IPR006980) और अधिकांश में दो मोनोकॉपर केंद्र होते हैं।[5][6]
मेथिलोकोकस कैप्सूलेटस (बाथ) से ए उपइकाई मुख्य रूप से झिल्ली के भीतर रहता है और इसमें 7 ट्रांसमेम्ब्रेन हेलिक्स और एक बीटा-हेयरपिन होता है, जो बी उपइकाई के घुलनशील क्षेत्र के साथ संपर्क करता है। माना जाता है कि एक संरक्षित ग्लूटामेट अवशेष धातु केंद्र में योगदान देता है।[5]
मीथेन मोनोऑक्सीजिनेज मीथेनोट्रोफिक बैक्टीरिया में पाए जाते हैं, बैक्टीरिया का एक वर्ग जो एरोबिक (ऑक्सीजन युक्त) और एनारोबिक (ऑक्सीजन रहित) परिवेश के अंतरपृष्ठ में उपस्थित होता है। इस प्रकार के अधिक व्यापक रूप से अध्ययन किए गए जीवाणुओं में से एक मेथिलोकोकस कैप्सूलैटस (बाथ) है। यह जीवाणु बाथ, इंग्लैंड के गर्म झरनों में खोजा गया था।[7] विशेष रूप से, सख्ती से अवायवीय मेथनोट्रॉफ़्स भी मीथेन मोनोऑक्सीजिनेस को बंद कर सकते हैं, यद्यपि सामान्यतः जीन में महत्वपूर्ण बेमेल हैं जो सामान्य मेथनोट्रोफ़ की मांग करने वाले प्राइमर को मिलान से रोकते हैं।[8]
घुलनशील मीथेन मोनोऑक्सीजिनेज प्रणाली
अवायवीय अवसादों के माध्यम से मेथनोट्रोफिक बैक्टीरिया, चक्रण कार्बन की एक आवश्यक भूमिका निभाते हैं। चक्रण के पीछे का रसायन एक रासायनिक रूप से निष्क्रिय हाइड्रोकार्बन, मीथेन लेता है, और इसे एक अधिक सक्रिय प्रजाति, मेथनॉल में परिवर्तित करता है। अन्य हाइड्रोकार्बन एमएमओ द्वारा ऑक्सीकृत होते हैं, इसलिए एमएमओ प्रणाली की समझ के आधार पर एक नया हाइड्रॉक्सिलेशन उत्प्रेरक संभवतः प्राकृतिक गैस की विश्व आपूर्ति का अधिक कुशल उपयोग कर सकता है।[9]
यह एक क्लासिक मोनोऑक्सीजिनेज अभिक्रिया है जिसमें NAD(P)H से अपचयित करने वाले समकक्षों को O2 के O-O बंधन को विभाजित करने के लिए उपयोग किया जाता है। एक परमाणु को 2 e- के अपचयन द्वारा पानी में अपचयित किया जाता है और दूसरा मेथनॉल उत्पन्न करने के लिए क्रियाधार में सम्मिलित किया जाता है:[10]
CH4 + O2 + NAD(P)H + H+ -> CH3OH + NAD(P)+ + H2O
MMO के दो रूप पाए गए हैं: घुलनशील और कण। घुलनशील MMO के सबसे अच्छे रूपों में तीन प्रोटीन घटक होते हैं: हाइड्रॉक्सिलेज़, β यूनिट और रिडक्टेस। जिनमें से प्रत्येक प्रभावी क्रियाधार हाइड्रॉक्सिलेशन और एनएडीएच ऑक्सीकरण के लिए आवश्यक है।[10]
संरचना
MMO के एक्स-रे क्रिस्टलोग्राफी से पता चलता है कि यह तीन उपइकाइयों α2β2γ2 से बना एक मंदक है। 2.2 A रिज़ॉल्यूशन के साथ, क्रिस्टलोग्राफी से पता चलता है कि MMO 60 x 100 x 120 A के आयामों के साथ एक अपेक्षाकृत सपाट अणु है। इसके अलावा, अणु के केंद्र में एक मुख के साथ डिमर अंतरफलक के साथ एक विस्तृत कैनियन चल रहा है। अधिकांश प्रोटोमर्स में α और β उपइकाइयों से हेलिक्स सम्मिलित होते हैं जिनमें γ उपइकाई से कोई भागीदारी नहीं होती है। इसके अलावा, प्रोटोमर्स के साथ अंतःक्रिया राइबोन्यूक्लियोटाइड रिडक्टेस R2 प्रोटीन डिमर पारस्परिक क्रिया के समान होती है, जो हृदय के समान होती है।[11][12] प्रत्येक लोहे में छह समन्वयित अष्टफलकीय परिवेश होता है। डाइन्यूक्लियर आयरन केंद्र α उपइकाई में स्थित हैं। प्रत्येक लोहे के परमाणुओं को हिस्टडीन δN परमाणु, Fe 1 से His 147 और Fe 2 से His 246 तक समन्वित किया जाता है, Fe 1 एक मोनोदंतुर कार्बोक्सिलेट, Glu 114, एक सेमी ब्रिजिंग कैबोक्सिलेट, Glu 144, और एक पानी के अणु से जुड़ा होता है। .[9]
अभिक्रिया होने के लिए क्रियाधार को सक्रिय स्थान के पास बांधना चाहिए। लोहे के केंद्रों के पास हाइड्रोफोबिक पॉकेट हैं। ऐसा माना जाता है कि यहां मीथेन बंधी रहती है और जरूरत पड़ने तक बनी रहती है। एक्स-रे क्रिस्टलोग्राफी से इन पैकेटों का कोई सीधा रास्ता नहीं है। यद्यपि, Phe 188 या The 213 साइड-चेन्स में थोड़ा सा रचना परिवर्तन प्रवेश की अनुमति दे सकता है।[9]युग्मन प्रोटीन और सक्रियता के बंधन से इस गठनात्मक परिवर्तन को प्रेरित किया जा सकता है।
अपचयित करने पर, कार्बोक्जिलेट लिगैंड्स में से एक टर्मिनल मोनोदंतुर लिगैंड के पीछे से "1,2 कार्बोक्जिलेट" स्थानान्तरण से गुजरता है, दो लोहे के लिए ब्रिजिंग लिगैंड के साथ, दूसरा ऑक्सीजन Fe 2 के लिए समन्वित होता है।MMOHred के अपचयित रूप में, Fe के लिए लिगैंड परिवेश प्रभावी रूप से पांच समन्वित हो जाता है, एक ऐसा रूप जो क्लस्टर को डाइऑक्सीजन को सक्रिय करने की अनुमति देता है।[10]दो आयरन इस बिंदु पर FeIV में ऑक्सीकृत हैं और निम्न प्रचक्रण लौह-चुंबकीय से उच्च प्रचक्रण प्रतिलौहचुम्बकीय में बदल गए हैं।
प्रस्तावित उत्प्रेरक चक्र और तंत्र
MMOHred से डायरॉन केंद्र मध्यवर्ती P बनाने के लिए O2 के साथ अभिक्रिया करते हैं2 । यह मध्यवर्ती एक पेरोक्साइड प्रजाति है जहां ऑक्सीजेंस सममित रूप से बंधे होते हैं, स्पेक्ट्रोस्कोपिक अध्ययन द्वारा सुझाए गए हैं।[13] यद्यपि, संरचना ज्ञात नहीं है। इंटरमीडिएट P तब इंटरमीडिएट Q में परिवर्तित हो जाता है, जिसमें दो प्रतिलौहचुम्बकीय रूप से युग्मित उच्च प्रचक्रण FeIV केंद्र सम्मिलित करने का प्रस्ताव था।[10]अपने डायमंड कोर के साथ यह यौगिक Q, MMO के लिए ऑक्सीडाइजिंग प्रजाति के लिए महत्वपूर्ण है।
यौगिक Q और अल्केन के बीच अभिक्रिया के लिए दो तंत्र सुझाए गए हैं: मौलिक और गैर-मौलिक। मौलिक तंत्र क्रियाधार से हाइड्रोजन परमाणु के पृथक्करण के साथ शुरू होता है ताकि QH (दर निर्धारण कदम), हाइड्रॉक्सिल ब्रिज्ड यौगिक क्यू और फ्री एल्काइल रेडिकल बनाया जा सके। गैर-मौलिक तंत्र का तात्पर्य एक ठोस मार्ग से है, जो चार-केंद्र संक्रमण अवस्था के माध्यम से होता है और "हाइड्रिडो-अल्काइल-क्यू" यौगिक की ओर जाता है। 1999 तक, शोध से पता चलता है कि मीथेन ऑक्सीकरण एक परिबद्ध-रेडिकल तंत्र के माध्यम से आगे बढ़ता है।
यह सुझाव दिया गया था कि मौलिक तंत्र के लिए संक्रमण अवस्था में हाइड्रॉक्सिल OH लिगैंड का आघूर्ण बल सम्मिलित है, इससे पहले कि मिथाइल रेडिकल अल्कोहल बनाने के लिए ब्रिजिंग हाइड्रॉक्सिल लिगैंड में जुड़ सकता है। मौलिक दृष्टिकोण के रूप में, अल्केन के H परमाणु समतलीय त्रिनिर्देशांक O परिवेश छोड़ देते हैं और टेट्राहेड्रल चतुष्कनिर्देशांक O परिवेश बनाने के लिए ऊपर की ओर झुकते हैं।[10]
इस अभिक्रिया का अंतिम चरण अल्कोहल का उन्मूलन और उत्प्रेरकों का पुनर्जनन है। ऐसा होने के कुछ तरीके हैं। यह एक चरणबद्ध तंत्र हो सकता है जो अल्कोहल के उन्मूलन और एक मध्यवर्ती Fe-O-Fe कोर के साथ शुरू होता है, और बाद वाला पानी को खत्म कर सकता है और 2e- अपचयन के माध्यम से एंजाइम को पुन: उत्पन्न कर सकता है। दूसरी ओर, यह पानी के अणु को देने के लिए O1 परमाणु को पाटने की 2e- अपचयन प्रक्रिया के साथ शुरू हो सकता है, इसके बाद अल्कोहल का उन्मूलन और एंजाइम का पुनर्जनन हो सकता है। इसके अलावा, यह संभव है कि एक ठोस तंत्र हो जिससे मेथनॉल का उन्मूलन अनायास 2e- ब्रिजिंग O1 केंद्र केअपचयन और उत्प्रेरक के पुनर्जनन के साथ होता है।[10]
यह भी देखें
- जैव अकार्बनिक रसायन
- ऑक्सीजनेज़
- शिलोव प्रणाली
संदर्भ
- ↑ Sazinsky MH, Lippard SJ (2015). "Chapter 6 Methane Monooxygenase: Functionalizing Methane at Iron and Copper". In Kroneck PM, Torres ME (eds.). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Vol. 15. Springer. pp. 205–256. doi:10.1007/978-3-319-12415-5_6. ISBN 978-3-319-12414-8. PMID 25707469.
- ↑ Ross MO, Rosenzweig AC (April 2017). "A tale of two methane monooxygenases". Journal of Biological Inorganic Chemistry. 22 (2–3): 307–319. doi:10.1007/s00775-016-1419-y. PMC 5352483. PMID 27878395.
- ↑ Holmes AJ, Costello A, Lidstrom ME, Murrell JC (October 1995). "Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related". FEMS Microbiology Letters. 132 (3): 203–208. doi:10.1111/j.1574-6968.1995.tb07834.x. PMID 7590173.
- ↑ Arp DJ, Sayavedra-Soto LA, Hommes NG (October 2002). "Molecular biology and biochemistry of ammonia oxidation by Nitrosomonas europaea". Archives of Microbiology. 178 (4): 250–255. doi:10.1007/s00203-002-0452-0. PMID 12209257. S2CID 27432735.
- ↑ 5.0 5.1 Lieberman RL, Rosenzweig AC (March 2005). "Crystal structure of a membrane-bound metalloenzyme that catalyses the biological oxidation of methane". Nature. 434 (7030): 177–182. Bibcode:2005Natur.434..177L. doi:10.1038/nature03311. PMID 15674245. S2CID 30711411.
- ↑ Ross MO, MacMillan F, Wang J, Nisthal A, Lawton TJ, Olafson BD, et al. (May 2019). "Particulate methane monooxygenase contains only mononuclear copper centers". Science. 364 (6440): 566–570. doi:10.1126/science.aav2572. PMC 6664434. PMID 31073062.
- ↑ Dalton H, Whittenbury R (August 1976). "The acetylene reduction technique as an assay for nitrogenase activity in the methane oxidizing bacterium Methylococcus capsulatus strain bath". Archives of Microbiology. 109 (1): 147–151. doi:10.1007/BF00425127. S2CID 21926661.
- ↑ Luesken FA, Zhu B, van Alen TA, Butler MK, Diaz MR, Song B, et al. (June 2011). "pmoA Primers for detection of anaerobic methanotrophs". Applied and Environmental Microbiology (in English). 77 (11): 3877–3880. doi:10.1128/AEM.02960-10. PMC 3127593. PMID 21460105.
- ↑ 9.0 9.1 9.2 Rosenzweig AC, Frederick CA, Lippard SJ, Nordlund P (December 1993). "Crystal structure of a bacterial non-haem iron hydroxylase that catalyses the biological oxidation of methane". Nature. 366 (6455): 537–543. Bibcode:1993Natur.366..537R. doi:10.1038/366537a0. PMID 8255292. S2CID 4237249.
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 Basch, Harold; et al. (1999). "Mechanism of the Methane -> Methanol Conversion Reaction Catalyzed by Methane Monoxygenase: A Density Function Study". J. Am. Chem. Soc. 121 (31): 7249–7256. doi:10.1021/ja9906296.
- ↑ Nordlund P, Sjöberg BM, Eklund H (June 1990). "Three-dimensional structure of the free radical protein of ribonucleotide reductase". Nature. 345 (6276): 593–598. Bibcode:1990Natur.345..593N. doi:10.1038/345593a0. PMID 2190093. S2CID 4233134.
- ↑ Nordlund P, Eklund H (July 1993). "Structure and function of the Escherichia coli ribonucleotide reductase protein R2". Journal of Molecular Biology. 232 (1): 123–164. doi:10.1006/jmbi.1993.1374. PMID 8331655.
- ↑ Liu KE, Valentine AM, Qiu D, Edmondson DE, Appelman EH, Spiro TG, Lippard SJ (1995). "Characterization of a Diiron(III) Peroxide Intermediate in the Reaction Cycle of Methane Monooxygenase Hydroxylase from Methylococcus capsulatus (Bath)". Journal of the American Chemical Society. 117 (17): 4997–4998. doi:10.1021/ja00122a032.
अग्रिम पठन
- Fraústo da Silva JJ, Williams RJ (2008). The biological chemistry of the elements : the inorganic chemistry of life (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-850848-9.
बाहरी संबंध
- UMich Orientation of Proteins in Membranes protein/pdbid-1yew
- methane+monooxygenase at the US National Library of Medicine Medical Subject Headings (MeSH)
