जेरम प्लॉट: Difference between revisions
No edit summary |
No edit summary |
||
| (2 intermediate revisions by 2 users not shown) | |||
| Line 77: | Line 77: | ||
== संदर्भ == | == संदर्भ == | ||
{{reflist}} | {{reflist}} | ||
[[Category:Created On 27/03/2023]] | [[Category:Created On 27/03/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:अम्ल-क्षार रसायन]] | |||
[[Category:ऊष्मप्रवैगिकी]] | |||
[[Category:औशेयनोग्रफ़ी]] | |||
[[Category:जल रसायन]] | |||
[[Category:जलीय पारिस्थितिकी]] | |||
[[Category:भू-रसायन शास्त्र]] | |||
[[Category:मृदा रसायन]] | |||
[[Category:रासायनिक समुद्र विज्ञान]] | |||
[[Category:लींनोलोगु]] | |||
Latest revision as of 11:21, 27 April 2023
जेरम आरेख (नील्स जेरम के नाम पर; कभी-कभी सिलेन आरेख या हैग आरेख के रूप में भी जाना जाता है) विलयन में पॉलीप्रोटिक अम्ल की विभिन्न प्रजातियों की सांद्रता का आरेख है, पीएच (हाइड्रोजन की क्षमता) के कार्य के रूप में[1] विलयन रासायनिक साम्यावस्था में होता है। अतः सांद्रता द्वारा विस्तृत परिमाण के कई क्रमों के कारण, वे सामान्य रूप से लघुगणकीय पैमाने पर आरेखित किए जाते हैं। कभी-कभी वास्तविक सांद्रता के अतिरिक्त सांद्रता के अनुपात को आरेख किया जाता है। और कभी-कभी H+ और OH− भी आलेखित किए गए हैं।
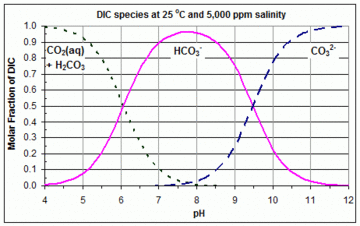
सबसे अधिक बार कार्बोनेट प्रणाली को आरेखित किया जाता है, जहां पॉलीप्रोटिक अम्ल कार्बोनिक अम्ल (डिप्रोटिक अम्ल) होता है, और विभिन्न प्रजातियां कार्बन डाइऑक्साइड, कार्बोनिक अम्ल, बाइकार्बोनेट और कार्बोनेट में विलेय हो जाती हैं। अम्लीय स्थितियों में, प्रभावशाली रूप CO2 और मूल (क्षारीय) स्थितियों में, प्रभावशाली रूप CO2−
3 है; और बीच में, प्रभावशाली रूप HCO−
3 है। प्रत्येक पीएच मान पर, कार्बोनिक अम्ल की सांद्रता घुलित CO2 की सांद्रता की तुलना में नगण्य माना जाता है, और इसलिए इसे प्रायः जेरम आरेखों से विलोपित किया जाता है। ये आरेख विलयन रसायन और प्राकृतिक जल रसायन में अधिक सहायक होते हैं। यहाँ दिए गए उदाहरण में, यह जीवाश्म ईंधन के दहन द्वारा मानव निर्मित CO2 उत्सर्जन के सहयोग के कारण समुद्री जल के पीएच और कार्बोनेट उपजातिकरण की प्रतिक्रिया को दर्शाता है।[2]
सिलिकिक अम्ल, बोरिक अम्ल, सल्फ्यूरिक अम्ल और फॉस्फोरिक अम्ल अम्ल सहित अन्य पॉलीप्रोटिक अम्ल के लिए जेरम आरेख अन्य सामान्य रूप से उपयोग किए जाने वाले उदाहरण हैं।[1]
कार्बोनेट प्रणाली के लिए जेरम आरेख समीकरण
यदि कार्बन डाइऑक्साइड, कार्बोनिक अम्ल, हाइड्रोन (रसायन विज्ञान), बाइकार्बोनेट और कार्बोनेट सभी पानी में विलेय हो जाते हैं, और रासायनिक साम्यावस्था पर उनकी साम्य सांद्रता को प्रायः निम्न अभिक्रिया द्वारा दिया जाता है:
जहां पादांक 'eq' दर्शाता है कि ये साम्य सांद्रता हैं, K1 प्रतिक्रिया के लिए साम्य CO
2 + H
2O ⇌ H+ + HCO−
3 स्थिरांक है, अर्थात कार्बोनिक अम्ल के लिए पहला अम्ल पृथक्करण स्थिरांक है और K2 प्रतिक्रिया के लिए HCO−
3 ⇌ H+ + CO2−
3 साम्य स्थिरांक (अर्थात कार्बोनिक अम्ल के लिए दूसरा अम्ल पृथक्करण स्थिरांक) है, और डीआईसी प्रणाली में कुल अकार्बनिक कार्बन की (अपरिवर्तनीय) समग्र सांद्रता [CO2] + [HCO−
3] + [CO2−
3] होती है। अर्थात K1, K2 और डीआईसी प्रत्येक में सांद्रता की इकाइयां होती हैं, उदाहरण मोल (इकाई)/लीटर है।
इन तीन प्रजातियों के विपरीत आरेख करने के लिए इन तीन समीकरणों का उपयोग करके pH = −log10 [H+]eq जेरम आरेख प्राप्त किया जाता है, दिए गए K1, K2 और डीआईसी के लिए इन अभिक्रियाओ में भाग तीन प्रजातियों के सापेक्ष अनुपात देते हैं, और इसलिए यदि डीआईसी अज्ञात है, या वास्तविक सांद्रता नगण्य होती हैं, तो इसके अतिरिक्त इन अनुपातों को आरेख किया जा सकता है।
इन तीन समीकरणों से पता चलता है कि CO2 और HCO−
3 के लिए वक्र [H+]eq = K1, पर प्रतिच्छेद करता है, और HCO−
3 और CO2−
3 के वक्र [H+]eq = K2 पर प्रतिच्छेद करते हैं। इसलिए, K1 और K2 के मान जो किसी दिए गए जेरम आरेख को बनाने के लिए उपयोग किए गए थे, उस आरेख से परस्पर क्रिया के इन बिंदुओं पर सांद्रता का अध्ययन करके आसानी से प्राप्त किया जा सकता है। रेखीय Y अक्ष के साथ एक उदाहरण संलग्न आरेख में दिखाया गया है कि K1 और K2 के मान और इसलिए जेरम आरेख में वक्र, तापमान और लवणता के साथ अपेक्षाकृत अधिक भिन्न होते हैं।[3]
कार्बोनेट प्रणाली के लिए जेरम आरेख समीकरणों की रासायनिक और गणितीय व्युत्पत्ति
मान लीजिए कि पानी में विलेय कार्बन डाइऑक्साइड, हाइड्रोन (रसायन विज्ञान), बाइकार्बोनेट और कार्बोनेट आयनों के बीच प्रतिक्रियाएँ इस प्रकार हैं:
-
CO
2 + H
2O ⇌ H+ + HCO−
3(1)
-
HCO−
3 ⇌ H+ + CO2−
3(2)
ध्यान दें कि प्रतिक्रिया 1 वास्तव में दो प्राथमिक प्रतिक्रियाओं का संयोजन है:
- CO
2 + H
2O ⇌ H
2CO
3 ⇌ H+ + HCO−
3
यह मानते हुए कि द्रव्यमान क्रिया नियम इन दो प्रतिक्रियाओं पर प्रयुक्त होता है कि जल अधिकता (रसायन विज्ञान) है, और यह कि विभिन्न रासायनिक प्रजातियां सदैव अच्छी तरह से मिश्रित होती हैं, उनके दर समीकरण हैं
जहाँ [ ] सांद्रता को दर्शाता है, t समय है, और K1 और K−1 प्रतिक्रिया 1 के लिए उपयुक्त समानुपातिकता (गणित) स्थिरांक हैं, इस प्रतिक्रिया के लिए क्रमशः आगे और विपरीत प्रतिवर्ती दर स्थिरांक (इसी प्रकार K2 और K−2 प्रतिक्रिया के लिए 2) कहा जाता है।
किसी भी साम्यावस्था पर, सांद्रता अपरिवर्तित होती है, इसलिए इन समीकरणों के बायीं ओर शून्य होते हैं। फिर, इन चार समीकरणों में से पहले से, प्रतिक्रिया का अनुपात 1 की दर स्थिरांक इसकी साम्य सांद्रता के अनुपात के समान होती है, और इस अनुपात को K1 कहा जाता है, प्रतिक्रिया 1 के लिए साम्य स्थिरांक कहा जाता है, अर्थात
-
(3)
जहां पादांक 'eq' दर्शाता है कि ये साम्य सांद्रता हैं।
इसी प्रकार, साम्य स्थिरांक K2 के लिए चतुर्थ समीकरण 2 से प्रतिक्रिया के लिए,
-
(4)
3 को पुनर्व्यवस्थित करने पर प्राप्त होता है
-
(5)
और पुनर्व्यवस्थित 4, फिर प्रतिस्थापित करने पर 5 देता है
-
(6)
प्रणाली में विलेय हुए अकार्बनिक कार्बन की कुल सांद्रता 5 और 6 में प्रतिस्थापित करके दी गई है:
इसे पुनर्व्यवस्थित करने पर CO
2 के लिए समीकरण प्राप्त होता है:
5 और 6 के लिए समीकरण HCO−
3 और CO2−
3 को इसमें प्रतिस्थापित करके प्राप्त किया जाता है
यह भी देखें
- चार्लोट समीकरण
- ग्रैन प्लॉट (ग्रैन अनुमापन या ग्रैन विधि के रूप में भी जाना जाता है)
- हेंडरसन-हसलबल्च समीकरण
- हिल समीकरण (जैव रसायन)
- आयन प्रजाति
- स्वच्छ जल
- समुद्री जल
- तापलवणीय संचरण
संदर्भ
- ↑ 1.0 1.1 Andersen, C. B. (2002). "प्रायोगिक और प्राकृतिक प्रणालियों में क्षारीयता को मापकर कार्बोनेट संतुलन को समझना". Journal of Geoscience Education. 50 (4): 389–403. Bibcode:2002JGeEd..50..389A. doi:10.5408/1089-9995-50.4.389. S2CID 17094010.
- ↑ D.A. Wolf-Gladrow (2007). "Total alkalinity: the explicit conservative expression and its application to biogeochemical processes" (PDF). Marine Chemistry. 106 (1): 287–300. doi:10.1016/j.marchem.2007.01.006.
- ↑ Mook W (2000) Chemistry of carbonic acid in water. In 'Environmental Isotopes in the Hydrological Cycle: Principles and Applications' pp. 143-165. (INEA / UNESCO: Paris). [1] Retrieved 30 November 2013.