साइटोक्रोम सी ऑक्सीडेज: Difference between revisions
No edit summary |
No edit summary |
||
| (10 intermediate revisions by 3 users not shown) | |||
| Line 1: | Line 1: | ||
एंजाइम साइटोक्रोम सी ऑक्सीडेज या जटिल IV, (ईसी 1.9.3.1 था, जिसे अब ट्रांसलोकेस ईसी 7.1.1.9 के रूप में पुनर्वर्गीकृत किया गया है) | एंजाइम साइटोक्रोम सी ऑक्सीडेज या जटिल IV, (ईसी 1.9.3.1 था, जिसे अब ट्रांसलोकेस ईसी 7.1.1.9 के रूप में पुनर्वर्गीकृत किया गया है) सुकेंद्रक के बैक्टीरिया, आर्किया और माइटोकॉन्ड्रिया में पाया जाने वाला एक बड़ा पारपक्षझिल्ली प्रोटीन जटिल है | ||
यह झिल्ली में स्थित कोशिकाओं की श्वसन | |||
यह झिल्ली में स्थित कोशिकाओं की श्वसन इलेक्ट्रॉनअभिगमनश्रृंखला का अंतिम एंजाइम है। यह चार साइटोक्रोम सी अणुओं में से प्रत्येक से एक इलेक्ट्रॉन प्राप्त करता है और उन्हें एक ऑक्सीजन अणु और चार प्रोटॉन में स्थानांतरित करता है, जिससे जल के दो अणु बनते हैं। आंतरिक जलीय चरण से चार प्रोटॉन को बांधने के अलावा, यह झिल्ली के पार दूसरे और चार प्रोटॉन को स्थानांतरित करता है, जो प्रोटॉन विद्युत रासायनिक क्षमता के पारपक्षझिल्ली अंतर को बढ़ाता है, जिसे एटीपी संश्लेषण ,तब एटीपी को संश्लेषित करने के लिए उपयोग करता है। | |||
{{enzyme | |||
| Name = Cytochrome c oxidase | | Name = Cytochrome c oxidase | ||
| EC_number = 1.9.3.1 | | EC_number = 1.9.3.1 | ||
| IUBMB_EC_number = 1/9/3/1 | | IUBMB_EC_number = 1/9/3/1 | ||
| GO_code = 0009485 | | GO_code = 0009485 | ||
| image = Cytochrome C Oxidase 1OCC in Membrane 2.png | | image = Cytochrome C Oxidase 1OCC in Membrane 2.png | ||
| width = 296px | | width = 296px | ||
| caption = फॉस्फोलिपिड बाइलेयर में गोजातीय साइटोक्रोम ''सी'' ऑक्सीडेज की क्रिस्टल संरचना। | | caption = फॉस्फोलिपिड बाइलेयर में गोजातीय साइटोक्रोम ''सी'' ऑक्सीडेज की क्रिस्टल संरचना। अन्तराझिल्ली स्थान छवि के शीर्ष पर स्थित है। {{PDB|1OCC}} से अनुकूलित (यह इस संरचना में एक होमोडीमर है) | ||
|name=साइटोक्रोम सी ऑक्सीडेज}} | |name=साइटोक्रोम सी ऑक्सीडेज}} | ||
| Line 14: | Line 16: | ||
=== जटिल === | === जटिल === | ||
जटिल एक बड़ा पूर्ण झिल्ली प्रोटीन है जो कई धातु कृत्रिम स्थानो और स्तनधारियों में 14 प्रोटीन उप इकाई से बना है। स्तनधारियों में, ग्यारह उप इकाई मूल रूप से परमाणु होते हैं, और तीन माइटोकॉन्ड्रिया में संश्लेषित होते हैं। परिसर में दो हीम, एक साइटोक्रोम A और साइटोक्रोम A3, और दो तांबे के केंद्र, Cu<sub>A</sub> और Cu<sub>B</sub> केंद्र सम्मिलित हैं। वास्तव में, साइटोक्रोम a3 और CuB एक द्विनाभिक केंद्र बनाते हैं जो ऑक्सीजन के अपचयन का स्थल है। साइटोक्रोम सी, जो श्वसन श्रृंखला के पूर्ववर्ती घटक (साइटोक्रोम बीसी1 जटिल III) द्वारा अपचयित किया जाता है, Cu<sub>A</sub> द्विनाभिकीय केंद्र के पास संक्षिप्त करता है और इसे एक इलेक्ट्रॉन पास करता है, Fe<sup>3+</sup> युक्त साइटोक्रोम c में वापस ऑक्सीकृत हो जाता है। अपचयित Cu<sub>A</sub> द्विनाभिक केंद्र अब एक इलेक्ट्रॉन को साइटोक्रोम a पर भेजता है, जो बदले में एक इलेक्ट्रॉन को साइटोक्रोम a<sub>3</sub>>-Cu<sub>B</sub> द्विनाभिक केंद्र पर भेजता है। इस द्विनाभिक केंद्र में दो धातु आयन 4.5 Å अलग हैं और पूरी तरह से ऑक्सीकृत अवस्था में एक हाइड्रॉक्साइड आयन का समन्वय करते हैं। | |||
साइटोक्रोम सी ऑक्सीडेज के | साइटोक्रोम सी ऑक्सीडेज के क्रिस्टललेखीय अध्ययन एक असामान्य स्थानान्तरण के बाद सुधार दिखाते हैं, Tyr (244) के C6 और His (240) (गोजातीय एंजाइम अंकन)के ε-N को जोड़ते हैं। यह आणविक ऑक्सीजन और चार प्रोटॉन को जल में अपचयित करने में चार इलेक्ट्रॉनों को स्वीकार करने के लिए साइटोक्रोम a<sub>3</sub>- Cu<sub>B</sub> द्विनाभिक केंद्र को सक्षम करने में महत्वपूर्ण भूमिका निभाता है। कमी के तंत्र में पूर्व में एक परऑक्साइड मध्यवर्ती सम्मिलित करने के लिए सोचा गया था, जिसके बारे में माना जाता था कि इससे सुपरऑक्साइड का उत्पादन होता है। यद्यपि, वर्तमान में स्वीकृत तंत्र में तेजी से चार-इलेक्ट्रॉन कमी सम्मिलित है, जिसमें तत्काल ऑक्सीजन-ऑक्सीजन बंधन दरार सम्मिलित है, जिससे सुपरऑक्साइड बनाने की किसी भी मध्यवर्ती संभावना से बचा जा सकता है। | ||
=== संरक्षित उप इकाईयाँ === | === संरक्षित उप इकाईयाँ === | ||
{| class="wikitable" | {| class="wikitable" | ||
|+साइटोक्रोम सी ऑक्सीडेज | |+साइटोक्रोम सी ऑक्सीडेज जटिल की संरक्षित उप इकाई की तालिका | ||
!'''No.''' | !'''No.''' | ||
!Subunit name | !Subunit name | ||
| Line 147: | Line 149: | ||
|Pfam PF02285 | |Pfam PF02285 | ||
|- | |- | ||
|''' | | '''समन्वायोजन उप इकाईयाँ''' | ||
|- | |- | ||
|1 | |1 | ||
|Coa1 | |Coa1 | ||
|COA1_HUMAN | |COA1_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 1 होमोलॉग | ||
|Pfam PF08695 | |Pfam PF08695 | ||
|- | |- | ||
| Line 158: | Line 160: | ||
|Coa3 | |Coa3 | ||
|COA3_HUMAN | |COA3_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 3 होमोलॉग, माइटोकॉन्ड्रियल | ||
|Pfam PF09813 | |Pfam PF09813 | ||
|- | |- | ||
| Line 164: | Line 166: | ||
|Coa4 | |Coa4 | ||
|COA4_HUMAN | |COA4_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 4 होमोलॉग, माइटोकॉन्ड्रियल | ||
|Pfam PF06747 | |Pfam PF06747 | ||
|- | |- | ||
| Line 170: | Line 172: | ||
|Coa5 | |Coa5 | ||
|COA5_HUMAN | |COA5_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 5 | ||
|Pfam PF10203 | |Pfam PF10203 | ||
|- | |- | ||
| Line 176: | Line 178: | ||
|Coa6 | |Coa6 | ||
|COA6_HUMAN | |COA6_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 6 होमोलॉग | ||
|Pfam PF02297 | |Pfam PF02297 | ||
|- | |- | ||
| Line 182: | Line 184: | ||
|Coa7 | |Coa7 | ||
|COA7_HUMAN | |COA7_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 7 | ||
|Pfam PF08238 | |Pfam PF08238 | ||
|- | |- | ||
| Line 188: | Line 190: | ||
|Cox11 | |Cox11 | ||
|COX11_HUMAN | |COX11_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX11 माइटोकॉन्ड्रियल | ||
|Pfam PF04442 | |Pfam PF04442 | ||
|- | |- | ||
| Line 194: | Line 196: | ||
|Cox14 | |Cox14 | ||
|COX14_HUMAN | |COX14_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन | ||
|Pfam PF14880 | |Pfam PF14880 | ||
|- | |- | ||
| Line 200: | Line 202: | ||
|Cox15 | |Cox15 | ||
|COX15_HUMAN | |COX15_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX15 होमोलॉग | ||
|Pfam PF02628 | |Pfam PF02628 | ||
|- | |- | ||
| Line 206: | Line 208: | ||
|Cox16 | |Cox16 | ||
|COX16_HUMAN | |COX16_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX16 होमोलॉग माइटोकॉन्ड्रियल | ||
|Pfam PF14138 | |Pfam PF14138 | ||
|- | |- | ||
| Line 218: | Line 220: | ||
|Cox18 | |Cox18 | ||
|COX18_HUMAN | |COX18_HUMAN | ||
|माइटोकॉन्ड्रियल आंतरिक झिल्ली प्रोटीन (साइटोक्रोम सी ऑक्सीडेज | |माइटोकॉन्ड्रियल आंतरिक झिल्ली प्रोटीन (साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन 18) | ||
|Pfam PF02096 | |Pfam PF02096 | ||
|- | |- | ||
| Line 224: | Line 226: | ||
|Cox19 | |Cox19 | ||
|COX19_HUMAN | |COX19_HUMAN | ||
|साइटोक्रोम सी ऑक्सीडेज | |साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन | ||
|Pfam PF06747 | |Pfam PF06747 | ||
|- | |- | ||
| Line 234: | Line 236: | ||
|} | |} | ||
== | == समन्वायोजन == | ||
{{Pfam_box | {{Pfam_box | ||
| Symbol = साइटोक्रोम सी ऑक्सीडेज | | Symbol = साइटोक्रोम सी ऑक्सीडेज | ||
| Line 253: | Line 255: | ||
}} | }} | ||
यीस्ट | यीस्ट में COX समन्वायोजन एक जटिल प्रक्रिया है जिसे जलविरोधी उप इकाई के तीव्र और अपरिवर्तनीय एकत्रीकरण के कारण पूरी तरह से समझा नहीं जा सका है जो होलोनीजाइम जटिल बनाते हैं, साथ ही अनावृत जलविरोधी टुकड़े के साथ उत्परिवर्ती उप इकाई का एकत्रीकरण करते है।<ref name="pmid16760263" /> COX उपइकाइयां परमाणु और माइटोकॉन्ड्रियल जीनोम दोनों में कूटबद्ध हैं। COX उप्प्रेरणात्मक अंतर्भाग बनाने वाली तीन उपइकाई माइटोकॉन्ड्रियल जीनोम में कूटबद्ध हैं। | ||
हेम्स और सहकारक को उपइकाई I और II में डाला जाता है। दो हीम अणु उपइकाई I में रहते हैं, उपइकाई II मेंअभिगमनमें मदद करते हैं जहां दो तांबे के अणु इलेक्ट्रॉनों के निरंतर हस्तांतरण में सहायता करते हैं।<ref>{{cite web | first = Antony | last = Crofts | name-list-style = vanc | date = 1996 | title = Cytochrome oxidase: Complex IV | publisher = University of Illinois at Urbana-Champaign | url = http://www.life.illinois.edu/crofts/bioph354/cyt_ox.html | access-date = 2018-01-28 | archive-date = 2018-01-23 | archive-url = https://web.archive.org/web/20180123023311/http://www.life.illinois.edu/crofts/bioph354/cyt_ox.html | url-status = live }}</ref> उपइकाई I और IV समन्वायोजन आरंभ करते हैं। अलग-अलग उप इकाई उप - जटिल मध्यवर्ती बनाने के लिए संबद्ध हो सकते हैं जो बाद में COX जटिल बनाने के लिए अन्य उप इकाई से जुड़ जाते हैं।<ref name="pmid16760263" /> समन्वायोजन के बाद के संशोधनों में, COX एक होमोडीमर बनाएगा। यह गतिविधि के लिए आवश्यक है। डिमर्स एक [[कार्डियोलिपिन]] अणु से जुड़े होते हैं,<ref name="pmid16760263">{{cite journal | vauthors = Fontanesi F, Soto IC, Horn D, Barrientos A | title = Assembly of mitochondrial cytochrome c-oxidase, a complicated and highly regulated cellular process | journal = American Journal of Physiology. Cell Physiology | volume = 291 | issue = 6 | pages = C1129-47 | date = December 2006 | pmid = 16760263 | doi = 10.1152/ajpcell.00233.2006 }}</ref><ref name="pmid16199211">{{cite journal | vauthors = Khalimonchuk O, Rödel G | title = Biogenesis of cytochrome c oxidase | journal = Mitochondrion | volume = 5 | issue = 6 | pages = 363–88 | date = December 2005 | pmid = 16199211 | doi = 10.1016/j.mito.2005.08.002 }}</ref><ref name="pmid26284624">{{cite journal | vauthors = Sedlák E, Robinson NC | title = Destabilization of the Quaternary Structure of Bovine Heart Cytochrome c Oxidase upon Removal of Tightly Bound Cardiolipin | journal = Biochemistry | volume = 54 | issue = 36 | pages = 5569–77 | date = September 2015 | pmid = 26284624 | doi = 10.1021/acs.biochem.5b00540 }}</ref> जो होलोनीजाइम जटिल के स्थिरीकरण में महत्वपूर्ण भूमिका निभाते पाए गए हैं। उप इकाई VIIa और III के पृथक्करण के साथ-साथ कार्डियोलिपिन को हटाने से एंजाइम गतिविधि का पूर्ण नुकसान होता है।<ref name="pmid26284624" /> परमाणु जीनोम में कूटबद्ध उप इकाई को एंजाइम डाइमराइजेशन और स्थिरता में भूमिका निभाने के लिए जाना जाता है। इन उप इकाई के उत्परिवर्तन COXकार्य को समाप्त कर देते हैं।<ref name="pmid16760263" /> | |||
समन्वायोजन को कम से कम तीन अलग-अलग दर-निर्धारण चरणों में जाना जाता है। इन चरणों के उत्पाद पाए गए हैं, यद्यपि विशिष्ट उपइकाई संयोजन निर्धारित नहीं किए गए हैं।<ref name="pmid16760263" /> | |||
COX उप इकाई I, II, और III के संश्लेषण और समन्वायोजन को स्थानांतरीय सक्रियक द्वारा सुगम बनाया जाता है, जो माइटोकॉन्ड्रियल mRNA प्रतिलिपि के 5' बिना स्थानान्तरण वाले क्षेत्रों के साथ परस्पर क्रिया करते हैं। स्थानांतरीय सक्रियक नाभिक में कूटबद्ध हैं। वे स्थानान्तरण तंत्र के अन्य घटकों के साथ प्रत्यक्ष या अप्रत्यक्ष परस्परक्रिया के माध्यम से काम कर सकते हैं, लेकिन इन-विट्रो में स्थानान्तरण तंत्र को संश्लेषित करने से जुड़ी कठिनाइयों के कारण सटीक आणविक तंत्र स्पष्ट नहीं हैं।<ref name="pmid22450032">{{cite journal | vauthors = Herrmann JM, Woellhaf MW, Bonnefoy N | title = Control of protein synthesis in yeast mitochondria: the concept of translational activators | journal = Biochimica et Biophysica Acta (BBA) - Molecular Cell Research | volume = 1833 | issue = 2 | pages = 286–94 | date = February 2013 | pmid = 22450032 | doi = 10.1016/j.bbamcr.2012.03.007 | doi-access = free }}</ref><ref name="pmid21958598">{{cite journal | vauthors = Soto IC, Fontanesi F, Liu J, Barrientos A | title = Biogenesis and assembly of eukaryotic cytochrome c oxidase catalytic core | journal = Biochimica et Biophysica Acta (BBA) - Bioenergetics | volume = 1817 | issue = 6 | pages = 883–97 | date = June 2012 | pmid = 21958598 | pmc = 3262112 | doi = 10.1016/j.bbabio.2011.09.005 }}</ref> यद्यपि माइटोकॉन्ड्रियल जीनोम के भीतर कूटबद्ध किए गए उपइकाई I, II और III के बीच की परस्परक्रिया, द्विजीनोमिक उप इकाई के बीच की परस्पर क्रिया की तुलना में एंजाइम स्थिरता में कम योगदान देती है, ये उप इकाई अधिक संरक्षित हैं, जो एंजाइम गतिविधि के लिए संभावित अस्पष्टीकृत भूमिकाओं का संकेत देती हैं।<ref name="pmid4255772">{{cite journal | vauthors = Aledo JC, Valverde H, Ruíz-Camacho M, Morilla I, López FD | title = Protein-protein interfaces from cytochrome c oxidase I evolve faster than nonbinding surfaces, yet negative selection is the driving force | journal = Genome Biology and Evolution | volume = 6 | issue = 11 | pages = 3064–76 | date = October 2014 | pmid = 25359921 | pmc = 4255772 | doi = 10.1093/gbe/evu240 }}</ref> | |||
== जैव रसायन == | == जैव रसायन == | ||
{{missing information|section|इस खंड में छह पारंपरिक मध्यवर्ती अवस्था (APFOER) के नामों के बारे में जानकारी नहीं है; 2021 साइरो-ईएम परिणाम रेड-ऑक्स चरणों के उलट असाइनमेंट के साथ एक आरपीएफओई तंत्र का प्रस्ताव (doi:10.1038/s41467-021-27174-y ओपन एक्सेस)। कृपया इस जानकारी को सम्मिलित करने के लिए अनुभाग का विस्तार करें। अधिक विवरण वार्ता पृष्ठ पर उपस्थित हो सकते हैं। (दिसंबर 2021)|date=December 2021}} | {{missing information|section|इस खंड में छह पारंपरिक मध्यवर्ती अवस्था (APFOER) के नामों के बारे में जानकारी नहीं है; 2021 साइरो-ईएम परिणाम रेड-ऑक्स चरणों के उलट असाइनमेंट के साथ एक आरपीएफओई तंत्र का प्रस्ताव (doi:10.1038/s41467-021-27174-y ओपन एक्सेस)। कृपया इस जानकारी को सम्मिलित करने के लिए अनुभाग का विस्तार करें। अधिक विवरण वार्ता पृष्ठ पर उपस्थित हो सकते हैं। (दिसंबर 2021)|date=December 2021}} | ||
समग्र | समग्र अभिक्रिया है | ||
: 4 Fe<sup>2+</sup> - साइटोक्रोम सी + 4H<sup>+</sup> + O<sub>2</sub>→ 4 Fe<sup>3+</sup> - साइटोक्रोम सी + 2 H<sub>2</sub>O Δ<sub>f</sub>''G''<sup>o</sup><nowiki>''</nowiki> = - 218 केजे/मोल | : 4 Fe<sup>2+</sup> - साइटोक्रोम सी + 4H<sup>+</sup> + O<sub>2</sub>→ 4 Fe<sup>3+</sup> - साइटोक्रोम सी + 2 H<sub>2</sub>O Δ<sub>f</sub>''G''<sup>o</sup><nowiki>''</nowiki> = - 218 केजे/मोल | ||
दो इलेक्ट्रॉन दो साइटोक्रोम c's से,Cu<sub>A</sub>और साइटोक्रोम a | दो इलेक्ट्रॉन दो साइटोक्रोम c's से,Cu<sub>A</sub> और साइटोक्रोम a स्थानो के माध्यम से साइटोक्रोम a<sub>3</sub>–Cu<sub>B</sub> द्विनाभिक केंद्र में पारित किए जाते हैं,जो धातुओं को Fe<sup>2+</sup> रूप और Cu<sup>+</sup>में अपचयित कर देते हैं।हाइड्रॉक्साइड लिगैंड प्रोटोनेटेड होता है और जल के रूप में खो जाता है, जिससे धातुओं के बीच एक शून्य पैदा हो जाता है जो O<sub>2</sub> से भर जाता है। Fe<sup>2+</sup>साइटोक्रोम a<sub>3</sub> से आने वाले दो इलेक्ट्रॉनों के साथ, ऑक्सीजन तेजी से अपचयित हो जाते हैं जो फेरिल ऑक्सो फॉर्म (Fe<sup>4+</sup>=O) में परिवर्तित हो जाती है। Cu<sub>B</sub>के करीब का ऑक्सीजन परमाणु Cu<sup>+</sup> से एक इलेक्ट्रॉन, और एक दूसरा इलेक्ट्रॉन और Tyr(244) के हाइड्रॉक्सिल से एक प्रोटॉन लेता है, जो टायरोसिल रेडिकल बन जाता है। दूसरा ऑक्सीजन दो इलेक्ट्रॉनों और एक प्रोटॉन को लेकर एक हाइड्रॉक्साइड आयन में परिवर्तित हो जाता है। एक अन्य साइटोक्रोम c से एक तीसरा इलेक्ट्रॉन पहले दो इलेक्ट्रॉन वाहकों के माध्यम से साइटोक्रोम a<sub>3</sub>–Cu<sub>B</sub> द्विनाभिक केंद्र में जाता है, और यह इलेक्ट्रॉन और दो प्रोटॉन टायरोसिल रेडिकल को वापस Tyr में परिवर्तित कर देते हैं, और Cu<sub>B</sub><sup>2+</sup> से बंधे हाइड्रॉक्साइड को जल के अणु में बदल देते हैं। एक अन्य साइटोक्रोम c से चौथा इलेक्ट्रॉन Cu<sub>A</sub>और साइटोक्रोम a के माध्यम से साइटोक्रोम a<sub>3</sub>–Cu<sub>B</sub> द्विनाभिक केंद्र में प्रवाहित होता है, Fe<sup>4+</sup>=O को Fe<sup>3+</sup> में अपचयित करता है, ऑक्सीजन परमाणु एक साथ एक प्रोटॉन उठाता है, इस ऑक्सीजन को हाइड्रॉक्साइड आयन के रूप में पुन: उत्पन्न करता है साइटोक्रोम a<sub>3</sub>–Cu<sub>B</sub>केंद्र के मध्य में जैसा कि इस चक्र की शुरुआत में था। कुल मिलाकर, चार अपचयित किए गए साइटोक्रोम सी का ऑक्सीकरण होता है जबकि O<sub>2</sub> और चार प्रोटॉन दो जल के अणुओं में अपचयित हो जाते हैं।<ref name = "Voest_2011">{{cite book |last1=Voet |first1=Donald |last2=Voet |first2=Judith G. | name-list-style = vanc |title=जीव रसायन|date=2011 |publisher=John Wiley & Sons |location=Hoboken, NJ |isbn=978-0-470-57095-1 |edition=4th}}</ref>{{rp|841–5}} | ||
| Line 274: | Line 275: | ||
COX तीन गठनात्मक अवस्थाओं में मौजूद है: पूरी तरह से ऑक्सीकृत (स्पंदित), आंशिक रूप से कम, और पूरी तरह से कम। प्रत्येक अवरोधक का एक अलग राज्य के लिए एक उच्च संबंध है। स्पंदित अवस्था में दोनों हीम a{{sub|3}} और क्यू{{sub|B}} परमाणु केंद्र ऑक्सीकृत होते हैं; यह उच्चतम गतिविधि वाले एंजाइम की रचना है। एक दो-इलेक्ट्रॉन कमी एक गठनात्मक परिवर्तन शुरू करती है जो ऑक्सीजन को आंशिक रूप से कम एंजाइम को सक्रिय साइट पर बाँधने की अनुमति देती है। एंजाइम को पूरी तरह से कम करने के लिए चार इलेक्ट्रॉन COX से जुड़ते हैं। इसकी पूरी तरह से कम अवस्था, जिसमें एक कम Fe होता है{{sup|2+}} साइटोक्रोम ए पर{{sub|3}} हीम समूह और एक घटा हुआ घन{{sub|B}}{{sup|+}} द्विनाभिक केंद्र, एंजाइम की निष्क्रिय या विश्राम अवस्था माना जाता है।<ref name="pmid17906319">{{cite journal | vauthors = Leavesley HB, Li L, Prabhakaran K, Borowitz JL, Isom GE | title = Interaction of cyanide and nitric oxide with cytochrome c oxidase: implications for acute cyanide toxicity | journal = Toxicological Sciences | volume = 101 | issue = 1 | pages = 101–11 | date = January 2008 | pmid = 17906319 | doi = 10.1093/toxsci/kfm254 | doi-access = free }}</ref> | COX तीन गठनात्मक अवस्थाओं में मौजूद है: पूरी तरह से ऑक्सीकृत (स्पंदित), आंशिक रूप से कम, और पूरी तरह से कम। प्रत्येक अवरोधक का एक अलग राज्य के लिए एक उच्च संबंध है। स्पंदित अवस्था में दोनों हीम a{{sub|3}} और क्यू{{sub|B}} परमाणु केंद्र ऑक्सीकृत होते हैं; यह उच्चतम गतिविधि वाले एंजाइम की रचना है। एक दो-इलेक्ट्रॉन कमी एक गठनात्मक परिवर्तन शुरू करती है जो ऑक्सीजन को आंशिक रूप से कम एंजाइम को सक्रिय साइट पर बाँधने की अनुमति देती है। एंजाइम को पूरी तरह से कम करने के लिए चार इलेक्ट्रॉन COX से जुड़ते हैं। इसकी पूरी तरह से कम अवस्था, जिसमें एक कम Fe होता है{{sup|2+}} साइटोक्रोम ए पर{{sub|3}} हीम समूह और एक घटा हुआ घन{{sub|B}}{{sup|+}} द्विनाभिक केंद्र, एंजाइम की निष्क्रिय या विश्राम अवस्था माना जाता है।<ref name="pmid17906319">{{cite journal | vauthors = Leavesley HB, Li L, Prabhakaran K, Borowitz JL, Isom GE | title = Interaction of cyanide and nitric oxide with cytochrome c oxidase: implications for acute cyanide toxicity | journal = Toxicological Sciences | volume = 101 | issue = 1 | pages = 101–11 | date = January 2008 | pmid = 17906319 | doi = 10.1093/toxsci/kfm254 | doi-access = free }}</ref> | ||
== निषेध == | == निषेध == | ||
COX तीन गठनात्मक अवस्थाओं में | COX तीन गठनात्मक अवस्थाओं में उपस्थित है: पूरी तरह से ऑक्सीकृत (स्पंदित), आंशिक रूप से कम, और पूरी तरह से अपचयित। प्रत्येक अवरोधक का एक अलग अवस्था के लिए एक उच्च संबंध है। स्पंदित अवस्था में, हीम a<sub>3</sub> औरCu<sub>B</sub> परमाणु केंद्र दोनों ऑक्सीकृत होते हैं; यह उच्चतम गतिविधि वाले एंजाइम की रचना है,जिसकी क्रियाशीलता सबसे अधिक है। एक दो-इलेक्ट्रॉन अपचयन एक गठनात्मक परिवर्तन शुरू करती है जो ऑक्सीजन को आंशिक रूप से कम एंजाइम को सक्रिय स्थल पर बाँधने की अनुमति देती है। एंजाइम को पूरी तरह से कम करने के लिए चार इलेक्ट्रॉन COX से जुड़ते हैं। इसकी पूरी तरह से अपचयित अवस्था, जिसमें साइटोक्रोम a<sub>3</sub> हीम समूह में एक अपचयित Fe<sup>2+</sup> और एक अपचयितCu<sub>B</sub><sup>+</sup> द्विनाभिक केंद्र सम्मिलित है, को एंजाइम की निष्क्रिय या आराम की अवस्था माना जाता है। [[साइनाइड]], [[अब्द|एजाइड]] और [[कार्बन मोनोआक्साइड]]<ref name="pmid12969439">{{cite journal | vauthors = Alonso JR, Cardellach F, López S, Casademont J, Miró O | title = Carbon monoxide specifically inhibits cytochrome c oxidase of human mitochondrial respiratory chain | journal = Pharmacology & Toxicology | volume = 93 | issue = 3 | pages = 142–6 | date = September 2003 | pmid = 12969439 | doi = 10.1034/j.1600-0773.2003.930306.x }}</ref> सभी साइटोक्रोम सी ऑक्सीडेज से बंधते हैं, प्रोटीन को कार्य करने से रोकते हैं और कोशिकाओं के रासायनिक श्वासावरोध की ओर ले जाते हैं। अवरोधक सांद्रता में वृद्धि के लिए क्षतिपूर्ति करने के लिए आणविक ऑक्सीजन की उच्च सांद्रता की आवश्यकता होती है, जिससे अवरोधक की उपस्थिति में सेल में चयापचय गतिविधि में समग्र कमी आती है। अन्य लिगेंड, जैसे नाइट्रिक ऑक्साइड और हाइड्रोजन सल्फाइड, एंजाइम पर नियामक स्थलो को बाध्य करके COX को रोक सकते हैं, कोशिकीय श्वसन की दर को कम कर सकते हैं।<ref name="pmid24059525">{{cite journal | vauthors = Nicholls P, Marshall DC, Cooper CE, Wilson MT | s2cid = 11554252 | title = Sulfide inhibition of and metabolism by cytochrome c oxidase | journal = Biochemical Society Transactions | volume = 41 | issue = 5 | pages = 1312–6 | date = October 2013 | pmid = 24059525 | doi = 10.1042/BST20130070 }}</ref> | ||
साइनाइड COX के लिए एक गैर-प्रतिस्पर्धी अवरोधक है,<ref>{{Cite book|url=https://books.google.com/books?id=HHaDGynAz1EC&q=cyanide+cytochrome+competitive&pg=PA130|title=Advanced Biology|last1=Roberts|first1=Michael|last2=Reiss|first2=Michael Jonathan|last3=Monger|first3=Grace|name-list-style=vanc|date=2000|publisher=Nelson Thornes|isbn=9780174387329|language=en|access-date=2020-10-25|archive-date=2022-02-24|archive-url=https://web.archive.org/web/20220224105346/https://books.google.com/books?id=HHaDGynAz1EC&q=cyanide+cytochrome+competitive&pg=PA130|url-status=live}}</ref><ref>{{Cite book|url=https://books.google.com/books?id=ASADBUVAiDUC&q=cyanide+cytochrome+competitive&pg=PA92|title=Biology: A Functional Approach|vauthors=Roberts MB|date=1986|publisher=Nelson Thornes|isbn=9780174480198|language=en|access-date=2020-10-25|archive-date=2022-02-24|archive-url=https://web.archive.org/web/20220224105345/https://books.google.com/books?id=ASADBUVAiDUC&q=cyanide+cytochrome+competitive&pg=PA92|url-status=live}}</ref> एंजाइम की आंशिक रूप से अपचयित स्थिति के लिए उच्च | साइनाइड COX के लिए एक गैर-प्रतिस्पर्धी अवरोधक है,<ref>{{Cite book|url=https://books.google.com/books?id=HHaDGynAz1EC&q=cyanide+cytochrome+competitive&pg=PA130|title=Advanced Biology|last1=Roberts|first1=Michael|last2=Reiss|first2=Michael Jonathan|last3=Monger|first3=Grace|name-list-style=vanc|date=2000|publisher=Nelson Thornes|isbn=9780174387329|language=en|access-date=2020-10-25|archive-date=2022-02-24|archive-url=https://web.archive.org/web/20220224105346/https://books.google.com/books?id=HHaDGynAz1EC&q=cyanide+cytochrome+competitive&pg=PA130|url-status=live}}</ref><ref>{{Cite book|url=https://books.google.com/books?id=ASADBUVAiDUC&q=cyanide+cytochrome+competitive&pg=PA92|title=Biology: A Functional Approach|vauthors=Roberts MB|date=1986|publisher=Nelson Thornes|isbn=9780174480198|language=en|access-date=2020-10-25|archive-date=2022-02-24|archive-url=https://web.archive.org/web/20220224105345/https://books.google.com/books?id=ASADBUVAiDUC&q=cyanide+cytochrome+competitive&pg=PA92|url-status=live}}</ref> एंजाइम की आंशिक रूप से अपचयित स्थिति के लिए उच्च बंधुता के साथ बाध्यकारी है और एंजाइम के और अपचयन को रोकता है। स्पंदित अवस्था में साइनाइड धीरे-धीरे ,लेकिन उच्च बंधुता के साथ बंधता है। लिगैंड को इलेक्ट्रोस्टैटिक रूप से दोनों धातुओं को एक ही बार में उनके बीच स्थित करके स्थिर करने के लिए प्रस्तुत किया जाता है। एक उच्च नाइट्रिक ऑक्साइड सांद्रता, जैसे कि एंजाइम में बहिर्जात रूप से जोड़ा गया, COX के साइनाइड निषेध को उलट देता है।<ref name="pmid1144519">{{cite journal | vauthors = Jensen P, Wilson MT, Aasa R, Malmström BG | title = Cyanide inhibition of cytochrome c oxidase. A rapid-freeze e.p.r. investigation | journal = The Biochemical Journal | volume = 224 | issue = 3 | pages = 829–37 | date = December 1984 | pmid = 6098268 | pmc = 1144519 | doi = 10.1042/bj2240829 }}</ref> | ||
नाइट्रिक ऑक्साइड द्विनाभिक केंद्र में किसी भी धातु आयन को नाइट्राइट में ऑक्सीकृत करने के लिए विपरीत रूप से बांध सकता है। NO और CN<sup>−</sup> | नाइट्रिक ऑक्साइड द्विनाभिक केंद्र में किसी भी धातु आयन को नाइट्राइट में ऑक्सीकृत करने के लिए विपरीत रूप से बांध सकता है। NO और CN<sup>−</sup> स्थल पर बाध्य करने के लिए ऑक्सीजन के साथ प्रतिस्पर्धा करेंगे, जिससे कोशिकीय श्वसन की दर कम होगी। अंतर्जात NO, यद्यपि, जो निचले स्तरों पर उत्पादित होता है, CN<sup>−</sup> निषेध को बढ़ाता है। NO का उच्च स्तर, जो अपचयित अवस्था में अधिक एंजाइम के अस्तित्व के साथ संबंध रखता है, साइनाइड के अधिक निषेध का कारण बनता है। इन आधारीय सांद्रता पर, जटिल IV के अवरोध को लाभकारी प्रभाव के लिए जाना जाता है, जैसे कि रक्त वाहिका के ऊतकों में ऑक्सीजन का स्तर बढ़ाना। जल में ऑक्सीजन को कम करने के लिए एंजाइम की अक्षमता के परिणामस्वरूप ऑक्सीजन का निर्माण होता है, जो आसपास के ऊतकों में गहराई तक फैल सकता है।<ref name="pmid19461104">{{cite journal | vauthors = Gladwin MT, Shiva S | title = The ligand binding battle at cytochrome c oxidase: how NO regulates oxygen gradients in tissue | journal = Circulation Research | volume = 104 | issue = 10 | pages = 1136–8 | date = May 2009 | pmid = 19461104 | doi = 10.1161/CIRCRESAHA.109.198911 | doi-access = free }}</ref> जटिल IV के NO निषेध का कम ऑक्सीजन सांद्रता पर बड़ा प्रभाव पड़ता है, जिससे ज़रूरत के ऊतकों में वाहिकाविस्फारक के रूप में इसकी उपयोगिता बढ़ जाती है।<ref name="pmid19461104" /> | ||
[[हाइड्रोजन सल्फाइड]] कार्बन मोनोऑक्साइड के समान एंजाइम पर एक नियामक | [[हाइड्रोजन सल्फाइड]] कार्बन मोनोऑक्साइड के समान एंजाइम पर एक नियामक स्थल पर एक गैर-प्रतिस्पर्धी आचरण में COX को बांध देगा। सल्फाइड में एंजाइम के स्पंदित या आंशिक रूप से अपचयित होने वाले अवस्थाओं के लिए उच्चतम संबंध है, और हीम ए{{sub|3}}केंद्र पर एंजाइम को आंशिक रूप से अपचयित करने में सक्षम है। यह स्पष्ट नहीं है कि अंतर्जात H<sub>2</sub>S स्तर एंजाइम को बाधित करने के लिए पर्याप्त हैं। हाइड्रोजन सल्फाइड और सीओएक्स की पूरी तरह से अपचयित संरचना के बीच कोई पारस्परिक क्रिया नहीं है।<ref name="pmid24059525" /> | ||
मिथाइलेटेड स्पिरिट में मेथनॉल फॉर्मिक एसिड में परिवर्तित हो जाता है, जो उसी ऑक्सीडेज प्रणाली को भी रोकता है। एटीपी के उच्च स्तर माइटोकॉन्ड्रियल | मिथाइलेटेड स्पिरिट में मेथनॉल फॉर्मिक एसिड में परिवर्तित हो जाता है, जो उसी ऑक्सीडेज प्रणाली को भी रोकता है। एटीपी के उच्च स्तर माइटोकॉन्ड्रियल परिवेश के भीतर से बाध्यकारी, साइटोक्रोम सी ऑक्सीडेज को पूरी तरह से रोक सकते हैं।<ref name="pmid9363790">{{cite journal |vauthors=Arnold S, Kadenbach B | title = Cell respiration s controlled by ATP, an allosteric inhibitor of cytochrome-c oxidase. | journal = Eur J Biochem | pages = 350–354| date = October 1997 | doi = 10.1111/j.1432-1033.1997.t01-1-00350.x | pmid = 9363790 | volume=249| issue = 1 }}</ref> | ||
== | ==अतिरिक्तमाइटोकोंड्रियल और उपकोशिकीय स्थानीयकरण == | ||
[[File:Map of the human mitochondrial genome.svg|thumb|320px|मानव माइटोकॉन्ड्रियल जीनोम में 3 साइटोक्रोम सी ऑक्सीडेज उपइकाई जीन का स्थान: [[मीट्रिक टन-CO1]], [[पदधारी]], और [[मीट्रिक टन-CO3]] (नारंगी बक्से)।]]साइटोक्रोम सी ऑक्सीडेज में 3 उप इकाई हैं जो माइटोकॉन्ड्रियल डीएनए (साइटोक्रोम सी ऑक्सीडेज उप इकाई I, उप इकाई II और उप इकाई III) द्वारा कूटलेखन किए गए हैं। माइटोकॉन्ड्रियल डीएनए द्वारा कूटलेखन किए गए इन 3 उप इकाई में से दो की पहचान | [[File:Map of the human mitochondrial genome.svg|thumb|320px|मानव माइटोकॉन्ड्रियल जीनोम में 3 साइटोक्रोम सी ऑक्सीडेज उपइकाई जीन का स्थान: [[मीट्रिक टन-CO1]], [[पदधारी]], और [[मीट्रिक टन-CO3]] (नारंगी बक्से)।]]साइटोक्रोम सी ऑक्सीडेज में 3 उप इकाई हैं जो माइटोकॉन्ड्रियल डीएनए (साइटोक्रोम सी ऑक्सीडेज उप इकाई I, उप इकाई II और उप इकाई III) द्वारा कूटलेखन किए गए हैं। माइटोकॉन्ड्रियल डीएनए द्वारा कूटलेखन किए गए इन 3 उप इकाई में से दो की पहचान अतिरिक्तमाइटोकॉन्ड्रियल स्थानों में की गई है। अग्नाशयी संगोष्ठी ऊतक में, ये उप इकाई ज़ाइमोजेन कणिकाओं में पाए गए। इसके अतिरिक्त, पूर्वकाल पिट्यूटरी में, इन उप इकाई की अपेक्षाकृत उच्च मात्रा में वृद्धि हार्मोन स्रावी कणिकाओं में पाई गई। इन साइटोक्रोम सी ऑक्सीडेज उप इकाई के अतिरिक्तमाइटोकॉन्ड्रियल कार्य को अभी तक विशेषता नहीं दी गई है। साइटोक्रोम सी ऑक्सीडेज उप इकाई के अलावा, अन्य माइटोकॉन्ड्रियल प्रोटीनों की बड़ी संख्या के लिए अतिरिक्तमाइटोकॉन्ड्रियल स्थानीयकरण भी देखा गया है। यह माइटोकॉन्ड्रिया से अन्य कोशिकीय अभिप्राय तक प्रोटीन स्थानांतरण के लिए अभी तक अज्ञात विशिष्ट तंत्र के अस्तित्व की संभावना को बढ़ाता है।<ref name="Sadacharan">{{cite journal | vauthors = Sadacharan SK, Singh B, Bowes T, Gupta RS | title = Localization of mitochondrial DNA encoded cytochrome c oxidase subunits I and II in rat pancreatic zymogen granules and pituitary growth hormone granules | journal = Histochemistry and Cell Biology | volume = 124 | issue = 5 | pages = 409–21 | date = November 2005 | pmid = 16133117 | doi = 10.1007/s00418-005-0056-2 | s2cid = 24440427 }}</ref><ref name="Soltysb">{{cite journal | vauthors = Soltys BJ, Gupta RS | title = Mitochondrial proteins at unexpected cellular locations: export of proteins from mitochondria from an evolutionary perspective | journal = International Review of Cytology | volume = 194 | pages = 133–96 | year = 1999 | pmid = 10494626 | doi = 10.1016/S0074-7696(08)62396-7 | isbn = 9780123645982 }}</ref><ref>{{cite journal | vauthors = Soltys BJ, Gupta RS | title = Mitochondrial-matrix proteins at unexpected locations: are they exported? | journal = Trends in Biochemical Sciences | volume = 24 | issue = 5 | pages = 174–7 | date = May 1999 | pmid = 10322429 | doi = 10.1016/s0968-0004(99)01390-0 }}</ref> | ||
==आनुवंशिक दोष और विकार== | ==आनुवंशिक दोष और विकार== | ||
साइटोक्रोम सी ऑक्सीडेज (सीओएक्स) की कार्यक्षमता या संरचना को बदलने वाले आनुवंशिक उत्परिवर्तनों से जुड़े दोषों के परिणामस्वरूप गंभीर, अक्सर घातक चयापचय संबंधी विकार हो सकते हैं। इस तरह के विकार | साइटोक्रोम सी ऑक्सीडेज (सीओएक्स) की कार्यक्षमता या संरचना को बदलने वाले आनुवंशिक उत्परिवर्तनों से जुड़े दोषों के परिणामस्वरूप गंभीर, अक्सर घातक चयापचय संबंधी विकार हो सकते हैं। इस तरह के विकार सामान्यतः बचपन में प्रकट होते हैं और मुख्य रूप से उच्च ऊर्जा की मांग वाले ऊतकों (मस्तिष्क, हृदय, मांसपेशियों) को प्रभावित करते हैं। कई वर्गीकृत माइटोकॉन्ड्रियल बीमारियों में से, निष्क्रिय COX समन्वायोजन को सम्मिलित करने वालों को सबसे गंभीर माना जाता है।<ref name="pmid15119951">{{cite journal | vauthors = Pecina P, Houstková H, Hansíková H, Zeman J, Houstek J | title = Genetic defects of cytochrome c oxidase assembly | journal = Physiological Research | volume = 53 Suppl 1 | pages = S213-23 | year = 2004 | pmid = 15119951 | url = http://www.biomed.cas.cz/physiolres/pdf/53%20Suppl%201/53_S213.pdf | access-date = 2010-11-17 | archive-date = 2011-07-18 | archive-url = https://web.archive.org/web/20110718170246/http://www.biomed.cas.cz/physiolres/pdf/53%20Suppl%201/53_S213.pdf | url-status = live }}</ref> | ||
COX विकारों के विशाल बहुमत परमाणु-कूटबद्ध प्रोटीन में उत्परिवर्तन से जुड़े होते हैं जिन्हें समन्वायोजन कारक या समन्वायोजन प्रोटीन कहा जाता है। ये समन्वायोजन कारक COX संरचना और कार्यक्षमता में योगदान करते हैं, और कई आवश्यक प्रक्रियाओं में सम्मिलित होते हैं, जिनमें माइटोकॉन्ड्रियन-कूटबद्ध उप इकाई का प्रतिलेख और स्थानान्तरण, प्रीप्रोटीन का प्रसंस्करण और झिल्ली सम्मिलन,और सहकारक जैवसंश्लेषण और निगमन सम्मिलित हैं।<ref name="pmid17215873">{{cite journal | vauthors = Zee JM, Glerum DM | title = Defects in cytochrome oxidase assembly in humans: lessons from yeast | journal = Biochemistry and Cell Biology | volume = 84 | issue = 6 | pages = 859–69 | date = December 2006 | pmid = 17215873 | doi = 10.1139/o06-201 }}</ref> | |||
वर्तमान में, सात COX | वर्तमान में, सात COX समन्वायोजन कारकों में उत्परिवर्तन की पहचान की गई है: [[SURF1]], [[SCO1]], [[SCO2]], [[COX10]], [[COX15]], [[COX20]], [[COA5]] और [[LRPPRC]]। इन प्रोटीनों में उत्परिवर्तन के परिणामस्वरूप सब- जटिल समन्वायोजन, कॉपर अभिगम या स्थानांतरीय विनियम की कार्यक्षमता बदल सकती है। प्रत्येक जीन उत्परिवर्तन एक विशिष्ट बीमारी के हेतुविज्ञान से जुड़ा होता है, जिसमें कुछ का कई विकारों में प्रभाव होता है। जीन उत्परिवर्तन के माध्यम से शिथिल COX समन्वायोजन से जुड़े विकारों में [[लेह सिंड्रोम]], [[कार्डियोमायोपैथी]], [[ल्यूकोडिस्ट्रॉफी]], [[रक्ताल्पता]] और [[सेंसरिनुरल बहरापन]] सम्मिलित हैं। | ||
== हिस्टोकेमिस्ट्री == | == हिस्टोकेमिस्ट्री == | ||
ऊर्जा के लिए ऑक्सीडेटिव फास्फारिलीकरण पर न्यूरॉन्स की बढ़ती निर्भरता<ref name = "pmid24032355">{{cite journal | vauthors = Johar K, Priya A, Dhar S, Liu Q, Wong-Riley MT | title = Neuron-specific specificity protein 4 bigenomically regulates the transcription of all mitochondria- and nucleus-encoded cytochrome c oxidase subunit genes in neurons | journal = Journal of Neurochemistry | volume = 127 | issue = 4 | pages = 496–508 | date = November 2013 | pmid = 24032355 | pmc = 3820366 | doi = 10.1111/jnc.12433 }}</ref> जानवरों में क्षेत्रीय मस्तिष्क चयापचय की | ऊर्जा के लिए ऑक्सीडेटिव फास्फारिलीकरण पर न्यूरॉन्स की बढ़ती निर्भरता<ref name = "pmid24032355">{{cite journal | vauthors = Johar K, Priya A, Dhar S, Liu Q, Wong-Riley MT | title = Neuron-specific specificity protein 4 bigenomically regulates the transcription of all mitochondria- and nucleus-encoded cytochrome c oxidase subunit genes in neurons | journal = Journal of Neurochemistry | volume = 127 | issue = 4 | pages = 496–508 | date = November 2013 | pmid = 24032355 | pmc = 3820366 | doi = 10.1111/jnc.12433 }}</ref> जानवरों में क्षेत्रीय मस्तिष्क चयापचय की प्रति चित्रण में COX हिस्टोकेमिस्ट्री के उपयोग की सुविधा देता है, क्योंकि यह एंजाइम गतिविधि और तंत्रिका गतिविधि के बीच प्रत्यक्ष और सकारात्मक संबंध स्थापित करता है।<ref name="pmid:2469224">{{cite journal | vauthors = Wong-Riley MT | title = Cytochrome oxidase: an endogenous metabolic marker for neuronal activity | journal = Trends in Neurosciences | volume = 12 | issue = 3 | pages = 94–101 | date = March 1989 | pmid = 2469224 | doi = 10.1016/0166-2236(89)90165-3 | s2cid = 42996304 }}</ref> यह COX एंजाइम मात्राऔर गतिविधि के बीच संबंध में देखा जा सकता है, जो जीन अभिव्यक्ति के स्तर पर COX के नियमन को इंगित करता है। COX वितरण पशु मस्तिष्क के विभिन्न क्षेत्रों में असंगत है, लेकिन इसके वितरण का तरीका जानवरों के अनुरूप है। यह तरीका बंदर, चूहे और बछड़े के मस्तिष्क में देखा गया है। मस्तिष्क के हिस्टोकेमिकल विश्लेषण में COX के एक आइसोजाइम का लगातार पता लगाया गया है।<ref name = "pmid2555458">{{cite journal | vauthors = Hevner RF, Wong-Riley MT | title = Brain cytochrome oxidase: purification, antibody production, and immunohistochemical/histochemical correlations in the CNS | journal = The Journal of Neuroscience | volume = 9 | issue = 11 | pages = 3884–98 | date = November 1989 | pmid = 2555458 | pmc = 6569932 | doi=10.1523/jneurosci.09-11-03884.1989}}</ref> इस तरह मस्तिष्क के प्रतिचित्रण को अनुमस्तिष्क रोग जैसे रीलर और अल्जाइमर रोग के पराजीनी नमूने के साथ सहज उत्परिवर्ती चूहों में पूरा किया गया है।<ref name="pmid:12732258">{{cite journal | vauthors = Strazielle C, Sturchler-Pierrat C, Staufenbiel M, Lalonde R | title = Regional brain cytochrome oxidase activity in beta-amyloid precursor protein transgenic mice with the Swedish mutation | journal = Neuroscience | volume = 118 | issue = 4 | pages = 1151–63 | year = 2003 | pmid = 12732258 | doi = 10.1016/S0306-4522(03)00037-X | s2cid = 9366458 }}</ref> इस तकनीक का उपयोग पशु मस्तिष्क में सीखने की गतिविधि को प्रतिचित्रण करने के लिए भी किया गया है।<ref name="pmid:19969098">{{cite journal | vauthors = Conejo NM, González-Pardo H, Gonzalez-Lima F, Arias JL | title = Spatial learning of the water maze: progression of brain circuits mapped with cytochrome oxidase histochemistry | journal = Neurobiology of Learning and Memory | volume = 93 | issue = 3 | pages = 362–71 | date = March 2010 | pmid = 19969098 | doi = 10.1016/j.nlm.2009.12.002 | s2cid = 24271956 }}</ref> | ||
== अतिरिक्त छवियां == | == अतिरिक्त छवियां == | ||
<gallery> | <gallery> | ||
| Line 327: | Line 339: | ||
{{Authority control}} | {{Authority control}} | ||
{{DEFAULTSORT:Cytochrome C Oxidase}} | {{DEFAULTSORT:Cytochrome C Oxidase}} | ||
[[Category: | [[Category:Articles to be expanded from December 2021|Cytochrome C Oxidase]] | ||
[[Category:Created On 08/02/2023]] | [[Category:CS1|Cytochrome C Oxidase]] | ||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Collapse templates|Cytochrome C Oxidase]] | |||
[[Category:Created On 08/02/2023|Cytochrome C Oxidase]] | |||
[[Category:Machine Translated Page|Cytochrome C Oxidase]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists|Cytochrome C Oxidase]] | |||
[[Category:Pages using infobox enzyme with unknown parameters|IUBMB_EC_numberसाइटोक्रोम सी ऑक्सीडेज]] | |||
[[Category:Pages with reference errors|Cytochrome C Oxidase]] | |||
[[Category:Pages with script errors|Cytochrome C Oxidase]] | |||
[[Category:Sidebars with styles needing conversion|Cytochrome C Oxidase]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready|Cytochrome C Oxidase]] | |||
[[Category:Templates generating microformats|Cytochrome C Oxidase]] | |||
[[Category:Templates that are not mobile friendly|Cytochrome C Oxidase]] | |||
[[Category:Templates using TemplateData|Cytochrome C Oxidase]] | |||
[[Category:Wikipedia metatemplates|Cytochrome C Oxidase]] | |||
[[Category:अभिन्न झिल्ली प्रोटीन|Cytochrome C Oxidase]] | |||
[[Category:ईसी 1.9.3|Cytochrome C Oxidase]] | |||
[[Category:कॉपर एंजाइम|Cytochrome C Oxidase]] | |||
[[Category:कोशिकीय श्वसन|Cytochrome C Oxidase]] | |||
[[Category:हेमोप्रोटीन|Cytochrome C Oxidase]] | |||
Latest revision as of 13:18, 1 May 2023
एंजाइम साइटोक्रोम सी ऑक्सीडेज या जटिल IV, (ईसी 1.9.3.1 था, जिसे अब ट्रांसलोकेस ईसी 7.1.1.9 के रूप में पुनर्वर्गीकृत किया गया है) सुकेंद्रक के बैक्टीरिया, आर्किया और माइटोकॉन्ड्रिया में पाया जाने वाला एक बड़ा पारपक्षझिल्ली प्रोटीन जटिल है
यह झिल्ली में स्थित कोशिकाओं की श्वसन इलेक्ट्रॉनअभिगमनश्रृंखला का अंतिम एंजाइम है। यह चार साइटोक्रोम सी अणुओं में से प्रत्येक से एक इलेक्ट्रॉन प्राप्त करता है और उन्हें एक ऑक्सीजन अणु और चार प्रोटॉन में स्थानांतरित करता है, जिससे जल के दो अणु बनते हैं। आंतरिक जलीय चरण से चार प्रोटॉन को बांधने के अलावा, यह झिल्ली के पार दूसरे और चार प्रोटॉन को स्थानांतरित करता है, जो प्रोटॉन विद्युत रासायनिक क्षमता के पारपक्षझिल्ली अंतर को बढ़ाता है, जिसे एटीपी संश्लेषण ,तब एटीपी को संश्लेषित करने के लिए उपयोग करता है।
| साइटोक्रोम सी ऑक्सीडेज | |||||||||
|---|---|---|---|---|---|---|---|---|---|
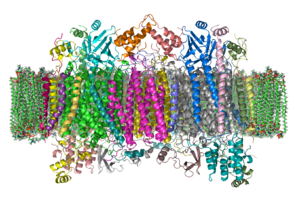 | |||||||||
| Identifiers | |||||||||
| EC no. | 1.9.3.1 | ||||||||
| Databases | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / QuickGO | ||||||||
| |||||||||
संरचना
जटिल
जटिल एक बड़ा पूर्ण झिल्ली प्रोटीन है जो कई धातु कृत्रिम स्थानो और स्तनधारियों में 14 प्रोटीन उप इकाई से बना है। स्तनधारियों में, ग्यारह उप इकाई मूल रूप से परमाणु होते हैं, और तीन माइटोकॉन्ड्रिया में संश्लेषित होते हैं। परिसर में दो हीम, एक साइटोक्रोम A और साइटोक्रोम A3, और दो तांबे के केंद्र, CuA और CuB केंद्र सम्मिलित हैं। वास्तव में, साइटोक्रोम a3 और CuB एक द्विनाभिक केंद्र बनाते हैं जो ऑक्सीजन के अपचयन का स्थल है। साइटोक्रोम सी, जो श्वसन श्रृंखला के पूर्ववर्ती घटक (साइटोक्रोम बीसी1 जटिल III) द्वारा अपचयित किया जाता है, CuA द्विनाभिकीय केंद्र के पास संक्षिप्त करता है और इसे एक इलेक्ट्रॉन पास करता है, Fe3+ युक्त साइटोक्रोम c में वापस ऑक्सीकृत हो जाता है। अपचयित CuA द्विनाभिक केंद्र अब एक इलेक्ट्रॉन को साइटोक्रोम a पर भेजता है, जो बदले में एक इलेक्ट्रॉन को साइटोक्रोम a3>-CuB द्विनाभिक केंद्र पर भेजता है। इस द्विनाभिक केंद्र में दो धातु आयन 4.5 Å अलग हैं और पूरी तरह से ऑक्सीकृत अवस्था में एक हाइड्रॉक्साइड आयन का समन्वय करते हैं।
साइटोक्रोम सी ऑक्सीडेज के क्रिस्टललेखीय अध्ययन एक असामान्य स्थानान्तरण के बाद सुधार दिखाते हैं, Tyr (244) के C6 और His (240) (गोजातीय एंजाइम अंकन)के ε-N को जोड़ते हैं। यह आणविक ऑक्सीजन और चार प्रोटॉन को जल में अपचयित करने में चार इलेक्ट्रॉनों को स्वीकार करने के लिए साइटोक्रोम a3- CuB द्विनाभिक केंद्र को सक्षम करने में महत्वपूर्ण भूमिका निभाता है। कमी के तंत्र में पूर्व में एक परऑक्साइड मध्यवर्ती सम्मिलित करने के लिए सोचा गया था, जिसके बारे में माना जाता था कि इससे सुपरऑक्साइड का उत्पादन होता है। यद्यपि, वर्तमान में स्वीकृत तंत्र में तेजी से चार-इलेक्ट्रॉन कमी सम्मिलित है, जिसमें तत्काल ऑक्सीजन-ऑक्सीजन बंधन दरार सम्मिलित है, जिससे सुपरऑक्साइड बनाने की किसी भी मध्यवर्ती संभावना से बचा जा सकता है।
संरक्षित उप इकाईयाँ
| No. | Subunit name | Human protein | Protein description from UniProt | Pfam family with Human protein |
|---|---|---|---|---|
| 1 | Cox1 | COX1_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 1 | Pfam PF00115 |
| 2 | Cox2 | COX2_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 2 | Pfam PF02790, Pfam PF00116 |
| 3 | Cox3 | COX3_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 3 | Pfam PF00510 |
| 4 | Cox4i1 | COX41_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 4 आइसोफॉर्म 1, माइटोकॉन्ड्रियल | Pfam PF02936 |
| 5 | Cox4a2 | COX42_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 4 आइसोफॉर्म 2, माइटोकॉन्ड्रियल | Pfam PF02936 |
| 6 | Cox5a | COX5A_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 5ए, माइटोकॉन्ड्रियल | Pfam PF02284 |
| 7 | Cox5b | COX5B_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 5बी, माइटोकॉन्ड्रियल | Pfam PF01215 |
| 8 | Cox6a1 | CX6A1_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 6A1, माइटोकॉन्ड्रियल | Pfam PF02046 |
| 9 | Cox6a2 | CX6A2_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 6A2, माइटोकॉन्ड्रियल | Pfam PF02046 |
| 10 | Cox6b1 | CX6B1_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 6बी1 | Pfam PF02297 |
| 11 | Cox6b2 | CX6B2_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 6B2 | Pfam PF02297 |
| 12 | Cox6c | COX6C_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 6सी | Pfam PF02937 |
| 13 | Cox7a1 | CX7A1_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7ए1, माइटोकॉन्ड्रियल | Pfam PF02238 |
| 14 | Cox7a2 | CX7A2_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7A2, माइटोकॉन्ड्रियल | Pfam PF02238 |
| 15 | Cox7a3 | COX7S_HUMAN | पुटेटिव साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7A3, माइटोकॉन्ड्रियल | Pfam PF02238 |
| 16 | Cox7b | COX7B_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7बी, माइटोकॉन्ड्रियल | Pfam PF05392 |
| 17 | Cox7c | COX7C_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7सी, माइटोकॉन्ड्रियल | Pfam PF02935 |
| 18 | Cox7r | COX7R_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 7ए-संबंधित प्रोटीन, माइटोकॉन्ड्रियल | Pfam PF02238 |
| 19 | Cox8a | COX8A_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 8ए, माइटोकॉन्ड्रियल पी | Pfam PF02285 |
| 20 | Cox8c | COX8C_HUMAN | साइटोक्रोम सी ऑक्सीडेज सबयूनिट 8सी, माइटोकॉन्ड्रियल | Pfam PF02285 |
| समन्वायोजन उप इकाईयाँ | ||||
| 1 | Coa1 | COA1_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 1 होमोलॉग | Pfam PF08695 |
| 2 | Coa3 | COA3_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 3 होमोलॉग, माइटोकॉन्ड्रियल | Pfam PF09813 |
| 3 | Coa4 | COA4_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 4 होमोलॉग, माइटोकॉन्ड्रियल | Pfam PF06747 |
| 4 | Coa5 | COA5_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 5 | Pfam PF10203 |
| 5 | Coa6 | COA6_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 6 होमोलॉग | Pfam PF02297 |
| 6 | Coa7 | COA7_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन फैक्टर 7 | Pfam PF08238 |
| 7 | Cox11 | COX11_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX11 माइटोकॉन्ड्रियल | Pfam PF04442 |
| 8 | Cox14 | COX14_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन | Pfam PF14880 |
| 9 | Cox15 | COX15_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX15 होमोलॉग | Pfam PF02628 |
| 10 | Cox16 | COX16_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन COX16 होमोलॉग माइटोकॉन्ड्रियल | Pfam PF14138 |
| 11 | Cox17 | COX17_HUMAN | साइटोक्रोम सी ऑक्सीडेज कॉपर चैपरोन | Pfam PF05051 |
| 12 | Cox18 | COX18_HUMAN | माइटोकॉन्ड्रियल आंतरिक झिल्ली प्रोटीन (साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन 18) | Pfam PF02096 |
| 13 | Cox19 | COX19_HUMAN | साइटोक्रोम सी ऑक्सीडेज समन्वायोजन प्रोटीन | Pfam PF06747 |
| 14 | Cox20 | COX20_HUMAN | साइटोक्रोम सी ऑक्सीडेज प्रोटीन 20 होमोलॉग | Pfam PF12597 |
समन्वायोजन
| साइटोक्रोम सी ऑक्सीडेज | |
|---|---|
 | |
| Identifiers | |
| Symbol | साइटोक्रोम सी ऑक्सीडेज |
| OPM superfamily | 4 |
| OPM protein | 2dyr |
| Membranome | 257 |
यीस्ट में COX समन्वायोजन एक जटिल प्रक्रिया है जिसे जलविरोधी उप इकाई के तीव्र और अपरिवर्तनीय एकत्रीकरण के कारण पूरी तरह से समझा नहीं जा सका है जो होलोनीजाइम जटिल बनाते हैं, साथ ही अनावृत जलविरोधी टुकड़े के साथ उत्परिवर्ती उप इकाई का एकत्रीकरण करते है।[1] COX उपइकाइयां परमाणु और माइटोकॉन्ड्रियल जीनोम दोनों में कूटबद्ध हैं। COX उप्प्रेरणात्मक अंतर्भाग बनाने वाली तीन उपइकाई माइटोकॉन्ड्रियल जीनोम में कूटबद्ध हैं।
हेम्स और सहकारक को उपइकाई I और II में डाला जाता है। दो हीम अणु उपइकाई I में रहते हैं, उपइकाई II मेंअभिगमनमें मदद करते हैं जहां दो तांबे के अणु इलेक्ट्रॉनों के निरंतर हस्तांतरण में सहायता करते हैं।[2] उपइकाई I और IV समन्वायोजन आरंभ करते हैं। अलग-अलग उप इकाई उप - जटिल मध्यवर्ती बनाने के लिए संबद्ध हो सकते हैं जो बाद में COX जटिल बनाने के लिए अन्य उप इकाई से जुड़ जाते हैं।[1] समन्वायोजन के बाद के संशोधनों में, COX एक होमोडीमर बनाएगा। यह गतिविधि के लिए आवश्यक है। डिमर्स एक कार्डियोलिपिन अणु से जुड़े होते हैं,[1][3][4] जो होलोनीजाइम जटिल के स्थिरीकरण में महत्वपूर्ण भूमिका निभाते पाए गए हैं। उप इकाई VIIa और III के पृथक्करण के साथ-साथ कार्डियोलिपिन को हटाने से एंजाइम गतिविधि का पूर्ण नुकसान होता है।[4] परमाणु जीनोम में कूटबद्ध उप इकाई को एंजाइम डाइमराइजेशन और स्थिरता में भूमिका निभाने के लिए जाना जाता है। इन उप इकाई के उत्परिवर्तन COXकार्य को समाप्त कर देते हैं।[1]
समन्वायोजन को कम से कम तीन अलग-अलग दर-निर्धारण चरणों में जाना जाता है। इन चरणों के उत्पाद पाए गए हैं, यद्यपि विशिष्ट उपइकाई संयोजन निर्धारित नहीं किए गए हैं।[1]
COX उप इकाई I, II, और III के संश्लेषण और समन्वायोजन को स्थानांतरीय सक्रियक द्वारा सुगम बनाया जाता है, जो माइटोकॉन्ड्रियल mRNA प्रतिलिपि के 5' बिना स्थानान्तरण वाले क्षेत्रों के साथ परस्पर क्रिया करते हैं। स्थानांतरीय सक्रियक नाभिक में कूटबद्ध हैं। वे स्थानान्तरण तंत्र के अन्य घटकों के साथ प्रत्यक्ष या अप्रत्यक्ष परस्परक्रिया के माध्यम से काम कर सकते हैं, लेकिन इन-विट्रो में स्थानान्तरण तंत्र को संश्लेषित करने से जुड़ी कठिनाइयों के कारण सटीक आणविक तंत्र स्पष्ट नहीं हैं।[5][6] यद्यपि माइटोकॉन्ड्रियल जीनोम के भीतर कूटबद्ध किए गए उपइकाई I, II और III के बीच की परस्परक्रिया, द्विजीनोमिक उप इकाई के बीच की परस्पर क्रिया की तुलना में एंजाइम स्थिरता में कम योगदान देती है, ये उप इकाई अधिक संरक्षित हैं, जो एंजाइम गतिविधि के लिए संभावित अस्पष्टीकृत भूमिकाओं का संकेत देती हैं।[7]
जैव रसायन
This section is missing information about इस खंड में छह पारंपरिक मध्यवर्ती अवस्था (APFOER) के नामों के बारे में जानकारी नहीं है; 2021 साइरो-ईएम परिणाम रेड-ऑक्स चरणों के उलट असाइनमेंट के साथ एक आरपीएफओई तंत्र का प्रस्ताव (doi:10.1038/s41467-021-27174-y ओपन एक्सेस)। कृपया इस जानकारी को सम्मिलित करने के लिए अनुभाग का विस्तार करें। अधिक विवरण वार्ता पृष्ठ पर उपस्थित हो सकते हैं। (दिसंबर 2021). (December 2021) |
समग्र अभिक्रिया है
- 4 Fe2+ - साइटोक्रोम सी + 4H+ + O2→ 4 Fe3+ - साइटोक्रोम सी + 2 H2O ΔfGo'' = - 218 केजे/मोल
दो इलेक्ट्रॉन दो साइटोक्रोम c's से,CuA और साइटोक्रोम a स्थानो के माध्यम से साइटोक्रोम a3–CuB द्विनाभिक केंद्र में पारित किए जाते हैं,जो धातुओं को Fe2+ रूप और Cu+में अपचयित कर देते हैं।हाइड्रॉक्साइड लिगैंड प्रोटोनेटेड होता है और जल के रूप में खो जाता है, जिससे धातुओं के बीच एक शून्य पैदा हो जाता है जो O2 से भर जाता है। Fe2+साइटोक्रोम a3 से आने वाले दो इलेक्ट्रॉनों के साथ, ऑक्सीजन तेजी से अपचयित हो जाते हैं जो फेरिल ऑक्सो फॉर्म (Fe4+=O) में परिवर्तित हो जाती है। CuBके करीब का ऑक्सीजन परमाणु Cu+ से एक इलेक्ट्रॉन, और एक दूसरा इलेक्ट्रॉन और Tyr(244) के हाइड्रॉक्सिल से एक प्रोटॉन लेता है, जो टायरोसिल रेडिकल बन जाता है। दूसरा ऑक्सीजन दो इलेक्ट्रॉनों और एक प्रोटॉन को लेकर एक हाइड्रॉक्साइड आयन में परिवर्तित हो जाता है। एक अन्य साइटोक्रोम c से एक तीसरा इलेक्ट्रॉन पहले दो इलेक्ट्रॉन वाहकों के माध्यम से साइटोक्रोम a3–CuB द्विनाभिक केंद्र में जाता है, और यह इलेक्ट्रॉन और दो प्रोटॉन टायरोसिल रेडिकल को वापस Tyr में परिवर्तित कर देते हैं, और CuB2+ से बंधे हाइड्रॉक्साइड को जल के अणु में बदल देते हैं। एक अन्य साइटोक्रोम c से चौथा इलेक्ट्रॉन CuAऔर साइटोक्रोम a के माध्यम से साइटोक्रोम a3–CuB द्विनाभिक केंद्र में प्रवाहित होता है, Fe4+=O को Fe3+ में अपचयित करता है, ऑक्सीजन परमाणु एक साथ एक प्रोटॉन उठाता है, इस ऑक्सीजन को हाइड्रॉक्साइड आयन के रूप में पुन: उत्पन्न करता है साइटोक्रोम a3–CuBकेंद्र के मध्य में जैसा कि इस चक्र की शुरुआत में था। कुल मिलाकर, चार अपचयित किए गए साइटोक्रोम सी का ऑक्सीकरण होता है जबकि O2 और चार प्रोटॉन दो जल के अणुओं में अपचयित हो जाते हैं।[8]: 841–5
निषेध
COX तीन गठनात्मक अवस्थाओं में मौजूद है: पूरी तरह से ऑक्सीकृत (स्पंदित), आंशिक रूप से कम, और पूरी तरह से कम। प्रत्येक अवरोधक का एक अलग राज्य के लिए एक उच्च संबंध है। स्पंदित अवस्था में दोनों हीम a3 और क्यूB परमाणु केंद्र ऑक्सीकृत होते हैं; यह उच्चतम गतिविधि वाले एंजाइम की रचना है। एक दो-इलेक्ट्रॉन कमी एक गठनात्मक परिवर्तन शुरू करती है जो ऑक्सीजन को आंशिक रूप से कम एंजाइम को सक्रिय साइट पर बाँधने की अनुमति देती है। एंजाइम को पूरी तरह से कम करने के लिए चार इलेक्ट्रॉन COX से जुड़ते हैं। इसकी पूरी तरह से कम अवस्था, जिसमें एक कम Fe होता है2+ साइटोक्रोम ए पर3 हीम समूह और एक घटा हुआ घनB+ द्विनाभिक केंद्र, एंजाइम की निष्क्रिय या विश्राम अवस्था माना जाता है।[9]
निषेध
COX तीन गठनात्मक अवस्थाओं में उपस्थित है: पूरी तरह से ऑक्सीकृत (स्पंदित), आंशिक रूप से कम, और पूरी तरह से अपचयित। प्रत्येक अवरोधक का एक अलग अवस्था के लिए एक उच्च संबंध है। स्पंदित अवस्था में, हीम a3 औरCuB परमाणु केंद्र दोनों ऑक्सीकृत होते हैं; यह उच्चतम गतिविधि वाले एंजाइम की रचना है,जिसकी क्रियाशीलता सबसे अधिक है। एक दो-इलेक्ट्रॉन अपचयन एक गठनात्मक परिवर्तन शुरू करती है जो ऑक्सीजन को आंशिक रूप से कम एंजाइम को सक्रिय स्थल पर बाँधने की अनुमति देती है। एंजाइम को पूरी तरह से कम करने के लिए चार इलेक्ट्रॉन COX से जुड़ते हैं। इसकी पूरी तरह से अपचयित अवस्था, जिसमें साइटोक्रोम a3 हीम समूह में एक अपचयित Fe2+ और एक अपचयितCuB+ द्विनाभिक केंद्र सम्मिलित है, को एंजाइम की निष्क्रिय या आराम की अवस्था माना जाता है। साइनाइड, एजाइड और कार्बन मोनोआक्साइड[10] सभी साइटोक्रोम सी ऑक्सीडेज से बंधते हैं, प्रोटीन को कार्य करने से रोकते हैं और कोशिकाओं के रासायनिक श्वासावरोध की ओर ले जाते हैं। अवरोधक सांद्रता में वृद्धि के लिए क्षतिपूर्ति करने के लिए आणविक ऑक्सीजन की उच्च सांद्रता की आवश्यकता होती है, जिससे अवरोधक की उपस्थिति में सेल में चयापचय गतिविधि में समग्र कमी आती है। अन्य लिगेंड, जैसे नाइट्रिक ऑक्साइड और हाइड्रोजन सल्फाइड, एंजाइम पर नियामक स्थलो को बाध्य करके COX को रोक सकते हैं, कोशिकीय श्वसन की दर को कम कर सकते हैं।[11]
साइनाइड COX के लिए एक गैर-प्रतिस्पर्धी अवरोधक है,[12][13] एंजाइम की आंशिक रूप से अपचयित स्थिति के लिए उच्च बंधुता के साथ बाध्यकारी है और एंजाइम के और अपचयन को रोकता है। स्पंदित अवस्था में साइनाइड धीरे-धीरे ,लेकिन उच्च बंधुता के साथ बंधता है। लिगैंड को इलेक्ट्रोस्टैटिक रूप से दोनों धातुओं को एक ही बार में उनके बीच स्थित करके स्थिर करने के लिए प्रस्तुत किया जाता है। एक उच्च नाइट्रिक ऑक्साइड सांद्रता, जैसे कि एंजाइम में बहिर्जात रूप से जोड़ा गया, COX के साइनाइड निषेध को उलट देता है।[14]
नाइट्रिक ऑक्साइड द्विनाभिक केंद्र में किसी भी धातु आयन को नाइट्राइट में ऑक्सीकृत करने के लिए विपरीत रूप से बांध सकता है। NO और CN− स्थल पर बाध्य करने के लिए ऑक्सीजन के साथ प्रतिस्पर्धा करेंगे, जिससे कोशिकीय श्वसन की दर कम होगी। अंतर्जात NO, यद्यपि, जो निचले स्तरों पर उत्पादित होता है, CN− निषेध को बढ़ाता है। NO का उच्च स्तर, जो अपचयित अवस्था में अधिक एंजाइम के अस्तित्व के साथ संबंध रखता है, साइनाइड के अधिक निषेध का कारण बनता है। इन आधारीय सांद्रता पर, जटिल IV के अवरोध को लाभकारी प्रभाव के लिए जाना जाता है, जैसे कि रक्त वाहिका के ऊतकों में ऑक्सीजन का स्तर बढ़ाना। जल में ऑक्सीजन को कम करने के लिए एंजाइम की अक्षमता के परिणामस्वरूप ऑक्सीजन का निर्माण होता है, जो आसपास के ऊतकों में गहराई तक फैल सकता है।[15] जटिल IV के NO निषेध का कम ऑक्सीजन सांद्रता पर बड़ा प्रभाव पड़ता है, जिससे ज़रूरत के ऊतकों में वाहिकाविस्फारक के रूप में इसकी उपयोगिता बढ़ जाती है।[15]
हाइड्रोजन सल्फाइड कार्बन मोनोऑक्साइड के समान एंजाइम पर एक नियामक स्थल पर एक गैर-प्रतिस्पर्धी आचरण में COX को बांध देगा। सल्फाइड में एंजाइम के स्पंदित या आंशिक रूप से अपचयित होने वाले अवस्थाओं के लिए उच्चतम संबंध है, और हीम ए3केंद्र पर एंजाइम को आंशिक रूप से अपचयित करने में सक्षम है। यह स्पष्ट नहीं है कि अंतर्जात H2S स्तर एंजाइम को बाधित करने के लिए पर्याप्त हैं। हाइड्रोजन सल्फाइड और सीओएक्स की पूरी तरह से अपचयित संरचना के बीच कोई पारस्परिक क्रिया नहीं है।[11]
मिथाइलेटेड स्पिरिट में मेथनॉल फॉर्मिक एसिड में परिवर्तित हो जाता है, जो उसी ऑक्सीडेज प्रणाली को भी रोकता है। एटीपी के उच्च स्तर माइटोकॉन्ड्रियल परिवेश के भीतर से बाध्यकारी, साइटोक्रोम सी ऑक्सीडेज को पूरी तरह से रोक सकते हैं।[16]
अतिरिक्तमाइटोकोंड्रियल और उपकोशिकीय स्थानीयकरण

साइटोक्रोम सी ऑक्सीडेज में 3 उप इकाई हैं जो माइटोकॉन्ड्रियल डीएनए (साइटोक्रोम सी ऑक्सीडेज उप इकाई I, उप इकाई II और उप इकाई III) द्वारा कूटलेखन किए गए हैं। माइटोकॉन्ड्रियल डीएनए द्वारा कूटलेखन किए गए इन 3 उप इकाई में से दो की पहचान अतिरिक्तमाइटोकॉन्ड्रियल स्थानों में की गई है। अग्नाशयी संगोष्ठी ऊतक में, ये उप इकाई ज़ाइमोजेन कणिकाओं में पाए गए। इसके अतिरिक्त, पूर्वकाल पिट्यूटरी में, इन उप इकाई की अपेक्षाकृत उच्च मात्रा में वृद्धि हार्मोन स्रावी कणिकाओं में पाई गई। इन साइटोक्रोम सी ऑक्सीडेज उप इकाई के अतिरिक्तमाइटोकॉन्ड्रियल कार्य को अभी तक विशेषता नहीं दी गई है। साइटोक्रोम सी ऑक्सीडेज उप इकाई के अलावा, अन्य माइटोकॉन्ड्रियल प्रोटीनों की बड़ी संख्या के लिए अतिरिक्तमाइटोकॉन्ड्रियल स्थानीयकरण भी देखा गया है। यह माइटोकॉन्ड्रिया से अन्य कोशिकीय अभिप्राय तक प्रोटीन स्थानांतरण के लिए अभी तक अज्ञात विशिष्ट तंत्र के अस्तित्व की संभावना को बढ़ाता है।[17][18][19]
आनुवंशिक दोष और विकार
साइटोक्रोम सी ऑक्सीडेज (सीओएक्स) की कार्यक्षमता या संरचना को बदलने वाले आनुवंशिक उत्परिवर्तनों से जुड़े दोषों के परिणामस्वरूप गंभीर, अक्सर घातक चयापचय संबंधी विकार हो सकते हैं। इस तरह के विकार सामान्यतः बचपन में प्रकट होते हैं और मुख्य रूप से उच्च ऊर्जा की मांग वाले ऊतकों (मस्तिष्क, हृदय, मांसपेशियों) को प्रभावित करते हैं। कई वर्गीकृत माइटोकॉन्ड्रियल बीमारियों में से, निष्क्रिय COX समन्वायोजन को सम्मिलित करने वालों को सबसे गंभीर माना जाता है।[20]
COX विकारों के विशाल बहुमत परमाणु-कूटबद्ध प्रोटीन में उत्परिवर्तन से जुड़े होते हैं जिन्हें समन्वायोजन कारक या समन्वायोजन प्रोटीन कहा जाता है। ये समन्वायोजन कारक COX संरचना और कार्यक्षमता में योगदान करते हैं, और कई आवश्यक प्रक्रियाओं में सम्मिलित होते हैं, जिनमें माइटोकॉन्ड्रियन-कूटबद्ध उप इकाई का प्रतिलेख और स्थानान्तरण, प्रीप्रोटीन का प्रसंस्करण और झिल्ली सम्मिलन,और सहकारक जैवसंश्लेषण और निगमन सम्मिलित हैं।[21]
वर्तमान में, सात COX समन्वायोजन कारकों में उत्परिवर्तन की पहचान की गई है: SURF1, SCO1, SCO2, COX10, COX15, COX20, COA5 और LRPPRC। इन प्रोटीनों में उत्परिवर्तन के परिणामस्वरूप सब- जटिल समन्वायोजन, कॉपर अभिगम या स्थानांतरीय विनियम की कार्यक्षमता बदल सकती है। प्रत्येक जीन उत्परिवर्तन एक विशिष्ट बीमारी के हेतुविज्ञान से जुड़ा होता है, जिसमें कुछ का कई विकारों में प्रभाव होता है। जीन उत्परिवर्तन के माध्यम से शिथिल COX समन्वायोजन से जुड़े विकारों में लेह सिंड्रोम, कार्डियोमायोपैथी, ल्यूकोडिस्ट्रॉफी, रक्ताल्पता और सेंसरिनुरल बहरापन सम्मिलित हैं।
हिस्टोकेमिस्ट्री
ऊर्जा के लिए ऑक्सीडेटिव फास्फारिलीकरण पर न्यूरॉन्स की बढ़ती निर्भरता[22] जानवरों में क्षेत्रीय मस्तिष्क चयापचय की प्रति चित्रण में COX हिस्टोकेमिस्ट्री के उपयोग की सुविधा देता है, क्योंकि यह एंजाइम गतिविधि और तंत्रिका गतिविधि के बीच प्रत्यक्ष और सकारात्मक संबंध स्थापित करता है।[23] यह COX एंजाइम मात्राऔर गतिविधि के बीच संबंध में देखा जा सकता है, जो जीन अभिव्यक्ति के स्तर पर COX के नियमन को इंगित करता है। COX वितरण पशु मस्तिष्क के विभिन्न क्षेत्रों में असंगत है, लेकिन इसके वितरण का तरीका जानवरों के अनुरूप है। यह तरीका बंदर, चूहे और बछड़े के मस्तिष्क में देखा गया है। मस्तिष्क के हिस्टोकेमिकल विश्लेषण में COX के एक आइसोजाइम का लगातार पता लगाया गया है।[24] इस तरह मस्तिष्क के प्रतिचित्रण को अनुमस्तिष्क रोग जैसे रीलर और अल्जाइमर रोग के पराजीनी नमूने के साथ सहज उत्परिवर्ती चूहों में पूरा किया गया है।[25] इस तकनीक का उपयोग पशु मस्तिष्क में सीखने की गतिविधि को प्रतिचित्रण करने के लिए भी किया गया है।[26]
अतिरिक्त छवियां
यह भी देखें
- साइटोक्रोम सी ऑक्सीडेज उपइकाई आई
- साइटोक्रोम सी ऑक्सीडेज उपइकाई II
- साइटोक्रोम सी ऑक्सीडेज उपइकाई III
- हेम ए
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 Fontanesi F, Soto IC, Horn D, Barrientos A (December 2006). "Assembly of mitochondrial cytochrome c-oxidase, a complicated and highly regulated cellular process". American Journal of Physiology. Cell Physiology. 291 (6): C1129-47. doi:10.1152/ajpcell.00233.2006. PMID 16760263.
- ↑ Crofts A (1996). "Cytochrome oxidase: Complex IV". University of Illinois at Urbana-Champaign. Archived from the original on 2018-01-23. Retrieved 2018-01-28.
- ↑ Khalimonchuk O, Rödel G (December 2005). "Biogenesis of cytochrome c oxidase". Mitochondrion. 5 (6): 363–88. doi:10.1016/j.mito.2005.08.002. PMID 16199211.
- ↑ 4.0 4.1 Sedlák E, Robinson NC (September 2015). "Destabilization of the Quaternary Structure of Bovine Heart Cytochrome c Oxidase upon Removal of Tightly Bound Cardiolipin". Biochemistry. 54 (36): 5569–77. doi:10.1021/acs.biochem.5b00540. PMID 26284624.
- ↑ Herrmann JM, Woellhaf MW, Bonnefoy N (February 2013). "Control of protein synthesis in yeast mitochondria: the concept of translational activators". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1833 (2): 286–94. doi:10.1016/j.bbamcr.2012.03.007. PMID 22450032.
- ↑ Soto IC, Fontanesi F, Liu J, Barrientos A (June 2012). "Biogenesis and assembly of eukaryotic cytochrome c oxidase catalytic core". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1817 (6): 883–97. doi:10.1016/j.bbabio.2011.09.005. PMC 3262112. PMID 21958598.
- ↑ Aledo JC, Valverde H, Ruíz-Camacho M, Morilla I, López FD (October 2014). "Protein-protein interfaces from cytochrome c oxidase I evolve faster than nonbinding surfaces, yet negative selection is the driving force". Genome Biology and Evolution. 6 (11): 3064–76. doi:10.1093/gbe/evu240. PMC 4255772. PMID 25359921.
- ↑ Voet D, Voet JG (2011). जीव रसायन (4th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-470-57095-1.
- ↑ Leavesley HB, Li L, Prabhakaran K, Borowitz JL, Isom GE (January 2008). "Interaction of cyanide and nitric oxide with cytochrome c oxidase: implications for acute cyanide toxicity". Toxicological Sciences. 101 (1): 101–11. doi:10.1093/toxsci/kfm254. PMID 17906319.
- ↑ Alonso JR, Cardellach F, López S, Casademont J, Miró O (September 2003). "Carbon monoxide specifically inhibits cytochrome c oxidase of human mitochondrial respiratory chain". Pharmacology & Toxicology. 93 (3): 142–6. doi:10.1034/j.1600-0773.2003.930306.x. PMID 12969439.
- ↑ 11.0 11.1 Nicholls P, Marshall DC, Cooper CE, Wilson MT (October 2013). "Sulfide inhibition of and metabolism by cytochrome c oxidase". Biochemical Society Transactions. 41 (5): 1312–6. doi:10.1042/BST20130070. PMID 24059525. S2CID 11554252.
- ↑ Roberts M, Reiss MJ, Monger G (2000). Advanced Biology (in English). Nelson Thornes. ISBN 9780174387329. Archived from the original on 2022-02-24. Retrieved 2020-10-25.
- ↑ Roberts MB (1986). Biology: A Functional Approach (in English). Nelson Thornes. ISBN 9780174480198. Archived from the original on 2022-02-24. Retrieved 2020-10-25.
- ↑ Jensen P, Wilson MT, Aasa R, Malmström BG (December 1984). "Cyanide inhibition of cytochrome c oxidase. A rapid-freeze e.p.r. investigation". The Biochemical Journal. 224 (3): 829–37. doi:10.1042/bj2240829. PMC 1144519. PMID 6098268.
- ↑ 15.0 15.1 Gladwin MT, Shiva S (May 2009). "The ligand binding battle at cytochrome c oxidase: how NO regulates oxygen gradients in tissue". Circulation Research. 104 (10): 1136–8. doi:10.1161/CIRCRESAHA.109.198911. PMID 19461104.
- ↑ Arnold S, Kadenbach B (October 1997). "Cell respiration s controlled by ATP, an allosteric inhibitor of cytochrome-c oxidase". Eur J Biochem. 249 (1): 350–354. doi:10.1111/j.1432-1033.1997.t01-1-00350.x. PMID 9363790.
- ↑ Sadacharan SK, Singh B, Bowes T, Gupta RS (November 2005). "Localization of mitochondrial DNA encoded cytochrome c oxidase subunits I and II in rat pancreatic zymogen granules and pituitary growth hormone granules". Histochemistry and Cell Biology. 124 (5): 409–21. doi:10.1007/s00418-005-0056-2. PMID 16133117. S2CID 24440427.
- ↑ Soltys BJ, Gupta RS (1999). "Mitochondrial proteins at unexpected cellular locations: export of proteins from mitochondria from an evolutionary perspective". International Review of Cytology. 194: 133–96. doi:10.1016/S0074-7696(08)62396-7. ISBN 9780123645982. PMID 10494626.
- ↑ Soltys BJ, Gupta RS (May 1999). "Mitochondrial-matrix proteins at unexpected locations: are they exported?". Trends in Biochemical Sciences. 24 (5): 174–7. doi:10.1016/s0968-0004(99)01390-0. PMID 10322429.
- ↑ Pecina P, Houstková H, Hansíková H, Zeman J, Houstek J (2004). "Genetic defects of cytochrome c oxidase assembly" (PDF). Physiological Research. 53 Suppl 1: S213-23. PMID 15119951. Archived (PDF) from the original on 2011-07-18. Retrieved 2010-11-17.
- ↑ Zee JM, Glerum DM (December 2006). "Defects in cytochrome oxidase assembly in humans: lessons from yeast". Biochemistry and Cell Biology. 84 (6): 859–69. doi:10.1139/o06-201. PMID 17215873.
- ↑ Johar K, Priya A, Dhar S, Liu Q, Wong-Riley MT (November 2013). "Neuron-specific specificity protein 4 bigenomically regulates the transcription of all mitochondria- and nucleus-encoded cytochrome c oxidase subunit genes in neurons". Journal of Neurochemistry. 127 (4): 496–508. doi:10.1111/jnc.12433. PMC 3820366. PMID 24032355.
- ↑ Wong-Riley MT (March 1989). "Cytochrome oxidase: an endogenous metabolic marker for neuronal activity". Trends in Neurosciences. 12 (3): 94–101. doi:10.1016/0166-2236(89)90165-3. PMID 2469224. S2CID 42996304.
- ↑ Hevner RF, Wong-Riley MT (November 1989). "Brain cytochrome oxidase: purification, antibody production, and immunohistochemical/histochemical correlations in the CNS". The Journal of Neuroscience. 9 (11): 3884–98. doi:10.1523/jneurosci.09-11-03884.1989. PMC 6569932. PMID 2555458.
- ↑ Strazielle C, Sturchler-Pierrat C, Staufenbiel M, Lalonde R (2003). "Regional brain cytochrome oxidase activity in beta-amyloid precursor protein transgenic mice with the Swedish mutation". Neuroscience. 118 (4): 1151–63. doi:10.1016/S0306-4522(03)00037-X. PMID 12732258. S2CID 9366458.
- ↑ Conejo NM, González-Pardo H, Gonzalez-Lima F, Arias JL (March 2010). "Spatial learning of the water maze: progression of brain circuits mapped with cytochrome oxidase histochemistry". Neurobiology of Learning and Memory. 93 (3): 362–71. doi:10.1016/j.nlm.2009.12.002. PMID 19969098. S2CID 24271956.
बाहरी संबंध
- The Cytochrome Oxidase home page at Rice University
- Interactive Molecular model of साइटोक्रोम सी ऑक्सीडेज (Requires MDL Chime)
- UMich Orientation of Proteins in Membranes families/superfamily-4
- Cytochrome-c+Oxidase at the US National Library of Medicine Medical Subject Headings (MeSH)