एंटीबॉडी आणविक कक्षीय: Difference between revisions
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Short description|Type of molecular orbital which weakens the chemical bond between two atoms}} | {{Short description|Type of molecular orbital which weakens the chemical bond between two atoms}} | ||
[[Image:Dihydrogen-LUMO-phase-3D-balls.png|thumb|right|150px|H<sub>2</sub> 1sσ* प्रतिरक्षी आण्विक कक्षक]]रासायनिक बंधन सिद्धांत में, एक रोगप्रतिकारक.कक्षीय एक प्रकार का आणविक कक्षीय है जो दो परमाणुओं के बीच रासायनिक बंधन को कमजोर करता है और अलग-अलग परमाणुओं के सापेक्ष अणु की ऊर्जा को बढ़ाने में सहायता करता है। इस तरह के एक कक्षीय में नाभिक के बीच बंधन क्षेत्र में एक या एक से अधिक नोड होते हैं। कक्षीय में इलेक्ट्रॉनों का घनत्व बंधन क्षेत्र के बाहर केंद्रित होता है और यह एक नाभिक को दूसरे से दूर खींचने का कार्य करता है और दो परमाणुओं के बीच परस्पर प्रतिकर्षण पैदा करता है।<ref>Atkins P. and de Paula J. ''Atkins Physical Chemistry''. 8th ed. (W.H. Freeman 2006), p.371 {{ISBN|0-7167-8759-8}}</ref><ref>Miessler G.L. and Tarr D.A., ''Inorganic Chemistry'' 2nd ed. (Prentice-Hall 1999), p.111 {{ISBN|0-13-841891-8}}</ref> यह एक बंधन आणविक कक्षीय के विपरीत है, जिसमें अलग-अलग परमाणुओं की तुलना में कम ऊर्जा होती है, और रासायनिक बंधनों के लिए यह उत्तरदायी होता है। | [[Image:Dihydrogen-LUMO-phase-3D-balls.png|thumb|right|150px|H<sub>2</sub> 1sσ* प्रतिरक्षी आण्विक कक्षक]]रासायनिक बंधन सिद्धांत में, एक रोगप्रतिकारक.कक्षीय एक प्रकार का आणविक कक्षीय है जो दो परमाणुओं के बीच रासायनिक बंधन को कमजोर करता है और अलग-अलग परमाणुओं के सापेक्ष अणु की ऊर्जा को बढ़ाने में सहायता करता है। इस तरह के एक कक्षीय में नाभिक के बीच बंधन क्षेत्र में एक या एक से अधिक नोड होते हैं। कक्षीय में इलेक्ट्रॉनों का घनत्व बंधन क्षेत्र के बाहर केंद्रित होता है और यह एक नाभिक को दूसरे से दूर खींचने का कार्य करता है और दो परमाणुओं के बीच परस्पर प्रतिकर्षण पैदा करता है।<ref>Atkins P. and de Paula J. ''Atkins Physical Chemistry''. 8th ed. (W.H. Freeman 2006), p.371 {{ISBN|0-7167-8759-8}}</ref><ref>Miessler G.L. and Tarr D.A., ''Inorganic Chemistry'' 2nd ed. (Prentice-Hall 1999), p.111 {{ISBN|0-13-841891-8}}</ref> यह एक बंधन आणविक कक्षीय के विपरीत है, जिसमें अलग-अलग परमाणुओं की तुलना में कम ऊर्जा होती है, और रासायनिक बंधनों के लिए यह उत्तरदायी होता है। | ||
| Line 33: | Line 31: | ||
* Orchin, M. Jaffe, H.H. (1967) ''The Importance of Antibonding Orbitals''. Houghton Mifflin. ISBN B0006BPT5O | * Orchin, M. Jaffe, H.H. (1967) ''The Importance of Antibonding Orbitals''. Houghton Mifflin. ISBN B0006BPT5O | ||
[[Category: रासायनिक संबंध]] | [[Category: रासायनिक संबंध]] | ||
Revision as of 08:57, 28 April 2023
रासायनिक बंधन सिद्धांत में, एक रोगप्रतिकारक.कक्षीय एक प्रकार का आणविक कक्षीय है जो दो परमाणुओं के बीच रासायनिक बंधन को कमजोर करता है और अलग-अलग परमाणुओं के सापेक्ष अणु की ऊर्जा को बढ़ाने में सहायता करता है। इस तरह के एक कक्षीय में नाभिक के बीच बंधन क्षेत्र में एक या एक से अधिक नोड होते हैं। कक्षीय में इलेक्ट्रॉनों का घनत्व बंधन क्षेत्र के बाहर केंद्रित होता है और यह एक नाभिक को दूसरे से दूर खींचने का कार्य करता है और दो परमाणुओं के बीच परस्पर प्रतिकर्षण पैदा करता है।[1][2] यह एक बंधन आणविक कक्षीय के विपरीत है, जिसमें अलग-अलग परमाणुओं की तुलना में कम ऊर्जा होती है, और रासायनिक बंधनों के लिए यह उत्तरदायी होता है।
द्विपरमाणुक अणु
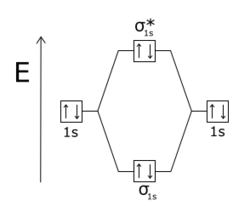
आबंधी आण्विक कक्षक (MOs) सामान्यतः आबंधी आण्विक कक्षकों की तुलना में ऊर्जा में अधिक होते हैं। बंधन और प्रतिबंधक कक्षक तब बनते हैं जब परमाणु अणुओं में संयोजित होते हैं।[3] यदि दो हाइड्रोजन परमाणु प्रारंभिक अवस्था में दूर हैं, तो उनके परमाणु कक्षक समान होते हैं। यद्यपि, जैसे-जैसे दो परमाणुओं के बीच की दूरी कम होती जाती है, इलेक्ट्रॉन का तरंग कार्य अतिव्याति होने लगते हैं। पाउली अपवर्जन सिद्धांत किसी अणु में किन्हीं दो इलेक्ट्रॉनों (e-) को क्वांटम के समान सेट होने से रोकता है।[4] इसलिए पृथक परमाणुओं का प्रत्येक मूल परमाणु कक्षीय (उदाहरण के लिए, प्रारंभिक अवस्था वाले ऊर्जा स्तर, 1s) जोड़ी से संबंधित दो आणविक कक्षकों में विभाजित होता है, यह मूल परमाणु स्तर की तुलना में ऊर्जा में एक कम और एक उच्च होता है। कक्षक जो अलग-अलग परमाणुओं के कक्षक की तुलना में कम ऊर्जा अवस्था में होता है, बंधन कक्षक होता है, जो अधिक स्थिर होता है और दो H परमाणुओं के बंधन को H2 में बढ़ावा देता है। उच्च-ऊर्जा कक्षीय प्रति-बंधन कक्षीय है, जो कम स्थिर होता है और बंधन का विरोध करता है यदि यह व्याप्त है। H2 जैसे अणु में, दो इलेक्ट्रॉन सामान्य रूप से निम्न-ऊर्जा बंधन कक्षीय पर अतिक्रमण कर लेते हैं, ताकि अणु अलग-अलग H परमाणुओं की तुलना में अधिक स्थिर हो।
एक आणविक कक्षीय प्रतिबंधक बन जाता है जब दो नाभिकों के बीच कम इलेक्ट्रॉन घनत्व होता है, अगर कोई बंधकआदान प्रदान नहीं होता।[5]जब एक आणविक कक्षीय दो परमाणुओं के बीच एक नोडल तल पर संकेत (सकारात्मक से नकारात्मक) बदलता है, तो इसे उन परमाणुओं के संबंध में प्रतिरक्षी कहा जाता है। आण्विक कक्षीय आरेखों पर आबंधी कक्षकों को प्रायः तारांकन चिह्न (*) के साथ निर्देशित किया जाता है।
समानाभिकीय द्विपरमाणुक अणुओं में, σ* (सिग्मा स्टार) द्विपरमाणुक कक्षक में सिग्मा बंध की तरह दो नाभिकों से गुजरने वाला कोई नोडल तल नहीं होता है, और π* (पाई स्टार) कक्षक में दो नाभिकों से गुजरने वाला एक नोडल तल होता है, जैसे पाई बंध। पाउली बहिष्करण सिद्धांत यह निर्धारित करता है कि एक परस्पर क्रिया प्रणाली में दो इलेक्ट्रॉनों की समान क्वांटम स्थिति नहीं हो सकती है। यदि आबंधी कक्षक भरे हुए हैं, तो कोई भी अतिरिक्त इलेक्ट्रॉन प्रतिआबंधन कक्षक पर कब्जा कर लेगा। यह He2 अणु में होता है जिसमें 1sσ और 1sσ* दोनों कक्षक भरे हुए हैं।।[6]चूँकि प्रति-आबंधी कक्षक, आबंधन कक्षक की तुलना में अधिक प्रति-आबंधी होता है, अणु में दो पृथक हीलियम परमाणुओं की तुलना में अधिक ऊर्जा होती है, और इसलिए यह अस्थिर होता है।
बहुपरमाणुक अणु
कई परमाणुओं वाले अणुओं में, कुछ कक्षक को दो से अधिक परमाणुओं पर विभाजित किया जा सकता है। एक विशेष आण्विक कक्षक परमाणुओं के कुछ निकटवर्ती युग्मों के संबंध में आबंधन और अन्य युग्मों के संबंध में प्रतिआबंधन हो सकता है। यदि आबंधन अंतःक्रियाओं की संख्या प्रतिआबंधन अंतःक्रियाओं से अधिक हो जाती है, तो MO को आबंधन कहा जाता है, जबकि, यदि प्रतिआबंधन अंतःक्रियाओं की संख्या आबंधन अंतःक्रियाओं से अधिक हो जाती है, तो आणविक कक्षक को प्रतिआबंधी कहा जाता है।
उदाहरण के लिए, ब्यूटाडाइन में पाई कक्षक होते हैं जो सभी चार कार्बन परमाणुओं पर विभाजित होते हैं। दो बंधक पाई कक्षक हैं जो निचलीअवस्था में व्याप्त हैं: π1 सभी कार्बन के बीच बंधक है, जबकि π2 C1 और C2 के बीच और C3 और C4 के बीच बंधक है, और C2 और C3 के बीच द्विपरमाणुक है। आरेख में दिखाए गए अनुसार दो और तीन द्विपरमाणुक आदान प्रदान वाले द्विपरमाणुक पाई कक्षक भी हैं; ये निचली अवस्था में रिक्त हैं, लेकिन उत्तेजित अवस्थाओं में इनका आधिपत्य हो सकता है।
इसी तरह छह कार्बन परमाणुओं वाले बेंजीन में तीन बंधक पाई कक्षक और तीन प्रतिबंधक पाई कक्षक हैं। चूंकि प्रत्येक कार्बन परमाणु बेंजीन की π-प्रणाली में एक इलेक्ट्रॉन का योगदान देता है, इसलिए छह पाई इलेक्ट्रॉन होते हैं जो तीन सबसे कम ऊर्जा वाले पाई आणविक कक्षक (बंधक पाई कक्षक) को भरते हैं।
आण्विक कक्षीय सिद्धांत के संदर्भ में रासायनिक अभिक्रियाओं को समझाने के लिए प्रतिबंधक कक्षक भी महत्वपूर्ण हैं। रोआल्ड हॉफमैन और केनिची फुकुई ने अपने काम और रासायनिक अभिक्रियाओं के लिए गुणात्मक आणविक कक्षीय स्पष्टीकरण के आगे के विकास के लिए रसायन विज्ञान में 1981 का नोबेल पुरस्कार साझा किया।[7]
यह भी देखें
- बंधन आणविक कक्षीय
- वैलेंस और कंडक्शन बैंड
- वैलेंस बांड सिद्धांत
- आणविक कक्षीय सिद्धांत
- संयुग्मित प्रणाली
संदर्भ
- ↑ Atkins P. and de Paula J. Atkins Physical Chemistry. 8th ed. (W.H. Freeman 2006), p.371 ISBN 0-7167-8759-8
- ↑ Miessler G.L. and Tarr D.A., Inorganic Chemistry 2nd ed. (Prentice-Hall 1999), p.111 ISBN 0-13-841891-8
- ↑ "Molecular Orbital - an overview | ScienceDirect Topics".
- ↑ "The Chemical Bond - the Effect of the Pauli Principle on Chemical Binding".
- ↑ Nordholm, Sture; Bacskay, George B. (2020). "ऊर्जा और गतिशीलता के संदर्भ में सहसंयोजक बंधन की मूल बातें". Molecules. 25 (11): 2667. doi:10.3390/molecules25112667. PMC 7321125. PMID 32521828.
- ↑ "2.1. Combining atomic orbitals, sigma and pi bonding | Organic Chemistry 1: An open textbook".
- ↑ "The Nobel Prize in Chemistry 1981". Nobelprize.org. Archived from the original on 21 December 2008. Retrieved 15 March 2022.
अग्रिम पठन
- Orchin, M. Jaffe, H.H. (1967) The Importance of Antibonding Orbitals. Houghton Mifflin. ISBN B0006BPT5O