डिसोडियम टेट्राकार्बोनिलफेरेट: Difference between revisions
No edit summary |
|||
| Line 34: | Line 34: | ||
|OtherCompounds = [[Iron pentacarbonyl]]}} | |OtherCompounds = [[Iron pentacarbonyl]]}} | ||
}} | }} | ||
डाइसोडियम टेट्राकार्बोनिलफेरेट सूत्र ना के साथ ऑर्गेनोआयरन यौगिक है<sub>2</sub>[फे (सीओ)<sub>4</sub>]। यह हमेशा सॉल्वेट के रूप में प्रयोग किया जाता है, उदाहरण के लिए, [[ टेट्राहाइड्रोफ्यूरान ]] या [[डाईमेथोक्सीएथेन]] के साथ, जो सोडियम केशन से जुड़ता है।<ref name = RJA>{{cite journal |author1=Strong, H.|author2=Krusic, P. J. |author3=San Filippo, J. | title = Sodium Carbonyl Ferrates, Na<sub>2</sub>[Fe(CO)<sub>4</sub>], Na<sub>2</sub>[Fe<sub>2</sub>(CO)<sub>8</sub>], and Na<sub>2</sub>[Fe<sub>3</sub>(CO)<sub>11</sub>]. Bis[μ-Nitrido-Bis(triphenylphosphorus)<sup>1+</sup>] Undeca-Carbonyltriferrate<sup>2−</sup>, [(Ph<sub>3</sub>P)<sub>2</sub>N]<sub>2</sub>[Fe<sub>3</sub>(CO)<sub>11</sub>] | journal = [[Inorganic Syntheses]] | year = 1990 | volume = 28 | pages = 203–207 | isbn = 0-471-52619-3 | doi = 10.1002/9780470132593.ch52}}</ref> एक [[ऑक्सीजन]]-संवेदनशील रंगहीन ठोस, यह ऑर्गोनोमेटिक और कार्बनिक रासायनिक अनुसंधान में एक अभिकर्मक है। डाइऑक्सेन सॉल्वेटेड सोडियम नमक को कोलमैन के अभिकर्मक के रूप में जाना जाता है, जेम्स पी। कोलमैन की मान्यता में, इसके उपयोग के शुरुआती लोकप्रिय।<ref>{{cite book |author1=Miessler, G. L. |author2=Tarr, D. A. | year = 2004 | title = अकार्बनिक रसायन शास्त्र|url=https://archive.org/details/inorganicchemist03edmies |url-access=registration | location = Upper Saddle River, NJ | publisher = Pearson}}</ref> | |||
| Line 59: | Line 59: | ||
इसके बाद इस घोल को PPh<sub>3</sub> और फिर [[ एसीटिक अम्ल |एसीटिक]] [[ एसीटिक अम्ल |अम्ल]] के साथ क्रमिक रूप से उपचारित किया जाता है एल्डिहाइड, RCHO देने के लिए । | इसके बाद इस घोल को PPh<sub>3</sub> और फिर [[ एसीटिक अम्ल |एसीटिक]] [[ एसीटिक अम्ल |अम्ल]] के साथ क्रमिक रूप से उपचारित किया जाता है एल्डिहाइड, RCHO देने के लिए । | ||
डाइसोडियमटेट्राकार्बोनिलफेरेट का उपयोग [[एसिड क्लोराइड|क्लोराइड]] अम्ल को एल्डिहाइड में बदलने के लिए किया जा सकता है। यह प्रतिक्रिया जटिल लोह [[एसाइल]] की मध्यस्थता के माध्यम से आगे बढ़ती है। | |||
:: Na<sub>2</sub>[Fe(CO)<sub>4</sub>] + RCOCl → Na[RC(O)Fe(CO)<sub>4</sub>] + NaCl | :: Na<sub>2</sub>[Fe(CO)<sub>4</sub>] + RCOCl → Na[RC(O)Fe(CO)<sub>4</sub>] + NaCl | ||
:: Na[RC(O)Fe(CO)<sub>4</sub>] + HCl → RCHO + "Fe(CO)<sub>4</sub>" + NaCl | :: Na[RC(O)Fe(CO)<sub>4</sub>] + HCl → RCHO + "Fe(CO)<sub>4</sub>" + NaCl | ||
:: | ::डाइसोडियमटेट्राकार्बोनिलफेरेट जटिल एल्किल बनाने के लिए[[ अल्काइल हलाइड्स | एल्किल हैलाइड]] (RX) के साथ प्रतिक्रिया करता है: | ||
:: Na<sub>2</sub>[Fe(CO)<sub>4</sub>] + RX → Na[RFe(CO)<sub>4</sub>] + NaX | :: Na<sub>2</sub>[Fe(CO)<sub>4</sub>] + RX → Na[RFe(CO)<sub>4</sub>] + NaX | ||
::इस तरह के लोहे के एल्किलों को संबंधित कार्बोक्सिलिक अम्ल और हैलाइड अम्ल में परिवर्तित किया जा सकता है | ::इस तरह के लोहे के एल्किलों को संबंधित कार्बोक्सिलिक अम्ल और हैलाइड अम्ल में परिवर्तित किया जा सकता है | ||
Revision as of 09:57, 26 March 2023
| |
| Names | |
|---|---|
| IUPAC name
disodium tetracarbonylferrate
| |
| Systematic IUPAC name
disodium tetracarbonylferrate | |
| Other names
disodium iron tetracarbonyl,
Collman's reagent
| |
| Identifiers | |
3D model (JSmol)
|
|
| EC Number |
|
PubChem CID
|
|
| |
| |
| Properties | |
| C4FeNa2O4 | |
| Molar mass | 213.87 |
| Appearance | Colorless solid |
| Density | 2.16 g/cm3, solid |
| Decomposes | |
| Solubility | tetrahydrofuran, dimethylformamide, dioxane |
| Structure | |
| Distorted tetrahedron | |
| Tetrahedral | |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
Main hazards
|
Pyrophoric |
| Related compounds | |
Related compounds
|
Iron pentacarbonyl |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
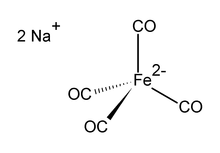
डाइसोडियम टेट्राकार्बोनिलफेरेट सूत्र ना के साथ ऑर्गेनोआयरन यौगिक है2[फे (सीओ)4]। यह हमेशा सॉल्वेट के रूप में प्रयोग किया जाता है, उदाहरण के लिए, टेट्राहाइड्रोफ्यूरान या डाईमेथोक्सीएथेन के साथ, जो सोडियम केशन से जुड़ता है।[1] एक ऑक्सीजन-संवेदनशील रंगहीन ठोस, यह ऑर्गोनोमेटिक और कार्बनिक रासायनिक अनुसंधान में एक अभिकर्मक है। डाइऑक्सेन सॉल्वेटेड सोडियम नमक को कोलमैन के अभिकर्मक के रूप में जाना जाता है, जेम्स पी। कोलमैन की मान्यता में, इसके उपयोग के शुरुआती लोकप्रिय।[2]
संरचना
डायनियन [Fe(CO)]4]2− Ni(CO) के साथ समइलेक्ट्रॉनिक है4.[3][4] लोहे का केंद्र Na के साथ टेट्राहेड्रल है+---OCFe इंटरैक्शन। यह आमतौर पर सोडियम केशन के लिए जटिल डाइअॉॉक्सिन के साथ प्रयोग किया जाता है।
संश्लेषण
अभिकर्मक मूल रूप से सोडियम अमलगम के साथ लोहे के पेंटाकारबोनील को कम करके सीटू में उत्पन्न किया गया था।[5] आधुनिक संश्लेषण सोडियम नेफ़थलीन या सोडियम बेंजोफेनोन केटिल्स का उपयोग रिड्यूसेंट्स के रूप में करते हैं:[1][6]
- Fe(CO)5 + 2 Na → Na2[Fe(CO)4] + CO
- जब सोडियम की कमी का उपयोग किया जाता है, तो कमी गहरे पीले रंग के ऑक्टाकारबोनील अलग-अलग होती है:
- 2 Fe(CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
[1] कुछ विशिष्ट विधियाँ आयरन कार्बोनिल से शुरू नहीं होती हैं।[7]
प्रतिक्रियाएं
इसका उपयोग एल्किल हैलाइड से एल्डिहाइड को संश्लेषित करने के लिए किया जाता है।[8]अभिकर्मक को मूल रूप से दो-चरणोंमें होने वाली एक-पॉट प्रतिक्रिया से संबंधित एल्डिहाइड में प्राथमिक एल्किल ब्रोमाइड के रूपांतरण के लिए वर्णित किया गया था:[5]:
Na2[Fe(CO)4] + RBr → Na[RFe(CO)4] + NaBr
इसके बाद इस घोल को PPh3 और फिर एसीटिक अम्ल के साथ क्रमिक रूप से उपचारित किया जाता है एल्डिहाइड, RCHO देने के लिए ।
डाइसोडियमटेट्राकार्बोनिलफेरेट का उपयोग क्लोराइड अम्ल को एल्डिहाइड में बदलने के लिए किया जा सकता है। यह प्रतिक्रिया जटिल लोह एसाइल की मध्यस्थता के माध्यम से आगे बढ़ती है।
- Na2[Fe(CO)4] + RCOCl → Na[RC(O)Fe(CO)4] + NaCl
- Na[RC(O)Fe(CO)4] + HCl → RCHO + "Fe(CO)4" + NaCl
- डाइसोडियमटेट्राकार्बोनिलफेरेट जटिल एल्किल बनाने के लिए एल्किल हैलाइड (RX) के साथ प्रतिक्रिया करता है:
- Na2[Fe(CO)4] + RX → Na[RFe(CO)4] + NaX
- इस तरह के लोहे के एल्किलों को संबंधित कार्बोक्सिलिक अम्ल और हैलाइड अम्ल में परिवर्तित किया जा सकता है
- Na[RFe(CO)4] + O2, H+ →→ RCO2H + Fe... Na[RFe(CO)4] + 2 X2 → RC(O)X + FeX2 + 3 CO + NaX
संदर्भ
- ↑ 1.0 1.1 1.2 Strong, H.; Krusic, P. J.; San Filippo, J. (1990). "Sodium Carbonyl Ferrates, Na2[Fe(CO)4], Na2[Fe2(CO)8], and Na2[Fe3(CO)11]. Bis[μ-Nitrido-Bis(triphenylphosphorus)1+] Undeca-Carbonyltriferrate2−, [(Ph3P)2N]2[Fe3(CO)11]". Inorganic Syntheses. 28: 203–207. doi:10.1002/9780470132593.ch52. ISBN 0-471-52619-3.
- ↑ Miessler, G. L.; Tarr, D. A. (2004). अकार्बनिक रसायन शास्त्र. Upper Saddle River, NJ: Pearson.
- ↑ Chin, H. B.; Bau, R. (1976). "The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate2− Anion in the Solid State". Journal of the American Chemical Society. 98 (9): 2434–2439. doi:10.1021/ja00425a009.
- ↑ Teller, R. G.; Finke, R. G.; Collman, J. P.; Chin, H. B.; Bau, R. (1977). "Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N]". Journal of the American Chemical Society. 99 (4): 1104–1111. doi:10.1021/ja00446a022.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ 5.0 5.1 Cooke, M. P. (1970). "सोडियम टेट्राकार्बोनिलफेरेट (-II) का उपयोग करके अल्काइल ब्रोमाइड्स का एल्डिहाइड में सुगम रूपांतरण". Journal of the American Chemical Society. 92 (20): 6080–6082. doi:10.1021/ja00723a056.
- ↑ Richard G. Finke, Thomas N. Sorrell (1979). "Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-Oxoöctanoate". Organic Syntheses. 59: 102. doi:10.15227/orgsyn.059.0102.
- ↑ Scholsser, M. (2013). सिंथेसिस में ऑर्गेनोमेटेलिक्स, तीसरा मैनुअल. Chicester, England: Wiley.
- ↑ Pike, R. D. (2001). "डिसोडियम टेट्राकार्बोनिलफेरेट (-II)". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd465.
अग्रिम पठन
- Collman, J. P. (1975). "Disodium Tetracarbonylferrate, a Transition Metal Analog of a Grignard Reagent". Accounts of Chemical Research. 8 (10): 342–347. doi:10.1021/ar50094a004.
- Ungurenasu, C.; Cotzur, C. (1982). "Disodium Tetracarbonylferrate: A Reagent for Acid Functionalization of Halogenated Polymers". Polymer Bulletin. 6 (5–6): 299–303. doi:10.1007/BF00255401. S2CID 101154955.
- Hieber, V. W.; Braun, G. (1959). "Notizen: "Rheniumcarbonylwasserstoff" und Methylpentacarbonylrhenium". Zeitschrift für Naturforschung B. 14 (2): 132–133. doi:10.1515/znb-1959-0214. S2CID 94402946.