परमाणु संख्या: Difference between revisions
No edit summary |
No edit summary |
||
| Line 3: | Line 3: | ||
[[File:Atomic number depiction.jpg|thumb|300px|right|परमाणु संख्या संकेतन में देखी जाने वाली सुपरस्क्रिप्ट और सबस्क्रिप्ट की व्याख्या। परमाणु संख्या प्रोटॉन की संख्या है, और इसलिए परमाणु नाभिक में कुल धनात्मक आवेश भी है।]] | [[File:Atomic number depiction.jpg|thumb|300px|right|परमाणु संख्या संकेतन में देखी जाने वाली सुपरस्क्रिप्ट और सबस्क्रिप्ट की व्याख्या। परमाणु संख्या प्रोटॉन की संख्या है, और इसलिए परमाणु नाभिक में कुल धनात्मक आवेश भी है।]] | ||
[[Image:Bohr atom model.svg|thumb|right|300px|[[ हाइड्रोजन परमाणु ]] का रदरफोर्ड-बोह्र मॉडल ({{nowrap|''Z'' {{=}} 1}}) या हाइड्रोजन जैसा आयन ({{nowrap|1=''Z'' > 1}}). इस मॉडल में यह एक आवश्यक विशेषता है कि जब एक इलेक्ट्रॉन एक कक्षीय से दूसरे कक्ष में कूदता है तो उत्सर्जित विद्युत चुम्बकीय विकिरण की फोटॉन ऊर्जा (या आवृत्ति) परमाणु आवेश के गणितीय वर्ग के समानुपाती होती है ({{nowrap|''Z<sup>2</sup>''}}). कई तत्वों के लिए इस विकिरण के [[ हेनरी मोस्ले ]] द्वारा प्रायोगिक माप (से {{nowrap|''Z'' {{=}} 13 to 92}}) बोह्र द्वारा भविष्यवाणी के अनुसार परिणाम दिखाया। इस प्रकार परमाणु संख्या की अवधारणा और बोह्र मॉडल दोनों को वैज्ञानिक विश्वास दिया गया।]]किसी [[ रासायनिक तत्व ]] का परमाणु क्रमांक या परमाणु आवेश संख्या (प्रतीक ''Z'') [[ परमाणु नाभिक ]] की आवेश संख्या होती है। साधारण नाभिक के लिए, यह प्रोटॉन संख्या के समान है (''n''<sub>p</sub>) या उस तत्व के प्रत्येक [[ परमाणु ]] के [[ नाभिक ]] में पाए जाने वाले [[ प्रोटॉन ]] की संख्या साधारण [[ रासायनिक तत्व ]] की विशिष्ट पहचान के लिए परमाणु संख्या का उपयोग किया जा सकता है। एक साधारण विद्युत आवेश परमाणु में, परमाणु संख्या भी [[ इलेक्ट्रॉन ]]की संख्या के समान होती है। | [[Image:Bohr atom model.svg|thumb|right|300px|[[ हाइड्रोजन परमाणु | हाइड्रोजन परमाणु]] का रदरफोर्ड-बोह्र मॉडल ({{nowrap|''Z'' {{=}} 1}}) या हाइड्रोजन जैसा आयन ({{nowrap|1=''Z'' > 1}}). इस मॉडल में यह एक आवश्यक विशेषता है कि जब एक इलेक्ट्रॉन एक कक्षीय से दूसरे कक्ष में कूदता है तो उत्सर्जित विद्युत चुम्बकीय विकिरण की फोटॉन ऊर्जा (या आवृत्ति) परमाणु आवेश के गणितीय वर्ग के समानुपाती होती है ({{nowrap|''Z<sup>2</sup>''}}). कई तत्वों के लिए इस विकिरण के [[ हेनरी मोस्ले |हेनरी मोस्ले]] द्वारा प्रायोगिक माप (से {{nowrap|''Z'' {{=}} 13 to 92}}) बोह्र द्वारा भविष्यवाणी के अनुसार परिणाम दिखाया। इस प्रकार परमाणु संख्या की अवधारणा और बोह्र मॉडल दोनों को वैज्ञानिक विश्वास दिया गया।]]किसी [[ रासायनिक तत्व |रासायनिक तत्व]] का परमाणु क्रमांक या परमाणु आवेश संख्या (प्रतीक ''Z'') [[ परमाणु नाभिक |परमाणु नाभिक]] की आवेश संख्या होती है। साधारण नाभिक के लिए, यह प्रोटॉन संख्या के समान है (''n''<sub>p</sub>) या उस तत्व के प्रत्येक [[ परमाणु |परमाणु]] के [[ नाभिक |नाभिक]] में पाए जाने वाले [[ प्रोटॉन |प्रोटॉन]] की संख्या साधारण [[ रासायनिक तत्व |रासायनिक तत्व]] की विशिष्ट पहचान के लिए परमाणु संख्या का उपयोग किया जा सकता है। एक साधारण विद्युत आवेश परमाणु में, परमाणु संख्या भी [[ इलेक्ट्रॉन |इलेक्ट्रॉन]] की संख्या के समान होती है। | ||
एक साधारण परमाणु के लिए, परमाणु संख्या Z और [[ न्यूट्रॉन संख्या ]] N का योग परमाणु का [[ परमाणु द्रव्यमान संख्या ]] A देता है। चूंकि प्रोटॉन और न्यूट्रॉन का द्रव्यमान लगभग समान होता है (और इलेक्ट्रॉनों का द्रव्यमान कई उद्देश्यों के लिए नगण्य होता है) और बंधन ऊर्जा | एक साधारण परमाणु के लिए, परमाणु संख्या Z और [[ न्यूट्रॉन संख्या |न्यूट्रॉन संख्या]] N का योग परमाणु का [[ परमाणु द्रव्यमान संख्या |परमाणु द्रव्यमान संख्या]] A देता है। चूंकि प्रोटॉन और न्यूट्रॉन का द्रव्यमान लगभग समान होता है (और इलेक्ट्रॉनों का द्रव्यमान कई उद्देश्यों के लिए नगण्य होता है) और बंधन ऊर्जा या न्यूक्लियॉन बाइंडिंग का द्रव्यमान परिवर्तन न्यूक्लियॉन द्रव्यमान की तुलना में सदैव छोटा होता है, किसी भी परमाणु का परमाणु द्रव्यमान, जब परमाणु द्रव्यमान इकाई में व्यक्त किया जाता है (एक मात्रा जिसे परमाणु द्रव्यमान कहा जाता है), पूरी संख्या ए के 1% के अंदर होता है। | ||
समान परमाणु संख्या वाले परमाणु किंतु विभिन्न न्यूट्रॉन संख्याएँ, और इसलिए भिन्न द्रव्यमान संख्याएँ, समस्थानिक कहलाती हैं। प्राकृतिक रूप से पाए जाने वाले तत्वों का तीन-चौथाई से थोड़ा अधिक [[ आइसोटोप ]] के मिश्रण के रूप में उपस्थित है ([[ मोनोआइसोटोपिक तत्व ]] देखें), और पृथ्वी पर एक परिभाषित वातावरण में एक तत्व के लिए एक समस्थानिक मिश्रण का औसत समस्थानिक द्रव्यमान (जिसे सापेक्ष परमाणु द्रव्यमान कहा जाता है) निर्धारित करता है तत्व का मानक [[ परमाणु भार ]]ऐतिहासिक रूप से, यह तत्वों के परमाणु भार (हाइड्रोजन की तुलना में) थे जो 19वीं शताब्दी में रसायनज्ञों द्वारा मापने योग्य मात्राएँ थीं। | समान परमाणु संख्या वाले परमाणु किंतु विभिन्न न्यूट्रॉन संख्याएँ, और इसलिए भिन्न द्रव्यमान संख्याएँ, समस्थानिक कहलाती हैं। प्राकृतिक रूप से पाए जाने वाले तत्वों का तीन-चौथाई से थोड़ा अधिक [[ आइसोटोप |आइसोटोप]] के मिश्रण के रूप में उपस्थित है ([[ मोनोआइसोटोपिक तत्व | मोनोआइसोटोपिक तत्व]] देखें), और पृथ्वी पर एक परिभाषित वातावरण में एक तत्व के लिए एक समस्थानिक मिश्रण का औसत समस्थानिक द्रव्यमान (जिसे सापेक्ष परमाणु द्रव्यमान कहा जाता है) निर्धारित करता है तत्व का मानक [[ परमाणु भार |परमाणु भार]] ऐतिहासिक रूप से, यह तत्वों के परमाणु भार (हाइड्रोजन की तुलना में) थे जो 19वीं शताब्दी में रसायनज्ञों द्वारा मापने योग्य मात्राएँ थीं। | ||
पारंपरिक प्रतीक Z [[ जर्मन भाषा ]] के शब्द से आया है {{lang|de|'''Z'''ahl}} 'संख्या', जो, रसायन विज्ञान और भौतिकी से विचारों के आधुनिक संश्लेषण से पहले, [[ आवर्त सारणी ]] में केवल एक तत्व के संख्यात्मक स्थान को दर्शाता है, जिसका क्रम तब लगभग था, किंतु पूरी तरह से नहीं, परमाणु भार द्वारा तत्वों के क्रम के अनुरूप था। 1915 के बाद ही, इस सुझाव और प्रमाण के साथ कि यह Z संख्या भी परमाणु आवेश और परमाणुओं की एक भौतिक विशेषता थी, ने शब्द बनाया {{lang|de|एटम'ज'अहल}} (और इसके अंग्रेजी समतुल्य परमाणु संख्या) इस संदर्भ में समान्य उपयोग में आते हैं। | पारंपरिक प्रतीक Z [[ जर्मन भाषा |जर्मन भाषा]] के शब्द से आया है {{lang|de|'''Z'''ahl}} 'संख्या', जो, रसायन विज्ञान और भौतिकी से विचारों के आधुनिक संश्लेषण से पहले, [[ आवर्त सारणी |आवर्त सारणी]] में केवल एक तत्व के संख्यात्मक स्थान को दर्शाता है, जिसका क्रम तब लगभग था, किंतु पूरी तरह से नहीं, परमाणु भार द्वारा तत्वों के क्रम के अनुरूप था। 1915 के बाद ही, इस सुझाव और प्रमाण के साथ कि यह Z संख्या भी परमाणु आवेश और परमाणुओं की एक भौतिक विशेषता थी, ने शब्द बनाया {{lang|de|एटम'ज'अहल}} (और इसके अंग्रेजी समतुल्य परमाणु संख्या) इस संदर्भ में समान्य उपयोग में आते हैं। | ||
== इतिहास == | == इतिहास == | ||
=== आवर्त सारणी और प्रत्येक तत्व के लिए एक प्राकृतिक संख्या === | === आवर्त सारणी और प्रत्येक तत्व के लिए एक प्राकृतिक संख्या === | ||
[[File:DIMendeleevCab.jpg|thumb|upright|आवर्त सारणी के निर्माता रूसी रसायनज्ञ [[ दिमित्री मेंडेलीव ]]।]]शिथिल रूप से बोलना, तत्वों की आवर्त सारणी का अस्तित्व या निर्माण तत्वों का क्रम बनाता है, और इसलिए उन्हें क्रम में क्रमांकित किया जा सकता है। | [[File:DIMendeleevCab.jpg|thumb|upright|आवर्त सारणी के निर्माता रूसी रसायनज्ञ [[ दिमित्री मेंडेलीव |दिमित्री मेंडेलीव]] ।]]शिथिल रूप से बोलना, तत्वों की आवर्त सारणी का अस्तित्व या निर्माण तत्वों का क्रम बनाता है, और इसलिए उन्हें क्रम में क्रमांकित किया जा सकता है। | ||
दिमित्री मेंडेलीव ने प्रमाणित किया कि उन्होंने अपनी पहली आवर्त सारणी (पहली बार 6 मार्च, 1869 को प्रकाशित) को परमाणु भार (एटोमगेविच) के क्रम में व्यवस्थित किया।<ref name="dm1869">[https://history.aip.org/exhibits/curie/periodic.htm The Periodic Table of Elements], American Institute of Physics</ref> चूँकि, तत्वों के देखे गए रासायनिक गुणों को ध्यान में रखते हुए, उन्होंने क्रम को थोड़ा बदल दिया और [[ टेल्यूरियम ]] (परमाणु भार 127.6) को [[ आयोडीन ]] (परमाणु भार 126.9) से आगे रखा है ।<ref name="dm1869"/><ref>[http://www.rsc.org/chemsoc/visualelements/pages/history_ii.html The Development of the Periodic Table], Royal Society of Chemistry</ref> यह स्थान प्रोटॉन संख्या, जेड द्वारा तत्वों को क्रमबद्ध करने के आधुनिक अभ्यास के अनुरूप है, किंतु वह संख्या उस समय ज्ञात या संदिग्ध नहीं थी। | दिमित्री मेंडेलीव ने प्रमाणित किया कि उन्होंने अपनी पहली आवर्त सारणी (पहली बार 6 मार्च, 1869 को प्रकाशित) को परमाणु भार (एटोमगेविच) के क्रम में व्यवस्थित किया।<ref name="dm1869">[https://history.aip.org/exhibits/curie/periodic.htm The Periodic Table of Elements], American Institute of Physics</ref> चूँकि, तत्वों के देखे गए रासायनिक गुणों को ध्यान में रखते हुए, उन्होंने क्रम को थोड़ा बदल दिया और [[ टेल्यूरियम |टेल्यूरियम]] (परमाणु भार 127.6) को [[ आयोडीन |आयोडीन]] (परमाणु भार 126.9) से आगे रखा है ।<ref name="dm1869"/><ref>[http://www.rsc.org/chemsoc/visualelements/pages/history_ii.html The Development of the Periodic Table], Royal Society of Chemistry</ref> यह स्थान प्रोटॉन संख्या, जेड द्वारा तत्वों को क्रमबद्ध करने के आधुनिक अभ्यास के अनुरूप है, किंतु वह संख्या उस समय ज्ञात या संदिग्ध नहीं थी। | ||
[[File:Niels Bohr.jpg|thumb|upright|[[ बोहर मॉडल ]] के निर्माता [[ नील्स बोह्र ]]।]]चूँकि, आवर्त सारणी की स्थिति पर आधारित एक साधारण संख्या कभी भी पूरी तरह से संतोषजनक नहीं थी। आयोडीन और टेल्यूरियम के स्थिति के अतिरिक्त, बाद में तत्वों के कई अन्य जोड़े (जैसे [[ आर्गन ]] और [[ पोटैशियम | पोटैशियम]], [[ कोबाल्ट ]] और [[ निकल ]]) को लगभग समान या उलट परमाणु भार के लिए जाना जाता था, इस प्रकार आवर्त सारणी में उनके स्थान को उनके रासायनिक द्वारा निर्धारित करने की आवश्यकता होती है। गुण। चूँकि | [[File:Niels Bohr.jpg|thumb|upright|[[ बोहर मॉडल | बोहर मॉडल]] के निर्माता [[ नील्स बोह्र |नील्स बोह्र]] ।]]चूँकि, आवर्त सारणी की स्थिति पर आधारित एक साधारण संख्या कभी भी पूरी तरह से संतोषजनक नहीं थी। आयोडीन और टेल्यूरियम के स्थिति के अतिरिक्त, बाद में तत्वों के कई अन्य जोड़े (जैसे [[ आर्गन |आर्गन]] और [[ पोटैशियम |पोटैशियम]], [[ कोबाल्ट |कोबाल्ट]] और [[ निकल |निकल]] ) को लगभग समान या उलट परमाणु भार के लिए जाना जाता था, इस प्रकार आवर्त सारणी में उनके स्थान को उनके रासायनिक द्वारा निर्धारित करने की आवश्यकता होती है। गुण। चूँकि अधिक से अधिक रासायनिक रूप से समान [[ लैंथेनाइड |लैंथेनाइड]] तत्वों की क्रमिक पहचान, जिनकी परमाणु संख्या स्पष्ट नहीं थी, तत्वों की आवधिक संख्या में कम से कम [[ ल्यूटेशियम |ल्यूटेशियम]] (तत्व 71) से आगे (इस समय [[ हेफ़नियम |हेफ़नियम]] ज्ञात नहीं था) में असंगति और अनिश्चितता का नेतृत्व किया। | ||
=== रदरफोर्ड-बोह्र मॉडल और वैन डेन ब्रोक === | === रदरफोर्ड-बोह्र मॉडल और वैन डेन ब्रोक === | ||
1911 में, [[ अर्नेस्ट रदरफोर्ड ]] ने परमाणु का एक [[ रदरफोर्ड मॉडल ]] दिया जिसमें एक केंद्रीय नाभिक में परमाणु का अधिकांश द्रव्यमान होता है और एक धनात्मक आवेश होता है, जो इलेक्ट्रॉन के आवेश की इकाइयों में, परमाणु के परमाणु भार के लगभग आधे के समान होता है, जिसे व्यक्त किया जाता है। हाइड्रोजन परमाणुओं की संख्या में इस प्रकार यह केंद्रीय प्रभार परमाणु भार का लगभग आधा होगा (चूँकि | 1911 में, [[ अर्नेस्ट रदरफोर्ड |अर्नेस्ट रदरफोर्ड]] ने परमाणु का एक [[ रदरफोर्ड मॉडल |रदरफोर्ड मॉडल]] दिया जिसमें एक केंद्रीय नाभिक में परमाणु का अधिकांश द्रव्यमान होता है और एक धनात्मक आवेश होता है, जो इलेक्ट्रॉन के आवेश की इकाइयों में, परमाणु के परमाणु भार के लगभग आधे के समान होता है, जिसे व्यक्त किया जाता है। हाइड्रोजन परमाणुओं की संख्या में इस प्रकार यह केंद्रीय प्रभार परमाणु भार का लगभग आधा होगा (चूँकि यह सोने की परमाणु संख्या से लगभग 25% भिन्न था {{nowrap|1=(''Z'' = 79}}, {{nowrap|1=''A'' = 197}}), एकमात्र तत्व जिससे रदरफोर्ड ने अनुमान लगाया था)। फिर भी, रदरफोर्ड के अनुमान के अतिरिक्त कि सोने का केंद्रीय प्रभार लगभग 100 था (किंतु तत्व था) {{nowrap|1=''Z'' = 79}} आवर्त सारणी पर), रदरफोर्ड के पेपर के प्रकट होने के एक महीने बाद, [[ एंथोनी वैन डेन ब्रोक |एंथोनी वैन डेन ब्रोक]] ने पहली बार औपचारिक रूप से सुझाव दिया कि एक परमाणु में केंद्रीय आवेश और इलेक्ट्रॉनों की संख्या आवर्त सारणी में इसके स्थान के समान थी (तत्व संख्या, परमाणु संख्या के रूप में भी जाना जाता है) , और प्रतीक Z) यह अंततः स्थिति सिद्ध हुआ। | ||
=== मोसले का 1913 का प्रयोग === | === मोसले का 1913 का प्रयोग === | ||
[[File:Henry Moseley.jpg|thumb|upright|हेनरी मोस्ले अपनी प्रयोगशाला में।]]1913 में हेनरी मोस्ले द्वारा शोध के बाद प्रायोगिक स्थिति में नाटकीय रूप से सुधार हुआ।<ref>[http://www.rsc.org/Education/Teachers/Resources/periodictable/pre16/order.doc Ordering the Elements in the Periodic Table], Royal Chemical Society</ref> मोसले, बोह्र के साथ चर्चा के बाद, जो उसी प्रयोगशाला में थे (और जिन्होंने परमाणु के अपने बोह्र मॉडल में वैन डेन ब्रोक की परिकल्पना का उपयोग किया था), वैन डेन ब्रोक और बोह्र की परिकल्पना का सीधे परीक्षण करने का फैसला किया, यह देखकर कि क्या उत्तेजित परमाणुओं से [[ वर्णक्रमीय रेखा ]]एँ उत्सर्जित होती हैं बोह्र सिद्धांत की धारणा को फिट किया कि वर्णक्रमीय रेखाओं की आवृत्ति Z के वर्ग के समानुपाती होती है। | [[File:Henry Moseley.jpg|thumb|upright|हेनरी मोस्ले अपनी प्रयोगशाला में।]]1913 में हेनरी मोस्ले द्वारा शोध के बाद प्रायोगिक स्थिति में नाटकीय रूप से सुधार हुआ।<ref>[http://www.rsc.org/Education/Teachers/Resources/periodictable/pre16/order.doc Ordering the Elements in the Periodic Table], Royal Chemical Society</ref> मोसले, बोह्र के साथ चर्चा के बाद, जो उसी प्रयोगशाला में थे (और जिन्होंने परमाणु के अपने बोह्र मॉडल में वैन डेन ब्रोक की परिकल्पना का उपयोग किया था), वैन डेन ब्रोक और बोह्र की परिकल्पना का सीधे परीक्षण करने का फैसला किया, यह देखकर कि क्या उत्तेजित परमाणुओं से [[ वर्णक्रमीय रेखा |वर्णक्रमीय रेखा]] एँ उत्सर्जित होती हैं बोह्र सिद्धांत की धारणा को फिट किया कि वर्णक्रमीय रेखाओं की आवृत्ति Z के वर्ग के समानुपाती होती है। | ||
ऐसा करने के लिए, मोसले ने एल्युमीनियम (Z = 13) से सोने (Z = 79) तक के तत्वों द्वारा उत्पादित अंतरतम फोटॉन संक्रमण (K और L रेखा) की तरंग दैर्ध्य को मापा, जो एक एक्स-रे के अंदर चल एनोडिक लक्ष्यों की एक श्रृंखला के रूप में उपयोग किया जाता है। ट्यूब।<ref>{{cite journal|url=http://www.chemistry.co.nz/henry_moseley_article.htm |doi=10.1080/14786441308635052 |title=XCIII। तत्वों की उच्च आवृत्ति स्पेक्ट्रा|journal=Philosophical Magazine |series=Series 6 |volume=26 |issue=156 |pages=1024–1034 |year=1913 |last1=Moseley |first1=H.G.J. |url-status=dead |archive-url=https://web.archive.org/web/20100122022821/http://www.materials.manchester.ac.uk/research/facilities/moseley/biography/ |archive-date=22 January 2010 |df=dmy }}</ref> इन फोटॉनों की आवृत्ति का वर्गमूल {{nowrap|(एक्स-रे)}} एक अंकगणितीय प्रगति में एक लक्ष्य से दूसरे तक बढ़ा इससे यह निष्कर्ष निकला (मोसले का नियम) कि परमाणु संख्या नाभिक के परिकलित विद्युत आवेश, जिससे तत्व संख्या Z के साथ निकटता से मेल खाती है (के-रेखाों के लिए एक इकाई की ऑफसमूह के साथ), अन्य बातों के अतिरिक्त, मोसले ने प्रदर्शित किया कि [[ लेण्टेनियुम ]] श्रृंखला (लान्थेनम से लेकर लुटेटियम समावेशी तक) में 15 सदस्य होने चाहिए- न कम और न अधिक- जो उस समय ज्ञात रसायन विज्ञान से स्पष्ट नहीं था। | ऐसा करने के लिए, मोसले ने एल्युमीनियम (Z = 13) से सोने (Z = 79) तक के तत्वों द्वारा उत्पादित अंतरतम फोटॉन संक्रमण (K और L रेखा) की तरंग दैर्ध्य को मापा, जो एक एक्स-रे के अंदर चल एनोडिक लक्ष्यों की एक श्रृंखला के रूप में उपयोग किया जाता है। ट्यूब।<ref>{{cite journal|url=http://www.chemistry.co.nz/henry_moseley_article.htm |doi=10.1080/14786441308635052 |title=XCIII। तत्वों की उच्च आवृत्ति स्पेक्ट्रा|journal=Philosophical Magazine |series=Series 6 |volume=26 |issue=156 |pages=1024–1034 |year=1913 |last1=Moseley |first1=H.G.J. |url-status=dead |archive-url=https://web.archive.org/web/20100122022821/http://www.materials.manchester.ac.uk/research/facilities/moseley/biography/ |archive-date=22 January 2010 |df=dmy }}</ref> इन फोटॉनों की आवृत्ति का वर्गमूल {{nowrap|(एक्स-रे)}} एक अंकगणितीय प्रगति में एक लक्ष्य से दूसरे तक बढ़ा इससे यह निष्कर्ष निकला (मोसले का नियम) कि परमाणु संख्या नाभिक के परिकलित विद्युत आवेश, जिससे तत्व संख्या Z के साथ निकटता से मेल खाती है (के-रेखाों के लिए एक इकाई की ऑफसमूह के साथ), अन्य बातों के अतिरिक्त, मोसले ने प्रदर्शित किया कि [[ लेण्टेनियुम |लेण्टेनियुम]] श्रृंखला (लान्थेनम से लेकर लुटेटियम समावेशी तक) में 15 सदस्य होने चाहिए- न कम और न अधिक- जो उस समय ज्ञात रसायन विज्ञान से स्पष्ट नहीं था। | ||
=== लापता तत्व === | === लापता तत्व === | ||
| Line 32: | Line 32: | ||
=== प्रोटॉन और परमाणु इलेक्ट्रॉनों का विचार === | === प्रोटॉन और परमाणु इलेक्ट्रॉनों का विचार === | ||
1915 में, Z की इकाइयों में परमाणु आवेश की मात्रा निर्धारित करने का कारण, जिसे अब तत्व संख्या के समान माना जाता था, समझ में नहीं आया प्राउट की परिकल्पना नामक एक पुराने विचार ने माना था कि सभी तत्व सबसे हल्के तत्व हाइड्रोजन के अवशेषों (या प्रोटील) से बने थे, जो बोह्र-रदरफोर्ड मॉडल में एक एकल इलेक्ट्रॉन और एक का परमाणु प्रभार था। चूँकि, 1907 की प्रारंभ | 1915 में, Z की इकाइयों में परमाणु आवेश की मात्रा निर्धारित करने का कारण, जिसे अब तत्व संख्या के समान माना जाता था, समझ में नहीं आया प्राउट की परिकल्पना नामक एक पुराने विचार ने माना था कि सभी तत्व सबसे हल्के तत्व हाइड्रोजन के अवशेषों (या प्रोटील) से बने थे, जो बोह्र-रदरफोर्ड मॉडल में एक एकल इलेक्ट्रॉन और एक का परमाणु प्रभार था। चूँकि, 1907 की प्रारंभ में, रदरफोर्ड और [[ थॉमस रॉयड्स |थॉमस रॉयड्स]] ने दिखाया था कि अल्फा कण, जिनका आवेश +2 था, हीलियम परमाणुओं के नाभिक थे, जिनका द्रव्यमान हाइड्रोजन से चार गुना था, दो बार नहीं। यदि प्राउट की परिकल्पना सत्य थी, तो भारी परमाणुओं के नाभिकों में उपस्थित हाइड्रोजन नाभिकों के कुछ आवेशों को निष्प्रभावी करने के लिए कुछ करना पड़ता था। | ||
1917 में, रदरफोर्ड अल्फा कणों और नाइट्रोजन गैस के बीच एक [[ परमाणु प्रतिक्रिया ]] से हाइड्रोजन नाभिक उत्पन्न करने में सफल रहे,<ref>[http://www.nzhistory.net.nz/people/ernest-rutherford Ernest Rutherford | NZHistory.net.nz, New Zealand history online]. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.</ref> और उन्हें विश्वास था कि उन्होंने प्राउट के नियम को सिद्ध कर दिया है। उन्होंने 1920 में नए भारी परमाणु कणों को प्रोटॉन (वैकल्पिक नाम प्रोटोन और प्रोटाइल्स) कहा मोसले के काम से यह तुरंत स्पष्ट हो गया था कि भारी परमाणुओं के नाभिकों का द्रव्यमान दोगुने से अधिक होता है, जैसा कि उनके [[ हाइड्रोजन ]] नाभिकों से बने होने की अपेक्षा की जाती है, और इस प्रकार अतिरिक्त [[ प्रोटान ]] के निराकरण के लिए एक परिकल्पना की आवश्यकता होती है। सभी भारी नाभिकों में उपस्थित है। एक हीलियम नाभिक को दो आवेशों को समाप्त करने के लिए चार प्रोटॉन और दो परमाणु इलेक्ट्रॉनों (नाभिक के अंदर बंधे इलेक्ट्रॉनों) से बना माना गया था। आवर्त सारणी के दूसरे छोर पर, हाइड्रोजन के 197 गुना द्रव्यमान वाले सोने के एक नाभिक को नाभिक में 118 परमाणु इलेक्ट्रॉनों को समाहित करने के लिए माना जाता था, जिससे इसे +79 का अवशिष्ट आवेश दिया जा सके, जो इसकी परमाणु संख्या के अनुरूप हो। | 1917 में, रदरफोर्ड अल्फा कणों और नाइट्रोजन गैस के बीच एक [[ परमाणु प्रतिक्रिया |परमाणु प्रतिक्रिया]] से हाइड्रोजन नाभिक उत्पन्न करने में सफल रहे,<ref>[http://www.nzhistory.net.nz/people/ernest-rutherford Ernest Rutherford | NZHistory.net.nz, New Zealand history online]. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.</ref> और उन्हें विश्वास था कि उन्होंने प्राउट के नियम को सिद्ध कर दिया है। उन्होंने 1920 में नए भारी परमाणु कणों को प्रोटॉन (वैकल्पिक नाम प्रोटोन और प्रोटाइल्स) कहा मोसले के काम से यह तुरंत स्पष्ट हो गया था कि भारी परमाणुओं के नाभिकों का द्रव्यमान दोगुने से अधिक होता है, जैसा कि उनके [[ हाइड्रोजन |हाइड्रोजन]] नाभिकों से बने होने की अपेक्षा की जाती है, और इस प्रकार अतिरिक्त [[ प्रोटान |प्रोटान]] के निराकरण के लिए एक परिकल्पना की आवश्यकता होती है। सभी भारी नाभिकों में उपस्थित है। एक हीलियम नाभिक को दो आवेशों को समाप्त करने के लिए चार प्रोटॉन और दो परमाणु इलेक्ट्रॉनों (नाभिक के अंदर बंधे इलेक्ट्रॉनों) से बना माना गया था। आवर्त सारणी के दूसरे छोर पर, हाइड्रोजन के 197 गुना द्रव्यमान वाले सोने के एक नाभिक को नाभिक में 118 परमाणु इलेक्ट्रॉनों को समाहित करने के लिए माना जाता था, जिससे इसे +79 का अवशिष्ट आवेश दिया जा सके, जो इसकी परमाणु संख्या के अनुरूप हो। | ||
== [[ न्यूट्रॉन की खोज |न्यूट्रॉन की खोज]] Z को प्रोटॉन संख्या बनाती है == | == [[ न्यूट्रॉन की खोज |न्यूट्रॉन की खोज]] Z को प्रोटॉन संख्या बनाती है == | ||
1932 में न्यूट्रॉन की [[ जेम्स चाडविक | जेम्स चाडविक]] की खोज के साथ परमाणु इलेक्ट्रॉनों के सभी विचार समाप्त हो गए। सोने के एक परमाणु को अब 118 परमाणु इलेक्ट्रॉनों के अतिरिक्त 118 न्यूट्रॉन के रूप में देखा जाता था, और इसके सकारात्मक परमाणु आवेश को अब पूरी तरह से 79 प्रोटॉन की पदार्थ से आने के लिए अनुभव किया गया था। . चूँकि मोसले ने पहले दिखाया था कि किसी तत्व की परमाणु संख्या Z इस धनात्मक आवेश के समान होती है, अब यह स्पष्ट हो गया था कि Z इसके नाभिक के प्रोटॉन की संख्या के समान है। | 1932 में न्यूट्रॉन की [[ जेम्स चाडविक |जेम्स चाडविक]] की खोज के साथ परमाणु इलेक्ट्रॉनों के सभी विचार समाप्त हो गए। सोने के एक परमाणु को अब 118 परमाणु इलेक्ट्रॉनों के अतिरिक्त 118 न्यूट्रॉन के रूप में देखा जाता था, और इसके सकारात्मक परमाणु आवेश को अब पूरी तरह से 79 प्रोटॉन की पदार्थ से आने के लिए अनुभव किया गया था। . चूँकि मोसले ने पहले दिखाया था कि किसी तत्व की परमाणु संख्या Z इस धनात्मक आवेश के समान होती है, अब यह स्पष्ट हो गया था कि Z इसके नाभिक के प्रोटॉन की संख्या के समान है। | ||
== रासायनिक गुण == | == रासायनिक गुण == | ||
तटस्थ परमाणु में उपस्थित इलेक्ट्रॉनों की संख्या के परिणामस्वरूप प्रत्येक तत्व में रासायनिक गुणों का एक विशिष्ट समूह होता है, जो कि Z (परमाणु संख्या) है। इन इलेक्ट्रॉनों का इलेक्ट्रॉन विन्यास [[ क्वांटम यांत्रिकी ]] के सिद्धांतों से अनुसरण करता है। प्रत्येक तत्व के [[ इलेक्ट्रॉन कवच ]] में इलेक्ट्रॉनों की संख्या, विशेष रूप से सबसे बाहरी संयोजी खोल, इसके रासायनिक बंधन व्यवहार को निर्धारित करने में प्राथमिक कारक है। इसलिए, यह केवल परमाणु संख्या है जो किसी तत्व के रासायनिक गुणों को निर्धारित करती है; और यह इस कारण से है कि एक तत्व को एक निश्चित परमाणु संख्या वाले परमाणुओं के किसी भी मिश्रण से मिलकर परिभाषित किया जा सकता है। | तटस्थ परमाणु में उपस्थित इलेक्ट्रॉनों की संख्या के परिणामस्वरूप प्रत्येक तत्व में रासायनिक गुणों का एक विशिष्ट समूह होता है, जो कि Z (परमाणु संख्या) है। इन इलेक्ट्रॉनों का इलेक्ट्रॉन विन्यास [[ क्वांटम यांत्रिकी |क्वांटम यांत्रिकी]] के सिद्धांतों से अनुसरण करता है। प्रत्येक तत्व के [[ इलेक्ट्रॉन कवच |इलेक्ट्रॉन कवच]] में इलेक्ट्रॉनों की संख्या, विशेष रूप से सबसे बाहरी संयोजी खोल, इसके रासायनिक बंधन व्यवहार को निर्धारित करने में प्राथमिक कारक है। इसलिए, यह केवल परमाणु संख्या है जो किसी तत्व के रासायनिक गुणों को निर्धारित करती है; और यह इस कारण से है कि एक तत्व को एक निश्चित परमाणु संख्या वाले परमाणुओं के किसी भी मिश्रण से मिलकर परिभाषित किया जा सकता है। | ||
== नए तत्व == | == नए तत्व == | ||
नए तत्वों की खोज को सामान्यतः | नए तत्वों की खोज को सामान्यतः परमाणु संख्या का उपयोग करके वर्णित किया जाता है। के रूप में {{year}}, परमाणु संख्या 1 से 118 वाले सभी तत्व रासायनिक तत्वों की खोज की समयरेखा नए तत्वों का संश्लेषण आयनों के साथ भारी तत्वों के लक्ष्य परमाणुओं पर बमबारी करके पूरा किया जाता है, जैसे कि लक्ष्य और आयन तत्वों की परमाणु संख्या का योग निर्मित होने वाले तत्व की परमाणु संख्या के समान होता है। सामान्यतः एक [[ न्यूक्लाइड |न्यूक्लाइड]] का आधा जीवन कम हो जाता है क्योंकि परमाणु संख्या बढ़ जाती है, चूँकि प्रोटॉन और न्यूट्रॉन की निश्चित जादुई संख्या (भौतिकी) के साथ [[ विस्तारित आवर्त सारणी |विस्तारित आवर्त सारणी]] में अपेक्षाकृत लंबा आधा जीवन हो सकता है और इसमें स्थिरता का एक द्वीप सम्मिलित है। | ||
एक काल्पनिक [[ न्यूट्रोनियम ]] भी प्रस्तावित किया गया है और इसकी परमाणु संख्या 0 होगी। | एक काल्पनिक [[ न्यूट्रोनियम |न्यूट्रोनियम]] भी प्रस्तावित किया गया है और इसकी परमाणु संख्या 0 होगी। | ||
'''चूँकि | '''चूँकि प्रोटॉन और न्यूट्रॉन की निश्चित जादुई संख्या (भौतिकी) के साथ [[ विस्तारित आवर्त सारणी |विस्तारित आवर्त सारणी]] में अपेक्षाकृत लंबा आधा जीवन हो सकता है और इसमें स्थिरता का एक द्वीप सम्मिलित है।''' | ||
== यह भी देखें == | == यह भी देखें == | ||
Revision as of 14:53, 5 May 2023

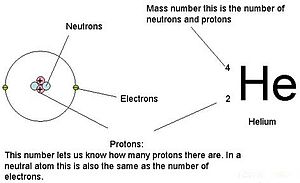
किसी रासायनिक तत्व का परमाणु क्रमांक या परमाणु आवेश संख्या (प्रतीक Z) परमाणु नाभिक की आवेश संख्या होती है। साधारण नाभिक के लिए, यह प्रोटॉन संख्या के समान है (np) या उस तत्व के प्रत्येक परमाणु के नाभिक में पाए जाने वाले प्रोटॉन की संख्या साधारण रासायनिक तत्व की विशिष्ट पहचान के लिए परमाणु संख्या का उपयोग किया जा सकता है। एक साधारण विद्युत आवेश परमाणु में, परमाणु संख्या भी इलेक्ट्रॉन की संख्या के समान होती है।
एक साधारण परमाणु के लिए, परमाणु संख्या Z और न्यूट्रॉन संख्या N का योग परमाणु का परमाणु द्रव्यमान संख्या A देता है। चूंकि प्रोटॉन और न्यूट्रॉन का द्रव्यमान लगभग समान होता है (और इलेक्ट्रॉनों का द्रव्यमान कई उद्देश्यों के लिए नगण्य होता है) और बंधन ऊर्जा या न्यूक्लियॉन बाइंडिंग का द्रव्यमान परिवर्तन न्यूक्लियॉन द्रव्यमान की तुलना में सदैव छोटा होता है, किसी भी परमाणु का परमाणु द्रव्यमान, जब परमाणु द्रव्यमान इकाई में व्यक्त किया जाता है (एक मात्रा जिसे परमाणु द्रव्यमान कहा जाता है), पूरी संख्या ए के 1% के अंदर होता है।
समान परमाणु संख्या वाले परमाणु किंतु विभिन्न न्यूट्रॉन संख्याएँ, और इसलिए भिन्न द्रव्यमान संख्याएँ, समस्थानिक कहलाती हैं। प्राकृतिक रूप से पाए जाने वाले तत्वों का तीन-चौथाई से थोड़ा अधिक आइसोटोप के मिश्रण के रूप में उपस्थित है ( मोनोआइसोटोपिक तत्व देखें), और पृथ्वी पर एक परिभाषित वातावरण में एक तत्व के लिए एक समस्थानिक मिश्रण का औसत समस्थानिक द्रव्यमान (जिसे सापेक्ष परमाणु द्रव्यमान कहा जाता है) निर्धारित करता है तत्व का मानक परमाणु भार ऐतिहासिक रूप से, यह तत्वों के परमाणु भार (हाइड्रोजन की तुलना में) थे जो 19वीं शताब्दी में रसायनज्ञों द्वारा मापने योग्य मात्राएँ थीं।
पारंपरिक प्रतीक Z जर्मन भाषा के शब्द से आया है Zahl 'संख्या', जो, रसायन विज्ञान और भौतिकी से विचारों के आधुनिक संश्लेषण से पहले, आवर्त सारणी में केवल एक तत्व के संख्यात्मक स्थान को दर्शाता है, जिसका क्रम तब लगभग था, किंतु पूरी तरह से नहीं, परमाणु भार द्वारा तत्वों के क्रम के अनुरूप था। 1915 के बाद ही, इस सुझाव और प्रमाण के साथ कि यह Z संख्या भी परमाणु आवेश और परमाणुओं की एक भौतिक विशेषता थी, ने शब्द बनाया एटम'ज'अहल (और इसके अंग्रेजी समतुल्य परमाणु संख्या) इस संदर्भ में समान्य उपयोग में आते हैं।
इतिहास
आवर्त सारणी और प्रत्येक तत्व के लिए एक प्राकृतिक संख्या

शिथिल रूप से बोलना, तत्वों की आवर्त सारणी का अस्तित्व या निर्माण तत्वों का क्रम बनाता है, और इसलिए उन्हें क्रम में क्रमांकित किया जा सकता है।
दिमित्री मेंडेलीव ने प्रमाणित किया कि उन्होंने अपनी पहली आवर्त सारणी (पहली बार 6 मार्च, 1869 को प्रकाशित) को परमाणु भार (एटोमगेविच) के क्रम में व्यवस्थित किया।[1] चूँकि, तत्वों के देखे गए रासायनिक गुणों को ध्यान में रखते हुए, उन्होंने क्रम को थोड़ा बदल दिया और टेल्यूरियम (परमाणु भार 127.6) को आयोडीन (परमाणु भार 126.9) से आगे रखा है ।[1][2] यह स्थान प्रोटॉन संख्या, जेड द्वारा तत्वों को क्रमबद्ध करने के आधुनिक अभ्यास के अनुरूप है, किंतु वह संख्या उस समय ज्ञात या संदिग्ध नहीं थी।
चूँकि, आवर्त सारणी की स्थिति पर आधारित एक साधारण संख्या कभी भी पूरी तरह से संतोषजनक नहीं थी। आयोडीन और टेल्यूरियम के स्थिति के अतिरिक्त, बाद में तत्वों के कई अन्य जोड़े (जैसे आर्गन और पोटैशियम, कोबाल्ट और निकल ) को लगभग समान या उलट परमाणु भार के लिए जाना जाता था, इस प्रकार आवर्त सारणी में उनके स्थान को उनके रासायनिक द्वारा निर्धारित करने की आवश्यकता होती है। गुण। चूँकि अधिक से अधिक रासायनिक रूप से समान लैंथेनाइड तत्वों की क्रमिक पहचान, जिनकी परमाणु संख्या स्पष्ट नहीं थी, तत्वों की आवधिक संख्या में कम से कम ल्यूटेशियम (तत्व 71) से आगे (इस समय हेफ़नियम ज्ञात नहीं था) में असंगति और अनिश्चितता का नेतृत्व किया।
रदरफोर्ड-बोह्र मॉडल और वैन डेन ब्रोक
1911 में, अर्नेस्ट रदरफोर्ड ने परमाणु का एक रदरफोर्ड मॉडल दिया जिसमें एक केंद्रीय नाभिक में परमाणु का अधिकांश द्रव्यमान होता है और एक धनात्मक आवेश होता है, जो इलेक्ट्रॉन के आवेश की इकाइयों में, परमाणु के परमाणु भार के लगभग आधे के समान होता है, जिसे व्यक्त किया जाता है। हाइड्रोजन परमाणुओं की संख्या में इस प्रकार यह केंद्रीय प्रभार परमाणु भार का लगभग आधा होगा (चूँकि यह सोने की परमाणु संख्या से लगभग 25% भिन्न था (Z = 79, A = 197), एकमात्र तत्व जिससे रदरफोर्ड ने अनुमान लगाया था)। फिर भी, रदरफोर्ड के अनुमान के अतिरिक्त कि सोने का केंद्रीय प्रभार लगभग 100 था (किंतु तत्व था) Z = 79 आवर्त सारणी पर), रदरफोर्ड के पेपर के प्रकट होने के एक महीने बाद, एंथोनी वैन डेन ब्रोक ने पहली बार औपचारिक रूप से सुझाव दिया कि एक परमाणु में केंद्रीय आवेश और इलेक्ट्रॉनों की संख्या आवर्त सारणी में इसके स्थान के समान थी (तत्व संख्या, परमाणु संख्या के रूप में भी जाना जाता है) , और प्रतीक Z) यह अंततः स्थिति सिद्ध हुआ।
मोसले का 1913 का प्रयोग
1913 में हेनरी मोस्ले द्वारा शोध के बाद प्रायोगिक स्थिति में नाटकीय रूप से सुधार हुआ।[3] मोसले, बोह्र के साथ चर्चा के बाद, जो उसी प्रयोगशाला में थे (और जिन्होंने परमाणु के अपने बोह्र मॉडल में वैन डेन ब्रोक की परिकल्पना का उपयोग किया था), वैन डेन ब्रोक और बोह्र की परिकल्पना का सीधे परीक्षण करने का फैसला किया, यह देखकर कि क्या उत्तेजित परमाणुओं से वर्णक्रमीय रेखा एँ उत्सर्जित होती हैं बोह्र सिद्धांत की धारणा को फिट किया कि वर्णक्रमीय रेखाओं की आवृत्ति Z के वर्ग के समानुपाती होती है।
ऐसा करने के लिए, मोसले ने एल्युमीनियम (Z = 13) से सोने (Z = 79) तक के तत्वों द्वारा उत्पादित अंतरतम फोटॉन संक्रमण (K और L रेखा) की तरंग दैर्ध्य को मापा, जो एक एक्स-रे के अंदर चल एनोडिक लक्ष्यों की एक श्रृंखला के रूप में उपयोग किया जाता है। ट्यूब।[4] इन फोटॉनों की आवृत्ति का वर्गमूल (एक्स-रे) एक अंकगणितीय प्रगति में एक लक्ष्य से दूसरे तक बढ़ा इससे यह निष्कर्ष निकला (मोसले का नियम) कि परमाणु संख्या नाभिक के परिकलित विद्युत आवेश, जिससे तत्व संख्या Z के साथ निकटता से मेल खाती है (के-रेखाों के लिए एक इकाई की ऑफसमूह के साथ), अन्य बातों के अतिरिक्त, मोसले ने प्रदर्शित किया कि लेण्टेनियुम श्रृंखला (लान्थेनम से लेकर लुटेटियम समावेशी तक) में 15 सदस्य होने चाहिए- न कम और न अधिक- जो उस समय ज्ञात रसायन विज्ञान से स्पष्ट नहीं था।
लापता तत्व
1915 में मोसले की मृत्यु के बाद, हाइड्रोजन से यूरेनियम (Z = 92) तक सभी ज्ञात तत्वों की परमाणु संख्या की जांच उनकी विधि द्वारा की गई। सात तत्व थे (Z < 92 के साथ) जो नहीं मिले थे और इसलिए परमाणु संख्या 43, 61, 72, 75, 85, 87 और 91 के अनुरूप अभी भी अनदेखे के रूप में पहचाने गए।[5] 1918 से 1947 तक, इन सभी सात लापता तत्वों की खोज की गई।[6] इस समय तक, पहले चार ट्रांस्यूरेनियम तत्व भी खोजे जा चुके थे, जिससे क्यूरियम (Z = 96) तक बिना किसी अंतराल के आवर्त सारणी पूरी हो गई थी।
प्रोटॉन और परमाणु इलेक्ट्रॉनों का विचार
1915 में, Z की इकाइयों में परमाणु आवेश की मात्रा निर्धारित करने का कारण, जिसे अब तत्व संख्या के समान माना जाता था, समझ में नहीं आया प्राउट की परिकल्पना नामक एक पुराने विचार ने माना था कि सभी तत्व सबसे हल्के तत्व हाइड्रोजन के अवशेषों (या प्रोटील) से बने थे, जो बोह्र-रदरफोर्ड मॉडल में एक एकल इलेक्ट्रॉन और एक का परमाणु प्रभार था। चूँकि, 1907 की प्रारंभ में, रदरफोर्ड और थॉमस रॉयड्स ने दिखाया था कि अल्फा कण, जिनका आवेश +2 था, हीलियम परमाणुओं के नाभिक थे, जिनका द्रव्यमान हाइड्रोजन से चार गुना था, दो बार नहीं। यदि प्राउट की परिकल्पना सत्य थी, तो भारी परमाणुओं के नाभिकों में उपस्थित हाइड्रोजन नाभिकों के कुछ आवेशों को निष्प्रभावी करने के लिए कुछ करना पड़ता था।
1917 में, रदरफोर्ड अल्फा कणों और नाइट्रोजन गैस के बीच एक परमाणु प्रतिक्रिया से हाइड्रोजन नाभिक उत्पन्न करने में सफल रहे,[7] और उन्हें विश्वास था कि उन्होंने प्राउट के नियम को सिद्ध कर दिया है। उन्होंने 1920 में नए भारी परमाणु कणों को प्रोटॉन (वैकल्पिक नाम प्रोटोन और प्रोटाइल्स) कहा मोसले के काम से यह तुरंत स्पष्ट हो गया था कि भारी परमाणुओं के नाभिकों का द्रव्यमान दोगुने से अधिक होता है, जैसा कि उनके हाइड्रोजन नाभिकों से बने होने की अपेक्षा की जाती है, और इस प्रकार अतिरिक्त प्रोटान के निराकरण के लिए एक परिकल्पना की आवश्यकता होती है। सभी भारी नाभिकों में उपस्थित है। एक हीलियम नाभिक को दो आवेशों को समाप्त करने के लिए चार प्रोटॉन और दो परमाणु इलेक्ट्रॉनों (नाभिक के अंदर बंधे इलेक्ट्रॉनों) से बना माना गया था। आवर्त सारणी के दूसरे छोर पर, हाइड्रोजन के 197 गुना द्रव्यमान वाले सोने के एक नाभिक को नाभिक में 118 परमाणु इलेक्ट्रॉनों को समाहित करने के लिए माना जाता था, जिससे इसे +79 का अवशिष्ट आवेश दिया जा सके, जो इसकी परमाणु संख्या के अनुरूप हो।
न्यूट्रॉन की खोज Z को प्रोटॉन संख्या बनाती है
1932 में न्यूट्रॉन की जेम्स चाडविक की खोज के साथ परमाणु इलेक्ट्रॉनों के सभी विचार समाप्त हो गए। सोने के एक परमाणु को अब 118 परमाणु इलेक्ट्रॉनों के अतिरिक्त 118 न्यूट्रॉन के रूप में देखा जाता था, और इसके सकारात्मक परमाणु आवेश को अब पूरी तरह से 79 प्रोटॉन की पदार्थ से आने के लिए अनुभव किया गया था। . चूँकि मोसले ने पहले दिखाया था कि किसी तत्व की परमाणु संख्या Z इस धनात्मक आवेश के समान होती है, अब यह स्पष्ट हो गया था कि Z इसके नाभिक के प्रोटॉन की संख्या के समान है।
रासायनिक गुण
तटस्थ परमाणु में उपस्थित इलेक्ट्रॉनों की संख्या के परिणामस्वरूप प्रत्येक तत्व में रासायनिक गुणों का एक विशिष्ट समूह होता है, जो कि Z (परमाणु संख्या) है। इन इलेक्ट्रॉनों का इलेक्ट्रॉन विन्यास क्वांटम यांत्रिकी के सिद्धांतों से अनुसरण करता है। प्रत्येक तत्व के इलेक्ट्रॉन कवच में इलेक्ट्रॉनों की संख्या, विशेष रूप से सबसे बाहरी संयोजी खोल, इसके रासायनिक बंधन व्यवहार को निर्धारित करने में प्राथमिक कारक है। इसलिए, यह केवल परमाणु संख्या है जो किसी तत्व के रासायनिक गुणों को निर्धारित करती है; और यह इस कारण से है कि एक तत्व को एक निश्चित परमाणु संख्या वाले परमाणुओं के किसी भी मिश्रण से मिलकर परिभाषित किया जा सकता है।
नए तत्व
नए तत्वों की खोज को सामान्यतः परमाणु संख्या का उपयोग करके वर्णित किया जाता है। के रूप में 2024, परमाणु संख्या 1 से 118 वाले सभी तत्व रासायनिक तत्वों की खोज की समयरेखा नए तत्वों का संश्लेषण आयनों के साथ भारी तत्वों के लक्ष्य परमाणुओं पर बमबारी करके पूरा किया जाता है, जैसे कि लक्ष्य और आयन तत्वों की परमाणु संख्या का योग निर्मित होने वाले तत्व की परमाणु संख्या के समान होता है। सामान्यतः एक न्यूक्लाइड का आधा जीवन कम हो जाता है क्योंकि परमाणु संख्या बढ़ जाती है, चूँकि प्रोटॉन और न्यूट्रॉन की निश्चित जादुई संख्या (भौतिकी) के साथ विस्तारित आवर्त सारणी में अपेक्षाकृत लंबा आधा जीवन हो सकता है और इसमें स्थिरता का एक द्वीप सम्मिलित है।
एक काल्पनिक न्यूट्रोनियम भी प्रस्तावित किया गया है और इसकी परमाणु संख्या 0 होगी।
चूँकि प्रोटॉन और न्यूट्रॉन की निश्चित जादुई संख्या (भौतिकी) के साथ विस्तारित आवर्त सारणी में अपेक्षाकृत लंबा आधा जीवन हो सकता है और इसमें स्थिरता का एक द्वीप सम्मिलित है।
यह भी देखें
- आणविक सिद्धांत
- रासायनिक तत्व
- प्रभावी परमाणु संख्या (बहुविकल्पी)
- सम और विषम परमाणु नाभिक
- विदेशी परमाणु
- आवर्त सारणी का इतिहास
- परमाणु संख्या द्वारा तत्वों की सूची
- जन अंक
- न्यूट्रॉन संख्या
- न्यूट्रॉन-प्रोटॉन अनुपात
- प्राउट की परिकल्पना
संदर्भ
- ↑ 1.0 1.1 The Periodic Table of Elements, American Institute of Physics
- ↑ The Development of the Periodic Table, Royal Society of Chemistry
- ↑ Ordering the Elements in the Periodic Table, Royal Chemical Society
- ↑ Moseley, H.G.J. (1913). "XCIII। तत्वों की उच्च आवृत्ति स्पेक्ट्रा". Philosophical Magazine. Series 6. 26 (156): 1024–1034. doi:10.1080/14786441308635052. Archived from the original on 22 January 2010.
- ↑ Eric Scerri, A tale of seven elements, (Oxford University Press 2013) ISBN 978-0-19-539131-2, p.47
- ↑ Scerri chaps. 3–9 (one chapter per element)
- ↑ Ernest Rutherford | NZHistory.net.nz, New Zealand history online. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.