थर्मोकेमिकल चक्र: Difference between revisions
No edit summary |
No edit summary |
||
| Line 15: | Line 15: | ||
संतुलन तभी दाईं ओर विस्थापित होता है जब ऊर्जा (जल-[[पानी का बंटवारा|विदारण]] के लिए [[तापीय धारिता]] परिवर्तन ΔH) [[ऊष्मप्रवैगिकी]] द्वारा लगाए गए कठिन स्थितियाँ के अनुसार प्रणाली को प्रदान की जाती है: | संतुलन तभी दाईं ओर विस्थापित होता है जब ऊर्जा (जल-[[पानी का बंटवारा|विदारण]] के लिए [[तापीय धारिता]] परिवर्तन ΔH) [[ऊष्मप्रवैगिकी]] द्वारा लगाए गए कठिन स्थितियाँ के अनुसार प्रणाली को प्रदान की जाती है: | ||
* एक अंश को कार्य के रूप में प्रदान किया जाना चाहिए, अर्थात् प्रतिक्रिया के गिब्स मुक्त ऊर्जा परिवर्तन ΔG: इसमें "उत्कृष्ट" ऊर्जा सम्मिलित है, अर्थात् एक संगठित अवस्था के अनुसार जहां पदार्थ को नियंत्रित किया जा सकता है, जैसे इलेक्ट्रोलिसिस के स्थिति में विद्युत पानी। वस्तुतः, उत्पन्न इलेक्ट्रॉन प्रवाह प्रोटॉन (H<sup>+</sup>) | * एक अंश को कार्य के रूप में प्रदान किया जाना चाहिए, अर्थात् प्रतिक्रिया के गिब्स मुक्त ऊर्जा परिवर्तन ΔG: इसमें "उत्कृष्ट" ऊर्जा सम्मिलित है, अर्थात् एक संगठित अवस्था के अनुसार जहां पदार्थ को नियंत्रित किया जा सकता है, जैसे इलेक्ट्रोलिसिस के स्थिति में विद्युत पानी। वस्तुतः, उत्पन्न इलेक्ट्रॉन प्रवाह कैथोड पर प्रोटॉन (H<sup>+</sup>) को कम कर सकता है और एनोड पर आयनों (O<sup>2−</sup>) को ऑक्सीकृत कर सकता है (आयन पानी की रासायनिक ध्रुवीयता के कारण मौजूद हैं), वांछित प्रजातियों की उपज। | ||
* दूसरे को [[गर्मी|ताप]] के रूप में आपूर्ति की जानी चाहिए, अर्थात् प्रजातियों के थर्मल आंदोलन को बढ़ाकर, और [[एन्ट्रापी]] की परिभाषा के बराबर पूर्ण तापमान टी बार प्रतिक्रिया के एन्ट्रॉपी परिवर्तन ΔS के बराबर है। | * दूसरे को [[गर्मी|ताप]] के रूप में आपूर्ति की जानी चाहिए, अर्थात् प्रजातियों के थर्मल आंदोलन को बढ़ाकर, और [[एन्ट्रापी]] की परिभाषा के बराबर पूर्ण तापमान टी बार प्रतिक्रिया के एन्ट्रॉपी परिवर्तन ΔS के बराबर है। | ||
::<math>\Delta H = \Delta G + T\Delta S </math> (2) | ::<math>\Delta H = \Delta G + T\Delta S </math> (2) | ||
Revision as of 21:42, 9 April 2023
थर्मोकेमिकल चक्र पानी को उसके हाइड्रोजन और ऑक्सीजन घटकों में विभाजित करने के लिए रासायनिक प्रतिक्रियाओं के साथ पूरी तरह से ऊष्मा स्रोतों (थर्मो) को जोड़ते हैं।[1] चक्र शब्द का उपयोग इसलिए किया जाता है क्योंकि पानी, हाइड्रोजन और ऑक्सीजन के अतिरिक्त, इन प्रक्रियाओं में उपयोग किए जाने वाले रासायनिक यौगिकों को निरंतर पुनर्नवीनीकरण किया जाता है।
यदि कार्य (ऊष्मप्रवैगिकी) को आंशिक रूप से एक उत्पादक सामग्री के रूप में उपयोग किया जाता है, तो परिणामी 'थर्मोकेमिकल चक्र' को एक संकर के रूप में परिभाषित किया जाता है।
इतिहास
इस अवधारणा को प्रारंभिक समय में फंक और रेनस्ट्रॉम (1966) द्वारा स्थिर और प्रचुर मात्रा में प्रजातियों (जैसे पानी, नाइट्रोजन) और ताप स्रोतों से ईंधन (जैसे हाइड्रोजन, अमोनिया) का उत्पादन करने के लिए एक अधिकतम कुशल विधि के रूप में माना गया था।[2] यद्यपि 1973 के तेल संकट से पहले ईंधन की उपलब्धता पर कठिनता से विचार किया गया था, महत्वपूर्ण उच्च बाजार में कुशल ईंधन उत्पादन एक ज्वलंत विषय था। एक उदाहरण के रूप में, सैन्य खाद्य-सामग्री क्षेत्र में, दूरस्थ युद्धक्षेत्रों में वाहनों के लिए ईंधन उपलब्ध कराना एक महत्वपूर्ण कार्य है। इसलिए, एक सुवाहय़ ताप स्रोत (एक परमाणु ऊर्जा पर विचार किया गया था) पर आधारित एक अस्थिर उत्पादन प्रणाली का अत्यंत रुचि के साथ परीक्षण किया जा रहा था।
तेल संकट के बाद, ऊर्जा स्वतंत्रता जैसे उद्देश्यों के लिए ऐसी प्रक्रियाओं को रेखांकित, परीक्षण और योग्य बनाने के लिए कई कार्यक्रम (यूरोप, जापान, संयुक्त राज्य अमेरिका) बनाए गए थे। उच्च तापमान (लगभग 1,000 K (730 °C; 1,340 °F) परिचालित तापमान) परमाणु रिएक्टरों को अभी भी संभावित ताप स्रोत माना जाता था। यद्यपि, प्रारंभिक ऊष्मप्रवैगिकी अध्ययनों के आधार पर आशावादी अपेक्षाओं को मानक विधियों (विद्युत उत्पादन के लिए थर्मोडायनामिक चक्र, पानी के इलेक्ट्रोलिसिस के साथ युग्मित) और कई व्यावहारिक विषयों (यहां तक कि परमाणु रिएक्टरों से अपर्याप्त तापमान, धीमी प्रतिक्रियाशीलता, रिएक्टर क्षरण) की तुलना में व्यावहारिक विश्लेषणों द्वारा त्वरितता से नियंत्रित किया गया था। , समय के साथ मध्यवर्ती यौगिकों का महत्वपूर्ण हानि...)[3] इसलिए, इस विधि के लिए रुचि अगले दशकों के समय क्षीण हो गई,[4] या कम से कम कुछ समझौताकारी समन्वयन (हाइब्रिड संस्करण) को प्रतिक्रियाओं के लिए मात्र ताप के अतिरिक्त आंशिक ऊर्जा उत्पादक सामग्री के रूप में विद्युत के उपयोग के साथ माना जा रहा था (जैसे हाइब्रिड सल्फर चक्र)। वर्ष 2000 में एक पुनस्र्त्थान को नवीन ऊर्जा संकट, विद्युत की मांग, और केंद्रित सौर ऊर्जा प्रौद्योगिकियों के विकास की तीव्र गति दोनों के द्वारा समझाया जा सकता है, जिनके संभावित अत्यंत उच्च तापमान थर्मोकेमिकल प्रक्रियाओं के लिए आदर्श हैं,[5] जबकि थर्माकेमिकल चक्रों के पर्यावरण के अनुकूल पक्ष ने एक संभावित उच्चतम तेल बिंदु परिणाम से संबंधित अवधि में धन को आकर्षित किया
एकल प्रतिक्रिया के माध्यम से जल-विभाजन
निरंतर दबाव और थर्मोडायनामिक तापमान T पर थर्मोडायनामिक संतुलन में रासायनिक प्रकार (जैसे जल का विदारण) से बनी प्रणाली पर विचार करें:
- H2O (l) H2(g) + 1/2 O2(g) (1)
संतुलन तभी दाईं ओर विस्थापित होता है जब ऊर्जा (जल-विदारण के लिए तापीय धारिता परिवर्तन ΔH) ऊष्मप्रवैगिकी द्वारा लगाए गए कठिन स्थितियाँ के अनुसार प्रणाली को प्रदान की जाती है:
- एक अंश को कार्य के रूप में प्रदान किया जाना चाहिए, अर्थात् प्रतिक्रिया के गिब्स मुक्त ऊर्जा परिवर्तन ΔG: इसमें "उत्कृष्ट" ऊर्जा सम्मिलित है, अर्थात् एक संगठित अवस्था के अनुसार जहां पदार्थ को नियंत्रित किया जा सकता है, जैसे इलेक्ट्रोलिसिस के स्थिति में विद्युत पानी। वस्तुतः, उत्पन्न इलेक्ट्रॉन प्रवाह कैथोड पर प्रोटॉन (H+) को कम कर सकता है और एनोड पर आयनों (O2−) को ऑक्सीकृत कर सकता है (आयन पानी की रासायनिक ध्रुवीयता के कारण मौजूद हैं), वांछित प्रजातियों की उपज।
- दूसरे को ताप के रूप में आपूर्ति की जानी चाहिए, अर्थात् प्रजातियों के थर्मल आंदोलन को बढ़ाकर, और एन्ट्रापी की परिभाषा के बराबर पूर्ण तापमान टी बार प्रतिक्रिया के एन्ट्रॉपी परिवर्तन ΔS के बराबर है।
- (2)
इसलिए, एक परिवेशी तापमान के लिए 298K (केल्विन) का T° और 1 atm (वातावरण (यूनिट)) का दबाव (ΔG° और ΔS° क्रमशः 237 kJ/mol और 163 J/mol/K के बराबर हैं, सापेक्ष में) पानी की प्रारंभिक मात्रा), पानी के बंटवारे को आगे बढ़ाने के लिए आवश्यक ऊर्जा ΔH का 80% से अधिक कार्य के रूप में प्रदान किया जाना चाहिए।
यदि सादगी के लिए चरण संक्रमणों की उपेक्षा की जाती है (उदाहरण के लिए पानी को तरल अवस्था में रखने के लिए दबाव में पानी का इलेक्ट्रोलिसिस), तो कोई यह मान सकता है कि ΔH et ΔS दिए गए तापमान परिवर्तन के लिए महत्वपूर्ण रूप से भिन्न नहीं होते हैं। इस प्रकार इन पैरामीटरों को तापमान T° पर उनके मानक मानों ΔH° et ΔS° के बराबर लिया जाता है। नतीजतन, तापमान T पर आवश्यक कार्य है,
- (3)
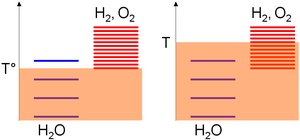
चूंकि ΔS° धनात्मक है, तापमान में वृद्धि से आवश्यक कार्य में कमी आती है। यह उच्च तापमान इलेक्ट्रोलिसिस का आधार है। इसे सहज रूप से रेखांकन द्वारा भी समझाया जा सकता है। पूर्ण तापमान टी के आधार पर रासायनिक प्रजातियों में विभिन्न उत्तेजना स्तर हो सकते हैं, जो थर्मल आंदोलन का एक उपाय है। उत्तरार्द्ध बंद प्रणाली के अंदर परमाणुओं या अणुओं के बीच झटके का कारण बनता है जैसे कि उत्तेजना स्तरों के बीच फैलने वाली ऊर्जा समय के साथ बढ़ जाती है, और रुक जाती है (संतुलन) मात्र तभी जब अधिकांश प्रजातियों में समान उत्तेजना स्तर होते हैं (अत्यधिक उत्तेजित स्तर में एक अणु जल्दी से वापस आ जाएगा) टक्करों द्वारा कम ऊर्जा की स्थिति में) (एन्ट्रॉपी (सांख्यिकीय ऊष्मप्रवैगिकी))।
निरपेक्ष तापमान पैमाने के सापेक्ष, प्रजातियों के उत्तेजन स्तरों को गठन संबंधी विचारों के मानक एन्थैल्पी परिवर्तन के आधार पर इकट्ठा किया जाता है; अर्थात् उनकी स्थिरता। चूंकि यह मान पानी के लिए शून्य है लेकिन ऑक्सीजन और हाइड्रोजन के लिए सख्ती से सकारात्मक है, इन अंतिम प्रजातियों के अधिकांश उत्तेजना स्तर पानी के ऊपर हैं। फिर, किसी दिए गए तापमान रेंज के लिए उत्तेजना स्तरों का घनत्व नीरस रूप से प्रजातियों की एन्ट्रापी के साथ बढ़ रहा है। जल-विभाजन के लिए एक सकारात्मक एन्ट्रापी परिवर्तन का मतलब उत्पादों में कहीं अधिक उत्तेजना स्तर है। फलस्वरूप,
- एक कम तापमान (T°), थर्मल आंदोलन ज्यादातर पानी के अणुओं को उत्तेजित करने की अनुमति देता है क्योंकि हाइड्रोजन और ऑक्सीजन के स्तर के लिए उच्च तापीय आंदोलन की आवश्यकता होती है (मनमानी आरेख पर, ऑक्सीजन के लिए पानी बनाम 1 के लिए 3 स्तरों को पॉप्युलेट किया जा सकता है) /हाइड्रोजन सबसिस्टम),
- उच्च तापमान (टी) पर, थर्मल आंदोलन ऑक्सीजन/हाइड्रोजन सबसिस्टम उत्तेजना स्तरों को उत्तेजित करने के लिए पर्याप्त है (मनमानी आरेख पर, ऑक्सीजन/हाइड्रोजन सबसिस्टम के लिए पानी बनाम 8 के लिए 4 स्तरों को पॉप्युलेट किया जा सकता है)। पिछले कथनों के अनुसार, प्रणाली इस प्रकार उस रचना की ओर विकसित होगी जहाँ इसके अधिकांश उत्तेजना स्तर समान हैं, अर्थात अधिकांश ऑक्सीजन और हाइड्रोजन प्रजातियाँ।
कोई कल्पना कर सकता है कि यदि T Eq में काफी अधिक था। (3), ΔG को अशक्त किया जा सकता है, जिसका अर्थ है कि पानी का बंटवारा बिना काम के भी होगा (पानी का थेर्मलिसिस)। यद्यपि संभव है, इसके लिए अत्यधिक उच्च तापमान की आवश्यकता होगी: तरल पानी के अतिरिक्त स्वाभाविक रूप से भाप के साथ एक ही प्रणाली पर विचार करना (ΔH° = 242 kJ/mol; ΔS° = 44 J/mol/K) इसलिए 3000K से ऊपर आवश्यक तापमान देगा, जिससे रिएक्टर डिजाइन और संचालन अत्यंत चुनौतीपूर्ण।[6] इसलिए, एक एकल प्रतिक्रिया मात्र ताप से हाइड्रोजन और ऑक्सीजन का उत्पादन करने के लिए मात्र एक स्वतंत्रता डिग्री (टी) प्रदान करती है (यद्यपि ले चेटेलियर के सिद्धांत का उपयोग थर्मोलिसिस तापमान को थोड़ा कम करने की अनुमति देगा, इस मामले में गैस उत्पादों को निकालने के लिए काम प्रदान किया जाना चाहिए प्रणाली)
एकाधिक प्रतिक्रियाओं के साथ जल-विभाजन
इसके विपरीत, जैसा कि फंक और रेनस्ट्रॉम द्वारा दिखाया गया है, कई प्रतिक्रियाएँ (जैसे k चरण) अलग-अलग एन्ट्रापी परिवर्तनों के लिए काम के बिना सहज जल-विभाजन की अनुमति देने के लिए अतिरिक्त साधन प्रदान करती हैं।i प्रत्येक प्रतिक्रिया के लिए मैं। पानी के थर्मोलिसिस की तुलना में एक अतिरिक्त लाभ यह है कि ऑक्सीजन और हाइड्रोजन अलग-अलग उत्पन्न होते हैं, उच्च तापमान पर जटिल पृथक्करण से बचते हैं।[7] पानी के बंटवारे के बराबर होने वाली कई प्रतिक्रियाओं के लिए पहली पूर्व-आवश्यकताएँ (Eqs। (4) और (5)) तुच्छ हैं (cf. Hess's law):
- (4)
- (5)
इसी प्रकार, प्रक्रिया द्वारा आवश्यक कार्य ΔG प्रत्येक प्रतिक्रिया कार्य ΔG का योग हैi:
- (6)
Eq के रूप में। (3) एक सामान्य कानून है, इसे प्रत्येक ΔG को विकसित करने के लिए नवीनसिरे से इस्तेमाल किया जा सकता हैi अवधि। यदि धनात्मक (p सूचकांक) और ऋणात्मक (n सूचकांक) एन्ट्रापी परिवर्तनों के साथ प्रतिक्रियाएँ अलग-अलग योगों के रूप में व्यक्त की जाती हैं, तो यह देता है,
- (7)
Eq का उपयोग करना। (6) मानक स्थितियों के लिए ΔG ° को गुणनखंडित करने की अनुमति देता हैi शर्तों, उपज,
- (8)
अब Eq में प्रत्येक योग के योगदान पर विचार करें। (8): ΔG को कम करने के लिए, उन्हें यथासंभव नकारात्मक होना चाहिए:
- : -ΔS°i नकारात्मक हैं, इसलिए (टी-टी °) जितना संभव हो उतना उच्च होना चाहिए: इसलिए, अधिकतम प्रक्रिया तापमान टी पर काम करना चुनते हैंH
- : -ΔS°i धनात्मक हैं, ΔG को घटाने के लिए (T-T°) को आदर्श रूप से ऋणात्मक होना चाहिए। व्यावहारिक रूप से, कोई भी इस परेशानी की अवधि से छुटकारा पाने के लिए न्यूनतम प्रक्रिया तापमान के रूप में T के बराबर T ° सेट कर सकता है (ऊर्जा उत्पादन के लिए मानक तापमान से कम तापमान की आवश्यकता वाली प्रक्रिया एक भौतिक बेतुकापन है क्योंकि इसमें रेफ्रिजरेटर की आवश्यकता होगी और इस प्रकार एक उच्च आउटपुट की तुलना में कार्य उत्पादक सामग्री)। नतीजतन, समीकरण (8) बन जाता है,
- (9)
अंत में, कोई भी इस अंतिम समीकरण से शून्य कार्य आवश्यकता (ΔG ≤ 0) के लिए आवश्यक रिश्ते को घटा सकता है।
- (10)
नतीजतन, i चरणों वाले थर्मोकेमिकल चक्र को जल-विभाजन और संतोषजनक समीकरणों (4), (5) और (10) के बराबर i प्रतिक्रियाओं के अनुक्रम के रूप में परिभाषित किया जा सकता है। उस मामले में याद रखने वाली मुख्य बात यह है कि प्रक्रिया का तापमान TH सैद्धांतिक रूप से मनमाने ढंग से चुना जा सकता है (उच्च तापमान परमाणु रिएक्टरों के लिए पिछले अध्ययनों में संदर्भ के रूप में 1000K), पानी के थर्मोलिसिस से बहुत नीचे।
यह समीकरण वैकल्पिक रूप से (और स्वाभाविक रूप से) कार्नोट के प्रमेय (थर्मोडायनामिक्स) के माध्यम से प्राप्त किया जा सकता है।
* चक्रीय संचालन के लिए अलग-अलग तापमान के कम से कम दो ताप स्रोतों की आवश्यकता होती है, अन्यथा सतत गति संभव होगी। थर्मोलिसिस के मामले में यह तुच्छ है, क्योंकि ईंधन एक उलटा प्रतिक्रिया के माध्यम से भस्म हो जाता है। नतीजतन, यदि मात्र एक तापमान (थर्मोलिसिस एक) है, तो ईंधन सेल में अधिकतम कार्य वसूली उसी तापमान पर जल-विभाजन प्रतिक्रिया की गिब्स मुक्त ऊर्जा के विपरीत होती है, अर्थात् थर्मोलिसिस की परिभाषा के अनुसार शून्य। या अलग विधि से कहा जाए तो, एक ईंधन को उसकी अस्थिरता से परिभाषित किया जाता है, इसलिए यदि पानी/हाइड्रोजन/ऑक्सीजन प्रणाली मात्र हाइड्रोजन और ऑक्सीजन (संतुलन अवस्था) के रूप में उपस्थित है, दहन (इंजन) या ईंधन सेल में उपयोग संभव नहीं होगा।
- एंडोथर्मिक प्रतिक्रियाओं को सकारात्मक एन्ट्रापी परिवर्तनों के साथ चुना जाता है ताकि तापमान बढ़ने पर और एक्सोथर्मिक प्रतिक्रियाओं के विपरीत हो सके।
- अधिकतम उष्मा-से-कार्य दक्षता समान प्रक्रिया स्थितियों वाले कार्नाट ताप इंजन में से एक है, अर्थात् टी पर एक गर्म ताप स्रोतH और T° पर एक ठंडा,
- (11)
- कार्य आउटपुट डब्ल्यू हाइड्रोजन और ऑक्सीजन उत्पादों में संग्रहीत महान ऊर्जा है (उदाहरण के लिए ईंधन सेल में ईंधन की खपत के समय विद्युत के रूप में जारी)। इस प्रकार यह जल-विभाजन ΔG के मुक्त गिब्स ऊर्जा परिवर्तन के अनुरूप है, और प्रक्रिया के न्यूनतम तापमान (T°) पर समीकरण (3) के अनुसार अधिकतम है जहां यह ΔG° के बराबर है।
- ऊष्मा उत्पादक सामग्री Q तापमान T पर गर्म स्रोत द्वारा प्रदान की जाने वाली ऊष्मा हैH थर्मोकेमिकल चक्र की एन्दोठेर्मिक प्रतिक्रियाओं के लिए (ईंधन खपत सबसिस्टम एक्ज़ोथिर्मिक है):
- (12)
- इसलिए, तापमान T पर प्रत्येक ऊष्मा की आवश्यकताH है,
- (13)
- Eq.(13) को Eq.(12) में प्रतिस्थापित करने पर प्राप्त होता है:
- (14)
परिणामस्वरूप, समीकरण (11) में W (ΔG°) और Q (समीकरण (14)) को प्रतिस्थापित करने पर समीकरण (10) को पुनर्गठित करने के बाद प्राप्त होता है (यह मानते हुए कि ΔSi तापमान के साथ महत्वपूर्ण परिवर्तन नहीं होता है, अर्थात ΔS° के बराबर होते हैंi)
समीकरण (10) में अधिकतम प्रक्रिया तापमान टी के अनुसार ऐसी प्रक्रिया के लिए प्रतिक्रियाओं की न्यूनतम संख्या के बारे में व्यावहारिक प्रभाव हैंH.[8] वस्तुतः, मूल रूप से चुनी गई स्थितियों (टी के साथ उच्च तापमान वाले परमाणु रिएक्टर) के मामले में एक संख्यात्मक अनुप्रयोग (ΔG ° भाप के रूप में माने जाने वाले पानी के लिए 229 kJ/K के बराबर है)H और T° क्रमशः 1000K और 298K के बराबर) सकारात्मक एन्ट्रॉपी परिवर्तन ΔS° के योग के लिए लगभग 330 J/mol/K का न्यूनतम मान देता हैi प्रक्रिया प्रतिक्रियाओं की।
यह अंतिम मान बहुत अधिक है क्योंकि अधिकांश प्रतिक्रियाओं में 50 J/mol/K से नीचे एन्ट्रापी परिवर्तन मान होते हैं, और यहां तक कि एक ऊंचा (जैसे तरल पानी से पानी का विभाजन: 163 J/mol/K) दो गुना कम होता है। नतीजतन, तीन चरणों से कम से बना थर्मोकेमिकल चक्र मूल रूप से नियोजित ताप स्रोतों (1000K से नीचे) के साथ व्यावहारिक रूप से असंभव है, या हाइब्रिड संस्करणों की आवश्यकता होती है
हाइब्रिड थर्मोकेमिकल चक्र
इस मामले में, अपेक्षाकृत छोटे कार्य उत्पादक सामग्री डब्ल्यू के माध्यम से एक अतिरिक्त स्वतंत्रता की डिग्री जोड़ी जाती हैadd (अधिकतम काम की खपत, Eq। (9) ΔG ≤ W के साथadd), और समीकरण (10) बन जाता है,
- (15)
अगर डब्ल्यूadd प्रक्रिया ऊष्मा Q (Eq। (14)) के एक अंश f के रूप में व्यक्त किया जाता है, Eq। (15) पुनर्गठन के बाद बन जाता है,
- (16)
ऊष्मा उत्पादक सामग्री के एक अंश f के बराबर कार्य उत्पादक सामग्री का उपयोग शुद्ध समान थर्मोकेमिकल चक्र को संचालित करने के लिए प्रतिक्रियाओं की पसंद के सापेक्ष होता है, लेकिन एक गर्म स्रोत के साथ तापमान में समान अनुपात f से वृद्धि होती है।
स्वाभाविक रूप से, यह ताप-से-कार्य क्षमता को उसी अनुपात में घटाता है f। नतीजतन, यदि कोई 2000K ताप स्रोत (1000K के अतिरिक्त) के साथ चलने वाले थर्मोकेमिकल चक्र के समान प्रक्रिया चाहता है, तो अधिकतम ताप-से-कार्य दक्षता दो बार कम होती है। जैसा कि वास्तविक क्षमताएं अक्सर आदर्श क्षमता से काफी कम होती हैं, इस प्रकार ऐसी प्रक्रिया दृढ़ता से सीमित होती है।
व्यावहारिक रूप से, कार्य का उपयोग उत्पाद पृथक्करण जैसे प्रमुख चरणों तक ही सीमित है, जहां कार्य पर निर्भर विधि (जैसे इलेक्ट्रोलिसिस) में कभी-कभी मात्र ताप (जैसे आसवन) का उपयोग करने वालों की तुलना में कम समस्याएं हो सकती हैं।
विशेष मामला: दो-चरण थर्मोकेमिकल चक्र
समीकरण (10) के अनुसार, सकारात्मक एंट्रॉपी परिवर्तनों के योग के लिए न्यूनतम आवश्यक एंट्रॉपी परिवर्तन (सही अवधि) टी होने पर घट जाती हैH बढ़ती है। एक उदाहरण के रूप में, समान संख्यात्मक अनुप्रयोग करना लेकिन T के साथH 2000K के बराबर दो बार कम मान (लगभग 140 kJ/mol) देगा, जो थर्मोकेमिकल चक्रों को मात्र दो प्रतिक्रियाओं के साथ अनुमति देता है। इस तरह की प्रक्रियाओं को वास्तविक रूप से सोलर अपड्राफ्ट टॉवर जैसी केंद्रित सौर ऊर्जा प्रौद्योगिकियों के साथ जोड़ा जा सकता है। यूरोप में एक उदाहरण के रूप में, यह Hydrosol-2 परियोजना (ग्रीस, जर्मनी (जर्मन एयरोस्पेस सेंटर), स्पेन, डेनमार्क, इंग्लैंड) का लक्ष्य है। [9] और ईटीएच ज्यूरिख के सौर विभाग और पॉल शेरर संस्थान (स्विट्जरलैंड) के शोधों के बारे में।[10] उच्च एन्ट्रापी परिवर्तनों को संतुष्ट करने वाली प्रतिक्रियाओं के उदाहरण धातु ऑक्साइड पृथक्करण (रसायन विज्ञान) हैं, क्योंकि उत्पादों में अभिकारक (क्रिस्टलीय संरचना के साथ ठोस) की तुलना में उनकी गैसीय अवस्था (धातु वाष्प और ऑक्सीजन) के कारण अधिक उत्तेजना स्तर होता है, इसलिए समरूपता नाटकीय रूप से संख्याओं की संख्या को कम कर देती है। विभिन्न उत्तेजना स्तर)। नतीजतन, ये एन्ट्रापी परिवर्तन अक्सर जल-विभाजन वाले से बड़े हो सकते हैं और इस प्रकार थर्मोकेमिकल प्रक्रिया में एक नकारात्मक एन्ट्रापी परिवर्तन के साथ प्रतिक्रिया की आवश्यकता होती है ताकि ईक। (5) संतुष्ट हो। इसके अतिरिक्त, थर्मोलिसिस और ऑक्साइड पृथक्करण दोनों के लिए अभिकारक (ΔH °) की समान स्थिरता को मानते हुए, दूसरे मामले में एक बड़ा एन्ट्रापी परिवर्तन फिर से कम प्रतिक्रिया तापमान (Eq। (3)) की व्याख्या करता है।
आइए हम दो प्रतिक्रियाओं को मान लें, सकारात्मक (1 सबस्क्रिप्ट, टी परH) और ऋणात्मक (2 सबस्क्रिप्ट, T° पर) एन्ट्रापी परिवर्तन। टी रखने के लिए एक अतिरिक्त संपत्ति प्राप्त की जा सकती हैH थर्मोलिसिस तापमान से सख्ती से कम: प्रतिक्रियाओं के बीच मानक थर्मोडायनामिक मूल्यों को असमान रूप से वितरित किया जाना चाहिए।[11] वस्तुतः, सामान्य समीकरणों (2) (सहज प्रतिक्रिया), (4) और (5) के अनुसार, किसी को संतुष्ट होना चाहिए,
- (17)
इसलिए, यदि ΔH°1 ΔH° के समानुपाती होता है2 किसी दिए गए कारक से, और यदि ΔS°1 और ΔS °2 एक समान कानून (समान आनुपातिकता कारक) का पालन करें, असमानता (17) टूट गई है (इसके अतिरिक्त समानता, इसलिए टीH पानी के थर्मोलिसिस तापमान के बराबर)।
उदाहरण
ऐसे सैकड़ों चक्रों का प्रस्ताव और परीक्षण की गई है। कंप्यूटर की उपलब्धता से यह कार्य आसान हो गया है, थर्मोडायनामिक डेटाबेस के आधार पर रासायनिक प्रतिक्रियाओं के अनुक्रमों की एक व्यवस्थित परीक्षण की अनुमति देता है।[12] इस लेख में मात्र मुख्य परिवारों का वर्णन किया जाएगा।[13]
दो-चरण चक्र
दो-चरण थर्मोकेमिकल चक्र, जिसमें अक्सर धातु आक्साइड सम्मिलित होते हैं,[14] प्रतिक्रिया की प्रकृति के आधार पर दो श्रेणियों में विभाजित किया जा सकता है: वाष्पशील और गैर-वाष्पशील। वाष्पशील चक्र धातु प्रजातियों का उपयोग करते हैं जो धातु ऑक्साइड की कमी के समय उदात्त होते हैं, और गैर-वाष्पशील चक्रों को आगे स्टोइकोमेट्रिक चक्रों और गैर-स्टोइकियोमेट्रिक चक्रों में वर्गीकृत किया जा सकता है। स्टोकिओमेट्रिक चक्र के आधे चक्र में कमी के समय, धातु ऑक्साइड कम हो जाता है और विभिन्न ऑक्सीकरण अवस्थाों (Fe) के साथ एक नया धातु ऑक्साइड बनाता है।3O4 → 3FeO + 1/2 हे2); धातु ऑक्साइड के एक गैर-स्टोकियोमेट्रिक चक्र की कमी रिक्तियों का उत्पादन करेगी, अक्सर ऑक्सीजन की रिक्तियां, लेकिन क्रिस्टल संरचना स्थिर रहती है और धातु परमाणुओं का मात्र एक हिस्सा उनके ऑक्सीकरण अवस्था (CeO) को बदलता है।2 → सीईओ2-δ + डी/2 ओ2).
सीईओ के साथ गैर-स्टोइकोमेट्रिक चक्र2
सीईओ के साथ गैर-स्टोइकोमेट्रिक चक्र2 निम्नलिखित प्रतिक्रियाओं के साथ वर्णित किया जा सकता है:
- कमी प्रतिक्रिया: सीईओ2 → सीईओ2-δ + डी/2 ओ2
- ऑक्सीकरण प्रतिक्रिया: CeO2-δ + डी एच2ओ → सीईओ2 + डी एच2
कमी तब होती है जब CeO2, या सेरिया, लगभग 1500 °C से 1600 °C पर एक निष्क्रिय वातावरण के संपर्क में है,[15] और हाइड्रोजन रिलीज हाइड्रोलिसिस के समय 800 डिग्री सेल्सियस पर होता है जब यह जल वाष्प युक्त वातावरण के अधीन होता है। आयरन ऑक्साइड पर सेरिया का एक लाभ इसके उच्च गलनांक में निहित है, जो इसे अपचयन चक्र के समय उच्च तापमान बनाए रखने की अनुमति देता है। इसके अतिरिक्त, सेरिया की आयनिक चालकता ऑक्सीजन परमाणुओं को इसकी संरचना के माध्यम से फैलाने की अनुमति देती है, आयरन ऑक्साइड के माध्यम से Fe आयनों की तुलना में परिमाण के कई आदेश तेजी से फैल सकते हैं। नतीजतन, सेरिया की रेडॉक्स प्रतिक्रियाएं बड़े पैमाने पर हो सकती हैं, जिससे यह थर्मोकेमिकल रिएक्टर परीक्षण के लिए एक आदर्श उम्मीदवार बन जाता है। सेरिया-आधारित थर्मोकेमिकल रिएक्टर का निर्माण और परीक्षण 2010 की शुरुआत में किया गया था, और साइकिल चलाने की व्यवहार्यता यथार्थवादी सौर संकेंद्रण स्थितियों के अनुसार पुष्टि की गई थी। एक नुकसान जो सेरिया के अनुप्रयोग को सीमित करता है, वह इसकी अपेक्षाकृत कम ऑक्सीजन भंडारण क्षमता है।
गैर-स्टोइकियोमेट्रिक चक्र पर्कोव्साइट के साथ
पेरोसाइट एबीओ के साथ गैर-स्टोइकोमेट्रिक चक्र3 निम्नलिखित प्रतिक्रियाओं के साथ वर्णित किया जा सकता है:
- न्यूनीकरण प्रतिक्रिया: ABO3 → उन्हें3-δ + डी/2 ओ2
- ऑक्सीकरण प्रतिक्रिया: एबीओ3-δ + डी एच2ओ → महिला3 + डी एच2
पेरोसाइट की कमी ऊष्मप्रवैगिकी इसे अर्ध-चक्र में कमी के समय अधिक अनुकूल बनाती है, जिसके समय अधिक ऑक्सीजन का उत्पादन होता है; यद्यपि, ऑक्सीकरण थर्मोडायनामिक्स कम उपयुक्त साबित होता है, और कभी-कभी पेरोसाइट पूरी तरह से ऑक्सीकृत नहीं होता है। दो परमाणु स्थल, ए और बी, अधिक डोपिंग संभावनाएं और विभिन्न विन्यासों के लिए बहुत बड़ी क्षमता प्रदान करते हैं।[16]
3 से अधिक चरणों और संकर चक्रों के साथ चक्र
गंधक रसायन पर आधारित चक्र
सल्फर की उच्च सहसंयोजकता के कारण, यह ऑक्सीजन जैसे अन्य तत्वों के साथ 6 रासायनिक बंध तक बना सकता है, जिसके परिणामस्वरूप बड़ी संख्या में ऑक्सीकरण अवस्थाएं बन जाती हैं। इस प्रकार, सल्फर यौगिकों से जुड़े कई रिडॉक्स प्रतिक्रियाएं उपस्थित हैं। यह स्वतंत्रता विभिन्न एन्ट्रॉपी परिवर्तनों के साथ कई रासायनिक कदमों की अनुमति देती है, जिससे थर्मोकेमिकल चक्र के मानदंडों को पूरा करने की बाधाओं में वृद्धि होती है।
संयुक्त राज्य अमेरिका में अधिकांश प्रारंभिक शोध सल्फेट- और सल्फाइड-आधारित चक्रों के साथ केंटकी विश्वविद्यालय में अध्ययन किया गया था,[17][18] लॉस अलामोस नेशनल लेबोरेटरी[19] और सामान्य परमाणु। सल्फेट्स पर आधारित महत्वपूर्ण शोध (जैसे, FeSO4 और क्यूएसओ4) जर्मनी में आयोजित किया गया था[20] और जापान।[21][22] जनरल एटॉमिक्स द्वारा खोजा गया सल्फर-आयोडीन चक्र, हाइड्रोकार्बन की आवश्यकता के बिना हाइड्रोजन अर्थव्यवस्था की आपूर्ति के विधि के रूप में प्रस्तावित किया गया है।[23]
उल्टे डीकन प्रक्रिया पर आधारित चक्र
973K से ऊपर, डीकॉन प्रक्रिया उलट जाती है, पानी और क्लोरीन से हाइड्रोजन क्लोराइड और ऑक्सीजन प्राप्त होती है:
- एच2ओ + सीएल2 → 2 एचसीएल + 1/2 ओ2
यह भी देखें
- आयरन ऑक्साइड चक्र
- सेरियम (IV) ऑक्साइड-सेरियम (III) ऑक्साइड चक्र
- कॉपर-क्लोरीन चक्र
- संकर सल्फर चक्र
- हाइड्रोसोल-2
- सल्फर-आयोडीन चक्र
- जिंक जिंक-ऑक्साइड चक्र
- यूटी -3 चक्र
संदर्भ
- ↑ Producing Hydrogen: The Thermochemical Cycles - Idaho National Laboratory (INL)
- ↑ Funk, J.E., Reinstrom, R.M., 1966. Energy requirements in the production of hydrogen from water. I&EC Process Design and Development 5(3):336-342.
- ↑ Shinnar, R., Shapira, D., Zakai, S., 1981. Thermochemical and hybrid cycles for hydrogen production. A differential economic comparison with electrolysis. I&EC Process Design and Development 20(4):581-593.
- ↑ Funk, J.E., 2001. Thermochemical hydrogen production: past and present. International Journal of Hydrogen Energy 26(3):185:190.
- ↑ Steinfeld, A., 2005. Solar thermochemical production of hydrogen - a review. Solar Energy 78(5):603-615
- ↑ Lédé, J., Lapicque, F., Villermaux, J., Cales, B., Ounalli, A., Baumard, J.F., Anthony, A.M., 1982. Production of hydrogen by direct thermal decomposition of water: preliminary investigations. International Journal of Hydrogen Energy 7(12):939-950.
- ↑ Kogan, A., 1998. Direct solar thermal splitting of water and on-site separation of the products - II. Experimental feasibility study. International Journal of Hydrogen Energy 23(9):89-98.
- ↑ Abraham, B.M., Schreiner, F., 1974. General principles underlying chemical cycles which thermally decompose water into elements. I&EC Fundamentals 13(4):305-310.
- ↑ Roeb, M., Neises, M., Säck, J.P., Rietbrock, P., Monnerie, N.; Dersch, J., Schmitz, S., Sattler, C., 2009. Operational strategy of a two-step thermochemical process for solar hydrogen production. International Journal of Hydrogen Energy 34(10):4537-4545.
- ↑ Schunk, L.O., Lipinski, W., Steinfeld, A., 2009. Heat transfer model of a solar receiver-reactor for the thermal dissociation of ZnO – Experimental validation at 10 kW and scale-up to 1 MW. Chemical Engineering Journal 150(2-3):502-508.
- ↑ Glandt, E.D., Myers, A.L., 1976. Hydrogen production from water by means of chemical cycles. I&EC Process Design and Development 15(1):100-108.
- ↑ Russel, J.L., Porter, J.T., 1975. A search for thermochemical water-splitting cycles. Verziroglu, T.N., Hydrogen Energy, 517-529, Plenum
- ↑ Chao, R.E., 1974. Thermochemical water decomposition processes. I&EC Product Research Development 13(2):94-101.
- ↑ Jonathan, R.S., 2014. Oxygen exchange materials for solar thermochemical splitting of H2O and CO2: a review. Materials Today 17(7):341-348.
- ↑ Chueh W.C. 2010 thermochemical study of ceria: exploiting an old material for new modes of energy conversion and CO2 mitigation. Phil. Trans. R. Soc. A. 368: 3269–3294.
- ↑ Jonathan, R.S., 2013. Lanthanum–Strontium–Manganese Perovskites as Redox Materials for Solar Thermochemical Splitting of H2O and CO2. Energy Fuels 27(8):4250-4257.
- ↑ Ota K., Conger, W.L., 1977. Thermochemical hydrogen production via a cycle using barium and sulfur : reaction between barium sulfide and water. International Journal of Hydrogen Energy 2(2):101:106.
- ↑ Soliman, M.A., Conger, W.L., Carty, R.H., Funk, J.E., Cox, K.E., 1976. Hydrogen production via thermochemical cycles based on sulfur chemistry. International Journal of Hydrogen Energy 1(3):265-270.
- ↑ Mason, C.F.m 1977. The reduction of hydrogen bromide using transition metal compounds. International Journal of hydrogen energy 1(4):427-434.
- ↑ Schulten, R.m Knoche, K.F., Erzeugung von Wasserstoff und Sauerstoff aus Wasser mit Hilfe von Wärme. German Patent #2 257 103, December, the 26th, 1974
- ↑ Yoshida, K., Kameyama, H., Toguchi, K., 1975. Proceedings of the U.S. Japan Joint Seminar Publication Office Ohta's Laboratory Yokohama National University, Tokyo, 20–23 June
- ↑ Kameyama, H., Yoshida, K., Kunii, D., 1976. A method for screening possible thermochemical decomposition processes for water using deltaG-T diagrams. The Chemical Engineering Journal 11(3):223-229.
- ↑ Besenbruch, G. 1982. General Atomic sulfur iodine thermochemical water-splitting process. Proceedings of the American Chemical Society, Div. Pet. Chem., 27(1):48-53.