संचय विन्यास रसायन: Difference between revisions
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
संचयविन्यास रसायन में रासायनिक संश्लिष्ट विधियाँ सम्मिलित होती हैं जो समान प्रक्रिया में बड़ी संख्या में (दसियों से हज़ारों या यहाँ तक कि लाखों) यौगिकों को तैयार करना संभव बनाती हैं। इन यौगिक प्रयोगशालाओ को मिश्रण, व्यक्तिगत यौगिकों के समूह या कंप्यूटर सॉफ्टवेयर द्वारा उत्पन्न रासायनिक संरचनाओं के रूप में बनाया जा सकता है।<ref>{{cite journal | doi=10.1021/acs.jcim.6b00648 | journal= J. Chem. Inf. Model. |author1=Pottel, J. |author2=Moitessier, N. | year=2017 | title=सिंथेटिक रूप से सुलभ, स्थानीय रासायनिक उप-स्थानों का अनुकूलन योग्य उत्पादन| pages=454–467 | volume=57 | issue=3 | pmid= 28234470 | url= https://escholarship.mcgill.ca/concern/articles/05741x18t }}</ref> संचयविन्यास रसायन का उपयोग छोटे अणुओं के संश्लेषण और पेप्टाइड्स के लिए किया जा सकता है। | |||
रणनीतियाँ जो | रणनीतियाँ जो प्रयोगशालाओ के उपयोगी घटकों की पहचान करने की स्वीकृति देती हैं, वे भी संयोजी रसायन विज्ञान का भाग हैं। संचयविन्यास रसायन में उपयोग की जाने वाली विधियों को रसायन के बाहर भी प्रयुक्त किया जाता है। | ||
== इतिहास == | == इतिहास == | ||
संचयविन्यास रसायन का आविष्कार फुरका ए (ईटोवोस लोरैंड विश्वविद्यालय बुडापेस्ट हंगरी) द्वारा किया गया था, जिन्होंने 1982 में अप्रचलित किए गए एक दस्तावेज में इसके सिद्धांत, संयोजन संश्लेषण और एक विसंवलन प्रक्रिया का वर्णन किया था।<ref name="Furka_Á">फुरका ए. Tanulmány, gyógyászatilag hasznosítható पेप्टाइडक szisztematikus felkutatásának lehetőségéről (और औषधीय रूप से उपयोगी पेप्टाइड्स के लिए व्यवस्थित खोज की संभावना पर अध्ययन https://mersz.hu/mod/object.php?objazonosito=matud202006_f42772_i2</ref> संयोजन विधि का सिद्धांत है : एकल चरणबद्ध प्रक्रिया में एक बहु-घटक यौगिक मिश्रण (संयोजन प्रयोगशाला) को संश्लेषित करें और समान प्रक्रिया में औषधि पदाभिलाषी या अन्य प्रकार के उपयोगी यौगिकों को खोजने के लिए इसे जांच करें। संयोजन विधि का सबसे महत्वपूर्ण नवाचार संश्लेषण में मिश्रण का उपयोग करना है और अनुवीक्षण जो प्रक्रिया की उच्च उत्पादकता सुनिश्चित करती है। आविष्कार के लिए प्रेरित करने वाली प्रेरणाएँ 2002 में प्रकाशित हुई थीं।<ref>https://en.wikipedia.org/wiki/Combinatorial_chemistry#cite_note-3</ref> | |||
https:// | |||
</ | |||
== परिचय == | == परिचय == | ||
संयोजी | संयोजी विधि में अणुओं का संश्लेषण तेजी से बड़ी संख्या में अणुओं को उत्पन्न कर सकता है। उदाहरण के लिए, विविधता के तीन बिंदुओं (''R''<sub>1</sub>, ''R''<sub>2</sub>, और ''R''<sub>3</sub>) के साथ एक अणु संभव उत्पन्न कर सकता है। संरचनाएं, जहां <math>N_{R_1} \times N_{R_2} \times N_{R_3}</math> <math>N_{R_1}</math>, <math>N_{R_2}</math>, और <math>N_{R_3}</math> उपयोग किए गए विभिन्न प्रतिस्थापियों की संख्या हैं।<ref name="Furka_Á"/> | ||
संयोजन रसायन का मूल सिद्धांत बहुत बड़ी संख्या में यौगिकों के प्रयोगशालाओ को तैयार करना है और फिर प्रयोगशालाओ के उपयोगी घटकों की पहचान करना है। | |||
हालांकि 1990 के दशक के बाद से उद्योग द्वारा संयुक्त रसायन विज्ञान को वास्तव में स्वीकृत किया गया है,<ref>{{cite journal|url=https://ijpsr.com/bft-article/combinatorial-chemistry-a-review/?view=fulltext#|title=COMBINATORIAL CHEMISTRY: A REVIEW|doi=10.13040/IJPSR.0975-8232.4(7).2502-16|date=July 2013|access-date=June 21, 2020|journal=International Journal of Pharmaceutical Sciences and Research|volume=4|issue=7|doi-access=free}}</ref> इसके कारण 1960 के दशक में देखी जा सकती हैं जब रॉकफेलर विश्वविद्यालय के एक शोधकर्ता ब्रूस मेरिफिल्ड ने पेप्टाइड्स के ठोस-अवस्था संश्लेषण की जांच प्रारंभ की थी। | |||
अपने आधुनिक रूप में, | अपने आधुनिक रूप में, संचयविन्यास रसायन शास्त्र का संभवतः [[दवा|औषधि]] उद्योग में इसका सबसे बड़ा प्रभाव पड़ा है।<ref>{{Cite web|url=https://pubs.acs.org/subscribe/archive/tcaw/11/i01/html/01lesney.html|title=Concocting combinatorials: Chemistry in drug development|last=Lesney|first=Mark S.|date=2002|access-date=October 19, 2018}}</ref> एक यौगिक की गतिविधि प्रोफ़ाइल को अनुकूलित करने का प्रयास करने वाले शोधकर्ता कई अलग-अलग लेकिन संबंधित यौगिकों का '[[रासायनिक पुस्तकालय|रासायनिक प्रयोगशाला]]' बनाते हैं।<ref>{{Cite book |last=Dolle |first=Roland |title=रासायनिक पुस्तकालय डिजाइन का ऐतिहासिक अवलोकन|publisher=in Zhou, J.Z. (ed.), Chemical Library Design, Methods in Molecular Biology, Springer, 2011, Chapter 1, pp. 3-25 |year=2011}}</ref><ref>{{Cite journal |last1=Podlewska |first1=S. |last2=Czarnecki |first2=W.M. |last3=Kafel |first3=R. |last4=Bojarski |first4=A.J. |date=2017 |title=Creating the New from the Old: Combinatorial Libraries Generation with Machine-Learning-Based Compound Structure Optimization |journal=J. Chem. Inf. Modeling |volume=57 |issue=2 |pages=133–147|doi=10.1021/acs.jcim.6b00426 |pmid=28158942 }}</ref> रोबोटिक्स में हुई प्रगति ने संयोजी संश्लेषण के लिए एक औद्योगिक दृष्टिकोण का नेतृत्व किया है, जिससे कंपनियां नियमित रूप से प्रति वर्ष 100,000 से अधिक नए और अद्वितीय यौगिकों का उत्पादन कर पाती हैं।<ref>Jeffrey W. Noonan et al. "Advancing Parallel Solution Phase Library Synthesis through Efficient Purification, Quantitation, and Characterization Techniques" [https://doi.org/10.1016/S1535-5535-03-00017-0 Journal of Laboratory Automation, 48 (1992) 3789].</ref> | ||
== | बड़ी संख्या में संरचनात्मक संभावनाओं को नियंत्रण करने के लिए, शोधकर्ता प्रायः एक ' आभासी प्रयोगशाला' बनाते हैं, सभी उपलब्ध [[अभिकारक]] के साथ दिए गए [[फार्माकोफोर]] (भेषजगुण) की सभी संभावित संरचनाओं की एक संगणनात्मक गणना है।<ref>E. V.Gordeeva et al. "COMPASS program - an original semi-empirical approach to computer-assisted synthesis" [https://dx.doi.org/10.1016/S0040-4020(01)92270-7 Tetrahedron, 48 (1992) 3789].</ref> इस तरह के प्रयोगशाला में हजारों से लाखों 'आभासी' यौगिक सम्मिलित हो सकते हैं। शोधकर्ता विभिन्न गणनाओं और मानदंडों के आधार पर वास्तविक संश्लेषण के लिए 'आभासी प्रयोगशाला' के (एडीएमई, [[ कम्प्यूटेशनल रसायन विज्ञान | संगणनात्मक रसायन विज्ञान]] और परिमाणात्मक संरचना-गतिविधि संबंध देखें) एक उपसमुच्चय का चयन करेगा। | ||
== बहुलक (पेप्टाइड्स और ऑलिगोन्यूक्लियोटाइड्स) == | |||
[[File:Cycle 3,4 vágott.jpg|thumb|right|250px| पेप्टाइड्स चक्र 3 और 4 में बनते हैं]] | [[File:Cycle 3,4 vágott.jpg|thumb|right|250px| पेप्टाइड्स चक्र 3 और 4 में बनते हैं]] | ||
== | == संयोजी विभाजन-मिश्रण (विभाजन और निकाय) संश्लेषण == | ||
{{main|Split and pool synthesis}} | {{main|Split and pool synthesis}} | ||
संयोजी विभाजन-मिश्रण (विभाजन और निकाय) संश्लेषण <ref>Furka Á, Sebestyén F, Asgedom M, Dibó G. Cornucopia of peptides by synthesis. In Highlights of Modern Biochemistry, Proceedings of the 14th International Congress of Biochemistry. VSP.Utrecht.1988; 5; p. 47.</ref><ref>Á. Furka, F. Sebestyen, M. Asgedom, G. Dibo, General method for rapid synthesis of multicomponent peptide mixtures. Int. J. Peptide Protein Res., 1991, 37, 487-493.</ref> [[रॉबर्ट ब्रूस मेरिफिल्ड]] द्वारा विकसित ठोस-चरण संश्लेषण पर आधारित है।<ref>[[Robert Bruce Merrifield|Merrifield RB]], 1963 J. Am. Chem. Soc. 85, 2149.</ref> यदि 20 [[ एमिनो एसिड | एमिनो अम्ल]] (या अन्य प्रकार के मूलभूत अंग) का उपयोग करके एक संयोजी पेप्टाइड प्रयोगशाला को संश्लेषित किया जाता है, तो गोले के रूप ठोस सहायक को 20 बराबर भागों में विभाजित किया जाता है। इसके बाद प्रत्येक भाग में एक अलग अमीनो अम्ल का युग्मन होता है। तीसरा चरण सभी भागों का मिश्रण है। इन तीन चरणों में एक चक्र सम्मिलित है। चक्र के चरणों को दोहराकर पेप्टाइड श्रृंखलाओं को बढ़ाया जा सकता है। | |||
[[File:Split-mix synthesis.jpg|thumb|left |200px| | [[File:Split-mix synthesis.jpg|thumb|left |200px|विभाजन-मिश्रण संयोजी संश्लेषण का फ्लो डायग्राम]]प्रक्रिया को दोनों चक्रों में निर्माण खंड के रूप में समान तीन अमीनो अम्ल का उपयोग करके [[डाइपेप्टाइड]] प्रयोगशाला के संश्लेषण द्वारा चित्रित किया गया है। इस प्रयोगशाला के प्रत्येक घटक में अलग-अलग क्रम में व्यवस्थित दो अमीनो अम्ल होते हैं। युग्मन में उपयोग किए जाने वाले अमीनो अम्ल को आकृति में पीले, नीले और लाल वृत्त द्वारा दर्शाया गया है। विभिन्न तीर ठोस समर्थन रेजिन (हरे वृत्त) को समान भागों में विभाजित करते हुए दिखाते हैं, ऊर्ध्वाधर तीरों का अर्थ है युग्मन और अभिसरण तीर समर्थन के भागों को मिलाने और समरूप बनाने का प्रतिनिधित्व करते हैं। | ||
चित्र से पता चलता है कि दो संश्लिष्ट चक्रों में 9 डाईपेप्टाइड बनते हैं। तीसरे और चौथे चक्र में क्रमशः 27 ट्राइपेप्टाइड और 81 टेट्रापेप्टाइड बनेंगे। | चित्र से पता चलता है कि दो संश्लिष्ट चक्रों में 9 डाईपेप्टाइड बनते हैं। तीसरे और चौथे चक्र में क्रमशः 27 ट्राइपेप्टाइड और 81 टेट्रापेप्टाइड बनेंगे। | ||
"विभाजन-मिश्रण संश्लेषण" में कई उत्कृष्ट विशेषताएं हैं: | |||
* यह अत्यधिक | * यह अत्यधिक दक्ष है। जैसा कि चित्र प्रदर्शित करता है कि संश्लेषित प्रक्रिया (3, 9, 27, 81) में बनने वाले पेप्टाइड्स की संख्या निष्पादित चक्रों की संख्या के साथ तेजी से बढ़ती है। प्रत्येक संश्लेषित चक्र में 20 अमीनो अम्ल का उपयोग करके गठित पेप्टाइड्स की संख्या क्रमशः 400, 8,000, 160,000 और 3,200,000 है। इसका तात्पर्य यह है कि निष्पादित चक्रों की संख्या के साथ पेप्टाइड्स की संख्या तेजी से बढ़ती है। | ||
* सभी पेप्टाइड अनुक्रम इस प्रक्रिया में बनते हैं जो चक्रों में प्रयुक्त अमीनो | * सभी पेप्टाइड अनुक्रम इस प्रक्रिया में बनते हैं जो चक्रों में प्रयुक्त अमीनो अम्ल के संयोजन से निकाले जा सकते हैं। | ||
* समर्थन को समान नमूनों में विभाजित करना | * समर्थन को समान नमूनों में विभाजित करना प्रयोगशाला के घटकों को लगभग समान मोलीय मात्रा में निर्माण सुनिश्चित होता है। | ||
* समर्थन के प्रत्येक | * समर्थन के प्रत्येक गोले पर केवल समान पेप्टाइड बनता है। यह युग्मन चरणों में केवल एक अमीनो अम्ल का उपयोग करने का परिणाम है। हालांकि, यह पूरी तरह से अज्ञात है कि पेप्टाइड कौन सा है जो एक चयनित गोले पर प्रग्रहण कर लेता है। | ||
* | * विभाजन-मिश्रण पद्धति का उपयोग कार्बनिक या किसी अन्य प्रकार के प्रयोगशाला के संश्लेषण के लिए किया जा सकता है जिसे चरणबद्ध प्रक्रिया में इसके निर्माण खंड से तैयार किया जा सकता है। | ||
1990 में तीन समूहों ने जैविक विधियों द्वारा पेप्टाइड | 1990 में तीन समूहों ने जैविक विधियों द्वारा और एक साल बाद फोडोर एट अल द्वारा पेप्टाइड <ref>{{cite journal | last1=Scott | first1=J. | last2=Smith | first2=G. | title=एक एपिटोप लाइब्रेरी के साथ पेप्टाइड लिगेंड की खोज| journal=Science | publisher=American Association for the Advancement of Science (AAAS) | volume=249 | issue=4967 | date=1990-07-27 | issn=0036-8075 | doi=10.1126/science.1696028 | pmid=1696028 | pages=386–390 | bibcode=1990Sci...249..386S }}</ref><ref>{{cite journal | last1=Cwirla | first1=S. E. | last2=Peters | first2=E. A. | last3=Barrett | first3=R. W. | last4=Dower | first4=W. J. | title=Peptides on phage: a vast library of peptides for identifying ligands. | journal=Proceedings of the National Academy of Sciences | volume=87 | issue=16 | date=1990-08-01 | issn=0027-8424 | doi=10.1073/pnas.87.16.6378 | pmid=2201029 | pmc=54537 | pages=6378–6382 | bibcode=1990PNAS...87.6378C | doi-access=free }}</ref><ref>J. J. Devlin, L. C. Panganiban and P. E. Devlin Science 1990, 249, 404.</ref> प्रयोगशालाओ को तैयार करने के तरीकों का वर्णन किया। छोटे कांच की स्लाइड्स पर पेप्टाइड सरणियों के संश्लेषण के लिए एक उल्लेखनीय विधि प्रकाशित की।<ref>Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D, 1991. Light-directed, spatially addressable parallel chemical synthesis. ''Science'' 251, 767-73.</ref> पेप्टाइड सरणियों की तैयारी के लिए मारियो गेसेन और उनके सहयोगियों द्वारा एक समानांतर संश्लेषण विधि विकसित की गई थी।<ref>H. M. Geysen, R. H. Meloen, S. J. Barteling Proc. Natl. Acad. Sci. USA 1984, 81, 3998.</ref> उन्होंने ठोस समर्थन के साथ अपने सिरों पर लेपित प्लास्टिक की छड़ (पिन) पर 96 पेप्टाइड्स को संश्लेषित किया। पिनों को एक [[माइक्रोटिटर प्लेट|सूक्ष्मदर्शी प्लेट]] मे अच्छी तरह रखे अभिकर्मकों के विलयन में निमज्जित किया गया। विधि विशेष रूप से स्वचालित समांतर संश्लेषक का उपयोग करके व्यापक रूप से प्रयुक्त होती है। यद्यपि समानांतर विधि वास्तविक दहनशील विधि की तुलना में बहुत मंद है, इसका लाभ यह है कि यह सही से ज्ञात है कि प्रत्येक पिन पर कौन सा पेप्टाइड या अन्य यौगिक बनता है। | ||
पेप्टाइड सरणियों की तैयारी के लिए मारियो गेसेन और उनके सहयोगियों द्वारा एक समानांतर संश्लेषण विधि विकसित की गई थी।<ref>H. M. Geysen, R. H. Meloen, S. J. Barteling Proc. Natl. Acad. Sci. USA 1984, 81, 3998.</ref> उन्होंने ठोस समर्थन के साथ अपने सिरों पर लेपित प्लास्टिक की छड़ (पिन) पर 96 पेप्टाइड्स को संश्लेषित किया। | |||
विभाजन-मिश्रण और समान संश्लेषण दोनों के लाभों को मिलाने के लिए आगे की प्रक्रियाएँ विकसित की गईं। दो समूहों द्वारा वर्णित विधि में<ref>E. J. Moran, S. Sarshar, J. F. Cargill, M. Shahbaz, A Lio, A. M. M. Mjalli, R. W. Armstrong J. Am. Chem. Soc. 1995, 117, 10787.</ref><ref>K. C. Nicolaou, X –Y. Xiao, Z. Parandoosh, A. Senyei, M. P. Nova Angew. Chem. Int. Ed. Engl. 1995, 36, 2289.</ref> ठोस समर्थन को पारगम्य प्लास्टिक झिल्ली में एक रेडियो-आवृत्ति टैग के साथ संलग्न किया गया था जो झिल्ली में बनने वाले यौगिक के कोड को ले गया था। प्रक्रिया विभाजन-मिश्रण विधि के समान की गई थी। विभाजित चरण में, हालांकि, झिल्ली के रेडियो-आवृत्ति टैग से पढ़े गए कोड के अनुसार प्रतिक्रिया वाहिकाओं के बीच झिल्ली वितरित किए गए थे। | |||
फुरका एट अल द्वारा इसी उद्देश्य के लिए एक अलग विधि विकसित की गई थी।<ref>Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.</ref> स्ट्रिंग संश्लेषण कहा जाता है। इस पद्धति में, | फुरका एट अल द्वारा इसी उद्देश्य के लिए एक अलग विधि विकसित की गई थी।<ref>Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.</ref> स्ट्रिंग संश्लेषण कहा जाता है। इस पद्धति में, झिल्ली में कोई कोड नहीं होता है। वे एक हार में मोतियों की तरह पिरोए जाते हैं और दृढ़ रूप में प्रतिक्रिया वाहिकाओं में रखे जाते हैं। झिल्ली की पहचान, साथ ही साथ उनके पदार्थ, स्ट्रिंग्स पर व्याप्त उनकी स्थिति द्वारा संग्रहीत की जाती है। युग्मन के प्रत्येक चरण के बाद, निश्चित नियमों के अनुसार नए तारों के बीच झिल्ली का पुनर्वितरण किया जाता है। | ||
== छोटे अणु == | == छोटे अणु == | ||
औषधि खोज प्रक्रिया में, रुचि के छोटे अणुओं का संश्लेषण और जैविक मूल्यांकन आमतौर पर एक लंबी और श्रमसाध्य प्रक्रिया रही है। संचयविन्यास रसायन विज्ञान हाल के दशकों में बड़ी संख्या में क्षमता को जल्दी और कुशलता से संश्लेषित करने के दृष्टिकोण के रूप में उभरा है | |||
छोटे अणु औषधि पदाभिलाषी। एक विशिष्ट संश्लेषण में, एक संश्लेषित योजना के अंत में केवल एक लक्ष्य अणु का उत्पादन होता है, संश्लेषण में प्रत्येक चरण में केवल समान उत्पाद का उत्पादन होता है। संयोजी संश्लेषण में, केवल एक प्रारंभिक पदार्थ का उपयोग करते समय, समान प्रतिक्रिया स्थितियों का उपयोग करके अणुओं के एक बड़े प्रयोगशाला को संश्लेषित करना संभव है, जिसे तब उनकी [[जैविक गतिविधि]] के लिए जांचा जा सकता है। उत्पादों के इस निकाय को फिर तीन समान भागों में विभाजित किया जाता है जिसमें तीन उत्पादों में से प्रत्येक होता है, और फिर तीन अलग-अलग पूलों में से प्रत्येक को अभिकर्मक बी, सी, या डी की एक और इकाई के साथ प्रतिक्रिया दी जाती है, जो पिछले 3 से 9 अद्वितीय यौगिकों का उत्पादन करती है। इस प्रक्रिया को तब तक दोहराया जाता है जब तक कि निर्माण खंड की वांछित संख्या नहीं जुड़ जाती है, जिससे कई यौगिक बनते हैं। एक बहु-चरण संश्लेषण द्वारा यौगिकों के एक प्रयोगशाला को संश्लेषित करते समय, कुशल प्रतिक्रिया विधियों को नियोजित किया जाना चाहिए, और यदि प्रत्येक प्रतिक्रिया चरण के बाद पारंपरिक शुद्धिकरण विधियों का उपयोग किया जाता है, तो पैदावार और दक्षता प्रभावित होगी। | |||
छोटे अणु | |||
ठोस-चरण संश्लेषण विशिष्ट शमन और शुद्धिकरण चरणों की आवश्यकता को कम करने के लिए संभावित समाधान प्रदान करता है जो | ठोस-चरण संश्लेषण विशिष्ट शमन और शुद्धिकरण चरणों की आवश्यकता को कम करने के लिए संभावित समाधान प्रदान करता है जो प्रायः संश्लेषित रसायन विज्ञान में उपयोग किया जाता है। सामान्य तौर पर, एक प्रारंभिक अणु एक ठोस समर्थन (आमतौर पर एक [[अघुलनशील बहुलक]]) का पालन करता है, फिर अतिरिक्त प्रतिक्रियाएं की जाती हैं, और अंतिम उत्पाद को शुद्ध किया जाता है और फिर ठोस समर्थन से साफ किया जाता है। चूंकि ब्याज के अणु एक ठोस समर्थन से जुड़े होते हैं, इसलिए प्रत्येक प्रतिक्रिया के बाद शुद्धिकरण को कम करना संभव होता है, जिससे थकाऊ तरल-तरल निष्कर्षण और सॉल्वेंट वाष्पीकरण चरणों की आवश्यकता समाप्त हो जाती है, जिसमें अधिकांश संश्लेषित रसायन सम्मिलित होते हैं। इसके अलावा, विषम अभिकारकों का उपयोग करके, अतिरिक्त अभिकर्मकों का उपयोग सुस्त प्रतिक्रियाओं को पूरा करने के लिए किया जा सकता है, जिससे पैदावार में और सुधार हो सकता है। [[क्रोमैटोग्राफी]] जैसे अतिरिक्त शुद्धिकरण चरणों की आवश्यकता के बिना अतिरिक्त अभिकर्मकों को आसानी से धोया जा सकता है। | ||
फ़ाइल: एक ठोस-समर्थित पॉलीमाइन का उपयोग जिसका उपयोग अतिरिक्त अभिकर्मक को साफ़ करने के लिए किया जाता है। tif|thumb| अतिरिक्त अभिकर्मक को साफ़ करने के लिए एक ठोस-समर्थित पॉलीमाइन का उपयोग | फ़ाइल: एक ठोस-समर्थित पॉलीमाइन का उपयोग जिसका उपयोग अतिरिक्त अभिकर्मक को साफ़ करने के लिए किया जाता है। tif|thumb| अतिरिक्त अभिकर्मक को साफ़ करने के लिए एक ठोस-समर्थित पॉलीमाइन का उपयोग | ||
इन वर्षों में, | इन वर्षों में, संयोजी रसायन विज्ञान में ठोस-चरण कार्बनिक संश्लेषण के उपयोग को परिष्कृत करने के लिए विभिन्न प्रकार के तरीकों का विकास किया गया है, जिसमें संश्लेषण और शुद्धिकरण की आसानी बढ़ाने के प्रयासों के साथ-साथ मध्यवर्ती उत्पादों को चिह्नित करने के लिए गैर-पारंपरिक तरीके भी सम्मिलित हैं। यद्यपि | ||
यहाँ वर्णित अधिकांश उदाहरण प्रत्येक प्रतिक्रिया चरण में विषम प्रतिक्रिया मीडिया को नियोजित करेंगे, बूथ और हॉजेस केवल पारंपरिक समाधान-चरण संश्लेषण के शुद्धिकरण चरण के दौरान ठोस-समर्थित अभिकर्मकों का उपयोग करने का एक प्रारंभिक उदाहरण प्रदान करते हैं।<ref>{{Cite journal |last1=Booth |first1=R. John |last2=Hodges |first2=John C. |year=1999–2001 |title=मिश्रित संश्लेषण उत्पादों के तेजी से शुद्धिकरण के लिए ठोस-समर्थित अभिकर्मक रणनीतियाँ|journal=Accounts of Chemical Research |language=en |volume=32 |issue=1 |pages=18–26 |doi=10.1021/ar970311n |issn=0001-4842}}</ref> उनके विचार में, | यहाँ वर्णित अधिकांश उदाहरण प्रत्येक प्रतिक्रिया चरण में विषम प्रतिक्रिया मीडिया को नियोजित करेंगे, बूथ और हॉजेस केवल पारंपरिक समाधान-चरण संश्लेषण के शुद्धिकरण चरण के दौरान ठोस-समर्थित अभिकर्मकों का उपयोग करने का एक प्रारंभिक उदाहरण प्रदान करते हैं।<ref>{{Cite journal |last1=Booth |first1=R. John |last2=Hodges |first2=John C. |year=1999–2001 |title=मिश्रित संश्लेषण उत्पादों के तेजी से शुद्धिकरण के लिए ठोस-समर्थित अभिकर्मक रणनीतियाँ|journal=Accounts of Chemical Research |language=en |volume=32 |issue=1 |pages=18–26 |doi=10.1021/ar970311n |issn=0001-4842}}</ref> उनके विचार में, | ||
सॉल्यूशन-फेज रसायन रेजिन से अणुओं को जोड़ने और निकालने के लिए जरूरी अटैचमेंट और क्लीवेज रिएक्शन से बचने के साथ-साथ स्थापित सॉल्यूशन-फेज रिएक्शन के सॉलिड-फेज एनालॉग्स को फिर से बनाने की जरूरत को खत्म करने का फायदा देती है। | सॉल्यूशन-फेज रसायन रेजिन से अणुओं को जोड़ने और निकालने के लिए जरूरी अटैचमेंट और क्लीवेज रिएक्शन से बचने के साथ-साथ स्थापित सॉल्यूशन-फेज रिएक्शन के सॉलिड-फेज एनालॉग्स को फिर से बनाने की जरूरत को खत्म करने का फायदा देती है। | ||
एक संश्लेषण के अंत में एकल शुद्धिकरण कदम एक या अधिक अशुद्धियों को हटाने की स्वीकृति देता है, यह मानते हुए कि आपत्तिजनक अशुद्धता की रासायनिक संरचना ज्ञात है। जबकि ठोस-समर्थित अभिकर्मकों का उपयोग यौगिकों के संश्लेषण को बहुत सरल करता है, कई दहनशील संश्लेषणों को कई चरणों की आवश्यकता होती है, जिनमें से प्रत्येक को अभी भी शुद्धिकरण के कुछ रूपों की आवश्यकता होती है। आर्मस्ट्रांग, एट अल। बहु-घटक संघनन (MCCs) कहे जाने वाले संयोजी | एक संश्लेषण के अंत में एकल शुद्धिकरण कदम एक या अधिक अशुद्धियों को हटाने की स्वीकृति देता है, यह मानते हुए कि आपत्तिजनक अशुद्धता की रासायनिक संरचना ज्ञात है। जबकि ठोस-समर्थित अभिकर्मकों का उपयोग यौगिकों के संश्लेषण को बहुत सरल करता है, कई दहनशील संश्लेषणों को कई चरणों की आवश्यकता होती है, जिनमें से प्रत्येक को अभी भी शुद्धिकरण के कुछ रूपों की आवश्यकता होती है। आर्मस्ट्रांग, एट अल। बहु-घटक संघनन (MCCs) कहे जाने वाले संयोजी प्रयोगशालाओ को उत्पन्न करने के लिए एक-पॉट विधि का वर्णन करें।<ref>{{Cite journal |last1=Armstrong |first1=Robert W. |last2=Combs |first2=Andrew P. |last3=Tempest |first3=Paul A. |last4=Brown |first4=S. David |last5=Keating |first5=Thomas A. |s2cid=95815562 |year=1996–2001 |title=कॉम्बिनेटरियल लाइब्रेरी सिंथेसिस के लिए मल्टीपल-कंपोनेंट कंडेनसेशन स्ट्रैटेजीज|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=123–131 |doi=10.1021/ar9502083 |issn=0001-4842}}</ref> इस योजना में, तीन या अधिक अभिकर्मक इस तरह से प्रतिक्रिया करते हैं कि प्रत्येक अभिकर्मक को समान चरण में अंतिम उत्पाद में सम्मिलित किया जाता है, जिससे बहु-चरण संश्लेषण की आवश्यकता समाप्त हो जाती है जिसमें कई शुद्धिकरण चरण सम्मिलित होते हैं। MCCs में, यह निर्धारित करने के लिए कोई विसंक्रमण आवश्यक नहीं है कि कौन से यौगिक जैविक रूप से सक्रिय हैं क्योंकि सरणी में प्रत्येक संश्लेषण में केवल समान उत्पाद होता है, इस प्रकार यौगिक की पहचान स्पष्ट रूप से ज्ञात होनी चाहिए। | ||
फ़ाइल: एक ठोस-चरण समर्थित डाई का उदाहरण लिगैंड बाइंडिंग का संकेत देता है। tif|thumb|लिगैंड बाइंडिंग को सिग्नल करने के लिए एक ठोस-चरण समर्थित डाई का उदाहरण | फ़ाइल: एक ठोस-चरण समर्थित डाई का उदाहरण लिगैंड बाइंडिंग का संकेत देता है। tif|thumb|लिगैंड बाइंडिंग को सिग्नल करने के लिए एक ठोस-चरण समर्थित डाई का उदाहरण | ||
एक अन्य ऐरे | एक अन्य ऐरे संश्लेषण में, स्प्लिट संश्लेषण द्वारा [[ओलिगोपेप्टाइड]] का एक बड़ा प्रयोगशाला फिर भी उत्पन्न हुआ।<ref>{{Cite journal |last=Still |first=W. Clark |year=1996–2001 |title=एन्कोडेड कॉम्बिनेटरियल लाइब्रेरी का उपयोग करके सिंथेटिक रिसेप्टर्स द्वारा अनुक्रम-चयनात्मक पेप्टाइड बाइंडिंग की खोज|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=155–163 |doi=10.1021/ar950166i |issn=0001-4842}}</ref> हजारों यौगिकों को बनाने का दोष यह है कि गठित यौगिकों की संरचना का निर्धारण करना कठिन होता है। उनका समाधान आणविक टैग का उपयोग करना है, जहां एक डाई की एक छोटी राशि (1 pmol/) गोले से जुड़ी होती है, और एक निश्चित गोले की पहचान यह विश्लेषण करके निर्धारित की जा सकती है कि गोले पर कौन से टैग मौजूद हैं। टैग संलग्न करने से रिसेप्टर्स की पहचान कितनी आसान हो जाती है, इसके बावजूद प्रत्येक कंपाउंड को उसकी रिसेप्टर बाइंडिंग क्षमता के लिए व्यक्तिगत रूप से स्क्रीन करना काफी असंभव होगा, इसलिए प्रत्येक रिसेप्टर से एक डाई जुड़ी हुई थी, जैसे कि केवल वे रिसेप्टर्स जो अपने सब्सट्रेट से बंधते हैं, एक रंग परिवर्तन उत्पन्न करते हैं। | ||
जब कई प्रतिक्रियाओं को एक सरणी में चलाने की आवश्यकता होती है (जैसे आर्मस्ट्रांग के एमसीसी सरणी में वर्णित 96 प्रतिक्रियाएं), दक्षता में सुधार के लिए संश्लेषण के कुछ अधिक कठिन पहलुओं को स्वचालित किया जा सकता है। डेविट और जारनिक [[डाइवर्सोमर विधि]] नामक एक विधि का विवरण देते हैं, जिसमें रासायनिक प्रतिक्रियाओं के कई लघु संस्करण एक साथ चलते हैं।<ref>{{Cite journal |last1=DeWitt |first1=Sheila Hobbs |last2=Czarnik |first2=Anthony W. |year=1996–2001 |title=पार्के-डेविस के डायवर्सोमर विधि का उपयोग करके संयुक्त कार्बनिक संश्लेषण|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=114–122 |doi=10.1021/ar950209v |issn=0001-4842}}</ref> यह विधि एक ऐसे उपकरण का उपयोग करती है जो राल लोडिंग और वॉश चक्रों के साथ-साथ प्रतिक्रिया चक्र की निगरानी और शुद्धिकरण को स्वचालित करती है, और विभिन्न प्रकार के अणु वर्गों, जैसे कि [[ hydantoins ]] और [[एन्ज़ोदिअज़ेपिनेस]] को संश्लेषित करने के लिए इसका उपयोग करके उनकी विधि और उपकरण की व्यवहार्यता प्रदर्शित करती है। ज्यादातर मामलों में 40 व्यक्तिगत प्रतिक्रियाएं चल रही हैं। | जब कई प्रतिक्रियाओं को एक सरणी में चलाने की आवश्यकता होती है (जैसे आर्मस्ट्रांग के एमसीसी सरणी में वर्णित 96 प्रतिक्रियाएं), दक्षता में सुधार के लिए संश्लेषण के कुछ अधिक कठिन पहलुओं को स्वचालित किया जा सकता है। डेविट और जारनिक [[डाइवर्सोमर विधि]] नामक एक विधि का विवरण देते हैं, जिसमें रासायनिक प्रतिक्रियाओं के कई लघु संस्करण एक साथ चलते हैं।<ref>{{Cite journal |last1=DeWitt |first1=Sheila Hobbs |last2=Czarnik |first2=Anthony W. |year=1996–2001 |title=पार्के-डेविस के डायवर्सोमर विधि का उपयोग करके संयुक्त कार्बनिक संश्लेषण|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=114–122 |doi=10.1021/ar950209v |issn=0001-4842}}</ref> यह विधि एक ऐसे उपकरण का उपयोग करती है जो राल लोडिंग और वॉश चक्रों के साथ-साथ प्रतिक्रिया चक्र की निगरानी और शुद्धिकरण को स्वचालित करती है, और विभिन्न प्रकार के अणु वर्गों, जैसे कि [[ hydantoins ]] और [[एन्ज़ोदिअज़ेपिनेस]] को संश्लेषित करने के लिए इसका उपयोग करके उनकी विधि और उपकरण की व्यवहार्यता प्रदर्शित करती है। ज्यादातर मामलों में 40 व्यक्तिगत प्रतिक्रियाएं चल रही हैं। | ||
प्रायः, महंगे उपकरण का उपयोग करना संभव नहीं होता है, और श्वाबैकर, एट अल। प्रयोगशाला सदस्यों के समांतर संश्लेषण और यौगिकों के पूरे प्रयोगशालाओ के मूल्यांकन के संयोजन की एक सरल विधि का वर्णन करें।<ref>{{Cite journal |last1=Schwabacher |first1=Alan W. |last2=Shen |first2=Yixing |last3=Johnson |first3=Christopher W. |year=1999–2009 |title=फूरियर ट्रांसफॉर्म कॉम्बिनेटरियल केमिस्ट्री|journal=Journal of the American Chemical Society |language=en |volume=121 |issue=37 |pages=8669–8670 |doi=10.1021/ja991452i |issn=0002-7863}}</ref> उनकी पद्धति में, एक धागा जिसे अलग-अलग क्षेत्रों में विभाजित किया जाता है, एक सिलेंडर के चारों ओर लपेटा जाता है, जहां एक अलग अभिकर्मक को प्रत्येक क्षेत्र में जोड़ा जाता है जो केवल समान प्रजाति को धारण करता है। धागे को फिर से विभाजित किया जाता है और एक अलग आकार के सिलेंडर के चारों ओर लपेटा जाता है, और फिर इस प्रक्रिया को दोहराया जाता है। इस पद्धति की सुंदरता यह है कि प्रत्येक उत्पाद की पहचान केवल धागे के साथ उसके स्थान से जानी जा सकती है, और संबंधित जैविक गतिविधि की पहचान प्रतिदीप्ति संकेतों के फूरियर रूपांतरण द्वारा की जाती है। | |||
फ़ाइल: Ellman.tif|thumb द्वारा बताए अनुसार एक ट्रेसलेस लिंकर का उपयोग करना | फ़ाइल: Ellman.tif|thumb द्वारा बताए अनुसार एक ट्रेसलेस लिंकर का उपयोग करना | ||
यहां वर्णित अधिकांश संश्लेषणों में, प्रारंभिक अभिकर्मक को ठोस समर्थन से/से जोड़ना और निकालना आवश्यक है। यह एक हाइड्रॉक्सिल समूह की पीढ़ी को जन्म दे सकता है, जो लक्ष्य परिसर की जैविक गतिविधि को संभावित रूप से प्रभावित कर सकता है। एल्मैन 192 व्यक्तिगत 1,4-बेंजोडायजेपाइन डेरिवेटिव प्राप्त करने के लिए एक बहु-चरण संश्लेषण योजना में ठोस चरण का उपयोग करता है, जो प्रसिद्ध चिकित्सीय एजेंट हैं।<ref>{{Cite journal |last=Ellman |first=Jonathan A. |year=1996–2001 |title=लघु-अणु पुस्तकालयों का डिजाइन, संश्लेषण और मूल्यांकन|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=132–143 |doi=10.1021/ar950190w |issn=0001-4842}}</ref> संभावित हाइड्रॉक्सिल समूह के हस्तक्षेप की संभावना को खत्म करने के लिए, अणुओं को ठोस समर्थन से जोड़ने के लिए सिलिल-एरिल रसायन शास्त्र का उपयोग करने वाली एक उपन्यास विधि का उपयोग किया जाता है जो समर्थन से अलग हो जाता है और लिंकर का कोई निशान नहीं छोड़ता है। | यहां वर्णित अधिकांश संश्लेषणों में, प्रारंभिक अभिकर्मक को ठोस समर्थन से/से जोड़ना और निकालना आवश्यक है। यह एक हाइड्रॉक्सिल समूह की पीढ़ी को जन्म दे सकता है, जो लक्ष्य परिसर की जैविक गतिविधि को संभावित रूप से प्रभावित कर सकता है। एल्मैन 192 व्यक्तिगत 1,4-बेंजोडायजेपाइन डेरिवेटिव प्राप्त करने के लिए एक बहु-चरण संश्लेषण योजना में ठोस चरण का उपयोग करता है, जो प्रसिद्ध चिकित्सीय एजेंट हैं।<ref>{{Cite journal |last=Ellman |first=Jonathan A. |year=1996–2001 |title=लघु-अणु पुस्तकालयों का डिजाइन, संश्लेषण और मूल्यांकन|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=132–143 |doi=10.1021/ar950190w |issn=0001-4842}}</ref> संभावित हाइड्रॉक्सिल समूह के हस्तक्षेप की संभावना को खत्म करने के लिए, अणुओं को ठोस समर्थन से जोड़ने के लिए सिलिल-एरिल रसायन शास्त्र का उपयोग करने वाली एक उपन्यास विधि का उपयोग किया जाता है जो समर्थन से अलग हो जाता है और लिंकर का कोई निशान नहीं छोड़ता है। | ||
फ़ाइल: उत्पाद जिन्हें imines.tif|thumb|कंपाउंड्स से संश्लेषित किया जा सकता है जिन्हें सॉलिड-फेज़ बाउंड इमाइन्स से संश्लेषित किया जा सकता है | फ़ाइल: उत्पाद जिन्हें imines.tif|thumb|कंपाउंड्स से संश्लेषित किया जा सकता है जिन्हें सॉलिड-फेज़ बाउंड इमाइन्स से संश्लेषित किया जा सकता है | ||
एक अणु को एक ठोस समर्थन के लिए एंकरिंग करते समय, मध्यवर्ती को राल से अणु को अलग किए बिना एक दूसरे से अलग नहीं किया जा सकता है। चूँकि प्रतिक्रिया की प्रगति को ट्रैक करने और उत्पाद संरचना की पुष्टि करने के लिए उपयोग की जाने वाली कई पारंपरिक लक्षण वर्णन तकनीकें समाधान-आधारित हैं, | एक अणु को एक ठोस समर्थन के लिए एंकरिंग करते समय, मध्यवर्ती को राल से अणु को अलग किए बिना एक दूसरे से अलग नहीं किया जा सकता है। चूँकि प्रतिक्रिया की प्रगति को ट्रैक करने और उत्पाद संरचना की पुष्टि करने के लिए उपयोग की जाने वाली कई पारंपरिक लक्षण वर्णन तकनीकें समाधान-आधारित हैं, | ||
विभिन्न तकनीकों का उपयोग करना चाहिए। जेल-चरण 13 सी एनएमआर स्पेक्ट्रोस्कोपी, मालडी मास स्पेक्ट्रोमेट्री, और आईआर स्पेक्ट्रोस्कोपी का उपयोग संरचना की पुष्टि करने और ठोस-चरण प्रतिक्रियाओं की प्रगति की निगरानी के लिए किया गया है।<ref name=accounts>{{Cite journal |last1=Gordon |first1=E. M. |last2=Gallop |first2=M. A. |last3=Patel |first3=D. V. |year=1996–2001 |title=कॉम्बिनेटरियल ऑर्गेनिक सिंथेसिस में रणनीति और रणनीति। ड्रग डिस्कवरी के लिए आवेदन|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=144–154 |doi=10.1021/ar950170u |issn=0001-4842}}</ref> गॉर्डन एट अल।, कई केस स्टडीज का वर्णन करते हैं जो छोटे अणुओं के दहनशील | विभिन्न तकनीकों का उपयोग करना चाहिए। जेल-चरण 13 सी एनएमआर स्पेक्ट्रोस्कोपी, मालडी मास स्पेक्ट्रोमेट्री, और आईआर स्पेक्ट्रोस्कोपी का उपयोग संरचना की पुष्टि करने और ठोस-चरण प्रतिक्रियाओं की प्रगति की निगरानी के लिए किया गया है।<ref name=accounts>{{Cite journal |last1=Gordon |first1=E. M. |last2=Gallop |first2=M. A. |last3=Patel |first3=D. V. |year=1996–2001 |title=कॉम्बिनेटरियल ऑर्गेनिक सिंथेसिस में रणनीति और रणनीति। ड्रग डिस्कवरी के लिए आवेदन|journal=Accounts of Chemical Research |language=en |volume=29 |issue=3 |pages=144–154 |doi=10.1021/ar950170u |issn=0001-4842}}</ref> गॉर्डन एट अल।, कई केस स्टडीज का वर्णन करते हैं जो छोटे अणुओं के दहनशील प्रयोगशालाओ को उत्पन्न करने के लिए इमाइन और पेप्टिडिल फॉस्फोनेट्स का उपयोग करते हैं।<ref name=accounts/>इमाइन प्रयोगशाला उत्पन्न करने के लिए, एक राल से जुड़े एक एमिनो अम्ल को एल्डिहाइड की उपस्थिति में प्रतिक्रिया दी जाती है। लेखकों ने प्रतिक्रियाओं की प्रगति की निगरानी के लिए तेजी से 13 सी जेल चरण एनएमआर स्पेक्ट्रोस्कोपी और जादू कोण कताई 1 एच एनएमआर स्पेक्ट्रोस्कोपी का उपयोग प्रदर्शित किया और दिखाया कि ट्राइमेथिल ऑर्थोफोर्मेट के रूप में उपयोग किए जाने पर कमरे के तापमान पर 10 मिनट के रूप में कम से कम इमाइन बन सकते हैं। विलायक। गठित इमीन्स को तब 4-थियाजोलिडिनोन्स, बी-लैक्टम्स और पायरोलिडाइन्स उत्पन्न करने के लिए व्युत्पन्न किया गया था। | ||
ठोस-चरण समर्थन का उपयोग यौगिकों के बड़े संयोजी प्रयोगशालाओ के संश्लेषण को बहुत सरल करता है। यह एक प्रारंभिक पदार्थ को एक ठोस समर्थन के लिए एंकरिंग करके किया जाता है और फिर पर्याप्त रूप से बड़े प्रयोगशाला के निर्माण तक बाद की प्रतिक्रियाओं को चलाता है, जिसके बाद उत्पादों को समर्थन से अलग किया जाता है। मानक तरल-तरल निष्कर्षण शोधन तकनीकों के संयोजन में समाधान-चरण संश्लेषण योजनाओं में उपयोग के लिए ठोस-चरण शुद्धि का उपयोग भी प्रदर्शित किया गया है। | |||
== डीकनवोल्यूशन और अनुवीक्षण == | |||
== | === संयोजी प्रयोगशाला === | ||
संयोजी प्रयोगशाला छोटे-अणु रासायनिक यौगिकों के विशेष बहु-घटक मिश्रण हैं जो एकल चरणबद्ध प्रक्रिया में संश्लेषित होते हैं। वे व्यक्तिगत यौगिकों के संग्रह के साथ-साथ समानांतर संश्लेषण द्वारा तैयार यौगिकों की श्रृंखला से भिन्न होते हैं। | |||
यह एक महत्वपूर्ण विशेषता है कि उनके संश्लेषण में मिश्रण का उपयोग किया जाता है। मिश्रण का उपयोग प्रक्रिया की उच्च दक्षता सुनिश्चित करता है। दोनों अभिकारक मिश्रण हो सकते हैं और इस मामले में प्रक्रिया और भी अधिक कुशल होगी। हालांकि व्यावहारिक कारणों से, विभाजन-मिश्रण विधि का उपयोग करने की सलाह दी जाती है जिसमें दो मिश्रणों में से एक को सिंगल निर्माण खंड (BBs) से बदल दिया जाता है। मिश्रण इतने महत्वपूर्ण हैं कि संश्लेषण में मिश्रण का उपयोग किए बिना कोई संयोजन प्रयोगशाला नहीं हैं, और यदि प्रक्रिया में मिश्रण का उपयोग अनिवार्य रूप से संयोजन प्रयोगशाला रूपों में किया जाता है। विभाजन-मिश्रण संश्लेषण आमतौर पर ठोस समर्थन का उपयोग करके महसूस किया जाता है लेकिन इसे समाधान में भी प्रयुक्त करना संभव है। चूंकि वह संरचना करता है, घटक अज्ञात हैं, छानने में deconvolution विधियों का उपयोग करने की आवश्यकता है। | |||
संयोजी प्रयोगशालाओ की सबसे महत्वपूर्ण विशेषताओं में से एक यह है कि पूरे मिश्रण को समान प्रक्रिया में प्रदर्शित किया जा सकता है। यह इन प्रयोगशालाओ को फार्मास्युटिकल अनुसंधान में बहुत उपयोगी बनाता है। | |||
पूर्ण संयोजी प्रयोगशालाओ के आंशिक प्रयोगशालाओ को भी संश्लेषित किया जा सकता है। उनमें से कुछ का उपयोग deconvolution में किया जा सकता है<ref>A. Furka Sub-Library Composition of Peptide Libraries. Potential Application in Screening. Drug Development Research 33, 90-97 (1994).</ref> | |||
=== ठोस समर्थन === से विखंडित | === ठोस समर्थन === से विखंडित प्रयोगशालाओ का विखंडन | ||
यदि संयोजी | यदि संयोजी प्रयोगशाला के संश्लेषित अणुओं को ठोस आधार से अलग किया जाता है तो एक घुलनशील मिश्रण बनता है। इस तरह के समाधान में लाखों अलग-अलग यौगिक मिल सकते हैं। जब यह संश्लेषित विधि विकसित की गई थी, तो पहली बार अणुओं की पहचान करना और उपयोगी गुणों वाले अणुओं को खोजना असंभव लग रहा था। हालाँकि, समस्या को हल करने के लिए उपयोगी घटकों की पहचान के लिए रणनीतियाँ विकसित की गई थीं। ये सभी रणनीतियाँ आंशिक प्रयोगशालाओ के संश्लेषण और परीक्षण पर आधारित हैं। | ||
1982 में नोटरीकृत फुरका के उपर्युक्त दस्तावेज़ में जल्द से जल्द पुनरावृत्त रणनीति का वर्णन किया गया है।<ref name="Furka_Á"/>विधि को बाद में एर्ब एट अल द्वारा स्वतंत्र रूप से प्रकाशित किया गया था। पुनरावर्ती deconvolution के नाम से<ref>Erb E, Janda KD, Brenner S (1994) Recursive deconvolution of combinatorial chemical libraries Proc. Natl Acad Sci.USA 91; 11422-11426.</ref> | 1982 में नोटरीकृत फुरका के उपर्युक्त दस्तावेज़ में जल्द से जल्द पुनरावृत्त रणनीति का वर्णन किया गया है।<ref name="Furka_Á"/>विधि को बाद में एर्ब एट अल द्वारा स्वतंत्र रूप से प्रकाशित किया गया था। पुनरावर्ती deconvolution के नाम से<ref>Erb E, Janda KD, Brenner S (1994) Recursive deconvolution of combinatorial chemical libraries Proc. Natl Acad Sci.USA 91; 11422-11426.</ref> | ||
[[File:Recursive deconvolution.png|thumb|left|350px|पुनरावर्ती deconvolution। नीला, पीला और लाल वृत्त: अमीनो | [[File:Recursive deconvolution.png|thumb|left|350px|पुनरावर्ती deconvolution। नीला, पीला और लाल वृत्त: अमीनो अम्ल, हरा वृत्त: ठोस समर्थन]] | ||
==== पुनरावर्ती deconvolution ==== | ==== पुनरावर्ती deconvolution ==== | ||
विधि को चित्र द्वारा समझा जा सकता है। 27 सदस्यीय पेप्टाइड | विधि को चित्र द्वारा समझा जा सकता है। 27 सदस्यीय पेप्टाइड प्रयोगशाला को तीन अमीनो अम्ल से संश्लेषित किया जाता है। पहले (ए) और दूसरे (बी) चक्रों के बाद उन्हें मिलाने से पहले नमूने अलग रखे गए थे। तीसरे चक्र (C) के उत्पादों को मिलाने से पहले तोड़ा जाता है फिर गतिविधि के लिए परीक्षण किया जाता है। मान लीजिए कि + चिन्ह द्वारा लेबल किया गया समूह सक्रिय है। अंतिम युग्मन स्थिति (CP) पर सभी सदस्यों के पास लाल अमीनो अम्ल होता है। नतीजतन, सक्रिय सदस्य के पास अंतिम सीपी में लाल अमीनो अम्ल भी होता है। फिर लाल अमीनो अम्ल को नमूने डी प्राप्त करने के लिए दूसरे चक्र (बी) के बाद अलग रखे गए तीन नमूनों से जोड़ा जाता है। क्लीविंग के बाद, तीन ई नमूने बनते हैं। यदि परीक्षण के बाद + द्वारा चिह्नित नमूना सक्रिय है तो यह दर्शाता है कि नीला अमीनो अम्ल सक्रिय घटक में दूसरे सीपी पर प्रग्रहण कर लेता है। फिर तीन A नमूनों में पहले नीला फिर लाल अमीनो अम्ल युग्मित (F) होता है, फिर क्लीविंग (G) के बाद फिर से परीक्षण किया जाता है। यदि + घटक सक्रिय साबित होता है, तो सक्रिय घटक का क्रम निर्धारित किया जाता है और एच में दिखाया जाता है। | ||
==== स्थितीय स्कैनिंग ==== | ==== स्थितीय स्कैनिंग ==== | ||
फुरका एट अल द्वारा स्वतंत्र रूप से स्थितीय स्कैनिंग की शुरुआत की गई थी।<ref>Furka Á, Sebestyén F, WC 93/24517, 1993.</ref> और पिनिला एट अल।<ref>Pinilla C, Appel JR, Blanc P, Houghten RA (1993) Rapid identification of high affinity peptide ligands using positional scanning synthetic peptide combinatorial libraries. BioTechniques 13(6); 901-5.</ref> विधि उपपुस्तकालयों की श्रृंखला के संश्लेषण और परीक्षण पर आधारित है। जिसमें | फुरका एट अल द्वारा स्वतंत्र रूप से स्थितीय स्कैनिंग की शुरुआत की गई थी।<ref>Furka Á, Sebestyén F, WC 93/24517, 1993.</ref> और पिनिला एट अल।<ref>Pinilla C, Appel JR, Blanc P, Houghten RA (1993) Rapid identification of high affinity peptide ligands using positional scanning synthetic peptide combinatorial libraries. BioTechniques 13(6); 901-5.</ref> विधि उपपुस्तकालयों की श्रृंखला के संश्लेषण और परीक्षण पर आधारित है। जिसमें समान अमीनो अम्ल एक निश्चित अनुक्रम स्थिति पर प्रग्रहण कर लेता है। यह चित्र तीन अमीनो अम्ल से बने पूर्ण पेप्टाइड ट्रिमर प्रयोगशाला (ए) के नौ सबलाइब्रेरी (बी1-डी3) को दर्शाता है। उप-प्रयोगशालाओ में एक स्थिति होती है जो सभी घटकों में समान अमीनो अम्ल द्वारा प्रग्रहण कर ली जाती है। एक उपपुस्तकालय के संश्लेषण में समर्थन विभाजित नहीं होता है और पूरे नमूने में केवल एक एमिनो अम्ल जोड़ा जाता है। नतीजतन, एक स्थिति वास्तव में सभी घटकों में समान अमीनो अम्ल द्वारा प्रग्रहण कर ली जाती है। उदाहरण के लिए, बी2 सबलाइब्रेरी पोजीशन 2 में सभी नौ घटकों में पीले अमीनो अम्ल का प्रग्रहण है। यदि अनुवीक्षण टेस्ट में यह सबलाइब्रेरी सकारात्मक उत्तर देती है तो इसका तात्पर्य है कि सक्रिय पेप्टाइड में स्थिति 2 भी पीले अमीनो अम्ल द्वारा प्रग्रहण कर लिया गया है। सभी नौ (या कभी-कभी कम) उप-प्रयोगशालाओ का परीक्षण करके अमीनो अम्ल अनुक्रम निर्धारित किया जा सकता है। | ||
[[File:Positional scanning.png|thumb|left|400px|स्थितीय स्कैनिंग। पूर्ण ट्रिमर पेप्टाइड | [[File:Positional scanning.png|thumb|left|400px|स्थितीय स्कैनिंग। पूर्ण ट्रिमर पेप्टाइड प्रयोगशाला 3 अमीनो अम्ल और इसकी 9 सबलाइब्रेरी से बनी है। पहली पंक्ति युग्मन स्थिति दिखाती है]] | ||
[[File:Full and omission libraries.png|thumb|right|460px|एक 27-सदस्यीय त्रिपेप्टाइड पूर्ण | [[File:Full and omission libraries.png|thumb|right|460px|एक 27-सदस्यीय त्रिपेप्टाइड पूर्ण प्रयोगशाला और तीन चूक प्रयोगशाला। रंग मंडल अमीनो अम्ल होते हैं]] | ||
==== चूक | ==== चूक प्रयोगशाला ==== | ||
चूक | चूक प्रयोगशालाओ में<ref>Carell TE, Winter A, Rebek J Jr. (1994) A Novel Procedure for the Synthesis of Libraries Containing Small Organic Molecules, Angew Chem Int Ed Engl 33; 2059-2061.</ref><ref>Câmpian E, Peterson M, Saneii HH, Furka Á, (1998) Deconvolution by omission libraries, Bioorg &[ Med Chem Letters 8; 2357-2362.</ref> मिश्रण के सभी पेप्टाइड्स से एक निश्चित अमीनो अम्ल गायब है। यह चित्र पूर्ण प्रयोगशाला और तीन चूक प्रयोगशालाओ को दर्शाता है। शीर्ष पर छोड़े गए अमीनो अम्ल दिखाए जाते हैं। यदि चूक प्रयोगशाला एक नकारात्मक परीक्षण देता है तो सक्रिय घटक में छोड़ा गया अमीनो अम्ल मौजूद होता है। | ||
=== बंधे हुए | === बंधे हुए संयोजी प्रयोगशालाओ का विखंडन === | ||
यदि पेप्टाइड्स को ठोस समर्थन से अलग नहीं किया जाता है तो हम मोतियों के मिश्रण से निपटते हैं, प्रत्येक | यदि पेप्टाइड्स को ठोस समर्थन से अलग नहीं किया जाता है तो हम मोतियों के मिश्रण से निपटते हैं, प्रत्येक गोले में एक पेप्टाइड होता है। स्मिथ और उनके सहयोगी<ref>J. A. Smith J. G. R. Hurrel, S. J. Leach A novel method for delineating antigenic determinants: peptide synthesis and radioimmunoassay using the same solid support. Immunochemistry 1977, 14, 565.</ref> ने पहले दिखाया था कि पेप्टाइड्स का परीक्षण टीथर के रूप में भी किया जा सकता है। इस दृष्टिकोण का उपयोग पेप्टाइड प्रयोगशालाओ की अनुवीक्षण में भी किया गया था। टेथर्ड पेप्टाइड प्रयोगशाला को भंग लक्ष्य प्रोटीन के साथ परीक्षण किया गया था। जिन मोतियों से प्रोटीन जुड़ा हुआ था, उन्हें निकाल लिया गया, मनके से प्रोटीन को हटा दिया गया, फिर अनुक्रमण द्वारा टेथर्ड पेप्टाइड की पहचान की गई। | ||
टेलर और मोर्केन ने कुछ अलग दृष्टिकोण | टेलर और मोर्केन ने कुछ अलग दृष्टिकोण स्वीकृत किया।<ref>S. J. Taylor, J. P. Morken Thermographic Selection of Effective Catalysts from an Encoded Polymer-Bound Library Science 1998, 280, 267.</ref> उन्होंने गैर-पेप्टाइड टेथर्ड प्रयोगशालाओ में उत्प्रेरक की पहचान करने के लिए इन्फ्रारेड थर्मोग्राफी का इस्तेमाल किया। विधि उस गर्मी पर आधारित होती है जो मोतियों में विकसित होती है जिसमें उत्प्रेरक होता है जब टिथर्ड प्रयोगशाला को सब्सट्रेट के समाधान में डुबोया जाता है। जब एक इन्फ्रारेड माइक्रोस्कोप के माध्यम से मोतियों की जांच की जाती है तो गोले युक्त उत्प्रेरक चमकीले धब्बों के रूप में दिखाई देते हैं और उन्हें बाहर निकाला जा सकता है। | ||
==== एन्कोडेड | ==== एन्कोडेड संयोजी प्रयोगशाला ==== | ||
यदि हम एक गैर-पेप्टाइड कार्बनिक | यदि हम एक गैर-पेप्टाइड कार्बनिक प्रयोगशाला प्रयोगशाला के साथ व्यवहार करते हैं, तो गोले की पदार्थ की पहचान निर्धारित करना उतना आसान नहीं है जितना कि पेप्टाइड के मामले में। इस कठिनाई को दरकिनार करने के लिए, प्रयोगशाला के संश्लेषण के साथ-साथ मोतियों को संलग्न करने के तरीकों को विकसित किया गया था, अणु जो गोले में बने यौगिक की संरचना को कूटबद्ध करते हैं। | ||
ओह्लमेयर और उनके सहयोगियों ने एक बाइनरी एन्कोडिंग विधि प्रकाशित की<ref>Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC (1993) Complex synthetic chemical libraries indexed with molecular tags, Proc Natl Acad Sci USA 90; 10922-10926.</ref> उन्होंने 18 टैगिंग अणुओं के मिश्रण का इस्तेमाल किया, जो उन्हें मोतियों से अलग करने के बाद इलेक्ट्रॉन कैप्चर गैस क्रोमैटोग्राफी द्वारा पहचाना जा सकता था। सरकार एट अल। वर्णित पेंटेनोइक एमाइड्स (COPAs) के चिरल ओलिगोमर्स जिनका उपयोग बड़े पैमाने पर एन्कोडेड OBOC | ओह्लमेयर और उनके सहयोगियों ने एक बाइनरी एन्कोडिंग विधि प्रकाशित की<ref>Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC (1993) Complex synthetic chemical libraries indexed with molecular tags, Proc Natl Acad Sci USA 90; 10922-10926.</ref> उन्होंने 18 टैगिंग अणुओं के मिश्रण का इस्तेमाल किया, जो उन्हें मोतियों से अलग करने के बाद इलेक्ट्रॉन कैप्चर गैस क्रोमैटोग्राफी द्वारा पहचाना जा सकता था। सरकार एट अल। वर्णित पेंटेनोइक एमाइड्स (COPAs) के चिरल ओलिगोमर्स जिनका उपयोग बड़े पैमाने पर एन्कोडेड OBOC प्रयोगशालाओ के निर्माण के लिए किया जा सकता है।<ref>Sarkar M, Pascal BD, Steckler C, Aquino C., Micalizio GC, Kodadek T, Chalmers MJ (1993) Decoding Split and Pool Combinatorial Libraries with Electron Transfer Dissociation Tandem Mass Spectrometry, J Am Soc Mass Spectrom 24(7): 1026-36.</ref> केर एट अल। एक अभिनव एन्कोडिंग विधि पेश की<ref>Kerr JM, Banville SC, Zuckermann RN (1993) Encoded Combinatorial Peptide Libraries Containing Non-Natural Amino Acids, J Am Chem. Soc 115; 2529-2531.</ref> मोतियों से एक ऑर्थोगोनली संरक्षित रिमूवेबल बाइफंक्शनल लिंकर जुड़ा हुआ था। लिंकर के एक छोर का उपयोग प्रयोगशाला के गैर-प्राकृतिक भवन ब्लॉकों को संलग्न करने के लिए किया गया था, जबकि दूसरे छोर पर अमीनो अम्ल ट्रिपल को एन्कोडिंग से जोड़ा गया था। निर्माण खंड गैर-प्राकृतिक अमीनो अम्ल थे और उनके एन्कोडिंग अमीनो अम्ल ट्रिपल की श्रृंखला को एडमैन डिग्रेडेशन द्वारा निर्धारित किया जा सकता था। इस तरह के एन्कोडिंग का महत्वपूर्ण पहलू प्रयोगशाला के सदस्यों को उनके संलग्न एन्कोडिंग टैग के साथ मिलकर एक घुलनशील प्रयोगशाला बनाने की संभावना थी। निकोलाजेव एट अल द्वारा समान दृष्टिकोण का उपयोग किया गया था। पेप्टाइड्स के साथ एन्कोडिंग के लिए।<ref>Nikolaiev V, Stierandová A, Krchnák V, Seligmann B, Lam KS, Salmon SE, Lebl M, (1993) Peptide-encoding for structure determination of nonsequenceable polymers within libraries synthesized and tested on solid-phase supports, Pept Res. 6(3):161-70.</ref> 1992 में ब्रेनर और लर्नर ने ठोस समर्थन के मोतियों को एनकोड करने के लिए डीएनए अनुक्रम पेश किया जो सबसे सफल एन्कोडिंग विधि साबित हुई।<ref>Brenner S, Lerner RA. (1992) Encoded combinatorial chemistry. Proc Natl Acad Sci USA 89; 5381–5383.</ref> नील्सन, ब्रेनर और जैंडा ने डीएनए एन्कोडिंग को प्रयुक्त करने के लिए केर दृष्टिकोण का भी इस्तेमाल किया<ref>Nielsen J, Brenner S, Janda KD. (1993) Synthetic methods for the implementation of encoded combinatorial chemistry. Journal of the American Chemical Society, 115 (21); 9812–9813.</ref> | ||
समय की नवीनतम अवधि में डीएनए अनुक्रमण में महत्वपूर्ण प्रगति हुई है। अगली पीढ़ी की तकनीक समानांतर में बड़ी संख्या में नमूनों को अनुक्रमित करना संभव बनाती है जो डीएनए एन्कोडेड | समय की नवीनतम अवधि में डीएनए अनुक्रमण में महत्वपूर्ण प्रगति हुई है। अगली पीढ़ी की तकनीक समानांतर में बड़ी संख्या में नमूनों को अनुक्रमित करना संभव बनाती है जो डीएनए एन्कोडेड प्रयोगशालाओ की अनुवीक्षण में बहुत महत्वपूर्ण है। एक और नवाचार था जिसने डीएनए एन्कोडिंग की सफलता में योगदान दिया। 2000 में हैल्पिन और हारबरी ने डीएनए एन्कोडेड संयोजी प्रयोगशाला के विभाजन-मिश्रण संश्लेषण में ठोस समर्थन को छोड़ दिया और इसे एन्कोडिंग डीएनए ओलिगोमर्स द्वारा बदल दिया। ठोस चरण विभाजन और निकाय संश्लेषण में प्रयोगशालाओ के घटकों की संख्या समर्थन के मोतियों की संख्या से अधिक नहीं हो सकती। लेखकों के उपन्यास दृष्टिकोण से, इस संयम को समाप्त कर दिया गया और व्यावहारिक रूप से असीमित संख्या में नए यौगिक तैयार करना संभव हो गया।<ref>Harbury DR, Halpin DR (2000) WO 00/23458.</ref> उदाहरण के लिए डेनिश कंपनी न्यूवोल्यूशन ने 40 ट्रिलियन युक्त डीएनए एन्कोडेड प्रयोगशाला को संश्लेषित किया! अवयव<ref>B. Halford How DNA-encoded libraries are revolutionizing drug discovery. C&EN 2017, 95, Issue 25.</ref> | ||
डीएनए एन्कोडेड | डीएनए एन्कोडेड प्रयोगशाला घुलनशील हैं जो अनुवीक्षण में कुशल आत्मीयता बंधन को प्रयुक्त करना संभव बनाता है। कुछ लेखक डीएनए एन्कोडेड संयोजी प्रयोगशाला के एक्रोमिम के लिए डीईएल प्रयुक्त करते हैं, अन्य डीईसीएल का उपयोग कर रहे हैं। उत्तरार्द्ध बेहतर लगता है क्योंकि इस नाम में इन प्रयोगशालाओ की संयुक्त प्रकृति स्पष्ट रूप से व्यक्त की गई है। | ||
वर्तमान सहस्राब्दी के पहले दशक में कई प्रकार के डीएनए एन्कोडेड संयोजी | वर्तमान सहस्राब्दी के पहले दशक में कई प्रकार के डीएनए एन्कोडेड संयोजी प्रयोगशालाओ को पेश किया गया था और उनका वर्णन किया गया था। इन प्रयोगशालाओ को औषधि अनुसंधान में बहुत सफलतापूर्वक प्रयुक्त किया जाता है। | ||
* गार्टनर एट अल द्वारा 2001 में वर्णित संयोजन | * गार्टनर एट अल द्वारा 2001 में वर्णित संयोजन प्रयोगशालाओ के डीएनए टेम्पलेटेड संश्लेषण।<ref>Gartner ZJ, Tse BN, Grubina RB, Doyon JB, Snyder TM, Liu DR (2004) DNA-Templated Organic Synthesis and Selection of a Library of Macrocycles, Science 305; 1601-1605.</ref> | ||
* 2004 में Mlecco et al द्वारा आविष्कार की गई दोहरी फ़ार्माकोफ़ोर डीएनए एन्कोडेड | * 2004 में Mlecco et al द्वारा आविष्कार की गई दोहरी फ़ार्माकोफ़ोर डीएनए एन्कोडेड संयोजी प्रयोगशाला।<ref>Melkko S, Scheuermann J, Dumelin CE, Neri D (2004) Encoded self-assembling chemical libraries Nat Biotechnol 22; 568-574.</ref> | ||
* 2004 में हार्बरी हैल्पिन और हारबरी द्वारा प्रकाशित अनुक्रम एन्कोडेड रूटिंग।<ref>Halpin DR, Harbury PB (2004) DNA Display I. Sequence-Encoded Routing of DNA Populations, PLoS Biology 2; 1015-102.</ref> | * 2004 में हार्बरी हैल्पिन और हारबरी द्वारा प्रकाशित अनुक्रम एन्कोडेड रूटिंग।<ref>Halpin DR, Harbury PB (2004) DNA Display I. Sequence-Encoded Routing of DNA Populations, PLoS Biology 2; 1015-102.</ref> | ||
* एकल फ़ार्माकोफ़ोर डीएनए एन्कोडेड | * एकल फ़ार्माकोफ़ोर डीएनए एन्कोडेड संयोजी प्रयोगशाला को 2008 में Manocci et al द्वारा पेश किया गया।<ref>Mannocci L, Zhang Y, Scheuermann J, Leimbacher M, De Bellis G, Rizzi E, Dumelin C, Melkko S, and Neri N (2008) High-throughput sequencing allows the identification of binding molecules isolated from DNA-encoded chemical libraries, Proc Natl Acad Sci USA 105;17670–17675.</ref> | ||
* हैनसेन एट अल द्वारा प्रकाशित योक्टोलिटर-स्केल रिएक्टर का उपयोग करके गठित डीएनए एन्कोडेड | * हैनसेन एट अल द्वारा प्रकाशित योक्टोलिटर-स्केल रिएक्टर का उपयोग करके गठित डीएनए एन्कोडेड संयोजी प्रयोगशाला। 2009 में<ref>Hansen MH, Blakskjær P, Petersen LK, Hansen TH, Højfeldt JW, Gothelf KV, HansenNJV (2009) A Yoctoliter-Scale DNA Reactor for Small-Molecule Evolution (2009) J Am Chem Soc 131; 1322-1327.</ref> | ||
पृष्ठ [[डीएनए-एन्कोडेड रासायनिक पुस्तकालय]] में उनके संश्लेषण और अनुप्रयोग के बारे में विवरण पाए जाते हैं। | पृष्ठ [[डीएनए-एन्कोडेड रासायनिक पुस्तकालय|डीएनए-एन्कोडेड रासायनिक प्रयोगशाला]] में उनके संश्लेषण और अनुप्रयोग के बारे में विवरण पाए जाते हैं। | ||
डीएनए एन्कोडेड घुलनशील संयोजी | डीएनए एन्कोडेड घुलनशील संयोजी प्रयोगशालाओ में कमियां भी हैं। सबसे पहले, ठोस समर्थन के उपयोग से मिलने वाला लाभ पूरी तरह से खो जाता है। इसके अलावा, डीएनए एन्कोडिंग श्रृंखलाओं का पॉलीओनिक चरित्र संश्लेषण में गैर-जलीय सॉल्वैंट्स की उपयोगिता को सीमित करता है। इस कारण से कई प्रयोगशालाएं डीईसीएल के संश्लेषण में उपयोग के लिए डीएनए संगत प्रतिक्रियाओं को विकसित करना चुनती हैं। उपलब्ध में से कुछ का पहले ही वर्णन किया जा चुका है<ref>Luk KC, Satz AL (2014) DNA‐Compatible Chemistry in: Goodnow Jr. RA Editor A Handbook for DNA‐Encoded Chemistry: Theory and Applications for Exploring Chemical Space and Drug Discovery, Wiley, pp 67-98.</ref><ref>Satz AL, Cai J, Chen Y,§, Goodnow R, Felix Gruber F, Kowalczyk A, Petersen A, Naderi-Oboodi G, Orzechowski L, Strebel Q (2015) DNA Compatible Multistep Synthesis and Applications to DNA Encoded Libraries Bioconjugate Chem 26; 1623−1632.</ref><ref>Li Y, Gabriele E, Samain F, Favalli N, Sladojevich F, Scheuermann J, Neri D (2016) Optimized reaction conditions for amide bond formation in DNA-encoded combinatorial libraries, ACS Comb Sci 18(8); 438–443.</ref> | ||
== | == पदार्थ विज्ञान == | ||
पदार्थ विज्ञान ने नई सामग्रियों की खोज के लिए संचयविन्यास रसायन विज्ञान की तकनीकों को प्रयुक्त किया है। इस कार्य का नेतृत्व पीटर जी. शुल्ज़ ने किया था|पी.जी. शुल्ज़ एट अल। नब्बे के दशक के मध्य में <ref>X. -D. Xiang et al. "A Combinatorial Approach to Materials Discovery" [http://www.sciencemag.org/cgi/content/abstract/268/5218/1738 Science 268 (1995) 1738]</ref> सिलिकॉन सब्सट्रेट पर तत्वों के सह-निक्षेपण द्वारा प्राप्त ल्यूमिनेसेंट पदार्थ के संदर्भ में। उनका काम 1970 में जे. जे. हनक द्वारा किया गया था<ref>J.J. Hanak, J. Mater. Sci, 1970, 5, 964-971</ref> लेकिन उस समय विधि के प्रसार के लिए कंप्यूटर और रोबोटिक्स उपकरण उपलब्ध नहीं थे। कई अकादमिक समूहों द्वारा काम जारी रखा गया है<ref>Combinatorial methods for development of sensing materials, Springer, 2009. {{ISBN|978-0-387-73712-6}}</ref><ref>V. M. Mirsky, V. Kulikov, Q. Hao, O. S. Wolfbeis. Multiparameter High Throughput Characterization of Combinatorial Chemical Microarrays of Chemosensitive Polymers. Macromolec. Rap. Comm., 2004, 25, 253-258</ref><ref>H. Koinuma et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 1 (2000) 1 [https://dx.doi.org/10.1016/S1468-6996(00)00003-6 free download]</ref><ref>Andrei Ionut Mardare et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 9 (2008) 035009 [https://dx.doi.org/10.1088/1468-6996/9/3/035009 free download]</ref> साथ ही बड़े अनुसंधान और विकास कार्यक्रमों वाली कंपनियाँ ([[Symyx Technologies]], [[General Electric]], [[Dow Chemical]] आदि)। कटैलिसीस के लिए तकनीक का बड़े पैमाने पर उपयोग किया गया है,<ref>Applied Catalysis A, Volume 254, Issue 1, Pages 1-170 (10 November 2003)</ref> कोटिंग्स,<ref>J. N. Cawse et al., Progress in Organic Coatings, Volume 47, Issue 2, August 2003, Pages 128-135</ref> इलेक्ट्रॉनिक्स,<ref>Combinatorial Methods for High-Throughput Materials Science, | |||
MRS Proceedings Volume 1024E, Fall 2007</ref> और कई अन्य क्षेत्र।<ref>Combinatorial and Artificial Intelligence Methods in Materials Science II, MRS Proceedings Volume 804, Fall 2004</ref> उत्पादित डेटा की विशाल मात्रा को संभालने, प्रशासित करने और संग्रहीत करने के लिए उपयुक्त सूचना विज्ञान उपकरणों का अनुप्रयोग महत्वपूर्ण है।<ref>QSAR and Combinatorial Science, 24, Number 1 (February 2005)</ref> बड़े प्रयोगात्मक स्थानों को कुशलतापूर्वक संबोधित करने के लिए प्रयोग विधियों के नए प्रकार के डिजाइन भी विकसित किए गए हैं जिन्हें संयोजन विधियों का उपयोग करके निपटाया जा सकता है।<ref>J. N. Cawse, Ed., [http://cawseandeffect.com/wp-content/uploads/2013/11/Chapter_1.pdf Experimental Design for Combinatorial and High Throughput Materials Development], John Wiley and Sons, 2002.</ref> | MRS Proceedings Volume 1024E, Fall 2007</ref> और कई अन्य क्षेत्र।<ref>Combinatorial and Artificial Intelligence Methods in Materials Science II, MRS Proceedings Volume 804, Fall 2004</ref> उत्पादित डेटा की विशाल मात्रा को संभालने, प्रशासित करने और संग्रहीत करने के लिए उपयुक्त सूचना विज्ञान उपकरणों का अनुप्रयोग महत्वपूर्ण है।<ref>QSAR and Combinatorial Science, 24, Number 1 (February 2005)</ref> बड़े प्रयोगात्मक स्थानों को कुशलतापूर्वक संबोधित करने के लिए प्रयोग विधियों के नए प्रकार के डिजाइन भी विकसित किए गए हैं जिन्हें संयोजन विधियों का उपयोग करके निपटाया जा सकता है।<ref>J. N. Cawse, Ed., [http://cawseandeffect.com/wp-content/uploads/2013/11/Chapter_1.pdf Experimental Design for Combinatorial and High Throughput Materials Development], John Wiley and Sons, 2002.</ref> | ||
== विविधता उन्मुख | == विविधता उन्मुख प्रयोगशाला == | ||
भले ही दो दशकों से भी अधिक समय से | भले ही दो दशकों से भी अधिक समय से संयोजी रसायन प्रारंभिक औषधि की खोज का एक अनिवार्य भाग रहा है, लेकिन अब तक एफडीए द्वारा क्लिनिकल उपयोग के लिए केवल एक डे नोवो संयोजन रसायन-संश्लेषित रसायन को मंजूरी दी गई है ([[सरनब]], उन्नत गुर्दे के कैंसर के लिए संकेतित एक मल्टीकाइनेज अवरोधक) .<ref>D. Newman and G. Cragg "Natural Products as Sources of New Drugs over the Last 25 Years" [https://dx.doi.org/10.1021/np068054v J Nat Prod 70 (2007) 461]</ref> संयोजी रसायन विज्ञान के उत्पादों द्वारा कवर किए गए बल्कि सीमित [[रासायनिक स्थान]] से जुड़ने के लिए दृष्टिकोण की खराब सफलता दर के विश्लेषण का सुझाव दिया गया है।<ref name="pubs.acs.org">M. Feher and J. M. Schmidt "Property Distributions: Differences between Drugs, Natural Products, and Molecules from Combinatorial Chemistry" [http://pubs.acs.org/doi/full/10.1021/ci0200467 J. Chem. Inf. Comput. Sci., 43 (2003) 218]</ref> संयोजी रसायन शास्त्र प्रयोगशालाओ में यौगिकों के गुणों की तुलना स्वीकृत दवाओं और प्राकृतिक उत्पादों, फेहर और श्मिट से करते हैं<ref name="pubs.acs.org"/> नोट किया गया कि संचयविन्यास रसायन शास्त्र प्रयोगशाला विशेष रूप से [[चिरायता (रसायन विज्ञान)]] की कमी के साथ-साथ संरचना की कठोरता से पीड़ित हैं, दोनों को व्यापक रूप से औषधि-जैसी गुणों के रूप में माना जाता है। भले ही हाल के दिनों में प्राकृतिक उत्पाद औषधि की खोज शायद फार्मास्युटिकल उद्योग में सबसे फैशनेबल प्रवृत्ति नहीं रही है,{{citation needed|date=November 2012}} नई रासायनिक संस्थाओं का एक बड़ा भाग अभी भी प्रकृति-व्युत्पन्न यौगिक हैं,<ref>{{Cite journal |last1=Cordier |first1=C. |last2=Morton |first2=D. |last3=Murrison |first3=S. |last4=Nelson |first4=A. |last5=O'Leary-Steele |first5=C. |date=2008 |title=बायोएक्टिव कंपाउंड लाइब्रेरी के विविधता-उन्मुख संश्लेषण में एक प्रेरणा के रूप में प्राकृतिक उत्पाद|journal=Nat. Prod. Rep. |volume=25 |issue=4 |pages=719–737 |doi=10.1039/B706296F|pmid=18663392 |pmc=2496956 |s2cid=15697405 }}</ref><ref>{{Cite journal |last1=de Sousa Luis |first1=J.A. |last2=Costa Barros |first2=R.P. |last3=de Sousa |first3=N.F. |last4=Muratov |first4=E. |last5=Scotti |first5=L. |last6=Scotti |first6=M.T. |date=2021 |title=प्राकृतिक उत्पादों के डेटाबेस की वर्चुअल स्क्रीनिंग|journal=Mini-Rev. Med. Chem. |volume=21 |issue=18 |pages=2657–2730 |doi=10.2174/1389557520666200730161549|pmid=32744975 |s2cid=220965407 }}</ref><ref>{{Cite journal |last=Harvey |first=A.L. |date=2008 |title=दवा की खोज में प्राकृतिक उत्पाद|journal=Drug Discov. Today |volume=13 |issue=19–20 |pages=894–901 |doi=10.1016/j.drudis.2008.07.004|pmid=18691670 }}</ref><ref>{{Cite book |last=Kohli |first=S. |title=मॉलिक्यूलर इनसाइट ऑफ़ ड्रग डिज़ाइन, एड में न्यू ड्रग लेड के स्रोत के रूप में प्रकृति के लिए एकीकृत दृष्टिकोण। आदित्य, ए.|publisher=IntechOpen |year=2018 |pages=29–44 |doi=10.5772/intechopen.74961|s2cid=64364163 |url=https://openresearchlibrary.org/ext/api/media/ec03d739-9daa-4c97-b736-be928c62e9ea/assets/external_content.pdf |archive-url=https://web.archive.org/web/20220527120750/https://openresearchlibrary.org/ext/api/media/ec03d739-9daa-4c97-b736-be928c62e9ea/assets/external_content.pdf |archive-date=2022-05-27 |url-status=live }}</ref><ref>{{Cite journal |last1=Kaiser |first1=M. |last2=Wetzel |first2=S. |last3=Kumar |first3=K. |last4=Waldmann |first4=H. |date=2008 |title=यौगिक पुस्तकालयों का जीव विज्ञान-प्रेरित संश्लेषण|journal=Cell. Mol. Life Sci. |volume=65 |issue=7–8 |pages=1186–1201 |doi=10.1007/s00018-007-7492-1|pmid=18193390 |s2cid=22601514 |doi-access=free }}</ref><ref>{{Cite journal |last1=Teague |first1=S.J. |last2=Davis |first2=A.M. |last3=Leeson |first3=P.D. |last4=Oprea |first4=T. |date=1999 |title=सीसे के समान संयोजी पुस्तकालयों का डिजाइन|journal=Angew. Chem. Int. Ed. |volume=38 |issue=24 |pages=3743–3748 |doi=10.1002/(SICI)1521-3773(19991216)38:24<3743::AID-ANIE3743>3.0.CO;2-U|pmid=10649345 }}</ref> और इस प्रकार, यह सुझाव दिया गया है कि अनुवीक्षण प्रयोगशालाओ की रासायनिक विविधता को बढ़ाकर संचयविन्यास रसायन विज्ञान की प्रभावशीलता में सुधार किया जा सकता है।<ref>Su QB, Beeler AB, Lobkovsky E, Porco JA, Panek JS "Stereochemical diversity through cyclodimerization: Synthesis of polyketide-like macrodiolides." Org Lett 2003, 5:2149-2152.</ref> चिरायता और कठोरता के रूप में दो सबसे महत्वपूर्ण विशेषताएं हैं जो अनुमोदित दवाओं और प्राकृतिक उत्पादों को संचयविन्यास रसायन विज्ञान प्रयोगशालाओ में यौगिकों से अलग करती हैं, ये दो समस्याएं हैं जो तथाकथित विविधता उन्मुख प्रयोगशालाओ में जोर देते हैं, अर्थात यौगिक संग्रह जो कि रासायनिक स्थान के कवरेज का लक्ष्य रखते हैं, इसके बजाय बड़ी संख्या में यौगिकों की।<ref>{{Cite journal |last1=Medina-Franco |first1=J.L. |last2=Martínez-Mayorga |first2=K. |last3=Giulianotti |first3=M.A. |last4=Houghten |first4=R.A. |last5=Pinilla |first5=C. |date=2008 |title=दवा की खोज में रासायनिक स्थान का दृश्य|journal=Curr Comput-Aided Drug Des |volume=4 |issue=4 |pages=322–333 |doi=10.2174/157340908786786010 }}</ref><ref>{{Cite journal |last1=Rosén |first1=J. |last2=Gottfries |first2=J. |last3=Muresan |first3=S. |last4=Backlund |first4=A. |last5=Oprea |first5=T.I. |date=2009 |title=प्राकृतिक उत्पादों के माध्यम से उपन्यास रासायनिक अंतरिक्ष अन्वेषण|journal=J. Med. Chem. |volume=52 |issue=7 |pages=1953–1962 |doi=10.1021/jm801514w|pmid=19265440 |pmc=2696019 }}</ref><ref>{{Cite journal |last1=Lachance |first1=H. |last2=Wetzel |first2=S. |last3=Kumar |first3=K. |last4=Waldmann |first4=H. |date=2012 |title=ड्रग डिस्कवरी के लिए प्राकृतिक उत्पाद रासायनिक स्थान को चार्ट करना, नेविगेट करना और पॉप्युलेट करना|journal=J. Med. Chem. |volume=55 |issue=13 |pages=5989–6001 |doi=10.1021/jm300288g|pmid=22537178 }}</ref><ref>{{Cite journal |last1=Reymond |first1=J.-L. |last2=Awale |first2=M. |date=2012 |title=केमिकल यूनिवर्स डेटाबेस का उपयोग करके ड्रग डिस्कवरी के लिए केमिकल स्पेस की खोज करना|journal=ACS Chem. Neurosci. |volume=3 |issue=9 |pages=649–657 |doi=10.1021/cn3000422|pmid=23019491 |pmc=3447393 }}</ref><ref>{{Cite book |last=Medina-Franco |first=J.L. |title=Chemoinformatic characterization of the chemical space and molecular diversity of compound libraries, in Diversity-Oriented Synthesis: Basics and Applications in Organic Synthesis, Drug Discovery, and Chemical Biology, Trabocchi, A.; Ed., Chapter 10, 2013, 325-352 |publisher=John Wiley & Sons, Inc. |year=2013}}</ref><ref>{{Cite book |last1=Klein |first1=R. |title=Combinatorial Chemistry Library Design, in, Plant Chemical Biology, Audenaert, D.; Overvoorde, P.; Eds. |last2=Lindell |first2=S.D. |publisher=John Wiley & Sons, Inc. |year=2014 |location=New Jersey |pages=40–63}}</ref> | ||
== [[पेटेंट]] वर्गीकरण उपवर्ग == | == [[पेटेंट]] वर्गीकरण उपवर्ग == | ||
अंतर्राष्ट्रीय पेटेंट वर्गीकरण (आईपीसी) के 8वें संस्करण में, जो 1 जनवरी, 2006 को प्रयुक्त हुआ, संयुक्त रसायन विज्ञान "C40B" के क्षेत्र में आविष्कारों से संबंधित पेटेंट अनुप्रयोगों और पेटेंट के लिए एक विशेष उपवर्ग बनाया गया है। | |||
== यह भी देखें == | == यह भी देखें == | ||
* [[साहचर्य]] | * [[साहचर्य|संयोजन]] | ||
*[[रसायन विज्ञान]] | *[[रसायन विज्ञान|रासायनिक सूचना विज्ञान]] | ||
* [[कॉम्बिनेटरियल बायोलॉजी| | * [[कॉम्बिनेटरियल बायोलॉजी|संयुक्त जीव विज्ञान]] | ||
* | *औषधि का अन्वेषण | ||
* [[डायनेमिक कॉम्बिनेटरियल केमिस्ट्री| | * [[डायनेमिक कॉम्बिनेटरियल केमिस्ट्री|गतिशील संयोजन रसायन]] | ||
*[[उच्च परिणाम स्क्रीनिंग]] | *[[उच्च परिणाम स्क्रीनिंग|उच्च परिणाम अनुवीक्षण]] | ||
* [[गणितीय रसायन]] | * [[गणितीय रसायन]] | ||
* [[आणविक मॉडलिंग]] | * [[आणविक मॉडलिंग]] | ||
Revision as of 15:40, 10 May 2023
संचयविन्यास रसायन में रासायनिक संश्लिष्ट विधियाँ सम्मिलित होती हैं जो समान प्रक्रिया में बड़ी संख्या में (दसियों से हज़ारों या यहाँ तक कि लाखों) यौगिकों को तैयार करना संभव बनाती हैं। इन यौगिक प्रयोगशालाओ को मिश्रण, व्यक्तिगत यौगिकों के समूह या कंप्यूटर सॉफ्टवेयर द्वारा उत्पन्न रासायनिक संरचनाओं के रूप में बनाया जा सकता है।[1] संचयविन्यास रसायन का उपयोग छोटे अणुओं के संश्लेषण और पेप्टाइड्स के लिए किया जा सकता है।
रणनीतियाँ जो प्रयोगशालाओ के उपयोगी घटकों की पहचान करने की स्वीकृति देती हैं, वे भी संयोजी रसायन विज्ञान का भाग हैं। संचयविन्यास रसायन में उपयोग की जाने वाली विधियों को रसायन के बाहर भी प्रयुक्त किया जाता है।
इतिहास
संचयविन्यास रसायन का आविष्कार फुरका ए (ईटोवोस लोरैंड विश्वविद्यालय बुडापेस्ट हंगरी) द्वारा किया गया था, जिन्होंने 1982 में अप्रचलित किए गए एक दस्तावेज में इसके सिद्धांत, संयोजन संश्लेषण और एक विसंवलन प्रक्रिया का वर्णन किया था।[2] संयोजन विधि का सिद्धांत है : एकल चरणबद्ध प्रक्रिया में एक बहु-घटक यौगिक मिश्रण (संयोजन प्रयोगशाला) को संश्लेषित करें और समान प्रक्रिया में औषधि पदाभिलाषी या अन्य प्रकार के उपयोगी यौगिकों को खोजने के लिए इसे जांच करें। संयोजन विधि का सबसे महत्वपूर्ण नवाचार संश्लेषण में मिश्रण का उपयोग करना है और अनुवीक्षण जो प्रक्रिया की उच्च उत्पादकता सुनिश्चित करती है। आविष्कार के लिए प्रेरित करने वाली प्रेरणाएँ 2002 में प्रकाशित हुई थीं।[3]
परिचय
संयोजी विधि में अणुओं का संश्लेषण तेजी से बड़ी संख्या में अणुओं को उत्पन्न कर सकता है। उदाहरण के लिए, विविधता के तीन बिंदुओं (R1, R2, और R3) के साथ एक अणु संभव उत्पन्न कर सकता है। संरचनाएं, जहां , , और उपयोग किए गए विभिन्न प्रतिस्थापियों की संख्या हैं।[2]
संयोजन रसायन का मूल सिद्धांत बहुत बड़ी संख्या में यौगिकों के प्रयोगशालाओ को तैयार करना है और फिर प्रयोगशालाओ के उपयोगी घटकों की पहचान करना है।
हालांकि 1990 के दशक के बाद से उद्योग द्वारा संयुक्त रसायन विज्ञान को वास्तव में स्वीकृत किया गया है,[4] इसके कारण 1960 के दशक में देखी जा सकती हैं जब रॉकफेलर विश्वविद्यालय के एक शोधकर्ता ब्रूस मेरिफिल्ड ने पेप्टाइड्स के ठोस-अवस्था संश्लेषण की जांच प्रारंभ की थी।
अपने आधुनिक रूप में, संचयविन्यास रसायन शास्त्र का संभवतः औषधि उद्योग में इसका सबसे बड़ा प्रभाव पड़ा है।[5] एक यौगिक की गतिविधि प्रोफ़ाइल को अनुकूलित करने का प्रयास करने वाले शोधकर्ता कई अलग-अलग लेकिन संबंधित यौगिकों का 'रासायनिक प्रयोगशाला' बनाते हैं।[6][7] रोबोटिक्स में हुई प्रगति ने संयोजी संश्लेषण के लिए एक औद्योगिक दृष्टिकोण का नेतृत्व किया है, जिससे कंपनियां नियमित रूप से प्रति वर्ष 100,000 से अधिक नए और अद्वितीय यौगिकों का उत्पादन कर पाती हैं।[8]
बड़ी संख्या में संरचनात्मक संभावनाओं को नियंत्रण करने के लिए, शोधकर्ता प्रायः एक ' आभासी प्रयोगशाला' बनाते हैं, सभी उपलब्ध अभिकारक के साथ दिए गए फार्माकोफोर (भेषजगुण) की सभी संभावित संरचनाओं की एक संगणनात्मक गणना है।[9] इस तरह के प्रयोगशाला में हजारों से लाखों 'आभासी' यौगिक सम्मिलित हो सकते हैं। शोधकर्ता विभिन्न गणनाओं और मानदंडों के आधार पर वास्तविक संश्लेषण के लिए 'आभासी प्रयोगशाला' के (एडीएमई, संगणनात्मक रसायन विज्ञान और परिमाणात्मक संरचना-गतिविधि संबंध देखें) एक उपसमुच्चय का चयन करेगा।
बहुलक (पेप्टाइड्स और ऑलिगोन्यूक्लियोटाइड्स)
संयोजी विभाजन-मिश्रण (विभाजन और निकाय) संश्लेषण
संयोजी विभाजन-मिश्रण (विभाजन और निकाय) संश्लेषण [10][11] रॉबर्ट ब्रूस मेरिफिल्ड द्वारा विकसित ठोस-चरण संश्लेषण पर आधारित है।[12] यदि 20 एमिनो अम्ल (या अन्य प्रकार के मूलभूत अंग) का उपयोग करके एक संयोजी पेप्टाइड प्रयोगशाला को संश्लेषित किया जाता है, तो गोले के रूप ठोस सहायक को 20 बराबर भागों में विभाजित किया जाता है। इसके बाद प्रत्येक भाग में एक अलग अमीनो अम्ल का युग्मन होता है। तीसरा चरण सभी भागों का मिश्रण है। इन तीन चरणों में एक चक्र सम्मिलित है। चक्र के चरणों को दोहराकर पेप्टाइड श्रृंखलाओं को बढ़ाया जा सकता है।
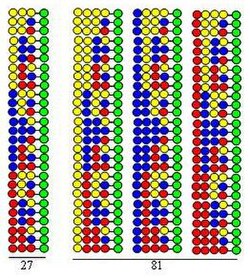
प्रक्रिया को दोनों चक्रों में निर्माण खंड के रूप में समान तीन अमीनो अम्ल का उपयोग करके डाइपेप्टाइड प्रयोगशाला के संश्लेषण द्वारा चित्रित किया गया है। इस प्रयोगशाला के प्रत्येक घटक में अलग-अलग क्रम में व्यवस्थित दो अमीनो अम्ल होते हैं। युग्मन में उपयोग किए जाने वाले अमीनो अम्ल को आकृति में पीले, नीले और लाल वृत्त द्वारा दर्शाया गया है। विभिन्न तीर ठोस समर्थन रेजिन (हरे वृत्त) को समान भागों में विभाजित करते हुए दिखाते हैं, ऊर्ध्वाधर तीरों का अर्थ है युग्मन और अभिसरण तीर समर्थन के भागों को मिलाने और समरूप बनाने का प्रतिनिधित्व करते हैं।
चित्र से पता चलता है कि दो संश्लिष्ट चक्रों में 9 डाईपेप्टाइड बनते हैं। तीसरे और चौथे चक्र में क्रमशः 27 ट्राइपेप्टाइड और 81 टेट्रापेप्टाइड बनेंगे।
"विभाजन-मिश्रण संश्लेषण" में कई उत्कृष्ट विशेषताएं हैं:
- यह अत्यधिक दक्ष है। जैसा कि चित्र प्रदर्शित करता है कि संश्लेषित प्रक्रिया (3, 9, 27, 81) में बनने वाले पेप्टाइड्स की संख्या निष्पादित चक्रों की संख्या के साथ तेजी से बढ़ती है। प्रत्येक संश्लेषित चक्र में 20 अमीनो अम्ल का उपयोग करके गठित पेप्टाइड्स की संख्या क्रमशः 400, 8,000, 160,000 और 3,200,000 है। इसका तात्पर्य यह है कि निष्पादित चक्रों की संख्या के साथ पेप्टाइड्स की संख्या तेजी से बढ़ती है।
- सभी पेप्टाइड अनुक्रम इस प्रक्रिया में बनते हैं जो चक्रों में प्रयुक्त अमीनो अम्ल के संयोजन से निकाले जा सकते हैं।
- समर्थन को समान नमूनों में विभाजित करना प्रयोगशाला के घटकों को लगभग समान मोलीय मात्रा में निर्माण सुनिश्चित होता है।
- समर्थन के प्रत्येक गोले पर केवल समान पेप्टाइड बनता है। यह युग्मन चरणों में केवल एक अमीनो अम्ल का उपयोग करने का परिणाम है। हालांकि, यह पूरी तरह से अज्ञात है कि पेप्टाइड कौन सा है जो एक चयनित गोले पर प्रग्रहण कर लेता है।
- विभाजन-मिश्रण पद्धति का उपयोग कार्बनिक या किसी अन्य प्रकार के प्रयोगशाला के संश्लेषण के लिए किया जा सकता है जिसे चरणबद्ध प्रक्रिया में इसके निर्माण खंड से तैयार किया जा सकता है।
1990 में तीन समूहों ने जैविक विधियों द्वारा और एक साल बाद फोडोर एट अल द्वारा पेप्टाइड [13][14][15] प्रयोगशालाओ को तैयार करने के तरीकों का वर्णन किया। छोटे कांच की स्लाइड्स पर पेप्टाइड सरणियों के संश्लेषण के लिए एक उल्लेखनीय विधि प्रकाशित की।[16] पेप्टाइड सरणियों की तैयारी के लिए मारियो गेसेन और उनके सहयोगियों द्वारा एक समानांतर संश्लेषण विधि विकसित की गई थी।[17] उन्होंने ठोस समर्थन के साथ अपने सिरों पर लेपित प्लास्टिक की छड़ (पिन) पर 96 पेप्टाइड्स को संश्लेषित किया। पिनों को एक सूक्ष्मदर्शी प्लेट मे अच्छी तरह रखे अभिकर्मकों के विलयन में निमज्जित किया गया। विधि विशेष रूप से स्वचालित समांतर संश्लेषक का उपयोग करके व्यापक रूप से प्रयुक्त होती है। यद्यपि समानांतर विधि वास्तविक दहनशील विधि की तुलना में बहुत मंद है, इसका लाभ यह है कि यह सही से ज्ञात है कि प्रत्येक पिन पर कौन सा पेप्टाइड या अन्य यौगिक बनता है।
विभाजन-मिश्रण और समान संश्लेषण दोनों के लाभों को मिलाने के लिए आगे की प्रक्रियाएँ विकसित की गईं। दो समूहों द्वारा वर्णित विधि में[18][19] ठोस समर्थन को पारगम्य प्लास्टिक झिल्ली में एक रेडियो-आवृत्ति टैग के साथ संलग्न किया गया था जो झिल्ली में बनने वाले यौगिक के कोड को ले गया था। प्रक्रिया विभाजन-मिश्रण विधि के समान की गई थी। विभाजित चरण में, हालांकि, झिल्ली के रेडियो-आवृत्ति टैग से पढ़े गए कोड के अनुसार प्रतिक्रिया वाहिकाओं के बीच झिल्ली वितरित किए गए थे।
फुरका एट अल द्वारा इसी उद्देश्य के लिए एक अलग विधि विकसित की गई थी।[20] स्ट्रिंग संश्लेषण कहा जाता है। इस पद्धति में, झिल्ली में कोई कोड नहीं होता है। वे एक हार में मोतियों की तरह पिरोए जाते हैं और दृढ़ रूप में प्रतिक्रिया वाहिकाओं में रखे जाते हैं। झिल्ली की पहचान, साथ ही साथ उनके पदार्थ, स्ट्रिंग्स पर व्याप्त उनकी स्थिति द्वारा संग्रहीत की जाती है। युग्मन के प्रत्येक चरण के बाद, निश्चित नियमों के अनुसार नए तारों के बीच झिल्ली का पुनर्वितरण किया जाता है।
छोटे अणु
औषधि खोज प्रक्रिया में, रुचि के छोटे अणुओं का संश्लेषण और जैविक मूल्यांकन आमतौर पर एक लंबी और श्रमसाध्य प्रक्रिया रही है। संचयविन्यास रसायन विज्ञान हाल के दशकों में बड़ी संख्या में क्षमता को जल्दी और कुशलता से संश्लेषित करने के दृष्टिकोण के रूप में उभरा है छोटे अणु औषधि पदाभिलाषी। एक विशिष्ट संश्लेषण में, एक संश्लेषित योजना के अंत में केवल एक लक्ष्य अणु का उत्पादन होता है, संश्लेषण में प्रत्येक चरण में केवल समान उत्पाद का उत्पादन होता है। संयोजी संश्लेषण में, केवल एक प्रारंभिक पदार्थ का उपयोग करते समय, समान प्रतिक्रिया स्थितियों का उपयोग करके अणुओं के एक बड़े प्रयोगशाला को संश्लेषित करना संभव है, जिसे तब उनकी जैविक गतिविधि के लिए जांचा जा सकता है। उत्पादों के इस निकाय को फिर तीन समान भागों में विभाजित किया जाता है जिसमें तीन उत्पादों में से प्रत्येक होता है, और फिर तीन अलग-अलग पूलों में से प्रत्येक को अभिकर्मक बी, सी, या डी की एक और इकाई के साथ प्रतिक्रिया दी जाती है, जो पिछले 3 से 9 अद्वितीय यौगिकों का उत्पादन करती है। इस प्रक्रिया को तब तक दोहराया जाता है जब तक कि निर्माण खंड की वांछित संख्या नहीं जुड़ जाती है, जिससे कई यौगिक बनते हैं। एक बहु-चरण संश्लेषण द्वारा यौगिकों के एक प्रयोगशाला को संश्लेषित करते समय, कुशल प्रतिक्रिया विधियों को नियोजित किया जाना चाहिए, और यदि प्रत्येक प्रतिक्रिया चरण के बाद पारंपरिक शुद्धिकरण विधियों का उपयोग किया जाता है, तो पैदावार और दक्षता प्रभावित होगी।
ठोस-चरण संश्लेषण विशिष्ट शमन और शुद्धिकरण चरणों की आवश्यकता को कम करने के लिए संभावित समाधान प्रदान करता है जो प्रायः संश्लेषित रसायन विज्ञान में उपयोग किया जाता है। सामान्य तौर पर, एक प्रारंभिक अणु एक ठोस समर्थन (आमतौर पर एक अघुलनशील बहुलक) का पालन करता है, फिर अतिरिक्त प्रतिक्रियाएं की जाती हैं, और अंतिम उत्पाद को शुद्ध किया जाता है और फिर ठोस समर्थन से साफ किया जाता है। चूंकि ब्याज के अणु एक ठोस समर्थन से जुड़े होते हैं, इसलिए प्रत्येक प्रतिक्रिया के बाद शुद्धिकरण को कम करना संभव होता है, जिससे थकाऊ तरल-तरल निष्कर्षण और सॉल्वेंट वाष्पीकरण चरणों की आवश्यकता समाप्त हो जाती है, जिसमें अधिकांश संश्लेषित रसायन सम्मिलित होते हैं। इसके अलावा, विषम अभिकारकों का उपयोग करके, अतिरिक्त अभिकर्मकों का उपयोग सुस्त प्रतिक्रियाओं को पूरा करने के लिए किया जा सकता है, जिससे पैदावार में और सुधार हो सकता है। क्रोमैटोग्राफी जैसे अतिरिक्त शुद्धिकरण चरणों की आवश्यकता के बिना अतिरिक्त अभिकर्मकों को आसानी से धोया जा सकता है। फ़ाइल: एक ठोस-समर्थित पॉलीमाइन का उपयोग जिसका उपयोग अतिरिक्त अभिकर्मक को साफ़ करने के लिए किया जाता है। tif|thumb| अतिरिक्त अभिकर्मक को साफ़ करने के लिए एक ठोस-समर्थित पॉलीमाइन का उपयोग इन वर्षों में, संयोजी रसायन विज्ञान में ठोस-चरण कार्बनिक संश्लेषण के उपयोग को परिष्कृत करने के लिए विभिन्न प्रकार के तरीकों का विकास किया गया है, जिसमें संश्लेषण और शुद्धिकरण की आसानी बढ़ाने के प्रयासों के साथ-साथ मध्यवर्ती उत्पादों को चिह्नित करने के लिए गैर-पारंपरिक तरीके भी सम्मिलित हैं। यद्यपि यहाँ वर्णित अधिकांश उदाहरण प्रत्येक प्रतिक्रिया चरण में विषम प्रतिक्रिया मीडिया को नियोजित करेंगे, बूथ और हॉजेस केवल पारंपरिक समाधान-चरण संश्लेषण के शुद्धिकरण चरण के दौरान ठोस-समर्थित अभिकर्मकों का उपयोग करने का एक प्रारंभिक उदाहरण प्रदान करते हैं।[21] उनके विचार में, सॉल्यूशन-फेज रसायन रेजिन से अणुओं को जोड़ने और निकालने के लिए जरूरी अटैचमेंट और क्लीवेज रिएक्शन से बचने के साथ-साथ स्थापित सॉल्यूशन-फेज रिएक्शन के सॉलिड-फेज एनालॉग्स को फिर से बनाने की जरूरत को खत्म करने का फायदा देती है।
एक संश्लेषण के अंत में एकल शुद्धिकरण कदम एक या अधिक अशुद्धियों को हटाने की स्वीकृति देता है, यह मानते हुए कि आपत्तिजनक अशुद्धता की रासायनिक संरचना ज्ञात है। जबकि ठोस-समर्थित अभिकर्मकों का उपयोग यौगिकों के संश्लेषण को बहुत सरल करता है, कई दहनशील संश्लेषणों को कई चरणों की आवश्यकता होती है, जिनमें से प्रत्येक को अभी भी शुद्धिकरण के कुछ रूपों की आवश्यकता होती है। आर्मस्ट्रांग, एट अल। बहु-घटक संघनन (MCCs) कहे जाने वाले संयोजी प्रयोगशालाओ को उत्पन्न करने के लिए एक-पॉट विधि का वर्णन करें।[22] इस योजना में, तीन या अधिक अभिकर्मक इस तरह से प्रतिक्रिया करते हैं कि प्रत्येक अभिकर्मक को समान चरण में अंतिम उत्पाद में सम्मिलित किया जाता है, जिससे बहु-चरण संश्लेषण की आवश्यकता समाप्त हो जाती है जिसमें कई शुद्धिकरण चरण सम्मिलित होते हैं। MCCs में, यह निर्धारित करने के लिए कोई विसंक्रमण आवश्यक नहीं है कि कौन से यौगिक जैविक रूप से सक्रिय हैं क्योंकि सरणी में प्रत्येक संश्लेषण में केवल समान उत्पाद होता है, इस प्रकार यौगिक की पहचान स्पष्ट रूप से ज्ञात होनी चाहिए। फ़ाइल: एक ठोस-चरण समर्थित डाई का उदाहरण लिगैंड बाइंडिंग का संकेत देता है। tif|thumb|लिगैंड बाइंडिंग को सिग्नल करने के लिए एक ठोस-चरण समर्थित डाई का उदाहरण एक अन्य ऐरे संश्लेषण में, स्प्लिट संश्लेषण द्वारा ओलिगोपेप्टाइड का एक बड़ा प्रयोगशाला फिर भी उत्पन्न हुआ।[23] हजारों यौगिकों को बनाने का दोष यह है कि गठित यौगिकों की संरचना का निर्धारण करना कठिन होता है। उनका समाधान आणविक टैग का उपयोग करना है, जहां एक डाई की एक छोटी राशि (1 pmol/) गोले से जुड़ी होती है, और एक निश्चित गोले की पहचान यह विश्लेषण करके निर्धारित की जा सकती है कि गोले पर कौन से टैग मौजूद हैं। टैग संलग्न करने से रिसेप्टर्स की पहचान कितनी आसान हो जाती है, इसके बावजूद प्रत्येक कंपाउंड को उसकी रिसेप्टर बाइंडिंग क्षमता के लिए व्यक्तिगत रूप से स्क्रीन करना काफी असंभव होगा, इसलिए प्रत्येक रिसेप्टर से एक डाई जुड़ी हुई थी, जैसे कि केवल वे रिसेप्टर्स जो अपने सब्सट्रेट से बंधते हैं, एक रंग परिवर्तन उत्पन्न करते हैं।
जब कई प्रतिक्रियाओं को एक सरणी में चलाने की आवश्यकता होती है (जैसे आर्मस्ट्रांग के एमसीसी सरणी में वर्णित 96 प्रतिक्रियाएं), दक्षता में सुधार के लिए संश्लेषण के कुछ अधिक कठिन पहलुओं को स्वचालित किया जा सकता है। डेविट और जारनिक डाइवर्सोमर विधि नामक एक विधि का विवरण देते हैं, जिसमें रासायनिक प्रतिक्रियाओं के कई लघु संस्करण एक साथ चलते हैं।[24] यह विधि एक ऐसे उपकरण का उपयोग करती है जो राल लोडिंग और वॉश चक्रों के साथ-साथ प्रतिक्रिया चक्र की निगरानी और शुद्धिकरण को स्वचालित करती है, और विभिन्न प्रकार के अणु वर्गों, जैसे कि hydantoins और एन्ज़ोदिअज़ेपिनेस को संश्लेषित करने के लिए इसका उपयोग करके उनकी विधि और उपकरण की व्यवहार्यता प्रदर्शित करती है। ज्यादातर मामलों में 40 व्यक्तिगत प्रतिक्रियाएं चल रही हैं।
प्रायः, महंगे उपकरण का उपयोग करना संभव नहीं होता है, और श्वाबैकर, एट अल। प्रयोगशाला सदस्यों के समांतर संश्लेषण और यौगिकों के पूरे प्रयोगशालाओ के मूल्यांकन के संयोजन की एक सरल विधि का वर्णन करें।[25] उनकी पद्धति में, एक धागा जिसे अलग-अलग क्षेत्रों में विभाजित किया जाता है, एक सिलेंडर के चारों ओर लपेटा जाता है, जहां एक अलग अभिकर्मक को प्रत्येक क्षेत्र में जोड़ा जाता है जो केवल समान प्रजाति को धारण करता है। धागे को फिर से विभाजित किया जाता है और एक अलग आकार के सिलेंडर के चारों ओर लपेटा जाता है, और फिर इस प्रक्रिया को दोहराया जाता है। इस पद्धति की सुंदरता यह है कि प्रत्येक उत्पाद की पहचान केवल धागे के साथ उसके स्थान से जानी जा सकती है, और संबंधित जैविक गतिविधि की पहचान प्रतिदीप्ति संकेतों के फूरियर रूपांतरण द्वारा की जाती है। फ़ाइल: Ellman.tif|thumb द्वारा बताए अनुसार एक ट्रेसलेस लिंकर का उपयोग करना यहां वर्णित अधिकांश संश्लेषणों में, प्रारंभिक अभिकर्मक को ठोस समर्थन से/से जोड़ना और निकालना आवश्यक है। यह एक हाइड्रॉक्सिल समूह की पीढ़ी को जन्म दे सकता है, जो लक्ष्य परिसर की जैविक गतिविधि को संभावित रूप से प्रभावित कर सकता है। एल्मैन 192 व्यक्तिगत 1,4-बेंजोडायजेपाइन डेरिवेटिव प्राप्त करने के लिए एक बहु-चरण संश्लेषण योजना में ठोस चरण का उपयोग करता है, जो प्रसिद्ध चिकित्सीय एजेंट हैं।[26] संभावित हाइड्रॉक्सिल समूह के हस्तक्षेप की संभावना को खत्म करने के लिए, अणुओं को ठोस समर्थन से जोड़ने के लिए सिलिल-एरिल रसायन शास्त्र का उपयोग करने वाली एक उपन्यास विधि का उपयोग किया जाता है जो समर्थन से अलग हो जाता है और लिंकर का कोई निशान नहीं छोड़ता है। फ़ाइल: उत्पाद जिन्हें imines.tif|thumb|कंपाउंड्स से संश्लेषित किया जा सकता है जिन्हें सॉलिड-फेज़ बाउंड इमाइन्स से संश्लेषित किया जा सकता है एक अणु को एक ठोस समर्थन के लिए एंकरिंग करते समय, मध्यवर्ती को राल से अणु को अलग किए बिना एक दूसरे से अलग नहीं किया जा सकता है। चूँकि प्रतिक्रिया की प्रगति को ट्रैक करने और उत्पाद संरचना की पुष्टि करने के लिए उपयोग की जाने वाली कई पारंपरिक लक्षण वर्णन तकनीकें समाधान-आधारित हैं, विभिन्न तकनीकों का उपयोग करना चाहिए। जेल-चरण 13 सी एनएमआर स्पेक्ट्रोस्कोपी, मालडी मास स्पेक्ट्रोमेट्री, और आईआर स्पेक्ट्रोस्कोपी का उपयोग संरचना की पुष्टि करने और ठोस-चरण प्रतिक्रियाओं की प्रगति की निगरानी के लिए किया गया है।[27] गॉर्डन एट अल।, कई केस स्टडीज का वर्णन करते हैं जो छोटे अणुओं के दहनशील प्रयोगशालाओ को उत्पन्न करने के लिए इमाइन और पेप्टिडिल फॉस्फोनेट्स का उपयोग करते हैं।[27]इमाइन प्रयोगशाला उत्पन्न करने के लिए, एक राल से जुड़े एक एमिनो अम्ल को एल्डिहाइड की उपस्थिति में प्रतिक्रिया दी जाती है। लेखकों ने प्रतिक्रियाओं की प्रगति की निगरानी के लिए तेजी से 13 सी जेल चरण एनएमआर स्पेक्ट्रोस्कोपी और जादू कोण कताई 1 एच एनएमआर स्पेक्ट्रोस्कोपी का उपयोग प्रदर्शित किया और दिखाया कि ट्राइमेथिल ऑर्थोफोर्मेट के रूप में उपयोग किए जाने पर कमरे के तापमान पर 10 मिनट के रूप में कम से कम इमाइन बन सकते हैं। विलायक। गठित इमीन्स को तब 4-थियाजोलिडिनोन्स, बी-लैक्टम्स और पायरोलिडाइन्स उत्पन्न करने के लिए व्युत्पन्न किया गया था।
ठोस-चरण समर्थन का उपयोग यौगिकों के बड़े संयोजी प्रयोगशालाओ के संश्लेषण को बहुत सरल करता है। यह एक प्रारंभिक पदार्थ को एक ठोस समर्थन के लिए एंकरिंग करके किया जाता है और फिर पर्याप्त रूप से बड़े प्रयोगशाला के निर्माण तक बाद की प्रतिक्रियाओं को चलाता है, जिसके बाद उत्पादों को समर्थन से अलग किया जाता है। मानक तरल-तरल निष्कर्षण शोधन तकनीकों के संयोजन में समाधान-चरण संश्लेषण योजनाओं में उपयोग के लिए ठोस-चरण शुद्धि का उपयोग भी प्रदर्शित किया गया है।
डीकनवोल्यूशन और अनुवीक्षण
संयोजी प्रयोगशाला
संयोजी प्रयोगशाला छोटे-अणु रासायनिक यौगिकों के विशेष बहु-घटक मिश्रण हैं जो एकल चरणबद्ध प्रक्रिया में संश्लेषित होते हैं। वे व्यक्तिगत यौगिकों के संग्रह के साथ-साथ समानांतर संश्लेषण द्वारा तैयार यौगिकों की श्रृंखला से भिन्न होते हैं। यह एक महत्वपूर्ण विशेषता है कि उनके संश्लेषण में मिश्रण का उपयोग किया जाता है। मिश्रण का उपयोग प्रक्रिया की उच्च दक्षता सुनिश्चित करता है। दोनों अभिकारक मिश्रण हो सकते हैं और इस मामले में प्रक्रिया और भी अधिक कुशल होगी। हालांकि व्यावहारिक कारणों से, विभाजन-मिश्रण विधि का उपयोग करने की सलाह दी जाती है जिसमें दो मिश्रणों में से एक को सिंगल निर्माण खंड (BBs) से बदल दिया जाता है। मिश्रण इतने महत्वपूर्ण हैं कि संश्लेषण में मिश्रण का उपयोग किए बिना कोई संयोजन प्रयोगशाला नहीं हैं, और यदि प्रक्रिया में मिश्रण का उपयोग अनिवार्य रूप से संयोजन प्रयोगशाला रूपों में किया जाता है। विभाजन-मिश्रण संश्लेषण आमतौर पर ठोस समर्थन का उपयोग करके महसूस किया जाता है लेकिन इसे समाधान में भी प्रयुक्त करना संभव है। चूंकि वह संरचना करता है, घटक अज्ञात हैं, छानने में deconvolution विधियों का उपयोग करने की आवश्यकता है। संयोजी प्रयोगशालाओ की सबसे महत्वपूर्ण विशेषताओं में से एक यह है कि पूरे मिश्रण को समान प्रक्रिया में प्रदर्शित किया जा सकता है। यह इन प्रयोगशालाओ को फार्मास्युटिकल अनुसंधान में बहुत उपयोगी बनाता है। पूर्ण संयोजी प्रयोगशालाओ के आंशिक प्रयोगशालाओ को भी संश्लेषित किया जा सकता है। उनमें से कुछ का उपयोग deconvolution में किया जा सकता है[28]
=== ठोस समर्थन === से विखंडित प्रयोगशालाओ का विखंडन
यदि संयोजी प्रयोगशाला के संश्लेषित अणुओं को ठोस आधार से अलग किया जाता है तो एक घुलनशील मिश्रण बनता है। इस तरह के समाधान में लाखों अलग-अलग यौगिक मिल सकते हैं। जब यह संश्लेषित विधि विकसित की गई थी, तो पहली बार अणुओं की पहचान करना और उपयोगी गुणों वाले अणुओं को खोजना असंभव लग रहा था। हालाँकि, समस्या को हल करने के लिए उपयोगी घटकों की पहचान के लिए रणनीतियाँ विकसित की गई थीं। ये सभी रणनीतियाँ आंशिक प्रयोगशालाओ के संश्लेषण और परीक्षण पर आधारित हैं। 1982 में नोटरीकृत फुरका के उपर्युक्त दस्तावेज़ में जल्द से जल्द पुनरावृत्त रणनीति का वर्णन किया गया है।[2]विधि को बाद में एर्ब एट अल द्वारा स्वतंत्र रूप से प्रकाशित किया गया था। पुनरावर्ती deconvolution के नाम से[29]
पुनरावर्ती deconvolution
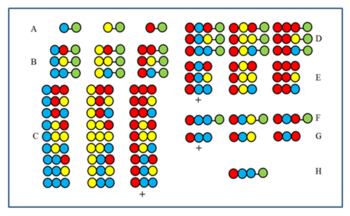
विधि को चित्र द्वारा समझा जा सकता है। 27 सदस्यीय पेप्टाइड प्रयोगशाला को तीन अमीनो अम्ल से संश्लेषित किया जाता है। पहले (ए) और दूसरे (बी) चक्रों के बाद उन्हें मिलाने से पहले नमूने अलग रखे गए थे। तीसरे चक्र (C) के उत्पादों को मिलाने से पहले तोड़ा जाता है फिर गतिविधि के लिए परीक्षण किया जाता है। मान लीजिए कि + चिन्ह द्वारा लेबल किया गया समूह सक्रिय है। अंतिम युग्मन स्थिति (CP) पर सभी सदस्यों के पास लाल अमीनो अम्ल होता है। नतीजतन, सक्रिय सदस्य के पास अंतिम सीपी में लाल अमीनो अम्ल भी होता है। फिर लाल अमीनो अम्ल को नमूने डी प्राप्त करने के लिए दूसरे चक्र (बी) के बाद अलग रखे गए तीन नमूनों से जोड़ा जाता है। क्लीविंग के बाद, तीन ई नमूने बनते हैं। यदि परीक्षण के बाद + द्वारा चिह्नित नमूना सक्रिय है तो यह दर्शाता है कि नीला अमीनो अम्ल सक्रिय घटक में दूसरे सीपी पर प्रग्रहण कर लेता है। फिर तीन A नमूनों में पहले नीला फिर लाल अमीनो अम्ल युग्मित (F) होता है, फिर क्लीविंग (G) के बाद फिर से परीक्षण किया जाता है। यदि + घटक सक्रिय साबित होता है, तो सक्रिय घटक का क्रम निर्धारित किया जाता है और एच में दिखाया जाता है।
स्थितीय स्कैनिंग
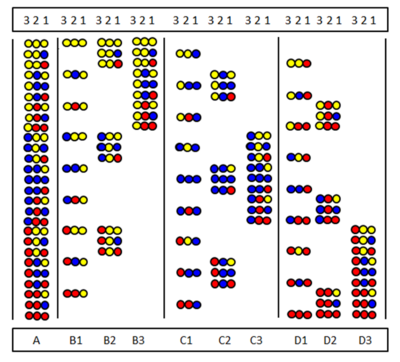
फुरका एट अल द्वारा स्वतंत्र रूप से स्थितीय स्कैनिंग की शुरुआत की गई थी।[30] और पिनिला एट अल।[31] विधि उपपुस्तकालयों की श्रृंखला के संश्लेषण और परीक्षण पर आधारित है। जिसमें समान अमीनो अम्ल एक निश्चित अनुक्रम स्थिति पर प्रग्रहण कर लेता है। यह चित्र तीन अमीनो अम्ल से बने पूर्ण पेप्टाइड ट्रिमर प्रयोगशाला (ए) के नौ सबलाइब्रेरी (बी1-डी3) को दर्शाता है। उप-प्रयोगशालाओ में एक स्थिति होती है जो सभी घटकों में समान अमीनो अम्ल द्वारा प्रग्रहण कर ली जाती है। एक उपपुस्तकालय के संश्लेषण में समर्थन विभाजित नहीं होता है और पूरे नमूने में केवल एक एमिनो अम्ल जोड़ा जाता है। नतीजतन, एक स्थिति वास्तव में सभी घटकों में समान अमीनो अम्ल द्वारा प्रग्रहण कर ली जाती है। उदाहरण के लिए, बी2 सबलाइब्रेरी पोजीशन 2 में सभी नौ घटकों में पीले अमीनो अम्ल का प्रग्रहण है। यदि अनुवीक्षण टेस्ट में यह सबलाइब्रेरी सकारात्मक उत्तर देती है तो इसका तात्पर्य है कि सक्रिय पेप्टाइड में स्थिति 2 भी पीले अमीनो अम्ल द्वारा प्रग्रहण कर लिया गया है। सभी नौ (या कभी-कभी कम) उप-प्रयोगशालाओ का परीक्षण करके अमीनो अम्ल अनुक्रम निर्धारित किया जा सकता है।
चूक प्रयोगशाला
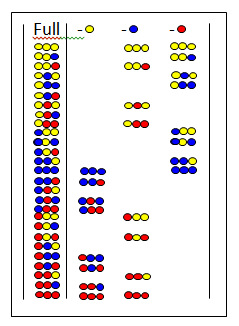
चूक प्रयोगशालाओ में[32][33] मिश्रण के सभी पेप्टाइड्स से एक निश्चित अमीनो अम्ल गायब है। यह चित्र पूर्ण प्रयोगशाला और तीन चूक प्रयोगशालाओ को दर्शाता है। शीर्ष पर छोड़े गए अमीनो अम्ल दिखाए जाते हैं। यदि चूक प्रयोगशाला एक नकारात्मक परीक्षण देता है तो सक्रिय घटक में छोड़ा गया अमीनो अम्ल मौजूद होता है।
बंधे हुए संयोजी प्रयोगशालाओ का विखंडन
यदि पेप्टाइड्स को ठोस समर्थन से अलग नहीं किया जाता है तो हम मोतियों के मिश्रण से निपटते हैं, प्रत्येक गोले में एक पेप्टाइड होता है। स्मिथ और उनके सहयोगी[34] ने पहले दिखाया था कि पेप्टाइड्स का परीक्षण टीथर के रूप में भी किया जा सकता है। इस दृष्टिकोण का उपयोग पेप्टाइड प्रयोगशालाओ की अनुवीक्षण में भी किया गया था। टेथर्ड पेप्टाइड प्रयोगशाला को भंग लक्ष्य प्रोटीन के साथ परीक्षण किया गया था। जिन मोतियों से प्रोटीन जुड़ा हुआ था, उन्हें निकाल लिया गया, मनके से प्रोटीन को हटा दिया गया, फिर अनुक्रमण द्वारा टेथर्ड पेप्टाइड की पहचान की गई। टेलर और मोर्केन ने कुछ अलग दृष्टिकोण स्वीकृत किया।[35] उन्होंने गैर-पेप्टाइड टेथर्ड प्रयोगशालाओ में उत्प्रेरक की पहचान करने के लिए इन्फ्रारेड थर्मोग्राफी का इस्तेमाल किया। विधि उस गर्मी पर आधारित होती है जो मोतियों में विकसित होती है जिसमें उत्प्रेरक होता है जब टिथर्ड प्रयोगशाला को सब्सट्रेट के समाधान में डुबोया जाता है। जब एक इन्फ्रारेड माइक्रोस्कोप के माध्यम से मोतियों की जांच की जाती है तो गोले युक्त उत्प्रेरक चमकीले धब्बों के रूप में दिखाई देते हैं और उन्हें बाहर निकाला जा सकता है।
एन्कोडेड संयोजी प्रयोगशाला
यदि हम एक गैर-पेप्टाइड कार्बनिक प्रयोगशाला प्रयोगशाला के साथ व्यवहार करते हैं, तो गोले की पदार्थ की पहचान निर्धारित करना उतना आसान नहीं है जितना कि पेप्टाइड के मामले में। इस कठिनाई को दरकिनार करने के लिए, प्रयोगशाला के संश्लेषण के साथ-साथ मोतियों को संलग्न करने के तरीकों को विकसित किया गया था, अणु जो गोले में बने यौगिक की संरचना को कूटबद्ध करते हैं। ओह्लमेयर और उनके सहयोगियों ने एक बाइनरी एन्कोडिंग विधि प्रकाशित की[36] उन्होंने 18 टैगिंग अणुओं के मिश्रण का इस्तेमाल किया, जो उन्हें मोतियों से अलग करने के बाद इलेक्ट्रॉन कैप्चर गैस क्रोमैटोग्राफी द्वारा पहचाना जा सकता था। सरकार एट अल। वर्णित पेंटेनोइक एमाइड्स (COPAs) के चिरल ओलिगोमर्स जिनका उपयोग बड़े पैमाने पर एन्कोडेड OBOC प्रयोगशालाओ के निर्माण के लिए किया जा सकता है।[37] केर एट अल। एक अभिनव एन्कोडिंग विधि पेश की[38] मोतियों से एक ऑर्थोगोनली संरक्षित रिमूवेबल बाइफंक्शनल लिंकर जुड़ा हुआ था। लिंकर के एक छोर का उपयोग प्रयोगशाला के गैर-प्राकृतिक भवन ब्लॉकों को संलग्न करने के लिए किया गया था, जबकि दूसरे छोर पर अमीनो अम्ल ट्रिपल को एन्कोडिंग से जोड़ा गया था। निर्माण खंड गैर-प्राकृतिक अमीनो अम्ल थे और उनके एन्कोडिंग अमीनो अम्ल ट्रिपल की श्रृंखला को एडमैन डिग्रेडेशन द्वारा निर्धारित किया जा सकता था। इस तरह के एन्कोडिंग का महत्वपूर्ण पहलू प्रयोगशाला के सदस्यों को उनके संलग्न एन्कोडिंग टैग के साथ मिलकर एक घुलनशील प्रयोगशाला बनाने की संभावना थी। निकोलाजेव एट अल द्वारा समान दृष्टिकोण का उपयोग किया गया था। पेप्टाइड्स के साथ एन्कोडिंग के लिए।[39] 1992 में ब्रेनर और लर्नर ने ठोस समर्थन के मोतियों को एनकोड करने के लिए डीएनए अनुक्रम पेश किया जो सबसे सफल एन्कोडिंग विधि साबित हुई।[40] नील्सन, ब्रेनर और जैंडा ने डीएनए एन्कोडिंग को प्रयुक्त करने के लिए केर दृष्टिकोण का भी इस्तेमाल किया[41] समय की नवीनतम अवधि में डीएनए अनुक्रमण में महत्वपूर्ण प्रगति हुई है। अगली पीढ़ी की तकनीक समानांतर में बड़ी संख्या में नमूनों को अनुक्रमित करना संभव बनाती है जो डीएनए एन्कोडेड प्रयोगशालाओ की अनुवीक्षण में बहुत महत्वपूर्ण है। एक और नवाचार था जिसने डीएनए एन्कोडिंग की सफलता में योगदान दिया। 2000 में हैल्पिन और हारबरी ने डीएनए एन्कोडेड संयोजी प्रयोगशाला के विभाजन-मिश्रण संश्लेषण में ठोस समर्थन को छोड़ दिया और इसे एन्कोडिंग डीएनए ओलिगोमर्स द्वारा बदल दिया। ठोस चरण विभाजन और निकाय संश्लेषण में प्रयोगशालाओ के घटकों की संख्या समर्थन के मोतियों की संख्या से अधिक नहीं हो सकती। लेखकों के उपन्यास दृष्टिकोण से, इस संयम को समाप्त कर दिया गया और व्यावहारिक रूप से असीमित संख्या में नए यौगिक तैयार करना संभव हो गया।[42] उदाहरण के लिए डेनिश कंपनी न्यूवोल्यूशन ने 40 ट्रिलियन युक्त डीएनए एन्कोडेड प्रयोगशाला को संश्लेषित किया! अवयव[43] डीएनए एन्कोडेड प्रयोगशाला घुलनशील हैं जो अनुवीक्षण में कुशल आत्मीयता बंधन को प्रयुक्त करना संभव बनाता है। कुछ लेखक डीएनए एन्कोडेड संयोजी प्रयोगशाला के एक्रोमिम के लिए डीईएल प्रयुक्त करते हैं, अन्य डीईसीएल का उपयोग कर रहे हैं। उत्तरार्द्ध बेहतर लगता है क्योंकि इस नाम में इन प्रयोगशालाओ की संयुक्त प्रकृति स्पष्ट रूप से व्यक्त की गई है। वर्तमान सहस्राब्दी के पहले दशक में कई प्रकार के डीएनए एन्कोडेड संयोजी प्रयोगशालाओ को पेश किया गया था और उनका वर्णन किया गया था। इन प्रयोगशालाओ को औषधि अनुसंधान में बहुत सफलतापूर्वक प्रयुक्त किया जाता है।
- गार्टनर एट अल द्वारा 2001 में वर्णित संयोजन प्रयोगशालाओ के डीएनए टेम्पलेटेड संश्लेषण।[44]
- 2004 में Mlecco et al द्वारा आविष्कार की गई दोहरी फ़ार्माकोफ़ोर डीएनए एन्कोडेड संयोजी प्रयोगशाला।[45]
- 2004 में हार्बरी हैल्पिन और हारबरी द्वारा प्रकाशित अनुक्रम एन्कोडेड रूटिंग।[46]
- एकल फ़ार्माकोफ़ोर डीएनए एन्कोडेड संयोजी प्रयोगशाला को 2008 में Manocci et al द्वारा पेश किया गया।[47]
- हैनसेन एट अल द्वारा प्रकाशित योक्टोलिटर-स्केल रिएक्टर का उपयोग करके गठित डीएनए एन्कोडेड संयोजी प्रयोगशाला। 2009 में[48]
पृष्ठ डीएनए-एन्कोडेड रासायनिक प्रयोगशाला में उनके संश्लेषण और अनुप्रयोग के बारे में विवरण पाए जाते हैं। डीएनए एन्कोडेड घुलनशील संयोजी प्रयोगशालाओ में कमियां भी हैं। सबसे पहले, ठोस समर्थन के उपयोग से मिलने वाला लाभ पूरी तरह से खो जाता है। इसके अलावा, डीएनए एन्कोडिंग श्रृंखलाओं का पॉलीओनिक चरित्र संश्लेषण में गैर-जलीय सॉल्वैंट्स की उपयोगिता को सीमित करता है। इस कारण से कई प्रयोगशालाएं डीईसीएल के संश्लेषण में उपयोग के लिए डीएनए संगत प्रतिक्रियाओं को विकसित करना चुनती हैं। उपलब्ध में से कुछ का पहले ही वर्णन किया जा चुका है[49][50][51]
पदार्थ विज्ञान
पदार्थ विज्ञान ने नई सामग्रियों की खोज के लिए संचयविन्यास रसायन विज्ञान की तकनीकों को प्रयुक्त किया है। इस कार्य का नेतृत्व पीटर जी. शुल्ज़ ने किया था|पी.जी. शुल्ज़ एट अल। नब्बे के दशक के मध्य में [52] सिलिकॉन सब्सट्रेट पर तत्वों के सह-निक्षेपण द्वारा प्राप्त ल्यूमिनेसेंट पदार्थ के संदर्भ में। उनका काम 1970 में जे. जे. हनक द्वारा किया गया था[53] लेकिन उस समय विधि के प्रसार के लिए कंप्यूटर और रोबोटिक्स उपकरण उपलब्ध नहीं थे। कई अकादमिक समूहों द्वारा काम जारी रखा गया है[54][55][56][57] साथ ही बड़े अनुसंधान और विकास कार्यक्रमों वाली कंपनियाँ (Symyx Technologies, General Electric, Dow Chemical आदि)। कटैलिसीस के लिए तकनीक का बड़े पैमाने पर उपयोग किया गया है,[58] कोटिंग्स,[59] इलेक्ट्रॉनिक्स,[60] और कई अन्य क्षेत्र।[61] उत्पादित डेटा की विशाल मात्रा को संभालने, प्रशासित करने और संग्रहीत करने के लिए उपयुक्त सूचना विज्ञान उपकरणों का अनुप्रयोग महत्वपूर्ण है।[62] बड़े प्रयोगात्मक स्थानों को कुशलतापूर्वक संबोधित करने के लिए प्रयोग विधियों के नए प्रकार के डिजाइन भी विकसित किए गए हैं जिन्हें संयोजन विधियों का उपयोग करके निपटाया जा सकता है।[63]
विविधता उन्मुख प्रयोगशाला
भले ही दो दशकों से भी अधिक समय से संयोजी रसायन प्रारंभिक औषधि की खोज का एक अनिवार्य भाग रहा है, लेकिन अब तक एफडीए द्वारा क्लिनिकल उपयोग के लिए केवल एक डे नोवो संयोजन रसायन-संश्लेषित रसायन को मंजूरी दी गई है (सरनब, उन्नत गुर्दे के कैंसर के लिए संकेतित एक मल्टीकाइनेज अवरोधक) .[64] संयोजी रसायन विज्ञान के उत्पादों द्वारा कवर किए गए बल्कि सीमित रासायनिक स्थान से जुड़ने के लिए दृष्टिकोण की खराब सफलता दर के विश्लेषण का सुझाव दिया गया है।[65] संयोजी रसायन शास्त्र प्रयोगशालाओ में यौगिकों के गुणों की तुलना स्वीकृत दवाओं और प्राकृतिक उत्पादों, फेहर और श्मिट से करते हैं[65] नोट किया गया कि संचयविन्यास रसायन शास्त्र प्रयोगशाला विशेष रूप से चिरायता (रसायन विज्ञान) की कमी के साथ-साथ संरचना की कठोरता से पीड़ित हैं, दोनों को व्यापक रूप से औषधि-जैसी गुणों के रूप में माना जाता है। भले ही हाल के दिनों में प्राकृतिक उत्पाद औषधि की खोज शायद फार्मास्युटिकल उद्योग में सबसे फैशनेबल प्रवृत्ति नहीं रही है,[citation needed] नई रासायनिक संस्थाओं का एक बड़ा भाग अभी भी प्रकृति-व्युत्पन्न यौगिक हैं,[66][67][68][69][70][71] और इस प्रकार, यह सुझाव दिया गया है कि अनुवीक्षण प्रयोगशालाओ की रासायनिक विविधता को बढ़ाकर संचयविन्यास रसायन विज्ञान की प्रभावशीलता में सुधार किया जा सकता है।[72] चिरायता और कठोरता के रूप में दो सबसे महत्वपूर्ण विशेषताएं हैं जो अनुमोदित दवाओं और प्राकृतिक उत्पादों को संचयविन्यास रसायन विज्ञान प्रयोगशालाओ में यौगिकों से अलग करती हैं, ये दो समस्याएं हैं जो तथाकथित विविधता उन्मुख प्रयोगशालाओ में जोर देते हैं, अर्थात यौगिक संग्रह जो कि रासायनिक स्थान के कवरेज का लक्ष्य रखते हैं, इसके बजाय बड़ी संख्या में यौगिकों की।[73][74][75][76][77][78]
पेटेंट वर्गीकरण उपवर्ग
अंतर्राष्ट्रीय पेटेंट वर्गीकरण (आईपीसी) के 8वें संस्करण में, जो 1 जनवरी, 2006 को प्रयुक्त हुआ, संयुक्त रसायन विज्ञान "C40B" के क्षेत्र में आविष्कारों से संबंधित पेटेंट अनुप्रयोगों और पेटेंट के लिए एक विशेष उपवर्ग बनाया गया है।
यह भी देखें
- संयोजन
- रासायनिक सूचना विज्ञान
- संयुक्त जीव विज्ञान
- औषधि का अन्वेषण
- गतिशील संयोजन रसायन
- उच्च परिणाम अनुवीक्षण
- गणितीय रसायन
- आणविक मॉडलिंग
संदर्भ
- ↑ Pottel, J.; Moitessier, N. (2017). "सिंथेटिक रूप से सुलभ, स्थानीय रासायनिक उप-स्थानों का अनुकूलन योग्य उत्पादन". J. Chem. Inf. Model. 57 (3): 454–467. doi:10.1021/acs.jcim.6b00648. PMID 28234470.
- ↑ 2.0 2.1 2.2 फुरका ए. Tanulmány, gyógyászatilag hasznosítható पेप्टाइडक szisztematikus felkutatásának lehetőségéről (और औषधीय रूप से उपयोगी पेप्टाइड्स के लिए व्यवस्थित खोज की संभावना पर अध्ययन https://mersz.hu/mod/object.php?objazonosito=matud202006_f42772_i2
- ↑ https://en.wikipedia.org/wiki/Combinatorial_chemistry#cite_note-3
- ↑ "COMBINATORIAL CHEMISTRY: A REVIEW". International Journal of Pharmaceutical Sciences and Research. 4 (7). July 2013. doi:10.13040/IJPSR.0975-8232.4(7).2502-16. Retrieved June 21, 2020.
- ↑ Lesney, Mark S. (2002). "Concocting combinatorials: Chemistry in drug development". Retrieved October 19, 2018.
- ↑ Dolle, Roland (2011). रासायनिक पुस्तकालय डिजाइन का ऐतिहासिक अवलोकन. in Zhou, J.Z. (ed.), Chemical Library Design, Methods in Molecular Biology, Springer, 2011, Chapter 1, pp. 3-25.
- ↑ Podlewska, S.; Czarnecki, W.M.; Kafel, R.; Bojarski, A.J. (2017). "Creating the New from the Old: Combinatorial Libraries Generation with Machine-Learning-Based Compound Structure Optimization". J. Chem. Inf. Modeling. 57 (2): 133–147. doi:10.1021/acs.jcim.6b00426. PMID 28158942.
- ↑ Jeffrey W. Noonan et al. "Advancing Parallel Solution Phase Library Synthesis through Efficient Purification, Quantitation, and Characterization Techniques" Journal of Laboratory Automation, 48 (1992) 3789.
- ↑ E. V.Gordeeva et al. "COMPASS program - an original semi-empirical approach to computer-assisted synthesis" Tetrahedron, 48 (1992) 3789.
- ↑ Furka Á, Sebestyén F, Asgedom M, Dibó G. Cornucopia of peptides by synthesis. In Highlights of Modern Biochemistry, Proceedings of the 14th International Congress of Biochemistry. VSP.Utrecht.1988; 5; p. 47.
- ↑ Á. Furka, F. Sebestyen, M. Asgedom, G. Dibo, General method for rapid synthesis of multicomponent peptide mixtures. Int. J. Peptide Protein Res., 1991, 37, 487-493.
- ↑ Merrifield RB, 1963 J. Am. Chem. Soc. 85, 2149.
- ↑ Scott, J.; Smith, G. (1990-07-27). "एक एपिटोप लाइब्रेरी के साथ पेप्टाइड लिगेंड की खोज". Science. American Association for the Advancement of Science (AAAS). 249 (4967): 386–390. Bibcode:1990Sci...249..386S. doi:10.1126/science.1696028. ISSN 0036-8075. PMID 1696028.
- ↑ Cwirla, S. E.; Peters, E. A.; Barrett, R. W.; Dower, W. J. (1990-08-01). "Peptides on phage: a vast library of peptides for identifying ligands". Proceedings of the National Academy of Sciences. 87 (16): 6378–6382. Bibcode:1990PNAS...87.6378C. doi:10.1073/pnas.87.16.6378. ISSN 0027-8424. PMC 54537. PMID 2201029.
- ↑ J. J. Devlin, L. C. Panganiban and P. E. Devlin Science 1990, 249, 404.
- ↑ Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D, 1991. Light-directed, spatially addressable parallel chemical synthesis. Science 251, 767-73.
- ↑ H. M. Geysen, R. H. Meloen, S. J. Barteling Proc. Natl. Acad. Sci. USA 1984, 81, 3998.
- ↑ E. J. Moran, S. Sarshar, J. F. Cargill, M. Shahbaz, A Lio, A. M. M. Mjalli, R. W. Armstrong J. Am. Chem. Soc. 1995, 117, 10787.
- ↑ K. C. Nicolaou, X –Y. Xiao, Z. Parandoosh, A. Senyei, M. P. Nova Angew. Chem. Int. Ed. Engl. 1995, 36, 2289.
- ↑ Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.
- ↑ Booth, R. John; Hodges, John C. (1999–2001). "मिश्रित संश्लेषण उत्पादों के तेजी से शुद्धिकरण के लिए ठोस-समर्थित अभिकर्मक रणनीतियाँ". Accounts of Chemical Research (in English). 32 (1): 18–26. doi:10.1021/ar970311n. ISSN 0001-4842.
- ↑ Armstrong, Robert W.; Combs, Andrew P.; Tempest, Paul A.; Brown, S. David; Keating, Thomas A. (1996–2001). "कॉम्बिनेटरियल लाइब्रेरी सिंथेसिस के लिए मल्टीपल-कंपोनेंट कंडेनसेशन स्ट्रैटेजीज". Accounts of Chemical Research (in English). 29 (3): 123–131. doi:10.1021/ar9502083. ISSN 0001-4842. S2CID 95815562.
- ↑ Still, W. Clark (1996–2001). "एन्कोडेड कॉम्बिनेटरियल लाइब्रेरी का उपयोग करके सिंथेटिक रिसेप्टर्स द्वारा अनुक्रम-चयनात्मक पेप्टाइड बाइंडिंग की खोज". Accounts of Chemical Research (in English). 29 (3): 155–163. doi:10.1021/ar950166i. ISSN 0001-4842.
- ↑ DeWitt, Sheila Hobbs; Czarnik, Anthony W. (1996–2001). "पार्के-डेविस के डायवर्सोमर विधि का उपयोग करके संयुक्त कार्बनिक संश्लेषण". Accounts of Chemical Research (in English). 29 (3): 114–122. doi:10.1021/ar950209v. ISSN 0001-4842.
- ↑ Schwabacher, Alan W.; Shen, Yixing; Johnson, Christopher W. (1999–2009). "फूरियर ट्रांसफॉर्म कॉम्बिनेटरियल केमिस्ट्री". Journal of the American Chemical Society (in English). 121 (37): 8669–8670. doi:10.1021/ja991452i. ISSN 0002-7863.
- ↑ Ellman, Jonathan A. (1996–2001). "लघु-अणु पुस्तकालयों का डिजाइन, संश्लेषण और मूल्यांकन". Accounts of Chemical Research (in English). 29 (3): 132–143. doi:10.1021/ar950190w. ISSN 0001-4842.
- ↑ 27.0 27.1 Gordon, E. M.; Gallop, M. A.; Patel, D. V. (1996–2001). "कॉम्बिनेटरियल ऑर्गेनिक सिंथेसिस में रणनीति और रणनीति। ड्रग डिस्कवरी के लिए आवेदन". Accounts of Chemical Research (in English). 29 (3): 144–154. doi:10.1021/ar950170u. ISSN 0001-4842.
- ↑ A. Furka Sub-Library Composition of Peptide Libraries. Potential Application in Screening. Drug Development Research 33, 90-97 (1994).
- ↑ Erb E, Janda KD, Brenner S (1994) Recursive deconvolution of combinatorial chemical libraries Proc. Natl Acad Sci.USA 91; 11422-11426.
- ↑ Furka Á, Sebestyén F, WC 93/24517, 1993.
- ↑ Pinilla C, Appel JR, Blanc P, Houghten RA (1993) Rapid identification of high affinity peptide ligands using positional scanning synthetic peptide combinatorial libraries. BioTechniques 13(6); 901-5.
- ↑ Carell TE, Winter A, Rebek J Jr. (1994) A Novel Procedure for the Synthesis of Libraries Containing Small Organic Molecules, Angew Chem Int Ed Engl 33; 2059-2061.
- ↑ Câmpian E, Peterson M, Saneii HH, Furka Á, (1998) Deconvolution by omission libraries, Bioorg &[ Med Chem Letters 8; 2357-2362.
- ↑ J. A. Smith J. G. R. Hurrel, S. J. Leach A novel method for delineating antigenic determinants: peptide synthesis and radioimmunoassay using the same solid support. Immunochemistry 1977, 14, 565.
- ↑ S. J. Taylor, J. P. Morken Thermographic Selection of Effective Catalysts from an Encoded Polymer-Bound Library Science 1998, 280, 267.
- ↑ Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC (1993) Complex synthetic chemical libraries indexed with molecular tags, Proc Natl Acad Sci USA 90; 10922-10926.
- ↑ Sarkar M, Pascal BD, Steckler C, Aquino C., Micalizio GC, Kodadek T, Chalmers MJ (1993) Decoding Split and Pool Combinatorial Libraries with Electron Transfer Dissociation Tandem Mass Spectrometry, J Am Soc Mass Spectrom 24(7): 1026-36.
- ↑ Kerr JM, Banville SC, Zuckermann RN (1993) Encoded Combinatorial Peptide Libraries Containing Non-Natural Amino Acids, J Am Chem. Soc 115; 2529-2531.
- ↑ Nikolaiev V, Stierandová A, Krchnák V, Seligmann B, Lam KS, Salmon SE, Lebl M, (1993) Peptide-encoding for structure determination of nonsequenceable polymers within libraries synthesized and tested on solid-phase supports, Pept Res. 6(3):161-70.
- ↑ Brenner S, Lerner RA. (1992) Encoded combinatorial chemistry. Proc Natl Acad Sci USA 89; 5381–5383.
- ↑ Nielsen J, Brenner S, Janda KD. (1993) Synthetic methods for the implementation of encoded combinatorial chemistry. Journal of the American Chemical Society, 115 (21); 9812–9813.
- ↑ Harbury DR, Halpin DR (2000) WO 00/23458.
- ↑ B. Halford How DNA-encoded libraries are revolutionizing drug discovery. C&EN 2017, 95, Issue 25.
- ↑ Gartner ZJ, Tse BN, Grubina RB, Doyon JB, Snyder TM, Liu DR (2004) DNA-Templated Organic Synthesis and Selection of a Library of Macrocycles, Science 305; 1601-1605.
- ↑ Melkko S, Scheuermann J, Dumelin CE, Neri D (2004) Encoded self-assembling chemical libraries Nat Biotechnol 22; 568-574.
- ↑ Halpin DR, Harbury PB (2004) DNA Display I. Sequence-Encoded Routing of DNA Populations, PLoS Biology 2; 1015-102.
- ↑ Mannocci L, Zhang Y, Scheuermann J, Leimbacher M, De Bellis G, Rizzi E, Dumelin C, Melkko S, and Neri N (2008) High-throughput sequencing allows the identification of binding molecules isolated from DNA-encoded chemical libraries, Proc Natl Acad Sci USA 105;17670–17675.
- ↑ Hansen MH, Blakskjær P, Petersen LK, Hansen TH, Højfeldt JW, Gothelf KV, HansenNJV (2009) A Yoctoliter-Scale DNA Reactor for Small-Molecule Evolution (2009) J Am Chem Soc 131; 1322-1327.
- ↑ Luk KC, Satz AL (2014) DNA‐Compatible Chemistry in: Goodnow Jr. RA Editor A Handbook for DNA‐Encoded Chemistry: Theory and Applications for Exploring Chemical Space and Drug Discovery, Wiley, pp 67-98.
- ↑ Satz AL, Cai J, Chen Y,§, Goodnow R, Felix Gruber F, Kowalczyk A, Petersen A, Naderi-Oboodi G, Orzechowski L, Strebel Q (2015) DNA Compatible Multistep Synthesis and Applications to DNA Encoded Libraries Bioconjugate Chem 26; 1623−1632.
- ↑ Li Y, Gabriele E, Samain F, Favalli N, Sladojevich F, Scheuermann J, Neri D (2016) Optimized reaction conditions for amide bond formation in DNA-encoded combinatorial libraries, ACS Comb Sci 18(8); 438–443.
- ↑ X. -D. Xiang et al. "A Combinatorial Approach to Materials Discovery" Science 268 (1995) 1738
- ↑ J.J. Hanak, J. Mater. Sci, 1970, 5, 964-971
- ↑ Combinatorial methods for development of sensing materials, Springer, 2009. ISBN 978-0-387-73712-6
- ↑ V. M. Mirsky, V. Kulikov, Q. Hao, O. S. Wolfbeis. Multiparameter High Throughput Characterization of Combinatorial Chemical Microarrays of Chemosensitive Polymers. Macromolec. Rap. Comm., 2004, 25, 253-258
- ↑ H. Koinuma et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 1 (2000) 1 free download
- ↑ Andrei Ionut Mardare et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 9 (2008) 035009 free download
- ↑ Applied Catalysis A, Volume 254, Issue 1, Pages 1-170 (10 November 2003)
- ↑ J. N. Cawse et al., Progress in Organic Coatings, Volume 47, Issue 2, August 2003, Pages 128-135
- ↑ Combinatorial Methods for High-Throughput Materials Science, MRS Proceedings Volume 1024E, Fall 2007
- ↑ Combinatorial and Artificial Intelligence Methods in Materials Science II, MRS Proceedings Volume 804, Fall 2004
- ↑ QSAR and Combinatorial Science, 24, Number 1 (February 2005)
- ↑ J. N. Cawse, Ed., Experimental Design for Combinatorial and High Throughput Materials Development, John Wiley and Sons, 2002.
- ↑ D. Newman and G. Cragg "Natural Products as Sources of New Drugs over the Last 25 Years" J Nat Prod 70 (2007) 461
- ↑ 65.0 65.1 M. Feher and J. M. Schmidt "Property Distributions: Differences between Drugs, Natural Products, and Molecules from Combinatorial Chemistry" J. Chem. Inf. Comput. Sci., 43 (2003) 218
- ↑ Cordier, C.; Morton, D.; Murrison, S.; Nelson, A.; O'Leary-Steele, C. (2008). "बायोएक्टिव कंपाउंड लाइब्रेरी के विविधता-उन्मुख संश्लेषण में एक प्रेरणा के रूप में प्राकृतिक उत्पाद". Nat. Prod. Rep. 25 (4): 719–737. doi:10.1039/B706296F. PMC 2496956. PMID 18663392. S2CID 15697405.
- ↑ de Sousa Luis, J.A.; Costa Barros, R.P.; de Sousa, N.F.; Muratov, E.; Scotti, L.; Scotti, M.T. (2021). "प्राकृतिक उत्पादों के डेटाबेस की वर्चुअल स्क्रीनिंग". Mini-Rev. Med. Chem. 21 (18): 2657–2730. doi:10.2174/1389557520666200730161549. PMID 32744975. S2CID 220965407.
- ↑ Harvey, A.L. (2008). "दवा की खोज में प्राकृतिक उत्पाद". Drug Discov. Today. 13 (19–20): 894–901. doi:10.1016/j.drudis.2008.07.004. PMID 18691670.
- ↑ Kohli, S. (2018). मॉलिक्यूलर इनसाइट ऑफ़ ड्रग डिज़ाइन, एड में न्यू ड्रग लेड के स्रोत के रूप में प्रकृति के लिए एकीकृत दृष्टिकोण। आदित्य, ए. (PDF). IntechOpen. pp. 29–44. doi:10.5772/intechopen.74961. S2CID 64364163. Archived (PDF) from the original on 2022-05-27.
- ↑ Kaiser, M.; Wetzel, S.; Kumar, K.; Waldmann, H. (2008). "यौगिक पुस्तकालयों का जीव विज्ञान-प्रेरित संश्लेषण". Cell. Mol. Life Sci. 65 (7–8): 1186–1201. doi:10.1007/s00018-007-7492-1. PMID 18193390. S2CID 22601514.
- ↑ Teague, S.J.; Davis, A.M.; Leeson, P.D.; Oprea, T. (1999). "सीसे के समान संयोजी पुस्तकालयों का डिजाइन". Angew. Chem. Int. Ed. 38 (24): 3743–3748. doi:10.1002/(SICI)1521-3773(19991216)38:24<3743::AID-ANIE3743>3.0.CO;2-U. PMID 10649345.
- ↑ Su QB, Beeler AB, Lobkovsky E, Porco JA, Panek JS "Stereochemical diversity through cyclodimerization: Synthesis of polyketide-like macrodiolides." Org Lett 2003, 5:2149-2152.
- ↑ Medina-Franco, J.L.; Martínez-Mayorga, K.; Giulianotti, M.A.; Houghten, R.A.; Pinilla, C. (2008). "दवा की खोज में रासायनिक स्थान का दृश्य". Curr Comput-Aided Drug Des. 4 (4): 322–333. doi:10.2174/157340908786786010.
- ↑ Rosén, J.; Gottfries, J.; Muresan, S.; Backlund, A.; Oprea, T.I. (2009). "प्राकृतिक उत्पादों के माध्यम से उपन्यास रासायनिक अंतरिक्ष अन्वेषण". J. Med. Chem. 52 (7): 1953–1962. doi:10.1021/jm801514w. PMC 2696019. PMID 19265440.
- ↑ Lachance, H.; Wetzel, S.; Kumar, K.; Waldmann, H. (2012). "ड्रग डिस्कवरी के लिए प्राकृतिक उत्पाद रासायनिक स्थान को चार्ट करना, नेविगेट करना और पॉप्युलेट करना". J. Med. Chem. 55 (13): 5989–6001. doi:10.1021/jm300288g. PMID 22537178.
- ↑ Reymond, J.-L.; Awale, M. (2012). "केमिकल यूनिवर्स डेटाबेस का उपयोग करके ड्रग डिस्कवरी के लिए केमिकल स्पेस की खोज करना". ACS Chem. Neurosci. 3 (9): 649–657. doi:10.1021/cn3000422. PMC 3447393. PMID 23019491.
- ↑ Medina-Franco, J.L. (2013). Chemoinformatic characterization of the chemical space and molecular diversity of compound libraries, in Diversity-Oriented Synthesis: Basics and Applications in Organic Synthesis, Drug Discovery, and Chemical Biology, Trabocchi, A.; Ed., Chapter 10, 2013, 325-352. John Wiley & Sons, Inc.
- ↑ Klein, R.; Lindell, S.D. (2014). Combinatorial Chemistry Library Design, in, Plant Chemical Biology, Audenaert, D.; Overvoorde, P.; Eds. New Jersey: John Wiley & Sons, Inc. pp. 40–63.
बाहरी संबंध
- English version of the 1982 document
- "The concealed side of the history of combinatorial chemistry"
- IUPAC's "Glossary of Terms Used in Combinatorial Chemistry"
- ACS Combinatorial Science (formerly Journal of Combinatorial Chemistry)
- Combinatorial Chemistry Review
- Molecular Diversity
- Combinatorial Chemistry and High Throughput Screening
- Combinatorial Chemistry: an Online Journal
- SmiLib - A free open-source software for combinatorial library enumeration
- GLARE - A free open-source software for combinatorial library design