पॉलीसल्फाइड: Difference between revisions
(Created page with "thumb|एकल-दीवार [[कार्बन नैनोट्यूब (सीएनटी, ए) के अंदर विकसित दो स...") |
No edit summary |
||
| Line 1: | Line 1: | ||
[[File:S@CNT.jpg|thumb|एकल-दीवार [[कार्बन नैनोट्यूब]] (सीएनटी, ए) के अंदर विकसित दो समानांतर मोनोएटोमिक सल्फर श्रृंखलाएं। ज़िग-ज़ैग (बी) और स्ट्रेट (सी) एस चेन डबल-वॉल सीएनटी के अंदर।<ref>{{cite journal|doi=10.1038/ncomms3162|title=कार्बन नैनोट्यूब के अंदर सल्फर की रेखीय श्रृंखला का संचालन|journal=Nature Communications|volume=4|pages=2162|year=2013|last1=Fujimori|first1=Toshihiko|last2=Morelos-Gómez|first2=Aarón|last3=Zhu|first3=Zhen|last4=Muramatsu|first4=Hiroyuki|last5=Futamura|first5=Ryusuke|last6=Urita|first6=Koki|last7=Terrones|first7=Mauricio|last8=Hayashi|first8=Takuya|last9=Endo|first9=Morinobu|last10=Young Hong|first10=Sang|last11=Chul Choi|first11=Young|last12=Tománek|first12=David|last13=Kaneko|first13=Katsumi|pmid=23851903|pmc=3717502|bibcode=2013NatCo...4.2162F}}</ref>]]पॉलीसल्फाइड [[रासायनिक यौगिक]] | [[File:S@CNT.jpg|thumb|एकल-दीवार [[कार्बन नैनोट्यूब]] (सीएनटी, ए) के अंदर विकसित दो समानांतर मोनोएटोमिक सल्फर श्रृंखलाएं। ज़िग-ज़ैग (बी) और स्ट्रेट (सी) एस चेन डबल-वॉल सीएनटी के अंदर।<ref>{{cite journal|doi=10.1038/ncomms3162|title=कार्बन नैनोट्यूब के अंदर सल्फर की रेखीय श्रृंखला का संचालन|journal=Nature Communications|volume=4|pages=2162|year=2013|last1=Fujimori|first1=Toshihiko|last2=Morelos-Gómez|first2=Aarón|last3=Zhu|first3=Zhen|last4=Muramatsu|first4=Hiroyuki|last5=Futamura|first5=Ryusuke|last6=Urita|first6=Koki|last7=Terrones|first7=Mauricio|last8=Hayashi|first8=Takuya|last9=Endo|first9=Morinobu|last10=Young Hong|first10=Sang|last11=Chul Choi|first11=Young|last12=Tománek|first12=David|last13=Kaneko|first13=Katsumi|pmid=23851903|pmc=3717502|bibcode=2013NatCo...4.2162F}}</ref>]]पॉलीसल्फाइड [[रासायनिक यौगिक]] का एक वर्ग है जिसमें [[ गंधक |गंधक]] परमाणुओं की श्रृंखला होती है।<ref>{{Citation |last=Kelly |first=P. F. |title=1.06 - Catenated Sulfur Compounds |date=2013-01-01 |url=https://www.sciencedirect.com/science/article/pii/B978008097774400108X |work=Comprehensive Inorganic Chemistry II (Second Edition) |pages=179–196 |editor-last=Reedijk |editor-first=Jan |place=Amsterdam |publisher=Elsevier |language=en |doi=10.1016/b978-0-08-097774-4.00108-x |isbn=978-0-08-096529-1 |access-date=2022-03-29 |last2=King |first2=R. S. P. |editor2-last=Poeppelmeier |editor2-first=Kenneth}}</ref> पॉलीसल्फाइड्स के दो मुख्य वर्ग हैं: अकार्बनिक और जैविक। अकार्बनिक पॉलीसल्फाइड्स में, ऐसे होते हैं जिनमें आयन होते हैं, जिनका सामान्य सूत्र होता है {{chem|S|''n''|2−}}. ये आयन हाइड्रोजन पॉलीसल्फाइड के संयुग्मित आधार हैं {{chem2|H2S_{''n''}|}}. कार्बनिक पॉलीसल्फाइड्स में सामान्यतः सूत्र होते हैं {{chem2|R^{1}S_{''n''}R^{2}|}}, जहाँ R = ऐल्किल या ऐरिल।<ref name=Steudel>{{cite encyclopedia|first=Ralf|last=Steudel|encyclopedia=Encyclopedia of Inorganic Chemistry|date=2007|publisher=Wiley-VCH|location=Weinheim|doi=10.1002/0470862106.ia233.pub2|chapter=Sulfur: Organic Polysulfanes|isbn=978-0470860786}}</ref> | ||
| Line 13: | Line 13: | ||
== ऑर्गेनिक पॉलीसल्फाइड्स == | == ऑर्गेनिक पॉलीसल्फाइड्स == | ||
[[Image:Lenthionine-2D-skeletal.png|thumb|130px|left|[[लेंथिओनाइन]] शिटेक मशरूम में पाया जाने वाला एक कार्बनिक पॉलीसल्फाइड है]]वाणिज्य में, पॉलीसल्फाइड शब्द | [[Image:Lenthionine-2D-skeletal.png|thumb|130px|left|[[लेंथिओनाइन]] शिटेक मशरूम में पाया जाने वाला एक कार्बनिक पॉलीसल्फाइड है]]वाणिज्य में, पॉलीसल्फाइड शब्द सामान्यतः पॉलिमर के एक वर्ग को संदर्भित करता है जिसमें कई सल्फर परमाणुओं और हाइड्रोकार्बन की वैकल्पिक श्रृंखला होती है। उनके पास सूत्र है {{chem2|R^{1}S_{''n''}R^{2}|}}. इस सूत्र में n सल्फर परमाणुओं की संख्या (या रैंक) को इंगित करता है। पॉलीसल्फ़ाइड पॉलिमर को पॉलीसल्फ़ाइड आयनों के कार्बनिक डाइहैलाइड्स और क्षार धातु लवणों के बीच संघनन पोलीमराइज़ेशन प्रतिक्रियाओं द्वारा संश्लेषित किया जा सकता है: | ||
:{{chem2|''n'' Na2S5 + ''n'' ClCH2CH2Cl → [CH2CH2S5]_{''n''} + 2''n'' NaCl}} | :{{chem2|''n'' Na2S5 + ''n'' ClCH2CH2Cl → [CH2CH2S5]_{''n''} + 2''n'' NaCl}} | ||
| Line 25: | Line 25: | ||
पॉलीसल्फ़ाइड पॉलिमर पानी, तेल और कई अन्य कार्बनिक सॉल्वैंट्स में अघुलनशील हैं। उनके विलायक प्रतिरोध के कारण, इन सामग्रियों को फुटपाथ, मोटर वाहन खिड़की के शीशे और विमान संरचनाओं में जोड़ों को भरने के लिए [[सीलेंट]] के रूप में उपयोग किया जाता है। | पॉलीसल्फ़ाइड पॉलिमर पानी, तेल और कई अन्य कार्बनिक सॉल्वैंट्स में अघुलनशील हैं। उनके विलायक प्रतिरोध के कारण, इन सामग्रियों को फुटपाथ, मोटर वाहन खिड़की के शीशे और विमान संरचनाओं में जोड़ों को भरने के लिए [[सीलेंट]] के रूप में उपयोग किया जाता है। | ||
हाइड्रोकार्बन अनुक्रमों द्वारा अलग किए गए एक या दो सल्फर परमाणुओं वाले पॉलिमर को | हाइड्रोकार्बन अनुक्रमों द्वारा अलग किए गए एक या दो सल्फर परमाणुओं वाले पॉलिमर को सामान्यतः पॉलीसल्फाइड वर्गीकृत नहीं किया जाता है, उदा। पॉली (पी-फेनिलीन सल्फाइड) | पॉली (पी-फेनिलीन) सल्फाइड {{chem2|(C6H4S)_{''n''}|}}. | ||
=== वल्केनाइज्ड रबर में पॉलीसल्फाइड्स === | === वल्केनाइज्ड रबर में पॉलीसल्फाइड्स === | ||
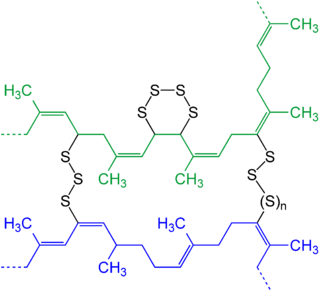
[[File:Vulcanization of POLYIsoprene V.2.png|thumb|320px|right|दो किस्में की आदर्श संरचना ({{color|blue|'''blue'''}} और {{color|green|'''green'''}}) मौलिक सल्फर के साथ वल्केनाइजेशन के बाद प्राकृतिक रबर का, जो पॉलीसल्फाइड लिंकेज बनाता है।]]कई वाणिज्यिक [[ elastomer ]] | [[File:Vulcanization of POLYIsoprene V.2.png|thumb|320px|right|दो किस्में की आदर्श संरचना ({{color|blue|'''blue'''}} और {{color|green|'''green'''}}) मौलिक सल्फर के साथ वल्केनाइजेशन के बाद प्राकृतिक रबर का, जो पॉलीसल्फाइड लिंकेज बनाता है।]]कई वाणिज्यिक [[ elastomer |धातुमल्ल]] में [[ पार लिंक |पार लिंक]] के रूप में पॉलीसल्फाइड होते हैं। ये क्रॉसलिंक पड़ोसी बहुलक श्रृंखलाओं को आपस में जोड़ते हैं, जिससे कठोरता का पता चलता है। कठोरता की डिग्री क्रॉसलिंक्स की संख्या से संबंधित है। इसलिए, इलास्टोमर्स में खिंचाव या संकुचित होने के बाद अपने मूल आकार में वापस आने की एक विशिष्ट क्षमता होती है। उनके मूल [[इलाज (रसायन विज्ञान)]] आकार के लिए इस स्मृति के कारण, इलास्टोमर्स को सामान्यतः घिसने के रूप में जाना जाता है। इन पॉलिमर में सल्फर के साथ पॉलीमर चेन को क्रॉसलिंक करने की प्रक्रिया को [[वल्केनाइजेशन]] कहा जाता है। सल्फर शृंखलाएँ स्वयं को एलिलिक कार्बन परमाणुओं से जोड़ती हैं, जो C = C लिंकेज से सटे हुए हैं। वल्केनाइजेशन [[ रबड़ |रबड़]] के कई वर्गों के प्रसंस्करण में एक कदम है, जिसमें पॉली[[क्लोरोप्रीन]] ([[नियोप्रीन]]), स्टाइरीन-ब्यूटाडाइन और पॉलीसोप्रीन शामिल हैं, जो रासायनिक रूप से प्राकृतिक रबर के समान है। [[चार्ल्स गुडइयर]] की वल्केनाइजेशन की खोज, जिसमें सल्फर के साथ पॉलीसोप्रीन को गर्म करना शामिल था, क्रांतिकारी था क्योंकि इसने एक चिपचिपी और लगभग बेकार सामग्री को एक इलास्टोमर में बदल दिया जिसे उपयोगी उत्पादों में गढ़ा जा सकता था। | ||
== गैस दिग्गजों में घटना == | == गैस दिग्गजों में घटना == | ||
| Line 38: | Line 38: | ||
== यह भी देखें == | == यह भी देखें == | ||
* {{annotated link| | * {{annotated link|डाईसल्फाइड}} | ||
* {{annotated link| | * {{annotated link|ट्राईसल्फाइड}} | ||
* {{annotated link| | * {{annotated link|पॉलीआयोडाइड}} | ||
* {{annotated link| | * {{annotated link|श्रृंखलन}} | ||
==संदर्भ== | ==संदर्भ== | ||
Revision as of 09:57, 27 May 2023

पॉलीसल्फाइड रासायनिक यौगिक का एक वर्ग है जिसमें गंधक परमाणुओं की श्रृंखला होती है।[2] पॉलीसल्फाइड्स के दो मुख्य वर्ग हैं: अकार्बनिक और जैविक। अकार्बनिक पॉलीसल्फाइड्स में, ऐसे होते हैं जिनमें आयन होते हैं, जिनका सामान्य सूत्र होता है S2−
n. ये आयन हाइड्रोजन पॉलीसल्फाइड के संयुग्मित आधार हैं H2Sn. कार्बनिक पॉलीसल्फाइड्स में सामान्यतः सूत्र होते हैं R1SnR2, जहाँ R = ऐल्किल या ऐरिल।[3]
पॉलीसल्फ़ाइड लवण और कॉम्प्लेक्स
फ़ाइल: Na2S5Packing.tif|thumb|बाएं|220px|की ठोस अवस्था संरचना का टुकड़ा Na2S5. वह S2−5 श्रृंखला स्पष्ट है।[4]सल्फाइड के घोल के उपचार से क्षार धातु पॉलीसल्फाइड उत्पन्न होते हैं, उदा। सोडियम सल्फाइड, मौलिक सल्फर के साथ:
- S2−
+ n S → S2−
n+1
कुछ मामलों में, इन आयनों को कार्बनिक लवण के रूप में प्राप्त किया गया है, जो कार्बनिक सॉल्वैंट्स में घुलनशील हैं।[5] सोडियम और मौलिक सल्फर की प्रतिक्रिया में जारी ऊर्जा बैटरी प्रौद्योगिकी का आधार है। सोडियम-सल्फर बैटरी और लिथियम-सल्फर बैटरी को तरल पॉलीसल्फाइड और बनाए रखने के लिए उच्च तापमान की आवश्यकता होती है Na+-प्रवाहकीय झिल्लियां जो सोडियम, सल्फर और सोडियम सल्फाइड के प्रति अक्रियाशील होती हैं।
पॉलीसल्फाइड्स समन्वय रसायन विज्ञान में लिगेंड हैं। ट्रांज़िशन मेटल पॉलीसल्फ़िडो कॉम्प्लेक्स के उदाहरणों में टिटानोसीन पेंटासल्फ़ाइड शामिल हैं(C5H5)2TiS5, [Ni(S4)2]2−, और [Pt(S5)3]2−.[6] मुख्य समूह तत्व भी पॉलीसल्फाइड्स बनाते हैं।[7]
ऑर्गेनिक पॉलीसल्फाइड्स

वाणिज्य में, पॉलीसल्फाइड शब्द सामान्यतः पॉलिमर के एक वर्ग को संदर्भित करता है जिसमें कई सल्फर परमाणुओं और हाइड्रोकार्बन की वैकल्पिक श्रृंखला होती है। उनके पास सूत्र है R1SnR2. इस सूत्र में n सल्फर परमाणुओं की संख्या (या रैंक) को इंगित करता है। पॉलीसल्फ़ाइड पॉलिमर को पॉलीसल्फ़ाइड आयनों के कार्बनिक डाइहैलाइड्स और क्षार धातु लवणों के बीच संघनन पोलीमराइज़ेशन प्रतिक्रियाओं द्वारा संश्लेषित किया जा सकता है:
- n Na2S5 + n ClCH2CH2Cl → [CH2CH2S5]n + 2n NaCl
इस संघनन पोलीमराइज़ेशन में उपयोग किए जाने वाले डाइहैलाइड्स डाइक्लोरोअल्केन्स हैं (जैसे कि 1,2-डाइक्लोरोइथेन|1,2-डाइक्लोरोइथेन, बीआईएस-(2-क्लोरोइथाइल) औपचारिक (ClCH2CH2OCH2OCH2CH2Cl), और 1,3-डाइक्लोरोप्रोपेन)। पॉलिमर को थियोकोल (बहुलक) कहा जाता है। कुछ मामलों में, रिंग-ओपनिंग पोलीमराइज़ेशन प्रतिक्रियाओं द्वारा पॉलीसल्फ़ाइड पॉलिमर का गठन किया जा सकता है।
पॉलीसल्फ़ाइड पॉलिमर भी पॉलीसल्फ़ेन को एल्केन्स में जोड़कर तैयार किए जाते हैं। एक आदर्श समीकरण है:
- 2 RCH=CH2 + H2Sn → (RCH2CH2)2Sn
वास्तव में, के सजातीय नमूने H2Sn को तैयार करना कठिन होता है।[3]
पॉलीसल्फ़ाइड पॉलिमर पानी, तेल और कई अन्य कार्बनिक सॉल्वैंट्स में अघुलनशील हैं। उनके विलायक प्रतिरोध के कारण, इन सामग्रियों को फुटपाथ, मोटर वाहन खिड़की के शीशे और विमान संरचनाओं में जोड़ों को भरने के लिए सीलेंट के रूप में उपयोग किया जाता है।
हाइड्रोकार्बन अनुक्रमों द्वारा अलग किए गए एक या दो सल्फर परमाणुओं वाले पॉलिमर को सामान्यतः पॉलीसल्फाइड वर्गीकृत नहीं किया जाता है, उदा। पॉली (पी-फेनिलीन सल्फाइड) | पॉली (पी-फेनिलीन) सल्फाइड (C6H4S)n.
वल्केनाइज्ड रबर में पॉलीसल्फाइड्स
कई वाणिज्यिक धातुमल्ल में पार लिंक के रूप में पॉलीसल्फाइड होते हैं। ये क्रॉसलिंक पड़ोसी बहुलक श्रृंखलाओं को आपस में जोड़ते हैं, जिससे कठोरता का पता चलता है। कठोरता की डिग्री क्रॉसलिंक्स की संख्या से संबंधित है। इसलिए, इलास्टोमर्स में खिंचाव या संकुचित होने के बाद अपने मूल आकार में वापस आने की एक विशिष्ट क्षमता होती है। उनके मूल इलाज (रसायन विज्ञान) आकार के लिए इस स्मृति के कारण, इलास्टोमर्स को सामान्यतः घिसने के रूप में जाना जाता है। इन पॉलिमर में सल्फर के साथ पॉलीमर चेन को क्रॉसलिंक करने की प्रक्रिया को वल्केनाइजेशन कहा जाता है। सल्फर शृंखलाएँ स्वयं को एलिलिक कार्बन परमाणुओं से जोड़ती हैं, जो C = C लिंकेज से सटे हुए हैं। वल्केनाइजेशन रबड़ के कई वर्गों के प्रसंस्करण में एक कदम है, जिसमें पॉलीक्लोरोप्रीन (नियोप्रीन), स्टाइरीन-ब्यूटाडाइन और पॉलीसोप्रीन शामिल हैं, जो रासायनिक रूप से प्राकृतिक रबर के समान है। चार्ल्स गुडइयर की वल्केनाइजेशन की खोज, जिसमें सल्फर के साथ पॉलीसोप्रीन को गर्म करना शामिल था, क्रांतिकारी था क्योंकि इसने एक चिपचिपी और लगभग बेकार सामग्री को एक इलास्टोमर में बदल दिया जिसे उपयोगी उत्पादों में गढ़ा जा सकता था।
गैस दिग्गजों में घटना
पानी और अमोनिया के अलावा, विशाल गैस ग्रहों के वायुमंडल में बादलों में अमोनियम सल्फाइड होते हैं। अमोनियम सल्फाइड के प्रकाश के संपर्क में आने से उत्पन्न होने वाले लाल-भूरे रंग के बादलों को पॉलीसल्फाइड्स के लिए जिम्मेदार ठहराया जाता है।[8]
गुण
पॉलीसल्फाइड, सल्फाइड के रूप में, कार्बन स्टील और स्टेनलेस स्टील में तनाव जंग खुर को प्रेरित कर सकता है।
यह भी देखें
संदर्भ
- ↑ Fujimori, Toshihiko; Morelos-Gómez, Aarón; Zhu, Zhen; Muramatsu, Hiroyuki; Futamura, Ryusuke; Urita, Koki; Terrones, Mauricio; Hayashi, Takuya; Endo, Morinobu; Young Hong, Sang; Chul Choi, Young; Tománek, David; Kaneko, Katsumi (2013). "कार्बन नैनोट्यूब के अंदर सल्फर की रेखीय श्रृंखला का संचालन". Nature Communications. 4: 2162. Bibcode:2013NatCo...4.2162F. doi:10.1038/ncomms3162. PMC 3717502. PMID 23851903.
- ↑ Kelly, P. F.; King, R. S. P. (2013-01-01), Reedijk, Jan; Poeppelmeier, Kenneth (eds.), "1.06 - Catenated Sulfur Compounds", Comprehensive Inorganic Chemistry II (Second Edition) (in English), Amsterdam: Elsevier, pp. 179–196, doi:10.1016/b978-0-08-097774-4.00108-x, ISBN 978-0-08-096529-1, retrieved 2022-03-29
- ↑ 3.0 3.1 Steudel, Ralf (2007). "Sulfur: Organic Polysulfanes". Encyclopedia of Inorganic Chemistry. Weinheim: Wiley-VCH. doi:10.1002/0470862106.ia233.pub2. ISBN 978-0470860786.
- ↑ Rosén, E.; Tegman, R. (1988). "Preparative and X-ray powder diffraction study of the polysulfides Na2S2, Na2S4 and Na2S5". Acta Chem. Scand. 25: 3329–3336. doi:10.3891/acta.chem.scand.25-3329.
- ↑ Dev, S.; Ramli, E.; Rauchfuss, T. B.; Wilson, S. R. (1991). "Synthesis and Structure of [M(N-Methylimidazole)6]S8: Polysulfide Salts Prepared by the Reaction N-Methylimidazole + Metal Powder + Sulfur". Inorg. Chem. 30 (11): 2514. doi:10.1021/ic00011a011.
- ↑ Draganjac, M. E.; Rauchfuss, T. B. (1985). "Transition Metal Polysulfides: Coordination Compounds with Purely Inorganic Chelate Ligands". Angew. Chem. Int. Ed. Engl. 24 (9): 742. doi:10.1002/anie.198507421.
- ↑ Takeda, N.; Tokitoh, N.; Okazaki, R. (2003). मुख्य समूह और संक्रमण धातुओं के पॉलीसल्फिडो कॉम्प्लेक्स. Topics in Current Chemistry. Vol. 231. pp. 153–202. doi:10.1007/b13184. ISBN 3-540-40378-7.
- ↑ "Jupiter: Cloud composition". Encyclopædia Britannica.