हाइड्रोज़ोइक एसिड: Difference between revisions
No edit summary |
|||
| (7 intermediate revisions by 3 users not shown) | |||
| Line 2: | Line 2: | ||
{{Chembox | {{Chembox | ||
| verifiedrevid = 443860054 | | verifiedrevid = 443860054 | ||
| Name = | | Name = हाइड्रेजोइक अम्ल | ||
| ImageFile = Hydrogen-azide-2D-dimensions.png | | ImageFile = Hydrogen-azide-2D-dimensions.png | ||
| ImageName = Structure, bonding and dimensions of the hydrogen azide molecule | | ImageName = Structure, bonding and dimensions of the hydrogen azide molecule | ||
| ImageFile1 = Hydrazoic_acid.svg | | ImageFile1 = Hydrazoic_acid.svg | ||
| ImageName1 = | | ImageName1 = हाइड्रेजोइक अम्ल | ||
| ImageFile2 = Hydrogen-azide-3D-vdW.png | | ImageFile2 = Hydrogen-azide-3D-vdW.png | ||
| ImageName2 = | | ImageName2 = हाइड्रेजोइक अम्ल | ||
| IUPACName = हाइड्रेजोइक अम्ल | | IUPACName = हाइड्रेजोइक अम्ल | ||
| OtherNames = Hydrogen azide<br>Azoimide | | OtherNames = Hydrogen azide<br>Azoimide | ||
| Line 70: | Line 70: | ||
}} | }} | ||
'''हाइड्रेजोइक अम्ल''', जिसे '''हाइड्रोजन एजाइड''' या '''ऐजोइमाइड''' के रूप में भी जाना जाता है,<ref name="EB1911">{{Cite EB1911 |wstitle=Azoimide |volume=3 |pages=82–83}} This also contains a detailed description of the contemporaneous production process.</ref> जो रासायनिक सूत्र {{chem2|HN3}} वाला यौगिक है|<ref>{{cite book | title = अकार्बनिक और Organometallic यौगिकों का शब्दकोश| publisher = Chapman & Hall }}</ref> यह कमरे के तापमान और दबाव में एक रंगहीन, अस्थिर और विस्फोटक तरल है। यह [[नाइट्रोजन]] और [[हाइड्रोजन]] का एक यौगिक है, और इसलिए एक [[निक्टोजन हाइड्राइड]] है। इसे पहली बार 1890 में [[ थिओडोर कर्टियस ]] द्वारा अलग किया गया था।<ref>{{Cite journal | last = Curtius | first = Theodor | author-link = Theodor Curtius | title = Ueber Stickstoffwasserstoffsäure (Azoimid) N<sub>3</sub>H |trans-title=On hydrazoic acid (azoimide) N<sub>3</sub>H | journal = Berichte der Deutschen Chemischen Gesellschaft | year = 1890 | volume = 23 | issue = 2 | pages = 3023–3033 | url = http://babel.hathitrust.org/cgi/pt?id=umn.319510006827352;view=1up;seq=919 | doi=10.1002/cber.189002302232}}</ref> अम्ल के कुछ अनुप्रयोग हैं, लेकिन इसका [[संयुग्मी क्षार]], एजाइड आयन, विशेष प्रक्रियाओं में उपयोगी है। | '''हाइड्रेजोइक अम्ल''', जिसे '''हाइड्रोजन एजाइड''' या '''ऐजोइमाइड''' के रूप में भी जाना जाता है,<ref name="EB1911">{{Cite EB1911 |wstitle=Azoimide |volume=3 |pages=82–83}} This also contains a detailed description of the contemporaneous production process.</ref> जो रासायनिक सूत्र {{chem2|HN3}} वाला यौगिक है|<ref>{{cite book | title = अकार्बनिक और Organometallic यौगिकों का शब्दकोश| publisher = Chapman & Hall }}</ref> यह कमरे के तापमान और दबाव में एक रंगहीन, अस्थिर और विस्फोटक तरल है। यह [[नाइट्रोजन]] और [[हाइड्रोजन]] का एक यौगिक है, और इसलिए एक [[निक्टोजन हाइड्राइड]] है। इसे पहली बार 1890 में[[ थिओडोर कर्टियस ]]द्वारा अलग किया गया था।<ref>{{Cite journal | last = Curtius | first = Theodor | author-link = Theodor Curtius | title = Ueber Stickstoffwasserstoffsäure (Azoimid) N<sub>3</sub>H |trans-title=On hydrazoic acid (azoimide) N<sub>3</sub>H | journal = Berichte der Deutschen Chemischen Gesellschaft | year = 1890 | volume = 23 | issue = 2 | pages = 3023–3033 | url = http://babel.hathitrust.org/cgi/pt?id=umn.319510006827352;view=1up;seq=919 | doi=10.1002/cber.189002302232}}</ref> अम्ल के कुछ अनुप्रयोग हैं, लेकिन इसका [[संयुग्मी क्षार]], एजाइड आयन, विशेष प्रक्रियाओं में उपयोगी है। | ||
हाइड्रेजोइक अम्ल, अपने साथी [[खनिज अम्ल]] की तरह, जल में घुलनशील है। विशुद्ध (अनडाइल्यूटेड) हाइड्रेजोइक अम्ल खतरनाक रूप से विस्फोटक होता है<ref>{{Cite journal|last1=Furman|first1=David|last2=Dubnikova|first2=Faina|last3=van Duin|first3=Adri C. T.|last4=Zeiri|first4=Yehuda|last5=Kosloff|first5=Ronnie|date=2016-03-10|title=विस्फोट रसायन विज्ञान के अनुप्रयोगों के साथ तरल हाइड्रोजोइक एसिड के लिए प्रतिक्रियाशील बल क्षेत्र|journal=The Journal of Physical Chemistry C|volume=120|issue=9|pages=4744–4752|doi=10.1021/acs.jpcc.5b10812|bibcode=2016APS..MARH20013F|s2cid=102029987 |issn=1932-7447}}</ref> जिसमें [[निर्माण की एक मानक एन्थैल्पी]] Δ<sub>f</sub>H<sup>o</sup> (l, 298K) = +264 kJ/mol होती है।<ref name="InorgChem" />तनु होने पर, गैस और जलीय विलयन (<10%) सुरक्षित रूप से तैयार किए जा सकते हैं लेकिन तुरंत उपयोग किए जाने चाहिए; इसके कम क्वथनांक के कारण, हाइड्रेजोइक अम्ल वाष्पीकरण और संघनन पर | हाइड्रेजोइक अम्ल, अपने साथी [[खनिज अम्ल]] की तरह, जल में घुलनशील है। विशुद्ध (अनडाइल्यूटेड) हाइड्रेजोइक अम्ल खतरनाक रूप से विस्फोटक होता है<ref>{{Cite journal|last1=Furman|first1=David|last2=Dubnikova|first2=Faina|last3=van Duin|first3=Adri C. T.|last4=Zeiri|first4=Yehuda|last5=Kosloff|first5=Ronnie|date=2016-03-10|title=विस्फोट रसायन विज्ञान के अनुप्रयोगों के साथ तरल हाइड्रोजोइक एसिड के लिए प्रतिक्रियाशील बल क्षेत्र|journal=The Journal of Physical Chemistry C|volume=120|issue=9|pages=4744–4752|doi=10.1021/acs.jpcc.5b10812|bibcode=2016APS..MARH20013F|s2cid=102029987 |issn=1932-7447}}</ref> जिसमें [[निर्माण की एक मानक एन्थैल्पी]] Δ<sub>f</sub>H<sup>o</sup> (l, 298K) = +264 kJ/mol होती है।<ref name="InorgChem" />तनु होने पर, गैस और जलीय विलयन (<10%) सुरक्षित रूप से तैयार किए जा सकते हैं लेकिन तुरंत उपयोग किए जाने चाहिए; इसके कम क्वथनांक के कारण, हाइड्रेजोइक अम्ल वाष्पीकरण और संघनन पर सम्पन्न होता है जैसे कि विस्फोट के लिए अक्षम तनु विलयन पात्र या रिएक्टर के हेडस्पेस में ड्रॉपलेट का निर्माण कर सकता है जो विस्फोट करने में सक्षम हैं।<ref>Gonzalez-Bobes, F. et al Org. Process Res. Dev. 2012, 16, 2051-2057.</ref><ref>Treitler, D. S. et al Org. Process Res. Dev. 2017, 21, 460-467.</ref> | ||
| Line 93: | Line 93: | ||
== | == निराकरण से पूर्व विनाश == | ||
हाइड्रेजोइक अम्ल नाइट्रस अम्ल के साथ अभिक्रिया करता है: | |||
:{{chem2|HN3 + HNO2 → N2O + N2 + H2O}} | :{{chem2|HN3 + HNO2 → N2O + N2 + H2O}} | ||
यह | यह अभिक्रिया असामान्य है क्योंकि इसमें चार अलग-अलग ऑक्सीकरण अवस्थाओं में नाइट्रोजन वाले यौगिक सम्मिलित हैं।<ref name=p461>Greenwood, pp. 461–464.</ref> | ||
== | == अभिक्रियाएं == | ||
इसके गुणों में हाइड्रेजोइक | इसके गुणों में हाइड्रेजोइक अम्ल हैलोजन अम्ल के लिए कुछ सादृश्य दिखाता है, क्योंकि यह कम घुलनशील (जल में) सीसा, चांदी और पारा (I) लवण बनाता है। धात्विक लवण सभी निर्जल रूप में क्रिस्टलीकृत होते हैं और गर्म करने पर विघटित हो जाते हैं, जिससे शुद्ध धातु का अवशेष रह जाता है।<ref name="EB1911"/>यह एक दुर्बल अम्ल (pK<sub>a</sub> = 4.75) है|<ref name="InorgChem">{{cite book | ||
| title = Inorganic Chemistry, 3rd Edition | | title = Inorganic Chemistry, 3rd Edition | ||
| chapter = Chapter 15: The group 15 elements | | chapter = Chapter 15: The group 15 elements | ||
| Line 112: | Line 112: | ||
| isbn = 978-0-13-175553-6 | | isbn = 978-0-13-175553-6 | ||
| page = 449 | | page = 449 | ||
}}</ref> | }}</ref> इसके भारी धातु के लवण विस्फोटक होते हैं और [[अल्काइल आयोडाइड|एल्काइल आयोडाइड्स]] के साथ आसानी से संपर्क करते हैं। भारी [[क्षार धातुओं]] ([[लिथियम]] को छोड़कर) या [[क्षारीय पृथ्वी धातुओं]] के एज़ाइड्स विस्फोटक नहीं होते हैं, लेकिन गर्म करने पर अधिक नियंत्रित तरीके से विघटित होते हैं, स्पैक्ट्रोस्कोप द्वारा शुद्ध {{chem2|N2}} गैस छोड़ते हैं।<ref name="wiberg"/> हाइड्रोजन की मुक्ति और लवण के निर्माण के साथ हाइड्रेजोइक अम्ल के विलयन कई धातुओं (जैसे [[जस्ता]], [[लोहा]]) को घोलते हैं, जिन्हें [[एज़ाइड्स]] (पूर्व में ऐजोइमाइड या हाइड्राज़ोएट्स भी कहा जाता है) कहा जाता है। | ||
नाइट्रोजन के निष्कासन के साथ, हाइड्रेजोइक | नाइट्रोजन के निष्कासन के साथ, हाइड्रेजोइक अम्ल एल्डिहाइड, कीटोन्स और कार्बोक्सिलिक अम्ल सहित कार्बोनिल डेरिवेटिव के साथ एक ऐमीन या ऐमाइड देने के लिए अभिक्रिया कर सकता है, इसे [[श्मिट प्रतिक्रिया|श्मिट अभिक्रिया]] या श्मिट पुनर्व्यवस्था कहा जाता है। | ||
[[File:Schmidt_Reaktion_Übersicht_Carbonsäuren1.svg|alt=|center|frameकम|350x350पीएक्स]] | [[File:Schmidt_Reaktion_Übersicht_Carbonsäuren1.svg|alt=|center|frameकम|350x350पीएक्स]] | ||
[[File:Schmidt Reaktion Übersicht Ketone1.svg|alt=|center|frameकम|400x400पीएक्स]]सबसे | [[File:Schmidt Reaktion Übersicht Ketone1.svg|alt=|center|frameकम|400x400पीएक्स]]सबसे प्रबल अम्लों में घुलने से एमिनोडायज़ोनियम आयन {{chem2|[H2N\dN\dN]+ ⇌ [H2N\sN\tN]+}}, युक्त विस्फोटक लवण उत्पन्न होते हैं, उदाहरण के लिए:<ref name="wiberg">{{cite book | ||
| title = Inorganic chemistry | | title = Inorganic chemistry | ||
| chapter = The Nitrogen Group | | chapter = The Nitrogen Group | ||
| Line 128: | Line 128: | ||
}}</ref> | }}</ref> | ||
:{{chem2|HN\dN\dN + H[SbCl6] → [H2N\dN\dN]+[SbCl6]-}} | :{{chem2|HN\dN\dN + H[SbCl6] → [H2N\dN\dN]+[SbCl6]-}} | ||
आयन {{chem2|[H2N\dN\dN]+}} [[डायज़ोमेथेन]] | आयन {{chem2|[H2N\dN\dN]+}} [[डायज़ोमेथेन|डाइऐजोमेथेन]] {{chem2|H2C\dN+\dN-}} के लिए [[समइलेक्ट्रॉनी]] है। | ||
झटके, घर्षण, चिंगारी आदि से | झटके, घर्षण, चिंगारी (स्पार्क) आदि से उत्प्रेरित हाइड्रेजोइक अम्ल का अपघटन नाइट्रोजन और हाइड्रोजन का उत्पादन करता है: | ||
:{{chem2|2 HN3 → H2 + 3 N2}} | :{{chem2|2 HN3 → H2 + 3 N2}} | ||
हाइड्रेजोइक | हाइड्रेजोइक अम्ल पर्याप्त ऊर्जा पर एकाण्विक अपघटन से गुजरता है: | ||
:{{chem2|HN3 → NH + N2}} | :{{chem2|HN3 → NH + N2}} | ||
निम्नतम ऊर्जा मार्ग NH को त्रिक अवस्था में उत्पन्न करता है, जिससे यह स्पिन- | निम्नतम ऊर्जा मार्ग NH को त्रिक अवस्था में उत्पन्न करता है, जिससे यह स्पिन-वर्जित अभिक्रिया बन जाती है। यह उन कुछ अभिक्रियाओं में से एक है, जिनकी दर लेजर प्रकाशिक वियोजन अध्ययन द्वारा जमीनी इलेक्ट्रॉनिक स्थिति में विशिष्ट मात्रा में कंपन ऊर्जा के लिए निर्धारित की गई है|<ref>{{cite journal |last1=Foy |first1=B.R. |last2= Casassa |first2= M.P. |first3= J.C. |last3= Stephenson |first4= D.S. |last4= King |title = Overtone-excited {{chem|HN|3}} (X1A') - Anharmonic resonance, homogeneous linewidths, and dissociation rates |journal = Journal of Chemical Physics | year = 1990 | volume = 92 | pages = 2782–2789 |doi = 10.1063/1.457924}}</ref> इसके अलावा, इन असमान आणविक दरों का सैद्धांतिक रूप से विश्लेषण किया गया है, और प्रयोगात्मक और गणना की गई दरें उचित अनुबंध (एग्रीमेंट) में हैं।<ref>{{cite journal |last1 = Besora |first1= M. |last2= Harvey |first2= J.N. |title = Understanding the rate of spin-forbidden thermolysis of {{chem|HN|3}} and {{chem|CH|3|N|3}} |journal = Journal of Chemical Physics | volume = 129 | pages = 044303 | year = 2008 |issue= 4 | doi=10.1063/1.2953697|pmid= 18681642 }}</ref> | ||
== विषाक्तता == | == विषाक्तता == | ||
हाइड्रेजोइक | हाइड्रेजोइक अम्ल अस्थिर और अत्यधिक विषैला होता है। इसमें तीखी गंध होती है और इसके वाष्प से तेज [[सिरदर्द]] हो सकता है। यौगिक असंचयी जहर के रूप में कार्य करता है। | ||
== अनुप्रयोग == | == अनुप्रयोग == | ||
[[2-फ्यूरोनिट्राइल]], एक | [[2-फ्यूरोनिट्राइल|2-फ्यूरोनाइट्राइल]], एक औषध मध्यम और संभावित कृत्रिम मिठास (स्वीट्निंग) अवस्था को 35 °C पर [[बेंजीन]] के विलयन में मैग्नीशियम परक्लोरेट की उपस्थिति में हाइड्रोजोइक अम्ल ({{chem2|HN3}}) और [[परक्लोरिक अम्ल]] ({{chem2|HClO4}}) के मिश्रण के साथ [[फरफ्यूरल]] को संसाधित करके अच्छे उत्पाद में तैयार किया गया है।<ref>{{cite journal | author = P. A. Pavlov | title = Synthesis of 5-substituted furannitriles and their reaction with hydrazine | journal = Khimiya Geterotsiklicheskikh Soedinenii | volume = 2 | pages = 181–186 | year = 1986 |last2 = Kul'nevich | first2 = V. G.}}</ref><ref>{{cite journal | author = B. Bandgar | title = पानी में जैविक प्रतिक्रियाएँ। हल्के परिस्थितियों में एनबीएस का उपयोग करके एल्डिहाइड का नाइट्राइल में परिवर्तन| journal = Synthetic Communications | volume = 36 | pages = 1347–1352 | year = 2006 |last2 = Makone | first2 = S. | issue = 10 | doi=10.1080/00397910500522009| s2cid = 98593006 }}</ref> | ||
[[ | |||
सभी [[आयोडीन|गैस प्रावस्था आयोडीन लेजर]] (AGIL) उत्तेजित [[नाइट्रोजन क्लोराइड]] का उत्पादन करने के लिए [[क्लोरीन]] के साथ गैसीय हाइड्रेजोइक अम्ल को मिश्रित करता है, जो तब [[आयोडीन]] को लेस करने के लिए उपयोग किया जाता है; यह [[COIL लेज़रों]] की तरल रसायन संबंधी आवश्यकताओं से बचा जाता है। | |||
==संदर्भ== | ==संदर्भ== | ||
| Line 159: | Line 160: | ||
{{Hydrides by group}} | {{Hydrides by group}} | ||
{{Azides}} | {{Azides}} | ||
[[Category: | [[Category:Articles containing unverified chemical infoboxes]] | ||
[[Category:Articles without KEGG source]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Chembox having GHS data]] | |||
[[Category:Chemical articles with multiple compound IDs|B]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 19/05/2023]] | [[Category:Created On 19/05/2023]] | ||
[[Category:ECHA InfoCard ID from Wikidata]] | |||
[[Category:E number from Wikidata]] | |||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Multiple chemicals in an infobox that need indexing]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages using collapsible list with both background and text-align in titlestyle|background:transparent;font-weight:normal;text-align:left ]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Webarchive template wayback links]] | |||
[[Category:Wikipedia articles incorporating a citation from the 1911 Encyclopaedia Britannica with Wikisource reference]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:एज़ाइड्स]] | |||
[[Category:एसिड]] | |||
[[Category:दुर्गंधयुक्त रसायन]] | |||
[[Category:नाइट्रोजन हाइड्राइड्स]] | |||
[[Category:विस्फोटक गैसें]] | |||
[[Category:विस्फोटक रसायन]] | |||
Latest revision as of 18:49, 15 June 2023
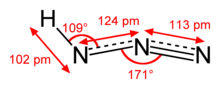
| |

| |

| |
| Names | |
|---|---|
| IUPAC name
हाइड्रेजोइक अम्ल
| |
| Other names
Hydrogen azide
Azoimide | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Number |
|
| 773 | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| HN3 | |
| Molar mass | 43.029 g·mol−1 |
| Appearance | colorless, highly volatile liquid |
| Density | 1.09 g/cm3 |
| Melting point | −80 °C (−112 °F; 193 K) |
| Boiling point | 37 °C (99 °F; 310 K) |
| highly soluble | |
| Solubility | soluble in alkali, alcohol, ether |
| Acidity (pKa) | 4.6 [1] |
| Conjugate base | Azide |
| Structure | |
| approximately linear | |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
Main hazards
|
Highly toxic, explosive, reactive |
| GHS labelling: | |
  
| |
| Danger | |
| H200, H319, H335, H370 | |
| P201, P202, P260, P261, P264, P270, P271, P280, P281, P304+P340, P305+P351+P338, P307+P311, P312, P321, P337+P313, P372, P373, P380, P401, P403+P233, P405, P501 | |
| NFPA 704 (fire diamond) | |
| Related compounds | |
Other cations
|
Sodium azide |
| Ammonia Hydrazine | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
हाइड्रेजोइक अम्ल, जिसे हाइड्रोजन एजाइड या ऐजोइमाइड के रूप में भी जाना जाता है,[2] जो रासायनिक सूत्र HN3 वाला यौगिक है|[3] यह कमरे के तापमान और दबाव में एक रंगहीन, अस्थिर और विस्फोटक तरल है। यह नाइट्रोजन और हाइड्रोजन का एक यौगिक है, और इसलिए एक निक्टोजन हाइड्राइड है। इसे पहली बार 1890 मेंथिओडोर कर्टियस द्वारा अलग किया गया था।[4] अम्ल के कुछ अनुप्रयोग हैं, लेकिन इसका संयुग्मी क्षार, एजाइड आयन, विशेष प्रक्रियाओं में उपयोगी है।
हाइड्रेजोइक अम्ल, अपने साथी खनिज अम्ल की तरह, जल में घुलनशील है। विशुद्ध (अनडाइल्यूटेड) हाइड्रेजोइक अम्ल खतरनाक रूप से विस्फोटक होता है[5] जिसमें निर्माण की एक मानक एन्थैल्पी ΔfHo (l, 298K) = +264 kJ/mol होती है।[6]तनु होने पर, गैस और जलीय विलयन (<10%) सुरक्षित रूप से तैयार किए जा सकते हैं लेकिन तुरंत उपयोग किए जाने चाहिए; इसके कम क्वथनांक के कारण, हाइड्रेजोइक अम्ल वाष्पीकरण और संघनन पर सम्पन्न होता है जैसे कि विस्फोट के लिए अक्षम तनु विलयन पात्र या रिएक्टर के हेडस्पेस में ड्रॉपलेट का निर्माण कर सकता है जो विस्फोट करने में सक्षम हैं।[7][8]
उत्पादन
अम्ल आमतौर पर सोडियम एज़ाइड जैसे एजाइड नमक के अम्लीकरण से बनता है। आम तौर पर जल में सोडियम एजाइड के विलयन में एज़ाइड नमक के साथ संतुलन में हाइड्रेजोइक अम्ल की ट्रेस मात्रा होती है, लेकिन एक प्रबल अम्ल की शुरूआत प्राथमिक वर्ग को हाइड्रेजोइक अम्ल के विलयन में परिवर्तित कर सकती है। बाद में शुद्ध अम्ल प्रभाजी आसवन द्वारा एक अत्यधिक विस्फोटक रंगहीन तरल के रूप में एक अप्रिय गंध के साथ प्राप्त किया जा सकता है।[2]
- NaN3 + HCl → HN3 + NaCl
अघुलनशील बेरियम सल्फ़ेट को छानकर तनु सल्फ्यूरिक अम्ल के साथ बेरियम एजाइड घोल की अभिक्रिया (ट्रीटमेंट) करके इसका जलीय विलयन भी तैयार किया जा सकता है।[9]
यह मूल रूप से नाइट्रस अम्ल के साथ जलीय हाइड्राज़ीन की अभिक्रिया से तैयार किया गया था:
- N2H4 + HNO2 → HN3 + 2 H2O
हाइड्राज़ीन धनायन [N2H5]+ के साथ यह अभिक्रिया इस प्रकार लिखी जाती है:
- [N2H5]+ + HNO2 → HN3 + H2O + [H3O]+
हाइड्रोजन परॉक्साइड, नाइट्रोसिल क्लोराइड, ट्राइक्लोरैमाइन या नाइट्रिक अम्ल जैसे अन्य ऑक्सीकारकों का भी हाइड्राज़ीन से हाइड्रेजोइक अम्ल का उत्पादन करने के लिए उपयोग किया जा सकता है।[10]
निराकरण से पूर्व विनाश
हाइड्रेजोइक अम्ल नाइट्रस अम्ल के साथ अभिक्रिया करता है:
- HN3 + HNO2 → N2O + N2 + H2O
यह अभिक्रिया असामान्य है क्योंकि इसमें चार अलग-अलग ऑक्सीकरण अवस्थाओं में नाइट्रोजन वाले यौगिक सम्मिलित हैं।[11]
अभिक्रियाएं
इसके गुणों में हाइड्रेजोइक अम्ल हैलोजन अम्ल के लिए कुछ सादृश्य दिखाता है, क्योंकि यह कम घुलनशील (जल में) सीसा, चांदी और पारा (I) लवण बनाता है। धात्विक लवण सभी निर्जल रूप में क्रिस्टलीकृत होते हैं और गर्म करने पर विघटित हो जाते हैं, जिससे शुद्ध धातु का अवशेष रह जाता है।[2]यह एक दुर्बल अम्ल (pKa = 4.75) है|[6] इसके भारी धातु के लवण विस्फोटक होते हैं और एल्काइल आयोडाइड्स के साथ आसानी से संपर्क करते हैं। भारी क्षार धातुओं (लिथियम को छोड़कर) या क्षारीय पृथ्वी धातुओं के एज़ाइड्स विस्फोटक नहीं होते हैं, लेकिन गर्म करने पर अधिक नियंत्रित तरीके से विघटित होते हैं, स्पैक्ट्रोस्कोप द्वारा शुद्ध N2 गैस छोड़ते हैं।[12] हाइड्रोजन की मुक्ति और लवण के निर्माण के साथ हाइड्रेजोइक अम्ल के विलयन कई धातुओं (जैसे जस्ता, लोहा) को घोलते हैं, जिन्हें एज़ाइड्स (पूर्व में ऐजोइमाइड या हाइड्राज़ोएट्स भी कहा जाता है) कहा जाता है।
नाइट्रोजन के निष्कासन के साथ, हाइड्रेजोइक अम्ल एल्डिहाइड, कीटोन्स और कार्बोक्सिलिक अम्ल सहित कार्बोनिल डेरिवेटिव के साथ एक ऐमीन या ऐमाइड देने के लिए अभिक्रिया कर सकता है, इसे श्मिट अभिक्रिया या श्मिट पुनर्व्यवस्था कहा जाता है।
सबसे प्रबल अम्लों में घुलने से एमिनोडायज़ोनियम आयन [H2N=N=N]+ ⇌ [H2N−N≡N]+, युक्त विस्फोटक लवण उत्पन्न होते हैं, उदाहरण के लिए:[12]
- HN=N=N + H[SbCl6] → [H2N=N=N]+[SbCl6]−
आयन [H2N=N=N]+ डाइऐजोमेथेन H2C=N+=N− के लिए समइलेक्ट्रॉनी है।
झटके, घर्षण, चिंगारी (स्पार्क) आदि से उत्प्रेरित हाइड्रेजोइक अम्ल का अपघटन नाइट्रोजन और हाइड्रोजन का उत्पादन करता है:
- 2 HN3 → H2 + 3 N2
हाइड्रेजोइक अम्ल पर्याप्त ऊर्जा पर एकाण्विक अपघटन से गुजरता है:
- HN3 → NH + N2
निम्नतम ऊर्जा मार्ग NH को त्रिक अवस्था में उत्पन्न करता है, जिससे यह स्पिन-वर्जित अभिक्रिया बन जाती है। यह उन कुछ अभिक्रियाओं में से एक है, जिनकी दर लेजर प्रकाशिक वियोजन अध्ययन द्वारा जमीनी इलेक्ट्रॉनिक स्थिति में विशिष्ट मात्रा में कंपन ऊर्जा के लिए निर्धारित की गई है|[13] इसके अलावा, इन असमान आणविक दरों का सैद्धांतिक रूप से विश्लेषण किया गया है, और प्रयोगात्मक और गणना की गई दरें उचित अनुबंध (एग्रीमेंट) में हैं।[14]
विषाक्तता
हाइड्रेजोइक अम्ल अस्थिर और अत्यधिक विषैला होता है। इसमें तीखी गंध होती है और इसके वाष्प से तेज सिरदर्द हो सकता है। यौगिक असंचयी जहर के रूप में कार्य करता है।
अनुप्रयोग
2-फ्यूरोनाइट्राइल, एक औषध मध्यम और संभावित कृत्रिम मिठास (स्वीट्निंग) अवस्था को 35 °C पर बेंजीन के विलयन में मैग्नीशियम परक्लोरेट की उपस्थिति में हाइड्रोजोइक अम्ल (HN3) और परक्लोरिक अम्ल (HClO4) के मिश्रण के साथ फरफ्यूरल को संसाधित करके अच्छे उत्पाद में तैयार किया गया है।[15][16]
सभी गैस प्रावस्था आयोडीन लेजर (AGIL) उत्तेजित नाइट्रोजन क्लोराइड का उत्पादन करने के लिए क्लोरीन के साथ गैसीय हाइड्रेजोइक अम्ल को मिश्रित करता है, जो तब आयोडीन को लेस करने के लिए उपयोग किया जाता है; यह COIL लेज़रों की तरल रसायन संबंधी आवश्यकताओं से बचा जाता है।
संदर्भ
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ 2.0 2.1 2.2 Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica (in English). Vol. 3 (11th ed.). Cambridge University Press. pp. 82–83. This also contains a detailed description of the contemporaneous production process.
- ↑ अकार्बनिक और Organometallic यौगिकों का शब्दकोश. Chapman & Hall.
- ↑ Curtius, Theodor (1890). "Ueber Stickstoffwasserstoffsäure (Azoimid) N3H" [On hydrazoic acid (azoimide) N3H]. Berichte der Deutschen Chemischen Gesellschaft. 23 (2): 3023–3033. doi:10.1002/cber.189002302232.
- ↑ Furman, David; Dubnikova, Faina; van Duin, Adri C. T.; Zeiri, Yehuda; Kosloff, Ronnie (2016-03-10). "विस्फोट रसायन विज्ञान के अनुप्रयोगों के साथ तरल हाइड्रोजोइक एसिड के लिए प्रतिक्रियाशील बल क्षेत्र". The Journal of Physical Chemistry C. 120 (9): 4744–4752. Bibcode:2016APS..MARH20013F. doi:10.1021/acs.jpcc.5b10812. ISSN 1932-7447. S2CID 102029987.
- ↑ 6.0 6.1 Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. p. 449. ISBN 978-0-13-175553-6.
- ↑ Gonzalez-Bobes, F. et al Org. Process Res. Dev. 2012, 16, 2051-2057.
- ↑ Treitler, D. S. et al Org. Process Res. Dev. 2017, 21, 460-467.
- ↑ L . F. Audrieth, C. F. Gibbs Hydrogen Azide in Aqueous and Ethereal Solution" Inorganic Syntheses 1939, vol. 1, pp. 71-79.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 432. ISBN 978-0-08-037941-8.
- ↑ Greenwood, pp. 461–464.
- ↑ 12.0 12.1 Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). "The Nitrogen Group". Inorganic chemistry. Academic Press. p. 625. ISBN 978-0-12-352651-9.
- ↑ Foy, B.R.; Casassa, M.P.; Stephenson, J.C.; King, D.S. (1990). "Overtone-excited HN
3 (X1A') - Anharmonic resonance, homogeneous linewidths, and dissociation rates". Journal of Chemical Physics. 92: 2782–2789. doi:10.1063/1.457924. - ↑ Besora, M.; Harvey, J.N. (2008). "Understanding the rate of spin-forbidden thermolysis of HN
3 and CH
3N
3". Journal of Chemical Physics. 129 (4): 044303. doi:10.1063/1.2953697. PMID 18681642. - ↑ P. A. Pavlov; Kul'nevich, V. G. (1986). "Synthesis of 5-substituted furannitriles and their reaction with hydrazine". Khimiya Geterotsiklicheskikh Soedinenii. 2: 181–186.
- ↑ B. Bandgar; Makone, S. (2006). "पानी में जैविक प्रतिक्रियाएँ। हल्के परिस्थितियों में एनबीएस का उपयोग करके एल्डिहाइड का नाइट्राइल में परिवर्तन". Synthetic Communications. 36 (10): 1347–1352. doi:10.1080/00397910500522009. S2CID 98593006.
बाहरी संबंध
 Media related to हाइड्रोज़ोइक एसिड at Wikimedia Commons
Media related to हाइड्रोज़ोइक एसिड at Wikimedia Commons- OSHA: Hydrazoic Acid Archived 2008-04-04 at the Wayback Machine


