रूथेनियम टेट्रोक्साइड: Difference between revisions
No edit summary |
No edit summary |
||
| (3 intermediate revisions by 3 users not shown) | |||
| Line 47: | Line 47: | ||
}} | }} | ||
रूथेनियम टेट्रोक्साइड सूत्र RuO<sub>4</sub>के साथ [[अकार्बनिक यौगिक]] है यह एक पीला अस्थिर ठोस है जो कमरे के तापमान के पास पिघलता है।<ref name=Brauer>{{cite book|author=H. L. Grube|chapter=Ruthenium (VIII) Oxide|title=Handbook of Preparative Inorganic Chemistry, 2nd Ed. |editor=G. Brauer|publisher=Academic Press|year=1963|place=NY|volume=1|pages=1599–1600}}</ref> इसमें ओजोन की गंध होती है।<ref name="Backman_2004" />नमूने विशिष्ट रूप से अशुद्धियों के कारण काले होते हैं। अनुरूप OsO<sub>4</sub>अधिक व्यापक रूप से उपयोग किया जाता है और बेहतर जाना जाता है। यह [[Index.php?title=हाइपररूथेनिक अम्ल|हाइपररूथेनिक अम्ल]] (H<sub>2</sub>RuO<sub>5</sub>) का एनहाइड्राइड भी | रूथेनियम टेट्रोक्साइड सूत्र RuO<sub>4</sub>के साथ [[अकार्बनिक यौगिक]] है यह एक पीला अस्थिर ठोस है जो कमरे के तापमान के पास पिघलता है।<ref name=Brauer>{{cite book|author=H. L. Grube|chapter=Ruthenium (VIII) Oxide|title=Handbook of Preparative Inorganic Chemistry, 2nd Ed. |editor=G. Brauer|publisher=Academic Press|year=1963|place=NY|volume=1|pages=1599–1600}}</ref> इसमें ओजोन की गंध होती है।<ref name="Backman_2004" />नमूने विशिष्ट रूप से अशुद्धियों के कारण काले होते हैं। अनुरूप OsO<sub>4</sub>अधिक व्यापक रूप से उपयोग किया जाता है और बेहतर जाना जाता है। यह [[Index.php?title=हाइपररूथेनिक अम्ल|हाइपररूथेनिक अम्ल]] (H<sub>2</sub>RuO<sub>5</sub>) का एनहाइड्राइड भी है। कुछ विलायक में से एक जिसमें RuO<sub>4</sub> स्थिर विलयन बनाता है CCl<sub>4</sub> है। <ref name=EROS>{{Cite book | last1 = Martín | first1 = V. S. | last2 = Palazón | first2 = J. M. | last3 = Rodríguez | first3 = C. M. | last4 = Nevill | first4 = C. R. | chapter = Ruthenium(VIII) Oxide | doi = 10.1002/047084289X.rr009.pub2 | title = कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश| year = 2006 | isbn = 978-0471936237 }}</ref> | ||
| Line 54: | Line 54: | ||
:8 Ru<sup>3+</sup>(aq) + 5IO<sub>4</sub><sup>−</sup>(aq) + 12H<sub>2</sub>O (l) → 8RuO<sub>4</sub>(s) + 5 I<sup>−</sup>(aq) + 24 H<sup>+</sup>(aq)<ref>{{Cite journal |last=Carlsen |first=Per H. J. |last2=Katsuki |first2=Tsutomu |last3=Martin |first3=Victor S. |last4=Sharpless |first4=K. Barry |date=September 1981 |title=कार्बनिक यौगिकों के रूथेनियम टेट्रोक्साइड उत्प्रेरित ऑक्सीकरण के लिए एक बहुत बेहतर प्रक्रिया|url=https://pubs.acs.org/doi/abs/10.1021/jo00332a045 |journal=The Journal of Organic Chemistry |language=en |volume=46 |issue=19 |pages=3936–3938 |doi=10.1021/jo00332a045 |issn=0022-3263}}</ref> | :8 Ru<sup>3+</sup>(aq) + 5IO<sub>4</sub><sup>−</sup>(aq) + 12H<sub>2</sub>O (l) → 8RuO<sub>4</sub>(s) + 5 I<sup>−</sup>(aq) + 24 H<sup>+</sup>(aq)<ref>{{Cite journal |last=Carlsen |first=Per H. J. |last2=Katsuki |first2=Tsutomu |last3=Martin |first3=Victor S. |last4=Sharpless |first4=K. Barry |date=September 1981 |title=कार्बनिक यौगिकों के रूथेनियम टेट्रोक्साइड उत्प्रेरित ऑक्सीकरण के लिए एक बहुत बेहतर प्रक्रिया|url=https://pubs.acs.org/doi/abs/10.1021/jo00332a045 |journal=The Journal of Organic Chemistry |language=en |volume=46 |issue=19 |pages=3936–3938 |doi=10.1021/jo00332a045 |issn=0022-3263}}</ref> | ||
इसकी चुनौतीपूर्ण अभिक्रियाशीलता के कारण, RuO<sub>4</sub> यह हमेशा सीटू में उत्पन्न होता है और कम से कम कार्बनिक अभिक्रियाओं में उत्प्रेरक मात्रा में उपयोग किया जाता है।<ref name=EROS/> | इसकी चुनौतीपूर्ण अभिक्रियाशीलता के कारण, RuO<sub>4</sub> यह हमेशा सीटू में उत्पन्न होता है और कम से कम कार्बनिक अभिक्रियाओं में उत्प्रेरक मात्रा में उपयोग किया जाता है।<ref name=EROS/> | ||
== संरचना == | == संरचना == | ||
| Line 63: | Line 62: | ||
RuO<sub>4</sub> का मुख्य व्यावसायिक मान [[Index.php?title=रूथेनियम|रूथेनियम]] यौगिकों और अयस्कों से धातु के उत्पादन में एक मध्यवर्ती के रूप में है। अन्य [[प्लेटिनम समूह धातु]]ओं (पीजीएम) की तरह, रूथेनियम कम सांद्रता में होता है और प्रायःअन्य पीजीएम के साथ मिश्रित होता है। OsO<sub>4</sub> के साथ में , इसे क्लोरीन-ऑक्सीडाइज़्ड अर्क के आसवन द्वारा अन्य PGM से अलग किया जाता है। रूथेनियम को RuO<sub>4</sub>को [[Index.php?title=हाइड्रोक्लोरिक अम्ल|हाइड्रोक्लोरिक अम्ल]] के साथ अपचयित करके OsO<sub>4</sub> से अलग किया जाता है , एक प्रक्रिया जो [RuO<sub>4</sub>]<sup>0/-</sup> युगल के लिए अत्यधिक सकारात्मक अपचयन क्षमता का फायदा उठाती है।<ref>{{cite journal | doi = 10.1016/j.reactfunctpolym.2005.05.011| title = प्लैटिनम-समूह धातुओं को उनके क्लोरो-कॉम्प्लेक्स के माध्यम से अलग करने के तरीकों की समीक्षा| journal = Reactive and Functional Polymers| volume = 65| issue = 3| pages = 205–217| year = 2005| last1 = Bernardis| first1 = Francesco L.| last2 = Grant| first2 = Richard A.| last3 = Sherrington| first3 = David C.}}</ref><ref>{{cite journal|author1=Swain, P. |author2=Mallika, C. |author3=Srinivasan, R. |author4=Mudali, U. K. |author5=Natarajan, R. |title=Separation and recovery of ruthenium: a review|journal=Journal of Radioanalytical and Nuclear Chemistry |year=2013|volume=298|issue=2|pages=781–796|doi=10.1007/s10967-013-2536-5|s2cid=95804621}}</ref> | RuO<sub>4</sub> का मुख्य व्यावसायिक मान [[Index.php?title=रूथेनियम|रूथेनियम]] यौगिकों और अयस्कों से धातु के उत्पादन में एक मध्यवर्ती के रूप में है। अन्य [[प्लेटिनम समूह धातु]]ओं (पीजीएम) की तरह, रूथेनियम कम सांद्रता में होता है और प्रायःअन्य पीजीएम के साथ मिश्रित होता है। OsO<sub>4</sub> के साथ में , इसे क्लोरीन-ऑक्सीडाइज़्ड अर्क के आसवन द्वारा अन्य PGM से अलग किया जाता है। रूथेनियम को RuO<sub>4</sub>को [[Index.php?title=हाइड्रोक्लोरिक अम्ल|हाइड्रोक्लोरिक अम्ल]] के साथ अपचयित करके OsO<sub>4</sub> से अलग किया जाता है , एक प्रक्रिया जो [RuO<sub>4</sub>]<sup>0/-</sup> युगल के लिए अत्यधिक सकारात्मक अपचयन क्षमता का फायदा उठाती है।<ref>{{cite journal | doi = 10.1016/j.reactfunctpolym.2005.05.011| title = प्लैटिनम-समूह धातुओं को उनके क्लोरो-कॉम्प्लेक्स के माध्यम से अलग करने के तरीकों की समीक्षा| journal = Reactive and Functional Polymers| volume = 65| issue = 3| pages = 205–217| year = 2005| last1 = Bernardis| first1 = Francesco L.| last2 = Grant| first2 = Richard A.| last3 = Sherrington| first3 = David C.}}</ref><ref>{{cite journal|author1=Swain, P. |author2=Mallika, C. |author3=Srinivasan, R. |author4=Mudali, U. K. |author5=Natarajan, R. |title=Separation and recovery of ruthenium: a review|journal=Journal of Radioanalytical and Nuclear Chemistry |year=2013|volume=298|issue=2|pages=781–796|doi=10.1007/s10967-013-2536-5|s2cid=95804621}}</ref> | ||
=== कार्बनिक रसायन === | === कार्बनिक रसायन === | ||
RuO<sub>4</sub> का कार्बनिक रसायन शास्त्र में विशेष महत्व है क्योंकि यह लगभग किसी भी हाइड्रोकार्बन को ऑक्सीकरण करता है। उदाहरण के लिए, यह एडामेंटेन को 1-एडामैंटानॉल में ऑक्सीकृत करेगा। क्योंकि यह इतना आक्रामक आक्सीकारक है, अभिक्रिया की स्थिति हल्की होनी चाहिए, सामान्यतः कमरे के तापमान पर होनी चाहिए।यद्यपि एक मजबूत आक्सीकारक, RuO<sub>4</sub> ऑक्सीकरण [[स्टीरियोसेंटर]] को परेशान नहीं करते हैं जो ऑक्सीकृत नहीं होते हैं। एक [[Index.php?title=कार्बोज़ाइलिक अम्ल|कार्बोज़ाइलिक अम्ल]] के लिए निम्नलिखित डायोल ऑक्सीकरण का उदाहरण है: | RuO<sub>4</sub> का कार्बनिक रसायन शास्त्र में विशेष महत्व है क्योंकि यह लगभग किसी भी हाइड्रोकार्बन को ऑक्सीकरण करता है। उदाहरण के लिए, यह एडामेंटेन को 1-एडामैंटानॉल में ऑक्सीकृत करेगा। क्योंकि यह इतना आक्रामक आक्सीकारक है, अभिक्रिया की स्थिति हल्की होनी चाहिए, सामान्यतः कमरे के तापमान पर होनी चाहिए।यद्यपि एक मजबूत आक्सीकारक, RuO<sub>4</sub> ऑक्सीकरण [[स्टीरियोसेंटर]] को परेशान नहीं करते हैं जो ऑक्सीकृत नहीं होते हैं। एक [[Index.php?title=कार्बोज़ाइलिक अम्ल|कार्बोज़ाइलिक अम्ल]] के लिए निम्नलिखित डायोल ऑक्सीकरण का उदाहरण है: | ||
| Line 80: | Line 78: | ||
यद्यपि RuO<sub>4</sub> की अपेक्षाकृत उच्च लागत के कारण यह प्रत्यक्ष आक्सीकारक के रूप में उपयोग किया जाता है इसे एक को सहऑक्सीकारक के साथ [[उत्प्रेरक]] के रूप में भी उपयोग किया जाता है। RuO<sub>4</sub> के साथ चक्रीय अल्कोहल के ऑक्सीकरण के लिए एक उत्प्रेरक के रूप में और [[ब्रोमेट]] [[Index.php?title=क्षार|क्षार]] स्थितियों के तहत आक्सीकारक के रूप में, RuO<sub>4</sub> पहले हाइड्रॉक्साइड द्वारा सक्रिय किया जाता है, हाइपररूथनेट आयनों में बदल जाता है: | यद्यपि RuO<sub>4</sub> की अपेक्षाकृत उच्च लागत के कारण यह प्रत्यक्ष आक्सीकारक के रूप में उपयोग किया जाता है इसे एक को सहऑक्सीकारक के साथ [[उत्प्रेरक]] के रूप में भी उपयोग किया जाता है। RuO<sub>4</sub> के साथ चक्रीय अल्कोहल के ऑक्सीकरण के लिए एक उत्प्रेरक के रूप में और [[ब्रोमेट]] [[Index.php?title=क्षार|क्षार]] स्थितियों के तहत आक्सीकारक के रूप में, RuO<sub>4</sub> पहले हाइड्रॉक्साइड द्वारा सक्रिय किया जाता है, हाइपररूथनेट आयनों में बदल जाता है: | ||
RuO<sub>4</sub> + OH<sup>−</sup> → HRuO<sub>5</sub><sup>−</sup> | |||
अभिक्रिया एक ग्लाइकोलेट कॉम्प्लेक्स के माध्यम से आगे बढ़ती है। | अभिक्रिया एक ग्लाइकोलेट कॉम्प्लेक्स के माध्यम से आगे बढ़ती है। | ||
| Line 89: | Line 88: | ||
== परमाणु दुर्घटनाओं द्वारा गैसीय विमोचन == | == परमाणु दुर्घटनाओं द्वारा गैसीय विमोचन == | ||
रूथेनियम टेट्रोक्साइड की बहुत अधिक अस्थिरता के कारण ({{chem|Ru|O|4}}) [[रूथेनियम के समस्थानिक]] | रूथेनियम टेट्रोक्साइड की बहुत अधिक अस्थिरता के कारण ({{chem|Ru|O|4}}) [[रूथेनियम के समस्थानिक]] को उनके अपेक्षाकृत कम आधे जीवन के साथ परमाणु दुर्घटना द्वारा जारी होने की स्थिति में आयोडीन-131 के बाद दूसरा सबसे खतरनाक गैसीय समस्थानिक माना जाता है।<ref name="Ronneau_1995">{{Cite journal|url=https://doi.org/10.1016/0265-931X(95)91633-F|doi=10.1016/0265-931X(95)91633-F|title=परमाणु ईंधन से रूथेनियम का ऑक्सीकरण-वर्धित उत्सर्जन|year=1995|last1=Ronneau|first1=C.|last2=Cara|first2=J.|last3=Rimski-Korsakov|first3=A.|journal=Journal of Environmental Radioactivity|volume=26|pages=63–70}}</ref><ref name="Backman_2004">बैकमैन, यू., लिपोनेन, एम., औविनेन, ए., जोकिनीमी, जे., और ज़िलियाकस, आर. (2004)। [https://inis.iaea.org/collection/NCLCollectionStore/_Public/36/031/36031958.pdf गंभीर परमाणु दुर्घटना स्थितियों में रूथेनियम व्यवहार]। अंतिम रिपोर्ट (संख्या एनकेएस-100)। नॉर्डिक परमाणु सुरक्षा अनुसंधान।</ref><ref name="Beuzet_2012">बेज़ेट, ई।, लैमी, जे.एस., पेरोन, एच।, सिमोनी, ई।, और डुक्रोस, जी। (2012)। [https://www.academia.edu/download/50047444/Ruthenium_release_modelling_in_air_and_s20161101-1709-kv6n0y.pdf MAAP4 कोड का उपयोग करके गंभीर दुर्घटना की स्थिति में रूथेनियम रिलीज़ मॉडलिंग]{{dead link|date=July 2022|bot=medic}}{{cbignore|bot=medic}}. न्यूक्लियर इंजीनियरिंग एंड डिजाइन, 246, 157-162।</ref> रूथेनियम के दो सबसे महत्वपूर्ण रेडियोधर्मी समस्थानिक हैं <sup>103</sup>Ru और <sup>106</sup>Ru इनकी अर्ध-आयु क्रमशः 39.6 दिन और 373.6 दिन होती है।<ref name="Backman_2004" /> | ||
| Line 101: | Line 100: | ||
* {{Cite journal | last1 = Singh | first1 = B. | last2 = Srivastava | first2 = S. | doi = 10.1007/BF01129466 | title = Kinetics and mechanism of ruthenium tetroxide catalysed oxidation of cyclic alcohols by bromate in a base | journal = Transition Metal Chemistry | volume = 16 | issue = 4 | pages = 466 | year = 1991 | s2cid = 95711945 }} | * {{Cite journal | last1 = Singh | first1 = B. | last2 = Srivastava | first2 = S. | doi = 10.1007/BF01129466 | title = Kinetics and mechanism of ruthenium tetroxide catalysed oxidation of cyclic alcohols by bromate in a base | journal = Transition Metal Chemistry | volume = 16 | issue = 4 | pages = 466 | year = 1991 | s2cid = 95711945 }} | ||
* {{cite journal |last1= Courtney|first1= J.L.|last2= Swansbor|first2= K.F.|year= 1972|title= Ruthenium tetroxide oxidation|journal= Reviews of Pure and Applied Chemistry|volume= 22|page= 47}} | * {{cite journal |last1= Courtney|first1= J.L.|last2= Swansbor|first2= K.F.|year= 1972|title= Ruthenium tetroxide oxidation|journal= Reviews of Pure and Applied Chemistry|volume= 22|page= 47}} | ||
[[Category:All articles with dead external links]] | [[Category:All articles with dead external links]] | ||
| Line 111: | Line 107: | ||
[[Category:Articles without EBI source]] | [[Category:Articles without EBI source]] | ||
[[Category:Articles without KEGG source]] | [[Category:Articles without KEGG source]] | ||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Collapse templates]] | [[Category:Collapse templates]] | ||
[[Category:Created On 23/05/2023]] | [[Category:Created On 23/05/2023]] | ||
[[Category:ECHA InfoCard ID from Wikidata]] | |||
[[Category:E number from Wikidata]] | |||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | [[Category:Machine Translated Page]] | ||
[[Category:Navigational boxes| ]] | [[Category:Navigational boxes| ]] | ||
[[Category:Pages using collapsible list with both background and text-align in titlestyle|background:transparent;font-weight:normal;text-align:left ]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
Latest revision as of 17:31, 28 June 2023
|
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Ruthenium(VIII) oxide
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| EC Number |
| ||
PubChem CID
|
|||
| UNII | |||
| |||
| |||
| Properties | |||
| RuO4 | |||
| Molar mass | 165.07 g/mol | ||
| Appearance | yellow easily melting solid | ||
| Odor | pungent | ||
| Density | 3.29 g/cm3 | ||
| Melting point | 25.4 °C (77.7 °F; 298.5 K) | ||
| Boiling point | 40.0 °C (104.0 °F; 313.1 K) | ||
| 2% w/v at 20 °C | |||
| Solubility in other solvents | Soluble in Carbon tetrachloride Chloroform | ||
| Structure | |||
| tetrahedral | |||
| zero | |||
| Hazards | |||
| NFPA 704 (fire diamond) | |||
| Safety data sheet (SDS) | external MSDS sheet | ||
| Related compounds | |||
Related compounds
|
Ruthenium dioxide Ruthenium trichloride | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
रूथेनियम टेट्रोक्साइड सूत्र RuO4के साथ अकार्बनिक यौगिक है यह एक पीला अस्थिर ठोस है जो कमरे के तापमान के पास पिघलता है।[1] इसमें ओजोन की गंध होती है।[2]नमूने विशिष्ट रूप से अशुद्धियों के कारण काले होते हैं। अनुरूप OsO4अधिक व्यापक रूप से उपयोग किया जाता है और बेहतर जाना जाता है। यह हाइपररूथेनिक अम्ल (H2RuO5) का एनहाइड्राइड भी है। कुछ विलायक में से एक जिसमें RuO4 स्थिर विलयन बनाता है CCl4 है। [3]
तैयारी
रूथेनियम (III) क्लोराइड के NaIO के साथ ऑक्सीकरण द्वारा RuO4 तैयार किया जाता है
- 8 Ru3+(aq) + 5IO4−(aq) + 12H2O (l) → 8RuO4(s) + 5 I−(aq) + 24 H+(aq)[4]
इसकी चुनौतीपूर्ण अभिक्रियाशीलता के कारण, RuO4 यह हमेशा सीटू में उत्पन्न होता है और कम से कम कार्बनिक अभिक्रियाओं में उत्प्रेरक मात्रा में उपयोग किया जाता है।[3]
संरचना
RuO4 दो क्रिस्टल संरचनाएं बनाता है, एक घन समरूपता के साथ और दूसरा एकनताक्ष समरूपता के साथ, जो OsO4 के लिए समप्ररूपी है।अणु एक टेट्राहेड्रल आणविक ज्यामिति को अपनाता है, जिसमें Ru–O दूरी 169 से 170 प्रति मीटर तक होती है।[5]
उपयोग
रूथेनियम का अयस्कों से अलगाव
RuO4 का मुख्य व्यावसायिक मान रूथेनियम यौगिकों और अयस्कों से धातु के उत्पादन में एक मध्यवर्ती के रूप में है। अन्य प्लेटिनम समूह धातुओं (पीजीएम) की तरह, रूथेनियम कम सांद्रता में होता है और प्रायःअन्य पीजीएम के साथ मिश्रित होता है। OsO4 के साथ में , इसे क्लोरीन-ऑक्सीडाइज़्ड अर्क के आसवन द्वारा अन्य PGM से अलग किया जाता है। रूथेनियम को RuO4को हाइड्रोक्लोरिक अम्ल के साथ अपचयित करके OsO4 से अलग किया जाता है , एक प्रक्रिया जो [RuO4]0/- युगल के लिए अत्यधिक सकारात्मक अपचयन क्षमता का फायदा उठाती है।[6][7]
कार्बनिक रसायन
RuO4 का कार्बनिक रसायन शास्त्र में विशेष महत्व है क्योंकि यह लगभग किसी भी हाइड्रोकार्बन को ऑक्सीकरण करता है। उदाहरण के लिए, यह एडामेंटेन को 1-एडामैंटानॉल में ऑक्सीकृत करेगा। क्योंकि यह इतना आक्रामक आक्सीकारक है, अभिक्रिया की स्थिति हल्की होनी चाहिए, सामान्यतः कमरे के तापमान पर होनी चाहिए।यद्यपि एक मजबूत आक्सीकारक, RuO4 ऑक्सीकरण स्टीरियोसेंटर को परेशान नहीं करते हैं जो ऑक्सीकृत नहीं होते हैं। एक कार्बोज़ाइलिक अम्ल के लिए निम्नलिखित डायोल ऑक्सीकरण का उदाहरण है:
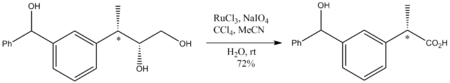
- एपॉक्साइड अल्कोहल का ऑक्सीकरण एपॉक्साइड रिंग के निम्नीकरण के बिना भी होता है:
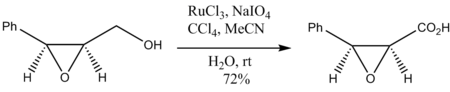
- मृदु परिस्थितियों में, ऑक्सीडेटिव अभिक्रिया इसके बदले में एल्डिहाइड पैदा करती है। RuO4 माध्यमिक अल्कोहल को आसानी से कीटोन्स में परिवर्तित करता है।यद्यपि इसी तरह के परिणाम अन्य सस्ते आक्सीकारक जैसे कि पाइरिडिनियम क्लोरोक्रोमेट- या डाइमिथाइल सल्फ़ोक्साइड आक्सीकारक, के साथ प्राप्त किए जा सकते हैं।RuO4 आदर्श है जब एक बहुत जोरदार आक्सीकारक की आवश्यकता होती है, लेकिन मृदु स्थिति बनाए रखनी चाहिए। इसका उपयोग कार्बनिक संश्लेषण में आंतरिक अल्केन्स को 1,2-डाइकेटोन्स और टर्मिनल एल्केनीज़ को प्राथमिक अल्कोहल के साथ कार्बोक्जिलिक अम्ल में ऑक्सीकरण करने के लिए किया जाता है। जब इस तरीके से उपयोग किया जाता है, तो रूथेनियम (VIII) ऑक्साइड का उपयोग उत्प्रेरक मात्रा में किया जाता है और रूथेनियम (III) क्लोराइड और ऐसीटोनाइट्राइल, जल और कार्बन टेट्राक्लोराइड के विलायक मिश्रण में सोडियम पीरियोडेट को मिलाकर पुन: उत्पन्न किया जाता है। RuO4 ओजोनोलिसिस के समान एक तरीके से कार्बोनिल उत्पादों का उत्पादन करने के लिए आसानी से दोहरे बंधनों को तोड़ता है। ऑस्मियम टेट्रोक्साइड|OsO4, एक अधिक सामान्य आक्सीकारक है जो संरचनात्मक रूप से RuO4 के समान, दोहरे बंधनों को विभाजित नहीं करता है, इसके बदले में वाइसिनल (रसायन विज्ञान) डायोल उत्पादों का उत्पादन करता है।यद्यपि, कम अभिक्रिया समय और सावधानीपूर्वक नियंत्रित स्थितियों के साथ, RuO4 डाइहाइड्रॉक्सिलेशन के लिए भी इस्तेमाल किया जा सकता है।[8]
क्योंकि RuO4 C-C बंध के डायहाइड्रॉक्सिलेशन और विपाटन द्वारा एरेन्स (विशेष रूप से इलेक्ट्रॉन-समृद्ध वाले) के दोहरे बंधनों को कम कर देता है, जिस तरह से कुछ अन्य अभिकर्मक कर सकते हैं, यह कार्बोक्जिलिक अम्ल के लिए विरक्षण अभिकर्मक के रूप में उपयोगी है जो एरील समूह (विशिष्ट रूप से फिनाइल या पी) के रूप में प्रच्छन्न होते हैं। -मेथॉक्सीफेनिल)। क्योंकि बनने वाले टुकड़े RuO4 द्वारा स्वयं आसानी से ऑक्सीकरण योग्य होते हैं कार्बन डाइऑक्साइड बनाने के लिए एरेन कार्बन परमाणुओं का एक बड़ा अंश संपूर्ण ऑक्सीकरण से गुजरता है। नतीजतन, परिवर्तन की यथार्थता को सीमित करते हुए, कार्बोक्जिलिक अम्ल में पूर्ण रूपांतरण प्राप्त करने के लिए टर्मिनल आक्सीकारक (प्रायः 10 समतुल्य प्रति एरील रिंग से अधिक) के कई समकक्षों की आवश्यकता होती है।[9][10][11]
यद्यपि RuO4 की अपेक्षाकृत उच्च लागत के कारण यह प्रत्यक्ष आक्सीकारक के रूप में उपयोग किया जाता है इसे एक को सहऑक्सीकारक के साथ उत्प्रेरक के रूप में भी उपयोग किया जाता है। RuO4 के साथ चक्रीय अल्कोहल के ऑक्सीकरण के लिए एक उत्प्रेरक के रूप में और ब्रोमेट क्षार स्थितियों के तहत आक्सीकारक के रूप में, RuO4 पहले हाइड्रॉक्साइड द्वारा सक्रिय किया जाता है, हाइपररूथनेट आयनों में बदल जाता है:
RuO4 + OH− → HRuO5−
अभिक्रिया एक ग्लाइकोलेट कॉम्प्लेक्स के माध्यम से आगे बढ़ती है।
अन्य उपयोग
रूथेनियम टेट्रोक्साइड एक संभावित धुंधला एजेंट है। इसका उपयोग वसायुक्त तेलों या प्रिंट के वसामय प्रदूषकों में निहित वसा के संपर्क में आने पर भूरे/काले रूथेनियम डाइऑक्साइड में बदल कर अव्यक्त उंगलियों के निशान को उजागर करने के लिए किया जाता है।[12]
परमाणु दुर्घटनाओं द्वारा गैसीय विमोचन
रूथेनियम टेट्रोक्साइड की बहुत अधिक अस्थिरता के कारण (RuO
4) रूथेनियम के समस्थानिक को उनके अपेक्षाकृत कम आधे जीवन के साथ परमाणु दुर्घटना द्वारा जारी होने की स्थिति में आयोडीन-131 के बाद दूसरा सबसे खतरनाक गैसीय समस्थानिक माना जाता है।[13][2][14] रूथेनियम के दो सबसे महत्वपूर्ण रेडियोधर्मी समस्थानिक हैं 103Ru और 106Ru इनकी अर्ध-आयु क्रमशः 39.6 दिन और 373.6 दिन होती है।[2]
संदर्भ
- ↑ H. L. Grube (1963). "Ruthenium (VIII) Oxide". In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 1. NY: Academic Press. pp. 1599–1600.
- ↑ 2.0 2.1 2.2 बैकमैन, यू., लिपोनेन, एम., औविनेन, ए., जोकिनीमी, जे., और ज़िलियाकस, आर. (2004)। गंभीर परमाणु दुर्घटना स्थितियों में रूथेनियम व्यवहार। अंतिम रिपोर्ट (संख्या एनकेएस-100)। नॉर्डिक परमाणु सुरक्षा अनुसंधान।
- ↑ 3.0 3.1 Martín, V. S.; Palazón, J. M.; Rodríguez, C. M.; Nevill, C. R. (2006). "Ruthenium(VIII) Oxide". कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश. doi:10.1002/047084289X.rr009.pub2. ISBN 978-0471936237.
- ↑ Carlsen, Per H. J.; Katsuki, Tsutomu; Martin, Victor S.; Sharpless, K. Barry (September 1981). "कार्बनिक यौगिकों के रूथेनियम टेट्रोक्साइड उत्प्रेरित ऑक्सीकरण के लिए एक बहुत बेहतर प्रक्रिया". The Journal of Organic Chemistry (in English). 46 (19): 3936–3938. doi:10.1021/jo00332a045. ISSN 0022-3263.
- ↑ Pley, M.; Wickleder, M. S. (2005). "Two Crystalline Modifications of RuO4". Journal of Solid State Chemistry. 178 (10): 3206–3209. Bibcode:2005JSSCh.178.3206P. doi:10.1016/j.jssc.2005.07.021.
- ↑ Bernardis, Francesco L.; Grant, Richard A.; Sherrington, David C. (2005). "प्लैटिनम-समूह धातुओं को उनके क्लोरो-कॉम्प्लेक्स के माध्यम से अलग करने के तरीकों की समीक्षा". Reactive and Functional Polymers. 65 (3): 205–217. doi:10.1016/j.reactfunctpolym.2005.05.011.
- ↑ Swain, P.; Mallika, C.; Srinivasan, R.; Mudali, U. K.; Natarajan, R. (2013). "Separation and recovery of ruthenium: a review". Journal of Radioanalytical and Nuclear Chemistry. 298 (2): 781–796. doi:10.1007/s10967-013-2536-5. S2CID 95804621.
- ↑ Plietker, Bernd (2005). "Selectivity versus reactivity - recent advances in RuO4-catalyzed oxidations". Synthesis. 5 (15): 2453–2472. doi:10.1055/s-2005-872172.
- ↑ Nunez, M. Teresa; Martin, Victor S. (March 1990). "रूथेनियम टेट्राऑक्साइड के साथ कार्बोक्जिलिक एसिड के लिए फिनाइल समूहों का कुशल ऑक्सीकरण। (आर)-.गामा.-कैप्रोलैक्टोन का एक सरल संश्लेषण, ट्रोगोडर्मा ग्रैनेरियम का फेरोमोन". The Journal of Organic Chemistry. 55 (6): 1928–1932. doi:10.1021/jo00293a044. ISSN 0022-3263.
- ↑ Nasr, Khaled; Pannier, Nadine; Frangioni, John V.; Maison, Wolfgang (February 2008). "एडमांटेन पर आधारित रिजिड मल्टीवेलेंट स्कैफोल्ड्स". The Journal of Organic Chemistry. 73 (3): 1056–1060. doi:10.1021/jo702310g. ISSN 0022-3263. PMC 2505186. PMID 18179237.
- ↑ Mander, Lewis N.; Williams, Craig M. (2003-02-17). "बेंजीन के छल्ले का ऑक्सीडेटिव गिरावट". Tetrahedron. 59 (8): 1105–1136. doi:10.1016/S0040-4020(02)01492-8. ISSN 0040-4020.
- ↑ Mashiko, K.; Miyamoto, T. (1998). "रूथेनियम टेट्रोक्साइड विधि द्वारा अव्यक्त फ़िंगरप्रिंट प्रसंस्करण". Journal of Forensic Identification. 48 (3): 279–290. doi:10.3408/jasti.2.21.
- ↑ Ronneau, C.; Cara, J.; Rimski-Korsakov, A. (1995). "परमाणु ईंधन से रूथेनियम का ऑक्सीकरण-वर्धित उत्सर्जन". Journal of Environmental Radioactivity. 26: 63–70. doi:10.1016/0265-931X(95)91633-F.
- ↑ बेज़ेट, ई।, लैमी, जे.एस., पेरोन, एच।, सिमोनी, ई।, और डुक्रोस, जी। (2012)। MAAP4 कोड का उपयोग करके गंभीर दुर्घटना की स्थिति में रूथेनियम रिलीज़ मॉडलिंग[dead link]. न्यूक्लियर इंजीनियरिंग एंड डिजाइन, 246, 157-162।
अग्रिम पठन
- Cotton, S.A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 978-0-7514-0413-5.
- Farmer, V.; Welton, T. (2002). "The oxidation of alcohols in substituted imidazolium ionic liquids using ruthenium catalysts". Green Chemistry. 4 (2): 97. doi:10.1039/B109851A.
- Singh, B.; Srivastava, S. (1991). "Kinetics and mechanism of ruthenium tetroxide catalysed oxidation of cyclic alcohols by bromate in a base". Transition Metal Chemistry. 16 (4): 466. doi:10.1007/BF01129466. S2CID 95711945.
- Courtney, J.L.; Swansbor, K.F. (1972). "Ruthenium tetroxide oxidation". Reviews of Pure and Applied Chemistry. 22: 47.



