बीटा शीट: Difference between revisions
(Created page with "{{short description|Protein structural motif}} thumb|[[हरा फ्लोरोसेंट प्रोटीन में बीटा...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{short description|Protein structural motif}} | {{short description|Protein structural motif}} | ||
[[File:Animated Beta sheet.gif|thumb|[[हरा फ्लोरोसेंट प्रोटीन]] में बीटा | [[File:Animated Beta sheet.gif|thumb|[[हरा फ्लोरोसेंट प्रोटीन]] में बीटा पत्रक के भागों की त्रि-आयामी संरचना]] | ||
{{Alpha beta structure}} | {{Alpha beta structure}} | ||
बीटा | बीटा पत्रक, (β-पत्रक) (भी β-चुन्नटदार पत्रक) नियमित प्रोटीन द्वितीयक संरचना का एक सामान्य [[संरचनात्मक रूप]]ांकन है। बीटा पत्रक में बीटा तंतु (बीटा-तंतु) होते हैं जो बाद में कम से कम दो या तीन [[रीढ़ की हड्डी श्रृंखला|आधार रज्जु श्रृंखला]] [[ हाइड्रोजन बंध |हाइड्रोजन बंध]] से जुड़े होते हैं, जो सामान्यतः मुड़ी हुई, चुन्नटदार पत्रक बनाते हैं। एक β-तंतु [[पेप्टाइड]] श्रृंखला का एक खिंचाव है जो सामान्यतः 3 से 10 [[ एमिनो एसिड |एमिनो अम्ल]] होता है, जो एक विस्तारित रूपात्मक समरूपता में आधार रज्जु के साथ होता है। β-पत्रक के '''सुपरमॉलेक्यूलर एसो'''सिएशन को [[अमाइलॉइड फाइब्रिल]] और [[अमाइलॉइड सजीले टुकड़े]] के निर्माण में फंसाया गया है, जो [[स्टार्चिंग]], विशेष रूप से अल्जाइमर रोग में देखा गया है। | ||
== इतिहास == | == इतिहास == | ||
[[File:1gwe antipar betaSheet both.png|thumb|right|500px| एंजाइम [[ केटालेज़ ]] ([[प्रोटीन डाटा बैंक]] फ़ाइल 1GWE 0.88 Å रिज़ॉल्यूशन पर) की क्रिस्टल संरचना से 4- | [[File:1gwe antipar betaSheet both.png|thumb|right|500px| एंजाइम [[ केटालेज़ ]] ([[प्रोटीन डाटा बैंक]] फ़ाइल 1GWE 0.88 Å रिज़ॉल्यूशन पर) की क्रिस्टल संरचना से 4-तंतुेड एंटीपैरलल (बायोकेमिस्ट्री) β-पत्रक के टुकड़े का एक उदाहरण। ए) सामने का दृश्य, आसन्न किस्में पर पेप्टाइड एनएच और सीओ समूहों के बीच एंटीपैरल समानांतर हाइड्रोजन बांड (बिंदीदार) दिखा रहा है। तीर श्रृंखला की दिशा का संकेत देते हैं, और इलेक्ट्रॉन घनत्व गैर-हाइड्रोजन परमाणुओं की रूपरेखा तैयार करते हैं। ऑक्सीजन परमाणु लाल गेंदें हैं, नाइट्रोजन परमाणु नीले हैं, और सादगी के लिए हाइड्रोजन परमाणु छोड़े गए हैं; साइडचेन्स को केवल पहले साइडचेन कार्बन परमाणु (हरा) के लिए दिखाया गया है। बी) ए में केंद्रीय दो β-किस्में का एज-ऑन व्यू, राइटहैंडेड ट्विस्ट और सी की प्लीट दिखा रहा है<sup>α</sup>एस और साइडचेन्स जो वैकल्पिक रूप से पत्रक से विपरीत दिशाओं में बाहर निकलते हैं।]]1930 के दशक में [[विलियम एस्टबरी]] द्वारा पहली बी-पत्रक संरचना प्रस्तावित की गई थी। उन्होंने समानांतर या एंटीपारेलल विस्तारित β-तंतु के [[ पेप्टाइड बंधन ]] के बीच हाइड्रोजन बॉन्डिंग के विचार का प्रस्ताव रखा। हालांकि, एस्टबरी के पास सटीक मॉडल बनाने के लिए अमीनो एसिड के बॉन्ड ज्यामिति पर आवश्यक डेटा नहीं था, खासकर जब से वह नहीं जानता था कि पेप्टाइड बॉन्ड प्लेनर था। 1951 में [[लिनस पॉलिंग]] और [[रॉबर्ट कोरी]] द्वारा एक परिष्कृत संस्करण प्रस्तावित किया गया था। उनके मॉडल में पेप्टाइड बॉन्ड की योजना शामिल थी जिसे उन्होंने पहले कीटो-एनोल [[टॉटोमेराइज़ेशन]] के परिणामस्वरूप समझाया था। | ||
== संरचना और अभिविन्यास == | == संरचना और अभिविन्यास == | ||
=== ज्यामिति === | === ज्यामिति === | ||
बहुसंख्यक β-स्ट्रेंड्स अन्य | बहुसंख्यक β-स्ट्रेंड्स अन्य तंतु से सटे हुए हैं और अपने पड़ोसियों के साथ एक व्यापक हाइड्रोजन बॉन्ड नेटवर्क बनाते हैं जिसमें एमाइन | एन-एच समूह एक तंतु की आधार रज्जु में कार्बोनिल के साथ हाइड्रोजन बॉन्ड स्थापित करते हैं। सी = ओ समूह आसन्न किस्में की रीढ़। पूरी तरह से विस्तारित β-तंतु में, लगातार साइड चेन एक वैकल्पिक पैटर्न में सीधे ऊपर और सीधे नीचे की ओर इशारा करते हैं। β-पत्रक में आसन्न β-किस्में संरेखित की जाती हैं ताकि उनका C<sup>α</sup> परमाणु आसन्न होते हैं और उनकी पार्श्व श्रृंखलाएं एक ही दिशा में इंगित करती हैं। सी पर टेट्राहेड्रल केमिकल बॉन्डिंग से β-तंतु की चुन्नटदार उपस्थिति उत्पन्न होती है<sup>α</sup> परमाणु; उदाहरण के लिए, यदि एक साइड चेन सीधे ऊपर की ओर इशारा करती है, तो C' के बॉन्ड को थोड़ा नीचे की ओर इशारा करना चाहिए, क्योंकि इसका बॉन्ड कोण लगभग 109.5° है। प्लेटिंग सी के बीच की दूरी का कारण बनता है{{su|p=α|b=''i''}} और सी{{su|p=α|b=''i'' + 2}} लगभग होना {{cvt|6|Å|nm|lk=on}}, इसके बजाय {{cvt|7.6|Å|nm}} दो पूरी तरह से विस्तारित [[सिस-ट्रांस समावयवता]] पेप्टाइड बॉन्ड से अपेक्षित है। आसन्न सी के बीच पार्श्व दूरी<sup>α</sup> हाइड्रोजन बंध में परमाणु|हाइड्रोजन बंधित β-किस्में मोटे तौर पर होती है {{cvt|5|Å|nm}}. | ||
[[File:Ramachandran plot general 100K.jpg|thumb|left|200px| रामचंद्रन (φ, ψ) लगभग 100,000 उच्च-रिज़ॉल्यूशन डेटा बिंदुओं का प्लॉट, जो β- | [[File:Ramachandran plot general 100K.jpg|thumb|left|200px| रामचंद्रन (φ, ψ) लगभग 100,000 उच्च-रिज़ॉल्यूशन डेटा बिंदुओं का प्लॉट, जो β-पत्रक अमीनो एसिड अवशेषों के लिए विशिष्ट संरचना के आसपास व्यापक, अनुकूल क्षेत्र दिखा रहा है।]]हालांकि, β-किस्में शायद ही कभी पूरी तरह से विस्तारित होती हैं; बल्कि, वे एक मोड़ प्रदर्शित करते हैं। (φ, ψ) = (-135°, 135°) (मोटे तौर पर, रामचंद्रन भूखंड के ऊपरी बाएँ क्षेत्र) के पास ऊर्जावान रूप से पसंदीदा डायहेड्रल कोण पूरी तरह से विस्तारित संरचना (φ, ψ) = (-180°, 180 डिग्री)।<ref>{{cite book |title=जीव रसायन| vauthors = Voet D, Voet JG |year=2004 |edition=3rd |publisher=Wiley |location=Hoboken, NJ |isbn=0-471-19350-X |pages=[https://archive.org/details/biochemistry00voet_1/page/227 227–231] |url=https://archive.org/details/biochemistry00voet_1|url-access=registration }}</ref> मोड़ अक्सर डायहेड्रल कोणों में वैकल्पिक उतार-चढ़ाव से जुड़ा होता है ताकि अलग-अलग पत्रक में अलग-अलग β-तंतु को अलग-अलग करने से रोका जा सके। जोरदार मुड़ β-हेयरपिन का एक अच्छा उदाहरण प्रोटीन [[ बपति ]] में देखा जा सकता है। | ||
साइड चेन प्लेट्स की तहों से बाहर की ओर इशारा करती हैं, मोटे तौर पर | साइड चेन प्लेट्स की तहों से बाहर की ओर इशारा करती हैं, मोटे तौर पर पत्रक के तल के लंबवत; क्रमिक अमीनो एसिड अवशेष पत्रक के वैकल्पिक चेहरों पर बाहर की ओर इशारा करते हैं। | ||
=== हाइड्रोजन बॉन्डिंग पैटर्न === | === हाइड्रोजन बॉन्डिंग पैटर्न === | ||
| Line 26: | Line 26: | ||
| caption2 = '''Parallel''' β-sheet [[hydrogen bonding]] patterns, represented by dotted lines. [[Oxygen]] atoms are colored <span style="color:red;">'''red'''</span> and [[nitrogen]] atoms colored <span style="color:blue;">'''blue'''</span>. | | caption2 = '''Parallel''' β-sheet [[hydrogen bonding]] patterns, represented by dotted lines. [[Oxygen]] atoms are colored <span style="color:red;">'''red'''</span> and [[nitrogen]] atoms colored <span style="color:blue;">'''blue'''</span>. | ||
}} | }} | ||
क्योंकि पेप्टाइड शृंखलाओं में उनके N-टर्मिनस और [[सी-टर्मिनल अंत]]|C-टर्मिनस द्वारा प्रदान की गई दिशात्मकता होती है, इसलिए β- | क्योंकि पेप्टाइड शृंखलाओं में उनके N-टर्मिनस और [[सी-टर्मिनल अंत]]|C-टर्मिनस द्वारा प्रदान की गई दिशात्मकता होती है, इसलिए β-तंतु को भी दिशात्मक कहा जा सकता है। वे सामान्यतः सी-टर्मिनस की ओर इशारा करते हुए एक तीर द्वारा प्रोटीन टोपोलॉजी आरेखों में दर्शाए जाते हैं। आसन्न β-किस्में एंटीपैरल, समानांतर या मिश्रित व्यवस्था में हाइड्रोजन बांड बना सकते हैं। | ||
एक समानांतर व्यवस्था में, क्रमिक β-किस्में वैकल्पिक दिशाएं ताकि एक किनारा का ए[[ N- टर्मिनस ]] अगले के सी-टर्मिनस के निकट हो। यह वह व्यवस्था है जो सबसे मजबूत इंटर- | एक समानांतर व्यवस्था में, क्रमिक β-किस्में वैकल्पिक दिशाएं ताकि एक किनारा का ए[[ N- टर्मिनस ]] अगले के सी-टर्मिनस के निकट हो। यह वह व्यवस्था है जो सबसे मजबूत इंटर-तंतु स्थिरता पैदा करती है क्योंकि यह कार्बोनिल्स और एमाइन के बीच इंटर-तंतु हाइड्रोजन बांड को प्लेनर होने की अनुमति देती है, जो कि उनका पसंदीदा अभिविन्यास है। पेप्टाइड बैकबोन डायहेड्रल कोण (φ, ψ) लगभग (-140°, 135°) प्रतिसमांतर पत्रक में होते हैं। इस स्थिति में, यदि दो परमाणु C{{su|p=α|b=''i''}} और सी{{su|p=α|b=''j''}} दो हाइड्रोजन बॉन्ड में सटे हुए हैं। हाइड्रोजन-बंधित β-किस्में, फिर वे एक दूसरे के फ़्लैंकिंग पेप्टाइड बॉन्ड में दो परस्पर आधार रज्जु वाले हाइड्रोजन बॉन्ड बनाते हैं; इसे हाइड्रोजन बांड की करीबी जोड़ी के रूप में जाना जाता है। | ||
एक समानांतर व्यवस्था में, क्रमिक किस्में के सभी एन-टर्मिनी एक ही दिशा में उन्मुख होते हैं; यह अभिविन्यास थोड़ा कम स्थिर हो सकता है क्योंकि यह इंटर- | एक समानांतर व्यवस्था में, क्रमिक किस्में के सभी एन-टर्मिनी एक ही दिशा में उन्मुख होते हैं; यह अभिविन्यास थोड़ा कम स्थिर हो सकता है क्योंकि यह इंटर-तंतु हाइड्रोजन बॉन्डिंग पैटर्न में नॉनप्लानरिटी का परिचय देता है। डायहेड्रल कोण (''φ'', ''ψ'') समानांतर पत्रक में लगभग (-120°, 115°) हैं। एक आकृति में पांच से कम अंतःक्रियात्मक समानांतर किस्में मिलना दुर्लभ है, यह सुझाव देता है कि छोटी संख्या में किस्में अस्थिर हो सकती हैं, हालांकि समानांतर β-पत्रक बनाने के लिए यह मौलिक रूप से अधिक कठिन है क्योंकि N और C टर्मिनी के साथ किस्में आवश्यक रूप से संरेखित होनी चाहिए। क्रम में बहुत दूर हो {{Citation needed|date=August 2019}}. इस बात के भी प्रमाण हैं कि समानांतर β-पत्रक अधिक स्थिर हो सकती है क्योंकि छोटे अमाइलॉइडोजेनिक अनुक्रम सामान्यतः मुख्य रूप से समानांतर β-पत्रक तंतु से बने β-पत्रक फ़िब्रिल्स में एकत्र होते हैं, जहाँ एंटी-पैरलल फ़ाइब्रिल्स की अपेक्षा अधिक स्थिर होती है। . | ||
समानांतर β- | समानांतर β-पत्रक संरचना में, यदि दो परमाणु C{{su|p=α|b=''i''}} और सी{{su|p=α|b=''j''}} दो हाइड्रोजन बंधन में आसन्न हैं | हाइड्रोजन-बंधित β-किस्में, तो वे एक दूसरे से हाइड्रोजन बंधन नहीं करते हैं; बल्कि, एक अवशेष अवशेषों के लिए हाइड्रोजन बॉन्ड बनाता है जो दूसरे को फ्लैंक करता है (लेकिन इसके विपरीत नहीं)। उदाहरण के लिए, अवशेष i अवशेषों j − 1 और j + 1 के लिए हाइड्रोजन बांड बना सकता है; इसे हाइड्रोजन बंधों की 'विस्तृत जोड़ी' के रूप में जाना जाता है। इसके विपरीत, अवशेष j पूरी तरह से अलग-अलग अवशेषों के लिए हाइड्रोजन-बॉन्ड हो सकता है, या बिल्कुल भी नहीं। | ||
समानांतर बीटा | समानांतर बीटा पत्रक में हाइड्रोजन बांड की व्यवस्था 11 परमाणुओं के साथ एक [[एमाइड रिंग]] आकृति के समान होती है। | ||
अंत में, एक व्यक्तिगत किनारा एक मिश्रित संबंध पैटर्न प्रदर्शित कर सकता है, जिसमें एक तरफ एक समानांतर किनारा और दूसरी तरफ एक समानांतर किनारा होता है। इस तरह की व्यवस्था अभिविन्यास के एक यादृच्छिक वितरण की तुलना में कम आम है, यह सुझाव देगा कि यह पैटर्न समानांतर-विरोधी व्यवस्था की तुलना में कम स्थिर है, हालांकि जैव सूचनात्मक विश्लेषण हमेशा संरचनात्मक ऊष्मप्रवैगिकी निकालने के साथ संघर्ष करता है क्योंकि पूरे प्रोटीन में हमेशा कई अन्य संरचनात्मक विशेषताएं मौजूद होती हैं। साथ ही प्रोटीन स्वाभाविक रूप से फोल्डिंग कैनेटीक्स के साथ-साथ फोल्डिंग थर्मोडायनामिक्स द्वारा विवश होते हैं, इसलिए जैव सूचनात्मक विश्लेषण से स्थिरता का निष्कर्ष निकालने में हमेशा सावधान रहना चाहिए। | अंत में, एक व्यक्तिगत किनारा एक मिश्रित संबंध पैटर्न प्रदर्शित कर सकता है, जिसमें एक तरफ एक समानांतर किनारा और दूसरी तरफ एक समानांतर किनारा होता है। इस तरह की व्यवस्था अभिविन्यास के एक यादृच्छिक वितरण की तुलना में कम आम है, यह सुझाव देगा कि यह पैटर्न समानांतर-विरोधी व्यवस्था की तुलना में कम स्थिर है, हालांकि जैव सूचनात्मक विश्लेषण हमेशा संरचनात्मक ऊष्मप्रवैगिकी निकालने के साथ संघर्ष करता है क्योंकि पूरे प्रोटीन में हमेशा कई अन्य संरचनात्मक विशेषताएं मौजूद होती हैं। साथ ही प्रोटीन स्वाभाविक रूप से फोल्डिंग कैनेटीक्स के साथ-साथ फोल्डिंग थर्मोडायनामिक्स द्वारा विवश होते हैं, इसलिए जैव सूचनात्मक विश्लेषण से स्थिरता का निष्कर्ष निकालने में हमेशा सावधान रहना चाहिए। | ||
β- | β-तंतु के हाइड्रोजन बॉन्डिंग को सही होने की आवश्यकता नहीं है, लेकिन बीटा उभार के रूप में जाना जाने वाला स्थानीय व्यवधान प्रदर्शित कर सकता है। β-बुलगे। | ||
हाइड्रोजन बॉन्ड मोटे तौर पर | हाइड्रोजन बॉन्ड मोटे तौर पर पत्रक के तल में स्थित होते हैं, जिसमें पेप्टाइड बॉन्ड [[कार्बोनिल]] समूह क्रमिक अवशेषों के साथ वैकल्पिक दिशाओं में इंगित करते हैं; तुलना के लिए, क्रमिक कार्बोनिल्स [[अल्फा हेलिक्स]] में एक ही दिशा में इंगित करते हैं। | ||
=== अमीनो एसिड की प्रवृत्ति === | === अमीनो एसिड की प्रवृत्ति === | ||
बड़े सुगंधित अवशेष ([[टायरोसिन]], [[फेनिलएलनिन]], [[ tryptophan ]]) और β-ब्रांच्ड अमीनो एसिड ([[थ्रेओनाइन]], [[वेलिन]], [[ isoleucine ]]) β-किस्में β-चादरों के बीच में पाए जाने के पक्षधर हैं। विभिन्न प्रकार के अवशेष (जैसे [[ PROLINE ]]) β- | बड़े सुगंधित अवशेष ([[टायरोसिन]], [[फेनिलएलनिन]], [[ tryptophan ]]) और β-ब्रांच्ड अमीनो एसिड ([[थ्रेओनाइन]], [[वेलिन]], [[ isoleucine ]]) β-किस्में β-चादरों के बीच में पाए जाने के पक्षधर हैं। विभिन्न प्रकार के अवशेष (जैसे [[ PROLINE ]]) β-पत्रक में एज तंतु में पाए जाने की संभावना है, संभवतः प्रोटीन के बीच एज-टू-एज एसोसिएशन से बचने के लिए जो एकत्रीकरण और [[कलफ़]] गठन का कारण बन सकता है।<ref>{{cite journal | vauthors = Richardson JS, Richardson DC | title = प्राकृतिक बीटा-शीट प्रोटीन एज-टू-एज एकत्रीकरण से बचने के लिए नकारात्मक डिज़ाइन का उपयोग करते हैं| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 99 | issue = 5 | pages = 2754–9 | date = March 2002 | pmid = 11880627 | pmc = 122420 | doi = 10.1073/pnas.052706099 | bibcode = 2002PNAS...99.2754R | doi-access = free }}</ref> | ||
| Line 51: | Line 51: | ||
=== β-हेयरपिन आकृति === | === β-हेयरपिन आकृति === | ||
β- | β-पत्रक को शामिल करने वाला एक बहुत ही सरल संरचनात्मक रूपांकन है बीटा हेयरपिन | β-हेयरपिन, जिसमें दो एंटीपैरल समानांतर तंतु दो से पांच अवशेषों के एक छोटे लूप से जुड़े होते हैं, जिनमें से एक अक्सर [[ग्लाइसिन]] या प्रोलाइन होता है, जिनमें से दोनों कर सकते हैं टाइट [[ बारी (जैव रसायन) ]] या बीटा बल्ज लूप | β-बल्गे लूप के लिए आवश्यक डायहेड्रल-एंगल कन्फर्मेशन मान लें। अलग-अलग तंतु को अधिक विस्तृत तरीकों से जोड़ा जा सकता है जिसमें लंबे लूप होते हैं जिनमें अल्फा हेलिक्स | α-हेलीकेस हो सकते हैं। | ||
=== ग्रीक कुंजी मूल भाव === | === ग्रीक कुंजी मूल भाव === | ||
ग्रीक कुंजी रूपांकनों में चार आसन्न एंटीपैरल समानांतर | ग्रीक कुंजी रूपांकनों में चार आसन्न एंटीपैरल समानांतर तंतु और उनके लिंकिंग लूप होते हैं। इसमें हेयरपिन से जुड़े तीन एंटीपेरेलल तंतु होते हैं, जबकि चौथा पहले के निकट होता है और तीसरे से लंबे लूप से जुड़ा होता है। प्रोटीन तह प्रक्रिया के दौरान इस प्रकार की संरचना आसानी से बनती है।<ref>[http://swissmodel.expasy.org/course/text/chapter4.htm Tertiary Protein Structure and Folds: section 4.3.2.1]. From [http://swissmodel.expasy.org/course/ Principles of Protein Structure, Comparative Protein Modelling, and Visualisation]</ref><ref name="pmid8506258">{{cite journal | vauthors = Hutchinson EG, Thornton JM | title = The Greek key motif: extraction, classification and analysis | journal = Protein Engineering | volume = 6 | issue = 3 | pages = 233–45 | date = April 1993 | pmid = 8506258 | doi = 10.1093/protein/6.3.233 }}</ref> इसका नाम ग्रीक सजावटी कलाकृति के सामान्य पैटर्न के नाम पर रखा गया था (मेन्डर (कला) देखें)। | ||
===β-α-β मूल भाव === | ===β-α-β मूल भाव === | ||
उनके घटक अमीनो एसिड की चिरायता के कारण, सभी किस्में दाएं हाथ के मोड़ को सबसे उच्च-क्रम β- | उनके घटक अमीनो एसिड की चिरायता के कारण, सभी किस्में दाएं हाथ के मोड़ को सबसे उच्च-क्रम β-पत्रक संरचनाओं में स्पष्ट रूप से प्रदर्शित करती हैं। विशेष रूप से, दो समानांतर तंतु के बीच लिंकिंग लूप में लगभग हमेशा एक दाहिने हाथ की क्रॉसओवर चिरायता होती है, जो पत्रक के अंतर्निहित मोड़ द्वारा दृढ़ता से पसंद की जाती है।<ref>See sections II B and III C, D in {{cite book | vauthors = Richardson JS |year= 1981 |title=Anatomy and Taxonomy of Protein Structures |chapter= The Anatomy and Taxonomy of Protein Structure |journal=Advances in Protein Chemistry |volume=34 |pages=167–339|isbn=0-12-034234-0 |doi=10.1016/s0065-3233(08)60520-3|pmid= 7020376 }}</ref> इस लिंकिंग लूप में अक्सर एक पेचदार क्षेत्र होता है, जिस स्थिति में इसे बीटा-अल्फा-बीटा | β-α-β मोटिफ कहा जाता है। β-α-β-α मोटिफ नामक एक बारीकी से संबंधित रूपांकन सबसे अधिक देखी जाने वाली प्रोटीन [[तृतीयक संरचना]], TIM बैरल का मूल घटक बनाता है। | ||
[[File:beta-meander1.png|left|thumb|300px| बाहरी सतह प्रोटीन A (OspA) से β-मेन्डर मोटिफ।<ref name=":0">{{cite journal | vauthors = Makabe K, McElheny D, Tereshko V, Hilyard A, Gawlak G, Yan S, Koide A, Koide S | display-authors = 6 | title = पेप्टाइड स्व-विधानसभा की परमाणु संरचना नकल करती है| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 103 | issue = 47 | pages = 17753–8 | date = November 2006 | pmid = 17093048 | pmc = 1693819 | doi = 10.1073/pnas.0606690103 | bibcode = 2006PNAS..10317753M | doi-access = free }}</ref> ऊपर की छवि OspA (OspA+3bh) का एक प्रकार दिखाती है जिसमें एक केंद्रीय, विस्तारित β-मीएंडर β- | [[File:beta-meander1.png|left|thumb|300px| बाहरी सतह प्रोटीन A (OspA) से β-मेन्डर मोटिफ।<ref name=":0">{{cite journal | vauthors = Makabe K, McElheny D, Tereshko V, Hilyard A, Gawlak G, Yan S, Koide A, Koide S | display-authors = 6 | title = पेप्टाइड स्व-विधानसभा की परमाणु संरचना नकल करती है| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 103 | issue = 47 | pages = 17753–8 | date = November 2006 | pmid = 17093048 | pmc = 1693819 | doi = 10.1073/pnas.0606690103 | bibcode = 2006PNAS..10317753M | doi-access = free }}</ref> ऊपर की छवि OspA (OspA+3bh) का एक प्रकार दिखाती है जिसमें एक केंद्रीय, विस्तारित β-मीएंडर β-पत्रक होती है जिसमें कोर OspA β-हेयरपिन (ग्रे में) की तीन अतिरिक्त प्रतियां (लाल रंग में) होती हैं जिन्हें डुप्लिकेट किया गया है और फिर से डाला गया है मूल OspA β-पत्रक में।]] | ||
[[File:5CPAgood.png|right|thumb|[[Carboxypeptidase A]] से साई-लूप मोटिफ]] | [[File:5CPAgood.png|right|thumb|[[Carboxypeptidase A]] से साई-लूप मोटिफ]] | ||
===बीटा-विपर्यय आकृति=== | ===बीटा-विपर्यय आकृति=== | ||
[[बीटा हेयरपिन]] लूप द्वारा एक साथ जुड़े दो या दो से अधिक लगातार एंटीपैरल β-किस्में से बना एक सरल संरचनात्मक रूपांकन प्रोटीन टोपोलॉजी।<ref>{{Cite web |url=http://scop.mrc-lmb.cam.ac.uk/scop/data/scop.b.c.bbf.html |title=SCOP: Fold: WW domain-like<!-- Bot generated title --> |access-date=2007-06-01 |archive-url=https://web.archive.org/web/20120204065925/http://scop.mrc-lmb.cam.ac.uk/scop/data/scop.b.c.bbf.html |archive-date=2012-02-04 |url-status=dead }}</ref><ref>[http://www.cryst.bbk.ac.uk/PPS2/course/section9/sss/super2.html PPS '96 – Super Secondary Structure<!-- Bot generated title -->]</ref> यह मोटिफ β- | [[बीटा हेयरपिन]] लूप द्वारा एक साथ जुड़े दो या दो से अधिक लगातार एंटीपैरल β-किस्में से बना एक सरल संरचनात्मक रूपांकन प्रोटीन टोपोलॉजी।<ref>{{Cite web |url=http://scop.mrc-lmb.cam.ac.uk/scop/data/scop.b.c.bbf.html |title=SCOP: Fold: WW domain-like<!-- Bot generated title --> |access-date=2007-06-01 |archive-url=https://web.archive.org/web/20120204065925/http://scop.mrc-lmb.cam.ac.uk/scop/data/scop.b.c.bbf.html |archive-date=2012-02-04 |url-status=dead }}</ref><ref>[http://www.cryst.bbk.ac.uk/PPS2/course/section9/sss/super2.html PPS '96 – Super Secondary Structure<!-- Bot generated title -->]</ref> यह मोटिफ β-पत्रक में आम है और बीटा बैरल | β-बैरल और बीटा प्रोपेलर | β-प्रोपेलर सहित कई संरचनात्मक आर्किटेक्चर में पाया जा सकता है। | ||
प्रोटीन में β-मेन्डर क्षेत्रों का विशाल बहुमत पॉलीपेप्टाइड श्रृंखला के अन्य रूपांकनों या वर्गों के खिलाफ पैक पाया जाता है, जो हाइड्रोफोबिक कोर के कुछ हिस्सों का निर्माण करता है जो कैनोनिक रूप से तह संरचना का निर्माण करता है।<ref>{{cite journal|vauthors=Biancalana M, Makabe K, Koide S|date=February 2010|title=पानी में घुलनशील क्रॉस-बीटा वास्तुकला का न्यूनतम डिजाइन|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=107|issue=8|pages=3469–74|doi=10.1073/pnas.0912654107|pmc=2840449|pmid=20133689|bibcode=2010PNAS..107.3469B|doi-access=free}}</ref> हालाँकि, कई उल्लेखनीय अपवादों में बाहरी सतह प्रोटीन A (OspA) संस्करण शामिल हैं<ref name=":0" />और सिंगल लेयर β- | प्रोटीन में β-मेन्डर क्षेत्रों का विशाल बहुमत पॉलीपेप्टाइड श्रृंखला के अन्य रूपांकनों या वर्गों के खिलाफ पैक पाया जाता है, जो हाइड्रोफोबिक कोर के कुछ हिस्सों का निर्माण करता है जो कैनोनिक रूप से तह संरचना का निर्माण करता है।<ref>{{cite journal|vauthors=Biancalana M, Makabe K, Koide S|date=February 2010|title=पानी में घुलनशील क्रॉस-बीटा वास्तुकला का न्यूनतम डिजाइन|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=107|issue=8|pages=3469–74|doi=10.1073/pnas.0912654107|pmc=2840449|pmid=20133689|bibcode=2010PNAS..107.3469B|doi-access=free}}</ref> हालाँकि, कई उल्लेखनीय अपवादों में बाहरी सतह प्रोटीन A (OspA) संस्करण शामिल हैं<ref name=":0" />और सिंगल लेयर β-पत्रक प्रोटीन (SLBPs)<ref>{{Cite journal|last1=Xu|first1=Qingping|last2=Biancalana|first2=Matthew|last3=Grant|first3=Joanna C.|last4=Chiu|first4=Hsiu-Ju|last5=Jaroszewski|first5=Lukasz|last6=Knuth|first6=Mark W.|last7=Lesley|first7=Scott A.|last8=Godzik|first8=Adam|last9=Elsliger|first9=Marc-André|last10=Deacon|first10=Ashley M.|last11=Wilson|first11=Ian A.|date=September 2019|title=Structures of single-layer β-sheet proteins evolved from β-hairpin repeats|journal=Protein Science |volume=28|issue=9|pages=1676–1689|doi=10.1002/pro.3683|issn=1469-896X|pmc=6699103|pmid=31306512}}</ref> जिसमें पारंपरिक हाइड्रोफोबिक कोर के अभाव में सिंगल-लेयर β-पत्रक होते हैं। इन β-रिच प्रोटीन में एक विस्तारित सिंगल-लेयर β-मीएंडर β-पत्रक होती हैं जो मुख्य रूप से इंटर-β-तंतु इंटरैक्शन और हाइड्रोफोबिक इंटरैक्शन के माध्यम से स्थिर होती हैं जो अलग-अलग तंतु को जोड़ने वाले टर्न क्षेत्रों में मौजूद होती हैं। | ||
=== साई-लूप मोटिफ === | === साई-लूप मोटिफ === | ||
साई-लूप (Ψ-लूप) मोटिफ में दो एंटीपैरल समानांतर | साई-लूप (Ψ-लूप) मोटिफ में दो एंटीपैरल समानांतर तंतु होते हैं जिनके बीच में एक तंतु होता है जो दोनों से हाइड्रोजन बॉन्ड से जुड़ा होता है।<ref>{{cite journal | vauthors = Hutchinson EG, Thornton JM | title = PROMOTIF - प्रोटीन में संरचनात्मक रूपांकनों की पहचान और विश्लेषण करने का कार्यक्रम| journal = Protein Science | volume = 5 | issue = 2 | pages = 212–20 | date = February 1996 | pmid = 8745398 | pmc = 2143354 | doi = 10.1002/pro.5560050204 }}</ref> सिंगल Ψ-लूप के लिए चार संभावित तंतु टोपोलॉजी हैं।<ref name="pmid2281084">{{cite journal | vauthors = Hutchinson EG, Thornton JM | title = हेरा - प्रोटीन माध्यमिक संरचनाओं के योजनाबद्ध आरेख बनाने के लिए एक कार्यक्रम| journal = Proteins | volume = 8 | issue = 3 | pages = 203–12 | year = 1990 | pmid = 2281084 | doi = 10.1002/prot.340080303 | s2cid = 28921557 }}</ref> यह आकृति दुर्लभ है क्योंकि इसके गठन की प्रक्रिया प्रोटीन तह के दौरान होने की संभावना नहीं है। [[एस्पार्टिक एसिड प्रोटीज]] परिवार में पहली बार Ψ-पाश की पहचान की गई थी।<ref name="pmid2281084"/> | ||
== β-चादरों के साथ प्रोटीन की संरचनात्मक संरचना == | == β-चादरों के साथ प्रोटीन की संरचनात्मक संरचना == | ||
β- | β-पत्रक All-β प्रोटीन|all-β, Α+β प्रोटीन|α+β और Α/β प्रोटीन|α/β डोमेन में मौजूद हैं, और कई पेप्टाइड्स या छोटे प्रोटीन में खराब परिभाषित समग्र वास्तुकला के साथ मौजूद हैं।<ref>{{cite journal | vauthors = Hubbard TJ, Murzin AG, Brenner SE, Chothia C | title = SCOP: a structural classification of proteins database | journal = Nucleic Acids Research | volume = 25 | issue = 1 | pages = 236–9 | date = January 1997 | pmid = 9016544 | pmc = 146380 | doi = 10.1093/nar/25.1.236 }}</ref><ref>{{cite journal | vauthors = Fox NK, Brenner SE, Chandonia JM | title = SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures | journal = Nucleic Acids Research | volume = 42 | issue = Database issue | pages = D304-9 | date = January 2014 | pmid = 24304899 | doi = 10.1093/nar/gkt1240 | pmc=3965108}}</ref> ऑल-β प्रोटीन|ऑल-β डोमेन बीटा बैरल बना सकते हैं|β-बैरल, β-सैंडविच, β-प्रिज्म, बीटा-प्रोपेलर डोमेन|β-प्रोपेलर, और बीटा हेलिक्स|β-हेलिकॉप्टर। | ||
== स्ट्रक्चरल टोपोलॉजी == | == स्ट्रक्चरल टोपोलॉजी == | ||
β- | β-पत्रक की टोपोलॉजी हाइड्रोजन बॉन्ड के क्रम का वर्णन करती है | आधार रज्जु के साथ हाइड्रोजन-बंधित β-किस्में। उदाहरण के लिए, फ्लेवोडॉक्सिन तह में 21345 टोपोलॉजी के साथ एक पांच-फंसे, समानांतर β-पत्रक है; इस प्रकार, किनारे की किस्में β-तंतु 2 और β-तंतु 5 आधार रज्जु के साथ हैं। स्पष्ट रूप से बताया गया है, β-तंतु 2, β-तंतु 1 से एच-बॉन्डेड है, जो β-तंतु 3 से एच-बॉन्ड है, जो β-तंतु 4 से एच-बॉन्ड है, जो β-तंतु 5 से एच-बॉन्ड है , दूसरा किनारा किनारा। उसी प्रणाली में, ऊपर वर्णित ग्रीक कुंजी मूल भाव में 4123 टोपोलॉजी है। एक β-पत्रक की द्वितीयक संरचना को मोटे तौर पर किस्में की संख्या, उनकी टोपोलॉजी, और क्या उनके हाइड्रोजन बांड समानांतर या एंटीपैरल हैं, देकर वर्णित किया जा सकता है। | ||
β-चादरें ''खुली'' हो सकती हैं, जिसका अर्थ है कि उनके दो किनारे हैं (जैसे कि [[फ्लेवोडॉक्सिन फोल्ड]] या [[ इम्युनोग्लोबुलिन गुना ]] में) या वे 'बंद बीटा-बैरल | β-बैरल'' हो सकते हैं (जैसे कि टीआईएम बैरल)। बीटा-बैरल | β-बैरल को अक्सर उनके ''स्टैगर'' या ''शियर'' द्वारा वर्णित किया जाता है। कुछ खुली β-चादरें बहुत घुमावदार होती हैं और अपने ऊपर मुड़ी होती हैं (जैसा कि SH3 डोमेन में होता है) या घोड़े की नाल का आकार बनाती हैं (जैसा कि [[राइबोन्यूक्लिज़ अवरोधक]] में होता है)। ओपन β- | β-चादरें ''खुली'' हो सकती हैं, जिसका अर्थ है कि उनके दो किनारे हैं (जैसे कि [[फ्लेवोडॉक्सिन फोल्ड]] या [[ इम्युनोग्लोबुलिन गुना ]] में) या वे 'बंद बीटा-बैरल | β-बैरल'' हो सकते हैं (जैसे कि टीआईएम बैरल)। बीटा-बैरल | β-बैरल को अक्सर उनके ''स्टैगर'' या ''शियर'' द्वारा वर्णित किया जाता है। कुछ खुली β-चादरें बहुत घुमावदार होती हैं और अपने ऊपर मुड़ी होती हैं (जैसा कि SH3 डोमेन में होता है) या घोड़े की नाल का आकार बनाती हैं (जैसा कि [[राइबोन्यूक्लिज़ अवरोधक]] में होता है)। ओपन β-पत्रक आमने-सामने (जैसे बीटा-प्रोपेलर डोमेन | β-प्रोपेलर डोमेन या इम्युनोग्लोबुलिन फोल्ड) या एज-टू-एज को इकट्ठा कर सकते हैं, जिससे एक बड़ी β-पत्रक बन सकती है।'' | ||
== गतिशील विशेषताएं == | == गतिशील विशेषताएं == | ||
β- | β-चुन्नटदार पत्रक संरचनाएं विस्तारित β-तंतु पॉलीपेप्टाइड श्रृंखलाओं से बनाई जाती हैं, जिसमें [[हाइड्रोजन बांड]] द्वारा उनके पड़ोसियों से जुड़ी किस्में होती हैं। इस विस्तारित रीढ़ की रचना के कारण, β-चादरें खिंचाव का विरोध करती हैं। प्रोटीन में β-पत्रक प्रोटीन और डीएनए में कम-आवृत्ति सामूहिक गति कर सकते हैं। [[रमन स्पेक्ट्रोस्कोपी]] द्वारा देखी गई कम-आवृत्ति अकॉर्डियन जैसी गति<ref name="pmid7115900">{{cite journal | vauthors = Painter PC, Mosher LE, Rhoads C | title = प्रोटीन के रमन स्पेक्ट्रा में कम आवृत्ति मोड| journal = Biopolymers | volume = 21 | issue = 7 | pages = 1469–72 | date = July 1982 | pmid = 7115900 | doi = 10.1002/bip.360210715 | doi-access = free }}</ref> और अर्ध-सातत्य मॉडल के साथ विश्लेषण किया।<ref name="pmid4052563">{{cite journal | vauthors = Chou KC | title = प्रोटीन अणुओं में कम आवृत्ति गति। बीटा-शीट और बीटा-बैरल| journal = Biophysical Journal | volume = 48 | issue = 2 | pages = 289–97 | date = August 1985 | pmid = 4052563 | pmc = 1329320 | doi = 10.1016/S0006-3495(85)83782-6 | bibcode = 1985BpJ....48..289C }}</ref> | ||
== समानांतर β-हेलिसेस == | == समानांतर β-हेलिसेस == | ||
[[File:1QRE L3betaHelix.jpg|thumb|right| एक 3-तरफा, बाएं हाथ का β-हेलिक्स का अंत-दृश्य ({{PDB|1QRE}})]]एक बीटा हेलिक्स | β-हेलिक्स शॉर्ट लूप से जुड़े दो या तीन छोटे β-स्ट्रेंड्स वाली संरचनात्मक इकाइयों को दोहराने से बनता है। ये इकाइयां एक दूसरे के ऊपर पेचदार तरीके से खड़ी होती हैं ताकि समानांतर अभिविन्यास में एक दूसरे के साथ एक ही | [[File:1QRE L3betaHelix.jpg|thumb|right| एक 3-तरफा, बाएं हाथ का β-हेलिक्स का अंत-दृश्य ({{PDB|1QRE}})]]एक बीटा हेलिक्स | β-हेलिक्स शॉर्ट लूप से जुड़े दो या तीन छोटे β-स्ट्रेंड्स वाली संरचनात्मक इकाइयों को दोहराने से बनता है। ये इकाइयां एक दूसरे के ऊपर पेचदार तरीके से खड़ी होती हैं ताकि समानांतर अभिविन्यास में एक दूसरे के साथ एक ही तंतु हाइड्रोजन-बॉन्ड की क्रमिक पुनरावृत्ति हो। अधिक जानकारी के लिए बीटा हेलिक्स | β-हेलिक्स आलेख देखें। | ||
बाएं हाथ के β-हेलीकॉप्टर में, किस्में स्वयं काफी सीधी और बिना मुड़ी हुई होती हैं; परिणामी पेचदार सतहें लगभग सपाट होती हैं, जो एक नियमित [[त्रिकोणीय प्रिज्म]] आकार बनाती हैं, जैसा कि दाईं ओर 1QRE पुरातन कार्बोनिक एनहाइड्रेज़ के लिए दिखाया गया है। अन्य उदाहरण लिपिड ए सिंथेसिस एंजाइम [[एलपीएक्सए]] और कीट एंटीफ्रीज प्रोटीन हैं जो बर्फ की संरचना की नकल करने वाले एक चेहरे पर थ्र साइडचेन्स की एक नियमित सरणी के साथ होते हैं।<ref>{{cite journal | vauthors = Liou YC, Tocilj A, Davies PL, Jia Z | title = सतह हाइड्रॉक्सिल और बीटा-हेलिक्स एंटीफ्रीज प्रोटीन के पानी द्वारा बर्फ की संरचना की नकल| journal = Nature | volume = 406 | issue = 6793 | pages = 322–4 | date = July 2000 | pmid = 10917536 | doi = 10.1038/35018604 | bibcode = 2000Natur.406..322L | s2cid = 4385352 }}</ref> | बाएं हाथ के β-हेलीकॉप्टर में, किस्में स्वयं काफी सीधी और बिना मुड़ी हुई होती हैं; परिणामी पेचदार सतहें लगभग सपाट होती हैं, जो एक नियमित [[त्रिकोणीय प्रिज्म]] आकार बनाती हैं, जैसा कि दाईं ओर 1QRE पुरातन कार्बोनिक एनहाइड्रेज़ के लिए दिखाया गया है। अन्य उदाहरण लिपिड ए सिंथेसिस एंजाइम [[एलपीएक्सए]] और कीट एंटीफ्रीज प्रोटीन हैं जो बर्फ की संरचना की नकल करने वाले एक चेहरे पर थ्र साइडचेन्स की एक नियमित सरणी के साथ होते हैं।<ref>{{cite journal | vauthors = Liou YC, Tocilj A, Davies PL, Jia Z | title = सतह हाइड्रॉक्सिल और बीटा-हेलिक्स एंटीफ्रीज प्रोटीन के पानी द्वारा बर्फ की संरचना की नकल| journal = Nature | volume = 406 | issue = 6793 | pages = 322–4 | date = July 2000 | pmid = 10917536 | doi = 10.1038/35018604 | bibcode = 2000Natur.406..322L | s2cid = 4385352 }}</ref> | ||
| Line 93: | Line 93: | ||
== पैथोलॉजी में == | == पैथोलॉजी में == | ||
कुछ प्रोटीन जो मोनोमर्स के रूप में अव्यवस्थित या पेचदार होते हैं, जैसे एमिलॉयड β ([[अमाइलॉइड पट्टिका]] देखें) पैथोलॉजिकल राज्यों से जुड़े β- | कुछ प्रोटीन जो मोनोमर्स के रूप में अव्यवस्थित या पेचदार होते हैं, जैसे एमिलॉयड β ([[अमाइलॉइड पट्टिका]] देखें) पैथोलॉजिकल राज्यों से जुड़े β-पत्रक-समृद्ध ओलिगोमेरिक संरचनाएं बना सकते हैं। अमाइलॉइड β प्रोटीन के ओलिगोमेरिक रूप को अल्जाइमर रोग | अल्जाइमर के कारण के रूप में फंसाया जाता है। इसकी संरचना अभी तक पूर्ण रूप से निर्धारित नहीं की गई है, लेकिन हाल के आंकड़ों से पता चलता है कि यह असामान्य दो-तंतु β-हेलिक्स के समान हो सकता है।<ref name="pmid15944695">{{cite journal | vauthors = Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D | title = अमाइलॉइड जैसे तंतुओं के क्रॉस-बीटा पाइन की संरचना| journal = Nature | volume = 435 | issue = 7043 | pages = 773–8 | date = June 2005 | pmid = 15944695 | pmc = 1479801 | doi = 10.1038/nature03680 | bibcode = 2005Natur.435..773N }}</ref> | ||
β- | β-पत्रक संरचना में पाए जाने वाले अमीनो एसिड अवशेषों से पार्श्व श्रृंखलाओं को भी इस तरह से व्यवस्थित किया जा सकता है कि पत्रक के एक तरफ आसन्न पक्ष श्रृंखलाओं में से कई हाइड्रोफोबिक हैं, जबकि उनमें से कई पत्रक के वैकल्पिक पक्ष पर एक दूसरे से सटे हुए हैं। ध्रुवीय या आवेशित (हाइड्रोफिलिक) हैं,<ref name="pmid7682699">{{cite journal | vauthors = Zhang S, Holmes T, Lockshin C, Rich A | title = एक स्थिर मैक्रोस्कोपिक झिल्ली बनाने के लिए एक स्व-पूरक ऑलिगोपेप्टाइड का सहज संयोजन| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 90 | issue = 8 | pages = 3334–8 | date = April 1993 | pmid = 7682699 | pmc = 46294 | doi = 10.1073/pnas.90.8.3334 | bibcode = 1993PNAS...90.3334Z | doi-access = free }}</ref> जो उपयोगी हो सकता है यदि पत्रक को ध्रुवीय/पानी और गैर-ध्रुवीय/चिकना वातावरण के बीच एक सीमा बनाना है। | ||
== यह भी देखें == | == यह भी देखें == | ||
Revision as of 13:01, 5 June 2023
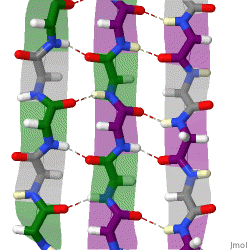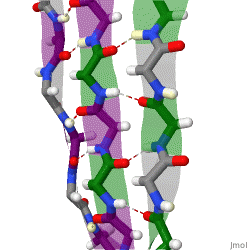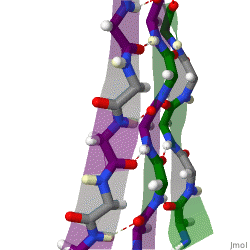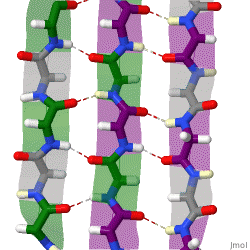

बीटा पत्रक, (β-पत्रक) (भी β-चुन्नटदार पत्रक) नियमित प्रोटीन द्वितीयक संरचना का एक सामान्य संरचनात्मक रूपांकन है। बीटा पत्रक में बीटा तंतु (बीटा-तंतु) होते हैं जो बाद में कम से कम दो या तीन आधार रज्जु श्रृंखला हाइड्रोजन बंध से जुड़े होते हैं, जो सामान्यतः मुड़ी हुई, चुन्नटदार पत्रक बनाते हैं। एक β-तंतु पेप्टाइड श्रृंखला का एक खिंचाव है जो सामान्यतः 3 से 10 एमिनो अम्ल होता है, जो एक विस्तारित रूपात्मक समरूपता में आधार रज्जु के साथ होता है। β-पत्रक के सुपरमॉलेक्यूलर एसोसिएशन को अमाइलॉइड फाइब्रिल और अमाइलॉइड सजीले टुकड़े के निर्माण में फंसाया गया है, जो स्टार्चिंग, विशेष रूप से अल्जाइमर रोग में देखा गया है।
इतिहास

1930 के दशक में विलियम एस्टबरी द्वारा पहली बी-पत्रक संरचना प्रस्तावित की गई थी। उन्होंने समानांतर या एंटीपारेलल विस्तारित β-तंतु के पेप्टाइड बंधन के बीच हाइड्रोजन बॉन्डिंग के विचार का प्रस्ताव रखा। हालांकि, एस्टबरी के पास सटीक मॉडल बनाने के लिए अमीनो एसिड के बॉन्ड ज्यामिति पर आवश्यक डेटा नहीं था, खासकर जब से वह नहीं जानता था कि पेप्टाइड बॉन्ड प्लेनर था। 1951 में लिनस पॉलिंग और रॉबर्ट कोरी द्वारा एक परिष्कृत संस्करण प्रस्तावित किया गया था। उनके मॉडल में पेप्टाइड बॉन्ड की योजना शामिल थी जिसे उन्होंने पहले कीटो-एनोल टॉटोमेराइज़ेशन के परिणामस्वरूप समझाया था।
संरचना और अभिविन्यास
ज्यामिति
बहुसंख्यक β-स्ट्रेंड्स अन्य तंतु से सटे हुए हैं और अपने पड़ोसियों के साथ एक व्यापक हाइड्रोजन बॉन्ड नेटवर्क बनाते हैं जिसमें एमाइन | एन-एच समूह एक तंतु की आधार रज्जु में कार्बोनिल के साथ हाइड्रोजन बॉन्ड स्थापित करते हैं। सी = ओ समूह आसन्न किस्में की रीढ़। पूरी तरह से विस्तारित β-तंतु में, लगातार साइड चेन एक वैकल्पिक पैटर्न में सीधे ऊपर और सीधे नीचे की ओर इशारा करते हैं। β-पत्रक में आसन्न β-किस्में संरेखित की जाती हैं ताकि उनका Cα परमाणु आसन्न होते हैं और उनकी पार्श्व श्रृंखलाएं एक ही दिशा में इंगित करती हैं। सी पर टेट्राहेड्रल केमिकल बॉन्डिंग से β-तंतु की चुन्नटदार उपस्थिति उत्पन्न होती हैα परमाणु; उदाहरण के लिए, यदि एक साइड चेन सीधे ऊपर की ओर इशारा करती है, तो C' के बॉन्ड को थोड़ा नीचे की ओर इशारा करना चाहिए, क्योंकि इसका बॉन्ड कोण लगभग 109.5° है। प्लेटिंग सी के बीच की दूरी का कारण बनता हैα
i और सीα
i + 2 लगभग होना 6 Å (0.60 nm), इसके बजाय 7.6 Å (0.76 nm) दो पूरी तरह से विस्तारित सिस-ट्रांस समावयवता पेप्टाइड बॉन्ड से अपेक्षित है। आसन्न सी के बीच पार्श्व दूरीα हाइड्रोजन बंध में परमाणु|हाइड्रोजन बंधित β-किस्में मोटे तौर पर होती है 5 Å (0.50 nm).
हालांकि, β-किस्में शायद ही कभी पूरी तरह से विस्तारित होती हैं; बल्कि, वे एक मोड़ प्रदर्शित करते हैं। (φ, ψ) = (-135°, 135°) (मोटे तौर पर, रामचंद्रन भूखंड के ऊपरी बाएँ क्षेत्र) के पास ऊर्जावान रूप से पसंदीदा डायहेड्रल कोण पूरी तरह से विस्तारित संरचना (φ, ψ) = (-180°, 180 डिग्री)।[1] मोड़ अक्सर डायहेड्रल कोणों में वैकल्पिक उतार-चढ़ाव से जुड़ा होता है ताकि अलग-अलग पत्रक में अलग-अलग β-तंतु को अलग-अलग करने से रोका जा सके। जोरदार मुड़ β-हेयरपिन का एक अच्छा उदाहरण प्रोटीन बपति में देखा जा सकता है।
साइड चेन प्लेट्स की तहों से बाहर की ओर इशारा करती हैं, मोटे तौर पर पत्रक के तल के लंबवत; क्रमिक अमीनो एसिड अवशेष पत्रक के वैकल्पिक चेहरों पर बाहर की ओर इशारा करते हैं।
हाइड्रोजन बॉन्डिंग पैटर्न
क्योंकि पेप्टाइड शृंखलाओं में उनके N-टर्मिनस और सी-टर्मिनल अंत|C-टर्मिनस द्वारा प्रदान की गई दिशात्मकता होती है, इसलिए β-तंतु को भी दिशात्मक कहा जा सकता है। वे सामान्यतः सी-टर्मिनस की ओर इशारा करते हुए एक तीर द्वारा प्रोटीन टोपोलॉजी आरेखों में दर्शाए जाते हैं। आसन्न β-किस्में एंटीपैरल, समानांतर या मिश्रित व्यवस्था में हाइड्रोजन बांड बना सकते हैं।
एक समानांतर व्यवस्था में, क्रमिक β-किस्में वैकल्पिक दिशाएं ताकि एक किनारा का एN- टर्मिनस अगले के सी-टर्मिनस के निकट हो। यह वह व्यवस्था है जो सबसे मजबूत इंटर-तंतु स्थिरता पैदा करती है क्योंकि यह कार्बोनिल्स और एमाइन के बीच इंटर-तंतु हाइड्रोजन बांड को प्लेनर होने की अनुमति देती है, जो कि उनका पसंदीदा अभिविन्यास है। पेप्टाइड बैकबोन डायहेड्रल कोण (φ, ψ) लगभग (-140°, 135°) प्रतिसमांतर पत्रक में होते हैं। इस स्थिति में, यदि दो परमाणु Cα
i और सीα
j दो हाइड्रोजन बॉन्ड में सटे हुए हैं। हाइड्रोजन-बंधित β-किस्में, फिर वे एक दूसरे के फ़्लैंकिंग पेप्टाइड बॉन्ड में दो परस्पर आधार रज्जु वाले हाइड्रोजन बॉन्ड बनाते हैं; इसे हाइड्रोजन बांड की करीबी जोड़ी के रूप में जाना जाता है।
एक समानांतर व्यवस्था में, क्रमिक किस्में के सभी एन-टर्मिनी एक ही दिशा में उन्मुख होते हैं; यह अभिविन्यास थोड़ा कम स्थिर हो सकता है क्योंकि यह इंटर-तंतु हाइड्रोजन बॉन्डिंग पैटर्न में नॉनप्लानरिटी का परिचय देता है। डायहेड्रल कोण (φ, ψ) समानांतर पत्रक में लगभग (-120°, 115°) हैं। एक आकृति में पांच से कम अंतःक्रियात्मक समानांतर किस्में मिलना दुर्लभ है, यह सुझाव देता है कि छोटी संख्या में किस्में अस्थिर हो सकती हैं, हालांकि समानांतर β-पत्रक बनाने के लिए यह मौलिक रूप से अधिक कठिन है क्योंकि N और C टर्मिनी के साथ किस्में आवश्यक रूप से संरेखित होनी चाहिए। क्रम में बहुत दूर हो[citation needed]. इस बात के भी प्रमाण हैं कि समानांतर β-पत्रक अधिक स्थिर हो सकती है क्योंकि छोटे अमाइलॉइडोजेनिक अनुक्रम सामान्यतः मुख्य रूप से समानांतर β-पत्रक तंतु से बने β-पत्रक फ़िब्रिल्स में एकत्र होते हैं, जहाँ एंटी-पैरलल फ़ाइब्रिल्स की अपेक्षा अधिक स्थिर होती है। .
समानांतर β-पत्रक संरचना में, यदि दो परमाणु Cα
i और सीα
j दो हाइड्रोजन बंधन में आसन्न हैं | हाइड्रोजन-बंधित β-किस्में, तो वे एक दूसरे से हाइड्रोजन बंधन नहीं करते हैं; बल्कि, एक अवशेष अवशेषों के लिए हाइड्रोजन बॉन्ड बनाता है जो दूसरे को फ्लैंक करता है (लेकिन इसके विपरीत नहीं)। उदाहरण के लिए, अवशेष i अवशेषों j − 1 और j + 1 के लिए हाइड्रोजन बांड बना सकता है; इसे हाइड्रोजन बंधों की 'विस्तृत जोड़ी' के रूप में जाना जाता है। इसके विपरीत, अवशेष j पूरी तरह से अलग-अलग अवशेषों के लिए हाइड्रोजन-बॉन्ड हो सकता है, या बिल्कुल भी नहीं।
समानांतर बीटा पत्रक में हाइड्रोजन बांड की व्यवस्था 11 परमाणुओं के साथ एक एमाइड रिंग आकृति के समान होती है।
अंत में, एक व्यक्तिगत किनारा एक मिश्रित संबंध पैटर्न प्रदर्शित कर सकता है, जिसमें एक तरफ एक समानांतर किनारा और दूसरी तरफ एक समानांतर किनारा होता है। इस तरह की व्यवस्था अभिविन्यास के एक यादृच्छिक वितरण की तुलना में कम आम है, यह सुझाव देगा कि यह पैटर्न समानांतर-विरोधी व्यवस्था की तुलना में कम स्थिर है, हालांकि जैव सूचनात्मक विश्लेषण हमेशा संरचनात्मक ऊष्मप्रवैगिकी निकालने के साथ संघर्ष करता है क्योंकि पूरे प्रोटीन में हमेशा कई अन्य संरचनात्मक विशेषताएं मौजूद होती हैं। साथ ही प्रोटीन स्वाभाविक रूप से फोल्डिंग कैनेटीक्स के साथ-साथ फोल्डिंग थर्मोडायनामिक्स द्वारा विवश होते हैं, इसलिए जैव सूचनात्मक विश्लेषण से स्थिरता का निष्कर्ष निकालने में हमेशा सावधान रहना चाहिए।
β-तंतु के हाइड्रोजन बॉन्डिंग को सही होने की आवश्यकता नहीं है, लेकिन बीटा उभार के रूप में जाना जाने वाला स्थानीय व्यवधान प्रदर्शित कर सकता है। β-बुलगे।
हाइड्रोजन बॉन्ड मोटे तौर पर पत्रक के तल में स्थित होते हैं, जिसमें पेप्टाइड बॉन्ड कार्बोनिल समूह क्रमिक अवशेषों के साथ वैकल्पिक दिशाओं में इंगित करते हैं; तुलना के लिए, क्रमिक कार्बोनिल्स अल्फा हेलिक्स में एक ही दिशा में इंगित करते हैं।
अमीनो एसिड की प्रवृत्ति
बड़े सुगंधित अवशेष (टायरोसिन, फेनिलएलनिन, tryptophan ) और β-ब्रांच्ड अमीनो एसिड (थ्रेओनाइन, वेलिन, isoleucine ) β-किस्में β-चादरों के बीच में पाए जाने के पक्षधर हैं। विभिन्न प्रकार के अवशेष (जैसे PROLINE ) β-पत्रक में एज तंतु में पाए जाने की संभावना है, संभवतः प्रोटीन के बीच एज-टू-एज एसोसिएशन से बचने के लिए जो एकत्रीकरण और कलफ़ गठन का कारण बन सकता है।[2]
सामान्य संरचनात्मक रूपांकनों
β-हेयरपिन आकृति
β-पत्रक को शामिल करने वाला एक बहुत ही सरल संरचनात्मक रूपांकन है बीटा हेयरपिन | β-हेयरपिन, जिसमें दो एंटीपैरल समानांतर तंतु दो से पांच अवशेषों के एक छोटे लूप से जुड़े होते हैं, जिनमें से एक अक्सर ग्लाइसिन या प्रोलाइन होता है, जिनमें से दोनों कर सकते हैं टाइट बारी (जैव रसायन) या बीटा बल्ज लूप | β-बल्गे लूप के लिए आवश्यक डायहेड्रल-एंगल कन्फर्मेशन मान लें। अलग-अलग तंतु को अधिक विस्तृत तरीकों से जोड़ा जा सकता है जिसमें लंबे लूप होते हैं जिनमें अल्फा हेलिक्स | α-हेलीकेस हो सकते हैं।
ग्रीक कुंजी मूल भाव
ग्रीक कुंजी रूपांकनों में चार आसन्न एंटीपैरल समानांतर तंतु और उनके लिंकिंग लूप होते हैं। इसमें हेयरपिन से जुड़े तीन एंटीपेरेलल तंतु होते हैं, जबकि चौथा पहले के निकट होता है और तीसरे से लंबे लूप से जुड़ा होता है। प्रोटीन तह प्रक्रिया के दौरान इस प्रकार की संरचना आसानी से बनती है।[3][4] इसका नाम ग्रीक सजावटी कलाकृति के सामान्य पैटर्न के नाम पर रखा गया था (मेन्डर (कला) देखें)।
β-α-β मूल भाव
उनके घटक अमीनो एसिड की चिरायता के कारण, सभी किस्में दाएं हाथ के मोड़ को सबसे उच्च-क्रम β-पत्रक संरचनाओं में स्पष्ट रूप से प्रदर्शित करती हैं। विशेष रूप से, दो समानांतर तंतु के बीच लिंकिंग लूप में लगभग हमेशा एक दाहिने हाथ की क्रॉसओवर चिरायता होती है, जो पत्रक के अंतर्निहित मोड़ द्वारा दृढ़ता से पसंद की जाती है।[5] इस लिंकिंग लूप में अक्सर एक पेचदार क्षेत्र होता है, जिस स्थिति में इसे बीटा-अल्फा-बीटा | β-α-β मोटिफ कहा जाता है। β-α-β-α मोटिफ नामक एक बारीकी से संबंधित रूपांकन सबसे अधिक देखी जाने वाली प्रोटीन तृतीयक संरचना, TIM बैरल का मूल घटक बनाता है।


बीटा-विपर्यय आकृति
बीटा हेयरपिन लूप द्वारा एक साथ जुड़े दो या दो से अधिक लगातार एंटीपैरल β-किस्में से बना एक सरल संरचनात्मक रूपांकन प्रोटीन टोपोलॉजी।[7][8] यह मोटिफ β-पत्रक में आम है और बीटा बैरल | β-बैरल और बीटा प्रोपेलर | β-प्रोपेलर सहित कई संरचनात्मक आर्किटेक्चर में पाया जा सकता है।
प्रोटीन में β-मेन्डर क्षेत्रों का विशाल बहुमत पॉलीपेप्टाइड श्रृंखला के अन्य रूपांकनों या वर्गों के खिलाफ पैक पाया जाता है, जो हाइड्रोफोबिक कोर के कुछ हिस्सों का निर्माण करता है जो कैनोनिक रूप से तह संरचना का निर्माण करता है।[9] हालाँकि, कई उल्लेखनीय अपवादों में बाहरी सतह प्रोटीन A (OspA) संस्करण शामिल हैं[6]और सिंगल लेयर β-पत्रक प्रोटीन (SLBPs)[10] जिसमें पारंपरिक हाइड्रोफोबिक कोर के अभाव में सिंगल-लेयर β-पत्रक होते हैं। इन β-रिच प्रोटीन में एक विस्तारित सिंगल-लेयर β-मीएंडर β-पत्रक होती हैं जो मुख्य रूप से इंटर-β-तंतु इंटरैक्शन और हाइड्रोफोबिक इंटरैक्शन के माध्यम से स्थिर होती हैं जो अलग-अलग तंतु को जोड़ने वाले टर्न क्षेत्रों में मौजूद होती हैं।
साई-लूप मोटिफ
साई-लूप (Ψ-लूप) मोटिफ में दो एंटीपैरल समानांतर तंतु होते हैं जिनके बीच में एक तंतु होता है जो दोनों से हाइड्रोजन बॉन्ड से जुड़ा होता है।[11] सिंगल Ψ-लूप के लिए चार संभावित तंतु टोपोलॉजी हैं।[12] यह आकृति दुर्लभ है क्योंकि इसके गठन की प्रक्रिया प्रोटीन तह के दौरान होने की संभावना नहीं है। एस्पार्टिक एसिड प्रोटीज परिवार में पहली बार Ψ-पाश की पहचान की गई थी।[12]
β-चादरों के साथ प्रोटीन की संरचनात्मक संरचना
β-पत्रक All-β प्रोटीन|all-β, Α+β प्रोटीन|α+β और Α/β प्रोटीन|α/β डोमेन में मौजूद हैं, और कई पेप्टाइड्स या छोटे प्रोटीन में खराब परिभाषित समग्र वास्तुकला के साथ मौजूद हैं।[13][14] ऑल-β प्रोटीन|ऑल-β डोमेन बीटा बैरल बना सकते हैं|β-बैरल, β-सैंडविच, β-प्रिज्म, बीटा-प्रोपेलर डोमेन|β-प्रोपेलर, और बीटा हेलिक्स|β-हेलिकॉप्टर।
स्ट्रक्चरल टोपोलॉजी
β-पत्रक की टोपोलॉजी हाइड्रोजन बॉन्ड के क्रम का वर्णन करती है | आधार रज्जु के साथ हाइड्रोजन-बंधित β-किस्में। उदाहरण के लिए, फ्लेवोडॉक्सिन तह में 21345 टोपोलॉजी के साथ एक पांच-फंसे, समानांतर β-पत्रक है; इस प्रकार, किनारे की किस्में β-तंतु 2 और β-तंतु 5 आधार रज्जु के साथ हैं। स्पष्ट रूप से बताया गया है, β-तंतु 2, β-तंतु 1 से एच-बॉन्डेड है, जो β-तंतु 3 से एच-बॉन्ड है, जो β-तंतु 4 से एच-बॉन्ड है, जो β-तंतु 5 से एच-बॉन्ड है , दूसरा किनारा किनारा। उसी प्रणाली में, ऊपर वर्णित ग्रीक कुंजी मूल भाव में 4123 टोपोलॉजी है। एक β-पत्रक की द्वितीयक संरचना को मोटे तौर पर किस्में की संख्या, उनकी टोपोलॉजी, और क्या उनके हाइड्रोजन बांड समानांतर या एंटीपैरल हैं, देकर वर्णित किया जा सकता है।
β-चादरें खुली हो सकती हैं, जिसका अर्थ है कि उनके दो किनारे हैं (जैसे कि फ्लेवोडॉक्सिन फोल्ड या इम्युनोग्लोबुलिन गुना में) या वे 'बंद बीटा-बैरल | β-बैरल हो सकते हैं (जैसे कि टीआईएम बैरल)। बीटा-बैरल | β-बैरल को अक्सर उनके स्टैगर या शियर द्वारा वर्णित किया जाता है। कुछ खुली β-चादरें बहुत घुमावदार होती हैं और अपने ऊपर मुड़ी होती हैं (जैसा कि SH3 डोमेन में होता है) या घोड़े की नाल का आकार बनाती हैं (जैसा कि राइबोन्यूक्लिज़ अवरोधक में होता है)। ओपन β-पत्रक आमने-सामने (जैसे बीटा-प्रोपेलर डोमेन | β-प्रोपेलर डोमेन या इम्युनोग्लोबुलिन फोल्ड) या एज-टू-एज को इकट्ठा कर सकते हैं, जिससे एक बड़ी β-पत्रक बन सकती है।
गतिशील विशेषताएं
β-चुन्नटदार पत्रक संरचनाएं विस्तारित β-तंतु पॉलीपेप्टाइड श्रृंखलाओं से बनाई जाती हैं, जिसमें हाइड्रोजन बांड द्वारा उनके पड़ोसियों से जुड़ी किस्में होती हैं। इस विस्तारित रीढ़ की रचना के कारण, β-चादरें खिंचाव का विरोध करती हैं। प्रोटीन में β-पत्रक प्रोटीन और डीएनए में कम-आवृत्ति सामूहिक गति कर सकते हैं। रमन स्पेक्ट्रोस्कोपी द्वारा देखी गई कम-आवृत्ति अकॉर्डियन जैसी गति[15] और अर्ध-सातत्य मॉडल के साथ विश्लेषण किया।[16]
समानांतर β-हेलिसेस
एक बीटा हेलिक्स | β-हेलिक्स शॉर्ट लूप से जुड़े दो या तीन छोटे β-स्ट्रेंड्स वाली संरचनात्मक इकाइयों को दोहराने से बनता है। ये इकाइयां एक दूसरे के ऊपर पेचदार तरीके से खड़ी होती हैं ताकि समानांतर अभिविन्यास में एक दूसरे के साथ एक ही तंतु हाइड्रोजन-बॉन्ड की क्रमिक पुनरावृत्ति हो। अधिक जानकारी के लिए बीटा हेलिक्स | β-हेलिक्स आलेख देखें।
बाएं हाथ के β-हेलीकॉप्टर में, किस्में स्वयं काफी सीधी और बिना मुड़ी हुई होती हैं; परिणामी पेचदार सतहें लगभग सपाट होती हैं, जो एक नियमित त्रिकोणीय प्रिज्म आकार बनाती हैं, जैसा कि दाईं ओर 1QRE पुरातन कार्बोनिक एनहाइड्रेज़ के लिए दिखाया गया है। अन्य उदाहरण लिपिड ए सिंथेसिस एंजाइम एलपीएक्सए और कीट एंटीफ्रीज प्रोटीन हैं जो बर्फ की संरचना की नकल करने वाले एक चेहरे पर थ्र साइडचेन्स की एक नियमित सरणी के साथ होते हैं।[17]
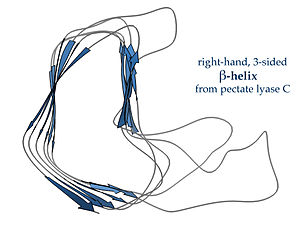
राइटहैंडेड β-हेलीकॉप्स, बाईं ओर दिखाए गए पेक्टेट लाईसे एंजाइम द्वारा टाइप किया गया या फेज P22 टेलस्पाइक प्रोटीन, एक कम नियमित क्रॉस-सेक्शन है, जो एक तरफ लंबा और इंडेंटेड है; तीन लिंकर छोरों में से एक लगातार केवल दो अवशेष लंबा होता है और अन्य परिवर्तनशील होते हैं, जिन्हें अक्सर बाध्यकारी या सक्रिय साइट बनाने के लिए विस्तृत किया जाता है।[18]
कुछ बैक्टीरियल मेटलोप्रोटीज में दो तरफा β-हेलिक्स (दाएं हाथ का) पाया जाता है; इसके दो लूप प्रत्येक छह अवशेष लंबे होते हैं और संरचना की अखंडता को बनाए रखने के लिए कैल्शियम आयनों को स्थिर करते हैं, बैकबोन और जीजीएक्सजीएक्सडी अनुक्रम आकृति के एस्प साइड चेन ऑक्सीजेन का उपयोग करते हैं।[19] इस तह को SCOP वर्गीकरण में β-रोल कहा जाता है।
पैथोलॉजी में
कुछ प्रोटीन जो मोनोमर्स के रूप में अव्यवस्थित या पेचदार होते हैं, जैसे एमिलॉयड β (अमाइलॉइड पट्टिका देखें) पैथोलॉजिकल राज्यों से जुड़े β-पत्रक-समृद्ध ओलिगोमेरिक संरचनाएं बना सकते हैं। अमाइलॉइड β प्रोटीन के ओलिगोमेरिक रूप को अल्जाइमर रोग | अल्जाइमर के कारण के रूप में फंसाया जाता है। इसकी संरचना अभी तक पूर्ण रूप से निर्धारित नहीं की गई है, लेकिन हाल के आंकड़ों से पता चलता है कि यह असामान्य दो-तंतु β-हेलिक्स के समान हो सकता है।[20] β-पत्रक संरचना में पाए जाने वाले अमीनो एसिड अवशेषों से पार्श्व श्रृंखलाओं को भी इस तरह से व्यवस्थित किया जा सकता है कि पत्रक के एक तरफ आसन्न पक्ष श्रृंखलाओं में से कई हाइड्रोफोबिक हैं, जबकि उनमें से कई पत्रक के वैकल्पिक पक्ष पर एक दूसरे से सटे हुए हैं। ध्रुवीय या आवेशित (हाइड्रोफिलिक) हैं,[21] जो उपयोगी हो सकता है यदि पत्रक को ध्रुवीय/पानी और गैर-ध्रुवीय/चिकना वातावरण के बीच एक सीमा बनाना है।
यह भी देखें
- कोलेजन हेलिक्स
- फ़ोल्डर
- तह (रसायन विज्ञान)
- तृतीयक संरचना
- अल्फा हेलिक्स|α-हेलिक्स
- संरचनात्मक रूप
संदर्भ
- ↑ Voet D, Voet JG (2004). जीव रसायन (3rd ed.). Hoboken, NJ: Wiley. pp. 227–231. ISBN 0-471-19350-X.
- ↑ Richardson JS, Richardson DC (March 2002). "प्राकृतिक बीटा-शीट प्रोटीन एज-टू-एज एकत्रीकरण से बचने के लिए नकारात्मक डिज़ाइन का उपयोग करते हैं". Proceedings of the National Academy of Sciences of the United States of America. 99 (5): 2754–9. Bibcode:2002PNAS...99.2754R. doi:10.1073/pnas.052706099. PMC 122420. PMID 11880627.
- ↑ Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- ↑ Hutchinson EG, Thornton JM (April 1993). "The Greek key motif: extraction, classification and analysis". Protein Engineering. 6 (3): 233–45. doi:10.1093/protein/6.3.233. PMID 8506258.
- ↑ See sections II B and III C, D in Richardson JS (1981). "The Anatomy and Taxonomy of Protein Structure". Anatomy and Taxonomy of Protein Structures. pp. 167–339. doi:10.1016/s0065-3233(08)60520-3. ISBN 0-12-034234-0. PMID 7020376.
{{cite book}}:|journal=ignored (help) - ↑ 6.0 6.1 Makabe K, McElheny D, Tereshko V, Hilyard A, Gawlak G, Yan S, et al. (November 2006). "पेप्टाइड स्व-विधानसभा की परमाणु संरचना नकल करती है". Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17753–8. Bibcode:2006PNAS..10317753M. doi:10.1073/pnas.0606690103. PMC 1693819. PMID 17093048.
- ↑ "SCOP: Fold: WW domain-like". Archived from the original on 2012-02-04. Retrieved 2007-06-01.
- ↑ PPS '96 – Super Secondary Structure
- ↑ Biancalana M, Makabe K, Koide S (February 2010). "पानी में घुलनशील क्रॉस-बीटा वास्तुकला का न्यूनतम डिजाइन". Proceedings of the National Academy of Sciences of the United States of America. 107 (8): 3469–74. Bibcode:2010PNAS..107.3469B. doi:10.1073/pnas.0912654107. PMC 2840449. PMID 20133689.
- ↑ Xu, Qingping; Biancalana, Matthew; Grant, Joanna C.; Chiu, Hsiu-Ju; Jaroszewski, Lukasz; Knuth, Mark W.; Lesley, Scott A.; Godzik, Adam; Elsliger, Marc-André; Deacon, Ashley M.; Wilson, Ian A. (September 2019). "Structures of single-layer β-sheet proteins evolved from β-hairpin repeats". Protein Science. 28 (9): 1676–1689. doi:10.1002/pro.3683. ISSN 1469-896X. PMC 6699103. PMID 31306512.
- ↑ Hutchinson EG, Thornton JM (February 1996). "PROMOTIF - प्रोटीन में संरचनात्मक रूपांकनों की पहचान और विश्लेषण करने का कार्यक्रम". Protein Science. 5 (2): 212–20. doi:10.1002/pro.5560050204. PMC 2143354. PMID 8745398.
- ↑ 12.0 12.1 Hutchinson EG, Thornton JM (1990). "हेरा - प्रोटीन माध्यमिक संरचनाओं के योजनाबद्ध आरेख बनाने के लिए एक कार्यक्रम". Proteins. 8 (3): 203–12. doi:10.1002/prot.340080303. PMID 2281084. S2CID 28921557.
- ↑ Hubbard TJ, Murzin AG, Brenner SE, Chothia C (January 1997). "SCOP: a structural classification of proteins database". Nucleic Acids Research. 25 (1): 236–9. doi:10.1093/nar/25.1.236. PMC 146380. PMID 9016544.
- ↑ Fox NK, Brenner SE, Chandonia JM (January 2014). "SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures". Nucleic Acids Research. 42 (Database issue): D304-9. doi:10.1093/nar/gkt1240. PMC 3965108. PMID 24304899.
- ↑ Painter PC, Mosher LE, Rhoads C (July 1982). "प्रोटीन के रमन स्पेक्ट्रा में कम आवृत्ति मोड". Biopolymers. 21 (7): 1469–72. doi:10.1002/bip.360210715. PMID 7115900.
- ↑ Chou KC (August 1985). "प्रोटीन अणुओं में कम आवृत्ति गति। बीटा-शीट और बीटा-बैरल". Biophysical Journal. 48 (2): 289–97. Bibcode:1985BpJ....48..289C. doi:10.1016/S0006-3495(85)83782-6. PMC 1329320. PMID 4052563.
- ↑ Liou YC, Tocilj A, Davies PL, Jia Z (July 2000). "सतह हाइड्रॉक्सिल और बीटा-हेलिक्स एंटीफ्रीज प्रोटीन के पानी द्वारा बर्फ की संरचना की नकल". Nature. 406 (6793): 322–4. Bibcode:2000Natur.406..322L. doi:10.1038/35018604. PMID 10917536. S2CID 4385352.
- ↑ Branden C, Tooze J (1999). प्रोटीन संरचना का परिचय. New York: Garland. pp. 20–32. ISBN 0-8153-2305-0.
- ↑ Baumann U, Wu S, Flaherty KM, McKay DB (September 1993). "Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif". The EMBO Journal. 12 (9): 3357–64. doi:10.1002/j.1460-2075.1993.tb06009.x. PMC 413609. PMID 8253063.
- ↑ Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D (June 2005). "अमाइलॉइड जैसे तंतुओं के क्रॉस-बीटा पाइन की संरचना". Nature. 435 (7043): 773–8. Bibcode:2005Natur.435..773N. doi:10.1038/nature03680. PMC 1479801. PMID 15944695.
- ↑ Zhang S, Holmes T, Lockshin C, Rich A (April 1993). "एक स्थिर मैक्रोस्कोपिक झिल्ली बनाने के लिए एक स्व-पूरक ऑलिगोपेप्टाइड का सहज संयोजन". Proceedings of the National Academy of Sciences of the United States of America. 90 (8): 3334–8. Bibcode:1993PNAS...90.3334Z. doi:10.1073/pnas.90.8.3334. PMC 46294. PMID 7682699.
अग्रिम पठन
- Cooper J (31 May 1996). "Super Secondary Structure - Part II". Principles of Protein Structure Using the Internet. Retrieved 25 May 2007.
- "Open-sided Beta-meander". Structural Classification of Proteins (SCOP). 20 October 2006. Archived from the original on 4 February 2012. Retrieved 31 May 2007.