कास्टनर-केल्नर प्रक्रिया: Difference between revisions
No edit summary |
|||
| Line 1: | Line 1: | ||
{{Short description|Method of electrolysis of alkali chloride solutions}} | {{Short description|Method of electrolysis of alkali chloride solutions}} | ||
'''कास्टनर-केल्नर प्रक्रिया''' संबंधित क्षार हाइड्रॉक्साइड का उत्पादन करने के लिए [[जलीय]] क्षार [[क्लोराइड]] | '''कास्टनर-केल्नर प्रक्रिया''' संबंधित क्षार हाइड्रॉक्साइड का उत्पादन करने के लिए [[जलीय]] क्षार [[क्लोराइड]] विलयन (आमतौर पर सोडियम क्लोराइड विलयन) पर विद्युतपघटन की एक विधि है,<ref>Pauling, Linus; ''General Chemistry'' 1970 ed. pp. 539–541 Dover publishing</ref> जिसका आविष्कार 1890 के दशक में अमेरिकी हैमिल्टन कास्टनर और ऑस्ट्रियाई कार्ल केल्नर ने किया था।<ref>{{cite book |author1=Trinder, Barrie Stuart |author2=Stratton, Michael |title=बीसवीं सदी का औद्योगिक पुरातत्व|publisher=E&FN Spon |location=London |year=2000 |pages=80–81 |isbn=978-0-419-24680-0 }}</ref><ref>{{cite web|title=नमकीन पानी का इलेक्ट्रोलिसिस|url=http://www.saltsense.co.uk/hist-chem12.htm |archive-url=https://web.archive.org/web/20070514034157/http://www.saltsense.co.uk/hist-chem12.htm |archive-date=May 14, 2007|publisher=Salt Manufacturers' Association|series=Salt and the Chemical Revolution}}</ref> कम ऊर्जा लागत और कम पर्यावरणीय चिंताओं के कारण, कास्टनर-केल्नर प्रक्रिया को धीरे-धीरे आवरण विद्युतपघटन से परिवर्तित किया जा रहा है।<ref>https://www.eurochlor.org/topics/mercury/</ref> | ||
==इतिहास== | ==इतिहास== | ||
इलेक्ट्रोलाइजिंग ब्राइन का पहला पेटेंट 1851 में [[चार्ल्स वॉट]] को इंग्लैंड में दिया गया था। हालाँकि, उनकी प्रक्रिया सोडियम हाइड्रॉक्साइड के उत्पादन के लिए आर्थिक रूप से व्यवहार्य तरीका नहीं थी क्योंकि यह [[नमकीन]] पानी के घोल में बनने वाले क्लोरीन को उसके अन्य घटकों के साथ | इलेक्ट्रोलाइजिंग ब्राइन का पहला पेटेंट 1851 में [[चार्ल्स वॉट]] को इंग्लैंड में दिया गया था। हालाँकि, उनकी प्रक्रिया सोडियम हाइड्रॉक्साइड के उत्पादन के लिए आर्थिक रूप से व्यवहार्य तरीका नहीं थी क्योंकि यह [[नमकीन]] पानी के घोल में बनने वाले क्लोरीन को उसके अन्य घटकों के साथ अभिक्रिया करने से नहीं रोक सकती थी। अमेरिकी रसायनज्ञ और इंजीनियर, हैमिल्टन कास्टनर ने पारा सेल के आविष्कार के साथ मिश्रण की समस्या का विलयन किया और उन्हें 1894 में अमेरिकी पेटेंट प्रदान किया गया।<ref>{{cite patent| inventor-last = Castner| inventor-first = H.Y.| issue-date = 30 Oct 1984| title = क्षारीय लवणों के इलेक्ट्रोलाइटिक अपघटन की प्रक्रिया और उपकरण| country-code = US| patent-number = 528322}}<!-- UK patent was issued in 1892 --></ref> ऑस्ट्रियाई रसायनशास्त्री कार्ल केलनर लगभग उसी समय इसी तरह के विलयन पर पहुंचे। कानूनी लड़ाई से बचने के लिए वे 1895 में भागीदार बने और कास्टनर-केल्नर अल्कली कंपनी की स्थापना की, जिसने पूरे यूरोप में इस प्रक्रिया को नियोजित करने वाले संयंत्र बनाए। पारा सेल प्रक्रिया का प्रयोग आज भी जारी है।<ref>{{cite journal| last = Kiefer| first = David M.| title = जब उद्योग ने आगे बढ़ने का आरोप लगाया|series=Chemistry Chronicles| journal = Today's Chemist at Work| volume = 11| issue = 3| page = 9| date = April 2002| url = http://pubs.acs.org/subscribe/journals/tcaw/11/i04/html/04chemistry.html| publisher = American Chemical Society}}</ref> वर्तमान समय में पारा सेल संयंत्र के संचालन की पर्यावरणीय रिहाई के लिए आलोचना की जाती है<ref>{{cite web|title=Chlorine Plants: Major, Overlooked Source of Mercury Pollution |publisher=Oceana |url=http://www.oceana.org/index.php?id=1707 |archive-url=https://web.archive.org/web/20110720142805/http://www.oceana.org/index.php?id=1707 |archive-date=20 Jul 2011}}</ref> जिससे कुछ मामलों में [[पारा विषाक्तता]] गंभीर हो जाती है (जैसा कि जापान में हुआ)। इन चिंताओं के कारण, पारा सेल संयंत्रों को चरणबद्ध तरीके से समाप्त किया जा रहा है, और मौजूदा संयंत्रों से पारा उत्सर्जन को कम करने के लिए निरंतर प्रयास किया जा रहा है।<ref>{{cite web|title=क्लोर-क्षार क्षेत्र में पारे की कमी के लिए वैश्विक पारा साझेदारी पर विश्व क्लोरीन परिषद का प्रस्तुतीकरण|url=http://www.chem.unep.ch/Mercury/partnerships/progress-reports/WCC%20Submission.pdf|archive-url=https://web.archive.org/web/20110525111624/http://www.chem.unep.ch/Mercury/partnerships/progress-reports/WCC%20Submission.pdf|archive-date=2011-05-25}}</ref> | ||
==प्रक्रिया विवरण== | ==प्रक्रिया विवरण== | ||
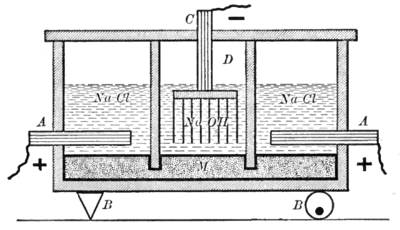
[[Image:HgNaOHElectrolysis.png|thumb|400px|right|कास्टनर-केल्नर उपकरण]]दिखाया गया उपकरण [[स्लेट]] की दीवारों से अलग होकर दो प्रकार की | [[Image:HgNaOHElectrolysis.png|thumb|400px|right|कास्टनर-केल्नर उपकरण]]दिखाया गया उपकरण [[स्लेट]] की दीवारों से अलग होकर दो प्रकार की सेल्स में विभाजित है। पहला प्रकार, जो आरेख के दाएं और बाएं दिखाया गया है, सोडियम क्लोराइड विलयन के इलेक्ट्रोलाइट, एक [[ग्रेफाइट|रेफाइट]] [[एनोड]] (A), और एक पारा कैथोड (M) का उपयोग करता है। आरेख के केंद्र में दिखाए गए अन्य प्रकार के सेल, [[सोडियम हाइड्रॉक्साइड]] विलयन के इलेक्ट्रोलाइट, एक पारा एनोड (M), और एक लौह कैथोड (D) का उपयोग करते हैं। पारा इलेक्ट्रोड दो सेल्स के बीच आम है। यह सेल्स को अलग करने वाली दीवारों को इलेक्ट्रोलाइट्स के स्तर से नीचे गिराकर प्राप्त किया जाता है लेकिन फिर भी पारा को उनके नीचे प्रवाहित होने देता है।<ref>Newell, Lyman C.; ''Descriptive Chemistry'' p. 291; D. C. Heath and company, 1903</ref> | ||
:2 | एनोड (A) पर अभिक्रिया है: | ||
:2 Cl<sup>−</sup> → Cl<sub>2</sub> + 2 e<sup>−</sup> | |||
परिणामस्वरूप [[क्लोरीन]] गैस बाहरी | जिसके परिणामस्वरूप [[क्लोरीन]] गैस बाहरी सेल्स के शीर्ष पर प्रवाहित होती है, जहां इसे प्रक्रिया के उपोत्पाद के रूप में एकत्र किया जाता है। बाह्य कोशिकाओं में मरकरी कैथोड पर अभिक्रिया होती है | ||
: | :: Na<sup>+</sup> + e<sup>−</sup> → Na (मिश्रण) | ||
: | |||
इस अभिक्रिया से बनने वाली [[सोडियम]] धातु पारे में घुलकर मिश्रण बनाती है। पारा बाहरी कोशिकाओं से केंद्र कोशिका तक धारा का संचालन करता है। इसके अलावा, एक रॉकिंग मैकेनिज्म (B को बाईं ओर फुलक्रम और दाईं ओर घूर्णन उत्केन्द्र द्वारा दिखाया गया है) बाहरी सेल्स से केंद्र सेल तक घुली सोडियम धातु को ले जाने के लिए पारा को संदीप्त करता है। | |||
केंद्र कोशिका में एनोड अभिक्रिया पारा और सोडियम हाइड्रॉक्साइड घोल के बीच इंटरफेस पर होती है। | |||
:2Na (मिश्रण) → 2Na<sup>+</sup> + 2e<sup>−</sup> | |||
अंततः केंद्र कोशिका के आयरन कैथोड (D) पर अभिक्रिया होती है | |||
:: 2H<sub>2</sub>O + 2e<sup>−</sup> → 2OH<sup>−</sup> + H<sub>2</sub> | |||
शुद्ध प्रभाव यह होता है कि बाहरी सेल्स में सोडियम क्लोराइड की सांद्रता कम हो जाती है और केंद्र कोशिका में सोडियम हाइड्रॉक्साइड की सांद्रता बढ़ जाती है। जैसे-जैसे प्रक्रिया जारी रहती है, कुछ सोडियम हाइड्रॉक्साइड घोल को आउटपुट उत्पाद के रूप में केंद्र कोशिका से निकाल लिया जाता है और पानी से बदल दिया जाता है। इलेक्ट्रोलाइज्ड की गई सेल्स को बदलने के लिए बाहरी सेल्स में सोडियम क्लोराइड मिलाया जाता है। | |||
: | |||
शुद्ध प्रभाव यह होता है कि बाहरी | |||
==यह भी देखें== | ==यह भी देखें== | ||
Revision as of 06:21, 26 July 2023
कास्टनर-केल्नर प्रक्रिया संबंधित क्षार हाइड्रॉक्साइड का उत्पादन करने के लिए जलीय क्षार क्लोराइड विलयन (आमतौर पर सोडियम क्लोराइड विलयन) पर विद्युतपघटन की एक विधि है,[1] जिसका आविष्कार 1890 के दशक में अमेरिकी हैमिल्टन कास्टनर और ऑस्ट्रियाई कार्ल केल्नर ने किया था।[2][3] कम ऊर्जा लागत और कम पर्यावरणीय चिंताओं के कारण, कास्टनर-केल्नर प्रक्रिया को धीरे-धीरे आवरण विद्युतपघटन से परिवर्तित किया जा रहा है।[4]
इतिहास
इलेक्ट्रोलाइजिंग ब्राइन का पहला पेटेंट 1851 में चार्ल्स वॉट को इंग्लैंड में दिया गया था। हालाँकि, उनकी प्रक्रिया सोडियम हाइड्रॉक्साइड के उत्पादन के लिए आर्थिक रूप से व्यवहार्य तरीका नहीं थी क्योंकि यह नमकीन पानी के घोल में बनने वाले क्लोरीन को उसके अन्य घटकों के साथ अभिक्रिया करने से नहीं रोक सकती थी। अमेरिकी रसायनज्ञ और इंजीनियर, हैमिल्टन कास्टनर ने पारा सेल के आविष्कार के साथ मिश्रण की समस्या का विलयन किया और उन्हें 1894 में अमेरिकी पेटेंट प्रदान किया गया।[5] ऑस्ट्रियाई रसायनशास्त्री कार्ल केलनर लगभग उसी समय इसी तरह के विलयन पर पहुंचे। कानूनी लड़ाई से बचने के लिए वे 1895 में भागीदार बने और कास्टनर-केल्नर अल्कली कंपनी की स्थापना की, जिसने पूरे यूरोप में इस प्रक्रिया को नियोजित करने वाले संयंत्र बनाए। पारा सेल प्रक्रिया का प्रयोग आज भी जारी है।[6] वर्तमान समय में पारा सेल संयंत्र के संचालन की पर्यावरणीय रिहाई के लिए आलोचना की जाती है[7] जिससे कुछ मामलों में पारा विषाक्तता गंभीर हो जाती है (जैसा कि जापान में हुआ)। इन चिंताओं के कारण, पारा सेल संयंत्रों को चरणबद्ध तरीके से समाप्त किया जा रहा है, और मौजूदा संयंत्रों से पारा उत्सर्जन को कम करने के लिए निरंतर प्रयास किया जा रहा है।[8]
प्रक्रिया विवरण
दिखाया गया उपकरण स्लेट की दीवारों से अलग होकर दो प्रकार की सेल्स में विभाजित है। पहला प्रकार, जो आरेख के दाएं और बाएं दिखाया गया है, सोडियम क्लोराइड विलयन के इलेक्ट्रोलाइट, एक रेफाइट एनोड (A), और एक पारा कैथोड (M) का उपयोग करता है। आरेख के केंद्र में दिखाए गए अन्य प्रकार के सेल, सोडियम हाइड्रॉक्साइड विलयन के इलेक्ट्रोलाइट, एक पारा एनोड (M), और एक लौह कैथोड (D) का उपयोग करते हैं। पारा इलेक्ट्रोड दो सेल्स के बीच आम है। यह सेल्स को अलग करने वाली दीवारों को इलेक्ट्रोलाइट्स के स्तर से नीचे गिराकर प्राप्त किया जाता है लेकिन फिर भी पारा को उनके नीचे प्रवाहित होने देता है।[9]
एनोड (A) पर अभिक्रिया है:
- 2 Cl− → Cl2 + 2 e−
जिसके परिणामस्वरूप क्लोरीन गैस बाहरी सेल्स के शीर्ष पर प्रवाहित होती है, जहां इसे प्रक्रिया के उपोत्पाद के रूप में एकत्र किया जाता है। बाह्य कोशिकाओं में मरकरी कैथोड पर अभिक्रिया होती है
- Na+ + e− → Na (मिश्रण)
इस अभिक्रिया से बनने वाली सोडियम धातु पारे में घुलकर मिश्रण बनाती है। पारा बाहरी कोशिकाओं से केंद्र कोशिका तक धारा का संचालन करता है। इसके अलावा, एक रॉकिंग मैकेनिज्म (B को बाईं ओर फुलक्रम और दाईं ओर घूर्णन उत्केन्द्र द्वारा दिखाया गया है) बाहरी सेल्स से केंद्र सेल तक घुली सोडियम धातु को ले जाने के लिए पारा को संदीप्त करता है।
केंद्र कोशिका में एनोड अभिक्रिया पारा और सोडियम हाइड्रॉक्साइड घोल के बीच इंटरफेस पर होती है।
- 2Na (मिश्रण) → 2Na+ + 2e−
अंततः केंद्र कोशिका के आयरन कैथोड (D) पर अभिक्रिया होती है
- 2H2O + 2e− → 2OH− + H2
शुद्ध प्रभाव यह होता है कि बाहरी सेल्स में सोडियम क्लोराइड की सांद्रता कम हो जाती है और केंद्र कोशिका में सोडियम हाइड्रॉक्साइड की सांद्रता बढ़ जाती है। जैसे-जैसे प्रक्रिया जारी रहती है, कुछ सोडियम हाइड्रॉक्साइड घोल को आउटपुट उत्पाद के रूप में केंद्र कोशिका से निकाल लिया जाता है और पानी से बदल दिया जाता है। इलेक्ट्रोलाइज्ड की गई सेल्स को बदलने के लिए बाहरी सेल्स में सोडियम क्लोराइड मिलाया जाता है।
यह भी देखें
संदर्भ
- ↑ Pauling, Linus; General Chemistry 1970 ed. pp. 539–541 Dover publishing
- ↑ Trinder, Barrie Stuart; Stratton, Michael (2000). बीसवीं सदी का औद्योगिक पुरातत्व. London: E&FN Spon. pp. 80–81. ISBN 978-0-419-24680-0.
- ↑ "नमकीन पानी का इलेक्ट्रोलिसिस". Salt and the Chemical Revolution. Salt Manufacturers' Association. Archived from the original on May 14, 2007.
- ↑ https://www.eurochlor.org/topics/mercury/
- ↑ US 528322, Castner, H.Y., "क्षारीय लवणों के इलेक्ट्रोलाइटिक अपघटन की प्रक्रिया और उपकरण", issued 30 Oct 1984
- ↑ Kiefer, David M. (April 2002). "जब उद्योग ने आगे बढ़ने का आरोप लगाया". Today's Chemist at Work. Chemistry Chronicles. American Chemical Society. 11 (3): 9.
- ↑ "Chlorine Plants: Major, Overlooked Source of Mercury Pollution". Oceana. Archived from the original on 20 Jul 2011.
- ↑ "क्लोर-क्षार क्षेत्र में पारे की कमी के लिए वैश्विक पारा साझेदारी पर विश्व क्लोरीन परिषद का प्रस्तुतीकरण" (PDF). Archived from the original (PDF) on 2011-05-25.
- ↑ Newell, Lyman C.; Descriptive Chemistry p. 291; D. C. Heath and company, 1903