मायोजेनेसिस: Difference between revisions
(Created page with "{{short description|Formation of muscular tissue, particularly during embryonic development}} मायोजेनेसिस कंकाल की मांसपेशि...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{short description|Formation of muscular tissue, particularly during embryonic development}} | {{short description|Formation of muscular tissue, particularly during embryonic development}} | ||
मायोजेनेसिस कंकाल की मांसपेशियों का | मायोजेनेसिस कंकाल की मांसपेशियों का निर्माण है, विशेषकर भ्रूण के विकास के समय। | ||
[[File:Myoblast Fusion - Myogenesis.jpg|thumb|300px| | [[File:Myoblast Fusion - Myogenesis.jpg|thumb|300px|मायोबलास्ट (एकल नाभिक वाली कोशिकाएं, बैंगनी रंग में प्रदर्शित) मायोजेनेसिस के समय कंकाल की मांसपेशी#कंकाल की मांसपेशी फाइबर (बहुकेंद्रकीय मांसपेशी कोशिकाएं) बनाने के लिए साथ मिलकर]]मांसपेशी फाइबर सामान्यतः पूर्ववर्ती मायोब्लास्ट के संलयन के माध्यम से[[ बहुकेन्द्रीय | बहुकेन्द्रीय]] फाइबर में बनते हैं जिन्हें मायोट्यूब कहा जाता है। [[भ्रूण]] के प्रारम्भिक विकास में, मायोबलास्ट या तो कोशिका प्रसार कर सकते हैं, या [[सेलुलर भेदभाव|कोशिकीय विभेदन]] मायोट्यूब में कर सकते हैं। विवो में इस चयन को क्या नियंत्रित करता है यह सामान्यतः अस्पष्ट है। यदि कोशिका संवर्धन में रखा जाता है, तो अधिकांश मायोबलास्ट फैलेंगे यदि पर्याप्त [[ फाइब्रोब्लास्ट वृद्धि कारक |फाइब्रोब्लास्ट वृद्धि कारक]] (एफजीएफ) या अन्य वृद्धि कारक कोशिकाओं के निकट के माध्यम में स्थित हो। जब विकास कारक समाप्त हो जाता है, मायोबलास्ट विभाजन संवृत कर देते हैं और मायोट्यूब में टर्मिनल विभेदन से गुजरते हैं। मायोबलास्ट विभेदन चरणों में आगे बढ़ता है। पहले चरण में, कोशिका चक्र से बाहर निकलना और कुछ जीनों की अभिव्यक्ति के प्रारम्भ सम्मिलित है। | ||
विभेदन के दूसरे चरण में मायोबलास्ट का दूसरे के साथ संरेखण सम्मिलित है। अध्ययनों से पता चला है कि चूहे और चूजे के मायोबलास्ट भी सम्मिलित तंत्र के विकासवादी संरक्षण का सुझाव देते हुए दूसरे के साथ पहचान और संरेखित कर सकते हैं।<ref>{{cite journal|last1=Yaffe|title=विभिन्न आनुवंशिक उत्पत्ति के मायोबलास्ट्स से संकर बहुसंस्कृति वाले मांसपेशी फाइबर का निर्माण|doi=10.1016/0012-1606(65)90062-X|year=1965|first1=David|last2=Feldman|first2=Michael|journal=Developmental Biology|volume=11|issue=2|pages=300–317|pmid=14332576 }}</ref> | |||
तीसरा चरण वास्तविक कोशिका संलयन ही है। इस अवस्था में, [[कैल्शियम]] आयनों की उपस्थिति महत्वपूर्ण होती है। मनुष्यों में संलयन [[ADAM12|एडम12]] [[जीन]] और कई अन्य प्रोटीनों द्वारा कोडित [[मेटेलोप्रोटीनेज]] के समूह द्वारा सहायता प्राप्त है। संलयन में [[सरकोलेममा]] में [[एक्टिन]] की भर्ती सम्मिलित होती है, इसके बाद निकट स्थितिक और छिद्र का निर्माण होता है जो बाद में तीव्रता से चौड़ा होता है। | |||
== | प्रक्रिया के समय अभिव्यक्त होने वाले नवीन जीन और उनके प्रोटीन उत्पाद कई प्रयोगशालाओं में सक्रिय जांच के अधीन हैं। वे सम्मिलित करते हैं: | ||
# [[Mef2|एमईएफ2]] , जो मायोजेनेसिस को बढ़ावा देते हैं। | |||
# [[सीरम प्रतिक्रिया कारक]] (एसआरएफ) रेखित अल्फा-एक्टिन जीन की अभिव्यक्ति के लिए आवश्यक होने के कारण मायोजेनेसिस के समय केंद्रीय भूमिका निभाता है।<ref>{{cite journal |vauthors=Wei L, Zhou W, Croissant JD, Johansen FE, Prywes R, Balasubramanyam A, Schwartz RJ |date=Nov 1998 | title = सीरम प्रतिक्रिया कारक के माध्यम से RhoA सिग्नलिंग मायोजेनिक भेदभाव में एक अनिवार्य भूमिका निभाता है| journal = J Biol Chem | volume = 273 | issue = 46| pages = 30287–94 | pmid = 9804789 | doi=10.1074/jbc.273.46.30287| doi-access = free }}</ref> कंकाल [[अल्फा-एक्टिन]] की अभिव्यक्ति को [[एण्ड्रोजन रिसेप्टर|एण्ड्रोजन संग्राहक]] द्वारा भी नियंत्रित किया जाता है; स्टेरॉयड इस प्रकार मायोजेनेसिस को नियंत्रित कर सकते हैं।<ref>{{cite journal |vauthors=Vlahopoulos S, Zimmer WE, Jenster G, Belaguli NS, Balk SP, Brinkmann AO, Lanz RB, Zoumpourlis VC, Schwartz RJ | year = 2005 | title = सीरम प्रतिक्रिया कारक के माध्यम से एण्ड्रोजन रिसेप्टर की भर्ती मायोजेनिक जीन की अभिव्यक्ति की सुविधा प्रदान करती है| journal = J Biol Chem | volume = 280 | issue = 9| pages = 7786–92 | doi = 10.1074/jbc.M413992200 | pmid = 15623502 |display-authors=etal| doi-access = free }}</ref> | |||
# [[मायोजेनिक नियामक कारक]] (एमईएफ): मयोडी, मायिफ5, मायिफ6 और मायोजेनिन। | |||
== अवलोकन == | |||
मांसपेशियों के विकास, या मायोजेनेसिस के कई चरण (नीचे सूचीबद्ध) हैं।<ref name="neuromuscular.wustl">{{cite web|last=Pestronk|first=Alan|title=मायोजेनेसिस और स्नायु उत्थान|url=http://neuromuscular.wustl.edu/mother/myogenesis.html|work=WU Neuromuscular|publisher=Washington University|accessdate=2013-03-16}}</ref> प्रत्येक चरण में विभिन्न संबंधित अनुवांशिक कारक होते हैं जिनकी कमी के परिणामस्वरूप मांसपेशियों के दोष होंगे। | मांसपेशियों के विकास, या मायोजेनेसिस के कई चरण (नीचे सूचीबद्ध) हैं।<ref name="neuromuscular.wustl">{{cite web|last=Pestronk|first=Alan|title=मायोजेनेसिस और स्नायु उत्थान|url=http://neuromuscular.wustl.edu/mother/myogenesis.html|work=WU Neuromuscular|publisher=Washington University|accessdate=2013-03-16}}</ref> प्रत्येक चरण में विभिन्न संबंधित अनुवांशिक कारक होते हैं जिनकी कमी के परिणामस्वरूप मांसपेशियों के दोष होंगे। | ||
| Line 19: | Line 20: | ||
{|class="wikitable" | {|class="wikitable" | ||
|- | |- | ||
! | !चरण!!संबद्ध आनुवंशिक कारक | ||
|- | |- | ||
| | |विस्तारण ||[[PAX3|पैक्स3]], [[c-Met|सी-मेट]] | ||
|- | |- | ||
| | |अभिगमन ||सी-मेट/[[Hepatocyte growth factor|एचजीएफ]], [[LBX1|एलबीएक्स1]] | ||
|- | |- | ||
| | |प्रचुरणी ||पैक्स3, सी-मेट, मोक्स2, [[MSX1|एमएसएक्स1]], सिक्स1/4, [[Myf5|मायिफ5]], [[MyoD|मयोडी]] | ||
|- | |- | ||
| | |निरूपण ||मायिफ5 और मयोडी | ||
|- | |- | ||
| | |विभेदन ||[[Myogenin|मायोजेनिन]], [[MCF2|एमसीएफ2]], सिक्स1/4, मयोडी, [[Myf6|मायिफ6]] | ||
|- | |- | ||
| | |विशिष्ट मांसपेशी निर्माण ||एलबीएक्स1, मेओक्स2 | ||
|- | |- | ||
| | |अनुषंगी कोशिका ||[[PAX7|पैक्स7]] | ||
|} | |} | ||
=== परिसीमन === | === परिसीमन === | ||
[[File:Patient with Waardenburg-Klein syndrome (1916).jpg|thumb|चौड़ी आंखों वाले [[वार्डनबर्ग सिंड्रोम]] III (वार्डनबर्ग क्लेन सिंड्रोम) के रोगी।|alt=वार्डनबर्ग सिंड्रोम III (वार्डनबर्ग-क्लेन सिंड्रोम) के रोगी]]संबद्ध आनुवंशिक कारक: [[PAX3]] और | [[File:Patient with Waardenburg-Klein syndrome (1916).jpg|thumb|चौड़ी आंखों वाले [[वार्डनबर्ग सिंड्रोम]] III (वार्डनबर्ग क्लेन सिंड्रोम) के रोगी।|alt=वार्डनबर्ग सिंड्रोम III (वार्डनबर्ग-क्लेन सिंड्रोम) के रोगी]]संबद्ध आनुवंशिक कारक: [[PAX3|पैक्स3]] और सी-मेट<br /> | ||
पैक्स3 में उत्परिवर्तन [[ सी मेट |सी मेट]] अभिव्यक्ति में विफलता का कारण बन सकता है। इस प्रकार के उत्परिवर्तन के परिणामस्वरूप पार्श्व प्रवासन की कमी होगी। | |||
पैक्स3 सी-मेट के प्रतिलेखन की मध्यस्थता करता है और मयोडी अभिव्यक्ति की सक्रियता के लिए उत्तरदायी है- मयोडी के फलनों में से उपग्रह कोशिकाओं की पुनर्योजी क्षमता को बढ़ावा देना है (नीचे वर्णित)।<ref name="neuromuscular.wustl" /> पैक्स3 सामान्यतः भ्रूण के विकास के समय अपने उच्चतम स्तर पर व्यक्त किया जाता है और भ्रूण के चरणों के समय कुछ मात्रा में व्यक्त किया जाता है; यह अभिगामी निम्नाक्ष कोशिकाओं और आदिचर्मपेशी खंड कोशिकाओं में व्यक्त किया जाता है, परन्तु मुख की मांसपेशियों के विकास के समय निश्चित व्यक्त नहीं किया जाता है।<ref name="neuromuscular.wustl" /> पैक्स3 में उत्परिवर्तन वार्डनबर्ग सिंड्रोम I और III के साथ-साथ [[क्रानियोफेशियल-डेफनेस-हैंड सिंड्रोम]] सहित कई प्रकार की जटिलताएं उत्पन्न कर सकता है।<ref name="neuromuscular.wustl" /> वॉर्डनबर्ग सिंड्रोम प्रायः जन्मजात विकारों से जुड़ा होता है जिसमें आंतों के मार्ग और रीढ़ की हड्डी, स्कैपुला की ऊंचाई, अन्य लक्षणों के बीच सम्मिलित होती है। प्रत्येक चरण में विभिन्न संबद्ध अनुवांशिक कारक होते हैं जिनके बिना मांसपेशियों के दोष होते हैं।<ref name="neuromuscular.wustl" /> | |||
=== प्रवासन === | === प्रवासन === | ||
एसोसिएटेड जेनेटिक | एसोसिएटेड जेनेटिक कारक: [[हेपेटोसाइट विकास कारक]] और [[एलबीएक्स1]]<br />इन अनुवांशिक कारकों में उत्परिवर्तन प्रवासन की कमी का कारण बनता है। | ||
इन अनुवांशिक कारकों में उत्परिवर्तन प्रवासन की कमी का कारण बनता है। | |||
एलबीएक्स1 पृष्ठीय अग्रपाद में मांसपेशियों के विकास और संनिर्माण के साथ-साथ विसंक्रमण के बाद अंग में पृष्ठीय मांसपेशियों के संचलन के लिए उत्तरदायी है।<ref name="neuromuscular.wustl" /> एलबीएक्स1 के बिना, अंग की मांसपेशियां ठीक से बनने में विफल रहेंगी; अध्ययनों से पता चला है कि इस विलोपन से पश्च अंग की मांसपेशियां गंभीर रूप से प्रभावित होती हैं, जबकि उदर मांसपेशी प्रवासन के परिणामस्वरूप मात्र आकुंचक मांसपेशियां अग्रपाद की मांसपेशियों में बनती हैं।<ref name="neuromuscular.wustl" /> | |||
सी-मेट [[रिसेप्टर टाइरोसिन किनसे|संग्राहक टाइरोसिन किनसे]] है जो माइग्रेट मायोबलास्ट के अस्तित्व और प्रसार के लिए आवश्यक है। सी-मेट की कमी द्वितीयक मायोजेनेसिस को बाधित करती है और जैसा कि एलबीएक्स1 में होता है- अंग मांसलता के निर्माण को रोकता है।<ref name="neuromuscular.wustl" /> यह स्पष्ट है कि सी-मेट प्रवासन के अतिरिक्त प्रदूषण और प्रसार में महत्वपूर्ण भूमिका निभाता है। सी-मेट के ट्रांसक्रिप्शन के लिए पैक्स3 की आवश्यकता है।<ref name="neuromuscular.wustl" /> | |||
=== प्रसार === | === प्रसार === | ||
एसोसिएटेड जेनेटिक | एसोसिएटेड जेनेटिक कारक: पैक्स3, सी-मेट, [[Mox2|मोक्स2]], [[MSX1|एमएसएक्स1]], सिक्स, [[Myf5|मायिफ5]] और [[MyoD|मयोडी]] | ||
मोक्स2 (जिसे मेओक्स-2 भी कहा जाता है) [[मेसोडर्म]] और [[क्षेत्रीय विशिष्टता]] को सम्मिलित करने में महत्वपूर्ण भूमिका निभाता है।<ref name="neuromuscular.wustl" /> मोक्स2 के कार्य के ह्रासन से [[मायोजेनिक अग्रदूत]]ों के प्रसार को रोका जा सकेगा और अंग की मांसपेशियों के असामान्य आकृति का कारण होगा।<ref name="Harovltch">{{cite journal|last=Harovltch|first=Sharon|title=Myogenesis in primary cell cultures from Drosophila melanogaster: protein synthesis and actin heterogeneity during development|journal=Cell|volume=66|issue=4|pages=1281–6 |pmid=418880|year=1975 |doi=10.1016/0092-8674(78)90210-6|s2cid=10811840 }}</ref> विशेष रूप से, अध्ययनों से पता चला है कि हिंद अंग गंभीर रूप से आकार में कम हो जाते हैं जबकि विशिष्ट अग्रपाद मांसपेशियां बनने में विफल हो जाएंगी।<ref name="neuromuscular.wustl" /> | |||
उचितमायोब्लास्ट प्रसार के लिए मायिफ5 आवश्यक है।<ref name="neuromuscular.wustl" />अध्ययनों से पता चला है कि अंतरापर्शुक और पैरास्पाइनल क्षेत्रों में चूहों की मांसपेशियों के विकास को मायिफ-5 को निष्क्रिय करके विलंबित किया जा सकता है।<ref name="neuromuscular.wustl" /> मायिफ5 को मायोजेनेसिस में शीघ्र से शीघ्र व्यक्त नियामक कारक जीन माना जाता है। यदि मायिफ-5 और मयोडी दोनों निष्क्रिय हैं, तो कंकाल की मांसपेशी का पूर्ण अभाव होगा।<ref name="neuromuscular.wustl" /> ये परिणाम मायोजेनेसिस की जटिलता और उचित मांसपेशियों के विकास में प्रत्येक आनुवंशिक कारक के महत्व को प्रकट करते हैं। | |||
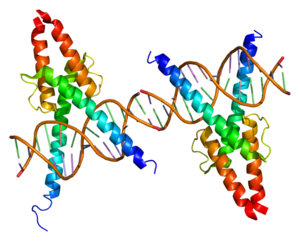
[[File:Protein MYOD1 PDB 1mdy.png|thumb|right|alt=MyoD1 (मयफा) 1 (मायफा)।]] | [[File:Protein MYOD1 PDB 1mdy.png|thumb|right|alt=MyoD1 (मयफा) 1 (मायफा)।]] | ||
=== निर्धारण === | === निर्धारण === | ||
संबद्ध आनुवंशिक कारक: | संबद्ध आनुवंशिक कारक: मायिफ5 और मयोडी<br />मायोजेनेसिस निर्धारण में सबसे महत्वपूर्ण चरणों में से को मायोजेनिक कोशिकाओं को सामान्य रूप से प्रगति करने के लिए मायिफ5 और मयोडी दोनों को ठीक से काम करने की आवश्यकता होती है। किसी भी संबद्ध आनुवंशिक कारक में उत्परिवर्तन कोशिकाओं को गैर-पेशी फ़िनोटाइप अपनाने का कारण बनेगा।<ref name="neuromuscular.wustl" /> | ||
मायोजेनेसिस निर्धारण में सबसे महत्वपूर्ण चरणों में से | |||
जैसा कि पहले कहा गया है, मायिफ5 और मयोडी का संयोजन मायोजेनेसिस की सफलता के लिए महत्वपूर्ण है। मयोडी और मायिफ5 दोनों मायोजेनिक बीएचएलएच (बेसिक हेलिक्स-लूप-हेलिक्स) प्रोटीन ट्रांसक्रिप्शन फ़ैमिली के सदस्य हैं। <ref><nowiki>कितामुरा 2477-2485>{{cite journal|doi=10.1172/JCI32054|last=Kitamura|first=Tadahiro|author2=Kitamura YI |author3=Funahashi Y |author4=Shawber CJ |author5=Castrillon DH |author6=Kollipara R |author7=DePinho RA |author8=Kitajewski J |author9=Accili D |title=एक फॉक्सो / नॉट पाथवे मायोजेनिक विभेदन और फाइबर प्रकार विनिर्देश को नियंत्रित करता है|journal=The Journal of Clinical Investigation|date=4 September 2007|volume=117|issue=9|pages=2477–2485|pmc=1950461|pmid=17717603}</nowiki></ref> कोशिकाएँ जो मायोजेनिक [[bHLH प्रतिलेखन कारक|बीएचएलएच प्रतिलेखन कारक]] (मयोडी या मायिफ5 सहित) बनाती हैं, मांसपेशी कोशिका के रूप में विकास के लिए प्रतिबद्ध हैं। <ref>अस्थानिक पैक्स-3 >{{cite journal|last=Maroto|first=M|author2=Reshef R |author3=Münsterberg A E |author4=Koester S |author5=Goulding M |author6=Lassar A B. |title=एक्टोपिक पैक्स -3 भ्रूण के मेसोडर्म और तंत्रिका ऊतक में MyoD और Myf-5 अभिव्यक्ति को सक्रिय करता है|journal=Cell|date=Apr 4, 1997|volume=89|issue=1|pages=139–148|pmid=9094722|doi=10.1016/S0092-8674(00)80190-7|doi-access=free}}</ref> फलस्वरूप, मायिफ5 और मयोडी के साथ विलोपन के परिणामस्वरूप कंकाल की मांसपेशियों के निर्माण का पूर्ण अभाव होता है।<ref name="ectopic pax-3" /> शोध से पता चला है कि मयोडी प्रत्यक्षतः अपने जीन को सक्रिय करता है; इसका अर्थ यह है कि बनाया गया प्रोटीन मयोडी जीन को बांधता है और मयोडी प्रोटीन उत्पादन का चक्र जारी रखता है।<ref name="ectopic pax-3" /> इस बीच, मायिफ5 अभिव्यक्ति को [[ध्वनि का हाथी|ध्वनिक जाहक]], [[Wnt1|डब्ल्यूएनt1]] और मयोडी द्वारा ही नियंत्रित किया जाता है।<ref name="neuromuscular.wustl" /> मायिफ5 को विनियमित करने में मयोडी की भूमिका को ध्यान में रखते हुए, दो आनुवंशिक कारकों की महत्वपूर्ण परस्परता स्पष्ट हो जाती है।<ref name="neuromuscular.wustl" /> | |||
=== भेद === | === भेद === | ||
एसोसिएटेड जेनेटिक कारक: [[Myogenin]], [[Mcf2]], | एसोसिएटेड जेनेटिक कारक: [[Myogenin|मायोजेनिन]], [[Mcf2|एमसीएफ2]], सिक्स, मयोडी, और [[Myf6|मायिफ6]]<br />इन संबद्ध आनुवंशिक कारकों में उत्परिवर्तन मायोसाइट को आगे बढ़ने और परिपक्व होने से रोकेगा। | ||
इन संबद्ध आनुवंशिक कारकों में उत्परिवर्तन | |||
= | [[File:Duchenne-muscular-dystrophy.jpg|thumb|right|alt=Muscular Dystrophy Histopathology|[[ मांसपेशीय दुर्विकास | मांसपेशीय दुर्विकास]] हिस्टोपैथोलॉजी।]]मायोजेनिन (मायिफ4 के रूप में भी जाना जाता है) मायोजेनिक अग्रदूत कोशिकाओं के संलयन के लिए या तो नवीन या पहले से स्थित फाइबर के लिए आवश्यक है।<ref name="neuromuscular.wustl" /> सामान्यतः, मायोजेनिन जीन की प्रवर्धित अभिव्यक्ति से जुड़ा होता है जो पहले से ही जीव में व्यक्त किया जा रहा है। मायोजेनिन को हटाने से विभेदित मांसपेशी फाइबर का लगभग पूर्ण हानि होती है और पार्श्व / उदर शरीर की दीवार में कंकाल की मांसपेशियों का गंभीर हानि होता है।<ref name="neuromuscular.wustl" /> | ||
[[File:Gowers's sign.png|thumb|left|alt=Gowersका चिह्न|गोवर्स के चिह्न को प्रदर्शित करने वाले मनुष्य का चित्रण: सेंट्रोन्यूक्लियर पेशीविकृति का सामान्य लक्षण जो निचले अंगों की मांसपेशियों की कमजोरी के परिणामस्वरूप होता है।]]मायिफ-6 ([[MRF4|एमआरएफ4]] या हरक्यूलिन के रूप में भी जाना जाता है) मायोट्यूब विभेदन के लिए महत्वपूर्ण है और कंकाल की मांसपेशी के लिए विशिष्ट है।<ref name="neuromuscular.wustl" /> मायिफ-6 में उत्परिवर्तन [[सेंट्रोन्यूक्लियर मायोपैथी|सेंट्रोन्यूक्लियर पेशीविकृति]] और [[बेकर मस्कुलर डिस्ट्रॉफी|बेकर मांसपेशीय दुर्विकास]] सहित विकारों को प्रकुपित सकता है।<ref name="neuromuscular.wustl" /> | |||
=== विशिष्ट मांसपेशी निर्माण === | |||
संबद्ध आनुवंशिक कारक: एलबीएक्स1 और मोक्स2<br />विशिष्ट मांसपेशियों के निर्माण में, संबद्ध आनुवंशिक कारकों में उत्परिवर्तन विशिष्ट मांसपेशियों के क्षेत्रों को प्रभावित करना प्रारंभ कर देते हैं। विस्तारण के बाद अंग में पृष्ठीय मांसपेशियों के संचलन में इसकी बड़ी उत्तरदायित्व के कारण, एलबीएक्स1 के उत्परिवर्तन या विलोपन के परिणामस्वरूप प्रसारण पेशी और पश्च अंग की मांसपेशियों में दोष होते हैं।<ref name="neuromuscular.wustl" /> जैसा कि प्रसार खंड में कहा गया है, मोक्स2 विलोपन या उत्परिवर्तन अंग की मांसपेशियों के असामान्य संरूपण का कारण बनता है। इस असामान्य संरूपण के परिणामों में हिंद अंगों के आकार में गंभीर कमी और सामने की मांसपेशियों की पूर्ण अनुपस्थिति सम्मिलित है।<ref name="neuromuscular.wustl" /> | |||
=== अनुषंगी सेल === | |||
संबद्ध आनुवंशिक कारक: [[PAX7|पैक्स7]]<br />पैक्स7 में उत्परिवर्तन उपग्रह कोशिकाओं के निर्माण को रोकेंगे और इसके स्थान पर, प्रसवोत्तर मांसपेशियों की वृद्धि को रोकेंगे।<ref name="neuromuscular.wustl" /> | |||
अनुषंगी कोशिकाओं को निश्चल मायोबलास्ट और निकटवर्ती मांसपेशी फाइबर सरकोलेममा के रूप में वर्णित किया गया है।<ref name="neuromuscular.wustl" /> वे मांसपेशियों की पुनर्निर्माण के लिए महत्वपूर्ण हैं, परन्तु दोहराने की क्षमता बहुत सीमित है। चोट या उच्च यांत्रिक भार जैसे उत्तेजनाओं द्वारा सक्रिय, वयस्क जीवों में मांसपेशियों के उत्थान के लिए उपग्रह कोशिकाओं की आवश्यकता होती है।<ref name="neuromuscular.wustl" /> इसके अतिरिक्त, उपग्रह कोशिकाओं में हड्डी या वसा में भी अंतर करने की क्षमता होती है। इस प्रकार, न मात्र मांसपेशियों के विकास में, यद्यपि वयस्कता के माध्यम से मांसपेशियों के रखरखाव में उपग्रह कोशिकाओं की महत्वपूर्ण भूमिका होती है।<ref name="neuromuscular.wustl" /> | |||
== कंकाल की मांसपेशी == | == कंकाल की मांसपेशी == | ||
[[भ्रूणजनन]] के | [[भ्रूणजनन]] के समय, [[ somites |somites]] में डर्[[ मायो स्टॉप | मायो स्टॉप]] और/या मायोटोम में मायोजेनिक पूर्वज कोशिकाएं होती हैं जो भावी कंकाल की मांसपेशी में विकसित होंगी।<ref name="Ito">{{cite journal|last=Ito|first=Yoshiaki|title=ए सिस्टम्स अप्रोच एंड स्केलेटल मायोजेनेसिस|volume=2012|pages=1–7|journal=International Journal of Genomics|publisher=Hindawi Publishing Organization|doi=10.1155/2012/759407|pmid=22991503|pmc=3443578|year=2012|doi-access=free }}</ref> डर्मोमायोटोम और मायोटोम का निर्धारण जीन नियामक नेटवर्क द्वारा नियंत्रित किया जाता है जिसमें [[ टी बॉक्स |टी बॉक्स]] परिवार, टीबीएक्स 6, रिप्ली 1 और मेस्प-बीए का सदस्य सम्मिलित होता है।<ref name="PMID25725067">{{cite journal |vauthors=Windner SE, Doris RA, Ferguson CM, Nelson AC, Valentin G, Tan H, Oates AC, Wardle FC, Devoto SH | title = Tbx6, Mesp-b and Ripply1 regulate the onset of skeletal myogenesis in zebrafish | journal = Development | volume = 142 | issue = 6 | pages = 1159–68 | year = 2015 | pmid = 25725067 | doi=10.1242/dev.113431 | pmc=4360180}}</ref> मायोफाइबर में मायोजेनिक पूर्वजों को अलग करने के लिए कंकाल मायोजेनेसिस विभिन्न जीन सब समूह के सख्त नियमन पर निर्भर करता है। बेसिक हेलिक्स-लूप-हेलिक्स (बीएचएलएच) ट्रांसक्रिप्शन कारक, मयोडी, मायिफ5, मायोजेनिन, और एमआरएफ4 इसके निर्माण के लिए महत्वपूर्ण हैं। मयोडी और मायिफ5 मायोजेनिक पूर्वजों केमायोब्लास्टs में विभेदन को सक्षम करते हैं, इसके बाद मायोजेनिन, जोमायोब्लास्ट को myotubes में अलग करता है।<ref name="Ito" />एमआरएफ4 मांसपेशी-विशिष्ट प्रमोटरों के प्रतिलेखन को अवरुद्ध करने के लिए महत्वपूर्ण है, कंकाल की मांसपेशी के पूर्वजों को बढ़ने और विभेद करने से पहले प्रसार करने में सक्षम बनाता है। | ||
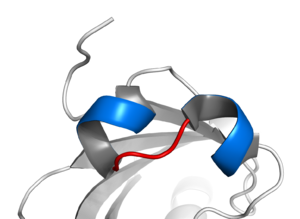
[[File:Basic helix loop helix.png|thumb|left|alt=Basic helix-लूप-हेलिक्स|बेसिक हेलिक्स-लूप-हेलिक्स।]]ऐसी कई घटनाएं होती हैं जो सोमाइट में मांसपेशियों की कोशिकाओं के विनिर्देशों को आगे बढ़ाने के लिए होती हैं। सोमाइट के पार्श्व और औसत दर्जे के दोनों क्षेत्रों के लिए, पेराक्रिन कारक | [[File:Basic helix loop helix.png|thumb|left|alt=Basic helix-लूप-हेलिक्स|बेसिक हेलिक्स-लूप-हेलिक्स।]]ऐसी कई घटनाएं होती हैं जो सोमाइट में मांसपेशियों की कोशिकाओं के विनिर्देशों को आगे बढ़ाने के लिए होती हैं। सोमाइट के पार्श्व और औसत दर्जे के दोनों क्षेत्रों के लिए, पेराक्रिन कारक मयोडी प्रोटीन का उत्पादन करने के लिए मायोटोम कोशिकाओं को प्रेरित करते हैं - जिससे वे मांसपेशियों की कोशिकाओं के रूप में विकसित होते हैं।<ref>{{cite journal|last=Maroto|first=M|author2=Reshef R |author3=Münsterberg A E |author4=Koester S |author5=Goulding M |author6=Lassar A B. |title=Ectopic Pax-3 activates MyoD and Myf-5 expression in embryonic mesoderm and neural tissue|journal=Cell|date=4 Apr 1997|volume=89|pages=139–148|pmid=9094722|doi=10.1016/S0092-8674(00)80190-7|issue=1|doi-access=free}}</ref> संयोजी ऊतक [[ तंतुकोशिका |तंतुकोशिका]] का प्रतिलेखन कारक ([[TCF4]]) मायोजेनेसिस के नियमन में सम्मिलित है। विशेष रूप से, यह विकसित मांसपेशी फाइबर के प्रकार और इसकी परिपक्वता को नियंत्रित करता है।<ref name="neuromuscular.wustl" />TCF4 का निम्न स्तर धीमी और तीव्र मायोजेनेसिस दोनों को बढ़ावा देता है, समग्र रूप से मांसपेशी फाइबर प्रकार की परिपक्वता को बढ़ावा देता है। जिससे यह भ्रूण के विकास के समय संयोजी ऊतक के साथ मांसपेशियों के घनिष्ठ संबंध को दर्शाता है।<ref>{{cite journal|last=Mathew|first=Sam J.|author2=Hansen JM |author3=Merrell AJ |author4=Murphy MM |author5=Lawson JA |author6=Hutcheson DA |author7=Hansen MS |author8=Angus-Hill M |author9=Kardon G |title=Connective tissue fibroblasts and Tcf4 regulate myogenesis|journal=Development|date=15 January 2011|volume=138|pages=371–384|doi=10.1242/dev.057463|pmid=21177349|issue=2|pmc=3005608}}</ref> | ||
मायोजेनिक विभेदन का विनियमन दो मार्गों द्वारा नियंत्रित किया जाता है: [[फॉस्फेटिडाइलिनोजिटोल 3-किनासे]] मार्ग और नोच सिग्नलिंग मार्ग/हेस मार्ग, जो मयोडी प्रतिलेखन को दबाने के लिए सहयोगी तरीके से काम करते हैं। <रेफरी नाम = कितामुरा 2477-2485 /> ओ फोर्कहेड प्रोटीन ([[FOXO]]) की उपप्रजाति मायोजेनिक विभेदन के नियमन में महत्वपूर्ण भूमिका निभाती है क्योंकि वे Notch/Hes बाइंडिंग को स्थिर करते हैं। शोध से पता चला है कि चूहों में FOXO1 के नॉकआउट से मयोडी एक्सप्रेशन बढ़ जाता है, जिससे [[तेज चिकोटी पेशी|तीव्र चिकोटी पेशी]]|फास्ट-ट्विच और स्लो-ट्विच फाइबर का वितरण बदल जाता है।<रेफरी नाम= कितामुरा 2477–2485 /> | |||
== स्नायु संलयन == | == स्नायु संलयन == | ||
प्राथमिक मांसपेशी फाइबर [[प्राथमिक मायोबलास्ट]] से उत्पन्न होते हैं और धीमी मांसपेशी फाइबर में विकसित होते हैं।<ref name="neuromuscular.wustl" />द्वितीयक पेशी तंतु तब प्राथमिक तंतुओं के चारों ओर बनते हैं जो कि संक्रमण के समय के निकट होते हैं। ये मांसपेशी फाइबर माध्यमिक | प्राथमिक मांसपेशी फाइबर [[प्राथमिक मायोबलास्ट]] से उत्पन्न होते हैं और धीमी मांसपेशी फाइबर में विकसित होते हैं।<ref name="neuromuscular.wustl" />द्वितीयक पेशी तंतु तब प्राथमिक तंतुओं के चारों ओर बनते हैं जो कि संक्रमण के समय के निकट होते हैं। ये मांसपेशी फाइबर माध्यमिक मायोबलास्ट से बनते हैं और सामान्यतः तीव्रता से मांसपेशी फाइबर के रूप में विकसित होते हैं। अंत में, बाद में बनने वाले मांसपेशी फाइबर उपग्रह कोशिकाओं से उत्पन्न होते हैं।<ref name="neuromuscular.wustl" /> | ||
मांसपेशी संलयन में महत्वपूर्ण दो जीन | मांसपेशी संलयन में महत्वपूर्ण दो जीन एमईएफ2 और [[मोड़ प्रतिलेखन कारक]] हैं। अध्ययनों से पता चला है कि चूहों में एमईएफ2C के लिए नॉकआउट हृदय और चिकनी मांसपेशियों के विकास में मांसपेशियों के दोषों का कारण बनता है, विशेष रूप से संलयन में।<ref>{{cite journal|last=Baylies|first=Mary|title=Invertebrate Myogenesis: looking back to the future of muscle development|volume=66|issue=4|pages=1281–6|journal=Current Opinion in Genetics & Development|pmid=11448630|year=2001|doi=10.1016/s0959-437x(00)00214-8}}</ref> ट्विस्ट जीन मांसपेशियों के विभेदन में भूमिका निभाता है। | ||
[[SIX1]] जीन मायोजेनेसिस में एपेक्सियल और | [[SIX1|सिक्स1]] जीन मायोजेनेसिस में एपेक्सियल और निम्नाक्ष मांसपेशियों के विभेदन में महत्वपूर्ण भूमिका निभाता है। इस जीन की कमी वाले चूहों में, गंभीर मांसपेशी [[हाइपोप्लेसिया]] ने शरीर की अधिकांश मांसपेशियों को प्रभावित किया, विशेष रूप से निम्नाक्ष मांसपेशियां।<ref>{{cite journal|last=Laclef|first=Christine|author2=Hamard G |author3=Demignon J |author4=Souil E |author5=Houbron C |author6=Maire P |title=छह1-कमी वाले चूहों में परिवर्तित मायोजेनेसिस|journal=Development|date=14 February 2003|volume=130|pages=2239–2252|doi=10.1242/dev.00440|pmid=12668636|issue=10|doi-access=free}}</ref> | ||
== प्रोटीन संश्लेषण और एक्टिन विषमता == | == प्रोटीन संश्लेषण और एक्टिन विषमता == | ||
मायोजेनेसिस के | मायोजेनेसिस के समय 3 प्रकार के प्रोटीन का उत्पादन होता है।<ref name="Harovltch"/> क्लास ए प्रोटीन सबसे प्रचुर मात्रा में हैं और पूरे मायोजेनेसिस में लगातार संश्लेषित होते हैं। क्लास बी प्रोटीन वे प्रोटीन होते हैं जो मायोजेनेसिस के समय प्रारंभ होते हैं और पूरे विकास के समय जारी रहते हैं। कक्षा सी प्रोटीन वे होते हैं जो विकास के समय विशिष्ट समय पर संश्लेषित होते हैं। साथ ही मायोजेनेसिस के समय एक्टिन के 3 अलग-अलग रूपों की पहचान की गई। | ||
[[Sim2]], | [[Sim2]], [[BHLH-Pas प्रतिलेखन कारक|बीएचएलएच-Pas प्रतिलेखन कारक]], सक्रिय दमन द्वारा प्रतिलेखन को रोकता है और चिक और माउस भ्रूण के विकास के समय उदर अंग की मांसपेशियों में बढ़ी हुई अभिव्यक्ति को प्रदर्शित करता है। यह एन्हांसर क्षेत्र से जुड़कर मयोडी प्रतिलेखन को दबाकर इसे पूरा करता है, और समय से पहले मायोजेनेसिस को रोकता है।<ref>{{cite journal|last=Havis|first=Emmanuelle |author2=Pascal Coumailleau |author3=Aline Bonnet |author4=Keren Bismuth |author5=Marie-Ange Bonnin |author6=Randy Johnson |author7=Chen-Min Fan |author8=Frédéric Relaix |author9=De-Li Shi |author10=Delphine Duprez|title=विकास और स्टेम सेल|journal=Development|date=2012-03-16|volume=139|issue=7|pages=1910–1920|doi=10.1242/dev.072561|pmid=22513369 |pmc=3347684}}</ref> | ||
नॉच सिग्नलिंग पाथवे के माध्यम से, सोमाइट्स की मांसपेशियों के विभेदन के लिए न्यूरल क्रेस्ट कोशिकाओं में [[डेल्टा1]] 1 अभिव्यक्ति आवश्यक है। तंत्रिका शिखा कोशिकाओं में इस लिगैंड के लाभ और हानि के परिणामस्वरूप विलंबित या समय से पहले मायोजेनेसिस होता है।<ref>{{cite journal|last1=Rios|first1=Anne|title=तंत्रिका शिखा NOTCH के क्षणिक सक्रियण के माध्यम से मायोजेनेसिस को नियंत्रित करती है|journal=Nature|date=2011-06-15|volume=473|pages=532–535|doi=10.1038/nature09970|last2=Serralbo|first2=Olivier|last3=Salgado|first3=David|last4=Marcelle|first4=Christophe|issue=7348|pmid=21572437|bibcode=2011Natur.473..532R|s2cid=4380479 }}</ref> | नॉच सिग्नलिंग पाथवे के माध्यम से, सोमाइट्स की मांसपेशियों के विभेदन के लिए न्यूरल क्रेस्ट कोशिकाओं में [[डेल्टा1]] 1 अभिव्यक्ति आवश्यक है। तंत्रिका शिखा कोशिकाओं में इस लिगैंड के लाभ और हानि के परिणामस्वरूप विलंबित या समय से पहले मायोजेनेसिस होता है।<ref>{{cite journal|last1=Rios|first1=Anne|title=तंत्रिका शिखा NOTCH के क्षणिक सक्रियण के माध्यम से मायोजेनेसिस को नियंत्रित करती है|journal=Nature|date=2011-06-15|volume=473|pages=532–535|doi=10.1038/nature09970|last2=Serralbo|first2=Olivier|last3=Salgado|first3=David|last4=Marcelle|first4=Christophe|issue=7348|pmid=21572437|bibcode=2011Natur.473..532R|s2cid=4380479 }}</ref> | ||
| Line 116: | Line 100: | ||
== तकनीक == | == तकनीक == | ||
विभेदित [[C2C12]] मायोबलास्ट के माइक्रोएरेरी विश्लेषण का उपयोग करके वैकल्पिक स्प्लिसिंग के महत्व को स्पष्ट किया गया था।<ref>{{cite journal |last=Bland |first=C.S |author2=Wang, David |author3=Johnson, Castle |author4=Burge, Cooper |title=मायोजेनिक भेदभाव के दौरान वैकल्पिक विभाजन का वैश्विक विनियमन|journal=Nucleic Acids Research |date=July 2010 |volume=38 |issue=21 |pages=7651–7664 |doi=10.1093/nar/gkq614 |pmid=20634200 |pmc=2995044|hdl=1721.1/66688 }}</ref> मायोजेनेसिस में C2C12 | विभेदित [[C2C12]] मायोबलास्ट के माइक्रोएरेरी विश्लेषण का उपयोग करके वैकल्पिक स्प्लिसिंग के महत्व को स्पष्ट किया गया था।<ref>{{cite journal |last=Bland |first=C.S |author2=Wang, David |author3=Johnson, Castle |author4=Burge, Cooper |title=मायोजेनिक भेदभाव के दौरान वैकल्पिक विभाजन का वैश्विक विनियमन|journal=Nucleic Acids Research |date=July 2010 |volume=38 |issue=21 |pages=7651–7664 |doi=10.1093/nar/gkq614 |pmid=20634200 |pmc=2995044|hdl=1721.1/66688 }}</ref> मायोजेनेसिस में C2C12 विभेदन के समय 95 वैकल्पिक स्प्लिसिंग घटनाएं होती हैं। इसलिए, मायोजेनेसिस में वैकल्पिक विभाजन आवश्यक है। | ||
=== सिस्टम दृष्टिकोण === | === सिस्टम दृष्टिकोण === | ||
सिस्टम दृष्टिकोण मायोजेनेसिस का अध्ययन करने के लिए उपयोग की जाने वाली | सिस्टम दृष्टिकोण मायोजेनेसिस का अध्ययन करने के लिए उपयोग की जाने वाली विधि है, जो सिस्टम के विभिन्न कारकों की पहचान करने के लिए [[उच्च परिणाम स्क्रीनिंग]] तकनीकों, जीनोम वाइड सेल-आधारित [[परख]] और जैव सूचना विज्ञान जैसी कई विभिन्न तकनीकों में हेरफेर करती है।<ref name="Ito"/>यह विशेष रूप से कंकाल की मांसपेशियों के विकास की जांच और इसके नियामक नेटवर्क की पहचान में उपयोग किया गया है। | ||
मयोडी और मायोजेनिन जैसे मायोजेनिक नियामक कारकों के लक्ष्य, उनके अंतर-संबंधित लक्ष्य, और कैसे मयोडीमायोब्लास्टs और myotubes में स्वदेशी को बदलने के लिए कार्य करता है, के लक्ष्य को स्पष्ट करने के लिए [[उच्च-थ्रूपुट अनुक्रमण]] और [[ चिप चिप |चिप चिप]] विश्लेषण का उपयोग करने वाला सिस्टम दृष्टिकोण आवश्यक है।<ref name="Ito"/>इसने मायोजेनेसिस में पैक्स3 के महत्व को भी प्रकट किया है, और यह मायोजेनिक पूर्वजों के अस्तित्व को सुनिश्चित करता है।<ref name="Ito"/> | |||
कोशिका आधारित उच्च-थ्रूपुट ट्रांसफेक्शन परख और स्वस्थानी संकरण में पूरे-माउंट का उपयोग करते हुए इस दृष्टिकोण का उपयोग मायोजेनेटिक रेगुलेटर RP58 और कण्डरा विभेदन जीन, मोहॉक होमोबॉक्स की पहचान करने में किया गया था।<ref name="Ito"/> | |||
| Line 132: | Line 116: | ||
==बाहरी संबंध== | ==बाहरी संबंध== | ||
* [https://www.ncbi.nlm.nih.gov/books/bv.fcgi?db=Books&rid=dbio.section.3475 Gilbert, Scott F. ''Developmental Biology'', | * [https://www.ncbi.nlm.nih.gov/books/bv.fcgi?db=Books&rid=dbio.section.3475 Gilbert, Scott F. ''Developmental Biology'', सिक्सth Edition - Myogenesis - The Development of Muscle] | ||
{{Muscular physiology}} | {{Muscular physiology}} | ||
Revision as of 08:22, 26 July 2023
मायोजेनेसिस कंकाल की मांसपेशियों का निर्माण है, विशेषकर भ्रूण के विकास के समय।
मांसपेशी फाइबर सामान्यतः पूर्ववर्ती मायोब्लास्ट के संलयन के माध्यम से बहुकेन्द्रीय फाइबर में बनते हैं जिन्हें मायोट्यूब कहा जाता है। भ्रूण के प्रारम्भिक विकास में, मायोबलास्ट या तो कोशिका प्रसार कर सकते हैं, या कोशिकीय विभेदन मायोट्यूब में कर सकते हैं। विवो में इस चयन को क्या नियंत्रित करता है यह सामान्यतः अस्पष्ट है। यदि कोशिका संवर्धन में रखा जाता है, तो अधिकांश मायोबलास्ट फैलेंगे यदि पर्याप्त फाइब्रोब्लास्ट वृद्धि कारक (एफजीएफ) या अन्य वृद्धि कारक कोशिकाओं के निकट के माध्यम में स्थित हो। जब विकास कारक समाप्त हो जाता है, मायोबलास्ट विभाजन संवृत कर देते हैं और मायोट्यूब में टर्मिनल विभेदन से गुजरते हैं। मायोबलास्ट विभेदन चरणों में आगे बढ़ता है। पहले चरण में, कोशिका चक्र से बाहर निकलना और कुछ जीनों की अभिव्यक्ति के प्रारम्भ सम्मिलित है।
विभेदन के दूसरे चरण में मायोबलास्ट का दूसरे के साथ संरेखण सम्मिलित है। अध्ययनों से पता चला है कि चूहे और चूजे के मायोबलास्ट भी सम्मिलित तंत्र के विकासवादी संरक्षण का सुझाव देते हुए दूसरे के साथ पहचान और संरेखित कर सकते हैं।[1]
तीसरा चरण वास्तविक कोशिका संलयन ही है। इस अवस्था में, कैल्शियम आयनों की उपस्थिति महत्वपूर्ण होती है। मनुष्यों में संलयन एडम12 जीन और कई अन्य प्रोटीनों द्वारा कोडित मेटेलोप्रोटीनेज के समूह द्वारा सहायता प्राप्त है। संलयन में सरकोलेममा में एक्टिन की भर्ती सम्मिलित होती है, इसके बाद निकट स्थितिक और छिद्र का निर्माण होता है जो बाद में तीव्रता से चौड़ा होता है।
प्रक्रिया के समय अभिव्यक्त होने वाले नवीन जीन और उनके प्रोटीन उत्पाद कई प्रयोगशालाओं में सक्रिय जांच के अधीन हैं। वे सम्मिलित करते हैं:
- एमईएफ2 , जो मायोजेनेसिस को बढ़ावा देते हैं।
- सीरम प्रतिक्रिया कारक (एसआरएफ) रेखित अल्फा-एक्टिन जीन की अभिव्यक्ति के लिए आवश्यक होने के कारण मायोजेनेसिस के समय केंद्रीय भूमिका निभाता है।[2] कंकाल अल्फा-एक्टिन की अभिव्यक्ति को एण्ड्रोजन संग्राहक द्वारा भी नियंत्रित किया जाता है; स्टेरॉयड इस प्रकार मायोजेनेसिस को नियंत्रित कर सकते हैं।[3]
- मायोजेनिक नियामक कारक (एमईएफ): मयोडी, मायिफ5, मायिफ6 और मायोजेनिन।
अवलोकन
मांसपेशियों के विकास, या मायोजेनेसिस के कई चरण (नीचे सूचीबद्ध) हैं।[4] प्रत्येक चरण में विभिन्न संबंधित अनुवांशिक कारक होते हैं जिनकी कमी के परिणामस्वरूप मांसपेशियों के दोष होंगे।
चरण
| चरण | संबद्ध आनुवंशिक कारक |
|---|---|
| विस्तारण | पैक्स3, सी-मेट |
| अभिगमन | सी-मेट/एचजीएफ, एलबीएक्स1 |
| प्रचुरणी | पैक्स3, सी-मेट, मोक्स2, एमएसएक्स1, सिक्स1/4, मायिफ5, मयोडी |
| निरूपण | मायिफ5 और मयोडी |
| विभेदन | मायोजेनिन, एमसीएफ2, सिक्स1/4, मयोडी, मायिफ6 |
| विशिष्ट मांसपेशी निर्माण | एलबीएक्स1, मेओक्स2 |
| अनुषंगी कोशिका | पैक्स7 |
परिसीमन

संबद्ध आनुवंशिक कारक: पैक्स3 और सी-मेट
पैक्स3 में उत्परिवर्तन सी मेट अभिव्यक्ति में विफलता का कारण बन सकता है। इस प्रकार के उत्परिवर्तन के परिणामस्वरूप पार्श्व प्रवासन की कमी होगी।
पैक्स3 सी-मेट के प्रतिलेखन की मध्यस्थता करता है और मयोडी अभिव्यक्ति की सक्रियता के लिए उत्तरदायी है- मयोडी के फलनों में से उपग्रह कोशिकाओं की पुनर्योजी क्षमता को बढ़ावा देना है (नीचे वर्णित)।[4] पैक्स3 सामान्यतः भ्रूण के विकास के समय अपने उच्चतम स्तर पर व्यक्त किया जाता है और भ्रूण के चरणों के समय कुछ मात्रा में व्यक्त किया जाता है; यह अभिगामी निम्नाक्ष कोशिकाओं और आदिचर्मपेशी खंड कोशिकाओं में व्यक्त किया जाता है, परन्तु मुख की मांसपेशियों के विकास के समय निश्चित व्यक्त नहीं किया जाता है।[4] पैक्स3 में उत्परिवर्तन वार्डनबर्ग सिंड्रोम I और III के साथ-साथ क्रानियोफेशियल-डेफनेस-हैंड सिंड्रोम सहित कई प्रकार की जटिलताएं उत्पन्न कर सकता है।[4] वॉर्डनबर्ग सिंड्रोम प्रायः जन्मजात विकारों से जुड़ा होता है जिसमें आंतों के मार्ग और रीढ़ की हड्डी, स्कैपुला की ऊंचाई, अन्य लक्षणों के बीच सम्मिलित होती है। प्रत्येक चरण में विभिन्न संबद्ध अनुवांशिक कारक होते हैं जिनके बिना मांसपेशियों के दोष होते हैं।[4]
प्रवासन
एसोसिएटेड जेनेटिक कारक: हेपेटोसाइट विकास कारक और एलबीएक्स1
इन अनुवांशिक कारकों में उत्परिवर्तन प्रवासन की कमी का कारण बनता है।
एलबीएक्स1 पृष्ठीय अग्रपाद में मांसपेशियों के विकास और संनिर्माण के साथ-साथ विसंक्रमण के बाद अंग में पृष्ठीय मांसपेशियों के संचलन के लिए उत्तरदायी है।[4] एलबीएक्स1 के बिना, अंग की मांसपेशियां ठीक से बनने में विफल रहेंगी; अध्ययनों से पता चला है कि इस विलोपन से पश्च अंग की मांसपेशियां गंभीर रूप से प्रभावित होती हैं, जबकि उदर मांसपेशी प्रवासन के परिणामस्वरूप मात्र आकुंचक मांसपेशियां अग्रपाद की मांसपेशियों में बनती हैं।[4]
सी-मेट संग्राहक टाइरोसिन किनसे है जो माइग्रेट मायोबलास्ट के अस्तित्व और प्रसार के लिए आवश्यक है। सी-मेट की कमी द्वितीयक मायोजेनेसिस को बाधित करती है और जैसा कि एलबीएक्स1 में होता है- अंग मांसलता के निर्माण को रोकता है।[4] यह स्पष्ट है कि सी-मेट प्रवासन के अतिरिक्त प्रदूषण और प्रसार में महत्वपूर्ण भूमिका निभाता है। सी-मेट के ट्रांसक्रिप्शन के लिए पैक्स3 की आवश्यकता है।[4]
प्रसार
एसोसिएटेड जेनेटिक कारक: पैक्स3, सी-मेट, मोक्स2, एमएसएक्स1, सिक्स, मायिफ5 और मयोडी
मोक्स2 (जिसे मेओक्स-2 भी कहा जाता है) मेसोडर्म और क्षेत्रीय विशिष्टता को सम्मिलित करने में महत्वपूर्ण भूमिका निभाता है।[4] मोक्स2 के कार्य के ह्रासन से मायोजेनिक अग्रदूतों के प्रसार को रोका जा सकेगा और अंग की मांसपेशियों के असामान्य आकृति का कारण होगा।[5] विशेष रूप से, अध्ययनों से पता चला है कि हिंद अंग गंभीर रूप से आकार में कम हो जाते हैं जबकि विशिष्ट अग्रपाद मांसपेशियां बनने में विफल हो जाएंगी।[4]
उचितमायोब्लास्ट प्रसार के लिए मायिफ5 आवश्यक है।[4]अध्ययनों से पता चला है कि अंतरापर्शुक और पैरास्पाइनल क्षेत्रों में चूहों की मांसपेशियों के विकास को मायिफ-5 को निष्क्रिय करके विलंबित किया जा सकता है।[4] मायिफ5 को मायोजेनेसिस में शीघ्र से शीघ्र व्यक्त नियामक कारक जीन माना जाता है। यदि मायिफ-5 और मयोडी दोनों निष्क्रिय हैं, तो कंकाल की मांसपेशी का पूर्ण अभाव होगा।[4] ये परिणाम मायोजेनेसिस की जटिलता और उचित मांसपेशियों के विकास में प्रत्येक आनुवंशिक कारक के महत्व को प्रकट करते हैं।
निर्धारण
संबद्ध आनुवंशिक कारक: मायिफ5 और मयोडी
मायोजेनेसिस निर्धारण में सबसे महत्वपूर्ण चरणों में से को मायोजेनिक कोशिकाओं को सामान्य रूप से प्रगति करने के लिए मायिफ5 और मयोडी दोनों को ठीक से काम करने की आवश्यकता होती है। किसी भी संबद्ध आनुवंशिक कारक में उत्परिवर्तन कोशिकाओं को गैर-पेशी फ़िनोटाइप अपनाने का कारण बनेगा।[4]
जैसा कि पहले कहा गया है, मायिफ5 और मयोडी का संयोजन मायोजेनेसिस की सफलता के लिए महत्वपूर्ण है। मयोडी और मायिफ5 दोनों मायोजेनिक बीएचएलएच (बेसिक हेलिक्स-लूप-हेलिक्स) प्रोटीन ट्रांसक्रिप्शन फ़ैमिली के सदस्य हैं। [6] कोशिकाएँ जो मायोजेनिक बीएचएलएच प्रतिलेखन कारक (मयोडी या मायिफ5 सहित) बनाती हैं, मांसपेशी कोशिका के रूप में विकास के लिए प्रतिबद्ध हैं। [7] फलस्वरूप, मायिफ5 और मयोडी के साथ विलोपन के परिणामस्वरूप कंकाल की मांसपेशियों के निर्माण का पूर्ण अभाव होता है।[8] शोध से पता चला है कि मयोडी प्रत्यक्षतः अपने जीन को सक्रिय करता है; इसका अर्थ यह है कि बनाया गया प्रोटीन मयोडी जीन को बांधता है और मयोडी प्रोटीन उत्पादन का चक्र जारी रखता है।[8] इस बीच, मायिफ5 अभिव्यक्ति को ध्वनिक जाहक, डब्ल्यूएनt1 और मयोडी द्वारा ही नियंत्रित किया जाता है।[4] मायिफ5 को विनियमित करने में मयोडी की भूमिका को ध्यान में रखते हुए, दो आनुवंशिक कारकों की महत्वपूर्ण परस्परता स्पष्ट हो जाती है।[4]
भेद
एसोसिएटेड जेनेटिक कारक: मायोजेनिन, एमसीएफ2, सिक्स, मयोडी, और मायिफ6
इन संबद्ध आनुवंशिक कारकों में उत्परिवर्तन मायोसाइट को आगे बढ़ने और परिपक्व होने से रोकेगा।
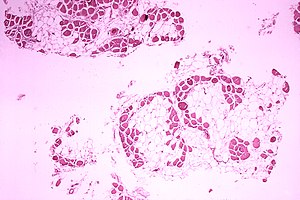
मायोजेनिन (मायिफ4 के रूप में भी जाना जाता है) मायोजेनिक अग्रदूत कोशिकाओं के संलयन के लिए या तो नवीन या पहले से स्थित फाइबर के लिए आवश्यक है।[4] सामान्यतः, मायोजेनिन जीन की प्रवर्धित अभिव्यक्ति से जुड़ा होता है जो पहले से ही जीव में व्यक्त किया जा रहा है। मायोजेनिन को हटाने से विभेदित मांसपेशी फाइबर का लगभग पूर्ण हानि होती है और पार्श्व / उदर शरीर की दीवार में कंकाल की मांसपेशियों का गंभीर हानि होता है।[4]
मायिफ-6 (एमआरएफ4 या हरक्यूलिन के रूप में भी जाना जाता है) मायोट्यूब विभेदन के लिए महत्वपूर्ण है और कंकाल की मांसपेशी के लिए विशिष्ट है।[4] मायिफ-6 में उत्परिवर्तन सेंट्रोन्यूक्लियर पेशीविकृति और बेकर मांसपेशीय दुर्विकास सहित विकारों को प्रकुपित सकता है।[4]
विशिष्ट मांसपेशी निर्माण
संबद्ध आनुवंशिक कारक: एलबीएक्स1 और मोक्स2
विशिष्ट मांसपेशियों के निर्माण में, संबद्ध आनुवंशिक कारकों में उत्परिवर्तन विशिष्ट मांसपेशियों के क्षेत्रों को प्रभावित करना प्रारंभ कर देते हैं। विस्तारण के बाद अंग में पृष्ठीय मांसपेशियों के संचलन में इसकी बड़ी उत्तरदायित्व के कारण, एलबीएक्स1 के उत्परिवर्तन या विलोपन के परिणामस्वरूप प्रसारण पेशी और पश्च अंग की मांसपेशियों में दोष होते हैं।[4] जैसा कि प्रसार खंड में कहा गया है, मोक्स2 विलोपन या उत्परिवर्तन अंग की मांसपेशियों के असामान्य संरूपण का कारण बनता है। इस असामान्य संरूपण के परिणामों में हिंद अंगों के आकार में गंभीर कमी और सामने की मांसपेशियों की पूर्ण अनुपस्थिति सम्मिलित है।[4]
अनुषंगी सेल
संबद्ध आनुवंशिक कारक: पैक्स7
पैक्स7 में उत्परिवर्तन उपग्रह कोशिकाओं के निर्माण को रोकेंगे और इसके स्थान पर, प्रसवोत्तर मांसपेशियों की वृद्धि को रोकेंगे।[4]
अनुषंगी कोशिकाओं को निश्चल मायोबलास्ट और निकटवर्ती मांसपेशी फाइबर सरकोलेममा के रूप में वर्णित किया गया है।[4] वे मांसपेशियों की पुनर्निर्माण के लिए महत्वपूर्ण हैं, परन्तु दोहराने की क्षमता बहुत सीमित है। चोट या उच्च यांत्रिक भार जैसे उत्तेजनाओं द्वारा सक्रिय, वयस्क जीवों में मांसपेशियों के उत्थान के लिए उपग्रह कोशिकाओं की आवश्यकता होती है।[4] इसके अतिरिक्त, उपग्रह कोशिकाओं में हड्डी या वसा में भी अंतर करने की क्षमता होती है। इस प्रकार, न मात्र मांसपेशियों के विकास में, यद्यपि वयस्कता के माध्यम से मांसपेशियों के रखरखाव में उपग्रह कोशिकाओं की महत्वपूर्ण भूमिका होती है।[4]
कंकाल की मांसपेशी
भ्रूणजनन के समय, somites में डर् मायो स्टॉप और/या मायोटोम में मायोजेनिक पूर्वज कोशिकाएं होती हैं जो भावी कंकाल की मांसपेशी में विकसित होंगी।[9] डर्मोमायोटोम और मायोटोम का निर्धारण जीन नियामक नेटवर्क द्वारा नियंत्रित किया जाता है जिसमें टी बॉक्स परिवार, टीबीएक्स 6, रिप्ली 1 और मेस्प-बीए का सदस्य सम्मिलित होता है।[10] मायोफाइबर में मायोजेनिक पूर्वजों को अलग करने के लिए कंकाल मायोजेनेसिस विभिन्न जीन सब समूह के सख्त नियमन पर निर्भर करता है। बेसिक हेलिक्स-लूप-हेलिक्स (बीएचएलएच) ट्रांसक्रिप्शन कारक, मयोडी, मायिफ5, मायोजेनिन, और एमआरएफ4 इसके निर्माण के लिए महत्वपूर्ण हैं। मयोडी और मायिफ5 मायोजेनिक पूर्वजों केमायोब्लास्टs में विभेदन को सक्षम करते हैं, इसके बाद मायोजेनिन, जोमायोब्लास्ट को myotubes में अलग करता है।[9]एमआरएफ4 मांसपेशी-विशिष्ट प्रमोटरों के प्रतिलेखन को अवरुद्ध करने के लिए महत्वपूर्ण है, कंकाल की मांसपेशी के पूर्वजों को बढ़ने और विभेद करने से पहले प्रसार करने में सक्षम बनाता है।
ऐसी कई घटनाएं होती हैं जो सोमाइट में मांसपेशियों की कोशिकाओं के विनिर्देशों को आगे बढ़ाने के लिए होती हैं। सोमाइट के पार्श्व और औसत दर्जे के दोनों क्षेत्रों के लिए, पेराक्रिन कारक मयोडी प्रोटीन का उत्पादन करने के लिए मायोटोम कोशिकाओं को प्रेरित करते हैं - जिससे वे मांसपेशियों की कोशिकाओं के रूप में विकसित होते हैं।[11] संयोजी ऊतक तंतुकोशिका का प्रतिलेखन कारक (TCF4) मायोजेनेसिस के नियमन में सम्मिलित है। विशेष रूप से, यह विकसित मांसपेशी फाइबर के प्रकार और इसकी परिपक्वता को नियंत्रित करता है।[4]TCF4 का निम्न स्तर धीमी और तीव्र मायोजेनेसिस दोनों को बढ़ावा देता है, समग्र रूप से मांसपेशी फाइबर प्रकार की परिपक्वता को बढ़ावा देता है। जिससे यह भ्रूण के विकास के समय संयोजी ऊतक के साथ मांसपेशियों के घनिष्ठ संबंध को दर्शाता है।[12]
मायोजेनिक विभेदन का विनियमन दो मार्गों द्वारा नियंत्रित किया जाता है: फॉस्फेटिडाइलिनोजिटोल 3-किनासे मार्ग और नोच सिग्नलिंग मार्ग/हेस मार्ग, जो मयोडी प्रतिलेखन को दबाने के लिए सहयोगी तरीके से काम करते हैं। <रेफरी नाम = कितामुरा 2477-2485 /> ओ फोर्कहेड प्रोटीन (FOXO) की उपप्रजाति मायोजेनिक विभेदन के नियमन में महत्वपूर्ण भूमिका निभाती है क्योंकि वे Notch/Hes बाइंडिंग को स्थिर करते हैं। शोध से पता चला है कि चूहों में FOXO1 के नॉकआउट से मयोडी एक्सप्रेशन बढ़ जाता है, जिससे तीव्र चिकोटी पेशी|फास्ट-ट्विच और स्लो-ट्विच फाइबर का वितरण बदल जाता है।<रेफरी नाम= कितामुरा 2477–2485 />
स्नायु संलयन
प्राथमिक मांसपेशी फाइबर प्राथमिक मायोबलास्ट से उत्पन्न होते हैं और धीमी मांसपेशी फाइबर में विकसित होते हैं।[4]द्वितीयक पेशी तंतु तब प्राथमिक तंतुओं के चारों ओर बनते हैं जो कि संक्रमण के समय के निकट होते हैं। ये मांसपेशी फाइबर माध्यमिक मायोबलास्ट से बनते हैं और सामान्यतः तीव्रता से मांसपेशी फाइबर के रूप में विकसित होते हैं। अंत में, बाद में बनने वाले मांसपेशी फाइबर उपग्रह कोशिकाओं से उत्पन्न होते हैं।[4]
मांसपेशी संलयन में महत्वपूर्ण दो जीन एमईएफ2 और मोड़ प्रतिलेखन कारक हैं। अध्ययनों से पता चला है कि चूहों में एमईएफ2C के लिए नॉकआउट हृदय और चिकनी मांसपेशियों के विकास में मांसपेशियों के दोषों का कारण बनता है, विशेष रूप से संलयन में।[13] ट्विस्ट जीन मांसपेशियों के विभेदन में भूमिका निभाता है।
सिक्स1 जीन मायोजेनेसिस में एपेक्सियल और निम्नाक्ष मांसपेशियों के विभेदन में महत्वपूर्ण भूमिका निभाता है। इस जीन की कमी वाले चूहों में, गंभीर मांसपेशी हाइपोप्लेसिया ने शरीर की अधिकांश मांसपेशियों को प्रभावित किया, विशेष रूप से निम्नाक्ष मांसपेशियां।[14]
प्रोटीन संश्लेषण और एक्टिन विषमता
मायोजेनेसिस के समय 3 प्रकार के प्रोटीन का उत्पादन होता है।[5] क्लास ए प्रोटीन सबसे प्रचुर मात्रा में हैं और पूरे मायोजेनेसिस में लगातार संश्लेषित होते हैं। क्लास बी प्रोटीन वे प्रोटीन होते हैं जो मायोजेनेसिस के समय प्रारंभ होते हैं और पूरे विकास के समय जारी रहते हैं। कक्षा सी प्रोटीन वे होते हैं जो विकास के समय विशिष्ट समय पर संश्लेषित होते हैं। साथ ही मायोजेनेसिस के समय एक्टिन के 3 अलग-अलग रूपों की पहचान की गई।
Sim2, बीएचएलएच-Pas प्रतिलेखन कारक, सक्रिय दमन द्वारा प्रतिलेखन को रोकता है और चिक और माउस भ्रूण के विकास के समय उदर अंग की मांसपेशियों में बढ़ी हुई अभिव्यक्ति को प्रदर्शित करता है। यह एन्हांसर क्षेत्र से जुड़कर मयोडी प्रतिलेखन को दबाकर इसे पूरा करता है, और समय से पहले मायोजेनेसिस को रोकता है।[15] नॉच सिग्नलिंग पाथवे के माध्यम से, सोमाइट्स की मांसपेशियों के विभेदन के लिए न्यूरल क्रेस्ट कोशिकाओं में डेल्टा1 1 अभिव्यक्ति आवश्यक है। तंत्रिका शिखा कोशिकाओं में इस लिगैंड के लाभ और हानि के परिणामस्वरूप विलंबित या समय से पहले मायोजेनेसिस होता है।[16]
तकनीक
विभेदित C2C12 मायोबलास्ट के माइक्रोएरेरी विश्लेषण का उपयोग करके वैकल्पिक स्प्लिसिंग के महत्व को स्पष्ट किया गया था।[17] मायोजेनेसिस में C2C12 विभेदन के समय 95 वैकल्पिक स्प्लिसिंग घटनाएं होती हैं। इसलिए, मायोजेनेसिस में वैकल्पिक विभाजन आवश्यक है।
सिस्टम दृष्टिकोण
सिस्टम दृष्टिकोण मायोजेनेसिस का अध्ययन करने के लिए उपयोग की जाने वाली विधि है, जो सिस्टम के विभिन्न कारकों की पहचान करने के लिए उच्च परिणाम स्क्रीनिंग तकनीकों, जीनोम वाइड सेल-आधारित परख और जैव सूचना विज्ञान जैसी कई विभिन्न तकनीकों में हेरफेर करती है।[9]यह विशेष रूप से कंकाल की मांसपेशियों के विकास की जांच और इसके नियामक नेटवर्क की पहचान में उपयोग किया गया है।
मयोडी और मायोजेनिन जैसे मायोजेनिक नियामक कारकों के लक्ष्य, उनके अंतर-संबंधित लक्ष्य, और कैसे मयोडीमायोब्लास्टs और myotubes में स्वदेशी को बदलने के लिए कार्य करता है, के लक्ष्य को स्पष्ट करने के लिए उच्च-थ्रूपुट अनुक्रमण और चिप चिप विश्लेषण का उपयोग करने वाला सिस्टम दृष्टिकोण आवश्यक है।[9]इसने मायोजेनेसिस में पैक्स3 के महत्व को भी प्रकट किया है, और यह मायोजेनिक पूर्वजों के अस्तित्व को सुनिश्चित करता है।[9]
कोशिका आधारित उच्च-थ्रूपुट ट्रांसफेक्शन परख और स्वस्थानी संकरण में पूरे-माउंट का उपयोग करते हुए इस दृष्टिकोण का उपयोग मायोजेनेटिक रेगुलेटर RP58 और कण्डरा विभेदन जीन, मोहॉक होमोबॉक्स की पहचान करने में किया गया था।[9]
संदर्भ
- ↑ Yaffe, David; Feldman, Michael (1965). "विभिन्न आनुवंशिक उत्पत्ति के मायोबलास्ट्स से संकर बहुसंस्कृति वाले मांसपेशी फाइबर का निर्माण". Developmental Biology. 11 (2): 300–317. doi:10.1016/0012-1606(65)90062-X. PMID 14332576.
- ↑ Wei L, Zhou W, Croissant JD, Johansen FE, Prywes R, Balasubramanyam A, Schwartz RJ (Nov 1998). "सीरम प्रतिक्रिया कारक के माध्यम से RhoA सिग्नलिंग मायोजेनिक भेदभाव में एक अनिवार्य भूमिका निभाता है". J Biol Chem. 273 (46): 30287–94. doi:10.1074/jbc.273.46.30287. PMID 9804789.
- ↑ Vlahopoulos S, Zimmer WE, Jenster G, Belaguli NS, Balk SP, Brinkmann AO, Lanz RB, Zoumpourlis VC, Schwartz RJ, et al. (2005). "सीरम प्रतिक्रिया कारक के माध्यम से एण्ड्रोजन रिसेप्टर की भर्ती मायोजेनिक जीन की अभिव्यक्ति की सुविधा प्रदान करती है". J Biol Chem. 280 (9): 7786–92. doi:10.1074/jbc.M413992200. PMID 15623502.
- ↑ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 4.20 4.21 4.22 4.23 4.24 4.25 4.26 4.27 4.28 4.29 Pestronk, Alan. "मायोजेनेसिस और स्नायु उत्थान". WU Neuromuscular. Washington University. Retrieved 2013-03-16.
- ↑ 5.0 5.1 Harovltch, Sharon (1975). "Myogenesis in primary cell cultures from Drosophila melanogaster: protein synthesis and actin heterogeneity during development". Cell. 66 (4): 1281–6. doi:10.1016/0092-8674(78)90210-6. PMID 418880. S2CID 10811840.
- ↑ कितामुरा 2477-2485>{{cite journal|doi=10.1172/JCI32054|last=Kitamura|first=Tadahiro|author2=Kitamura YI |author3=Funahashi Y |author4=Shawber CJ |author5=Castrillon DH |author6=Kollipara R |author7=DePinho RA |author8=Kitajewski J |author9=Accili D |title=एक फॉक्सो / नॉट पाथवे मायोजेनिक विभेदन और फाइबर प्रकार विनिर्देश को नियंत्रित करता है|journal=The Journal of Clinical Investigation|date=4 September 2007|volume=117|issue=9|pages=2477–2485|pmc=1950461|pmid=17717603}
- ↑ अस्थानिक पैक्स-3 >Maroto, M; Reshef R; Münsterberg A E; Koester S; Goulding M; Lassar A B. (Apr 4, 1997). "एक्टोपिक पैक्स -3 भ्रूण के मेसोडर्म और तंत्रिका ऊतक में MyoD और Myf-5 अभिव्यक्ति को सक्रिय करता है". Cell. 89 (1): 139–148. doi:10.1016/S0092-8674(00)80190-7. PMID 9094722.
- ↑ 8.0 8.1 Cite error: Invalid
<ref>tag; no text was provided for refs namedectopic pax-3 - ↑ 9.0 9.1 9.2 9.3 9.4 9.5 Ito, Yoshiaki (2012). "ए सिस्टम्स अप्रोच एंड स्केलेटल मायोजेनेसिस". International Journal of Genomics. Hindawi Publishing Organization. 2012: 1–7. doi:10.1155/2012/759407. PMC 3443578. PMID 22991503.
- ↑ Windner SE, Doris RA, Ferguson CM, Nelson AC, Valentin G, Tan H, Oates AC, Wardle FC, Devoto SH (2015). "Tbx6, Mesp-b and Ripply1 regulate the onset of skeletal myogenesis in zebrafish". Development. 142 (6): 1159–68. doi:10.1242/dev.113431. PMC 4360180. PMID 25725067.
- ↑ Maroto, M; Reshef R; Münsterberg A E; Koester S; Goulding M; Lassar A B. (4 Apr 1997). "Ectopic Pax-3 activates MyoD and Myf-5 expression in embryonic mesoderm and neural tissue". Cell. 89 (1): 139–148. doi:10.1016/S0092-8674(00)80190-7. PMID 9094722.
- ↑ Mathew, Sam J.; Hansen JM; Merrell AJ; Murphy MM; Lawson JA; Hutcheson DA; Hansen MS; Angus-Hill M; Kardon G (15 January 2011). "Connective tissue fibroblasts and Tcf4 regulate myogenesis". Development. 138 (2): 371–384. doi:10.1242/dev.057463. PMC 3005608. PMID 21177349.
- ↑ Baylies, Mary (2001). "Invertebrate Myogenesis: looking back to the future of muscle development". Current Opinion in Genetics & Development. 66 (4): 1281–6. doi:10.1016/s0959-437x(00)00214-8. PMID 11448630.
- ↑ Laclef, Christine; Hamard G; Demignon J; Souil E; Houbron C; Maire P (14 February 2003). "छह1-कमी वाले चूहों में परिवर्तित मायोजेनेसिस". Development. 130 (10): 2239–2252. doi:10.1242/dev.00440. PMID 12668636.
- ↑ Havis, Emmanuelle; Pascal Coumailleau; Aline Bonnet; Keren Bismuth; Marie-Ange Bonnin; Randy Johnson; Chen-Min Fan; Frédéric Relaix; De-Li Shi; Delphine Duprez (2012-03-16). "विकास और स्टेम सेल". Development. 139 (7): 1910–1920. doi:10.1242/dev.072561. PMC 3347684. PMID 22513369.
- ↑ Rios, Anne; Serralbo, Olivier; Salgado, David; Marcelle, Christophe (2011-06-15). "तंत्रिका शिखा NOTCH के क्षणिक सक्रियण के माध्यम से मायोजेनेसिस को नियंत्रित करती है". Nature. 473 (7348): 532–535. Bibcode:2011Natur.473..532R. doi:10.1038/nature09970. PMID 21572437. S2CID 4380479.
- ↑ Bland, C.S; Wang, David; Johnson, Castle; Burge, Cooper (July 2010). "मायोजेनिक भेदभाव के दौरान वैकल्पिक विभाजन का वैश्विक विनियमन". Nucleic Acids Research. 38 (21): 7651–7664. doi:10.1093/nar/gkq614. hdl:1721.1/66688. PMC 2995044. PMID 20634200.