सोडियम एलुमिनेट: Difference between revisions
(Created page with "{{Chembox | Watchedfields = changed | verifiedrevid = 414397248 | ImageFile = Unit cell of NaAlO2.png | ImageCaption = Crystal structure with sodium in yellow, aluminium in gr...") |
No edit summary |
||
| Line 44: | Line 44: | ||
| AutoignitionPt =}} | | AutoignitionPt =}} | ||
}} | }} | ||
[[सोडियम]] [[एलुमिनेट]] एक [[अकार्बनिक]] रसायन है जिसका उपयोग कई औद्योगिक और तकनीकी अनुप्रयोगों के लिए [[एल्यूमीनियम हाइड्रॉक्साइड]] के प्रभावी स्रोत के रूप में किया जाता है। शुद्ध सोडियम एल्युमिनेट ([[निर्जल]]) एक सफेद [[क्रिस्टल]] | '''[[सोडियम]] [[एलुमिनेट]]''' एक [[अकार्बनिक]] रसायन है जिसका उपयोग कई औद्योगिक और तकनीकी अनुप्रयोगों के लिए [[एल्यूमीनियम हाइड्रॉक्साइड]] के प्रभावी स्रोत के रूप में किया जाता है। शुद्ध सोडियम एल्युमिनेट ([[निर्जल]]) एक सफेद [[क्रिस्टल|क्रिस्टलाइन]] (पारदर्शी) ठोस है जिसका सूत्र विभिन्न प्रकार से NaAlO<sub>2</sub> दिया गया है, NaAl(OH)<sub>4</sub> ([[हाइड्रेट]]),<ref>{{cite web|url=http://www.chemguide.co.uk/inorganic/extraction/aluminium.html|title=अल्युमीनियम|work=chemguide.co.uk}}</ref> Na<sub>2</sub>O·Al<sub>2</sub>O<sub>3</sub>, या NaAl(OH)<sub>4</sub>. वाणिज्यिक सोडियम एल्युमिनेट घोल या ठोस के रूप में उपलब्ध है।<br /> | ||
अन्य संबंधित यौगिक, जिन्हें कभी-कभी सोडियम एलुमिनेट भी कहा जाता है, सोडियम ऑक्साइड Na<sub>2</sub>O की प्रतिक्रिया द्वारा तैयार किए जाते हैं और एल्यूमीनियम ऑक्साइड Al<sub>2</sub>O हैं Na<sub>5</sub>AlO<sub>4</sub> जिसमें असतत AlO<sub>4</sub><sup>5−</sup> आयन होता है, सोडियम एल्यूमीनियम ऑक्साइड Na<sub>7</sub>Al<sub>3</sub>O<sub>8</sub>और Na<sub>17</sub>Al<sub>5</sub>O<sub>16</sub> जिसमें जटिल पॉलिमरिक आयन और NaAl<sub>11</sub>O<sub>17</sub> होते है, जिसे एक बार गलती से β-एल्यूमिना, [[ अल्यूमिनियम ऑक्साइड | अल्यूमिनियम ऑक्साइड]] का एक चरण माना जाता था।<ref>"Identification and characterisation of three novel compounds in the sodium–aluminium–oxygen system", Marten G. Barker, Paul G. Gadd and Michael J. Begley, ''J. Chem. Soc.'', Dalton Trans., 1984, 1139–1146, {{doi|10.1039/DT9840001139}}</ref><ref name="Wiberg&Holleman">Egon Wiberg, Arnold Frederick Holleman (2001) ''Inorganic Chemistry'', Elsevier {{ISBN|0-12-352651-5}}</ref> | |||
==संरचना== | ==संरचना== | ||
निर्जल सोडियम एलुमिनेट, | निर्जल सोडियम एलुमिनेट, NaAl<sub>11</sub>O<sub>17</sub>, इसमें कोने से जुड़े अलओ का त्रि-आयामी ढांचा सम्मिलित है<sub>4</sub> टेट्राहेड्रा. हाइड्रेटेड रूप NaAlO<sub>2</sub>·5/4H<sub>2</sub>O में AlO<sub>4</sub> की परतें हैं टेट्राहेड्रा रिंग्स में जुड़ जाता है और परतें सोडियम आयनों और पानी के अणुओं द्वारा एक साथ जुड़ी रहती हैं जो AlO<sub>4</sub> टेट्राहेड्रा में Oपरमाणुओं से हाइड्रोजन बंधते हैंl .<ref>"The Crystal Structure of Hydrated Sodium Aluminate, NaAlO<sub>2</sub>·5/4H<sub>2</sub>O, and Its Dehydration Product", James A. Kaduk, Shiyou Pei, ''Journal of Solid State Chemistry'', 115, 1, 1995, 126–139, {{doi|10.1006/jssc.1995.1111}}</ref> | ||
==विनिर्माण== | ==विनिर्माण== | ||
सोडियम एल्युमिनेट का निर्माण एल्युमिनियम हाइड्रॉक्साइड (Al(OH) | सोडियम एल्युमिनेट का निर्माण एल्युमिनियम हाइड्रॉक्साइड (Al(OH)<sub>3</sub>) के विघटन से होता है) [[कटू सोडियम]] (NaOH) घोल में। एल्युमीनियम हाइड्रॉक्साइड ([[गिबसाइट]]) को क्वथनांक के निकट तापमान पर 20-25% जलीय NaOH घोल में घोला जा सकता है। अधिक सांद्र NaOH समाधानों के उपयोग से अर्ध-ठोस उत्पाद प्राप्त होता है। प्रक्रिया को [[निकल]] या [[ इस्पात ]] के भाप-गर्म बर्तनों में किया जाना चाहिए, और एल्यूमीनियम हाइड्रॉक्साइड को लगभग 50% जलीय कास्टिक सोडा के साथ उबालना चाहिए जब तक कि एक गूदा न बन जाए। अंतिम मिश्रण को एक टैंक में डालना होगा और ठंडा करना होगा; एक ठोस द्रव्यमान जिसमें लगभग 70% NaAlO<sub>2</sub> है फिर बनता है. कुचलने के बाद, इस उत्पाद को एक रोटरी ओवन में निर्जलित किया जाता है। परिणामी उत्पाद में 90% NaAlO<sub>2</sub> है और 1% पानी, साथ में 1% मुक्त NaOH। | ||
==एल्यूमीनियम धातु और क्षार की प्रतिक्रिया== | ==एल्यूमीनियम धातु और क्षार की प्रतिक्रिया== | ||
सोडियम एल्युमिनेट भी मौलिक एल्यूमीनियम पर सोडियम हाइड्रॉक्साइड की क्रिया से बनता है जो एक उभयचर धातु है। एक बार स्थापित होने के बाद प्रतिक्रिया अत्यधिक ऊष्माक्षेपी होती है और हाइड्रोजन गैस के तेजी से विकास के साथ होती है। प्रतिक्रिया को कभी-कभी इस प्रकार लिखा जाता है: | सोडियम एल्युमिनेट भी मौलिक एल्यूमीनियम पर सोडियम हाइड्रॉक्साइड की क्रिया से बनता है जो एक उभयचर धातु है। एक बार स्थापित होने के बाद प्रतिक्रिया अत्यधिक ऊष्माक्षेपी होती है और हाइड्रोजन गैस के तेजी से विकास के साथ होती है। प्रतिक्रिया को कभी-कभी इस प्रकार लिखा जाता है: | ||
: 2Al + 2NaOH + 2H<sub>2</sub>O → 2NaAlO<sub>2</sub> + | : 2Al + 2NaOH + 2H<sub>2</sub>O → 2NaAlO<sub>2</sub> + 3H<sub>2</sub> | ||
हालाँकि, समाधान में उत्पादित प्रजातियों में [Al(OH | हालाँकि, समाधान में उत्पादित प्रजातियों में [Al(OH<sub>4</sub>)]<sup>−</sup> आयन सम्मिलित होने की संभावना है या शायद [Al(H<sub>2</sub>O)<sub>2</sub>(OH)<sub>4</sub>]<sup>−</sup>आयन.<ref>{{Greenwood&Earnshaw}}</ref> | ||
==उपयोग== | ==उपयोग== | ||
जल उपचार में इसका उपयोग जल मृदुकरण प्रणालियों के सहायक के रूप में, [[flocculation]] में सुधार के लिए एक स्कंदक सहायता के रूप में, और घुले हुए [[सिलिका]] और [[ फास्फेट ]] को हटाने के लिए किया जाता है। | जल उपचार में इसका उपयोग जल मृदुकरण प्रणालियों के सहायक के रूप में, [[flocculation]] में सुधार के लिए एक स्कंदक सहायता के रूप में, और घुले हुए [[सिलिका]] और[[ फास्फेट | फास्फेट]] को हटाने के लिए किया जाता है। | ||
निर्माण प्रौद्योगिकी में, सोडियम एल्यूमिनेट का उपयोग [[ ठोस ]] के जमने में तेजी लाने के लिए किया जाता है, मुख्य रूप से ठंढ के दौरान काम करते | निर्माण प्रौद्योगिकी में, सोडियम एल्यूमिनेट का उपयोग [[ ठोस ]] के जमने में तेजी लाने के लिए किया जाता है, मुख्य रूप से ठंढ के दौरान काम करते समय करते है। | ||
सोडियम एल्युमिनेट का उपयोग [[अग्नि ईंट]] उत्पादन, एल्यूमिना उत्पादन आदि के लिए [[कागज रसायन]]ों में भी किया जाता है। | सोडियम एल्युमिनेट का उपयोग [[अग्नि ईंट]] उत्पादन, एल्यूमिना उत्पादन आदि के लिए [[कागज रसायन]]ों में भी किया जाता है। | ||
| Line 78: | Line 77: | ||
* [[बायर प्रक्रिया]] | * [[बायर प्रक्रिया]] | ||
* [[ बाक्साइट ]] | * [[ बाक्साइट ]] | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 19/07/2023]] | [[Category:Created On 19/07/2023]] | ||
Revision as of 23:29, 26 July 2023
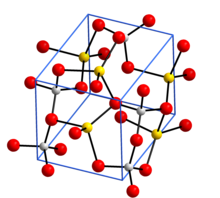 Crystal structure with sodium in yellow, aluminium in grey, and oxygen in red[1]
| |
 Sodium metaaluminate sample
| |
| Names | |
|---|---|
| Other names
Sodium aluminium oxide,
Sodium metaaluminate Aluminate, ((AlO2)1−), sodium | |
| Identifiers | |
3D model (JSmol)
|
|
| EC Number |
|
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| NaAlO2 | |
| Molar mass | 81.97 g/mol |
| Appearance | white powder (sometimes light-yellowish) hygroscopic/ when dissolved in water a colloidal black solution is formed |
| Odor | odorless |
| Density | 1.5 g/cm3 |
| Melting point | 1,650 °C (3,000 °F; 1,920 K) |
| highly soluble | |
| Solubility | Insoluble in alcohol[2] |
Refractive index (nD)
|
1.566 |
| Structure | |
| orthorhombic | |
| Thermochemistry | |
Heat capacity (C)
|
73.6 J/mol K |
Std molar
entropy (S⦵298) |
70.4 J/mol K |
Std enthalpy of
formation (ΔfH⦵298) |
-1133.2 kJ/mol |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
सोडियम एलुमिनेट एक अकार्बनिक रसायन है जिसका उपयोग कई औद्योगिक और तकनीकी अनुप्रयोगों के लिए एल्यूमीनियम हाइड्रॉक्साइड के प्रभावी स्रोत के रूप में किया जाता है। शुद्ध सोडियम एल्युमिनेट (निर्जल) एक सफेद क्रिस्टलाइन (पारदर्शी) ठोस है जिसका सूत्र विभिन्न प्रकार से NaAlO2 दिया गया है, NaAl(OH)4 (हाइड्रेट),[3] Na2O·Al2O3, या NaAl(OH)4. वाणिज्यिक सोडियम एल्युमिनेट घोल या ठोस के रूप में उपलब्ध है।
अन्य संबंधित यौगिक, जिन्हें कभी-कभी सोडियम एलुमिनेट भी कहा जाता है, सोडियम ऑक्साइड Na2O की प्रतिक्रिया द्वारा तैयार किए जाते हैं और एल्यूमीनियम ऑक्साइड Al2O हैं Na5AlO4 जिसमें असतत AlO45− आयन होता है, सोडियम एल्यूमीनियम ऑक्साइड Na7Al3O8और Na17Al5O16 जिसमें जटिल पॉलिमरिक आयन और NaAl11O17 होते है, जिसे एक बार गलती से β-एल्यूमिना, अल्यूमिनियम ऑक्साइड का एक चरण माना जाता था।[4][5]
संरचना
निर्जल सोडियम एलुमिनेट, NaAl11O17, इसमें कोने से जुड़े अलओ का त्रि-आयामी ढांचा सम्मिलित है4 टेट्राहेड्रा. हाइड्रेटेड रूप NaAlO2·5/4H2O में AlO4 की परतें हैं टेट्राहेड्रा रिंग्स में जुड़ जाता है और परतें सोडियम आयनों और पानी के अणुओं द्वारा एक साथ जुड़ी रहती हैं जो AlO4 टेट्राहेड्रा में Oपरमाणुओं से हाइड्रोजन बंधते हैंl .[6]
विनिर्माण
सोडियम एल्युमिनेट का निर्माण एल्युमिनियम हाइड्रॉक्साइड (Al(OH)3) के विघटन से होता है) कटू सोडियम (NaOH) घोल में। एल्युमीनियम हाइड्रॉक्साइड (गिबसाइट) को क्वथनांक के निकट तापमान पर 20-25% जलीय NaOH घोल में घोला जा सकता है। अधिक सांद्र NaOH समाधानों के उपयोग से अर्ध-ठोस उत्पाद प्राप्त होता है। प्रक्रिया को निकल या इस्पात के भाप-गर्म बर्तनों में किया जाना चाहिए, और एल्यूमीनियम हाइड्रॉक्साइड को लगभग 50% जलीय कास्टिक सोडा के साथ उबालना चाहिए जब तक कि एक गूदा न बन जाए। अंतिम मिश्रण को एक टैंक में डालना होगा और ठंडा करना होगा; एक ठोस द्रव्यमान जिसमें लगभग 70% NaAlO2 है फिर बनता है. कुचलने के बाद, इस उत्पाद को एक रोटरी ओवन में निर्जलित किया जाता है। परिणामी उत्पाद में 90% NaAlO2 है और 1% पानी, साथ में 1% मुक्त NaOH।
एल्यूमीनियम धातु और क्षार की प्रतिक्रिया
सोडियम एल्युमिनेट भी मौलिक एल्यूमीनियम पर सोडियम हाइड्रॉक्साइड की क्रिया से बनता है जो एक उभयचर धातु है। एक बार स्थापित होने के बाद प्रतिक्रिया अत्यधिक ऊष्माक्षेपी होती है और हाइड्रोजन गैस के तेजी से विकास के साथ होती है। प्रतिक्रिया को कभी-कभी इस प्रकार लिखा जाता है:
- 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
हालाँकि, समाधान में उत्पादित प्रजातियों में [Al(OH4)]− आयन सम्मिलित होने की संभावना है या शायद [Al(H2O)2(OH)4]−आयन.[7]
उपयोग
जल उपचार में इसका उपयोग जल मृदुकरण प्रणालियों के सहायक के रूप में, flocculation में सुधार के लिए एक स्कंदक सहायता के रूप में, और घुले हुए सिलिका और फास्फेट को हटाने के लिए किया जाता है।
निर्माण प्रौद्योगिकी में, सोडियम एल्यूमिनेट का उपयोग ठोस के जमने में तेजी लाने के लिए किया जाता है, मुख्य रूप से ठंढ के दौरान काम करते समय करते है।
सोडियम एल्युमिनेट का उपयोग अग्नि ईंट उत्पादन, एल्यूमिना उत्पादन आदि के लिए कागज रसायनों में भी किया जाता है।
सोडियम एलुमिनेट समाधान जिओलाइट्स के उत्पादन में मध्यवर्ती हैं।[8][9]
संदर्भ
- ↑ Kaduk, James A.; Pei, Shiyou (1995). "The Crystal Structure of Hydrated Sodium Aluminate, NaAlO2•5/4H2O, and Its Dehydration Product". Journal of Solid State Chemistry. 115 (1): 126–139. doi:10.1006/jssc.1995.1111.
- ↑ The Merck Index. 10th ed. Rahway, New Jersey: Merck Co., Inc., 1983., p. 1229
- ↑ "अल्युमीनियम". chemguide.co.uk.
- ↑ "Identification and characterisation of three novel compounds in the sodium–aluminium–oxygen system", Marten G. Barker, Paul G. Gadd and Michael J. Begley, J. Chem. Soc., Dalton Trans., 1984, 1139–1146, doi:10.1039/DT9840001139
- ↑ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ "The Crystal Structure of Hydrated Sodium Aluminate, NaAlO2·5/4H2O, and Its Dehydration Product", James A. Kaduk, Shiyou Pei, Journal of Solid State Chemistry, 115, 1, 1995, 126–139, doi:10.1006/jssc.1995.1111
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Lankapati, Henilkumar M.; Lathiya, Dharmesh R.; Choudhary, Lalita; Dalai, Ajay K.; Maheria, Kalpana C. (2020). "Mordenite-Type Zeolite from Waste Coal Fly Ash: Synthesis, Characterization and Its Application as a Sorbent in Metal Ions Removal". ChemistrySelect (in English). 5 (3): 1193–1198. doi:10.1002/slct.201903715. S2CID 213214375.
- ↑ Alan Dyer, (1994), Encyclopedia of Inorganic Chemistry, R. Bruce King (ed.), John Wiley & Sons, ISBN 0-471-93620-0