18-इलेक्ट्रॉन नियम: Difference between revisions
(Created page with "{{Short description|Chemical property of transition metals}} 18-इलेक्ट्रॉन नियम अंगूठे का एक रसायन शास्त्...") |
No edit summary |
||
| (7 intermediate revisions by 5 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Chemical property of transition metals}} | {{Short description|Chemical property of transition metals}} | ||
18-इलेक्ट्रॉन नियम | 18-इलेक्ट्रॉन अनुभवसिद्ध रीति या नियम एक रासायनिक नियम है जो मुख्य रूप से स्थिर [[ संक्रमण धातु |संक्रमण धातु]] सम्मिश्रण के लिए विशेष रूप से [[ ऑर्गोमेटेलिक यौगिक |ऑर्गोमेटेलिक यौगिक]] जैसे सूत्रों की भविष्यवाणी और युक्तिसंगत बनाने के लिए उपयोग किया जाता है,<ref name="Check1">{{cite journal | doi = 10.1126/science.54.1386.59 | pmid = 17843674| author-link = Irving Langmuir|last=Langmuir |first=I. | title = वैलेंस के प्रकार| journal = [[Science (journal)|Science]] | year = 1921 | volume = 54 | issue = 1386 | pages = 59–67|bibcode = 1921Sci....54...59L | url = https://zenodo.org/record/1448265 }}</ref> यह नियम ऐसे तथ्यों पर आधारित होता है जिनमें संक्रमण धातुओं के [[ इलेक्ट्रॉन |इलेक्ट्रॉन]] विन्यास में [[ संयोजकता कक्षीय |संयोजकता कक्ष]] होते हैं जिसमें पाँच (n−1)d कक्षक, एक ns कक्षक और तीन np कक्षक होते हैं, जहां एन [[ मुख्य क्वांटम संख्या | मुख्य क्वांटम संख्या]] है। ये ऑर्बिटल्स सामूहिक रूप से 18 इलेक्ट्रॉनों को या तो बंधन या गैर-बंधन इलेक्ट्रॉन के जोड़ों के रूप में समायोजित कर सकता हैं। इसका अर्थ हैं कि इन नौ परमाणुओं के कक्षक के [[ लिगैंड ]] कक्षकों के संयोजन से नौ [[ परमाणु कक्षक ]] बनते हैं जो या तो धातु-लिगैंड बंधन या गैर-बंधन होते हैं। जब एक धातु परिसर में 18 संयोजी इलेक्ट्रॉन होते हैं, तब ऐसी स्थिति में निर्वात गैस के समान इलेक्ट्रॉन विन्यास प्राप्त होता है। यह नियम उन धातुओं के सम्मिश्रण के लिए सहायक नहीं होता है जो संक्रमण धातु की श्रेणी में नहीं होती हैं, और उपयोगी संक्रमण धातु परिसर के नियम के विरूद्ध कार्य करने लगती है क्योंकि इस नियम से विचलित होने वाले परिणाम इसकी प्रतिक्रियाशीलता पर पड़ते हैं। यह नियम पहली बार 1921 में अमेरिकी रसायनज्ञ [[ इरविंग लैंगमुइर ]] द्वारा प्रस्तावित किया गया था।<ref name="Check1" /><ref>{{cite journal|title=18-इलेक्ट्रॉन नियम की उत्पत्ति|author1-link=William B. Jensen|first1=William B.|last1=Jensen |journal=[[Journal of Chemical Education|J. Chem. Educ.]]|date= 2005 |volume=82 |issue=1 |page=28 |bibcode=2005JChEd..82...28J|doi=10.1021/ed082p28}}</ref> | ||
== उपयुक्तता == | |||
यह नियम मुख्य रूप से घूर्णन स्थिति (जैसे डी इलेक्ट्रॉन की घूर्णन स्थिति) के लिए सूत्रों की भविष्यवाणी करता है, जैसे सीआर, एमएन, एफई, और सह ट्रायड्स के निम्न घूर्णन परिसर। अन्य प्रसिद्ध उदाहरणों में [[ फेरोसीन ]], [[ आयरन पेंटाकार्बोनिल ]], [[ क्रोमियम कार्बोनिल ]] और [[ निकल कार्बोनिल ]] सम्मिलित है। | |||
एक परिसर में लिगैंड्स 18-इलेक्ट्रॉन नियम की प्रयोज्यता को निर्धारित करता हैं। सामान्यतः इस नियम का पालन करने वाले परिसर कम से कम आंशिक रूप से π-स्वीकर्ता लिगेंड्स से बने होते हैं (इसे -एसिड के रूप में भी जाना जाता है)। इस प्रकार का लिगैंड एक बहुत मजबूत लिगैंड क्षेत्र बनाता है, जो परिणामी आणविक कक्षा की ऊर्जा को कम करता है जिससे वह अनुकूल रूप से अपना अधिकार स्थापित कर सकें। विशिष्ट लिगेंड में [[ ओलेफिन | ओलेफिन]] , [[ फॉस्फीन लिगैंड | फॉस्फीन लिगैंड]] और [[ कार्बोनिल | कार्बोनिल]] सम्मिलित हैं। अम्लीय सम्मिश्रण में सामान्यतः कम-ऑक्सीकरण अवस्था में धातुओं की विशेषता होती हैं। ऑक्सीकरण अवस्था और लिगेंड की प्रकृति के बीच संबंध को बैकबॉन्डिंग के प्रारूप के भीतर युक्तिसंगत करके बनाया गया है। | |||
एक परिसर में लिगैंड्स 18-इलेक्ट्रॉन नियम की प्रयोज्यता निर्धारित | |||
=== प्रतिक्रियाशीलता के परिणाम === | === प्रतिक्रियाशीलता के परिणाम === | ||
18-इलेक्ट्रॉन नियम का पालन करने वाले यौगिक | 18-इलेक्ट्रॉन नियम का पालन करने वाले यौगिक सामान्यतः निष्क्रिय होते हैं। उदाहरणों में [Co(NH<sub>3</sub>)<sub>6</sub>]Cl<sub>3</sub>, Mo(CO)<sub>6</sub>, and [Fe(CN)<sub>6</sub>]<sup>4−</sup> सम्मिलित हैं। ऐसी स्थिति में, सामान्य रूप से लिगैंड का स्थानांतरण विघटनकारी प्रतिस्थापन तंत्र के माध्यम से होता है, जिसमें प्रतिक्रिया की दर एक लिगैंड के पृथक्करण की दर से निर्धारित होती है। दूसरी ओर, 18-इलेक्ट्रॉन यौगिक प्रोटॉन जैसे इलेक्ट्रोफाइल के प्रति अत्यधिक प्रतिक्रियाशील हो सकते हैं, और ऐसी प्रतिक्रियाएं इस प्रणाली में सहयोगी होती हैं, इस प्रकार अम्ल व क्षार प्रतिक्रियाएं होती हैं। | ||
18 से कम | 18 से कम संयोजकता के इलेक्ट्रॉन वाले परिसर बढ़ी हुई प्रतिक्रियाशीलता दिखाते हैं। इस प्रकार, 18-इलेक्ट्रॉन नियम साधारणतयः [[ स्टोइकोमेट्रिक ]] या [[ कटैलिसीस ]] के अर्थ के लिए गैर-प्रतिक्रिया रूपी एक विधि है। | ||
=== डुओडेक्टेट नियम === | === डुओडेक्टेट नियम === | ||
कम्प्यूटरीकृत निष्कर्ष के अनुसार धातु पर संयोजकता पी-कक्षीय धातु-लिगैंड बंधन में भाग लेते हैं, चूंकि यह एक कमजोर कड़ी हैं।<ref>{{cite book |editor1-last=Frenking |editor1-first=Gernot|editor2-last=Shaik |editor2-first=Sason|title=रासायनिक बंधन: आवर्त सारणी के पार रासायनिक बंधन|publisher=Wiley-VCH |date=May 2014 |chapter=Chapter 7: Chemical bonding in Transition Metal Compounds |isbn=978-3-527-33315-8}}</ref> इसी प्रकार वेनहोल्ड और लैंडिस प्राकृतिक बंधन की कक्षा के संदर्भ में धातु-लिगैंड बन्धन में धातु पी-कक्षा की गणना नहीं करते हैं,<ref>{{cite journal | |||
| title = मुख्य समूह और संक्रमण धातु बंधन में वैलेंस और अतिरिक्त-वैलेंस ऑर्बिटल्स| first1= C. R. |last1=Landis |first2=F. |last2=Weinhold | | title = मुख्य समूह और संक्रमण धातु बंधन में वैलेंस और अतिरिक्त-वैलेंस ऑर्बिटल्स| first1= C. R. |last1=Landis |first2=F. |last2=Weinhold | ||
| journal = [[Journal of Computational Chemistry|J. Comput. Chem.]] | | journal = [[Journal of Computational Chemistry|J. Comput. Chem.]] | ||
| Line 22: | Line 21: | ||
| doi = 10.1002/jcc.20492 | | doi = 10.1002/jcc.20492 | ||
| pmid= 17063478 | doi-access = free | | pmid= 17063478 | doi-access = free | ||
}}</ref> | }}</ref> चूंकि ये कक्षाएं अभी भी आधारित सेट(रसायन विज्ञान) के रूप में सम्मिलित होता हैं। जिसके परिणामस्वरूप पांच डी-कक्षीय और एक एस-कक्षा के लिए डुओडेक्टेट नियम(12-इलेक्ट्रॉन नियम) होता है। | ||
सामान्य रसायन विज्ञान | सामान्य रसायन विज्ञान में वर्तमान समय में सर्वसम्मति यह है कि मुख्य समूह तत्वों के लिए अष्ट नियम के विपरीत, संक्रमण धातुएं 12-इलेक्ट्रॉन या 18-इलेक्ट्रॉन नियम का कठिनाई से पालन नहीं करती हैं, लेकिन यह नियम ऊपरी और निचली दोनों सीमाओं को क्रमशः इलेक्ट्रॉन गणना के लिए संतुलित करता हैं।<ref>{{cite journal | ||
| title = संक्रमण-धातु यौगिकों में बंधन की प्रकृति| first1= Gernot |last1=Frenking |first2=Nikolaus |last2=Fröhlich | | title = संक्रमण-धातु यौगिकों में बंधन की प्रकृति| first1= Gernot |last1=Frenking |first2=Nikolaus |last2=Fröhlich | ||
| journal = [[Chemical Reviews|Chem. Rev.]] | | journal = [[Chemical Reviews|Chem. Rev.]] | ||
| Line 40: | Line 39: | ||
| pages = 8781–8845 | | pages = 8781–8845 | ||
| doi = 10.1021/acs.chemrev.8b00722 | | doi = 10.1021/acs.chemrev.8b00722 | ||
| pmid= 31251603 | s2cid= 195761899 }}</ref> इस प्रकार, | | pmid= 31251603 | s2cid= 195761899 }}</ref> इस प्रकार, जब डी-कक्षीय और एस-कक्षीय संक्रमण धातुओं में बंधन आसानी से होता है, तब इस बंधन में उच्च ऊर्जा और अधिक स्थानिक रूप से फैलाने वाले पी-कक्षा की भागेदारी केंद्रीय परमाणु और समन्वय वातावरण पर निर्भर करती है।<ref>{{cite journal | ||
| title = समरूपता विश्लेषण द्वारा सरल संक्रमण धातु पॉलीहाइड्राइड परिसरों की ज्यामिति की भविष्यवाणी| first1= Craig |last1=Bayse |first2=Michael |last2=Hall | | title = समरूपता विश्लेषण द्वारा सरल संक्रमण धातु पॉलीहाइड्राइड परिसरों की ज्यामिति की भविष्यवाणी| first1= Craig |last1=Bayse |first2=Michael |last2=Hall | ||
| journal = [[Journal of the American Chemical Society|J. Am. Chem. Soc.]] | | journal = [[Journal of the American Chemical Society|J. Am. Chem. Soc.]] | ||
| Line 56: | Line 55: | ||
| doi = 10.1016/S0010-8545(00)00263-0 | | doi = 10.1016/S0010-8545(00)00263-0 | ||
}}</ref> | }}</ref> | ||
== अपवाद == | == अपवाद == | ||
-दाता या -दाता | π-दाता या σ-दाता धातु ऑर्बिटल्स के साथ परस्पर कम प्रतिक्रिया करके [[ लिगैंड क्षेत्र सिद्धांत | लिगैंड क्षेत्र सिद्धांत]] के कारण कमजोर लिगैंड क्षेत्र की ओर ले जाते हैं जो t<sub>2g</sub> कक्षकों की ऊर्जा को बढ़ाता है ये आणविक ऑर्बिटल्स नॉन-बॉन्डिंग या कमजोर रूप से [[ गैर-बंधन कक्षीय |गैर-बंधन कक्षीय]] (छोटे Δ<sub>oct</sub>) बन जाते हैं। इसलिए, इलेक्ट्रॉन को जोड़ने या हटाने से जटिल स्थिरता पर बहुत कम प्रभाव पड़ता है। ऐसी स्थिति में, डी-इलेक्ट्रॉनों की संख्याओं पर कोई प्रतिबंध नहीं होता हैं और 12-22 इलेक्ट्रॉनों वाले परिसर संभव हो जाते हैं। मान में कम Δ<sub>oct</sub> के द्वारा इसे भरना संभव बन जाता है जैसे (>18 e−) के लिए और इसी प्रकार π-दाता लिगेंड्स t<sub>2g</sub> प्रतिरक्षी (<18 e−) बना सकते हैं। इस प्रकार के लिगैंड [[ स्पेक्ट्रोकेमिकल श्रृंखला ]]निम्न-से-मध्य भाग में स्थित होती हैं। उदाहरण के लिए: [TiF<sub>6</sub>]<sup>2−</sup> (Ti(IV), d<sup>0</sup>, 12 e<sup>−</sup>), [Co(NH<sub>3</sub>)<sub>6</sub>]<sup>3+</sup> (Co(III), d<sup>6</sup>, 18 e<sup>−</sup>), [Cu(OH<sub>2</sub>)<sub>6</sub>]<sup>2+</sup> (Cu(II), d<sup>9</sup>, 21 e<sup>−</sup>)। | ||
धातु आयनों के संदर्भ में, oct एक समूह के साथ-साथ बढ़ती [[ ऑक्सीकरण संख्या |ऑक्सीकरण संख्या]] के साथ बढ़ता है। मजबूत लिगैंड फ़ील्ड निम्न-स्पिन सम्मिश्रण की ओर ले जाते हैं जो 18-इलेक्ट्रॉन नियम के कुछ अपवादों का कारण बनता है। | |||
===16-इलेक्ट्रॉन परिसर === | |||
सम्मिश्रण का एक महत्वपूर्ण वर्ग जो 18e नियम का उल्लंघन करते हैं, वे धातु d<sup>8</sup> संरूपण वाले 16-इलेक्ट्रॉन परिसर हैं।सभी हाई-स्पिन d<sup>8</sup> धातु आयन ऑक्टाहेड्रल (या [[ टेट्राहेड्रल आणविक ज्यामिति | टेट्राहेड्रल आणविक ज्यामिति]]) हैं लेकिन लो-स्पिन d<sup>8</sup> धातु के आयन सभी वर्गाकार समतलीय हैं। वर्गाकार समतलीय लो-स्पिन d<sup>8</sup> के महत्वपूर्ण उदाहरण धातु आयन Rh(I), Ir(I), Ni(II), Pd(II), और Pt(II) हैं। नीचे दिए गए चित्र में निम्न-स्पिन वर्ग-प्लानर सम्मिश्रण में d<sup>8</sup> उपकोश का विभाजन दिखाया गया है। उदाहरण के रूप में विशेष रूप से कोबाल्ट और निकल ट्रायड्स के डेरिवेटिव के लिए प्रचलित हैं। इस तरह के यौगिक साधारण रूप से [[ वर्ग समतलीय | वर्ग समतलीय]] होते हैं। सबसे प्रसिद्ध उदाहरण वास्का का परिसर ((IrCl(CO)(PPh<sub>3</sub>)<sub>2</sub>), [PtCl<sub>4</sub>]<sup>2−</sup> और ज़ीज़ नमक अर्ताथ [PtCl<sub>3</sub>(''η''<sup>2</sup>-C<sub>2</sub>H<sub>4</sub>)]<sup>−</sup> है। | |||
18e नियम का उल्लंघन | |||
:[[Image:Chem507f09sqvstet2.png]]कई [[ उत्प्रेरक चक्र ]] | ऐसे सम्मिश्रण में, डी<sub>''z''<sup>2</sup></sub> कक्षीय दोगुना व्यस्त और गैर-बंधन है। | ||
:[[Image:Chem507f09sqvstet2.png]] | |||
:कई [[ उत्प्रेरक चक्र | उत्प्रेरक चक्र]] सम्मिश्रण के माध्यम से संचालित होते हैं जो 18-इलेक्ट्रॉन और स्क्वायर-प्लानर 16-इलेक्ट्रॉन कॉन्फ़िगरेशन के बीच वैकल्पिक होते हैं। उदाहरणों में [[ मोनसेंटो एसिटिक एसिड संश्लेषण | मोनसेंटो एसिटिक एसिड संश्लेषण]] , [[ हाइड्रोजनीकरण | हाइड्रोजनीकरण]] , [[ हाइड्रोफॉर्माइलेशन | हाइड्रोफॉर्माइलेशन]] , ओलेफिन आइसोमेरिज़ेशन और कुछ एल्केन पोलीमराइज़ेशन शामिल हैं। | |||
अन्य उल्लंघनों को धातु केंद्र पर लिगेंड के प्रकार के अनुसार वर्गीकृत किया जा सकता है। | अन्य उल्लंघनों को धातु केंद्र पर लिगेंड के प्रकार के अनुसार वर्गीकृत किया जा सकता है। | ||
===भारी लिगेंड === | ===भारी लिगेंड === | ||
भारी लिगैंड्स लिगैंड्स के पूर्ण पूरक के दृष्टिकोण को रोक सकते हैं जो धातु को 18 इलेक्ट्रॉन | भारी लिगैंड्स लिगैंड्स के पूर्ण पूरक के दृष्टिकोण को रोक सकते हैं जो धातु को 18 इलेक्ट्रॉन विन्यास प्राप्त करने की अनुमति देगा। उदाहरण: | ||
* Ti([[नियोपेंटाइल]])<sub>4</sub> (8 e<sup>−</sup>) | |||
*[[ पेंटामेथिलसाइक्लोपेंटाडीन | पेंटामेथिलसाइक्लोपेंटाडीन Cp*<sub>2</sub>Ti(C<sub>2</sub>H<sub>4</sub>) (16 e<sup>−</sup>)]] | |||
*वैनेडियम हेक्साकार्बोनिल V(CO)<sub>6</sub> (17 e<sup>−</sup>) | |||
*Cp*Cr(CO)<sub>3</sub> (17 e<sup>−</sup>) | |||
*Pt(P<sup>t</sup>Bu<sub>3</sub>)<sub>2</sub> (14 e<sup>−</sup>) | |||
*Co(नॉरबोर्निल)<sub>4</sub> (13 e<sup>−</sup>) | |||
*[FeCp<sub>2</sub>]<sup>+</sup> (17 e<sup>−</sup>) | |||
कभी-कभी ऐसे परिसर भारी लिगैंड के हाइड्रोकार्बन ढांचे के साथ [[ एगोस्टिक इंटरैक्शन |एगोस्टिक इंटरैक्शन]] में संलग्न होते हैं। उदाहरण के लिए: | |||
* W(CO)<sub>3</sub>[P(C<sub>6</sub>H<sub>11</sub>)<sub>3</sub>]<sub>2</sub> में 16 e<sup>−</sup> है लेकिन एक C-H बंधन और W केंद्र के बीच एक छोटा बंधन संपर्क है। | |||
*[[ साइक्लोपेंटैडीन |साइक्लोपेंटैडीन]] Cp(PMe<sub>3</sub>)V(CHCMe<sub>3</sub>) (14 e<sup>−</sup>, प्रतिचुंबकीय) में 'एल्काइलिडीन-H' के साथ एक छोटा V–H बंध होता है, इसलिए यौगिक का विवरण Cp(PMe<sub>3</sub>)V(CHCMe<sub>3</sub>) and Cp(PMe<sub>3</sub>)V(H)(CCMe<sub>3</sub>) के बीच कहीं होता है। | |||
=== उच्च घर्णन परिसर === | |||
उच्च घर्णन धातु के परिसर स्वयं से ही कक्षक पर अधिकार स्थापित कर लेते हैं और उनके पास कोई रिक्त कक्षा नहीं होती है जिसमें लिगैंड इलेक्ट्रॉन घनत्व दान कर सकें। सामान्यतः ऐसे परिसर में कोई -अम्लीय लिगैंड नहीं होते हैं। ये स्वयं से अधिकार स्थापित कर कक्षक के रेडिकल लिगैंड्स (जैसे, [[ ऑक्सीजन ]]) पर स्वयं से अधिकार स्थापित कर ऑर्बिटल्स के साथ संयोजन कर लेते हैं, या लिगैंड फील्ड के नियम के अतिरिक्त इलेक्ट्रॉन-युग्मन का कारण बनते हैं, इस प्रकार एक खाली कक्षक बन जाता है जिसमें यह दान कर सकता है। | |||
उदाहरण: | उदाहरण: | ||
* CrCl<sub>3</sub>(THF)<sub>3</sub> (15 e<sup>−</sup>) | |||
* [Mn(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> (17 e<sup>−</sup>) | |||
* | *[Cu(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> (21 e<sup>−</sup>, नीचे टिप्पणियाँ देखें) | ||
*[ | दृढ़ता से -दान करने वाले लिगैंड वाले परिसर सामान्यतः 18-इलेक्ट्रॉन के नियम का उल्लंघन करते हैं। इन लिगैंड्स में [[ फ्लोराइड | फ्लोराइड]] (F<sup>−</sup>), [[ संक्रमण धातु ऑक्सो कॉम्प्लेक्स | संक्रमण धातु ऑक्सो परिसर]] (O)<sup>2−</sup>, [[ संक्रमण धातु नाइट्रिडो कॉम्प्लेक्स | संक्रमण धातु नाइट्रिडो परिसर]] (N)<sup>3−</sup>, [[ एल्कोक्साइड | एल्कोक्साइड]] (RO)<sup>−</sup>, और [[ संक्रमण धातु इमिडो कॉम्प्लेक्स | संक्रमण धातु इमिडो परिसर]] (RN)<sup>2−</sup> सम्मिलित हैं। उदाहरण के लिए | ||
*[ | |||
दृढ़ता से -दान करने वाले लिगैंड वाले परिसर | * [CrO<sub>4</sub>]<sup>2−</sup> (16 e<sup>−</sup>) | ||
*[CrO<sub>4</sub>]<sup>2−</sup> (16 | * Mo(=NR)<sub>2</sub>Cl<sub>2</sub> (12 e<sup>−</sup>) | ||
* | |||
बाद | बाद की स्थिति में, Mo को नाइट्रोजन के लिए अकेले जोड़े का पर्याप्त दान है (इसलिए यौगिक को 16 ई के रूप में भी वर्णित किया जा सकता है)<sup>-</sup> यौगिक)। इसे Mo-N बॉन्ड की छोटी लंबाई और Mo-N-C(R) कोण से देखा जा सकता है, जो लगभग 180° है। उदाहरण: | ||
*ट्रांस (''trans)''-WO<sub>2</sub>(Me<sub>2</sub>PCH<sub>2</sub>CH<sub>2</sub>PMe<sub>2</sub>)<sub>2</sub> (18 e<sup>−</sup>) | |||
*ट्रांस-WO<sub>2</sub>( | *Cp*ReO<sub>3</sub> (18 e<sup>−</sup>) | ||
* | इन स्थिति में, एम = ओ बॉन्ड "शुद्ध" डबल बॉन्ड हैं (अर्ताथ, धातु को ऑक्सीजन के अकेले जोड़े का कोई दान नहीं), जैसा कि अपेक्षाकृत लंबे बंधन की दूरी में परिलक्षित होता है। | ||
इन | |||
===π-दान करने वाले लिगेंड्स === | ===π-दान करने वाले लिगेंड्स === | ||
लिगैंड्स जहां समन्वयक परमाणु गैर-बंधन वाले अकेले जोड़े को सहन करते हैं, | लिगैंड्स जहां समन्वयक परमाणु गैर-बंधन वाले अकेले जोड़े को सहन करते हैं, सामान्यतः असंतृप्त सम्मिश्रण को स्थिर करते हैं। धातु एमाइड और एल्कोक्साइड सामान्यतः 18e नियम का उल्लंघन करते हैं | ||
=== प्रभावों का संयोजन === | === प्रभावों का संयोजन === | ||
उपरोक्त कारक कभी-कभी गठबंधन कर सकते हैं। उदाहरणों | उपरोक्त कारक कभी-कभी गठबंधन कर सकते हैं। उदाहरणों के लिए | ||
* Cp*VOCl<sub>2</sub> (14 e<sup>−</sup>) | |||
* TiCl<sub>4</sub> (8 e<sup>−</sup>) | |||
* | |||
* | |||
* | |||
=== उच्च इलेक्ट्रॉन की संख्या === | |||
कुछ संकुलों में 18 से अधिक इलेक्ट्रॉन होते हैं। उदाहरणतयः | |||
* [[ कोबाल्टोसिन ]] (19 e<sup>−</sup>) | |||
* [[ निकेलोसीन ]] (20 e<sup>−</sup>) | |||
* हेक्साएक्वाकॉपर (द्वितीय) आयन [Cu(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> (21 e<sup>−</sup>) | |||
*''TM''(CO)<sub>8</sub><sup>−</sup> (''TM'' = Sc, Y, La) (20 e<sup>−</sup>) | |||
सामान्यतः, ऐसे मामले जहां परिसर में 18 से अधिक वैलेंस इलेक्ट्रॉन होते हैं, इलेक्ट्रोस्टैटिक बलों के लिए जिम्मेदार होते हैं - धातु अपने धनात्मक आवेश को संतुलित करने का प्रयास करने के लिए लिगैंड्स को अपनी ओर आकर्षित करती है, और इसके साथ समाप्त होने वाले इलेक्ट्रॉनों की संख्या महत्वहीन है। मेटालोसीन के मामले में, साइक्लोपेंटैडिएनिल लिगैंड की [[ केलेशन |केलेशन]] प्रकृति धातु के साथ अपने बंधन को स्थिर करती है। निम्नलिखित दो अवलोकन कुछ हद तक संतोषजनक हैं: कोबाल्टोसिन एक मजबूत इलेक्ट्रॉन दाता है, जो आसानी से 18-इलेक्ट्रॉन कोबाल्टोसेनियम केशन का निर्माण करता है; और निकेलोसिन 18-इलेक्ट्रॉन परिसर देने के लिए सबस्ट्रेट्स के साथ प्रतिक्रिया करता है, उदाहरण के रूप में CpNiCl(PR<sub>3</sub>) और मुक्त CpH। | |||
निकलोसीन की स्थिति में, दो अतिरिक्त इलेक्ट्रॉन की कक्षा में कमजोर रूप से धातु-कार्बन प्रतिरक्षी होते हैं; यही कारण है कि यह सामान्यतः प्रतिक्रियाओं में भाग लेता है जहां M–C बंध टूट जाते हैं और धातु की इलेक्ट्रॉन संख्या 18 में बदल जाती है।<ref>{{cite book | last1 = Girolami | first1 = Gregory | last2 = Rauchfuss | first2 = Thomas | last3 = Angelici | first3 = Robert | title = अकार्बनिक रसायन विज्ञान में संश्लेषण और तकनीक| chapter = Experiment 20 | publisher = University Science Books | location = Sausalito, California | year = 1999 | isbn = 978-0-935702-48-4 }}</ref> | |||
20-इलेक्ट्रॉन सिस्टम TM(CO)<sub>8</sub><sup>−</sup> (TM = Sc, Y, La) में एक क्यूबिक (''O''<sub>h</sub>) संतुलन ज्यामिति और एक सिंगलेट (<sup>1</sup>A<sub>1g</sub>) इलेक्ट्रॉनिक ग्राउंड स्टेट होता है। a<sub>2u</sub> समरूपता के साथ एक अधिकृत संयोजकता MO है, जो धातु AOs के योगदान के बिना केवल लिगैंड ऑर्बिटल्स द्वारा बनता है। लेकिन जोड़ TM(CO)<sub>8</sub><sup>−</sup> (TM=Sc, Y, La) 18-इलेक्ट्रॉन नियम को पूरा करते हैं जब कोई केवल उन संयोजी इलेक्ट्रॉनों पर विचार करता है, जो धातु-लिगैंड बॉन्डिंग ऑर्बिटल्स पर कब्जा कर लेते हैं।<ref>{{Cite journal|last1=Jin|first1=Jiaye|last2=Yang|first2=Tao|last3=Xin|first3=Ke|last4=Wang|first4=Guanjun|last5=Jin|first5=Xiaoyang|last6=Zhou|first6=Mingfei|last7=Frenking|first7=Gernot|date=2018-04-25|title=समूह तीन संक्रमण धातुओं [टीएम (सीओ) 8] - (टीएम = एससी, वाई, ला) और 18-इलेक्ट्रॉन नियम के ऑक्टाकार्बोनिल आयन कॉम्प्लेक्स|journal=Angewandte Chemie International Edition|language=en|volume=57|issue=21|pages=6236–6241|doi=10.1002/anie.201802590|pmid=29578636|issn=1433-7851}}</ref> | |||
==यह भी देखें== | ==यह भी देखें== | ||
* {{annotated link| | * {{annotated link|इलेक्ट्रॉन गिनती}} | ||
* {{annotated link| | * {{annotated link|लिगैंड क्षेत्र सिद्धांत}} | ||
* {{annotated link| | * {{annotated link|डी इलेक्ट्रॉन गिनती}} | ||
* {{annotated link| | * {{annotated link|टॉलमैन का नियम}} | ||
==संदर्भ== | ==संदर्भ== | ||
{{Reflist}} | {{Reflist}} | ||
==अग्रिम पठन== | ==अग्रिम पठन== | ||
* {{cite journal | author-link = Chadwick A. Tolman | last1 = Tolman | first1 = C. A. | doi = 10.1039/CS9720100337 | title = The 16 and 18 electron rule in organometallic chemistry and homogeneous catalysis | year = 1972 | pages = 337 | issue = 3 | volume = 1 | journal = [[Chem. Soc. Rev.]]}} | * {{cite journal | author-link = Chadwick A. Tolman | last1 = Tolman | first1 = C. A. | doi = 10.1039/CS9720100337 | title = The 16 and 18 electron rule in organometallic chemistry and homogeneous catalysis | year = 1972 | pages = 337 | issue = 3 | volume = 1 | journal = [[Chem. Soc. Rev.]]}} | ||
| Line 152: | Line 136: | ||
{{organometallics}} | {{organometallics}} | ||
{{Electron configuration navbox}} | {{Electron configuration navbox}} | ||
[[Category: | [[Category:Articles with short description]] | ||
[[Category:CS1]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Created On 17/10/2022]] | [[Category:Created On 17/10/2022]] | ||
[[Category:Machine Translated Page]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:अंगूठे के नियम]] | |||
[[Category:अकार्बनिक रसायन]] | |||
[[Category:रासायनिक बंधन]] | |||
Latest revision as of 09:42, 20 November 2022
18-इलेक्ट्रॉन अनुभवसिद्ध रीति या नियम एक रासायनिक नियम है जो मुख्य रूप से स्थिर संक्रमण धातु सम्मिश्रण के लिए विशेष रूप से ऑर्गोमेटेलिक यौगिक जैसे सूत्रों की भविष्यवाणी और युक्तिसंगत बनाने के लिए उपयोग किया जाता है,[1] यह नियम ऐसे तथ्यों पर आधारित होता है जिनमें संक्रमण धातुओं के इलेक्ट्रॉन विन्यास में संयोजकता कक्ष होते हैं जिसमें पाँच (n−1)d कक्षक, एक ns कक्षक और तीन np कक्षक होते हैं, जहां एन मुख्य क्वांटम संख्या है। ये ऑर्बिटल्स सामूहिक रूप से 18 इलेक्ट्रॉनों को या तो बंधन या गैर-बंधन इलेक्ट्रॉन के जोड़ों के रूप में समायोजित कर सकता हैं। इसका अर्थ हैं कि इन नौ परमाणुओं के कक्षक के लिगैंड कक्षकों के संयोजन से नौ परमाणु कक्षक बनते हैं जो या तो धातु-लिगैंड बंधन या गैर-बंधन होते हैं। जब एक धातु परिसर में 18 संयोजी इलेक्ट्रॉन होते हैं, तब ऐसी स्थिति में निर्वात गैस के समान इलेक्ट्रॉन विन्यास प्राप्त होता है। यह नियम उन धातुओं के सम्मिश्रण के लिए सहायक नहीं होता है जो संक्रमण धातु की श्रेणी में नहीं होती हैं, और उपयोगी संक्रमण धातु परिसर के नियम के विरूद्ध कार्य करने लगती है क्योंकि इस नियम से विचलित होने वाले परिणाम इसकी प्रतिक्रियाशीलता पर पड़ते हैं। यह नियम पहली बार 1921 में अमेरिकी रसायनज्ञ इरविंग लैंगमुइर द्वारा प्रस्तावित किया गया था।[1][2]
उपयुक्तता
यह नियम मुख्य रूप से घूर्णन स्थिति (जैसे डी इलेक्ट्रॉन की घूर्णन स्थिति) के लिए सूत्रों की भविष्यवाणी करता है, जैसे सीआर, एमएन, एफई, और सह ट्रायड्स के निम्न घूर्णन परिसर। अन्य प्रसिद्ध उदाहरणों में फेरोसीन , आयरन पेंटाकार्बोनिल , क्रोमियम कार्बोनिल और निकल कार्बोनिल सम्मिलित है।
एक परिसर में लिगैंड्स 18-इलेक्ट्रॉन नियम की प्रयोज्यता को निर्धारित करता हैं। सामान्यतः इस नियम का पालन करने वाले परिसर कम से कम आंशिक रूप से π-स्वीकर्ता लिगेंड्स से बने होते हैं (इसे -एसिड के रूप में भी जाना जाता है)। इस प्रकार का लिगैंड एक बहुत मजबूत लिगैंड क्षेत्र बनाता है, जो परिणामी आणविक कक्षा की ऊर्जा को कम करता है जिससे वह अनुकूल रूप से अपना अधिकार स्थापित कर सकें। विशिष्ट लिगेंड में ओलेफिन , फॉस्फीन लिगैंड और कार्बोनिल सम्मिलित हैं। अम्लीय सम्मिश्रण में सामान्यतः कम-ऑक्सीकरण अवस्था में धातुओं की विशेषता होती हैं। ऑक्सीकरण अवस्था और लिगेंड की प्रकृति के बीच संबंध को बैकबॉन्डिंग के प्रारूप के भीतर युक्तिसंगत करके बनाया गया है।
प्रतिक्रियाशीलता के परिणाम
18-इलेक्ट्रॉन नियम का पालन करने वाले यौगिक सामान्यतः निष्क्रिय होते हैं। उदाहरणों में [Co(NH3)6]Cl3, Mo(CO)6, and [Fe(CN)6]4− सम्मिलित हैं। ऐसी स्थिति में, सामान्य रूप से लिगैंड का स्थानांतरण विघटनकारी प्रतिस्थापन तंत्र के माध्यम से होता है, जिसमें प्रतिक्रिया की दर एक लिगैंड के पृथक्करण की दर से निर्धारित होती है। दूसरी ओर, 18-इलेक्ट्रॉन यौगिक प्रोटॉन जैसे इलेक्ट्रोफाइल के प्रति अत्यधिक प्रतिक्रियाशील हो सकते हैं, और ऐसी प्रतिक्रियाएं इस प्रणाली में सहयोगी होती हैं, इस प्रकार अम्ल व क्षार प्रतिक्रियाएं होती हैं।
18 से कम संयोजकता के इलेक्ट्रॉन वाले परिसर बढ़ी हुई प्रतिक्रियाशीलता दिखाते हैं। इस प्रकार, 18-इलेक्ट्रॉन नियम साधारणतयः स्टोइकोमेट्रिक या कटैलिसीस के अर्थ के लिए गैर-प्रतिक्रिया रूपी एक विधि है।
डुओडेक्टेट नियम
कम्प्यूटरीकृत निष्कर्ष के अनुसार धातु पर संयोजकता पी-कक्षीय धातु-लिगैंड बंधन में भाग लेते हैं, चूंकि यह एक कमजोर कड़ी हैं।[3] इसी प्रकार वेनहोल्ड और लैंडिस प्राकृतिक बंधन की कक्षा के संदर्भ में धातु-लिगैंड बन्धन में धातु पी-कक्षा की गणना नहीं करते हैं,[4] चूंकि ये कक्षाएं अभी भी आधारित सेट(रसायन विज्ञान) के रूप में सम्मिलित होता हैं। जिसके परिणामस्वरूप पांच डी-कक्षीय और एक एस-कक्षा के लिए डुओडेक्टेट नियम(12-इलेक्ट्रॉन नियम) होता है।
सामान्य रसायन विज्ञान में वर्तमान समय में सर्वसम्मति यह है कि मुख्य समूह तत्वों के लिए अष्ट नियम के विपरीत, संक्रमण धातुएं 12-इलेक्ट्रॉन या 18-इलेक्ट्रॉन नियम का कठिनाई से पालन नहीं करती हैं, लेकिन यह नियम ऊपरी और निचली दोनों सीमाओं को क्रमशः इलेक्ट्रॉन गणना के लिए संतुलित करता हैं।[5][6] इस प्रकार, जब डी-कक्षीय और एस-कक्षीय संक्रमण धातुओं में बंधन आसानी से होता है, तब इस बंधन में उच्च ऊर्जा और अधिक स्थानिक रूप से फैलाने वाले पी-कक्षा की भागेदारी केंद्रीय परमाणु और समन्वय वातावरण पर निर्भर करती है।[7][8]
अपवाद
π-दाता या σ-दाता धातु ऑर्बिटल्स के साथ परस्पर कम प्रतिक्रिया करके लिगैंड क्षेत्र सिद्धांत के कारण कमजोर लिगैंड क्षेत्र की ओर ले जाते हैं जो t2g कक्षकों की ऊर्जा को बढ़ाता है ये आणविक ऑर्बिटल्स नॉन-बॉन्डिंग या कमजोर रूप से गैर-बंधन कक्षीय (छोटे Δoct) बन जाते हैं। इसलिए, इलेक्ट्रॉन को जोड़ने या हटाने से जटिल स्थिरता पर बहुत कम प्रभाव पड़ता है। ऐसी स्थिति में, डी-इलेक्ट्रॉनों की संख्याओं पर कोई प्रतिबंध नहीं होता हैं और 12-22 इलेक्ट्रॉनों वाले परिसर संभव हो जाते हैं। मान में कम Δoct के द्वारा इसे भरना संभव बन जाता है जैसे (>18 e−) के लिए और इसी प्रकार π-दाता लिगेंड्स t2g प्रतिरक्षी (<18 e−) बना सकते हैं। इस प्रकार के लिगैंड स्पेक्ट्रोकेमिकल श्रृंखला निम्न-से-मध्य भाग में स्थित होती हैं। उदाहरण के लिए: [TiF6]2− (Ti(IV), d0, 12 e−), [Co(NH3)6]3+ (Co(III), d6, 18 e−), [Cu(OH2)6]2+ (Cu(II), d9, 21 e−)।
धातु आयनों के संदर्भ में, oct एक समूह के साथ-साथ बढ़ती ऑक्सीकरण संख्या के साथ बढ़ता है। मजबूत लिगैंड फ़ील्ड निम्न-स्पिन सम्मिश्रण की ओर ले जाते हैं जो 18-इलेक्ट्रॉन नियम के कुछ अपवादों का कारण बनता है।
16-इलेक्ट्रॉन परिसर
सम्मिश्रण का एक महत्वपूर्ण वर्ग जो 18e नियम का उल्लंघन करते हैं, वे धातु d8 संरूपण वाले 16-इलेक्ट्रॉन परिसर हैं।सभी हाई-स्पिन d8 धातु आयन ऑक्टाहेड्रल (या टेट्राहेड्रल आणविक ज्यामिति) हैं लेकिन लो-स्पिन d8 धातु के आयन सभी वर्गाकार समतलीय हैं। वर्गाकार समतलीय लो-स्पिन d8 के महत्वपूर्ण उदाहरण धातु आयन Rh(I), Ir(I), Ni(II), Pd(II), और Pt(II) हैं। नीचे दिए गए चित्र में निम्न-स्पिन वर्ग-प्लानर सम्मिश्रण में d8 उपकोश का विभाजन दिखाया गया है। उदाहरण के रूप में विशेष रूप से कोबाल्ट और निकल ट्रायड्स के डेरिवेटिव के लिए प्रचलित हैं। इस तरह के यौगिक साधारण रूप से वर्ग समतलीय होते हैं। सबसे प्रसिद्ध उदाहरण वास्का का परिसर ((IrCl(CO)(PPh3)2), [PtCl4]2− और ज़ीज़ नमक अर्ताथ [PtCl3(η2-C2H4)]− है।
ऐसे सम्मिश्रण में, डीz2 कक्षीय दोगुना व्यस्त और गैर-बंधन है।
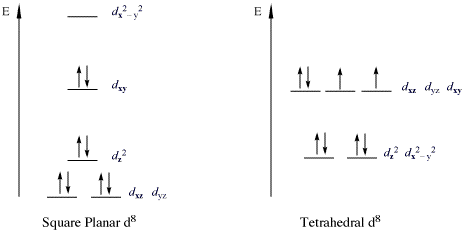
- कई उत्प्रेरक चक्र सम्मिश्रण के माध्यम से संचालित होते हैं जो 18-इलेक्ट्रॉन और स्क्वायर-प्लानर 16-इलेक्ट्रॉन कॉन्फ़िगरेशन के बीच वैकल्पिक होते हैं। उदाहरणों में मोनसेंटो एसिटिक एसिड संश्लेषण , हाइड्रोजनीकरण , हाइड्रोफॉर्माइलेशन , ओलेफिन आइसोमेरिज़ेशन और कुछ एल्केन पोलीमराइज़ेशन शामिल हैं।
अन्य उल्लंघनों को धातु केंद्र पर लिगेंड के प्रकार के अनुसार वर्गीकृत किया जा सकता है।
भारी लिगेंड
भारी लिगैंड्स लिगैंड्स के पूर्ण पूरक के दृष्टिकोण को रोक सकते हैं जो धातु को 18 इलेक्ट्रॉन विन्यास प्राप्त करने की अनुमति देगा। उदाहरण:
- Ti(नियोपेंटाइल)4 (8 e−)
- पेंटामेथिलसाइक्लोपेंटाडीन Cp*2Ti(C2H4) (16 e−)
- वैनेडियम हेक्साकार्बोनिल V(CO)6 (17 e−)
- Cp*Cr(CO)3 (17 e−)
- Pt(PtBu3)2 (14 e−)
- Co(नॉरबोर्निल)4 (13 e−)
- [FeCp2]+ (17 e−)
कभी-कभी ऐसे परिसर भारी लिगैंड के हाइड्रोकार्बन ढांचे के साथ एगोस्टिक इंटरैक्शन में संलग्न होते हैं। उदाहरण के लिए:
- W(CO)3[P(C6H11)3]2 में 16 e− है लेकिन एक C-H बंधन और W केंद्र के बीच एक छोटा बंधन संपर्क है।
- साइक्लोपेंटैडीन Cp(PMe3)V(CHCMe3) (14 e−, प्रतिचुंबकीय) में 'एल्काइलिडीन-H' के साथ एक छोटा V–H बंध होता है, इसलिए यौगिक का विवरण Cp(PMe3)V(CHCMe3) and Cp(PMe3)V(H)(CCMe3) के बीच कहीं होता है।
उच्च घर्णन परिसर
उच्च घर्णन धातु के परिसर स्वयं से ही कक्षक पर अधिकार स्थापित कर लेते हैं और उनके पास कोई रिक्त कक्षा नहीं होती है जिसमें लिगैंड इलेक्ट्रॉन घनत्व दान कर सकें। सामान्यतः ऐसे परिसर में कोई -अम्लीय लिगैंड नहीं होते हैं। ये स्वयं से अधिकार स्थापित कर कक्षक के रेडिकल लिगैंड्स (जैसे, ऑक्सीजन ) पर स्वयं से अधिकार स्थापित कर ऑर्बिटल्स के साथ संयोजन कर लेते हैं, या लिगैंड फील्ड के नियम के अतिरिक्त इलेक्ट्रॉन-युग्मन का कारण बनते हैं, इस प्रकार एक खाली कक्षक बन जाता है जिसमें यह दान कर सकता है।
उदाहरण:
- CrCl3(THF)3 (15 e−)
- [Mn(H2O)6]2+ (17 e−)
- [Cu(H2O)6]2+ (21 e−, नीचे टिप्पणियाँ देखें)
दृढ़ता से -दान करने वाले लिगैंड वाले परिसर सामान्यतः 18-इलेक्ट्रॉन के नियम का उल्लंघन करते हैं। इन लिगैंड्स में फ्लोराइड (F−), संक्रमण धातु ऑक्सो परिसर (O)2−, संक्रमण धातु नाइट्रिडो परिसर (N)3−, एल्कोक्साइड (RO)−, और संक्रमण धातु इमिडो परिसर (RN)2− सम्मिलित हैं। उदाहरण के लिए
- [CrO4]2− (16 e−)
- Mo(=NR)2Cl2 (12 e−)
बाद की स्थिति में, Mo को नाइट्रोजन के लिए अकेले जोड़े का पर्याप्त दान है (इसलिए यौगिक को 16 ई के रूप में भी वर्णित किया जा सकता है)- यौगिक)। इसे Mo-N बॉन्ड की छोटी लंबाई और Mo-N-C(R) कोण से देखा जा सकता है, जो लगभग 180° है। उदाहरण:
- ट्रांस (trans)-WO2(Me2PCH2CH2PMe2)2 (18 e−)
- Cp*ReO3 (18 e−)
इन स्थिति में, एम = ओ बॉन्ड "शुद्ध" डबल बॉन्ड हैं (अर्ताथ, धातु को ऑक्सीजन के अकेले जोड़े का कोई दान नहीं), जैसा कि अपेक्षाकृत लंबे बंधन की दूरी में परिलक्षित होता है।
π-दान करने वाले लिगेंड्स
लिगैंड्स जहां समन्वयक परमाणु गैर-बंधन वाले अकेले जोड़े को सहन करते हैं, सामान्यतः असंतृप्त सम्मिश्रण को स्थिर करते हैं। धातु एमाइड और एल्कोक्साइड सामान्यतः 18e नियम का उल्लंघन करते हैं
प्रभावों का संयोजन
उपरोक्त कारक कभी-कभी गठबंधन कर सकते हैं। उदाहरणों के लिए
- Cp*VOCl2 (14 e−)
- TiCl4 (8 e−)
उच्च इलेक्ट्रॉन की संख्या
कुछ संकुलों में 18 से अधिक इलेक्ट्रॉन होते हैं। उदाहरणतयः
- कोबाल्टोसिन (19 e−)
- निकेलोसीन (20 e−)
- हेक्साएक्वाकॉपर (द्वितीय) आयन [Cu(H2O)6]2+ (21 e−)
- TM(CO)8− (TM = Sc, Y, La) (20 e−)
सामान्यतः, ऐसे मामले जहां परिसर में 18 से अधिक वैलेंस इलेक्ट्रॉन होते हैं, इलेक्ट्रोस्टैटिक बलों के लिए जिम्मेदार होते हैं - धातु अपने धनात्मक आवेश को संतुलित करने का प्रयास करने के लिए लिगैंड्स को अपनी ओर आकर्षित करती है, और इसके साथ समाप्त होने वाले इलेक्ट्रॉनों की संख्या महत्वहीन है। मेटालोसीन के मामले में, साइक्लोपेंटैडिएनिल लिगैंड की केलेशन प्रकृति धातु के साथ अपने बंधन को स्थिर करती है। निम्नलिखित दो अवलोकन कुछ हद तक संतोषजनक हैं: कोबाल्टोसिन एक मजबूत इलेक्ट्रॉन दाता है, जो आसानी से 18-इलेक्ट्रॉन कोबाल्टोसेनियम केशन का निर्माण करता है; और निकेलोसिन 18-इलेक्ट्रॉन परिसर देने के लिए सबस्ट्रेट्स के साथ प्रतिक्रिया करता है, उदाहरण के रूप में CpNiCl(PR3) और मुक्त CpH।
निकलोसीन की स्थिति में, दो अतिरिक्त इलेक्ट्रॉन की कक्षा में कमजोर रूप से धातु-कार्बन प्रतिरक्षी होते हैं; यही कारण है कि यह सामान्यतः प्रतिक्रियाओं में भाग लेता है जहां M–C बंध टूट जाते हैं और धातु की इलेक्ट्रॉन संख्या 18 में बदल जाती है।[9]
20-इलेक्ट्रॉन सिस्टम TM(CO)8− (TM = Sc, Y, La) में एक क्यूबिक (Oh) संतुलन ज्यामिति और एक सिंगलेट (1A1g) इलेक्ट्रॉनिक ग्राउंड स्टेट होता है। a2u समरूपता के साथ एक अधिकृत संयोजकता MO है, जो धातु AOs के योगदान के बिना केवल लिगैंड ऑर्बिटल्स द्वारा बनता है। लेकिन जोड़ TM(CO)8− (TM=Sc, Y, La) 18-इलेक्ट्रॉन नियम को पूरा करते हैं जब कोई केवल उन संयोजी इलेक्ट्रॉनों पर विचार करता है, जो धातु-लिगैंड बॉन्डिंग ऑर्बिटल्स पर कब्जा कर लेते हैं।[10]
यह भी देखें
- इलेक्ट्रॉन गिनती
- लिगैंड क्षेत्र सिद्धांत
- डी इलेक्ट्रॉन गिनती – Description of the electron configuration
- टॉलमैन का नियम
संदर्भ
- ↑ 1.0 1.1 Langmuir, I. (1921). "वैलेंस के प्रकार". Science. 54 (1386): 59–67. Bibcode:1921Sci....54...59L. doi:10.1126/science.54.1386.59. PMID 17843674.
- ↑ Jensen, William B. (2005). "18-इलेक्ट्रॉन नियम की उत्पत्ति". J. Chem. Educ. 82 (1): 28. Bibcode:2005JChEd..82...28J. doi:10.1021/ed082p28.
- ↑ Frenking, Gernot; Shaik, Sason, eds. (May 2014). "Chapter 7: Chemical bonding in Transition Metal Compounds". रासायनिक बंधन: आवर्त सारणी के पार रासायनिक बंधन. Wiley-VCH. ISBN 978-3-527-33315-8.
- ↑ Landis, C. R.; Weinhold, F. (2007). "मुख्य समूह और संक्रमण धातु बंधन में वैलेंस और अतिरिक्त-वैलेंस ऑर्बिटल्स". J. Comput. Chem. 28 (1): 198–203. doi:10.1002/jcc.20492. PMID 17063478.
- ↑ Frenking, Gernot; Fröhlich, Nikolaus (2000). "संक्रमण-धातु यौगिकों में बंधन की प्रकृति". Chem. Rev. 100 (2): 717–774. doi:10.1021/cr980401l. PMID 11749249.
- ↑ Zhao, Lili; Holzmann, Nicole; Schwerdtfeger, Peter; Frenking, Gernot (2019). "मुख्य-समूह यौगिकों के रासायनिक बंधन और बंधन मॉडल". Chem. Rev. 119 (14): 8781–8845. doi:10.1021/acs.chemrev.8b00722. PMID 31251603. S2CID 195761899.
- ↑ Bayse, Craig; Hall, Michael (1999). "समरूपता विश्लेषण द्वारा सरल संक्रमण धातु पॉलीहाइड्राइड परिसरों की ज्यामिति की भविष्यवाणी". J. Am. Chem. Soc. 121 (6): 1348–1358. doi:10.1021/ja981965+.
- ↑ King, R.B. (2000). "होमोलेप्टिक संक्रमण धातु हाइड्राइड आयनों में संरचना और बंधन". Coordination Chemistry Reviews. 200–202: 813–829. doi:10.1016/S0010-8545(00)00263-0.
- ↑ Girolami, Gregory; Rauchfuss, Thomas; Angelici, Robert (1999). "Experiment 20". अकार्बनिक रसायन विज्ञान में संश्लेषण और तकनीक. Sausalito, California: University Science Books. ISBN 978-0-935702-48-4.
- ↑ Jin, Jiaye; Yang, Tao; Xin, Ke; Wang, Guanjun; Jin, Xiaoyang; Zhou, Mingfei; Frenking, Gernot (2018-04-25). "समूह तीन संक्रमण धातुओं [टीएम (सीओ) 8] - (टीएम = एससी, वाई, ला) और 18-इलेक्ट्रॉन नियम के ऑक्टाकार्बोनिल आयन कॉम्प्लेक्स". Angewandte Chemie International Edition (in English). 57 (21): 6236–6241. doi:10.1002/anie.201802590. ISSN 1433-7851. PMID 29578636.
अग्रिम पठन
- Tolman, C. A. (1972). "The 16 and 18 electron rule in organometallic chemistry and homogeneous catalysis". Chem. Soc. Rev. 1 (3): 337. doi:10.1039/CS9720100337.