कैल्सियम सल्फेट: Difference between revisions
mNo edit summary |
No edit summary |
||
| (5 intermediate revisions by 4 users not shown) | |||
| Line 91: | Line 91: | ||
}} | }} | ||
}} | }} | ||
'''कैल्सियम सल्फेट''' एक अकार्बनिक यौगिक है जिसका सूत्र संबंधित [[हाइड्रेट]] के साथ CaSO<sub>4</sub> है। γ-[[anhydrite|एनहाइड्राइट]]([[निर्जल]]) | '''कैल्सियम सल्फेट''' एक अकार्बनिक यौगिक है जिसका सूत्र संबंधित [[हाइड्रेट]] के साथ CaSO<sub>4</sub> है। γ-[[anhydrite|एनहाइड्राइट]]([[निर्जल]]), यह एक जल अवशोषक के रूप में प्रयोग किया जाता है। एक विशिष्ट हाइड्रेट को [[प्लास्टर ऑफ पेरिस]] के रूप में जाना जाता है, और दूसरे का प्राकृतिक रूप [[जिप्सम]] के रूप में होता है [[जिप्सम]] एक खनिज है। उद्योगों में इसके अनेक उपयोग हैं। यह सफेद रंग के ठोस पदार्थ होते हैं जो जल में कम घुलनशील होते हैं।<ref name="Ullmanns">Franz Wirsching "Calcium Sulfate" in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim. {{doi|10.1002/14356007.a04_555}}</ref> कैल्सियम सल्फेट जल में [[स्थायी कठोरता]] उत्पन्न करता है। | ||
== जलयोजन अवस्थाएँ और क्रिस्टलोग्राफिक संरचनाएं == | == जलयोजन अवस्थाएँ और क्रिस्टलोग्राफिक संरचनाएं == | ||
| Line 101: | Line 101: | ||
== उपयोग == | == उपयोग == | ||
{{See also|जिप्सम और उपयोग}} | {{See also|जिप्सम और उपयोग}} | ||
कैल्सियम सल्फेट का मुख्य उपयोग [[प्लास्टर]] ऑफ पेरिस और महीन चूना का उत्पादन करना है। ये अनुप्रयोग इस तथ्य का फायदा उठाते हैं कि कैल्सियम सल्फेट जिसे चूर्णित और कैलक्लाइंड किया गया है, जलयोजन करने पर एक ढाला हुआ पेस्ट बनाता है और क्रिस्टलीय कैल्सियम सल्फेट डाइहाइड्रेट के रूप में कठोर | कैल्सियम सल्फेट का मुख्य उपयोग [[प्लास्टर]] ऑफ पेरिस और महीन चूना का उत्पादन करना है। ये अनुप्रयोग इस तथ्य का फायदा उठाते हैं कि कैल्सियम सल्फेट जिसे चूर्णित और कैलक्लाइंड किया गया है, जलयोजन करने पर एक ढाला हुआ पेस्ट बनाता है और क्रिस्टलीय कैल्सियम सल्फेट डाइहाइड्रेट के रूप में कठोर हो जाता है। यह भी सुविधाजनक है कि कैल्सियम सल्फेट जल में कम घुलनशील है और जब यह जम जाता है तो दुबारा जल के संपर्क में आने पर आसानी से नहीं घुलता है। | ||
=== जलयोजन और निर्जलीकरण अभिक्रियाएँ === | === जलयोजन और निर्जलीकरण अभिक्रियाएँ === | ||
| Line 109: | Line 109: | ||
: CaSO<sub>4</sub> · 2 H<sub>2</sub>O → CaSO<sub>4</sub> · 1/2 H<sub>2</sub>O + 1+1/2 H<sub>2</sub>O↑ | : CaSO<sub>4</sub> · 2 H<sub>2</sub>O → CaSO<sub>4</sub> · 1/2 H<sub>2</sub>O + 1+1/2 H<sub>2</sub>O↑ | ||
इस अभिक्रिया के [[एन्दोठेर्मिक|ऊष्माशोषी]] गुण [[drywall|'''ड्रायवॉल''']] के प्रदर्शन के लिए प्रासंगिक है, जो आवासीय और अन्य संरचनाओं को अग्नि प्रतिरोध प्रदान करती है। आग में, ड्राईवॉल की शीट के पीछे की संरचना अपेक्षाकृत ठंडी रहेगी क्योंकि जिप्सम से जल बाहर निकल जाता है, इस प्रकार फ्रेमिंग(लकड़ी से बनी हुई वस्तुओं के दहन से या उच्च तापमान पर स्टील की | इस अभिक्रिया के [[एन्दोठेर्मिक|ऊष्माशोषी]] गुण [[drywall|'''ड्रायवॉल''']] के प्रदर्शन के लिए प्रासंगिक है, जो आवासीय और अन्य संरचनाओं को अग्नि प्रतिरोध प्रदान करती है। आग में, ड्राईवॉल की शीट के पीछे की संरचना अपेक्षाकृत ठंडी रहेगी क्योंकि जिप्सम से जल बाहर निकल जाता है, इस प्रकार फ्रेमिंग(लकड़ी से बनी हुई वस्तुओं के दहन) से या उच्च तापमान पर स्टील की मजबूती और इसके परिणामस्वरूप उसका संरचनात्मक पतन(या काफी हद तक मंदता) को रोकता है। लेकिन उच्च तापमान पर, कैल्सियम सल्फेट ऑक्सीजन छोड़ेगा और [[ऑक्सीकरण एजेंट|ऑक्सीकारक्]] के रूप में कार्य करेगा। इस गुण का उपयोग [[एल्युमिनोथर्मिक प्रतिक्रिया|एल्युमिनोथर्मिक]] में किया जाता है। अधिकांश खनिजों के विपरीत, जो पुनर्जलीकृत होने पर केवल तरल या अर्ध-तरल पेस्ट बनाते हैं, या चूर्ण बने रहते हैं इनमे एक कैलक्लाइंड जिप्सम है कैलक्लाइंड जिप्सम में एक असामान्य गुण होता है: जब सामान्य(परिवेश) तापमान पर जल के साथ मिलाया जाता है, तो यह रासायनिक रूप से पसंदीदा डाइहाइड्रेट रूप में वापस आ जाता है। कठोर और अपेक्षाकृत मजबूत जिप्सम क्रिस्टल जाली बनाने के लिए भौतिक रूप से सेटिंग करते समय निम्न अभिक्रिया देते हैं: | ||
: CaSO<sub>4</sub> · 1/2 H<sub>2</sub>O + 1+1/2 H<sub>2</sub>O → CaSO<sub>4</sub> · 2 H<sub>2</sub>O | : CaSO<sub>4</sub> · 1/2 H<sub>2</sub>O + 1+1/2 H<sub>2</sub>O → CaSO<sub>4</sub> · 2 H<sub>2</sub>O | ||
यह अभिक्रिया [[एक्ज़ोथिर्मिक|उष्माक्षेपी]] है और आसानी से जिप्सम को शीट्स(ड्राईवॉल के लिए), स्टिक्स(ब्लैकबोर्ड चॉक के लिए), और मोल्ड्स(टूटी हुई हड्डियों को स्थिर करने के लिए, या धातु की ढलाई के लिए) सहित विभिन्न आकृतियों में ढाला जा सकता है। पॉलिमर के साथ मिश्रित करके, इसका उपयोग हड्डी की मरम्मत वाली सीमेंट के रूप में किया गया है। कच्ची मिट्टी से सीधे मजबूत संरचना बनाने के लिए मिट्टी में थोड़ी मात्रा में कैलक्लाइंड जिप्सम मिलाया जाता है, जो कि [[एडोब]](जो गीला होने पर अपनी ताकत खो देता है) का एक विकल्प है। निर्जलीकरण की स्थितियों में हेमीहाइड्रेट की सरंध्रता को समायोजित करने के लिए | यह अभिक्रिया [[एक्ज़ोथिर्मिक|उष्माक्षेपी]] है और आसानी से जिप्सम को शीट्स(ड्राईवॉल के लिए), स्टिक्स(ब्लैकबोर्ड चॉक के लिए), और मोल्ड्स(टूटी हुई हड्डियों को स्थिर करने के लिए, या धातु की ढलाई के लिए) सहित विभिन्न आकृतियों में ढाला जा सकता है। पॉलिमर के साथ मिश्रित करके, इसका उपयोग हड्डी की मरम्मत वाली सीमेंट के रूप में किया गया है। कच्ची मिट्टी से सीधे मजबूत संरचना बनाने के लिए मिट्टी में थोड़ी मात्रा में कैलक्लाइंड जिप्सम मिलाया जाता है, जो कि [[एडोब]](जो गीला होने पर अपनी ताकत खो देता है) का एक विकल्प है। निर्जलीकरण की स्थितियों में हेमीहाइड्रेट की सरंध्रता को समायोजित करने के लिए परिवर्तन किया जा सकता है, जिसके परिणामस्वरूप तथाकथित α- और β-हेमीहाइड्रेट प्राप्त होते हैं(जो रासायनिक रूप से समान हैं)। | ||
180 °C (356 °F) पर गर्म करने पर, लगभग जल-मुक्त रूप, जिसे γ-एनहाइड्राइट कहा जाता है(CaSO<sub>4</sub>·''n''H<sub>2</sub>O जहाँ n = 0 से 0.05) उत्पन्न होता है। γ-एनहाइड्राइट डाइहाइड्रेट अवस्था में वापस आने के लिए जल के साथ धीरे-धीरे अभिक्रिया करता है। 250 °C से ऊपर गर्म करने पर पूरी तरह से निर्जल रूप जिसे β-एनहाइड्राइट या प्राकृतिक एनहाइड्राइट बनता है। प्राकृतिक एनहाइड्राइट जल के साथ अभिक्रिया नहीं करता है, यहां तक कि भूगर्भीय समय के पैमाने पर भी, जब तक बहुत महीन पिसा हुआ न हो जल के साथ अभिक्रिया नहीं करता है। | 180 °C (356 °F) पर गर्म करने पर, लगभग जल-मुक्त रूप, जिसे γ-एनहाइड्राइट कहा जाता है(CaSO<sub>4</sub>·''n''H<sub>2</sub>O जहाँ n = 0 से 0.05) उत्पन्न होता है। γ-एनहाइड्राइट डाइहाइड्रेट अवस्था में वापस आने के लिए जल के साथ धीरे-धीरे अभिक्रिया करता है। 250 °C से ऊपर गर्म करने पर पूरी तरह से निर्जल रूप जिसे β-एनहाइड्राइट या प्राकृतिक एनहाइड्राइट बनता है। प्राकृतिक एनहाइड्राइट जल के साथ अभिक्रिया नहीं करता है, यहां तक कि भूगर्भीय समय के पैमाने पर भी, जब तक बहुत महीन पिसा हुआ न हो जल के साथ अभिक्रिया नहीं करता है। | ||
हेमीहाइड्रेट और γ-एनहाइड्राइट की परिवर्तनीय संरचना, और उनका आसान अंतर-रूपांतरण, उनके लगभग समान क्रिस्टल संरचनाओं के कारण होता है जिसमें "चैनल" होते हैं जो जल की परिवर्तनीय मात्रा, | हेमीहाइड्रेट और γ-एनहाइड्राइट की परिवर्तनीय संरचना, और उनका आसान अंतर-रूपांतरण, उनके लगभग समान क्रिस्टल संरचनाओं के कारण होता है जिसमें "चैनल" होते हैं जो जल की परिवर्तनीय मात्रा, या मेथनॉल जैसे अन्य छोटे अणुओं को समायोजित कर सकते हैं। | ||
===खाद्य उद्योग=== | ===खाद्य उद्योग=== | ||
| Line 173: | Line 173: | ||
जल में कैल्सियम सल्फेट के विभिन्न क्रिस्टलीय चरणों का विघटन उष्माक्षेपी अभिक्रिया है और इसमें ऊष्मा ([[तापीय धारिता|एन्थैल्पी]] में कमी: ΔH <0) उत्पन्न होती है। तत्काल परिणाम के रूप में, आगे बढ़ने के लिए, विघटन अभिक्रिया को ऊष्मा को निकालने की जरूरत है जिसे अभिक्रिया के उत्पाद के रूप में माना जा सकता है। यदि सिस्टम ठंडा हो जाता है, विघटन साम्यावस्था [[ले चेटेलियर सिद्धांत|ली चेटेलियर सिद्धांत]] के अनुसार दाईं ओर विकसित होगा और कैल्सियम सल्फेट अधिक आसानी से विलेय हो जाएगा। इस प्रकार कैल्सियम सल्फेट की घुलनशीलता तापमान घटने के साथ बढ़ती है और इसके विपरीत। यदि सिस्टम का तापमान बढ़ा दिया जाता है, तो अभिक्रिया की ऊष्मा पूरी तरह से समाप्त नहीं होती है और ली चेटेलियर सिद्धांत के अनुसार संतुलन बाईं ओर वापस आ जाएगा। जैसे-जैसे तापमान बढ़ता है कैल्सियम सल्फेट की घुलनशीलता कम होती जाती है। इस प्रति-सहज ज्ञान युक्त विलेयता व्यवहार को प्रतिगामी विलेयता कहा जाता है। यह उन अधिकांश लवणों की तुलना में सामान्य है जिनकी विघटन अभिक्रिया ऊष्माशोषी है(यानी, अभिक्रिया में ऊष्मा की खपत होती है: एन्थैल्पी में वृद्धि: ΔH> 0) और उनकी घुलनशीलता ताप बढ़ने के साथ साथ काम होती जाती है। एक अन्य कैल्सियम यौगिक, कैल्सियम हाइड्रॉक्साइड(Ca(OH))<sub>2</sub>,[[पोर्टलैंडर्स]]) भी उसी थर्मोडायनामिक कारण के लिए विलेयता में कमी प्रदर्शित करता है: क्योंकि इसकी विघटन अभिक्रिया भी उष्माक्षेपी है और इसमें ऊष्मा उत्पन्न होती है। इसलिए, कैल्सियम सल्फेट या कैल्सियम हाइड्रॉक्साइड की अधिकतम मात्रा को जल में घोलने के लिए, घोल को उसके तापमान को बढ़ाने के बजाय उसके हिमांक के करीब ठंडा करना आवश्यक है। | जल में कैल्सियम सल्फेट के विभिन्न क्रिस्टलीय चरणों का विघटन उष्माक्षेपी अभिक्रिया है और इसमें ऊष्मा ([[तापीय धारिता|एन्थैल्पी]] में कमी: ΔH <0) उत्पन्न होती है। तत्काल परिणाम के रूप में, आगे बढ़ने के लिए, विघटन अभिक्रिया को ऊष्मा को निकालने की जरूरत है जिसे अभिक्रिया के उत्पाद के रूप में माना जा सकता है। यदि सिस्टम ठंडा हो जाता है, विघटन साम्यावस्था [[ले चेटेलियर सिद्धांत|ली चेटेलियर सिद्धांत]] के अनुसार दाईं ओर विकसित होगा और कैल्सियम सल्फेट अधिक आसानी से विलेय हो जाएगा। इस प्रकार कैल्सियम सल्फेट की घुलनशीलता तापमान घटने के साथ बढ़ती है और इसके विपरीत। यदि सिस्टम का तापमान बढ़ा दिया जाता है, तो अभिक्रिया की ऊष्मा पूरी तरह से समाप्त नहीं होती है और ली चेटेलियर सिद्धांत के अनुसार संतुलन बाईं ओर वापस आ जाएगा। जैसे-जैसे तापमान बढ़ता है कैल्सियम सल्फेट की घुलनशीलता कम होती जाती है। इस प्रति-सहज ज्ञान युक्त विलेयता व्यवहार को प्रतिगामी विलेयता कहा जाता है। यह उन अधिकांश लवणों की तुलना में सामान्य है जिनकी विघटन अभिक्रिया ऊष्माशोषी है(यानी, अभिक्रिया में ऊष्मा की खपत होती है: एन्थैल्पी में वृद्धि: ΔH> 0) और उनकी घुलनशीलता ताप बढ़ने के साथ साथ काम होती जाती है। एक अन्य कैल्सियम यौगिक, कैल्सियम हाइड्रॉक्साइड(Ca(OH))<sub>2</sub>,[[पोर्टलैंडर्स]]) भी उसी थर्मोडायनामिक कारण के लिए विलेयता में कमी प्रदर्शित करता है: क्योंकि इसकी विघटन अभिक्रिया भी उष्माक्षेपी है और इसमें ऊष्मा उत्पन्न होती है। इसलिए, कैल्सियम सल्फेट या कैल्सियम हाइड्रॉक्साइड की अधिकतम मात्रा को जल में घोलने के लिए, घोल को उसके तापमान को बढ़ाने के बजाय उसके हिमांक के करीब ठंडा करना आवश्यक है। | ||
[[File:Temperature dependence calcium sulfate solubility.svg|thumb|400px|left|शुद्ध जल में कैल्सियम सल्फेट (3 चरणों) की घुलनशीलता की तापमान निर्भरता।]] | [[File:Temperature dependence calcium sulfate solubility.svg|thumb|400px|left|शुद्ध जल में कैल्सियम सल्फेट (3 चरणों) की घुलनशीलता की तापमान निर्भरता।]]कैल्सियम सल्फेट की विलेयता में कमी ताप प्रणाली के सबसे गर्म क्षेत्र में इसके अवक्षेपण के लिए भी जिम्मेदार है और कैल्सियम कार्बोनेट के अवक्षेपण के साथ-साथ बायलर में फाउलिंग अवक्षेपण फाउलिंग के निर्माण में इसका योगदान जग जाहिर है, जिसकी घुलनशीलता भी कम हो जाती है जब CO2 गर्म जल से बाहर निकलती है या सिस्टम से बाहर निकलती है, कैल्सियम सल्फेट की घुलनशीलता भी कम हो जाती है | ||
कैल्सियम सल्फेट की विलेयता में कमी ताप प्रणाली के सबसे गर्म क्षेत्र में इसके अवक्षेपण के लिए भी जिम्मेदार है और कैल्सियम कार्बोनेट के अवक्षेपण के साथ-साथ बायलर में फाउलिंग अवक्षेपण फाउलिंग के निर्माण में इसका योगदान जग जाहिर है, जिसकी घुलनशीलता भी कम हो जाती है जब CO2 गर्म जल से बाहर निकलती है या सिस्टम से बाहर निकलती है, कैल्सियम सल्फेट की घुलनशीलता भी कम हो जाती है | |||
| Line 200: | Line 199: | ||
==संदर्भ== | ==संदर्भ== | ||
{{Reflist|2}} | {{Reflist|2}} | ||
==बाहरी संबंध== | ==बाहरी संबंध== | ||
*[http://www.inchem.org/documents/icsc/icsc/eics1215.htm International Chemical Safety Card 1215] | *[http://www.inchem.org/documents/icsc/icsc/eics1215.htm International Chemical Safety Card 1215] | ||
*[https://www.cdc.gov/niosh/npg/npgd0095.html NIOSH Pocket Guide to Chemical Hazards] | *[https://www.cdc.gov/niosh/npg/npgd0095.html NIOSH Pocket Guide to Chemical Hazards] | ||
{{Authority control}} | |||
[[Category:Articles containing unverified chemical infoboxes]] | |||
[[Category:Articles with changed KEGG identifier]] | |||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with short description]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:CS1 errors]] | |||
[[Category:CS1 français-language sources (fr)]] | |||
[[Category:CS1 maint]] | |||
[[Category:CS1 Ελληνικά-language sources (el)]] | |||
[[Category:Chemical articles with multiple CAS registry numbers|C]] | |||
[[Category:Chemical articles with multiple ChEBIs|B]] | |||
[[Category:Chemical articles with multiple compound IDs|C]] | |||
[[Category:Chemicals using indexlabels]] | |||
[[Category:Citation Style 1 templates|W]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 10/12/2022]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages using collapsible list with both background and text-align in titlestyle|background:transparent;font-weight:normal;text-align:left ]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates based on the Citation/CS1 Lua module]] | |||
[[Category:Templates generating COinS|Cite web]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates used by AutoWikiBrowser|Cite web]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia fully protected templates|Cite web]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:आतिशबाज़ी के रंग]] | |||
[[Category:ई-नंबर योजक]] | |||
[[Category:कैल्शियम यौगिक]] | [[Category:कैल्शियम यौगिक]] | ||
[[Category:खाद्य योजक]] | [[Category:खाद्य योजक]] | ||
[[Category: | [[Category:जलशुष्कक]] | ||
[[Category: | [[Category:सल्फेट्स]] | ||
Latest revision as of 17:41, 13 September 2023
| |

| |
| Names | |
|---|---|
| Other names | |
| Identifiers | |
| |
3D model (JSmol)
|
|
| ChEBI |
|
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| EC Number |
|
| 7487 | |
| KEGG | |
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
| |
| |
| Properties | |
| CaSO4 | |
| Molar mass | 136.14 g/mol (anhydrous) 145.15 g/mol (hemihydrate) 172.172 g/mol (dihydrate) |
| Appearance | white solid |
| Odor | odorless |
| Density | 2.96 g/cm3 (anhydrous) 2.32 g/cm3 (dihydrate) |
| Melting point | 1,460 °C (2,660 °F; 1,730 K) (anhydrous) |
| 0.26 g/100ml at 25 °C (dihydrate)[1] | |
Solubility product (Ksp)
|
4.93 × 10−5 mol2L−2 (anhydrous) 3.14 × 10−5 (dihydrate) [2] |
| Solubility in glycerol | slightly soluble (dihydrate) |
| Acidity (pKa) | 10.4 (anhydrous) 7.3 (dihydrate) |
| -49.7·10−6 cm3/mol | |
| Structure | |
| orthorhombic | |
| Thermochemistry | |
Std molar
entropy (S⦵298) |
107 J·mol−1·K−1 [3] |
Std enthalpy of
formation (ΔfH⦵298) |
-1433 kJ/mol[3] |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp) [for anhydrous form only][4] |
REL (Recommended)
|
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp) [anhydrous only][4] |
IDLH (Immediate danger)
|
N.D.[4] |
| Safety data sheet (SDS) | ICSC 1589 |
| Related compounds | |
Other cations
|
Magnesium sulfate Strontium sulfate Barium sulfate |
Related desiccants
|
Calcium chloride Magnesium sulfate |
Related compounds
|
Plaster of Paris Gypsum |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
कैल्सियम सल्फेट एक अकार्बनिक यौगिक है जिसका सूत्र संबंधित हाइड्रेट के साथ CaSO4 है। γ-एनहाइड्राइट(निर्जल), यह एक जल अवशोषक के रूप में प्रयोग किया जाता है। एक विशिष्ट हाइड्रेट को प्लास्टर ऑफ पेरिस के रूप में जाना जाता है, और दूसरे का प्राकृतिक रूप जिप्सम के रूप में होता है जिप्सम एक खनिज है। उद्योगों में इसके अनेक उपयोग हैं। यह सफेद रंग के ठोस पदार्थ होते हैं जो जल में कम घुलनशील होते हैं।[5] कैल्सियम सल्फेट जल में स्थायी कठोरता उत्पन्न करता है।
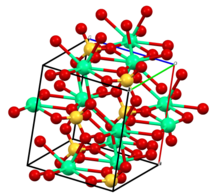
जलयोजन अवस्थाएँ और क्रिस्टलोग्राफिक संरचनाएं
यौगिक विभिन्न क्रिस्टलोग्राफिक संरचनाओं और खनिजों के अनुरूप जलयोजन के तीन स्तरों में मौजूद है:
- CaSO
4(एनहाइड्राइट): निर्जल अवस्था।[6] संरचना जिरकोनियम ऑर्थोसिलिकेट(जिरकॉन) से संबंधित है: Ca2+
की समन्वय संख्या 8 है, - SO2−
4 चतुष्फलकीय है, O की समन्वय संख्या 3 है। - CaSO
4·2H
2O (जिप्सम और सेलेनाइट(खनिज)): डाइहाइड्रेट।[7] - CaSO
4·1/2H
2O (बेसानाइट): हेमीहाइड्रेट, जिसे प्लास्टर ऑफ पेरिस भी कहा जाता है। विशिष्ट हेमीहाइड्रेट कभी-कभी दो विशिष्ट रूपों में होते हैं: α-हेमीहाइड्रेट और β-हेमीहाइड्रेट।[8]
उपयोग
कैल्सियम सल्फेट का मुख्य उपयोग प्लास्टर ऑफ पेरिस और महीन चूना का उत्पादन करना है। ये अनुप्रयोग इस तथ्य का फायदा उठाते हैं कि कैल्सियम सल्फेट जिसे चूर्णित और कैलक्लाइंड किया गया है, जलयोजन करने पर एक ढाला हुआ पेस्ट बनाता है और क्रिस्टलीय कैल्सियम सल्फेट डाइहाइड्रेट के रूप में कठोर हो जाता है। यह भी सुविधाजनक है कि कैल्सियम सल्फेट जल में कम घुलनशील है और जब यह जम जाता है तो दुबारा जल के संपर्क में आने पर आसानी से नहीं घुलता है।
जलयोजन और निर्जलीकरण अभिक्रियाएँ
उचित ताप पर, जिप्सम आंशिक रूप से निर्जल खनिज में परिवर्तित हो जाता है जिसे बेसानाइट या प्लास्टर ऑफ पेरिस कहा जाता है। इस पदार्थ का सूत्र CaSO4·(nH2O) है, जहां n का मान 0.5 ≤ n ≤ 0.8 [8] और ताप 100–150 °C (212–302 °F) के बीच इसके निर्जलीकरण के लिए आवश्यक है। तापमान और समय का विवरण परिवेश की आर्द्रता पर निर्भर करता है। उच्च ताप लगभग 170 °C (338 °F) औद्योगिक कैल्सीनेशन में उपयोग किया जाता है, लेकिन इन तापमानों पर γ-एनहाइड्राइट बनने लगता है। इस समय जिप्सम को दी जाने वाली ऊष्मा (जलयोजन की ऊष्मा) खनिज के तापमान को बढ़ाने के बजाय जल(जल वाष्प के रूप में) का ताप बढ़ाने में खर्च हो जाती है, जो खनिज के तापमान को बढ़ाने के बजाय, जल खत्म होने तक खनिज के ताप को धीरे-धीरे बढाती है, फिर तेजी से बढाती है। आंशिक निर्जलीकरण के लिए समीकरण है:
- CaSO4 · 2 H2O → CaSO4 · 1/2 H2O + 1+1/2 H2O↑
इस अभिक्रिया के ऊष्माशोषी गुण ड्रायवॉल के प्रदर्शन के लिए प्रासंगिक है, जो आवासीय और अन्य संरचनाओं को अग्नि प्रतिरोध प्रदान करती है। आग में, ड्राईवॉल की शीट के पीछे की संरचना अपेक्षाकृत ठंडी रहेगी क्योंकि जिप्सम से जल बाहर निकल जाता है, इस प्रकार फ्रेमिंग(लकड़ी से बनी हुई वस्तुओं के दहन) से या उच्च तापमान पर स्टील की मजबूती और इसके परिणामस्वरूप उसका संरचनात्मक पतन(या काफी हद तक मंदता) को रोकता है। लेकिन उच्च तापमान पर, कैल्सियम सल्फेट ऑक्सीजन छोड़ेगा और ऑक्सीकारक् के रूप में कार्य करेगा। इस गुण का उपयोग एल्युमिनोथर्मिक में किया जाता है। अधिकांश खनिजों के विपरीत, जो पुनर्जलीकृत होने पर केवल तरल या अर्ध-तरल पेस्ट बनाते हैं, या चूर्ण बने रहते हैं इनमे एक कैलक्लाइंड जिप्सम है कैलक्लाइंड जिप्सम में एक असामान्य गुण होता है: जब सामान्य(परिवेश) तापमान पर जल के साथ मिलाया जाता है, तो यह रासायनिक रूप से पसंदीदा डाइहाइड्रेट रूप में वापस आ जाता है। कठोर और अपेक्षाकृत मजबूत जिप्सम क्रिस्टल जाली बनाने के लिए भौतिक रूप से सेटिंग करते समय निम्न अभिक्रिया देते हैं:
- CaSO4 · 1/2 H2O + 1+1/2 H2O → CaSO4 · 2 H2O
यह अभिक्रिया उष्माक्षेपी है और आसानी से जिप्सम को शीट्स(ड्राईवॉल के लिए), स्टिक्स(ब्लैकबोर्ड चॉक के लिए), और मोल्ड्स(टूटी हुई हड्डियों को स्थिर करने के लिए, या धातु की ढलाई के लिए) सहित विभिन्न आकृतियों में ढाला जा सकता है। पॉलिमर के साथ मिश्रित करके, इसका उपयोग हड्डी की मरम्मत वाली सीमेंट के रूप में किया गया है। कच्ची मिट्टी से सीधे मजबूत संरचना बनाने के लिए मिट्टी में थोड़ी मात्रा में कैलक्लाइंड जिप्सम मिलाया जाता है, जो कि एडोब(जो गीला होने पर अपनी ताकत खो देता है) का एक विकल्प है। निर्जलीकरण की स्थितियों में हेमीहाइड्रेट की सरंध्रता को समायोजित करने के लिए परिवर्तन किया जा सकता है, जिसके परिणामस्वरूप तथाकथित α- और β-हेमीहाइड्रेट प्राप्त होते हैं(जो रासायनिक रूप से समान हैं)।
180 °C (356 °F) पर गर्म करने पर, लगभग जल-मुक्त रूप, जिसे γ-एनहाइड्राइट कहा जाता है(CaSO4·nH2O जहाँ n = 0 से 0.05) उत्पन्न होता है। γ-एनहाइड्राइट डाइहाइड्रेट अवस्था में वापस आने के लिए जल के साथ धीरे-धीरे अभिक्रिया करता है। 250 °C से ऊपर गर्म करने पर पूरी तरह से निर्जल रूप जिसे β-एनहाइड्राइट या प्राकृतिक एनहाइड्राइट बनता है। प्राकृतिक एनहाइड्राइट जल के साथ अभिक्रिया नहीं करता है, यहां तक कि भूगर्भीय समय के पैमाने पर भी, जब तक बहुत महीन पिसा हुआ न हो जल के साथ अभिक्रिया नहीं करता है।
हेमीहाइड्रेट और γ-एनहाइड्राइट की परिवर्तनीय संरचना, और उनका आसान अंतर-रूपांतरण, उनके लगभग समान क्रिस्टल संरचनाओं के कारण होता है जिसमें "चैनल" होते हैं जो जल की परिवर्तनीय मात्रा, या मेथनॉल जैसे अन्य छोटे अणुओं को समायोजित कर सकते हैं।
खाद्य उद्योग
कैल्सियम सल्फेट हाइड्रेट का उपयोग टोफू जैसे उत्पादों में स्कंदक के रूप में किया जाता है।[9]
FDA के लिए पनीर और संबंधित पनीर उत्पादों में कैल्सियम सल्फेट उपस्थित होता है, कैल्सियम सल्फेट अनाज का आटा, बेकरी उत्पाद, जमे हुए डेसर्ट, जेली, कृत्रिम मिठास, मसाला सब्जियां, मसाला टमाटर और कुछ कैंडी को संरक्षित रखता है।[10]
इसे E संख्या श्रृंखला में E516 के रूप में जाना जाता है, और संयुक्त राष्ट्र के खाद्य और कृषि संगठन इसे एक फर्मिंग एजेंट(अभिकर्ता), एक आटा उपचार एजेंट, एक अनुक्रमक और एक किण्वन एजेंट के रूप में जानते हैं।[10]
दंत चिकित्सा
कैल्सियम सल्फेट का दंत चिकित्सा में उपयोग का एक लंबा इतिहास रहा है।[11] यह हड्डी पुनर्जनन में एक ग्राफ्ट सामग्री और ग्राफ्ट बाइंडर (या एक्सटेंडर) के रूप में और निर्देशित हड्डी ऊतक पुनर्जनन में एक बाधा के रूप में उपयोग किया गया है। यह एक जैवसंगत सामग्री है और आरोपण के बाद पूरी तरह से अवशोषित हो जाती है।[12] यह एक महत्वपूर्ण मेजबान अभिक्रिया उत्पन्न नहीं करता है और आरोपण के क्षेत्र में एक कैल्सियम युक्त वातावरण बनाता है।[13]
अन्य उपयोग
जब कैल्सियम सल्फेट रंग-संकेतक एजेंट के साथ निर्जलीकरण के रूप में निर्जल अवस्था में बेचा जाता है, तो यह कोबाल्ट(II) क्लोराइड के संसेचन के कारण नीला(निर्जल) या गुलाबी(हाइड्रेटेड) दिखाई देता है, जो नमी सूचक के रूप में कार्य करता है।
1970 के दशक तक, निर्जल कैल्सियम सल्फेट से व्हाइटहेवन(कम्ब्रिया, यूके) में सल्फ्यूरिक अम्ल की व्यावसायिक मात्रा का उत्पादन किया गया था। कैल्सियम सल्फेट एक प्रकार की शीस्ट या चिकनी मिट्टी के साथ मिश्रित होने पर, और भुनने पर सल्फेट, सल्फर डाइऑक्साइड गैस को मुक्त करता है, सल्फ्यूरिक अम्ल उत्पादन में एक अग्रदूत अभिक्रिया, कैल्सियम सिलिकेट का उत्पादन करता है, जो सीमेंट क्लिंकर उत्पादन में आवश्यक खनिज चरण है।[14]
- 2 CaSO4 + 2 SiO2 → 2 CaSiO3 + 2 SO2 + O2 [15]
संयंत्र ने "एनहाइड्राइट प्रक्रिया" द्वारा सल्फ्यूरिक अम्ल बनाया, जिसमें सीमेंट क्लिंकर स्वयं एक उप-उत्पाद था। इस प्रक्रिया में, एनहाइड्राइट(कैल्सियम सल्फेट) सीमेंट कच्चे मिश्रण में चूना पत्थर की जगह लेता है, और कम करने की स्थिति में, कार्बन डाइआक्साइड के बजाय सल्फर डाइऑक्साइड उत्पन्न होता है। वैनेडियम पेंटोक्साइड उत्प्रेरक का उपयोग करके संपर्क प्रक्रिया द्वारा सल्फर डाइऑक्साइड को सल्फ्यूरिक अम्ल में परिवर्तित किया जाता है। [16]
CaSO4 + 2 C → CaS + 2CO2
3 CaSO4 + CaS + 2 SiO2 → 2 Ca2SiO4 + 4 SO2
3 CaSO4 + CaS → 4 CaO + 4 SO2
Ca2SiO4 + CaO → Ca3OSiO4
2 SO2 + O2 → 2 SO3 (उत्प्रेरक वैनेडियम पेंटोक्साइड की उपस्थिति में)
SO3 + H2O → H2SO4 [17]
एक विस्तारित आला बाजार में इसके उपयोग के कारण, व्हाइटहेवन संयंत्र अन्य एनहाइड्राइट प्रक्रिया संयंत्रों द्वारा साझा नहीं किए जाने वाले तरीके से विस्तार करना जारी रखता है। एनहाइड्राइट खदान 11/1/1955 और अम्ल प्लांट 14/11/1955 को प्रारम्भ हुआ था। 1970 के दशक की शुरुआत में कुछ समय के लिए, यह यूके में सबसे बड़ा सल्फ्यूरिक अम्ल प्लांट बन गया, जो राष्ट्रीय उत्पादन का लगभग 13% था, और यह अब तक का सबसे बड़ा एनहाइड्राइट प्रक्रिया प्लांट था। [18]
उत्पादन और घटना
कैल्सियम सल्फेट के मुख्य स्रोत प्राकृतिक रूप से जिप्सम और एनहाइड्राइट होते हैं, जो दुनिया भर में कई स्थानों पर वाष्पीकरण के रूप में पाए जाते हैं। इन्हें ओपन-कास्ट उत्खनन या गहरे खनन द्वारा निकाला जा सकता है। प्राकृतिक जिप्सम का विश्व उत्पादन लगभग 127 मिलियन टन प्रति वर्ष है।[19]
प्राकृतिक स्रोतों के अतिरिक्त, कैल्सियम सल्फेट को कई प्रक्रियाओं में उप-उत्पाद के रूप में उत्पादित किया जाता है:
- ग्रिप-गैस डिसल्फराइजेशन में, जीवाश्म-ईंधन पावर स्टेशन और अन्य प्रक्रियाओं(जैसे सीमेंट निर्माण) से निकलने वाली गैसों को उनके सल्फर ऑक्साइड सामग्री को कम करने के लिए बारीक पिसा हुआ चूना पत्थर इंजेक्ट करके साफ़ किया जाता है:[20]
- SO2 + 0.5 O2 + CaCO3 → CaSO4 + CO2
संबंधित सल्फर-ट्रैपिंग विधियों में चूने का उपयोग किया जाता है और कुछ अशुद्ध कैल्सियम सल्फाइट का उत्पादन करते हैं, जो एकत्र कैल्सियम सल्फेट का ऑक्सीकरण करता है।
- एपेटाइट से फॉस्फोरिक अम्ल के उत्पादन में, कैल्सियम फॉस्फेट को सल्फ्यूरिक अम्ल और कैल्सियम सल्फेट अवक्षेप के साथ क्रिया कराई जाती है। जिससे फास्फोजिप्सम उत्पाद प्राप्त होता है, जो प्रायः अशुद्धियों से दूषित होता है, जिससे इसका उपयोग अनार्थिक हो जाता है।
- हाइड्रोजिन फ्लोराइड के उत्पादन में, कैल्सियम फ्लोराइड को सल्फ्यूरिक अम्ल के साथ क्रिया कराई जाती है, कैल्सियम सल्फेट का अवक्षेपण हो जाता है।
- जस्ता के शोधन में, बेरियम जैसी भारी धातुओं को अवक्षेपित करने के लिए जिंक सल्फेट के घोल को कैल्सियम हाइड्रॉक्साइड के साथ क्रिया कराई जाती है।
- निर्माण स्थलों पर स्क्रैप ड्राईवॉल से कैल्सियम सल्फेट को भी पुनर्प्राप्त और पुन: उपयोग किया जा सकता है।
ये अवक्षेपण प्रक्रियाएं कैल्सियम सल्फेट उत्पाद में रेडियोधर्मी तत्वों को सान्द्रित करती हैं। यह मुद्दा विशेष रूप से फॉस्फेट उपोत्पाद के साथ है, क्योंकि फॉस्फेट अयस्कों में प्राकृतिक रूप से यूरेनियम और इसके क्षय उत्पाद जैसे रेडियम-226, नेतृत्व-210 और पोलोनियम -210 होते हैं। फास्फोरस अयस्कों से यूरेनियम का निष्कर्षण यूरेनियम बाजार की कीमतों के आधार पर अपने आप में किफायती हो सकता है या यूरेनियम का पृथक्करण पर्यावरणीय कानून द्वारा अनिवार्य किया जा सकता है और यह इसकी बिक्री प्रक्रिया की लागत का हिस्सा वसूल करने के लिए किया जाता है।[21][22][23]
कैल्सियम सल्फेट भी औद्योगिक ताप विनिमायकों में दूषण निक्षेप(मृदा) का एक सामान्य घटक है, क्योंकि बढ़ते तापमान के साथ इसकी विलेयता घट जाती है(विलेयता में कमी पर विशिष्ट खंड देखें)।
विलेयता में कमी
जल में कैल्सियम सल्फेट के विभिन्न क्रिस्टलीय चरणों का विघटन उष्माक्षेपी अभिक्रिया है और इसमें ऊष्मा (एन्थैल्पी में कमी: ΔH <0) उत्पन्न होती है। तत्काल परिणाम के रूप में, आगे बढ़ने के लिए, विघटन अभिक्रिया को ऊष्मा को निकालने की जरूरत है जिसे अभिक्रिया के उत्पाद के रूप में माना जा सकता है। यदि सिस्टम ठंडा हो जाता है, विघटन साम्यावस्था ली चेटेलियर सिद्धांत के अनुसार दाईं ओर विकसित होगा और कैल्सियम सल्फेट अधिक आसानी से विलेय हो जाएगा। इस प्रकार कैल्सियम सल्फेट की घुलनशीलता तापमान घटने के साथ बढ़ती है और इसके विपरीत। यदि सिस्टम का तापमान बढ़ा दिया जाता है, तो अभिक्रिया की ऊष्मा पूरी तरह से समाप्त नहीं होती है और ली चेटेलियर सिद्धांत के अनुसार संतुलन बाईं ओर वापस आ जाएगा। जैसे-जैसे तापमान बढ़ता है कैल्सियम सल्फेट की घुलनशीलता कम होती जाती है। इस प्रति-सहज ज्ञान युक्त विलेयता व्यवहार को प्रतिगामी विलेयता कहा जाता है। यह उन अधिकांश लवणों की तुलना में सामान्य है जिनकी विघटन अभिक्रिया ऊष्माशोषी है(यानी, अभिक्रिया में ऊष्मा की खपत होती है: एन्थैल्पी में वृद्धि: ΔH> 0) और उनकी घुलनशीलता ताप बढ़ने के साथ साथ काम होती जाती है। एक अन्य कैल्सियम यौगिक, कैल्सियम हाइड्रॉक्साइड(Ca(OH))2,पोर्टलैंडर्स) भी उसी थर्मोडायनामिक कारण के लिए विलेयता में कमी प्रदर्शित करता है: क्योंकि इसकी विघटन अभिक्रिया भी उष्माक्षेपी है और इसमें ऊष्मा उत्पन्न होती है। इसलिए, कैल्सियम सल्फेट या कैल्सियम हाइड्रॉक्साइड की अधिकतम मात्रा को जल में घोलने के लिए, घोल को उसके तापमान को बढ़ाने के बजाय उसके हिमांक के करीब ठंडा करना आवश्यक है।
कैल्सियम सल्फेट की विलेयता में कमी ताप प्रणाली के सबसे गर्म क्षेत्र में इसके अवक्षेपण के लिए भी जिम्मेदार है और कैल्सियम कार्बोनेट के अवक्षेपण के साथ-साथ बायलर में फाउलिंग अवक्षेपण फाउलिंग के निर्माण में इसका योगदान जग जाहिर है, जिसकी घुलनशीलता भी कम हो जाती है जब CO2 गर्म जल से बाहर निकलती है या सिस्टम से बाहर निकलती है, कैल्सियम सल्फेट की घुलनशीलता भी कम हो जाती है
मंगल ग्रह पर
मंगल ग्रह पर ऑपर्च्युनिटी रोवर द्वारा 2011 के निष्कर्ष सतह पर एक शिरे में कैल्सियम सल्फेट का एक रूप दिखाते हैं। चित्र दर्शाता है कि वह खनिज जिप्सम है।[24]
यह भी देखें
- कैल्सियम सल्फेट (डेटा पेज)
- सिलखड़ी
- एनहाइड्राइट
- बाथिबियस हेकेली
- चाक (कैल्सियम कार्बोनेट)
- जिप्सम
- प्लास्टर#जिप्सम प्लास्टर
- फॉस्फोजिप्सम
- सेलेनाइट (खनिज)
- फ्लू-गैस डिसल्फराइजेशन
संदर्भ
- ↑ Lebedev, A. L.; Kosorukov, V. L. (2017). "Gypsum Solubility in Water at 25°C" (PDF). Geochemistry International. 55 (2): 171–177. doi:10.1134/S0016702917010062. S2CID 132916752.
- ↑ D.R. Linde (ed.) "CRC Handbook of Chemistry and Physics", 83rd Edition, CRC Press, 2002
- ↑ 3.0 3.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ↑ 4.0 4.1 4.2 NIOSH Pocket Guide to Chemical Hazards. "#0095". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Franz Wirsching "Calcium Sulfate" in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_555
- ↑ Morikawa, H.; Minato, I.; Tomita, T.; Iwai, S. (1975). "एनहाइड्राइट: एक शोधन". Acta Crystallographica Section B. 31 (8): 2164. doi:10.1107/S0567740875007145.
- ↑ Cole, W.F.; Lancucki, C.J. (1974). "जिप्सम की क्रिस्टल संरचना का शोधन [[:Template:रसायन]]". Acta Crystallographica Section B. 30 (4): 921. doi:10.1107/S0567740874004055.
{{cite journal}}: URL–wikilink conflict (help) - ↑ 8.0 8.1 Taylor H.F.W. (1990) Cement Chemistry. Academic Press, ISBN 0-12-683900-X, pp. 186-187.
- ↑ "टोफू कौयगुलांट के बारे में". www.soymilkmaker.com. Sanlinx Inc. 31 August 2015.
- ↑ 10.0 10.1 "CID 24497 के लिए यौगिक सारांश - कैल्शियम सल्फेट". PubChem.
- ↑ Titus, Harry W.; McNally, Edmund; Hilberg, Frank C. (1933-01-01). "हड्डी के विकास पर कैल्शियम कार्बोनेट और कैल्शियम सल्फेट का प्रभाव". Poultry Science (in English). 12 (1): 5–8. doi:10.3382/ps.0120005. ISSN 0032-5791.
- ↑ Thomas, Mark V.; Puleo, David A.; Al-Sabbagh, Mohanad (2005). "कैल्शियम सल्फेट: एक समीक्षा". Journal of Long-Term Effects of Medical Implants. 15 (6): 599–607. doi:10.1615/jlongtermeffmedimplants.v15.i6.30. ISSN 1050-6934. PMID 16393128.
- ↑ "द्विध्रुवीय कैल्शियम सल्फेट - अवलोकन". Augma Biomaterials. 2020-03-25. Retrieved 2020-07-16.
- ↑ Whitehaven Coast Archeological Survey
- ↑ COMMONWEALTH OF AUSTRALIA. DEPARTMENT OF SUPPLY AND SHIPPING. BUREAU OF MINERAL RESOURCES GEOLOGY AND GEOPHYSICS. REPORT NO.1949/44 (Geol. Ser. No. 27) by E.K. Sturmfels THE PRODUCTION OF SULPHURIC ACID AND PORTLAND CEMENT FROM CALCIUM SULPHATE AND ALUMINIUM SILICATES
- ↑ Whitehaven anhydrate process
- ↑ Whitehaven anhydrate process
- ↑ website cement kilns whitehaven
- ↑ Gypsum, USGS, 2008
- ↑ Speight, James G. (2000). "Fuels, Synthetic, Gaseous Fuels". किर्क-ओथमर एनसाइक्लोपीडिया ऑफ केमिकल टेक्नोलॉजी. doi:10.1002/0471238961.0701190519160509.a01. ISBN 9780471484943.
- ↑ https://www.osti.gov/biblio/6654998
- ↑ https://world-nuclear.org/information-library/nuclear-fuel-cycle/uranium-resources/uranium-from-phosphates.aspx
- ↑ https://www.world-nuclear-news.org/Articles/Agreement-on-Brazilian-uranium-phosphate-extractio
- ↑ "नासा मार्स ऑपर्च्युनिटी रोवर ने पानी द्वारा जमा खनिज शिरा का पता लगाया". NASA Jet Propulsion Laboratory. December 7, 2011. Retrieved April 23, 2013.


