प्रवासी प्रविष्टि: Difference between revisions
(Text) |
No edit summary |
||
| (6 intermediate revisions by 4 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Chemical reaction in which two ligands of a metal complex combine}} | {{Short description|Chemical reaction in which two ligands of a metal complex combine}} | ||
कार्बधात्विक रसायन विज्ञान में, एक '''प्रवासी''' सम्मिलन एक प्रकार की [[ रासायनिक प्रतिक्रिया ]] है जिसमें एक [[ | [[कार्बधात्विक रसायन विज्ञान]] में, एक '''प्रवासी''' सम्मिलन एक प्रकार की [[:en:Chemical_compound|रासायनिक प्रतिक्रिया]] है जिसमें एक [[:en:Coordination_complex|धातु परिसर]] पर दो [[:en:Ligand|संलग्नी]] का गठबंधन होता है। यह प्रतिक्रियाओं का एक उपसमुच्चय है जो [[:en:Insertion_reaction|सम्मिलन प्रतिक्रियाओं]] से बहुत मिलता-जुलता है, और दोनों को [[:en:Reaction_mechanism|प्रतिक्रिया तंत्र]] द्वारा विभेदित किया जाता है जो उत्पादों के परिणामी [[:en:Stereochemistry|त्रिविम]] की ओर जाता है। तथापि, प्रायः दोनों का परस्पर उपयोग किया जाता है क्योंकि तंत्र कभी-कभी अज्ञात होता है। इसलिए, प्रवासी सम्मिलन प्रतिक्रियाएं या सम्मिलन प्रतिक्रियाएं, संक्षेप में, तंत्र द्वारा नहीं बल्कि समग्र [[:en:Regioselectivity|रीजियोकेमिस्ट्री]] द्वारा परिभाषित की जाती हैं, जिसमें एक रासायनिक इकाई खुद को दूसरे रासायनिक इकाई के मौजूदा [[:en:Chemical_bond|रासायनिक बंधन]] में अंतरस्थापित करती है जैसे:<ref>{{cite book|last=Elschenbroich|first=C.|title=आर्गेनोमेटेलिक्स|date=2006|publisher=Wiley-VCH|location=Weinheim|isbn=978-3-527-29390-2}}</ref> :<math chem>{\color{red}\ce A} + {\color{blue}\ce{B-C}} \longrightarrow {\color{blue}\ce{B{-}}}{\color{red}\ce A}{\color{blue}\ce{-C}}</math> | ||
==अवलोकन== | ==अवलोकन== | ||
{{see also| | {{see also|संलग्नी # संलग्नी का L और X के रूप में वर्गीकरण}} | ||
प्रवासी सम्मिलन में, एक संलग्नी जिसे [[:en:Ion#Anions_and_cations|आयनों]] (X) संलग्नी के रूप में देखा जाता है और एक संलग्नी जिसे [[:en:Neutral_particle|तटस्थ कण]] जोड़े के रूप में देखा जाता है, जो एक नया आयनिक संलग्नी उत्पन्न करता है। प्रतिक्रिया करने वाले आयन और तटस्थ संलग्नी आसन्न हैं। यदि [[:en:Precursor_(chemistry)|पूर्ववर्ती (रसायन विज्ञान]]) परिसर [[:en:Saturated_and_unsaturated_compounds|समन्वित रूप से संतृप्त]] है, तो प्रवासी सम्मिलन का परिणाम अक्सर [[:en:Saturated_and_unsaturated_compounds#Saturated_and_unsaturated_compounds_beyond_organic_chemistry|समन्वित रूप से असंतृप्त]] उत्पाद होता है। नया (तटस्थ) संलग्नी फिर [[:en:Metal|धातु]] के साथ प्रतिक्रिया कर सकता है जिससे आगे सम्मिलन हो सकता है। यह प्रक्रिया एक ही धातु पर कई बार हो सकती है, जैसे [[:en:Alkene#Polymerization|ओलेफिन पोलीमराइजेशन]] में। | |||
प्रवासी सम्मिलन पर विविध प्रतिक्रियाएं लागू होती हैं। एक तंत्र में तटस्थ संलग्नी के [[ वैद्युतकणसंचलन ]] भाग पर आयनिक संलग्नी का आक्रामक लिप्त है (आयनिक संलग्नी तटस्थ संलग्नी में विस्थापित होता है)। अन्य तंत्र में धातु और आयनिक संलग्नी के बीच तटस्थ संलग्नी सम्मिलित होता है। | आयनिक संलग्नी हो सकता है: H<sup>-</sup> ( [[:en:Hydride|हाइड्राइड]] ), R<sup>-</sup> (alkyl), [[:en:Acyl_group|एसाइल]] , Ar<sup>−</sup> ([[ आर्यल |आर्यल]]), या OR<sup>-</sup> ([[:en:Alkoxide|एल्कोक्साइड]])। इन समूहों की प्रवास करने की क्षमता को उनकी [[:en:Migratory_aptitude|प्रवासी योग्यता]] कहा जाता है। तटस्थ लिगैंड CO, [[:en:Alkyne|अल्काइन]] ,[[:en:Alkene|ऐल्कीन]] या कुछ मामलों में [[:en:Carbene|कार्बाइन]] भी हो सकता है। | ||
प्रवासी सम्मिलन पर विविध प्रतिक्रियाएं लागू होती हैं। एक तंत्र में तटस्थ संलग्नी के [[:en:Electrophile|वैद्युतकणसंचलन]] भाग पर आयनिक संलग्नी का आक्रामक लिप्त है (आयनिक संलग्नी तटस्थ संलग्नी में विस्थापित होता है)। अन्य तंत्र में धातु और आयनिक संलग्नी के बीच तटस्थ संलग्नी सम्मिलित होता है। | |||
== CO सम्मिलन == | == CO सम्मिलन == | ||
एसाइल समूह बनाने के लिए धातु-कार्बन बंधन में [[ कार्बन मोनोआक्साइड ]] का सम्मिलन [[ कार्बोनाइलीकरण ]] प्रतिक्रियाओं का आधार है, जो कई व्यावसायिक रूप से उपयोगी उत्पाद प्रदान करता है। | एसाइल समूह बनाने के लिए धातु-कार्बन बंधन में [[:en:Carbon_monoxide|कार्बन मोनोआक्साइड]] का सम्मिलन [[:en:Carbonylation|कार्बोनाइलीकरण]] प्रतिक्रियाओं का आधार है, जो कई व्यावसायिक रूप से उपयोगी उत्पाद प्रदान करता है। | ||
=== तंत्र === | === तंत्र === | ||
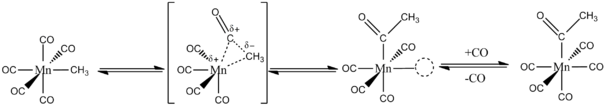
CO प्रवासी सम्मिलन के माध्यम से धातु-अल्काइल बंधन में प्रवेश करता है। मुख्य अवधारणा यह है कि CO और [[ एल्काइल ]] समूह दोनों एक ही धातु पर संलग्नी हैं। उदाहरण के लिए, <sup>13</sup>CO संग Mn(CO)<sub>5</sub>CH<sub>3</sub> की प्रतिक्रिया विशेष रूप से Mn(CO)<sub>4</sub>(<sup>13</sup>CO)COCH<sub>3</sub> बनाती है। अल्काइल समूह Mn (I) केंद्र के समन्वय क्षेत्र के भीतर एक निकटवर्ती CO संलग्नी में इंट्रामोलेक्युलर रूप से स्थानांतरित होता है। प्रवास के बाद, धातु मुक्त CO को बांधती है (नीचे चित्र देखें)।<ref name=Hartwig>{{cite book|last=Hartwig|first=J. F.|title=बॉन्डिंग से लेकर कटैलिसीस तक ऑर्गेनोट्रांसिशन मेटल केमिस्ट्री|publisher=University Science Books|location=New York, NY|date=2010|isbn=978-1-891389-53-5}}</ref><ref>{{cite book|title = अकार्बनिक रसायन विज्ञान में त्वरित समीक्षा|last=Yadav|first= M. S.|url = https://books.google.com/books?id=qlwlWsaoLwcC&q=Mn%28CO%295CH3+insertion+reaction&pg=PA244|publisher = Anmol Publications|year = 2005|page = 244|isbn = 978-81-261-1898-4}}</ref> | CO प्रवासी सम्मिलन के माध्यम से धातु-अल्काइल बंधन में प्रवेश करता है। मुख्य अवधारणा यह है कि CO और [[:en:Acyl_group|एल्काइल]] समूह दोनों एक ही धातु पर संलग्नी हैं। उदाहरण के लिए, <sup>13</sup>CO संग Mn(CO)<sub>5</sub>CH<sub>3</sub> की प्रतिक्रिया विशेष रूप से Mn(CO)<sub>4</sub>(<sup>13</sup>CO)COCH<sub>3</sub> बनाती है। [[अल्काइल समूह]] Mn (I) केंद्र के समन्वय क्षेत्र के भीतर एक निकटवर्ती CO संलग्नी में इंट्रामोलेक्युलर रूप से स्थानांतरित होता है। प्रवास के बाद, धातु मुक्त CO को बांधती है (नीचे चित्र देखें)।<ref name=Hartwig>{{cite book|last=Hartwig|first=J. F.|title=बॉन्डिंग से लेकर कटैलिसीस तक ऑर्गेनोट्रांसिशन मेटल केमिस्ट्री|publisher=University Science Books|location=New York, NY|date=2010|isbn=978-1-891389-53-5}}</ref><ref>{{cite book|title = अकार्बनिक रसायन विज्ञान में त्वरित समीक्षा|last=Yadav|first= M. S.|url = https://books.google.com/books?id=qlwlWsaoLwcC&q=Mn%28CO%295CH3+insertion+reaction&pg=PA244|publisher = Anmol Publications|year = 2005|page = 244|isbn = 978-81-261-1898-4}}</ref> | ||
:[[File:Insertion reaction for an octahedral complex.png|thumb|center|606px|सीओ एक अष्टफलकीय परिसर के लिए सम्मिलन प्रतिक्रिया मार्ग]]CO सम्मिलन में हमेशा स्थानान्तरण अन्तर्वलित नहीं होता है। CpFe(L)(CO)CH<sub>3</sub> की <sup>13</sup>CO, के साथ अभिक्रिया एल्काइल प्रवास उत्पाद और [[ | :[[File:Insertion reaction for an octahedral complex.png|thumb|center|606px|सीओ एक अष्टफलकीय परिसर के लिए सम्मिलन प्रतिक्रिया मार्ग]]CO सम्मिलन में हमेशा स्थानान्तरण अन्तर्वलित नहीं होता है। CpFe(L)(CO)CH<sub>3</sub> की <sup>13</sup>CO, के साथ अभिक्रिया एल्काइल प्रवास उत्पाद और [[:en:Methyl_group|मिथाइल]] समूह में बाउंड [[:en:Carbonyl_group|कार्बोनिल्स]] के सही सम्मिलन से बनने वाले उत्पाद, दोनों का मिश्रण देता है। उत्पाद वितरण [[:en:Solvent|विलायक]] की पसंद से प्रभावित होता है।<ref name="ACR">{{cite journal|last1 = Anderson|first1 = G. K.|last2 = Cross|first2 = R. J.|title = स्क्वायर प्लानर परिसरों की कार्बोनिल-सम्मिलन प्रतिक्रियाएं|journal = [[Acc. Chem. Res.]]|year = 1984|volume = 17|issue = 2|pages = 67–74|doi = 10.1021/ar00098a005}}</ref> | ||
[[ स्क्वायर प्लानर आणविक ज्यामिति ]] के अल्काइल व्युत्पादित विशेष रूप से आसानी से CO सम्मिलन से गुजरते हैं। वर्ग तलीय परिसरों पर सम्मिलन प्रतिक्रियाएं उनके औद्योगिक अनुप्रयोगों के कारण विशेष रुचि रखती हैं। चूँकि वर्गाकार तलीय संकुल प्रायः समन्वयात्मक रूप से असंतृप्त होते हैं, वे 5-निर्देशांक व्यसनों के निर्माण के लिए अतिसंवेदनशील होते हैं, जो आसानी से प्रवासी सम्मिलन अनुभव करते हैं।<ref name=ACR /> अधिकतम मामलों में इन-प्लेन स्थानान्तरण पंथ को प्राथमिकता दी जाती है, लेकिन [[ न्युक्लेओफ़िलिक ]] पंथ के विपरीत, यह CO की अधिकता से बाधित होता है।<ref name="CCR">{{cite journal|last = Cavell|first = K. J.|author-link = Kingsley Cavell|title=धातु-कार्बन बांडों में प्रवासी निवेश पर हालिया मौलिक अध्ययन|journal = [[Coord. Chem. Rev.]]|year = 1996|issue = 11|volume = 155|pages = 209–243|doi = 10.1016/S0010-8545(96)90182-4}}</ref> | [[:en:Square_planar_molecular_geometry|स्क्वायर प्लानर आणविक ज्यामिति]] के अल्काइल व्युत्पादित विशेष रूप से आसानी से CO सम्मिलन से गुजरते हैं। वर्ग तलीय परिसरों पर सम्मिलन प्रतिक्रियाएं उनके औद्योगिक अनुप्रयोगों के कारण विशेष रुचि रखती हैं। चूँकि वर्गाकार तलीय संकुल प्रायः समन्वयात्मक रूप से [[:en:Saturated_and_unsaturated_compounds#Saturated_and_unsaturated_compounds_beyond_organic_chemistry|असंतृप्त]] होते हैं, वे 5-निर्देशांक व्यसनों के निर्माण के लिए अतिसंवेदनशील होते हैं, जो आसानी से प्रवासी सम्मिलन अनुभव करते हैं।<ref name=ACR /> अधिकतम मामलों में इन-प्लेन स्थानान्तरण पंथ को प्राथमिकता दी जाती है, लेकिन [[:en:Nucleophile|न्युक्लेओफ़िलिक]] पंथ के विपरीत, यह CO की अधिकता से बाधित होता है।<ref name="CCR">{{cite journal|last = Cavell|first = K. J.|author-link = Kingsley Cavell|title=धातु-कार्बन बांडों में प्रवासी निवेश पर हालिया मौलिक अध्ययन|journal = [[Coord. Chem. Rev.]]|year = 1996|issue = 11|volume = 155|pages = 209–243|doi = 10.1016/S0010-8545(96)90182-4}}</ref> | ||
[[File:Square Planar.png|thumb|center|800px|एक वर्ग तलीय परिसर का न्यूक्लियोफिलिक सम्मिलन और पुनर्व्यवस्था]] | [[File:Square Planar.png|thumb|center|800px|एक वर्ग तलीय परिसर का न्यूक्लियोफिलिक सम्मिलन और पुनर्व्यवस्था]] | ||
====प्रतिक्रिया दर पर प्रभाव==== | ====प्रतिक्रिया दर पर प्रभाव==== | ||
* [[ | * [[:en:Steric_effects|त्रिविमी प्रभाव]] विकृति - वर्ग योजनाकार संकुल में [[:en:Chelation|केलेशन]] मेरुदंड के त्रिविमी विकृति को बढ़ाना कार्बोनिल और मिथाइल समूहों को एक साथ धकेलता है, जिससे सम्मिलन प्रतिक्रियाओं की प्रतिक्रियाशीलता बढ़ जाती है।<ref name=CCR />* | ||
*[[ | * [[:en:Oxidation_state|ऑक्सीकरण अवस्था]] - धातु के ऑक्सीकरण से सम्मिलन प्रतिक्रिया दर में वृद्धि होती है। तंत्र में मुख्य दर-सीमित कदम मिथाइल समूह का कार्बोनिल लिगैंड पर प्रवास है, एसिटाइल प्रागार पर अधिक आंशिक सकारात्मक प्रभार लगाकर धातु को ऑक्सीकरण करता है, और इस प्रकार प्रतिक्रिया की दर में वृद्धि करता है।<ref name="Brown">{{cite book|title=धातु-कार्बन बंधन का रसायन विज्ञान|volume=2|year=1985|publisher=John Wiley & Sons|first=J.J.|last=Alexander|contribution=Insertions into transition metal-carbon bonds|editor1=Hartley|editor2=Patai|doi=10.1002/9780470771747.ch5}}</ref> | ||
*छोड़ने वाले समूह की [[ | * [[:en:Lewis_acids_and_bases|लुईस अम्ल और क्षार]] - लुईस अम्ल भी प्रतिक्रिया दर में वृद्धि करते हैं, धातु ऑक्सीकरण के समान कारणों से प्रागार पर सकारात्मक प्रभार बढ़ता है। लुईस अम्ल CO ऑक्सीजन से बंधते हैं और प्रभार को हटाते हैं, जिससे प्रागार की इलेक्ट्रोफिलिसिटी बढ़ जाती है। यह प्रतिक्रिया दर को 10<sup>8</sup> तक के कारक से बढ़ा सकता है और बनने वाला संकुल इतना स्थिर है कि धातु से बंधने के लिए अतिरिक्त CO के बिना भी प्रतिक्रिया आगे बढ़ती है।<ref name="Brown" />* | ||
*[[:en:Leaving_group|छोड़ने वाले समूह]] की [[:en:Electronegativity|वैद्युतीयऋणात्मकता]] - छोड़ने वाले अल्काइल समूह की इलेक्ट्रोनगेटिविटी बढ़ने से धातु-कार्बन आबंध पारस्परिक प्रभाव स्थिर हो जाता है और इस प्रकार प्रवास के लिए आवश्यक [[:en:Activation_energy|सक्रियण ऊर्जा]] बढ़ जाती है, जिससे प्रतिक्रिया दर कम हो जाती है।<ref name="Shusterman">{{cite journal|last1 = Shusterman|first1 = A. J.|first2 = I.|last2 = Tamir|first3 = A.|last3 = Pross|title = Organometallic प्रवासन प्रतिक्रियाओं का तंत्र। एक विन्यास मिश्रण (सीएम) दृष्टिकोण|journal = [[J. Organomet. Chem.]]|year = 1988|volume = 340|issue = 2|pages = 203–222|doi = 10.1016/0022-328X(88)80076-7 }}</ref> | |||
[[:en:Trans_effect|विपक्ष-प्रभाव]] एक ऑक्टाहेड्रल या स्क्वायर प्लानर संकुल में संलग्नी उस समूह की प्रतिक्रियाशीलता को प्रभावित करने के लिए जाने जाते हैं जिससे वे विपक्ष होते हैं। इस संलग्नी प्रभाव को अक्सर विपक्ष-प्रभाव के रूप में जाना जाता है, और यह संलग्नी के बीच तीव्रता में भिन्न होता है। विपक्ष-प्रभावित करने वाले संलग्नी की आंशिक सूची इस प्रकार है, उच्चतम विपक्ष-प्रभाव से निम्नतम तक:<ref name="ACR" /> [[:en:Aryl|ऐरिल]], ऐल्किल > NR<sub>3</sub> > PR<sub>3</sub> > AsR<sub>3</sub> > CO> [[:en:Chlorine|Ch]] । अधिक विपक्ष-प्रभाव वाले संलग्नी सक्रिय स्थल को अधिक इलेक्ट्रोफिलिसिटी प्रदान करते हैं। CO समूह की इलेक्ट्रोफिलिसिटी को बढ़ाना प्रयोगात्मक रूप से प्रतिक्रिया दर को बढ़ाने के लिए दिखाया गया है, जबकि मिथाइल समूह की इलेक्ट्रोफिलिसिटी कम होने से प्रतिक्रिया दर थोड़ी बढ़ जाती है। यह एक स्क्वायर प्लानर [(pn) m (CO) (Ch<sub>3</sub>)] पर प्रतिक्रिया करके CO के साथ संकुल प्रदर्शित किया जा सकता है , जहां PN एक [[:en:Denticity|द्विदंती]] फॉस्फोरस- या भूयाति-विवश संलग्नी है। यह प्रतिक्रिया बहुत अधिक उपज में आगे बढ़ती है जब मिथाइल समूह विपक्ष-P और CO विपक्ष-N होता है, जो कि अधिक विद्युतीय नाइट्रोजन के उच्च विपक्ष-प्रभाव के कारण होता है।<ref name="CCR" /> | |||
=== रिवर्स रिएक्शन === | === रिवर्स रिएक्शन === | ||
[[ एल्डीहाइड ]] का [[ डीकार्बोनाइलेशन ]], CO सम्मिलन के विपरीत, एक अच्छी तरह से मान्यता प्राप्त प्रतिक्रिया है: | [[:en:Aldehyde|एल्डीहाइड]] का [[:en:Decarbonylation|डीकार्बोनाइलेशन]] , CO सम्मिलन के विपरीत, एक अच्छी तरह से मान्यता प्राप्त प्रतिक्रिया है: | ||
:RCHO → RH + CO | :RCHO → RH + CO | ||
प्रतिक्रिया का व्यापक रूप से खंड में अभ्यास नहीं किया जाता है क्योंकि [[ | प्रतिक्रिया का व्यापक रूप से खंड में अभ्यास नहीं किया जाता है क्योंकि [[:en:Alkanes|एलकेन]] एल्डिहाइड अग्रदूतों की तुलना में कम उपयोगी सामग्री हैं। इसके अलावा, प्रतिक्रिया अक्सर उत्प्रेरक रूप से आयोजित नहीं की जाती है क्योंकि बहिर्वेधित CO अलग करने के लिए धीमा हो सकता है।<ref>{{cite journal | last1 = Fristrup | first1 = Peter | last2 = Kreis | first2 = Michael | last3 = Palmelund | first3 = Anders | last4 = Norrby | first4 = Per-Ola | last5 = Madsen | first5 = Robert | year = 2008 | title = एल्डिहाइड के रोडियम-उत्प्रेरित डीकार्बोनाइलेशन के लिए तंत्र: एक संयुक्त प्रायोगिक और सैद्धांतिक अध्ययन| journal = [[J. Am. Chem. Soc.]] | volume = 130 | issue = 15| pages = 5206–5215 | doi = 10.1021/ja710270j | pmid = 18303836 }}</ref> कार्बनिक एल्डिहाइड से CO का निष्कासन सबसे प्रसिद्ध रूप से [[:en:Wilkinson's_catalyst|विल्किंसन के उत्प्रेरक]] का उपयोग करके प्रदर्शित किया जाता है:<ref name="OHNO">{{cite journal|last1 = Ohno|first1 = K.|first2 = J.|last2 = Tsuji|title = महान धातु यौगिकों के माध्यम से कार्बनिक संश्लेषण। XXXV. रोडियम कॉम्प्लेक्स का उपयोग करते हुए एल्डिहाइड और एसाइल हैलाइड्स की उपन्यास डीकार्बोनाइलेशन प्रतिक्रियाएं|journal = [[J. Am. Chem. Soc.]]|year = 1968|volume = 90|issue = 1|pages = 99–107|doi = 10.1021/ja01003a018}}</ref> | ||
:RhCl(PPh<sub>3</sub>)<sub>3</sub> + RCHO → RhCl(CO)(PPh<sub>3</sub>)<sub>2</sub> + Rh + PPh<sub>3</sub> | :RhCl(PPh<sub>3</sub>)<sub>3</sub> + RCHO → RhCl(CO)(PPh<sub>3</sub>)<sub>2</sub> + Rh + PPh<sub>3</sub> | ||
संश्लेषण में इस प्राथमिक कार्बधात्विक चरण के उदाहरण के लिए कृपया [[ सूजी-विल्किन्सन डीकार्बोनाइलेशन रिएक्शन ]] देखें। | संश्लेषण में इस प्राथमिक कार्बधात्विक चरण के उदाहरण के लिए कृपया [[:en:Tsuji–Wilkinson_decarbonylation_reaction|सूजी-विल्किन्सन डीकार्बोनाइलेशन रिएक्शन]] देखें। | ||
=== अन्य ऑक्साइड का सम्मिलन === | === अन्य ऑक्साइड का सम्मिलन === | ||
कई इलेक्ट्रॉनरागी ऑक्साइड धातु कार्बन आबंध में सम्मिलित होते हैं; इनमें [[ सल्फर डाइऑक्साइड ]], [[ कार्बन डाइआक्साइड ]] और नाइट्रिक ऑक्साइड | कई इलेक्ट्रॉनरागी ऑक्साइड धातु कार्बन आबंध में सम्मिलित होते हैं; इनमें [[:en:Sulfur_dioxide|सल्फर डाइऑक्साइड]] , [[ कार्बन डाइआक्साइड ]] और नाइट्रिक ऑक्साइड सम्मिलित हैं। इन प्रतिक्रियाओं का सीमित या कोई व्यावहारिक महत्व नहीं है, लेकिन ये ऐतिहासिक रुचि के हैं। संक्रमण धातु एल्काइल के साथ, ये ऑक्साइड इलेक्ट्रोफाइल के रूप में व्यवहार करते हैं और धातुओं और उनके अपेक्षाकृत नाभिकरागी अल्काइल संलग्नी के बीच बंधन में सम्मिलित होते हैं। जैसा कि [[:en:Metal_sulfur_dioxide_complex|धातु सल्फर डाइऑक्साइड परिसर]] पर लेख में चर्चा की गई है, SO<sub>2</sub> का अंतर्वेशन की विशेष रूप से जांच की गई है। SO<sub>2</sub> धातु केंद्र के आधार पर O-सल्फोनेट और S-सल्फोनेट दोनों देने के लिए सम्मिलित होता है।<ref name="DMA">{{cite book|author1=Douglas|author2=McDaniel|author3=Alexander|title=अकार्बनिक रसायन विज्ञान की अवधारणाएं और मॉडल|edition=3rd|year=1994|publisher=John Wiley & Sons, Inc.|isbn=978-0-471-62978-8}}</ref> स्क्वायर प्लानर एल्किल परिसरों के साथ, एक पूर्व-संतुलन माना जाता है जिसमें एक जोड़ का गठन होता है।<ref name="Puddephatt">{{cite journal|last=Puddephatt|first=R.A.|author2=Stalteri, M.A.|title=मिथाइल- या फिनाइल- ट्रांजिशन मेटल बॉन्ड में सल्फर डाइऑक्साइड के सम्मिलन के बीच प्रतिस्पर्धा|journal=Journal of Organometallic Chemistry|year=1980|volume=193|pages=C27–C29|doi=10.1016/S0022-328X(00)86091-X}}</ref> | ||
== धातु-कार्बन बंधों में एल्केन्स का सम्मिलन == | == धातु-कार्बन बंधों में एल्केन्स का सम्मिलन == | ||
धातु-कार्बन दोनों में एल्केन्स का सम्मिलन महत्वपूर्ण है। टाइटेनियम एल्काइल में एथिलीन और प्रोपलीन का सम्मिलन ज़िग्लर-नाट्टा कटैलिसीस की आधारशिला है, जो पॉलीइथाइलीन और पॉलीप्रोपाइलीन का मुख्य स्रोत है। इस तकनीक के बहुमत में विषम उत्प्रेरक | धातु-कार्बन दोनों में [[:en:Alkene|एल्केन्स]] का सम्मिलन महत्वपूर्ण है। टाइटेनियम एल्काइल में एथिलीन और प्रोपलीन का सम्मिलन [[:en:Ziegler–Natta_catalyst|ज़िग्लर-नाट्टा कटैलिसीस]] की आधारशिला है, जो पॉलीइथाइलीन और पॉलीप्रोपाइलीन का मुख्य स्रोत है। इस तकनीक के बहुमत में विषम उत्प्रेरक सम्मिलित हैं, लेकिन यह व्यापक रूप से माना जाता है कि सजातीय प्रणालियों पर सिद्धांत और अवलोकन ठोस-राज्य संस्करणों पर लागू होते हैं। संबंधित तकनीकों में [[:en:Shell_higher_olefin_process|शेल हायर ओलेफ़िन]] प्रक्रिया सम्मिलित है जो [[:en:Detergent|प्रक्षालक]] पूर्ववर्तियों का उत्पादन करती है। | ||
:[[File:AlkeneInsMech'.png|thumb | :[[File:AlkeneInsMech'.png|thumb|एल्किन पोलीमराइजेशन में कदम। चरण I में मोनोमर को धातु से बांधना सम्मिलित है और चरण ii में प्रवासी सम्मिलन चरण सम्मिलित है। ये चरण, जो धातु केंद्र के एक तरफ से दूसरी तरफ वैकल्पिक होते हैं, प्रत्येक बहुलक श्रृंखला के लिए कई बार दोहराए जाते हैं। बॉक्स एक खाली (या अत्यंत प्रयोगशाला) समन्वय स्थल का प्रतिनिधित्व करता है।]] | ||
=== तंत्र === | === तंत्र === | ||
ओलेफिन सम्मिलन की दर को प्रभावित करने वाले कारकों में धातु और ओलेफिन प्रंगार के बीच एक बंधन के प्रारंभिक गठन को | ओलेफिन सम्मिलन की दर को प्रभावित करने वाले कारकों में धातु और ओलेफिन प्रंगार के बीच एक बंधन के प्रारंभिक गठन को सम्मिलित करते हुए चक्रीय, तलीय, चार-केंद्र संक्रमण राज्य का गठन संलिप्त है। इस संक्रमण अवस्था से, यह देखा जा सकता है कि आंशिक धनात्मक आवेश β-प्रंगार पर बनता है और आंशिक ऋणात्मक आवेश प्रंगार पर बनता है जो प्रारंभ में धातु से बंधा होता है। यह ध्रुवीकरण ऋणात्मक रूप से आवेशित कार्बन/हाइड्रोजन और धनात्मक रूप से आवेशित β-कार्बन के साथ-साथ धातु-α-कार्बन बंधन के एक साथ गठन के बीच बाद में देखे गए बंधन की व्याख्या करता है। यह संक्रमण अवस्था उन दो कारकों पर भी प्रकाश डालती है जो ओलेफिन सम्मिलन प्रतिक्रियाओं की दर में सबसे अधिक योगदान करते हैं: (i) प्रारंभिक रूप से धातु से जुड़े एल्काइल समूह का कक्षीय ओवरलैप और (ii) धातु-अल्काइल बंधन की ताकत। आंशिक रूप से सकारात्मक β-प्रंगार और आंशिक रूप से नकारात्मक हाइड्रोजन/एल्काइल समूह प्रंगार के बीच अधिक कक्षीय अतिव्यापन के साथ, नए CC बांड के गठन की सुविधा है। धातु-अल्काइल बंधन की बढ़ती ताकत के साथ, α-कार्बन और β-प्रंगार (क्रमशः) के साथ दो नए बंधन बनाने के लिए धातु और हाइड्रोजन/अल्काइल प्रंगार बंधन के बीच बंधन का टूटना धीमा है, इस प्रकार सम्मिलन प्रतिक्रिया की दर कम हो रही है।<ref name="Burger et al.">{{cite journal|last1=Burger|first1=B. J.|last2=Thompson|first2=M. E.|last3=Cotter|first3=W. D.|last4=Bercaw|first4=J. E.|author-link4=John E. Bercaw|title=एथिलीन सम्मिलन और β-हाइड्रोजन उन्मूलन Permethylscandocene Alkyl परिसरों के लिए। एथिलीन के ज़िग्लर-नट्टा पॉलीमराइज़ेशन में श्रृंखला प्रसार और समाप्ति चरणों का एक अध्ययन|journal=[[J. Am. Chem. Soc.]]|year=1990|issue=4|volume=112|pages=1566–1577|doi=10.1021/ja00160a041}}</ref> | ||
== एम-एच बांड में एल्केन्स का सम्मिलन == | == एम-एच बांड में एल्केन्स का सम्मिलन == | ||
धातु-हाइड्रोजन बंधों में एल्केन्स का सम्मिलन [[ हाइड्रोजनीकरण ]] और [[ हाइड्रोफॉर्माइलेशन ]] प्रतिक्रियाओं में एक महत्वपूर्ण कदम है। प्रतिक्रिया में उत्प्रेरक के समन्वय क्षेत्र के भीतर संयोजन करने वाले अल्कीन और हाइड्राइड संलग्नी | धातु-हाइड्रोजन बंधों में एल्केन्स का सम्मिलन [[:en:Hydrogenation|हाइड्रोजनीकरण]] और [[:en:Hydroformylation|हाइड्रोफॉर्माइलेशन]] प्रतिक्रियाओं में एक महत्वपूर्ण कदम है। प्रतिक्रिया में उत्प्रेरक के समन्वय क्षेत्र के भीतर संयोजन करने वाले अल्कीन और हाइड्राइड संलग्नी सम्मिलित होते हैं। हाइड्रोजनीकरण में, परिणामी एल्काइल संलग्नी एक दूसरे हाइड्राइड के साथ मिलकर एल्केन देता है। एल्काइन्स के हाइड्रोजनीकरण पर अनुरूप प्रतिक्रियाएं लागू होती हैं: एक एल्केनाइल संलग्नी एक एल्केन को खत्म करने के लिए एक हाइड्राइड के साथ जुड़ती है। | ||
[[File:Beta-hydrideElim&TS.png|thumb|center|600px|धातु हाइड्राइड में एल्केन का प्रवासी सम्मिलन। मध्य छवि संक्रमण अवस्था को दर्शाती है। ध्यान दें कि कम प्रतिस्थापित कार्बन धातु से बंध जाता है, कम से कम आमतौर पर। रिवर्स रिएक्शन को बीटा-हाइड्राइड एलिमिनेशन कहा जाता है।]] | [[File:Beta-hydrideElim&TS.png|thumb|center|600px|धातु हाइड्राइड में एल्केन का प्रवासी सम्मिलन। मध्य छवि संक्रमण अवस्था को दर्शाती है। ध्यान दें कि कम प्रतिस्थापित कार्बन धातु से बंध जाता है, कम से कम आमतौर पर। रिवर्स रिएक्शन को बीटा-हाइड्राइड एलिमिनेशन कहा जाता है।]] | ||
=== तंत्र === | === तंत्र === | ||
तंत्र के संदर्भ में, M-H आबंध में और M-C आबंध में एल्केन्स के सम्मिलन को इसी तरह वर्णित किया गया है। दोनों में चार-सदस्यीय संक्रमण राज्य | तंत्र के संदर्भ में, M-H आबंध में और M-C आबंध में एल्केन्स के सम्मिलन को इसी तरह वर्णित किया गया है। दोनों में चार-सदस्यीय संक्रमण राज्य सम्मिलित हैं जो धातु पर कम प्रतिस्थापित प्रंगार रखते हैं। | ||
धातु-हाइड्रोजन बंधन में ओलेफिन सम्मिलन का उल्टा बीटा उन्मूलन | β-हाइड्राइड उन्मूलन है। सूक्ष्म उत्क्रमणीयता के सिद्धांत के लिए आवश्यक है कि β-हाइड्राइड उन्मूलन की क्रियाविधि धातु हाइड्राइड बंधों में एल्केन्स के सम्मिलन के समान मार्ग का अनुसरण करे। β-हाइड्राइड उन्मूलन के लिए पहली आवश्यकता धातु के संबंध में β की स्थिति में हाइड्रोजन की उपस्थिति है। β-उन्मूलन के लिए धातु पर एक रिक्त समन्वय स्थिति की आवश्यकता होती है जो कि अमूर्त हाइड्रोजन को समायोजित करेगी।<ref name=Crabtree>{{cite book|title = संक्रमण धातुओं की ऑर्गेनोमेटेलिक रसायन विज्ञान|last= Crabtree|first= R. H.|author-link = Robert H. Crabtree|page = 192|isbn = 978-0-470-25762-3|publisher = [[John Wiley and Sons]]|year = 2009}}</ref> | धातु-हाइड्रोजन बंधन में ओलेफिन सम्मिलन का उल्टा बीटा उन्मूलन | [[:en:Beta-Hydride_elimination|β-हाइड्राइड उन्मूलन]] है। [[:en:Microscopic_reversibility|सूक्ष्म उत्क्रमणीयता के सिद्धांत]] के लिए आवश्यक है कि β-हाइड्राइड उन्मूलन की क्रियाविधि धातु हाइड्राइड बंधों में एल्केन्स के सम्मिलन के समान मार्ग का अनुसरण करे। β-हाइड्राइड उन्मूलन के लिए पहली आवश्यकता धातु के संबंध में β की स्थिति में हाइड्रोजन की उपस्थिति है। β-उन्मूलन के लिए धातु पर एक रिक्त समन्वय स्थिति की आवश्यकता होती है जो कि अमूर्त हाइड्रोजन को समायोजित करेगी।<ref name=Crabtree>{{cite book|title = संक्रमण धातुओं की ऑर्गेनोमेटेलिक रसायन विज्ञान|last= Crabtree|first= R. H.|author-link = Robert H. Crabtree|page = 192|isbn = 978-0-470-25762-3|publisher = [[John Wiley and Sons]]|year = 2009}}</ref> | ||
| Line 60: | Line 62: | ||
=== कार्बोनिलेशन === | === कार्बोनिलेशन === | ||
कार्बोनिल समूहों के प्रवासी सम्मिलन के दो व्यापक रूप से नियोजित अनुप्रयोग हाइड्रोफॉर्माइलेशन और [[ मेथनॉल ]] के कार्बोनिलेशन द्वारा [[ सिरका अम्ल ]] का उत्पादन करते हैं। पूर्व एल्केन्स, हाइड्रोजन और कार्बन मोनोऑक्साइड को एल्डिहाइड में परिवर्तित करते हैं। कार्बोनिलाइजेशन द्वारा एसिटिक एसिड का उत्पादन दो समान औद्योगिक प्रक्रियाओं के माध्यम से होता है। अधिक पारंपरिक [[ | कार्बोनिल समूहों के प्रवासी सम्मिलन के दो व्यापक रूप से नियोजित अनुप्रयोग [[हाइड्रोफॉर्माइलेशन]] और [[:en:Methanol|मेथनॉल]] के [[:en:Methanol|कार्बोनिलेशन]] द्वारा [[:en:Acetic_acid|सिरका अम्ल]] का उत्पादन करते हैं। पूर्व एल्केन्स, हाइड्रोजन और कार्बन मोनोऑक्साइड को एल्डिहाइड में परिवर्तित करते हैं। कार्बोनिलाइजेशन द्वारा एसिटिक एसिड का उत्पादन दो समान औद्योगिक प्रक्रियाओं के माध्यम से होता है। अधिक पारंपरिक [[:en:Monsanto_process|मोनसेंटो प्रक्रिया]] है, जो मेथनॉल को एसिटिक एसिड में बदलने के लिए रोडियम-आयोडीन उत्प्रेरक पर निर्भर करती है। इस प्रक्रिया को [[:en:Cativa_process|कैटिवा प्रक्रिया]] द्वारा हटा दिया गया है जो एक संबंधित इरिडियम उत्प्रेरक का उपयोग करता है, [Ir (CO)<sub>2</sub>I<sub>2</sub>]<sup>-</sup> (1)।<ref name="Cativa">{{cite journal |title =एसिटिक एसिड के निर्माण के लिए कैटिवा प्रक्रिया|last1 = Jones |first1 = Jane H. |journal = [[Platinum Metals Review]] |year = 2000 |volume = 44|issue = 3|pages = 94–105 |url=https://technology.matthey.com/article/44/3/94-105/ }}</ref><ref>{{cite journal|title = इरिडियम का उपयोग कर उच्च उत्पादकता मेथनॉल कार्बोनिलेशन कटैलिसीस - एसिटिक एसिड के निर्माण के लिए कैटिवा प्रक्रिया|author1 = Sunley, G. J.|author2 = Watson, D. J.|journal = Catalysis Today|year = 2000|volume = 58|issue = 4|pages = 293–307|doi = 10.1016/S0920-5861(00)00263-7}}</ref> 2002 तक, दुनिया भर में एसिटिक एसिड का वार्षिक उत्पादन 6 मिलियन टन था, जिसमें से लगभग 60% कैटिवा प्रक्रिया द्वारा उत्पादित किया जाता है।<ref name = "Cativa" /> | ||
:[[File:Cativa-process-catalytic-cycle.png|center|400px|कैटिवा प्रक्रिया का उत्प्रेरक चक्र]]ऊपर दिखाए गए कैटिवा प्रक्रिया [[ उत्प्रेरक चक्र ]] में सम्मिलन और De-सम्मिलन दोनों चरण | :[[File:Cativa-process-catalytic-cycle.png|center|400px|कैटिवा प्रक्रिया का उत्प्रेरक चक्र]]ऊपर दिखाए गए कैटिवा प्रक्रिया [[:en:Catalytic_cycle|उत्प्रेरक चक्र]] में सम्मिलन और De-सम्मिलन दोनों चरण सम्मिलित हैं। (1) के साथ [[:en:Iodomethane|मिथाइल आयोडाइड]] की ऑक्सीडेटिव अतिरिक्त प्रतिक्रिया में कार्बन-आयोडीन बंधन में इरिडियम (आई) केंद्र का औपचारिक सम्मिलन सम्मिलित है, जबकि चरण (3) से (4) कार्बन मोनोऑक्साइड के प्रवासी सम्मिलन का एक उदाहरण है इरिडियम -कार्बन बंधन। सक्रिय उत्प्रेरक प्रजाति (4) से [[:en:Acetyl_iodide|एसिटाइल आयोडाइड]] के अपचायक उन्मूलन द्वारा पुन: उत्पन्न होती है, एक D-सम्मिलन प्रतिक्रिया।<ref name = "Cativa" /> | ||
=== एल्केन पोलीमराइजेशन === | === एल्केन पोलीमराइजेशन === | ||
एल्केन सम्मिलन के औद्योगिक अनुप्रयोगों में पॉलीइथाइलीन और पॉलीप्रोपाइलीन के लिए धातु-उत्प्रेरित मार्ग | एल्केन सम्मिलन के औद्योगिक अनुप्रयोगों में पॉलीइथाइलीन और पॉलीप्रोपाइलीन के लिए धातु-उत्प्रेरित मार्ग सम्मिलित हैं। आमतौर पर ये रूपांतरण टाइटेनियम ट्राइक्लोराइड द्वारा [[ विषम उत्प्रेरण |विषम उत्प्रेरण]] होते हैं जो एल्यूमीनियम एल्काइल द्वारा सक्रिय होते हैं। इस तकनीक को ज़िग्लर-नट्टा उत्प्रेरक के रूप में जाना जाता है।<ref>{{cite book|last = Kissin|first = Y. V.|title = संक्रमण धातु उत्प्रेरक के साथ अल्कीन पोलीमराइजेशन प्रतिक्रियाएं|publisher = [[Elsevier]]|location = Amsterdam|year = 2008|pages = 207–290|chapter = Synthesis, Chemical Composition, and Structure of Transition Metal Components and Cocatalysts in Catalyst Systems for Alkene Polymerization|isbn = 978-0-444-53215-2|chapter-url = https://books.google.com/books?id=JjhZiJEY5FsC&q=Alkene+Polymerization+Reactions+with+Transition+Metal+Catalysts&pg=PA207}}</ref> इन प्रतिक्रियाओं में, एथिलीन टाइटेनियम धातु के साथ समन्वय करता है और उसके बाद उसका सम्मिलन होता है। इन चरणों को कई बार दोहराया जा सकता है, संभावित रूप से उच्च आणविक भार बहुलक की ओर अग्रसर होता है। | ||
==संदर्भ== | ==संदर्भ== | ||
<references/> | <references/> | ||
==बाहरी संबंध== | ==बाहरी संबंध== | ||
*[https://web.archive.org/web/20040913062538/http://chemistry.lsu.edu/stanley/webpub/4571-chap13-Migratory-Insertion.pdf Migratory Insertion] | *[https://web.archive.org/web/20040913062538/http://chemistry.lsu.edu/stanley/webpub/4571-chap13-Migratory-Insertion.pdf Migratory Insertion] | ||
| Line 89: | Line 78: | ||
*[http://goldbook.iupac.org/goldbook/M03924.html Migratory insertion] | *[http://goldbook.iupac.org/goldbook/M03924.html Migratory insertion] | ||
{{DEFAULTSORT:Migratory Insertion}} | {{DEFAULTSORT:Migratory Insertion}} | ||
[[Category: | [[Category:Articles with hatnote templates targeting a nonexistent page|Migratory Insertion]] | ||
[[Category:Created On 20/10/2022]] | [[Category:Articles with short description|Migratory Insertion]] | ||
[[Category:Created On 20/10/2022|Migratory Insertion]] | |||
[[Category:Machine Translated Page|Migratory Insertion]] | |||
[[Category:Pages that use a deprecated format of the chem tags|Migratory Insertion]] | |||
[[Category:Short description with empty Wikidata description|Migratory Insertion]] | |||
[[Category:ऑर्गेनोमेटेलिक केमिस्ट्री|Migratory Insertion]] | |||
[[Category:प्रतिक्रिया तंत्र|Migratory Insertion]] | |||
Latest revision as of 10:27, 22 November 2022
कार्बधात्विक रसायन विज्ञान में, एक प्रवासी सम्मिलन एक प्रकार की रासायनिक प्रतिक्रिया है जिसमें एक धातु परिसर पर दो संलग्नी का गठबंधन होता है। यह प्रतिक्रियाओं का एक उपसमुच्चय है जो सम्मिलन प्रतिक्रियाओं से बहुत मिलता-जुलता है, और दोनों को प्रतिक्रिया तंत्र द्वारा विभेदित किया जाता है जो उत्पादों के परिणामी त्रिविम की ओर जाता है। तथापि, प्रायः दोनों का परस्पर उपयोग किया जाता है क्योंकि तंत्र कभी-कभी अज्ञात होता है। इसलिए, प्रवासी सम्मिलन प्रतिक्रियाएं या सम्मिलन प्रतिक्रियाएं, संक्षेप में, तंत्र द्वारा नहीं बल्कि समग्र रीजियोकेमिस्ट्री द्वारा परिभाषित की जाती हैं, जिसमें एक रासायनिक इकाई खुद को दूसरे रासायनिक इकाई के मौजूदा रासायनिक बंधन में अंतरस्थापित करती है जैसे:[1] :
अवलोकन
प्रवासी सम्मिलन में, एक संलग्नी जिसे आयनों (X) संलग्नी के रूप में देखा जाता है और एक संलग्नी जिसे तटस्थ कण जोड़े के रूप में देखा जाता है, जो एक नया आयनिक संलग्नी उत्पन्न करता है। प्रतिक्रिया करने वाले आयन और तटस्थ संलग्नी आसन्न हैं। यदि पूर्ववर्ती (रसायन विज्ञान) परिसर समन्वित रूप से संतृप्त है, तो प्रवासी सम्मिलन का परिणाम अक्सर समन्वित रूप से असंतृप्त उत्पाद होता है। नया (तटस्थ) संलग्नी फिर धातु के साथ प्रतिक्रिया कर सकता है जिससे आगे सम्मिलन हो सकता है। यह प्रक्रिया एक ही धातु पर कई बार हो सकती है, जैसे ओलेफिन पोलीमराइजेशन में।
आयनिक संलग्नी हो सकता है: H- ( हाइड्राइड ), R- (alkyl), एसाइल , Ar− (आर्यल), या OR- (एल्कोक्साइड)। इन समूहों की प्रवास करने की क्षमता को उनकी प्रवासी योग्यता कहा जाता है। तटस्थ लिगैंड CO, अल्काइन ,ऐल्कीन या कुछ मामलों में कार्बाइन भी हो सकता है।
प्रवासी सम्मिलन पर विविध प्रतिक्रियाएं लागू होती हैं। एक तंत्र में तटस्थ संलग्नी के वैद्युतकणसंचलन भाग पर आयनिक संलग्नी का आक्रामक लिप्त है (आयनिक संलग्नी तटस्थ संलग्नी में विस्थापित होता है)। अन्य तंत्र में धातु और आयनिक संलग्नी के बीच तटस्थ संलग्नी सम्मिलित होता है।
CO सम्मिलन
एसाइल समूह बनाने के लिए धातु-कार्बन बंधन में कार्बन मोनोआक्साइड का सम्मिलन कार्बोनाइलीकरण प्रतिक्रियाओं का आधार है, जो कई व्यावसायिक रूप से उपयोगी उत्पाद प्रदान करता है।
तंत्र
CO प्रवासी सम्मिलन के माध्यम से धातु-अल्काइल बंधन में प्रवेश करता है। मुख्य अवधारणा यह है कि CO और एल्काइल समूह दोनों एक ही धातु पर संलग्नी हैं। उदाहरण के लिए, 13CO संग Mn(CO)5CH3 की प्रतिक्रिया विशेष रूप से Mn(CO)4(13CO)COCH3 बनाती है। अल्काइल समूह Mn (I) केंद्र के समन्वय क्षेत्र के भीतर एक निकटवर्ती CO संलग्नी में इंट्रामोलेक्युलर रूप से स्थानांतरित होता है। प्रवास के बाद, धातु मुक्त CO को बांधती है (नीचे चित्र देखें)।[2][3]
- CO सम्मिलन में हमेशा स्थानान्तरण अन्तर्वलित नहीं होता है। CpFe(L)(CO)CH3 की 13CO, के साथ अभिक्रिया एल्काइल प्रवास उत्पाद और मिथाइल समूह में बाउंड कार्बोनिल्स के सही सम्मिलन से बनने वाले उत्पाद, दोनों का मिश्रण देता है। उत्पाद वितरण विलायक की पसंद से प्रभावित होता है।[4]
स्क्वायर प्लानर आणविक ज्यामिति के अल्काइल व्युत्पादित विशेष रूप से आसानी से CO सम्मिलन से गुजरते हैं। वर्ग तलीय परिसरों पर सम्मिलन प्रतिक्रियाएं उनके औद्योगिक अनुप्रयोगों के कारण विशेष रुचि रखती हैं। चूँकि वर्गाकार तलीय संकुल प्रायः समन्वयात्मक रूप से असंतृप्त होते हैं, वे 5-निर्देशांक व्यसनों के निर्माण के लिए अतिसंवेदनशील होते हैं, जो आसानी से प्रवासी सम्मिलन अनुभव करते हैं।[4] अधिकतम मामलों में इन-प्लेन स्थानान्तरण पंथ को प्राथमिकता दी जाती है, लेकिन न्युक्लेओफ़िलिक पंथ के विपरीत, यह CO की अधिकता से बाधित होता है।[5]
प्रतिक्रिया दर पर प्रभाव
- त्रिविमी प्रभाव विकृति - वर्ग योजनाकार संकुल में केलेशन मेरुदंड के त्रिविमी विकृति को बढ़ाना कार्बोनिल और मिथाइल समूहों को एक साथ धकेलता है, जिससे सम्मिलन प्रतिक्रियाओं की प्रतिक्रियाशीलता बढ़ जाती है।[5]*
- ऑक्सीकरण अवस्था - धातु के ऑक्सीकरण से सम्मिलन प्रतिक्रिया दर में वृद्धि होती है। तंत्र में मुख्य दर-सीमित कदम मिथाइल समूह का कार्बोनिल लिगैंड पर प्रवास है, एसिटाइल प्रागार पर अधिक आंशिक सकारात्मक प्रभार लगाकर धातु को ऑक्सीकरण करता है, और इस प्रकार प्रतिक्रिया की दर में वृद्धि करता है।[6]
- लुईस अम्ल और क्षार - लुईस अम्ल भी प्रतिक्रिया दर में वृद्धि करते हैं, धातु ऑक्सीकरण के समान कारणों से प्रागार पर सकारात्मक प्रभार बढ़ता है। लुईस अम्ल CO ऑक्सीजन से बंधते हैं और प्रभार को हटाते हैं, जिससे प्रागार की इलेक्ट्रोफिलिसिटी बढ़ जाती है। यह प्रतिक्रिया दर को 108 तक के कारक से बढ़ा सकता है और बनने वाला संकुल इतना स्थिर है कि धातु से बंधने के लिए अतिरिक्त CO के बिना भी प्रतिक्रिया आगे बढ़ती है।[6]*
- छोड़ने वाले समूह की वैद्युतीयऋणात्मकता - छोड़ने वाले अल्काइल समूह की इलेक्ट्रोनगेटिविटी बढ़ने से धातु-कार्बन आबंध पारस्परिक प्रभाव स्थिर हो जाता है और इस प्रकार प्रवास के लिए आवश्यक सक्रियण ऊर्जा बढ़ जाती है, जिससे प्रतिक्रिया दर कम हो जाती है।[7]
विपक्ष-प्रभाव एक ऑक्टाहेड्रल या स्क्वायर प्लानर संकुल में संलग्नी उस समूह की प्रतिक्रियाशीलता को प्रभावित करने के लिए जाने जाते हैं जिससे वे विपक्ष होते हैं। इस संलग्नी प्रभाव को अक्सर विपक्ष-प्रभाव के रूप में जाना जाता है, और यह संलग्नी के बीच तीव्रता में भिन्न होता है। विपक्ष-प्रभावित करने वाले संलग्नी की आंशिक सूची इस प्रकार है, उच्चतम विपक्ष-प्रभाव से निम्नतम तक:[4] ऐरिल, ऐल्किल > NR3 > PR3 > AsR3 > CO> Ch । अधिक विपक्ष-प्रभाव वाले संलग्नी सक्रिय स्थल को अधिक इलेक्ट्रोफिलिसिटी प्रदान करते हैं। CO समूह की इलेक्ट्रोफिलिसिटी को बढ़ाना प्रयोगात्मक रूप से प्रतिक्रिया दर को बढ़ाने के लिए दिखाया गया है, जबकि मिथाइल समूह की इलेक्ट्रोफिलिसिटी कम होने से प्रतिक्रिया दर थोड़ी बढ़ जाती है। यह एक स्क्वायर प्लानर [(pn) m (CO) (Ch3)] पर प्रतिक्रिया करके CO के साथ संकुल प्रदर्शित किया जा सकता है , जहां PN एक द्विदंती फॉस्फोरस- या भूयाति-विवश संलग्नी है। यह प्रतिक्रिया बहुत अधिक उपज में आगे बढ़ती है जब मिथाइल समूह विपक्ष-P और CO विपक्ष-N होता है, जो कि अधिक विद्युतीय नाइट्रोजन के उच्च विपक्ष-प्रभाव के कारण होता है।[5]
रिवर्स रिएक्शन
एल्डीहाइड का डीकार्बोनाइलेशन , CO सम्मिलन के विपरीत, एक अच्छी तरह से मान्यता प्राप्त प्रतिक्रिया है:
- RCHO → RH + CO
प्रतिक्रिया का व्यापक रूप से खंड में अभ्यास नहीं किया जाता है क्योंकि एलकेन एल्डिहाइड अग्रदूतों की तुलना में कम उपयोगी सामग्री हैं। इसके अलावा, प्रतिक्रिया अक्सर उत्प्रेरक रूप से आयोजित नहीं की जाती है क्योंकि बहिर्वेधित CO अलग करने के लिए धीमा हो सकता है।[8] कार्बनिक एल्डिहाइड से CO का निष्कासन सबसे प्रसिद्ध रूप से विल्किंसन के उत्प्रेरक का उपयोग करके प्रदर्शित किया जाता है:[9]
- RhCl(PPh3)3 + RCHO → RhCl(CO)(PPh3)2 + Rh + PPh3
संश्लेषण में इस प्राथमिक कार्बधात्विक चरण के उदाहरण के लिए कृपया सूजी-विल्किन्सन डीकार्बोनाइलेशन रिएक्शन देखें।
अन्य ऑक्साइड का सम्मिलन
कई इलेक्ट्रॉनरागी ऑक्साइड धातु कार्बन आबंध में सम्मिलित होते हैं; इनमें सल्फर डाइऑक्साइड , कार्बन डाइआक्साइड और नाइट्रिक ऑक्साइड सम्मिलित हैं। इन प्रतिक्रियाओं का सीमित या कोई व्यावहारिक महत्व नहीं है, लेकिन ये ऐतिहासिक रुचि के हैं। संक्रमण धातु एल्काइल के साथ, ये ऑक्साइड इलेक्ट्रोफाइल के रूप में व्यवहार करते हैं और धातुओं और उनके अपेक्षाकृत नाभिकरागी अल्काइल संलग्नी के बीच बंधन में सम्मिलित होते हैं। जैसा कि धातु सल्फर डाइऑक्साइड परिसर पर लेख में चर्चा की गई है, SO2 का अंतर्वेशन की विशेष रूप से जांच की गई है। SO2 धातु केंद्र के आधार पर O-सल्फोनेट और S-सल्फोनेट दोनों देने के लिए सम्मिलित होता है।[10] स्क्वायर प्लानर एल्किल परिसरों के साथ, एक पूर्व-संतुलन माना जाता है जिसमें एक जोड़ का गठन होता है।[11]
धातु-कार्बन बंधों में एल्केन्स का सम्मिलन
धातु-कार्बन दोनों में एल्केन्स का सम्मिलन महत्वपूर्ण है। टाइटेनियम एल्काइल में एथिलीन और प्रोपलीन का सम्मिलन ज़िग्लर-नाट्टा कटैलिसीस की आधारशिला है, जो पॉलीइथाइलीन और पॉलीप्रोपाइलीन का मुख्य स्रोत है। इस तकनीक के बहुमत में विषम उत्प्रेरक सम्मिलित हैं, लेकिन यह व्यापक रूप से माना जाता है कि सजातीय प्रणालियों पर सिद्धांत और अवलोकन ठोस-राज्य संस्करणों पर लागू होते हैं। संबंधित तकनीकों में शेल हायर ओलेफ़िन प्रक्रिया सम्मिलित है जो प्रक्षालक पूर्ववर्तियों का उत्पादन करती है।
 एल्किन पोलीमराइजेशन में कदम। चरण I में मोनोमर को धातु से बांधना सम्मिलित है और चरण ii में प्रवासी सम्मिलन चरण सम्मिलित है। ये चरण, जो धातु केंद्र के एक तरफ से दूसरी तरफ वैकल्पिक होते हैं, प्रत्येक बहुलक श्रृंखला के लिए कई बार दोहराए जाते हैं। बॉक्स एक खाली (या अत्यंत प्रयोगशाला) समन्वय स्थल का प्रतिनिधित्व करता है।
एल्किन पोलीमराइजेशन में कदम। चरण I में मोनोमर को धातु से बांधना सम्मिलित है और चरण ii में प्रवासी सम्मिलन चरण सम्मिलित है। ये चरण, जो धातु केंद्र के एक तरफ से दूसरी तरफ वैकल्पिक होते हैं, प्रत्येक बहुलक श्रृंखला के लिए कई बार दोहराए जाते हैं। बॉक्स एक खाली (या अत्यंत प्रयोगशाला) समन्वय स्थल का प्रतिनिधित्व करता है।
तंत्र
ओलेफिन सम्मिलन की दर को प्रभावित करने वाले कारकों में धातु और ओलेफिन प्रंगार के बीच एक बंधन के प्रारंभिक गठन को सम्मिलित करते हुए चक्रीय, तलीय, चार-केंद्र संक्रमण राज्य का गठन संलिप्त है। इस संक्रमण अवस्था से, यह देखा जा सकता है कि आंशिक धनात्मक आवेश β-प्रंगार पर बनता है और आंशिक ऋणात्मक आवेश प्रंगार पर बनता है जो प्रारंभ में धातु से बंधा होता है। यह ध्रुवीकरण ऋणात्मक रूप से आवेशित कार्बन/हाइड्रोजन और धनात्मक रूप से आवेशित β-कार्बन के साथ-साथ धातु-α-कार्बन बंधन के एक साथ गठन के बीच बाद में देखे गए बंधन की व्याख्या करता है। यह संक्रमण अवस्था उन दो कारकों पर भी प्रकाश डालती है जो ओलेफिन सम्मिलन प्रतिक्रियाओं की दर में सबसे अधिक योगदान करते हैं: (i) प्रारंभिक रूप से धातु से जुड़े एल्काइल समूह का कक्षीय ओवरलैप और (ii) धातु-अल्काइल बंधन की ताकत। आंशिक रूप से सकारात्मक β-प्रंगार और आंशिक रूप से नकारात्मक हाइड्रोजन/एल्काइल समूह प्रंगार के बीच अधिक कक्षीय अतिव्यापन के साथ, नए CC बांड के गठन की सुविधा है। धातु-अल्काइल बंधन की बढ़ती ताकत के साथ, α-कार्बन और β-प्रंगार (क्रमशः) के साथ दो नए बंधन बनाने के लिए धातु और हाइड्रोजन/अल्काइल प्रंगार बंधन के बीच बंधन का टूटना धीमा है, इस प्रकार सम्मिलन प्रतिक्रिया की दर कम हो रही है।[12]
एम-एच बांड में एल्केन्स का सम्मिलन
धातु-हाइड्रोजन बंधों में एल्केन्स का सम्मिलन हाइड्रोजनीकरण और हाइड्रोफॉर्माइलेशन प्रतिक्रियाओं में एक महत्वपूर्ण कदम है। प्रतिक्रिया में उत्प्रेरक के समन्वय क्षेत्र के भीतर संयोजन करने वाले अल्कीन और हाइड्राइड संलग्नी सम्मिलित होते हैं। हाइड्रोजनीकरण में, परिणामी एल्काइल संलग्नी एक दूसरे हाइड्राइड के साथ मिलकर एल्केन देता है। एल्काइन्स के हाइड्रोजनीकरण पर अनुरूप प्रतिक्रियाएं लागू होती हैं: एक एल्केनाइल संलग्नी एक एल्केन को खत्म करने के लिए एक हाइड्राइड के साथ जुड़ती है।
तंत्र
तंत्र के संदर्भ में, M-H आबंध में और M-C आबंध में एल्केन्स के सम्मिलन को इसी तरह वर्णित किया गया है। दोनों में चार-सदस्यीय संक्रमण राज्य सम्मिलित हैं जो धातु पर कम प्रतिस्थापित प्रंगार रखते हैं।
धातु-हाइड्रोजन बंधन में ओलेफिन सम्मिलन का उल्टा बीटा उन्मूलन | β-हाइड्राइड उन्मूलन है। सूक्ष्म उत्क्रमणीयता के सिद्धांत के लिए आवश्यक है कि β-हाइड्राइड उन्मूलन की क्रियाविधि धातु हाइड्राइड बंधों में एल्केन्स के सम्मिलन के समान मार्ग का अनुसरण करे। β-हाइड्राइड उन्मूलन के लिए पहली आवश्यकता धातु के संबंध में β की स्थिति में हाइड्रोजन की उपस्थिति है। β-उन्मूलन के लिए धातु पर एक रिक्त समन्वय स्थिति की आवश्यकता होती है जो कि अमूर्त हाइड्रोजन को समायोजित करेगी।[13]
औद्योगिक अनुप्रयोग
कार्बोनिलेशन
कार्बोनिल समूहों के प्रवासी सम्मिलन के दो व्यापक रूप से नियोजित अनुप्रयोग हाइड्रोफॉर्माइलेशन और मेथनॉल के कार्बोनिलेशन द्वारा सिरका अम्ल का उत्पादन करते हैं। पूर्व एल्केन्स, हाइड्रोजन और कार्बन मोनोऑक्साइड को एल्डिहाइड में परिवर्तित करते हैं। कार्बोनिलाइजेशन द्वारा एसिटिक एसिड का उत्पादन दो समान औद्योगिक प्रक्रियाओं के माध्यम से होता है। अधिक पारंपरिक मोनसेंटो प्रक्रिया है, जो मेथनॉल को एसिटिक एसिड में बदलने के लिए रोडियम-आयोडीन उत्प्रेरक पर निर्भर करती है। इस प्रक्रिया को कैटिवा प्रक्रिया द्वारा हटा दिया गया है जो एक संबंधित इरिडियम उत्प्रेरक का उपयोग करता है, [Ir (CO)2I2]- (1)।[14][15] 2002 तक, दुनिया भर में एसिटिक एसिड का वार्षिक उत्पादन 6 मिलियन टन था, जिसमें से लगभग 60% कैटिवा प्रक्रिया द्वारा उत्पादित किया जाता है।[14]
- ऊपर दिखाए गए कैटिवा प्रक्रिया उत्प्रेरक चक्र में सम्मिलन और De-सम्मिलन दोनों चरण सम्मिलित हैं। (1) के साथ मिथाइल आयोडाइड की ऑक्सीडेटिव अतिरिक्त प्रतिक्रिया में कार्बन-आयोडीन बंधन में इरिडियम (आई) केंद्र का औपचारिक सम्मिलन सम्मिलित है, जबकि चरण (3) से (4) कार्बन मोनोऑक्साइड के प्रवासी सम्मिलन का एक उदाहरण है इरिडियम -कार्बन बंधन। सक्रिय उत्प्रेरक प्रजाति (4) से एसिटाइल आयोडाइड के अपचायक उन्मूलन द्वारा पुन: उत्पन्न होती है, एक D-सम्मिलन प्रतिक्रिया।[14]
एल्केन पोलीमराइजेशन
एल्केन सम्मिलन के औद्योगिक अनुप्रयोगों में पॉलीइथाइलीन और पॉलीप्रोपाइलीन के लिए धातु-उत्प्रेरित मार्ग सम्मिलित हैं। आमतौर पर ये रूपांतरण टाइटेनियम ट्राइक्लोराइड द्वारा विषम उत्प्रेरण होते हैं जो एल्यूमीनियम एल्काइल द्वारा सक्रिय होते हैं। इस तकनीक को ज़िग्लर-नट्टा उत्प्रेरक के रूप में जाना जाता है।[16] इन प्रतिक्रियाओं में, एथिलीन टाइटेनियम धातु के साथ समन्वय करता है और उसके बाद उसका सम्मिलन होता है। इन चरणों को कई बार दोहराया जा सकता है, संभावित रूप से उच्च आणविक भार बहुलक की ओर अग्रसर होता है।
संदर्भ
- ↑ Elschenbroich, C. (2006). आर्गेनोमेटेलिक्स. Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ↑ Hartwig, J. F. (2010). बॉन्डिंग से लेकर कटैलिसीस तक ऑर्गेनोट्रांसिशन मेटल केमिस्ट्री. New York, NY: University Science Books. ISBN 978-1-891389-53-5.
- ↑ Yadav, M. S. (2005). अकार्बनिक रसायन विज्ञान में त्वरित समीक्षा. Anmol Publications. p. 244. ISBN 978-81-261-1898-4.
- ↑ 4.0 4.1 4.2 Anderson, G. K.; Cross, R. J. (1984). "स्क्वायर प्लानर परिसरों की कार्बोनिल-सम्मिलन प्रतिक्रियाएं". Acc. Chem. Res. 17 (2): 67–74. doi:10.1021/ar00098a005.
- ↑ 5.0 5.1 5.2 Cavell, K. J. (1996). "धातु-कार्बन बांडों में प्रवासी निवेश पर हालिया मौलिक अध्ययन". Coord. Chem. Rev. 155 (11): 209–243. doi:10.1016/S0010-8545(96)90182-4.
- ↑ 6.0 6.1 Alexander, J.J. (1985). "Insertions into transition metal-carbon bonds". In Hartley; Patai (eds.). धातु-कार्बन बंधन का रसायन विज्ञान. Vol. 2. John Wiley & Sons. doi:10.1002/9780470771747.ch5.
- ↑ Shusterman, A. J.; Tamir, I.; Pross, A. (1988). "Organometallic प्रवासन प्रतिक्रियाओं का तंत्र। एक विन्यास मिश्रण (सीएम) दृष्टिकोण". J. Organomet. Chem. 340 (2): 203–222. doi:10.1016/0022-328X(88)80076-7.
- ↑ Fristrup, Peter; Kreis, Michael; Palmelund, Anders; Norrby, Per-Ola; Madsen, Robert (2008). "एल्डिहाइड के रोडियम-उत्प्रेरित डीकार्बोनाइलेशन के लिए तंत्र: एक संयुक्त प्रायोगिक और सैद्धांतिक अध्ययन". J. Am. Chem. Soc. 130 (15): 5206–5215. doi:10.1021/ja710270j. PMID 18303836.
- ↑ Ohno, K.; Tsuji, J. (1968). "महान धातु यौगिकों के माध्यम से कार्बनिक संश्लेषण। XXXV. रोडियम कॉम्प्लेक्स का उपयोग करते हुए एल्डिहाइड और एसाइल हैलाइड्स की उपन्यास डीकार्बोनाइलेशन प्रतिक्रियाएं". J. Am. Chem. Soc. 90 (1): 99–107. doi:10.1021/ja01003a018.
- ↑ Douglas; McDaniel; Alexander (1994). अकार्बनिक रसायन विज्ञान की अवधारणाएं और मॉडल (3rd ed.). John Wiley & Sons, Inc. ISBN 978-0-471-62978-8.
- ↑ Puddephatt, R.A.; Stalteri, M.A. (1980). "मिथाइल- या फिनाइल- ट्रांजिशन मेटल बॉन्ड में सल्फर डाइऑक्साइड के सम्मिलन के बीच प्रतिस्पर्धा". Journal of Organometallic Chemistry. 193: C27–C29. doi:10.1016/S0022-328X(00)86091-X.
- ↑ Burger, B. J.; Thompson, M. E.; Cotter, W. D.; Bercaw, J. E. (1990). "एथिलीन सम्मिलन और β-हाइड्रोजन उन्मूलन Permethylscandocene Alkyl परिसरों के लिए। एथिलीन के ज़िग्लर-नट्टा पॉलीमराइज़ेशन में श्रृंखला प्रसार और समाप्ति चरणों का एक अध्ययन". J. Am. Chem. Soc. 112 (4): 1566–1577. doi:10.1021/ja00160a041.
- ↑ Crabtree, R. H. (2009). संक्रमण धातुओं की ऑर्गेनोमेटेलिक रसायन विज्ञान. John Wiley and Sons. p. 192. ISBN 978-0-470-25762-3.
- ↑ 14.0 14.1 14.2 Jones, Jane H. (2000). "एसिटिक एसिड के निर्माण के लिए कैटिवा प्रक्रिया". Platinum Metals Review. 44 (3): 94–105.
- ↑ Sunley, G. J.; Watson, D. J. (2000). "इरिडियम का उपयोग कर उच्च उत्पादकता मेथनॉल कार्बोनिलेशन कटैलिसीस - एसिटिक एसिड के निर्माण के लिए कैटिवा प्रक्रिया". Catalysis Today. 58 (4): 293–307. doi:10.1016/S0920-5861(00)00263-7.
- ↑ Kissin, Y. V. (2008). "Synthesis, Chemical Composition, and Structure of Transition Metal Components and Cocatalysts in Catalyst Systems for Alkene Polymerization". संक्रमण धातु उत्प्रेरक के साथ अल्कीन पोलीमराइजेशन प्रतिक्रियाएं. Amsterdam: Elsevier. pp. 207–290. ISBN 978-0-444-53215-2.