पोरबैक्स आरेख: Difference between revisions
(Created page with "{{Short description|Plot of thermodynamically stable phases of an aqueous electrochemical system}} Image:Pourbaix Diagram of Iron.svg|thumb|upright=1.35|लोहे का...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Short description|Plot of thermodynamically stable phases of an aqueous electrochemical system}} | {{Short description|Plot of thermodynamically stable phases of an aqueous electrochemical system}} | ||
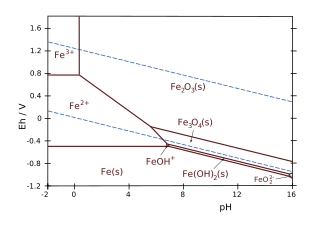
[[Image:Pourbaix Diagram of Iron.svg|thumb|upright=1.35|लोहे का पौरबैक्स आरेख।<ref>{{cite web|url=http://www.wou.edu/las/physci/ch412/pourbaix.htm|title=Western Oregon University}}</ref> Y अक्ष वोल्टेज क्षमता से मेल खाता है।]][[इलेक्ट्रोकैमिस्ट्री]] में, और | [[Image:Pourbaix Diagram of Iron.svg|thumb|upright=1.35|लोहे का पौरबैक्स आरेख।<ref>{{cite web|url=http://www.wou.edu/las/physci/ch412/pourbaix.htm|title=Western Oregon University}}</ref> Y अक्ष वोल्टेज क्षमता से मेल खाता है।]][[इलेक्ट्रोकैमिस्ट्री|विधुत रसायन]] में, और सामान्यतः विलयन रसायन विज्ञान में, एक पोरबैक्स आरेख, जिसे संभावित/पीएच आरेख, ई के रूप में भी जाना जाता है <sub>H</sub>-pH आरेख या pE/pH आरेख, एक जलीय विद्युत रासायनिक प्रणाली के संभावित थर्मोडायनामिक रूप से स्थिर अवस्था n (''अर्थात'', [[रासायनिक संतुलन]] पर) का एक प्लॉट है। प्रमुख रासायनिक प्रजातियों (विलयन में जलीय आयन, या ठोस अवस्था) के बीच की सीमाएं (50%/50%) रेखाओं द्वारा दर्शायी जाती हैं। जैसे कि पौरबैक्स आरेख को अक्षों के एक अलग सेट के साथ एक मानक [[चरण आरेख|अवस्था आरेख]] की तरह पढ़ा जा सकता है। अवस्था आरेखों की तरह, वे अभिक्रिया दर या गतिज प्रभावों की अनुमति नहीं देते हैं। क्षमता और पीएच के अलावा, संतुलन सांद्रता भी निर्भर करती है, जैसे, तापमान, दबाव और एकाग्रता। पौरबैक्स आरेख सामान्यतःकमरे के तापमान, वायुमंडलीय दबाव और 10 की मोलर सांद्रता पर दिए जाते हैं<sup>−6</sup>और इनमें से किसी भी पैरामीटर को बदलने से एक अलग आरेख प्राप्त होगा। | ||
आरेखों का नाम [[रूस]] | आरेखों का नाम [[रूस]] मूल के बेल्जियम के [[रसायनज्ञ]] [[मार्सेल पौरबैक्स]] (1904-1998) के नाम पर रखा गया है, जिन्होंने इनका आविष्कार किया था। | ||
==हम== | ==हम== | ||
| Line 8: | Line 8: | ||
== आरेख == | == आरेख == | ||
ऊर्ध्वाधर अक्ष को E | ऊर्ध्वाधर अक्ष को E<sub>H</sub> लेबल किया गया है [[नर्नस्ट समीकरण]] द्वारा गणना के अनुसार [[मानक हाइड्रोजन इलेक्ट्रोड]] (एसएचई) के संबंध में कमी क्षमता के लिए। एच का मतलब हाइड्रोजन है, हालांकि अन्य मानकों का उपयोग किया जा सकता है, और वे केवल कमरे के तापमान के लिए हैं। | ||
निम्नलिखित रासायनिक संतुलन द्वारा वर्णित प्रतिवर्ती रेडॉक्स | निम्नलिखित रासायनिक संतुलन द्वारा वर्णित प्रतिवर्ती रेडॉक्स अभिक्रिया के लिए: | ||
: {{mvar| {{chem2|a A + b B <-> c C + d D}} }} | : {{mvar| {{chem2|a A + b B <-> c C + d D}} }} | ||
| Line 41: | Line 41: | ||
घुलनशील प्रजातियों के लिए, रेखाएँ अक्सर 1 M या 10 की सांद्रता के लिए खींची जाती हैं<sup>−6</sup> एम. कभी-कभी अन्य सांद्रता के लिए अतिरिक्त रेखाएँ खींची जाती हैं। | घुलनशील प्रजातियों के लिए, रेखाएँ अक्सर 1 M या 10 की सांद्रता के लिए खींची जाती हैं<sup>−6</sup> एम. कभी-कभी अन्य सांद्रता के लिए अतिरिक्त रेखाएँ खींची जाती हैं। | ||
यदि आरेख में विघटित प्रजाति और गैस के बीच संतुलन शामिल है, तो दबाव | यदि आरेख में विघटित प्रजाति और गैस के बीच संतुलन शामिल है, तो दबाव सामान्यतःपी पर सेट होता है<sup>0</sup> = 1 एटीएम = {{val|101,325|u=Pa}}, मानक स्थितियों में जलीय घोल से गैस के विकास के लिए आवश्यक न्यूनतम दबाव।<ref name="Environmental Chemistry (vanLoon)" /> | ||
इसके अलावा, तापमान में परिवर्तन और घोल में घुलनशील आयनों की सांद्रता नर्नस्ट समीकरण के अनुसार संतुलन रेखाओं को स्थानांतरित कर देगी। | इसके अलावा, तापमान में परिवर्तन और घोल में घुलनशील आयनों की सांद्रता नर्नस्ट समीकरण के अनुसार संतुलन रेखाओं को स्थानांतरित कर देगी। | ||
आरेख गतिज प्रभावों को भी ध्यान में नहीं रखते हैं, जिसका अर्थ है कि अस्थिर के रूप में दिखाई गई प्रजातियां व्यवहार में किसी भी महत्वपूर्ण डिग्री पर | आरेख गतिज प्रभावों को भी ध्यान में नहीं रखते हैं, जिसका अर्थ है कि अस्थिर के रूप में दिखाई गई प्रजातियां व्यवहार में किसी भी महत्वपूर्ण डिग्री पर अभिक्रिया नहीं कर सकती हैं। | ||
एक सरलीकृत पौरबैक्स आरेख स्थिर प्रजातियों के बजाय प्रतिरक्षा, संक्षारण और निष्क्रियता के क्षेत्रों को इंगित करता है। इस प्रकार वे एक विशिष्ट वातावरण में किसी विशेष धातु की स्थिरता के लिए मार्गदर्शन देते हैं। प्रतिरक्षा का मतलब है कि धातु पर हमला नहीं किया गया है, जबकि संक्षारण से पता चलता है कि सामान्य हमला होगा। पैसिवेशन (रसायन विज्ञान) तब होता है जब धातु अपनी सतह पर ऑक्साइड या अन्य नमक की एक स्थिर कोटिंग बनाती है, इसका सबसे अच्छा उदाहरण हवा के संपर्क में आने पर इसकी सतह पर बनने वाली [[ अल्युमिना ]] परत के कारण [[ अल्युमीनियम ]] की सापेक्ष स्थिरता है। | एक सरलीकृत पौरबैक्स आरेख स्थिर प्रजातियों के बजाय प्रतिरक्षा, संक्षारण और निष्क्रियता के क्षेत्रों को इंगित करता है। इस प्रकार वे एक विशिष्ट वातावरण में किसी विशेष धातु की स्थिरता के लिए मार्गदर्शन देते हैं। प्रतिरक्षा का मतलब है कि धातु पर हमला नहीं किया गया है, जबकि संक्षारण से पता चलता है कि सामान्य हमला होगा। पैसिवेशन (रसायन विज्ञान) तब होता है जब धातु अपनी सतह पर ऑक्साइड या अन्य नमक की एक स्थिर कोटिंग बनाती है, इसका सबसे अच्छा उदाहरण हवा के संपर्क में आने पर इसकी सतह पर बनने वाली [[ अल्युमिना ]] परत के कारण [[ अल्युमीनियम ]] की सापेक्ष स्थिरता है। | ||
| Line 60: | Line 60: | ||
# यह इंगित नहीं करता है कि निष्क्रियता (ऑक्साइड या हाइड्रॉक्साइड के रूप में) सुरक्षात्मक है या नहीं। पतली ऑक्साइड परतों के माध्यम से ऑक्सीजन आयनों का प्रसार संभव है। | # यह इंगित नहीं करता है कि निष्क्रियता (ऑक्साइड या हाइड्रॉक्साइड के रूप में) सुरक्षात्मक है या नहीं। पतली ऑक्साइड परतों के माध्यम से ऑक्सीजन आयनों का प्रसार संभव है। | ||
# क्लोराइड आयनों द्वारा क्षरण को बाहर करता है ({{chem2|Cl(-)}}, {{chem2|Cl(3+)}} वगैरह।)।{{Efn|This is possible to estimate though. {{r|:1|pp=111}} }} | # क्लोराइड आयनों द्वारा क्षरण को बाहर करता है ({{chem2|Cl(-)}}, {{chem2|Cl(3+)}} वगैरह।)।{{Efn|This is possible to estimate though. {{r|:1|pp=111}} }} | ||
# | # सामान्यतःकेवल के तापमान पर लागू होता है {{Convert|25|C|F}}, जो डिफ़ॉल्ट रूप से मान लिया जाता है। उच्च तापमान के लिए पौरबैक्स आरेख मौजूद हैं। | ||
== पीएच के एक फलन के रूप में नर्नस्ट समीकरण की अभिव्यक्ति == <math>E_h</math> किसी | == पीएच के एक फलन के रूप में नर्नस्ट समीकरण की अभिव्यक्ति == <math>E_h</math> किसी विलयन का h> और pH नर्नस्ट समीकरण से संबंधित होता है जैसा कि सामान्यतःपौरबैक्स आरेख द्वारा दर्शाया जाता है {{nowrap|(<math>E_h</math> – [[pH]] plot)}}. <math>E_h</math> स्पष्ट रूप से दर्शाता है <math>E_\text{red}</math> मानक हाइड्रोजन इलेक्ट्रोड (SHE) बनाम व्यक्त किया गया। आधे सेल समीकरण के लिए, पारंपरिक रूप से कमी अभिक्रिया के रूप में लिखा जाता है (यानी, बाईं ओर ऑक्सीडेंट द्वारा स्वीकार किए गए इलेक्ट्रॉन): | ||
: <math chem="">a \, A + b \, B + h \, \ce{H+} + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D</math> | : <math chem="">a \, A + b \, B + h \, \ce{H+} + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D</math> | ||
संतुलन स्थिरांक {{mvar|K}इस कमी | <nowiki>संतुलन स्थिरांक {{mvar|K}इस कमी अभिक्रिया का } है:</nowiki> | ||
: <math chem>K = \frac{\{C\}^c\{D\}^d}{\{A\}^a\{B\}^b\{\ce{H+}\}^h} = \frac{(\gamma_c)^c\left[C\right]^c \ (\gamma_d)^d\left[D\right]^d} {(\gamma_a)^a\left[A\right]^a \ (\gamma_b)^b\left[B\right]^b \ (\gamma_{h+})^h\left[\ce{H+}\right]^h} = \frac{(\gamma_c)^c (\gamma_d)^d} {(\gamma_a)^a (\gamma_b)^b (\gamma_h)^h} \text{×} \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b \left[\ce{H+}\right]^h}</math> | : <math chem>K = \frac{\{C\}^c\{D\}^d}{\{A\}^a\{B\}^b\{\ce{H+}\}^h} = \frac{(\gamma_c)^c\left[C\right]^c \ (\gamma_d)^d\left[D\right]^d} {(\gamma_a)^a\left[A\right]^a \ (\gamma_b)^b\left[B\right]^b \ (\gamma_{h+})^h\left[\ce{H+}\right]^h} = \frac{(\gamma_c)^c (\gamma_d)^d} {(\gamma_a)^a (\gamma_b)^b (\gamma_h)^h} \text{×} \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b \left[\ce{H+}\right]^h}</math> | ||
जहां घुंघराले ब्रेसिज़ { } [[गतिविधि (रसायन विज्ञान)]] को इंगित करते हैं ({{mvar|a}}), आयताकार ब्रेसिज़ [ ] मोलर सांद्रता या [[मोलैलिटी]] सांद्रता को दर्शाते हैं ({{mvar|C}}), <math>\gamma</math> [[गतिविधि गुणांक]] का प्रतिनिधित्व करते हैं, और [[स्तुईचिओमेटरी]] गुणांक को घातांक के रूप में दिखाया जाता है। | जहां घुंघराले ब्रेसिज़ { } [[गतिविधि (रसायन विज्ञान)]] को इंगित करते हैं ({{mvar|a}}), आयताकार ब्रेसिज़ [ ] मोलर सांद्रता या [[मोलैलिटी]] सांद्रता को दर्शाते हैं ({{mvar|C}}), <math>\gamma</math> [[गतिविधि गुणांक]] का प्रतिनिधित्व करते हैं, और [[स्तुईचिओमेटरी]] गुणांक को घातांक के रूप में दिखाया जाता है। | ||
गतिविधियाँ थर्मोडायनामिक सांद्रता से मेल खाती हैं और | गतिविधियाँ थर्मोडायनामिक सांद्रता से मेल खाती हैं और विलयन में मौजूद आयनों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन को ध्यान में रखती हैं। जब सांद्रता बहुत अधिक न हो, तो गतिविधि (<math>a_i</math>) मापने योग्य एकाग्रता से संबंधित हो सकता है (<math>C_i</math>) गतिविधि गुणांक के साथ एक रैखिक संबंध द्वारा (<math>\gamma_i</math>): | ||
: <math>a_i = \gamma_i \, C_i</math> | : <math>a_i = \gamma_i \, C_i</math> | ||
| Line 96: | Line 96: | ||
===ऊर्ध्वाधर सीमा रेखा === | ===ऊर्ध्वाधर सीमा रेखा === | ||
जब कोई इलेक्ट्रॉनों का आदान-प्रदान नहीं होता है (z = 0), तो बीच संतुलन होता है {{mvar|A}}, {{mvar|B}}, {{mvar|C}}, और {{mvar|D}} पर ही निर्भर करता है {{mvar|[H<sup>+</sup>]}} और इलेक्ट्रोड क्षमता से प्रभावित नहीं होता है। इस मामले में, | जब कोई इलेक्ट्रॉनों का आदान-प्रदान नहीं होता है (z = 0), तो बीच संतुलन होता है {{mvar|A}}, {{mvar|B}}, {{mvar|C}}, और {{mvar|D}} पर ही निर्भर करता है {{mvar|[H<sup>+</sup>]}} और इलेक्ट्रोड क्षमता से प्रभावित नहीं होता है। इस मामले में, अभिक्रिया एक शास्त्रीय एसिड-बेस अभिक्रिया है जिसमें केवल विघटित प्रजातियों का [[प्रोटोनेशन]]/डिप्रोटोनेशन शामिल होता है। pH के एक विशेष मान पर सीमा रेखा एक ऊर्ध्वाधर रेखा होगी। अभिक्रिया समीकरण लिखा जा सकता है: | ||
: <math chem>a \, A + b \, B + h \, \ce{H+} \quad \ce{<=>} \quad c \, C + d \, D</math> | : <math chem>a \, A + b \, B + h \, \ce{H+} \quad \ce{<=>} \quad c \, C + d \, D</math> | ||
| Line 110: | Line 110: | ||
जिसे पीएच के विशेष मान के लिए हल किया जा सकता है। | जिसे पीएच के विशेष मान के लिए हल किया जा सकता है। | ||
उदाहरण के लिए<ref name="Verink"/>लोहे और पानी की व्यवस्था और [[फेरिक]] आयन Fe के बीच संतुलन रेखा पर विचार करें<sup>3+</sup>आयन और [[हेमेटाइट]] Fe<sub>2</sub>O<sub>3</sub>. | उदाहरण के लिए<ref name="Verink"/>लोहे और पानी की व्यवस्था और [[फेरिक]] आयन Fe के बीच संतुलन रेखा पर विचार करें<sup>3+</sup>आयन और [[हेमेटाइट]] Fe<sub>2</sub>O<sub>3</sub>. अभिक्रिया समीकरण है: | ||
:<chem>2 Fe^{3+}(aq) + 3 H_2 O (l) <=> Fe_2 O_3 (s) + 6 H^+ (aq)</chem> | :<chem>2 Fe^{3+}(aq) + 3 H_2 O (l) <=> Fe_2 O_3 (s) + 6 H^+ (aq)</chem> | ||
| Line 116: | Line 116: | ||
:<math chem>\ce{pH}=-\frac{1}{6}\left( \frac{\Delta G^\circ}{R T \lambda} + \log\left( \frac\ce{[Fe2O3]}\ce{[Fe^{3+}]^2[H2O]^3}\right) \right) </math> | :<math chem>\ce{pH}=-\frac{1}{6}\left( \frac{\Delta G^\circ}{R T \lambda} + \log\left( \frac\ce{[Fe2O3]}\ce{[Fe^{3+}]^2[H2O]^3}\right) \right) </math> | ||
क्योंकि ठोस | क्योंकि ठोस अवस्थाों और पानी की गतिविधियाँ (या सांद्रता) एकता के बराबर हैं:<br /> [Fe<sub>2</sub>O<sub>3</sub>] = [एच<sub>2</sub>ओ] = 1, पीएच केवल घुली हुई सांद्रता पर निर्भर करता है {{chem|Fe|3+}}: | ||
:<math chem>\ce{pH}=-\frac{1}{6}\left( \frac{\Delta G^\circ}{R T \lambda} + \log\left( \frac{1} {[\ce{Fe^{3+}}]^2} \right) \right) </math> | :<math chem>\ce{pH}=-\frac{1}{6}\left( \frac{\Delta G^\circ}{R T \lambda} + \log\left( \frac{1} {[\ce{Fe^{3+}}]^2} \right) \right) </math> | ||
| Line 123: | Line 123: | ||
=== क्षैतिज सीमा रेखा === | === क्षैतिज सीमा रेखा === | ||
जब एच<sup>+</sup>और ओह<sup>−</sup>आयन | जब एच<sup>+</sup>और ओह<sup>−</sup>आयन अभिक्रिया में शामिल नहीं होते हैं, सीमा रेखा क्षैतिज और pH से स्वतंत्र होती है। <br />अभिक्रिया समीकरण इस प्रकार लिखा गया है: | ||
: <math chem>a \, A + b \, B + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D \qquad (z > 0 \text{, but without} \ \ce{H+})</math> | : <math chem>a \, A + b \, B + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D \qquad (z > 0 \text{, but without} \ \ce{H+})</math> | ||
| Line 135: | Line 135: | ||
: <math chem>E_h = {E^\circ} - \frac{V_T \lambda}{z} \log \left( \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b} \right)</math> | : <math chem>E_h = {E^\circ} - \frac{V_T \lambda}{z} \log \left( \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b} \right)</math> | ||
संतुलन के लिए {{chem|Fe|2+}}/{{chem|Fe|3+}}, Fe के बीच की सीमा रेखा पर विचार करते हुए, यहां उदाहरण के रूप में लिया गया है<sup>2+</sup>और Fe<sup>3+</sup>, अर्ध- | संतुलन के लिए {{chem|Fe|2+}}/{{chem|Fe|3+}}, Fe के बीच की सीमा रेखा पर विचार करते हुए, यहां उदाहरण के रूप में लिया गया है<sup>2+</sup>और Fe<sup>3+</sup>, अर्ध-अभिक्रिया समीकरण है: | ||
: <chem>Fe^3+ (aq) + e^- <=> Fe^2+ (aq)</chem> | : <chem>Fe^3+ (aq) + e^- <=> Fe^2+ (aq)</chem> | ||
चूंकि एच<sup>+</sup>आयन इस [[ रिडॉक्स ]] | चूंकि एच<sup>+</sup>आयन इस [[ रिडॉक्स ]] अभिक्रिया में शामिल नहीं हैं, यह पीएच से स्वतंत्र है। | ||
इ<sup>o</sup> = 0.771 V जिसमें रेडॉक्स | इ<sup>o</sup> = 0.771 V जिसमें रेडॉक्स अभिक्रिया में केवल एक इलेक्ट्रॉन शामिल होता है।<ref name="USWater">{{cite journal |author=<!--Staff writer(s); no by-line.-->|date=1962 |title=प्राकृतिक जल में आयरन का रसायन|url=https://pubs.usgs.gov/wsp/1459a/report.pdf |journal=Geological Survey Water-Supply Paper 1459|access-date=2017-03-29 }}</ref> | ||
संभावित ई<sub>h</sub> थर्मल वोल्टेज के माध्यम से तापमान का एक कार्य है <math>V_T</math> और सीधे तौर पर की सांद्रता के अनुपात पर निर्भर करता है {{chem|Fe|2+}} और {{chem|Fe|3+}} आयन: | संभावित ई<sub>h</sub> थर्मल वोल्टेज के माध्यम से तापमान का एक कार्य है <math>V_T</math> और सीधे तौर पर की सांद्रता के अनुपात पर निर्भर करता है {{chem|Fe|2+}} और {{chem|Fe|3+}} आयन: | ||
| Line 147: | Line 147: | ||
===ढलानदार सीमा रेखा === | ===ढलानदार सीमा रेखा === | ||
इस मामले में, इलेक्ट्रॉन और एच दोनों<sup>+</sup>आयन शामिल हैं और इलेक्ट्रोड क्षमता पीएच का एक कार्य है। | इस मामले में, इलेक्ट्रॉन और एच दोनों<sup>+</sup>आयन शामिल हैं और इलेक्ट्रोड क्षमता पीएच का एक कार्य है। अभिक्रिया समीकरण लिखा जा सकता है: | ||
: <math chem>a \, A + b \, B + h \, \ce{H+} + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D</math> | : <math chem>a \, A + b \, B + h \, \ce{H+} + z \, e^{-} \quad \ce{<=>} \quad c \, C + d \, D</math> | ||
| Line 153: | Line 153: | ||
: <math chem>E_h = {E^\circ} - \frac{V_T\lambda}{z} \left( \log \left( \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b} \right) + h\, \ce{pH} \right)</math> | : <math chem>E_h = {E^\circ} - \frac{V_T\lambda}{z} \left( \log \left( \frac{\left[C\right]^c \left[D\right]^d}{\left[A\right]^a \left[B\right]^b} \right) + h\, \ce{pH} \right)</math> | ||
लोहे और पानी के उदाहरण के लिए, [[लौह आयन]] Fe के बीच की सीमा रेखा पर विचार करें<sup>2+</sup>और हेमेटाइट Fe<sub>2</sub>O<sub>3</sub>, | लोहे और पानी के उदाहरण के लिए, [[लौह आयन]] Fe के बीच की सीमा रेखा पर विचार करें<sup>2+</sup>और हेमेटाइट Fe<sub>2</sub>O<sub>3</sub>, अभिक्रिया समीकरण है: | ||
: <chem>Fe2O3(s) + 6 H+(aq) + 2 e^- <=> 2 Fe^{2+}(aq) + 3 H2O(l)</chem> | : <chem>Fe2O3(s) + 6 H+(aq) + 2 e^- <=> 2 Fe^{2+}(aq) + 3 H2O(l)</chem> | ||
| Line 160: | Line 160: | ||
: <math chem>E_h = {E^\circ} - \frac{V_T \lambda}{2} \left ( \log\left ( \frac\ce{[Fe^{2+}]^2[H2O]^3}\ce{[Fe2O3]} \right ) + 6 \ \ce{pH}\right)</math> | : <math chem>E_h = {E^\circ} - \frac{V_T \lambda}{2} \left ( \log\left ( \frac\ce{[Fe^{2+}]^2[H2O]^3}\ce{[Fe2O3]} \right ) + 6 \ \ce{pH}\right)</math> | ||
चूंकि, संतुलन स्थिरांक की परिभाषा में ठोस | चूंकि, संतुलन स्थिरांक की परिभाषा में ठोस अवस्थाों और पानी की गतिविधियों, या सांद्रता को हमेशा परंपरा के अनुसार एकता के बराबर लिया जाता है {{mvar|K}}: [स्त्री<sub>2</sub>O<sub>3</sub>] = [एच<sub>2</sub>ओ] = 1. | ||
इस प्रकार नर्नस्ट समीकरण विघटित प्रजातियों तक सीमित है {{chem|Fe|2+}} और {{H+}} इस प्रकार लिखा गया है: | इस प्रकार नर्नस्ट समीकरण विघटित प्रजातियों तक सीमित है {{chem|Fe|2+}} और {{H+}} इस प्रकार लिखा गया है: | ||
| Line 186: | Line 186: | ||
: <math chem>E_\ce{H} = - V_T\lambda\,\ce{pH} </math> | : <math chem>E_\ce{H} = - V_T\lambda\,\ce{pH} </math> | ||
: <math chem>E_\ce{H} = - 0.05916\,\ce{pH} </math> | : <math chem>E_\ce{H} = - 0.05916\,\ce{pH} </math> | ||
इस रेखा के नीचे, पानी हाइड्रोजन में कम हो जाता है, और | इस रेखा के नीचे, पानी हाइड्रोजन में कम हो जाता है, और सामान्यतःइस रेखा से आगे बढ़ना तब तक संभव नहीं होगा जब तक कि कम किए जाने वाले सिस्टम में अभी भी पानी मौजूद है। | ||
तदनुसार, अत्यधिक ऑक्सीकरण स्थितियों (उच्च ई) के तहत<sub>H</sub>) पानी ऑक्सीजन गैस में ऑक्सीकृत होता है:<ref name="Environmental Chemistry (vanLoon)" /> | तदनुसार, अत्यधिक ऑक्सीकरण स्थितियों (उच्च ई) के तहत<sub>H</sub>) पानी ऑक्सीजन गैस में ऑक्सीकृत होता है:<ref name="Environmental Chemistry (vanLoon)" /> | ||
| Line 198: | Line 198: | ||
: <math chem>E_\ce{H} = E^0 - V_T\lambda\,\ce{pH} </math> | : <math chem>E_\ce{H} = E^0 - V_T\lambda\,\ce{pH} </math> | ||
: <math chem>E_\ce{H} = 1.229 V - 0.05916\,\ce{pH} </math> | : <math chem>E_\ce{H} = 1.229 V - 0.05916\,\ce{pH} </math> | ||
मानक तापमान और दबाव पर. इस रेखा के ऊपर, ऑक्सीजन गैस बनाने के लिए पानी का ऑक्सीकरण किया जाता है, और | मानक तापमान और दबाव पर. इस रेखा के ऊपर, ऑक्सीजन गैस बनाने के लिए पानी का ऑक्सीकरण किया जाता है, और सामान्यतःइस रेखा से आगे बढ़ना तब तक संभव नहीं होगा जब तक सिस्टम में ऑक्सीकरण के लिए पानी मौजूद है। | ||
समान नकारात्मक ढलान (−59 mV/pH इकाई) वाली दो ऊपरी और निचली स्थिरता रेखाएं, पोरबैक्स आरेख में समानांतर हैं और पीएच के साथ कमी की क्षमता कम हो जाती है। | समान नकारात्मक ढलान (−59 mV/pH इकाई) वाली दो ऊपरी और निचली स्थिरता रेखाएं, पोरबैक्स आरेख में समानांतर हैं और पीएच के साथ कमी की क्षमता कम हो जाती है। | ||
| Line 204: | Line 204: | ||
== अनुप्रयोग == | == अनुप्रयोग == | ||
पौरबैक्स आरेखों के विभिन्न क्षेत्रों में कई अनुप्रयोग हैं, जैसे, संक्षारण समस्याएं, भू-रसायन विज्ञान और [[पर्यावरण विज्ञान]]। पौरबैक्स आरेख का सही ढंग से उपयोग करने से न केवल [[जलीय घोल]], या [[चरण (पदार्थ)]] में मौजूद प्रजातियों की प्रकृति पर प्रकाश डालने में मदद मिलेगी, बल्कि [[प्रतिक्रिया तंत्र]] को समझने में भी मदद मिल सकती है।<ref>{{cite journal | url=https://link.springer.com/article/10.1007/s12678-018-0459-1 | doi=10.1007/s12678-018-0459-1 | title=गैल्वेनिक कोशिकाओं में छिपी प्रतिक्रियाओं को उजागर करना| journal=Electrocatalysis | date=July 2018 | volume=9 | issue=4 | pages=531–538 | last1=Noyhouzer | first1=Tomer | last2=Bellemare-Alford | first2=Daphnée | last3=Payne | first3=Nicholas A. | last4=Martineau | first4=Eric | last5=Mauzeroll | first5=Janine | s2cid=104177121 }}</ref> | पौरबैक्स आरेखों के विभिन्न क्षेत्रों में कई अनुप्रयोग हैं, जैसे, संक्षारण समस्याएं, भू-रसायन विज्ञान और [[पर्यावरण विज्ञान]]। पौरबैक्स आरेख का सही ढंग से उपयोग करने से न केवल [[जलीय घोल]], या [[चरण (पदार्थ)|अवस्था (पदार्थ)]] में मौजूद प्रजातियों की प्रकृति पर प्रकाश डालने में मदद मिलेगी, बल्कि [[प्रतिक्रिया तंत्र|अभिक्रिया तंत्र]] को समझने में भी मदद मिल सकती है।<ref>{{cite journal | url=https://link.springer.com/article/10.1007/s12678-018-0459-1 | doi=10.1007/s12678-018-0459-1 | title=गैल्वेनिक कोशिकाओं में छिपी प्रतिक्रियाओं को उजागर करना| journal=Electrocatalysis | date=July 2018 | volume=9 | issue=4 | pages=531–538 | last1=Noyhouzer | first1=Tomer | last2=Bellemare-Alford | first2=Daphnée | last3=Payne | first3=Nicholas A. | last4=Martineau | first4=Eric | last5=Mauzeroll | first5=Janine | s2cid=104177121 }}</ref> | ||
| Line 217: | Line 217: | ||
:::::::::::::::::::: <math>pe = -\log [e^-]</math>, पीएच के समान रूप वाली एक अभिव्यक्ति। | :::::::::::::::::::: <math>pe = -\log [e^-]</math>, पीएच के समान रूप वाली एक अभिव्यक्ति। | ||
{{mvar|pe}}पर्यावरण रसायन विज्ञान में मान -12 से +25 तक होता है, क्योंकि कम या उच्च क्षमता पर पानी क्रमशः कम या ऑक्सीकृत हो जाएगा। पर्यावरणीय अनुप्रयोगों में, विघटित प्रजातियों की सांद्रता | {{mvar|pe}}पर्यावरण रसायन विज्ञान में मान -12 से +25 तक होता है, क्योंकि कम या उच्च क्षमता पर पानी क्रमशः कम या ऑक्सीकृत हो जाएगा। पर्यावरणीय अनुप्रयोगों में, विघटित प्रजातियों की सांद्रता सामान्यतः10 के बीच मान पर सेट की जाती है<sup>−2</sup> M और 10<sup>संतुलन रेखाओं के निर्धारण के लिए −5</sup>M. | ||
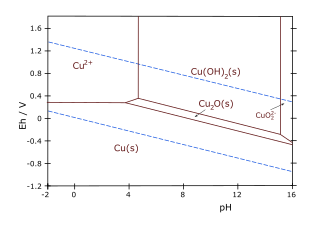
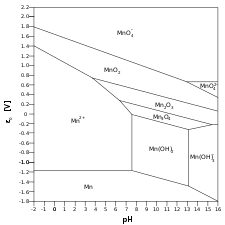
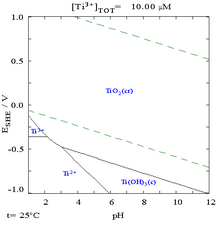
== गैलरी == | == गैलरी == | ||
| Line 275: | Line 275: | ||
श्रेणी:इलेक्ट्रोकैमिस्ट्री | श्रेणी:इलेक्ट्रोकैमिस्ट्री | ||
श्रेणी: | श्रेणी:अवस्था परिवर्तन | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 13/07/2023]] | [[Category:Created On 13/07/2023]] | ||
Revision as of 08:47, 18 September 2023

विधुत रसायन में, और सामान्यतः विलयन रसायन विज्ञान में, एक पोरबैक्स आरेख, जिसे संभावित/पीएच आरेख, ई के रूप में भी जाना जाता है H-pH आरेख या pE/pH आरेख, एक जलीय विद्युत रासायनिक प्रणाली के संभावित थर्मोडायनामिक रूप से स्थिर अवस्था n (अर्थात, रासायनिक संतुलन पर) का एक प्लॉट है। प्रमुख रासायनिक प्रजातियों (विलयन में जलीय आयन, या ठोस अवस्था) के बीच की सीमाएं (50%/50%) रेखाओं द्वारा दर्शायी जाती हैं। जैसे कि पौरबैक्स आरेख को अक्षों के एक अलग सेट के साथ एक मानक अवस्था आरेख की तरह पढ़ा जा सकता है। अवस्था आरेखों की तरह, वे अभिक्रिया दर या गतिज प्रभावों की अनुमति नहीं देते हैं। क्षमता और पीएच के अलावा, संतुलन सांद्रता भी निर्भर करती है, जैसे, तापमान, दबाव और एकाग्रता। पौरबैक्स आरेख सामान्यतःकमरे के तापमान, वायुमंडलीय दबाव और 10 की मोलर सांद्रता पर दिए जाते हैं−6और इनमें से किसी भी पैरामीटर को बदलने से एक अलग आरेख प्राप्त होगा।
आरेखों का नाम रूस मूल के बेल्जियम के रसायनज्ञ मार्सेल पौरबैक्स (1904-1998) के नाम पर रखा गया है, जिन्होंने इनका आविष्कार किया था।
हम

पौरबैक्स आरेख को ई के नाम से भी जाना जाता हैH-दो अक्षों की लेबलिंग के कारण पीएच आरेख।
आरेख
ऊर्ध्वाधर अक्ष को EH लेबल किया गया है नर्नस्ट समीकरण द्वारा गणना के अनुसार मानक हाइड्रोजन इलेक्ट्रोड (एसएचई) के संबंध में कमी क्षमता के लिए। एच का मतलब हाइड्रोजन है, हालांकि अन्य मानकों का उपयोग किया जा सकता है, और वे केवल कमरे के तापमान के लिए हैं।
निम्नलिखित रासायनिक संतुलन द्वारा वर्णित प्रतिवर्ती रेडॉक्स अभिक्रिया के लिए:
- a A + b B ⇌ c C + d D
संगत संतुलन स्थिरांक के साथ K:
नर्नस्ट समीकरण है:
कभी-कभी इस प्रकार तैयार किया जाता है:
या, अधिक सीधे तौर पर संख्यात्मक रूप से इस प्रकार व्यक्त किया जाता है:
कहाँ:
- वोल्ट मानक तापमान पर थर्मल वोल्टेज या नर्नस्ट ढलान है
- λ = ln(10) ≈ 2.30, ताकि वोल्ट.
क्षैतिज अक्ष को H के −log फ़ंक्शन के लिए pH लेबल किया गया है+आयन गतिविधि.
पौरबैक्स आरेख में रेखाएँ संतुलन की स्थिति दर्शाती हैं, अर्थात, जहाँ उस रेखा के प्रत्येक तरफ की प्रजातियों के लिए गतिविधियाँ समान होती हैं। रेखा के दोनों ओर, प्रजाति के एक रूप को प्रमुख कहा जाएगा।[3]
नर्नस्ट समीकरण के साथ रेखाओं की स्थिति खींचने के लिए, संतुलन पर रासायनिक प्रजातियों की गतिविधि को परिभाषित किया जाना चाहिए। आमतौर पर, किसी प्रजाति की गतिविधि को सांद्रता (घुलनशील प्रजातियों के लिए) या आंशिक दबाव (गैसों के लिए) के बराबर अनुमानित किया जाता है। सिस्टम में मौजूद सभी प्रजातियों के लिए समान मूल्यों का उपयोग किया जाना चाहिए।[3]
घुलनशील प्रजातियों के लिए, रेखाएँ अक्सर 1 M या 10 की सांद्रता के लिए खींची जाती हैं−6 एम. कभी-कभी अन्य सांद्रता के लिए अतिरिक्त रेखाएँ खींची जाती हैं।
यदि आरेख में विघटित प्रजाति और गैस के बीच संतुलन शामिल है, तो दबाव सामान्यतःपी पर सेट होता है0 = 1 एटीएम = 101325 Pa, मानक स्थितियों में जलीय घोल से गैस के विकास के लिए आवश्यक न्यूनतम दबाव।[3]
इसके अलावा, तापमान में परिवर्तन और घोल में घुलनशील आयनों की सांद्रता नर्नस्ट समीकरण के अनुसार संतुलन रेखाओं को स्थानांतरित कर देगी।
आरेख गतिज प्रभावों को भी ध्यान में नहीं रखते हैं, जिसका अर्थ है कि अस्थिर के रूप में दिखाई गई प्रजातियां व्यवहार में किसी भी महत्वपूर्ण डिग्री पर अभिक्रिया नहीं कर सकती हैं।
एक सरलीकृत पौरबैक्स आरेख स्थिर प्रजातियों के बजाय प्रतिरक्षा, संक्षारण और निष्क्रियता के क्षेत्रों को इंगित करता है। इस प्रकार वे एक विशिष्ट वातावरण में किसी विशेष धातु की स्थिरता के लिए मार्गदर्शन देते हैं। प्रतिरक्षा का मतलब है कि धातु पर हमला नहीं किया गया है, जबकि संक्षारण से पता चलता है कि सामान्य हमला होगा। पैसिवेशन (रसायन विज्ञान) तब होता है जब धातु अपनी सतह पर ऑक्साइड या अन्य नमक की एक स्थिर कोटिंग बनाती है, इसका सबसे अच्छा उदाहरण हवा के संपर्क में आने पर इसकी सतह पर बनने वाली अल्युमिना परत के कारण अल्युमीनियम की सापेक्ष स्थिरता है।
लागू रासायनिक प्रणालियाँ

जबकि ऐसे आरेख किसी भी रासायनिक प्रणाली के लिए तैयार किए जा सकते हैं, यह ध्यान रखना महत्वपूर्ण है कि धातु बाइंडिंग एजेंट (लिगैंड) को जोड़ने से अक्सर आरेख में संशोधन होगा। उदाहरण के लिए, कार्बोनेट (CO−3) यूरेनियम के आरेख पर बहुत प्रभाव डालता है। (दाईं ओर चित्र देखें)। क्लोराइड आयनों जैसी कुछ प्रजातियों की ट्रेस मात्रा की उपस्थिति भी निष्क्रिय परतों को नष्ट करके कुछ प्रजातियों की स्थिरता को बहुत प्रभावित कर सकती है।
सीमाएँ
यद्यपि पौरबैक्स आरेख धातु संक्षारण संभावित अनुमान के लिए उपयोगी हैं, तथापि, उनकी कुछ महत्वपूर्ण सीमाएँ हैं:[4]: 111
- संतुलन हमेशा माना जाता है, हालांकि व्यवहार में यह भिन्न हो सकता है।
- आरेख वास्तविक संक्षारण दर के बारे में जानकारी प्रदान नहीं करता है।
- मिश्रधातु पर लागू नहीं होता.[lower-alpha 1]
- यह इंगित नहीं करता है कि निष्क्रियता (ऑक्साइड या हाइड्रॉक्साइड के रूप में) सुरक्षात्मक है या नहीं। पतली ऑक्साइड परतों के माध्यम से ऑक्सीजन आयनों का प्रसार संभव है।
- क्लोराइड आयनों द्वारा क्षरण को बाहर करता है (Cl−, Cl3+ वगैरह।)।[lower-alpha 2]
- सामान्यतःकेवल के तापमान पर लागू होता है 25 °C (77 °F), जो डिफ़ॉल्ट रूप से मान लिया जाता है। उच्च तापमान के लिए पौरबैक्स आरेख मौजूद हैं।
== पीएच के एक फलन के रूप में नर्नस्ट समीकरण की अभिव्यक्ति == किसी विलयन का h> और pH नर्नस्ट समीकरण से संबंधित होता है जैसा कि सामान्यतःपौरबैक्स आरेख द्वारा दर्शाया जाता है ( – pH plot). स्पष्ट रूप से दर्शाता है मानक हाइड्रोजन इलेक्ट्रोड (SHE) बनाम व्यक्त किया गया। आधे सेल समीकरण के लिए, पारंपरिक रूप से कमी अभिक्रिया के रूप में लिखा जाता है (यानी, बाईं ओर ऑक्सीडेंट द्वारा स्वीकार किए गए इलेक्ट्रॉन):
संतुलन स्थिरांक {{mvar|K}इस कमी अभिक्रिया का } है:
जहां घुंघराले ब्रेसिज़ { } गतिविधि (रसायन विज्ञान) को इंगित करते हैं (a), आयताकार ब्रेसिज़ [ ] मोलर सांद्रता या मोलैलिटी सांद्रता को दर्शाते हैं (C), गतिविधि गुणांक का प्रतिनिधित्व करते हैं, और स्तुईचिओमेटरी गुणांक को घातांक के रूप में दिखाया जाता है।
गतिविधियाँ थर्मोडायनामिक सांद्रता से मेल खाती हैं और विलयन में मौजूद आयनों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन को ध्यान में रखती हैं। जब सांद्रता बहुत अधिक न हो, तो गतिविधि () मापने योग्य एकाग्रता से संबंधित हो सकता है () गतिविधि गुणांक के साथ एक रैखिक संबंध द्वारा ():
अर्ध-सेल मानक कमी क्षमता द्वारा दिया गया है
कहाँ मानक गिब्स मुक्त ऊर्जा परिवर्तन है, z शामिल इलेक्ट्रॉनों की संख्या है, और F फैराडे का स्थिरांक है। नर्नस्ट समीकरण pH और से संबंधित है निम्नलिखित नुसार:
निम्नलिखित में, नर्नस्ट ढलान (या थर्मल वोल्टेज) का उपयोग किया जाता है, जिसका तापमान और दबाव के लिए मानक स्थितियों पर 0.02569... V का मान होता है। जब आधार-10 लघुगणक का उपयोग किया जाता है, तो VT λ = 0.05916... वी एसटीपी पर जहां λ = एलएन[10] = 2.3026।
यह समीकरण एक सीधी रेखा का समीकरण है के ढलान के साथ पीएच के एक कार्य के रूप में वोल्ट (पीएच की कोई इकाई नहीं है)।
यह समीकरण कम की भविष्यवाणी करता है उच्च पीएच मान पर. यह O की कमी के लिए देखा जाता है2 एच में2ओ, या ओह−, और H की कमी के लिए+एच में2. फिर इसे अक्सर के रूप में नोट किया जाता है यह इंगित करने के लिए कि यह मानक हाइड्रोजन इलेक्ट्रोड (SHE) को संदर्भित करता है जिसका = 0 मानक परिस्थितियों में परंपरा के अनुसार (टी = 298.15 के = 25 डिग्री सेल्सियस = 77 एफ, पीgas = 1 एटीएम (1.013 बार), सांद्रता = 1 एम और इस प्रकार पीएच = 0)।
पौरबैक्स आरेख की गणना
जब गतिविधियाँ () को मोलर सांद्रता, या मोलैलिटी, सांद्रता के बराबर माना जा सकता है () पर्याप्त रूप से पतला सांद्रता पर जब गतिविधि गुणांक () एक की ओर प्रवृत्त होते हैं, सभी गतिविधि गुणांकों को पुनर्समूहित करने वाला शब्द एक के बराबर होता है, और नर्नस्ट समीकरण को केवल सांद्रता के साथ लिखा जा सकता है () यहां वर्गाकार ब्रेसिज़ के साथ दर्शाया गया है [ ]:
पौरबैक्स आरेख में तीन प्रकार की रेखा सीमाएँ होती हैं: लंबवत, क्षैतिज और ढलान वाली।[5][6]
ऊर्ध्वाधर सीमा रेखा
जब कोई इलेक्ट्रॉनों का आदान-प्रदान नहीं होता है (z = 0), तो बीच संतुलन होता है A, B, C, और D पर ही निर्भर करता है [H+] और इलेक्ट्रोड क्षमता से प्रभावित नहीं होता है। इस मामले में, अभिक्रिया एक शास्त्रीय एसिड-बेस अभिक्रिया है जिसमें केवल विघटित प्रजातियों का प्रोटोनेशन/डिप्रोटोनेशन शामिल होता है। pH के एक विशेष मान पर सीमा रेखा एक ऊर्ध्वाधर रेखा होगी। अभिक्रिया समीकरण लिखा जा सकता है:
और ऊर्जा संतुलन को इस प्रकार लिखा जाता है , कहाँ K संतुलन स्थिरांक है:
इस प्रकार:
या, आधार-10 लघुगणक में,
जिसे पीएच के विशेष मान के लिए हल किया जा सकता है।
उदाहरण के लिए[5]लोहे और पानी की व्यवस्था और फेरिक आयन Fe के बीच संतुलन रेखा पर विचार करें3+आयन और हेमेटाइट Fe2O3. अभिक्रिया समीकरण है:
जो है .[5]फिर पौरबैक्स आरेख पर ऊर्ध्वाधर रेखा के पीएच की गणना की जा सकती है:
क्योंकि ठोस अवस्थाों और पानी की गतिविधियाँ (या सांद्रता) एकता के बराबर हैं:
[Fe2O3] = [एच2ओ] = 1, पीएच केवल घुली हुई सांद्रता पर निर्भर करता है Fe3+
:
एसटीपी पर, [Fe3+]=10−6, इससे pH = 1.76 प्राप्त होता है।
क्षैतिज सीमा रेखा
जब एच+और ओह−आयन अभिक्रिया में शामिल नहीं होते हैं, सीमा रेखा क्षैतिज और pH से स्वतंत्र होती है।
अभिक्रिया समीकरण इस प्रकार लिखा गया है:
जैसे, मानक गिब्स मुक्त ऊर्जा :
इलेक्ट्रोड क्षमता ∆G = -zFE की परिभाषा का उपयोग करते हुए, जहां F फैराडे स्थिरांक है, इसे नर्नस्ट समीकरण के रूप में फिर से लिखा जा सकता है:
या, आधार-10 लघुगणक का उपयोग करके:
संतुलन के लिए Fe2+
/Fe3+
, Fe के बीच की सीमा रेखा पर विचार करते हुए, यहां उदाहरण के रूप में लिया गया है2+और Fe3+, अर्ध-अभिक्रिया समीकरण है:
चूंकि एच+आयन इस रिडॉक्स अभिक्रिया में शामिल नहीं हैं, यह पीएच से स्वतंत्र है।
इo = 0.771 V जिसमें रेडॉक्स अभिक्रिया में केवल एक इलेक्ट्रॉन शामिल होता है।[7]
संभावित ईh थर्मल वोल्टेज के माध्यम से तापमान का एक कार्य है और सीधे तौर पर की सांद्रता के अनुपात पर निर्भर करता है Fe2+
और Fe3+
आयन:
समान सांद्रता पर दोनों आयनिक प्रजातियों के लिए (उदाहरण के लिए, ) एसटीपी पर, लॉग 1 = 0, इसलिए, , और सीमा E पर एक क्षैतिज रेखा होगीh= 0.771 वोल्ट. तापमान के साथ क्षमता अलग-अलग होगी।
ढलानदार सीमा रेखा
इस मामले में, इलेक्ट्रॉन और एच दोनों+आयन शामिल हैं और इलेक्ट्रोड क्षमता पीएच का एक कार्य है। अभिक्रिया समीकरण लिखा जा सकता है:
विभवों के संदर्भ में मुक्त ऊर्जा के लिए अभिव्यक्तियों का उपयोग करते हुए, ऊर्जा संतुलन एक नर्नस्ट समीकरण द्वारा दिया गया है:
लोहे और पानी के उदाहरण के लिए, लौह आयन Fe के बीच की सीमा रेखा पर विचार करें2+और हेमेटाइट Fe2O3, अभिक्रिया समीकरण है:
- साथ .[5]
आधार-10 लघुगणक में व्यक्त सीमा रेखा का समीकरण है:
चूंकि, संतुलन स्थिरांक की परिभाषा में ठोस अवस्थाों और पानी की गतिविधियों, या सांद्रता को हमेशा परंपरा के अनुसार एकता के बराबर लिया जाता है K: [स्त्री2O3] = [एच2ओ] = 1.
इस प्रकार नर्नस्ट समीकरण विघटित प्रजातियों तक सीमित है Fe2+
और H+ इस प्रकार लिखा गया है:
के लिए, [स्त्री2+]=10−6M, इससे प्राप्त होता है:
E में इस रेखा का ऋणात्मक ढलान (-0.1775) नोट करेंh-पीएच आरेख.
जल का स्थिरता क्षेत्र

कई मामलों में, किसी प्रणाली में संभावित स्थितियाँ पानी के स्थिरता क्षेत्र द्वारा सीमित होती हैं। यहां ऊपर प्रस्तुत यूरेनियम के लिए पौरबैक्स आरेख में, पानी की स्थिरता की सीमाएं दो धराशायी हरी रेखाओं द्वारा चिह्नित की जाती हैं, और पानी के लिए स्थिरता क्षेत्र इन दो रेखाओं के बीच आता है। इसे यहां सरलीकृत पौरबैक्स आरेख में दो धराशायी लाल रेखाओं के बगल में भी दर्शाया गया है जो केवल जल स्थिरता क्षेत्र तक ही सीमित है।
अत्यधिक कम करने वाली परिस्थितियों में (निम्न ईH), पानी निम्न के अनुसार हाइड्रोजन में अपचयित होता है:[3]
- (कम पीएच पर)
और,
- (उच्च पीएच पर)
नर्नस्ट समीकरण का उपयोग करते हुए, ई सेट करना0 = 0 वी जैसा कि मानक हाइड्रोजन इलेक्ट्रोड (एसएचई, कटौती क्षमता श्रृंखला में संदर्भ के रूप में कार्य करता है) और 1 पर हाइड्रोजन गैस भगोड़ापन (गैस के लिए थर्मोडायनामिक गतिविधि के अनुरूप) के लिए सम्मेलन द्वारा परिभाषित किया गया है, के लिए समीकरण मानक तापमान और दबाव पर पौरबैक्स आरेख में पानी की निचली स्थिरता रेखा है:
इस रेखा के नीचे, पानी हाइड्रोजन में कम हो जाता है, और सामान्यतःइस रेखा से आगे बढ़ना तब तक संभव नहीं होगा जब तक कि कम किए जाने वाले सिस्टम में अभी भी पानी मौजूद है।
तदनुसार, अत्यधिक ऑक्सीकरण स्थितियों (उच्च ई) के तहतH) पानी ऑक्सीजन गैस में ऑक्सीकृत होता है:[3]
- (कम पीएच पर)
और,
- (उच्च पीएच पर)
ऊपर बताए अनुसार नर्नस्ट समीकरण का उपयोग करना, लेकिन ई के साथ0 = −ΔG0H2पानी के ऑक्सीकरण के लिए O/2F = 1.229 V, पीएच मान के आधार पर पानी की ऊपरी स्थिरता सीमा देता है:
मानक तापमान और दबाव पर. इस रेखा के ऊपर, ऑक्सीजन गैस बनाने के लिए पानी का ऑक्सीकरण किया जाता है, और सामान्यतःइस रेखा से आगे बढ़ना तब तक संभव नहीं होगा जब तक सिस्टम में ऑक्सीकरण के लिए पानी मौजूद है।
समान नकारात्मक ढलान (−59 mV/pH इकाई) वाली दो ऊपरी और निचली स्थिरता रेखाएं, पोरबैक्स आरेख में समानांतर हैं और पीएच के साथ कमी की क्षमता कम हो जाती है।
अनुप्रयोग
पौरबैक्स आरेखों के विभिन्न क्षेत्रों में कई अनुप्रयोग हैं, जैसे, संक्षारण समस्याएं, भू-रसायन विज्ञान और पर्यावरण विज्ञान। पौरबैक्स आरेख का सही ढंग से उपयोग करने से न केवल जलीय घोल, या अवस्था (पदार्थ) में मौजूद प्रजातियों की प्रकृति पर प्रकाश डालने में मदद मिलेगी, बल्कि अभिक्रिया तंत्र को समझने में भी मदद मिल सकती है।[8]
की अवधारणा peपर्यावरण रसायन शास्त्र में
जलमंडल में रासायनिक प्रजातियों के व्यवहार का वर्णन करने के लिए पौरबैक्स आरेखों का व्यापक रूप से उपयोग किया जाता है। इस संदर्भ में, कमी की संभावना pe के स्थान पर प्रायः प्रयोग किया जाता है EH.[3] मुख्य लाभ सीधे लघुगणक पैमाने के साथ काम करना है।
pe एक आयामहीन संख्या है और इसे आसानी से संबंधित किया जा सकता है EH समीकरण द्वारा:
कहाँ, थर्मल वोल्टेज है, के साथ R, गैस स्थिरांक (8.314 J⋅K−1⋅mol−1), T, केल्विन में थर्मोडायनामिक तापमान (298.15 K = 25 °C = 77 °F), और F, फैराडे स्थिरांक (96485 कूलम्ब/मोल) e−). लैम्ब्डा, λ = ln(10) ≈ 2.3026।
इसके अतिरिक्त,
- , पीएच के समान रूप वाली एक अभिव्यक्ति।
peपर्यावरण रसायन विज्ञान में मान -12 से +25 तक होता है, क्योंकि कम या उच्च क्षमता पर पानी क्रमशः कम या ऑक्सीकृत हो जाएगा। पर्यावरणीय अनुप्रयोगों में, विघटित प्रजातियों की सांद्रता सामान्यतः10 के बीच मान पर सेट की जाती है−2 M और 10संतुलन रेखाओं के निर्धारण के लिए −5M.
गैलरी
यह भी देखें
- नर्नस्ट समीकरण
- न्यूनीकरण क्षमता#नर्न्स्ट समीकरण
- एलिंगहैम आरेख
- लैटिमर आरेख
- फ्रॉस्ट आरेख
- आयनिक विभाजन आरेख
- बजर्रम प्लॉट
टिप्पणियाँ
संदर्भ
- ↑ "Western Oregon University".
- ↑ 2.0 2.1 . Ignasi Puigdomenech, Hydra/Medusa Chemical Equilibrium Database and Plotting Software (2004) KTH Royal Institute of Technology, freely downloadable software at "KTH - Chemistry / Chemical Equilibrium Software". Archived from the original on 2007-09-29. Retrieved 2007-09-29.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 van Loon, Gary; Duffy, Stephen (2011). Environmental Chemistry – a global perspective (3rd ed.). Oxford University Press. pp. 235–248. ISBN 978-0-19-922886-7.
- ↑ 4.0 4.1 4.2 McCafferty, E. (2010). संक्षारण विज्ञान का परिचय. New York: Springer. ISBN 978-1-4419-0454-6. OCLC 663096583.
- ↑ 5.0 5.1 5.2 5.3 Verink, E.D. Jr. (2000). "Simplified Procedure for Constructing Pourbaix Diagrams" (PDF). In Revie, R. Winston (ed.). उहलिग की संक्षारण पुस्तिका. John Wiley & Sons, Inc. ISBN 0471157775. Archived from the original (PDF) on 6 August 2020. Retrieved 12 February 2021.
- ↑ Kopeliovich, Dimitri. "पौरबैक्स आरेख". SubsTech. Retrieved 2017-03-29.
- ↑ "प्राकृतिक जल में आयरन का रसायन" (PDF). Geological Survey Water-Supply Paper 1459. 1962. Retrieved 2017-03-29.
- ↑ Noyhouzer, Tomer; Bellemare-Alford, Daphnée; Payne, Nicholas A.; Martineau, Eric; Mauzeroll, Janine (July 2018). "गैल्वेनिक कोशिकाओं में छिपी प्रतिक्रियाओं को उजागर करना". Electrocatalysis. 9 (4): 531–538. doi:10.1007/s12678-018-0459-1. S2CID 104177121.
- Brookins, D.G. (1988). Eh-pH Diagrams for Geochemistry. Springer-Verlag. ISBN 0-387-18485-6.
- Jones, Denny A. (1996). Principles and Prevention of Corrosion (2nd ed.). Prentice Hall. pp. 50–52. ISBN 0-13-359993-0.
- Pourbaix, M. (1974). Atlas of electrochemical equilibria in aqueous solutions (2nd ed.). National Association of Corrosion Engineers. ISBN 9780915567980.
- Takeno, Naoto (May 2005). Atlas of Eh-pH diagrams (Intercomparison of thermodynamic databases) (PDF) (Report). Tsukuba, Ibaraki, Japan: National Institute of Advanced Industrial Science and Technology: Research Center for Deep Geological Environments. Retrieved 2017-05-16.
बाहरी संबंध
- Marcel Pourbaix — Corrosion Doctors
- DoITPoMS Teaching and Learning Package- "The Nernst Equation and Pourbaix Diagrams"
सॉफ़्टवेयर
- ChemEQL संकोच न करें से रासायनिक संतुलन की गणना के लिए मुफ्त सॉफ्टवेयर।
- FactSage वाणिज्यिक थर्मोडायनामिक डेटाबैंक सॉफ़्टवेयर, मुफ़्त वेब एप्लिकेशन में भी उपलब्ध है।
- द जियोकेमिस्ट्स वर्कबेंच एक्वियस सॉल्यूशंस एलएलसी से वाणिज्यिक जियोकेमिकल मॉडलिंग सॉफ्टवेयर।
- GWB कम्युनिटी एडिशन लोकप्रिय जियोकेमिकल मॉडलिंग सॉफ्टवेयर पैकेज का मुफ्त डाउनलोड।
- HYDRA/MEDUSA रॉयल इंस्टीट्यूट ऑफ टेक्नोलॉजी के रसायन विज्ञान विभाग से रासायनिक संतुलन आरेख बनाने के लिए मुफ्त सॉफ्टवेयर।
- HSC रसायन विज्ञान आउटोटेक से वाणिज्यिक थर्मोकेमिकल गणना सॉफ्टवेयर।
- PhreePlot संयुक्त राज्य भूवैज्ञानिक सर्वेक्षण कोड PHREEQC का उपयोग करके भू-रासायनिक प्लॉट बनाने के लिए निःशुल्क कार्यक्रम।
- थर्मो-कैल्क विंडोज थर्मो-कैल्क सॉफ्टवेयर से थर्मोडायनामिक गणना के लिए वाणिज्यिक सॉफ्टवेयर।
- सामग्री परियोजना सार्वजनिक वेबसाइट जो एनईआरएससी पर होस्ट की गई गणना की गई सामग्री गुणों के एक बड़े डेटाबेस से पौरबैक्स आरेख उत्पन्न कर सकती है।
श्रेणी:इलेक्ट्रोकैमिस्ट्री
श्रेणी:अवस्था परिवर्तन
Cite error: <ref> tags exist for a group named "lower-alpha", but no corresponding <references group="lower-alpha"/> tag was found