वाष्प दबाव: Difference between revisions
No edit summary |
No edit summary |
||
| (13 intermediate revisions by 4 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Pressure exerted by a vapor in thermodynamic equilibrium}} | {{Short description|Pressure exerted by a vapor in thermodynamic equilibrium}} | ||
[[File:Vapor pressure.svg|thumb|तरल सतह पर वाष्पीकरण और संघनन की सूक्ष्म प्रक्रिया।]] | [[File:Vapor pressure.svg|thumb|तरल सतह पर वाष्पीकरण और संघनन की सूक्ष्म प्रक्रिया।]] | ||
[[File:Vapor pressure being used in a cloud chamber.jpg|thumb|यदि वाष्प का दबाव [[ थर्मोडायनामिक संतुलन |ऊष्मागतिकी संतुलन]] मूल्य से अधिक हो जाता है, तो [[ केंद्रक |केंद्रक]] साइटों की उपस्थिति में संघनन होता है। यह सिद्धांत [[ बादल कक्ष |बादल कक्ष]] | [[File:Vapor pressure being used in a cloud chamber.jpg|thumb|यदि वाष्प का दबाव [[ थर्मोडायनामिक संतुलन |ऊष्मागतिकी संतुलन]] मूल्य से अधिक हो जाता है, तो [[ केंद्रक |केंद्रक]] साइटों की उपस्थिति में संघनन होता है। यह सिद्धांत [[ बादल कक्ष |बादल कक्ष]] में स्वदेशी है, जहां से निकलने पर आयनकारी विकिरण कण संघनन ट्रैक बनाते हैं।]] | ||
[[File:02.Пиштол епрувета со алкохол.ogv|thumb|right|280px|पिस्टल टेस्ट ट्यूब प्रयोग। ट्यूब में [[ इथेनॉल |इथेनॉल]] होता है और कॉर्क के टुकड़े से बंद होता है। अल्कोहल को गर्म करने से, वाष्प अंतरिक्ष में भर जाती है, जिससे ट्यूब में दबाव इतना बढ़ जाता है कि कॉर्क बाहर निकल आता है।]] | [[File:02.Пиштол епрувета со алкохол.ogv|thumb|right|280px|पिस्टल टेस्ट ट्यूब प्रयोग। ट्यूब में [[ इथेनॉल |इथेनॉल]] होता है और कॉर्क के टुकड़े से बंद होता है। अल्कोहल को गर्म करने से, वाष्प अंतरिक्ष में भर जाती है, जिससे ट्यूब में दबाव इतना बढ़ जाता है कि कॉर्क बाहर निकल आता है।]] | ||
वाष्प [[ | '''वाष्प [[दबाव]]''' या संतुलन वाष्प दबाव को संघनन स्तिथि के साथ ऊष्मा गतिकी संतुलन में वाष्प के कारण लगने वाले दबाव के रूप में परिभाषित किया गया है ( ऊष्मागतिकी प्रणाली या क्लोज्ड प्रणाली में दिए गए तापमान पर पदार्थ (ठोस या तरल)। संतुलन वाष्प दबाव तरल की ऊष्मागतिकी प्रवृत्ति को वाष्पित करने का संकेत है। यह सह-अस्तित्व वाले वाष्प चरण में तरल (या ठोस) से निकलने वाले कणों के संतुलन से संबंधित है। सामान्य तापमान पर उच्च वाष्प दबाव वाले पदार्थ को अधिकांशतः '[[ अस्थिरता (रसायन विज्ञान) ]]' कहा जाता है। तरल सतह के ऊपर उपस्तिथ वाष्प द्वारा प्रदर्शित दबाव को वाष्प दबाव के रूप में जाना जाता है। जैसे-जैसे तरल का तापमान बढ़ता है, गैस के चरण में उन अणुओं की एन्ट्रापी की तुलना में तरल अणुओं के बीच आकर्षक संवाद कम महत्वपूर्ण हो जाती है, जिससे वाष्प का दबाव बढ़ जाता है। इस प्रकार, शक्तिशाली इंटरमॉलिक्युलर इंटरैक्शन वाले तरल पदार्थों में छोटे वाष्प दबाव होने की संभावना होती है, शक्तिहीन इंटरैक्शन के लिए रिवर्स ट्रू होता है। | ||
किसी भी पदार्थ का वाष्प दबाव गैर-रैखिक रूप से तापमान के साथ बढ़ता है, जिसे अधिकांशतः क्लॉसियस-क्लैप्रोन संबंध द्वारा वर्णित किया जाता है। तरल का वायुमंडलीय दबाव [[ क्वथनांक |क्वथनांक]] ( | किसी भी पदार्थ का वाष्प दबाव गैर-रैखिक रूप से तापमान के साथ बढ़ता है, जिसे अधिकांशतः क्लॉसियस-क्लैप्रोन संबंध द्वारा वर्णित किया जाता है। तरल का वायुमंडलीय दबाव [[ क्वथनांक |क्वथनांक]] (सामान्य क्वथनांक के रूप में भी जाना जाता है) वह तापमान होता है जिस पर वाष्प का दबाव परिवेश के वायुमंडलीय दबाव के बराबर होता है। उस तापमान में किसी भी वृद्धिशील वृद्धि के साथ, वाष्प का दबाव वायुमंडलीय दबाव को दूर करने के लिए पर्याप्त हो जाता है और तरल वाष्प के बुलबुले बनाने का कारण बनता है। उच्च तरल गहराई में तरल बुलबुले के गठन के लिए उच्च द्रव दबाव के कारण थोड़ा अधिक तापमान की आवश्यकता होती है, ऊपर द्रव द्रव्यमान के हाइड्रोस्टेटिक दबाव के कारण। उथली गहराई पर अधिक महत्वपूर्ण बुलबुला गठन प्रारंभ करने के लिए आवश्यक उच्च तापमान है। बुलबुले की दीवार का सतही तनाव बहुत छोटे, प्रारंभिक बुलबुले में अधिक दबाव की ओर जाता है। | ||
वाष्प दबाव जो मिश्रण में घटक प्रणाली में कुल दबाव में योगदान देता है, उसे [[ आंशिक दबाव |आंशिक दबाव]] कहा जाता है। उदाहरण के लिए, समुद्र तल पर हवा, और 20 डिग्री सेल्सियस पर जल वाष्प के साथ संतृप्त, लगभग 2.3 केपीए पानी, 78 केपीए नाइट्रोजन, 21 केपीए ऑक्सीजन और 0.9 केपीए आर्गन का आंशिक दबाव होता है, वातावरण (यूनिट) के लिए कुल मिलाकर 102.2 केपीए, आधार बनाता है। | |||
== मापन और इकाइयां == | == मापन और इकाइयां == | ||
वाष्प दबाव को दबाव की मानक इकाइयों में मापा जाता है। [[ इकाइयों की अंतर्राष्ट्रीय प्रणाली |इकाइयों की अंतर्राष्ट्रीय प्रणाली]] ( | वाष्प दबाव को दबाव की मानक इकाइयों में मापा जाता है। [[ इकाइयों की अंतर्राष्ट्रीय प्रणाली |इकाइयों की अंतर्राष्ट्रीय प्रणाली]] (एसआई) दबाव को एसआई व्युत्पन्न इकाई के रूप में प्रति क्षेत्र बल के आयाम के साथ पहचानता है और [[ पास्कल (यूनिट) |पास्कल (यूनिट)]] (पीए) को इसकी मानक इकाई के रूप में नामित करता है। पास्कल न्यूटन (इकाई) प्रति [[ वर्ग मीटर |वर्ग मीटर]] (N·m<sup>−2</sup> or kg·m<sup>−1</sup>·s<sup>−2</sup>). | ||
वाष्प दबाव का प्रायोगिक माप 1 और 200 | वाष्प दबाव का प्रायोगिक माप 1 और 200 केपीए के बीच सामान्य दबावों के लिए सरल प्रक्रिया है।<ref>{{cite web |url=http://www.capec.kt.dtu.dk/documents/overview/Vapor-pressure-Ruzicka.pdf |title=Vapor Pressure of Organic Compounds. Measurement and Correlation |author1=Růžička, K. |author2=Fulem, M. |author3=Růžička, V. |name-list-style=amp |access-date=2009-10-18 |archive-url=https://web.archive.org/web/20101226095004/http://www.capec.kt.dtu.dk/documents/overview/Vapor-pressure-Ruzicka.pdf |archive-date=2010-12-26 |url-status=dead }}</ref> अधिकांश त्रुटिहीन परिणाम पदार्थों के क्वथनांक के पास प्राप्त होते हैं और माप के बड़े त्रुटि परिणाम से छोटे होते हैं । प्रक्रियाओं में अधिकांशतः परीक्षण पदार्थ को शुद्ध करना, इसे कंटेनर में अलग करना, किसी भी विदेशी गैस को निकालना, फिर विभिन्न तापमानों पर कंटेनर में पदार्थ के गैसीय चरण के संतुलन के दबाव को मापना सम्मलित होता है। बेहतर त्रुटिहीन तब प्राप्त होती है जब यह सुनिश्चित करने के लिए देखभाल की जाती है कि संपूर्ण पदार्थ और उसका वाष्प निर्धारित तापमान पर है। यह अधिकांशतः किया जाता है, जैसा कि तरल स्नान में रोकथाम क्षेत्र को जलमग्न करके, [[ isotenoscope |आइसोटेनोस्कोप]] के उपयोग के साथ किया जाता है। | ||
[[ नुडसन इफ्यूजन सेल | नुडसन इफ्यूजन सेल]] विधि का उपयोग करके ठोस पदार्थों के बहुत कम वाष्प दबावों को मापा जा सकता है। | [[ नुडसन इफ्यूजन सेल | नुडसन इफ्यूजन सेल]] विधि का उपयोग करके ठोस पदार्थों के बहुत कम वाष्प दबावों को मापा जा सकता है। | ||
एक चिकित्सा संदर्भ में, वाष्प दबाव कभी-कभी अन्य इकाइयों में व्यक्त किया जाता है, विशेष रूप से पारा के मिलीमीटर | पारा के मिलीमीटर (एमएमएचजी)। यह अस्थिर एनेस्थेटिक्स के लिए महत्वपूर्ण है, जिनमें से अधिकांश शरीर के तापमान पर तरल होते | एक चिकित्सा संदर्भ में, वाष्प दबाव कभी-कभी अन्य इकाइयों में व्यक्त किया जाता है, विशेष रूप से पारा के मिलीमीटर | पारा के मिलीमीटर (एमएमएचजी)। यह अस्थिर एनेस्थेटिक्स के लिए महत्वपूर्ण है, किंतु अपेक्षाकृत उच्च वाष्प दबाव के साथ, जिनमें से अधिकांश शरीर के तापमान पर तरल होते हैं। | ||
==== [[ एंटोनी समीकरण |एंटोनी समीकरण]] के साथ वाष्प के दबाव का अनुमान लगाना ==== | ==== [[ एंटोनी समीकरण |एंटोनी समीकरण]] के साथ वाष्प के दबाव का अनुमान लगाना ==== | ||
| Line 26: | Line 25: | ||
<math display="block">T = \frac{B}{A-\log P} - C</math> | <math display="block">T = \frac{B}{A-\log P} - C</math> | ||
जहाँ पे: | |||
* <math>P</math> किसी पदार्थ का पूर्ण वाष्प दाब है | * <math>P</math> किसी पदार्थ का पूर्ण वाष्प दाब है | ||
* <math>T</math> पदार्थ का तापमान है | * <math>T</math> पदार्थ का तापमान है | ||
* <math>A</math>, <math>B</math> और <math>C</math> पदार्थ-विशिष्ट गुणांक हैं (अर्थात, स्थिरांक या पैरामीटर) | * <math>A</math>, <math>B</math> और <math>C</math> पदार्थ-विशिष्ट गुणांक हैं (अर्थात, स्थिरांक या पैरामीटर) | ||
* | * शैली = लंबवत-संरेखण:-30%; ><math>\log</math> सामान्यतः या तो है <math>\log_{10}</math> या <math>\log_e</math><ref name=Sinnot/> | ||
केवल दो गुणांक वाले समीकरण का सरल रूप कभी-कभी उपयोग किया जाता है: | केवल दो गुणांक वाले समीकरण का सरल रूप कभी-कभी उपयोग किया जाता है: | ||
| Line 38: | Line 37: | ||
<math display="block">T = \frac{B}{A-\log P}</math> | <math display="block">T = \frac{B}{A-\log P}</math> | ||
एक ही पदार्थ के उर्ध्वपातन और वाष्पीकरण में एंटोनी गुणांक के अलग-अलग सेट होते हैं, जैसा कि मिश्रण में घटक करते हैं।<ref name=frostburg/>एक विशिष्ट यौगिक के लिए निर्धारित प्रत्येक पैरामीटर केवल निर्दिष्ट तापमान सीमा पर लागू होता है। सामान्यतः, तापमान रेंज को समीकरण की | एक ही पदार्थ के उर्ध्वपातन और वाष्पीकरण में एंटोनी गुणांक के अलग-अलग सेट होते हैं, जैसा कि मिश्रण में घटक करते हैं।<ref name=frostburg/> एक विशिष्ट यौगिक के लिए निर्धारित प्रत्येक पैरामीटर केवल निर्दिष्ट तापमान सीमा पर लागू होता है। सामान्यतः, तापमान रेंज को समीकरण की त्रुटिहीन को 8-10 प्रतिशत तक बनाए रखने के लिए चुना जाता है। कई वाष्पशील पदार्थों के लिए, मापदंडों के कई अलग-अलग सेट उपलब्ध हैं और विभिन्न तापमान रेंज के लिए उपयोग किए जाते हैं। किसी यौगिक के गलनांक से उसके महत्वपूर्ण तापमान तक उपयोग किए जाने पर किसी एकल पैरामीटर सेट के साथ एंटोनी समीकरण की त्रुटिहीन खराब होती है। उपकरण की सीमाओं के कारण वाष्प का दबाव 10 टोर से कम होने पर त्रुटिहीन भी सामान्यतः खराब होती है{{citation needed|date=January 2020}} एंटोनी पैरामीटर मान स्थापित करने के लिए उपयोग किया जाता है। | ||
वैगनर समीकरण<ref>{{Citation|last= Wagner|first= W.|title= New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations|journal= Cryogenics| volume= 13|issue= 8|pages= 470–482 |year= 1973|doi= 10.1016/0011-2275(73)90003-9 |bibcode = 1973Cryo...13..470W }}</ref> सर्वश्रेष्ठ में से देता है<ref>Perry's Chemical Engineers' Handbook, 7th Ed. pp. 4–15</ref> प्रयोगात्मक डेटा के लिए फिट बैठता है | वैगनर समीकरण<ref>{{Citation|last= Wagner|first= W.|title= New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations|journal= Cryogenics| volume= 13|issue= 8|pages= 470–482 |year= 1973|doi= 10.1016/0011-2275(73)90003-9 |bibcode = 1973Cryo...13..470W }}</ref> सर्वश्रेष्ठ में से देता है<ref>Perry's Chemical Engineers' Handbook, 7th Ed. pp. 4–15</ref> प्रयोगात्मक डेटा के लिए फिट बैठता है किंतु अधिक जटिल है। यह कम वाष्प दबाव को कम तापमान के समारोह के रूप में व्यक्त करता है। | ||
== तरल पदार्थ के क्वथनांक से संबंध == | == तरल पदार्थ के क्वथनांक से संबंध == | ||
{{further|क्वथनांक}} | {{further|क्वथनांक}} | ||
[[Image:vapor_pressure_chart.svg|thumb|right|विभिन्न तरल पदार्थों के लिए लॉग-लिन वाष्प दबाव चार्ट]]एक सामान्य प्रवृत्ति के रूप में, परिवेश के तापमान पर तरल पदार्थ का वाष्प दबाव घटते क्वथनांक के साथ बढ़ता है। यह वाष्प दबाव चार्ट (दाएं देखें) में दिखाया गया है जो विभिन्न प्रकार के तरल पदार्थों के वाष्प दबाव बनाम तापमान के ग्राफ दिखाता है।<ref>{{cite book|editor=Perry, R.H. |editor2=Green, D.W. |title=Perry's Chemical Engineers' Handbook|edition=7th|publisher=McGraw-Hill|year=1997|isbn= 978-0-07-049841-9|title-link=Perry's Chemical Engineers' Handbook }}</ref> तरल के सामान्य क्वथनांक पर, वाष्प का दबाव मानक वायुमंडलीय दबाव के बराबर होता है जिसे 1 वायुमंडल के रूप में परिभाषित किया जाता है,<ref>{{cite book|author=Petrucci, Ralph H. |author2=Harwood, William S. |author3=Herring, F.Geoffrey |title=General Chemistry |url=https://archive.org/details/generalchemistry00hill |url-access=registration |edition=8th|publisher=Prentice Hall|year=2002|isbn= 978-0-13-014329-7|page=[https://archive.org/details/generalchemistry00hill/page/484 484]}}</ref> | [[Image:vapor_pressure_chart.svg|thumb|right|विभिन्न तरल पदार्थों के लिए लॉग-लिन वाष्प दबाव चार्ट]]एक सामान्य प्रवृत्ति के रूप में, परिवेश के तापमान पर तरल पदार्थ का वाष्प दबाव घटते क्वथनांक के साथ बढ़ता है। यह वाष्प दबाव चार्ट (दाएं देखें) में दिखाया गया है जो विभिन्न प्रकार के तरल पदार्थों के वाष्प दबाव बनाम तापमान के ग्राफ दिखाता है।<ref>{{cite book|editor=Perry, R.H. |editor2=Green, D.W. |title=Perry's Chemical Engineers' Handbook|edition=7th|publisher=McGraw-Hill|year=1997|isbn= 978-0-07-049841-9|title-link=Perry's Chemical Engineers' Handbook }}</ref> तरल के सामान्य क्वथनांक पर, वाष्प का दबाव मानक वायुमंडलीय दबाव के बराबर होता है जिसे 1 वायुमंडल के रूप में परिभाषित किया जाता है,<ref>{{cite book|author=Petrucci, Ralph H. |author2=Harwood, William S. |author3=Herring, F.Geoffrey |title=General Chemistry |url=https://archive.org/details/generalchemistry00hill |url-access=registration |edition=8th|publisher=Prentice Hall|year=2002|isbn= 978-0-13-014329-7|page=[https://archive.org/details/generalchemistry00hill/page/484 484]}}</ref> 760 टोर, 101.325 केपीए, या 14.69595 पीएसआई। | ||
उदाहरण के लिए, किसी दिए गए तापमान पर, [[ मिथाइल क्लोराइड |मिथाइल क्लोराइड]] में चार्ट में किसी भी तरल पदार्थ का उच्चतम वाष्प दबाव होता है। इसमें सबसे कम सामान्य क्वथनांक भी होता है {{Convert|−24.2|°C}}, जहां मिथाइल क्लोराइड (नीली रेखा) का वाष्प दबाव वक्र पूर्ण वाष्प दबाव के वायुमंडल (वातावरण (इकाई)) की क्षैतिज दबाव रेखा को काटता है। | उदाहरण के लिए, किसी दिए गए तापमान पर, [[ मिथाइल क्लोराइड |मिथाइल क्लोराइड]] में चार्ट में किसी भी तरल पदार्थ का उच्चतम वाष्प दबाव होता है। इसमें सबसे कम सामान्य क्वथनांक भी होता है {{Convert|−24.2|°C}}, जहां मिथाइल क्लोराइड (नीली रेखा) का वाष्प दबाव वक्र पूर्ण वाष्प दबाव के वायुमंडल (वातावरण (इकाई)) की क्षैतिज दबाव रेखा को काटता है। | ||
चूंकि वाष्प दबाव और तापमान के बीच का संबंध गैर-रैखिक है, चार्ट थोड़ा घुमावदार रेखाओं का निर्माण करने के लिए लॉगरिदमिक वर्टिकल | चूंकि वाष्प दबाव और तापमान के बीच का संबंध गैर-रैखिक है, चार्ट थोड़ा घुमावदार रेखाओं का निर्माण करने के लिए लॉगरिदमिक वर्टिकल एक्सिस का उपयोग करता है, इसलिए चार्ट कई तरल पदार्थों को ग्राफ़ कर सकता है। वाष्प दाब के लघुगणक को 1/(T + 230) के विरुद्ध आलेखित करने पर लगभग सीधी रेखा प्राप्त होती है।<ref>{{cite news|author1=Dreisbach, R. R. |author2=Spencer, R. S. |name-list-style=amp | title=Infinite Points of Cox Chart Families and dt/dP Values at any Pressure|journal=Industrial and Engineering Chemistry|volume=41|number=1|page=176|date= 1949|doi=10.1021/ie50469a040}}</ref> जहाँ T डिग्री सेल्सियस में तापमान है। क्वथनांक पर किसी द्रव का वाष्प दाब उसके आस-पास के वातावरण के दाब के बराबर होता है। | ||
== तरल मिश्रण: राउल्ट का नियम == | == तरल मिश्रण: राउल्ट का नियम == | ||
| Line 55: | Line 54: | ||
:<math> P_{\rm tot} =\sum_i P y_i = \sum_i P_i^{\rm sat} x_i \,</math> | :<math> P_{\rm tot} =\sum_i P y_i = \sum_i P_i^{\rm sat} x_i \,</math> | ||
कहाँ पे <math>P_{\rm tot}</math> मिश्रण का वाष्प दाब है, <math>x_i</math> घटक का मोल अंश है <math>i</math> तरल चरण में और <math>y | कहाँ पे <math>P_{\rm tot}</math> मिश्रण का वाष्प दाब है, <math>x_i</math> घटक का मोल अंश है <math>i</math> तरल चरण में और <math>y | ||
_i</math> घटक का मोल अंश है <math>i</math> वाष्प चरण में क्रमशः। <math>P_i^{\rm sat}</math> घटक का वाष्प दाब है <math>i</math>. राउल्ट का नियम केवल गैर-इलेक्ट्रोलाइट्स (अपरिवर्तित प्रजातियों) पर लागू होता है; यह गैर-ध्रुवीय अणुओं के लिए सबसे उपयुक्त है, जिनमें केवल | _i</math> घटक का मोल अंश है <math>i</math> वाष्प चरण में क्रमशः। <math>P_i^{\rm sat}</math> घटक का वाष्प दाब है <math>i</math>. राउल्ट का नियम केवल गैर-इलेक्ट्रोलाइट्स (अपरिवर्तित प्रजातियों) पर लागू होता है; यह गैर-ध्रुवीय अणुओं के लिए सबसे उपयुक्त है, जिनमें केवल शक्तिहीन अंतर-आणविक आकर्षण (जैसे [[ लंदन बल |लंदन फोर्सेज]]) हैं। | ||
उपरोक्त सूत्र द्वारा इंगित वाष्प दबाव वाले प्रणाली को सकारात्मक विचलन कहा जाता है। इस तरह का विचलन शुद्ध घटकों की तुलना में | उपरोक्त सूत्र द्वारा इंगित वाष्प दबाव वाले प्रणाली को सकारात्मक विचलन कहा जाता है। इस तरह का विचलन शुद्ध घटकों की तुलना में शक्तिहीन अंतर-आणविक आकर्षण का सुझाव देता है, जिससे कि अणुओं को तरल चरण में शुद्ध तरल की तुलना में कम दृढ़ता से आयोजित करने के बारे में सोचा जा सके। उदाहरण लगभग 95% इथेनॉल और पानी का [[ azeotrope |अजिओट्रॉप]] है। क्योंकि अजिओट्रॉप का वाष्प दाब राउल्ट के नियम की भविष्यवाणी से अधिक है, यह किसी भी शुद्ध घटक के तापमान से कम तापमान पर उबलता है। | ||
नकारात्मक विचलन वाली प्रणालियाँ भी हैं जिनमें वाष्प दबाव अपेक्षा से कम है। इस तरह का विचलन शुद्ध घटकों की तुलना में मिश्रण के घटकों के बीच | नकारात्मक विचलन वाली प्रणालियाँ भी हैं जिनमें वाष्प दबाव अपेक्षा से कम है। इस तरह का विचलन शुद्ध घटकों की तुलना में मिश्रण के घटकों के बीच शक्तिशाली अंतर-आणविक आकर्षण का प्रमाण है। इस प्रकार, जब कोई दूसरा अणु उपस्तिथ होता है तो अणु तरल में अधिक शक्तिशाली से बने रहते हैं। उदाहरण ट्राइक्लोरोमेथेन (क्लोरोफॉर्म) और 2-प्रोपेनोन (एसीटोन) का मिश्रण है, जो किसी भी शुद्ध घटक के क्वथनांक से ऊपर उबलता है। | ||
मिश्रण के घटकों के [[ थर्मोडायनामिक गतिविधि |ऊष्मागतिकी गतिविधि]] गुणांक निर्धारित करने के लिए नकारात्मक और सकारात्मक विचलन का उपयोग किया जा सकता है। | मिश्रण के घटकों के [[ थर्मोडायनामिक गतिविधि |ऊष्मागतिकी गतिविधि]] गुणांक निर्धारित करने के लिए नकारात्मक और सकारात्मक विचलन का उपयोग किया जा सकता है। | ||
== ठोस == | == ठोस == | ||
[[Image:Vapor Pressure Curve of Liquid and Solid Benzene.png|thumb|upright=1.25|तरल और ठोस बेंजीन का वाष्प दबाव]]संतुलन वाष्प दाब को उस दबाव के रूप में परिभाषित किया जा सकता है जब संघनित चरण अपने स्वयं के वाष्प के साथ संतुलन में होता है। संतुलन ठोस | [[Image:Vapor Pressure Curve of Liquid and Solid Benzene.png|thumb|upright=1.25|तरल और ठोस बेंजीन का वाष्प दबाव]]संतुलन वाष्प दाब को उस दबाव के रूप में परिभाषित किया जा सकता है जब संघनित चरण अपने स्वयं के वाष्प के साथ संतुलन में होता है। संतुलन ठोस की स्थितियों में, जैसे कि [[ क्रिस्टल |क्रिस्टल]], इसे दबाव के रूप में परिभाषित किया जा सकता है जब ठोस के [[ उच्च बनाने की क्रिया (भौतिकी) |उच्च बनाने की क्रिया (भौतिकी)]] की दर उसके वाष्प चरण के जमाव की दर से मेल खाती है। अधिकांश ठोस पदार्थों के लिए यह दबाव बहुत कम होता है, किंतु कुछ उल्लेखनीय अपवाद हैं [[ नेफ़थलीन |नेफ़थलीन]], [[ सूखी बर्फ |सूखी बर्फ]] (शुष्क बर्फ का वाष्प दबाव 5.73 एम्पीए (831 पीएसआई, 56.5 एटीएम्) 20 °C पर होता है, जिसके कारण अधिकांश सीलबंद कंटेनर फट जाते हैं), और बर्फ। सभी ठोस पदार्थों में वाष्प का दबाव होता है। चूंकि, उनके अधिकांशतः अत्यधिक कम मूल्यों के कारण मापन अधिक जटिल हो सकता है। विशिष्ट तकनीकों में [[ थर्मोग्रैविमेट्री |थर्मोग्रैविमेट्री]] और गैस वाष्पोत्सर्जन का उपयोग सम्मलित है। | ||
किसी ठोस के उर्ध्वपातन दाब (अर्थात् वाष्प दाब) की गणना के लिए कई विधियाँ हैं। क्लॉसियस-क्लैपेरॉन संबंध के इस विशेष रूप का उपयोग करके, [[ संलयन की तापीय धारिता |संलयन की तापीय धारिता]] ज्ञात होने पर, बहिर्वेशित तरल वाष्प दबावों (सुपरकूल्ड तरल के) से उर्ध्वपातन दबाव का अनुमान लगाने | किसी ठोस के उर्ध्वपातन दाब (अर्थात् वाष्प दाब) की गणना के लिए कई विधियाँ हैं। क्लॉसियस-क्लैपेरॉन संबंध के इस विशेष रूप का उपयोग करके, [[ संलयन की तापीय धारिता |संलयन की तापीय धारिता]] ज्ञात होने पर, बहिर्वेशित तरल वाष्प दबावों (सुपरकूल्ड तरल के) से उर्ध्वपातन दबाव का अनुमान लगाने की विधि है:<ref name="Moller">{{cite journal|author1=Moller B. |author2=Rarey J. |author3=Ramjugernath D. |title=Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions|journal=Journal of Molecular Liquids|volume=143|pages=52–63|doi=10.1016/j.molliq.2008.04.020 |year=2008}}</ref> | ||
:<math>\ln\,P^{\rm sub}_{\rm s} = \ln\,P^{\rm sub}_{\rm l} - \frac{\Delta_{\rm fus}H}{R} \left( \frac{1}{T_{\rm sub}} - \frac{1}{T_{\rm fus}} \right)</math> | :<math>\ln\,P^{\rm sub}_{\rm s} = \ln\,P^{\rm sub}_{\rm l} - \frac{\Delta_{\rm fus}H}{R} \left( \frac{1}{T_{\rm sub}} - \frac{1}{T_{\rm fus}} \right)</math> | ||
कहाँ पे: | कहाँ पे: | ||
| Line 77: | Line 76: | ||
* <math>T_{\rm fus}</math> गलनांक तापमान है। | * <math>T_{\rm fus}</math> गलनांक तापमान है। | ||
यह विधि मानती है कि संलयन की ऊष्मा तापमान-स्वतंत्र है, विभिन्न ठोस चरणों के बीच अतिरिक्त संक्रमण तापमान की उपेक्षा करती है, और यह तापमान के लिए उचित अनुमान देती है जो गलनांक से बहुत दूर नहीं है। | यह विधि मानती है कि संलयन की ऊष्मा तापमान-स्वतंत्र है, विभिन्न ठोस चरणों के बीच अतिरिक्त संक्रमण तापमान की उपेक्षा करती है, और यह तापमान के लिए उचित अनुमान देती है जो गलनांक से बहुत दूर नहीं है। यह भी दर्शाता है कि उर्ध्वपातन दाब बहिर्वेशित द्रव वाष्प दाब (Δ<sub>fus</sub>एच> 0) और अंतर गलनांक से बढ़ी हुई दूरी के साथ बढ़ता है। | ||
== पानी का क्वथनांक == | == पानी का क्वथनांक == | ||
| Line 91: | Line 90: | ||
== डुह्रिंग का नियम == | == डुह्रिंग का नियम == | ||
{{main| | {{main|डुह्रिंग का नियम}} | ||
डुह्रिंग के नियम में कहा गया है कि तापमान के बीच रैखिक संबंध | डुह्रिंग के नियम में कहा गया है कि तापमान के बीच रैखिक संबंध उपस्तिथ होता है जिस पर दो समाधान समान वाष्प दबाव डालते हैं। | ||
== उदाहरण == | == उदाहरण == | ||
| Line 102: | Line 101: | ||
(°C) | (°C) | ||
|- | |- | ||
! ( | ! (पीए) | ||
! ( | !(बार) | ||
! ( | !(एमएमएचजी) | ||
|- | |- | ||
| | | ऑक्टेथिलीन ग्लाइकोल<ref>{{cite journal |author1=Krieger, Ulrich K. |author2=Siegrist, Franziska |author3=Marcolli, Claudia |author4=Emanuelsson, Eva U. |author5=Gøbel, Freya M. |author6=Bilde, Merete |title=A reference data set for validating vapor pressure measurement techniques: homologous series of polyethylene glycols |journal=[[Atmospheric Measurement Techniques]] |date=8 January 2018 |volume=11 |issue=1 |pages=49–63 |doi=10.5194/amt-11-49-2018 |url=https://amt.copernicus.org/articles/11/49/2018/amt-11-49-2018.pdf |archive-url=https://ghostarchive.org/archive/20221009/https://amt.copernicus.org/articles/11/49/2018/amt-11-49-2018.pdf |archive-date=2022-10-09 |url-status=live |access-date=7 April 2022 |publisher=[[Copernicus Publications]] |issn=1867-1381}}</ref> | ||
| 9.2×10<sup>−8</sup> | | 9.2×10<sup>−8</sup> पीए | ||
| 9.2×10<sup>−13</sup> | | 9.2×10<sup>−13</sup> | ||
| 6.9×10<sup>−10</sup> | | 6.9×10<sup>−10</sup> | ||
| Line 114: | Line 113: | ||
|- | |- | ||
| [[Glycerol]] | | [[Glycerol|ग्लिसरॉल]] | ||
| 0.4 | | 0.4 पीए | ||
| 0.000004 | | 0.000004 | ||
| 0.003 | | 0.003 | ||
| Line 121: | Line 120: | ||
|- | |- | ||
| [[Mercury (element)| | | [[Mercury (element)|मरकरी]] | ||
| 1 | | 1 पीए | ||
| 0.00001 | | 0.00001 | ||
| 0.0075 | | 0.0075 | ||
| Line 128: | Line 127: | ||
|- | |- | ||
| [[Tungsten]] | | [[Tungsten|टंगस्टन]] | ||
| 1 | | 1 पीए | ||
| 0.00001 | | 0.00001 | ||
| 0.0075 | | 0.0075 | ||
| Line 135: | Line 134: | ||
|- | |- | ||
| [[Xenon difluoride]] | | [[Xenon difluoride|क्सीनन '''फ्लोराइड''']] | ||
| 600 | | 600 पीए | ||
| 0.006 | | 0.006 | ||
| 4.50 | | 4.50 | ||
| Line 142: | Line 141: | ||
|- | |- | ||
| [[Water]] (H<sub>2</sub>O) | | [[Water|वाटर]] (H<sub>2</sub>O) | ||
| 2.3 | | 2.3 केपीए | ||
| 0.023 | | 0.023 | ||
| 17.5 | | 17.5 | ||
| Line 149: | Line 148: | ||
|- | |- | ||
| [[Propanol]] | | [[Propanol|प्रोपेनोल]] | ||
| 2.4 | | 2.4 केपीए | ||
| 0.024 | | 0.024 | ||
| 18.0 | | 18.0 | ||
| Line 156: | Line 155: | ||
|- | |- | ||
| [[Methyl isobutyl ketone]] | | [[Methyl isobutyl ketone|मिथाइल आइसोबुटिल कीटोन]] | ||
| 2.66 | | 2.66 केपीए | ||
| 0.0266 | | 0.0266 | ||
| 19.95 | | 19.95 | ||
| Line 163: | Line 162: | ||
|- | |- | ||
| [[Ethanol]] | | [[Ethanol|इथेनॉल]] | ||
| 5.83 | | 5.83 केपीए | ||
| 0.0583 | | 0.0583 | ||
| 43.7 | | 43.7 | ||
| Line 170: | Line 169: | ||
|- | |- | ||
| [[Freon| | | [[Freon|फ्रिओंन 113]] | ||
| 37.9 | | 37.9 केपीए | ||
| 0.379 | | 0.379 | ||
| 284 | | 284 | ||
| Line 177: | Line 176: | ||
|- | |- | ||
| [[Acetaldehyde]] | | [[Acetaldehyde|एसीटैल्डिहाइड]] | ||
| 98.7 | | 98.7 केपीए | ||
| 0.987 | | 0.987 | ||
| 740 | | 740 | ||
| Line 184: | Line 183: | ||
|- | |- | ||
| [[Butane]] | | [[Butane|ब्यूटेन]] | ||
| 220 | | 220 केपीए | ||
| 2.2 | | 2.2 | ||
| 1650 | | 1650 | ||
| Line 191: | Line 190: | ||
|- | |- | ||
| [[Formaldehyde]] | | [[Formaldehyde|फॉर्मल्डेहाइड]] | ||
| 435.7 | | 435.7 केपीए | ||
| 4.357 | | 4.357 | ||
| 3268 | | 3268 | ||
| Line 198: | Line 197: | ||
|- | |- | ||
| [[Propane]]<ref>[https://www.nist.gov/data/PDFfiles/jpcrd331.pdf "''Thermophysical Properties Of Fluids II – Methane, Ethane, Propane, Isobutane, And Normal Butane''"] {{Webarchive|url=https://web.archive.org/web/20161221135455/http://nist.gov/data/PDFfiles/jpcrd331.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://nist.gov/data/PDFfiles/jpcrd331.pdf |archive-date=2022-10-09 |url-status=live |date=2016-12-21 }} (page 110 of PDF, page 686 of original document), BA Younglove and JF Ely.</ref> | | [[Propane|प्रोपेन]]<ref>[https://www.nist.gov/data/PDFfiles/jpcrd331.pdf "''Thermophysical Properties Of Fluids II – Methane, Ethane, Propane, Isobutane, And Normal Butane''"] {{Webarchive|url=https://web.archive.org/web/20161221135455/http://nist.gov/data/PDFfiles/jpcrd331.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://nist.gov/data/PDFfiles/jpcrd331.pdf |archive-date=2022-10-09 |url-status=live |date=2016-12-21 }} (page 110 of PDF, page 686 of original document), BA Younglove and JF Ely.</ref> | ||
| 997.8 | | 997.8 केपीए | ||
| 9.978 | | 9.978 | ||
| 7584 | | 7584 | ||
| Line 205: | Line 204: | ||
|- | |- | ||
| [[Carbonyl sulfide]] | | [[Carbonyl sulfide|कार्बोनिल सल्फाइड]] | ||
| 1.255 | | 1.255 एम् पीए | ||
| 12.55 | | 12.55 | ||
| 9412 | | 9412 | ||
| Line 212: | Line 211: | ||
|- | |- | ||
| [[Nitrous oxide]]<ref>[http://edge.rit.edu/content/P07106/public/Nox.pdf "''Thermophysical Properties Of Nitrous Oxide''"] (page 14 of PDF, page 10 of original document), ESDU.</ref> | | [[Nitrous oxide|नाइट्रस ऑक्साइड]]<ref>[http://edge.rit.edu/content/P07106/public/Nox.pdf "''Thermophysical Properties Of Nitrous Oxide''"] (page 14 of PDF, page 10 of original document), ESDU.</ref> | ||
| 5.660 | | 5.660 एम् पीए | ||
| 56.60 | | 56.60 | ||
| 42453 | | 42453 | ||
| Line 219: | Line 218: | ||
|- | |- | ||
| [[Carbon dioxide]] | | [[Carbon dioxide|कार्बन डाइऑक्साइड]] | ||
| 5.7 | | 5.7 एम् पीए | ||
| 57 | | 57 | ||
| 42753 | | 42753 | ||
| Line 226: | Line 225: | ||
|} | |} | ||
== आणविक संरचना से वाष्प दाब का आकलन == | |||
== | कार्बनिक अणुओं के लिए आणविक संरचना से वाष्प के दबाव का अनुमान लगाने के लिए कई अनुभवजन्य विधिया उपस्तिथ हैं। कुछ उदाहरण सिम्पोल.1 विधि हैं,<ref>{{cite journal|author=Pankow, J. F. |title=SIMPOL.1: a simple group contribution method for predicting vapor pressures and enthalpies of vaporization of multifunctional organic compounds|journal=Atmos. Chem. Phys.|volume=8|issue=10|pages=2773–2796|year=2008|doi=10.5194/acp-8-2773-2008|bibcode=2008ACP.....8.2773P|display-authors=etal|doi-access=free}}</ref> मोलर एट अल की विधि।<ref name = "Moller" /> और वाष्पीकरण (ऑर्गेनिक्स के वाष्प दबाव का अनुमान, तापमान के लिए लेखांकन, इंट्रामोलेक्युलर, और गैर-एडिटिविटी प्रभाव)।<ref>{{Cite web|url=http://tropo.aeronomie.be/models/evaporation_run.htm|title=Vapour pressure of Pure Liquid Organic Compounds: Estimation by EVAPORATION|date=11 June 2014|website=Tropospheric Chemistry Modelling at BIRA-IASB|access-date=2018-11-26}}</ref><ref>{{cite journal|author=Compernolle, S. |title=EVAPORATION: a new vapour pressure estimation method for organic molecules including non-additivity and intramolecular interactions|journal=Atmos. Chem. Phys.|volume=11|issue=18|pages=9431–9450|year=2011|url=http://www.atmos-chem-phys.net/11/9431/2011/acp-11-9431-2011.html|doi=10.5194/acp-11-9431-2011|bibcode = 2011ACP....11.9431C |display-authors=etal|doi-access=free}}</ref> | ||
कार्बनिक अणुओं के लिए आणविक संरचना से वाष्प के दबाव का अनुमान लगाने के लिए कई अनुभवजन्य | == मौसम विज्ञान में == | ||
मौसम विज्ञान में, वाष्प दाब शब्द का अर्थ है वातावरण में [[ पानी का वाष्प दाब |पानी का वाष्प दाब]], यदि वह संतुलन में न हो।<ref name="ams glossary vapor pressure"> | |||
== मौसम विज्ञान में | |||
मौसम विज्ञान में, वाष्प दाब शब्द का अर्थ है वातावरण में [[ पानी का वाष्प दाब |पानी का वाष्प दाब]] , | |||
{{Cite encyclopedia |url=https://glossary.ametsoc.org/wiki/Vapor_pressure |title=vapor pressure |date=2012 |access-date=2022-11-28 |encyclopedia=Glossary of Meteorology |author=American Meteorological Society |author-link=American Meteorological Society}} | {{Cite encyclopedia |url=https://glossary.ametsoc.org/wiki/Vapor_pressure |title=vapor pressure |date=2012 |access-date=2022-11-28 |encyclopedia=Glossary of Meteorology |author=American Meteorological Society |author-link=American Meteorological Society}} | ||
</ref> यह अन्य विज्ञानों में इसके अर्थ से भिन्न है।<ref name="ams glossary vapor pressure" />[[ अमेरिकी मौसम विज्ञान सोसायटी | अमेरिकी मौसम विज्ञान सोसायटी]] ग्लोसरी ऑफ़ मेटेरोलॉजी के अनुसार, 'संतृप्ति वाष्प दबाव' ठीक से तरल पानी या ठोस बर्फ की सपाट सतह के ऊपर पानी के संतुलन वाष्प दबाव को संदर्भित करता है, और यह केवल तापमान का कार्य है और संघनित चरण तरल है या | </ref> यह अन्य विज्ञानों में इसके अर्थ से भिन्न है।<ref name="ams glossary vapor pressure" />[[ अमेरिकी मौसम विज्ञान सोसायटी | अमेरिकी मौसम विज्ञान सोसायटी]] ग्लोसरी ऑफ़ मेटेरोलॉजी के अनुसार, 'संतृप्ति वाष्प दबाव' ठीक से तरल पानी या ठोस बर्फ की सपाट सतह के ऊपर पानी के संतुलन वाष्प दबाव को संदर्भित करता है, और यह केवल तापमान का कार्य है और संघनित चरण तरल है या ठोस है ।<ref name="ams glossary saturation vapor pressure"> | ||
{{Cite encyclopedia |title=saturation vapor pressure |url=https://glossary.ametsoc.org/wiki/Saturation_vapor_pressure |date=2020 |access-date=2022-11-28 |encyclopedia=Glossary of Meteorology |author=American Meteorological Society |author-link=American Meteorological Society}} | {{Cite encyclopedia |title=saturation vapor pressure |url=https://glossary.ametsoc.org/wiki/Saturation_vapor_pressure |date=2020 |access-date=2022-11-28 |encyclopedia=Glossary of Meteorology |author=American Meteorological Society |author-link=American Meteorological Society}} | ||
</ref> | </ref> | ||
चूंकि, इन शब्दों का उपयोग असंगत रूप से किया जाता है, और कुछ लेखक | सापेक्ष आर्द्रता को संतृप्ति वाष्प दाब के सापेक्ष परिभाषित किया जाता है।<ref name="Babin" /> संतुलन वाष्प दबाव के लिए संघनित चरण को समतल सतह होने की आवश्यकता नहीं होती है; इसमें छोटी-छोटी बूंदें हो सकती हैं जिनमें संभवतः विलेय (अशुद्धियाँ) हों, जैसे कि [[ बादल |बादल]] ।<ref name="ams glossary equilibrium vapor pressure" /><ref name="Babin" /> बूंदों के आकार और [[ बादल संघनन नाभिक |बादल संघनन नाभिक]] के रूप में कार्य करने वाले अन्य कणों की उपस्थिति के आधार पर संतुलन वाष्प दबाव संतृप्ति वाष्प दबाव से अधिक भिन्न हो सकता है।<ref name="ams glossary equilibrium vapor pressure">{{Cite encyclopedia |title=equilibrium vapor pressure |date=2012 |url=https://glossary.ametsoc.org/wiki/Equilibrium_vapor_pressure |access-date=2022-11-28 |encyclopedia=Glossary of Meteorology |author=American Meteorological Society |author-link=American Meteorological Society}}</ref><ref name="Babin" /> | ||
अभी भी वर्तमान शब्द संतृप्ति वाष्प दबाव अप्रचलित सिद्धांत से निकला है कि जल वाष्प हवा में घुल जाता है, और किसी दिए गए तापमान पर हवा संतृप्त होने से पहले केवल निश्चित मात्रा में पानी पकड़ सकती है।<ref name="Babin" /> | |||
चूंकि, इन शब्दों का उपयोग असंगत रूप से किया जाता है, और कुछ लेखक एएम्एस शब्दावली द्वारा दिए गए संकीर्ण अर्थ के बाहर संतृप्ति वाष्प दबाव का उपयोग करते हैं। उदाहरण के लिए, [[ वायुमंडलीय संवहन |वायुमंडलीय संवहन]] पर टेक्स्ट बताता है, [[ केल्विन प्रभाव |केल्विन प्रभाव]] के कारण छोटी बूंद की घुमावदार सतह पर <u>संतृप्ति वाष्प दबाव</u> का कारण समतल पानी की सतह की तुलना में अधिक होता है (महत्व दिया जाता है)।<ref>{{cite book |last=Raymond |first=David J. |publisher=[[New Mexico Institute of Mining and Technology]] |title=Atmospheric Convection |chapter=Chapter 5: Cloud Microphysics |page=73 |chapter-url=http://kestrel.nmt.edu/~raymond/classes/ph536/notes/microphys.pdf |archive-url=https://web.archive.org/web/20170329103831/http://kestrel.nmt.edu/~raymond/classes/ph536/notes/microphys.pdf |archive-date=2017-03-29 |url-status=live |date=2011-05-12 |access-date=2022-11-28}}</ref> | |||
अभी भी वर्तमान शब्द संतृप्ति वाष्प दबाव अप्रचलित सिद्धांत से निकला है कि जल वाष्प हवा में घुल जाता है, और किसी दिए गए तापमान पर हवा संतृप्त होने से पहले केवल निश्चित मात्रा में पानी पकड़ सकती है।<ref name="Babin" /> वास्तव में, जैसा कि डाल्टन के नियम (1802 से जाना जाता है) द्वारा कहा गया है, जल वाष्प या किसी पदार्थ का आंशिक दबाव हवा पर बिल्कुल भी निर्भर नहीं करता है, और प्रासंगिक तापमान तरल का होता है।<ref name="Babin" /> फिर भी, गलत धारणा जनता और यहां तक कि मौसम विज्ञानियों के बीच बनी रहती है, भ्रामक शर्तों संतृप्ति दबाव और सुपरसेटरेशन और सापेक्ष आर्द्रता की संबंधित परिभाषा से सहायता प्राप्त होती है।<ref name="Babin"> | |||
{{cite web |url=https://fermi.jhuapl.edu/people/babin/vapor/vapor.html |title=Relative Humidity & Saturation Vapor Pressure: A Brief Tutorial |last=Babin |first=Steven M. |publisher=[[Johns Hopkins University Applied Physics Laboratory]] |date=1998 |archive-url=https://web.archive.org/web/19980713043127/http://fermi.jhuapl.edu/people/babin/vapor/vapor.html |archive-date=1998-07-13 |url-status=live |access-date=2022-11-28}} (Alternate title: "Water Vapor Myths: A Brief Tutorial".) | {{cite web |url=https://fermi.jhuapl.edu/people/babin/vapor/vapor.html |title=Relative Humidity & Saturation Vapor Pressure: A Brief Tutorial |last=Babin |first=Steven M. |publisher=[[Johns Hopkins University Applied Physics Laboratory]] |date=1998 |archive-url=https://web.archive.org/web/19980713043127/http://fermi.jhuapl.edu/people/babin/vapor/vapor.html |archive-date=1998-07-13 |url-status=live |access-date=2022-11-28}} (Alternate title: "Water Vapor Myths: A Brief Tutorial".) | ||
</ref> | </ref> | ||
== यह भी देखें == | == यह भी देखें == | ||
* [[ पूर्ण आर्द्रता ]] | * [[ पूर्ण आर्द्रता ]] | ||
| Line 263: | Line 259: | ||
==संदर्भ== | ==संदर्भ== | ||
{{Reflist|30em}} | {{Reflist|30em}} | ||
==बाहरी कड़ियाँ== | ==बाहरी कड़ियाँ== | ||
| Line 272: | Line 267: | ||
*[http://www.aim.env.uea.ac.uk/aim/ddbst/pcalc_main.php Prediction of Vapor Pressures of Pure Liquid Organic Compounds] | *[http://www.aim.env.uea.ac.uk/aim/ddbst/pcalc_main.php Prediction of Vapor Pressures of Pure Liquid Organic Compounds] | ||
[[Category: | [[Category:All articles with unsourced statements]] | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with unsourced statements from January 2020]] | |||
[[Category: | |||
[[Category:Created On 18/01/2023]] | [[Category:Created On 18/01/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Webarchive template wayback links]] | |||
[[Category:इंजीनियरिंग ऊष्मप्रवैगिकी]] | |||
[[Category:गैसों]] | |||
[[Category:थर्मोडायनामिक गुण]] | |||
[[Category:दबाव]] | |||
[[Category:मौसम संबंधी अवधारणाएँ]] | |||
Latest revision as of 13:31, 27 October 2023

वाष्प दबाव या संतुलन वाष्प दबाव को संघनन स्तिथि के साथ ऊष्मा गतिकी संतुलन में वाष्प के कारण लगने वाले दबाव के रूप में परिभाषित किया गया है ( ऊष्मागतिकी प्रणाली या क्लोज्ड प्रणाली में दिए गए तापमान पर पदार्थ (ठोस या तरल)। संतुलन वाष्प दबाव तरल की ऊष्मागतिकी प्रवृत्ति को वाष्पित करने का संकेत है। यह सह-अस्तित्व वाले वाष्प चरण में तरल (या ठोस) से निकलने वाले कणों के संतुलन से संबंधित है। सामान्य तापमान पर उच्च वाष्प दबाव वाले पदार्थ को अधिकांशतः 'अस्थिरता (रसायन विज्ञान) ' कहा जाता है। तरल सतह के ऊपर उपस्तिथ वाष्प द्वारा प्रदर्शित दबाव को वाष्प दबाव के रूप में जाना जाता है। जैसे-जैसे तरल का तापमान बढ़ता है, गैस के चरण में उन अणुओं की एन्ट्रापी की तुलना में तरल अणुओं के बीच आकर्षक संवाद कम महत्वपूर्ण हो जाती है, जिससे वाष्प का दबाव बढ़ जाता है। इस प्रकार, शक्तिशाली इंटरमॉलिक्युलर इंटरैक्शन वाले तरल पदार्थों में छोटे वाष्प दबाव होने की संभावना होती है, शक्तिहीन इंटरैक्शन के लिए रिवर्स ट्रू होता है।
किसी भी पदार्थ का वाष्प दबाव गैर-रैखिक रूप से तापमान के साथ बढ़ता है, जिसे अधिकांशतः क्लॉसियस-क्लैप्रोन संबंध द्वारा वर्णित किया जाता है। तरल का वायुमंडलीय दबाव क्वथनांक (सामान्य क्वथनांक के रूप में भी जाना जाता है) वह तापमान होता है जिस पर वाष्प का दबाव परिवेश के वायुमंडलीय दबाव के बराबर होता है। उस तापमान में किसी भी वृद्धिशील वृद्धि के साथ, वाष्प का दबाव वायुमंडलीय दबाव को दूर करने के लिए पर्याप्त हो जाता है और तरल वाष्प के बुलबुले बनाने का कारण बनता है। उच्च तरल गहराई में तरल बुलबुले के गठन के लिए उच्च द्रव दबाव के कारण थोड़ा अधिक तापमान की आवश्यकता होती है, ऊपर द्रव द्रव्यमान के हाइड्रोस्टेटिक दबाव के कारण। उथली गहराई पर अधिक महत्वपूर्ण बुलबुला गठन प्रारंभ करने के लिए आवश्यक उच्च तापमान है। बुलबुले की दीवार का सतही तनाव बहुत छोटे, प्रारंभिक बुलबुले में अधिक दबाव की ओर जाता है।
वाष्प दबाव जो मिश्रण में घटक प्रणाली में कुल दबाव में योगदान देता है, उसे आंशिक दबाव कहा जाता है। उदाहरण के लिए, समुद्र तल पर हवा, और 20 डिग्री सेल्सियस पर जल वाष्प के साथ संतृप्त, लगभग 2.3 केपीए पानी, 78 केपीए नाइट्रोजन, 21 केपीए ऑक्सीजन और 0.9 केपीए आर्गन का आंशिक दबाव होता है, वातावरण (यूनिट) के लिए कुल मिलाकर 102.2 केपीए, आधार बनाता है।
मापन और इकाइयां
वाष्प दबाव को दबाव की मानक इकाइयों में मापा जाता है। इकाइयों की अंतर्राष्ट्रीय प्रणाली (एसआई) दबाव को एसआई व्युत्पन्न इकाई के रूप में प्रति क्षेत्र बल के आयाम के साथ पहचानता है और पास्कल (यूनिट) (पीए) को इसकी मानक इकाई के रूप में नामित करता है। पास्कल न्यूटन (इकाई) प्रति वर्ग मीटर (N·m−2 or kg·m−1·s−2).
वाष्प दबाव का प्रायोगिक माप 1 और 200 केपीए के बीच सामान्य दबावों के लिए सरल प्रक्रिया है।[1] अधिकांश त्रुटिहीन परिणाम पदार्थों के क्वथनांक के पास प्राप्त होते हैं और माप के बड़े त्रुटि परिणाम से छोटे होते हैं । प्रक्रियाओं में अधिकांशतः परीक्षण पदार्थ को शुद्ध करना, इसे कंटेनर में अलग करना, किसी भी विदेशी गैस को निकालना, फिर विभिन्न तापमानों पर कंटेनर में पदार्थ के गैसीय चरण के संतुलन के दबाव को मापना सम्मलित होता है। बेहतर त्रुटिहीन तब प्राप्त होती है जब यह सुनिश्चित करने के लिए देखभाल की जाती है कि संपूर्ण पदार्थ और उसका वाष्प निर्धारित तापमान पर है। यह अधिकांशतः किया जाता है, जैसा कि तरल स्नान में रोकथाम क्षेत्र को जलमग्न करके, आइसोटेनोस्कोप के उपयोग के साथ किया जाता है।
नुडसन इफ्यूजन सेल विधि का उपयोग करके ठोस पदार्थों के बहुत कम वाष्प दबावों को मापा जा सकता है।
एक चिकित्सा संदर्भ में, वाष्प दबाव कभी-कभी अन्य इकाइयों में व्यक्त किया जाता है, विशेष रूप से पारा के मिलीमीटर | पारा के मिलीमीटर (एमएमएचजी)। यह अस्थिर एनेस्थेटिक्स के लिए महत्वपूर्ण है, किंतु अपेक्षाकृत उच्च वाष्प दबाव के साथ, जिनमें से अधिकांश शरीर के तापमान पर तरल होते हैं।
एंटोनी समीकरण के साथ वाष्प के दबाव का अनुमान लगाना
एंटोनी समीकरण[2][3] वाष्प दबाव और शुद्ध तरल या ठोस पदार्थों के तापमान के बीच संबंध की व्यावहारिक गणितीय अभिव्यक्ति है। यह वक्र-फिटिंग द्वारा प्राप्त किया जाता है और इस तथ्य के अनुकूल होता है कि वाष्प दबाव सामान्यतः तापमान के समारोह के रूप में बढ़ रहा है और अवतल है। समीकरण का मूल रूप है:
- किसी पदार्थ का पूर्ण वाष्प दाब है
- पदार्थ का तापमान है
- , और पदार्थ-विशिष्ट गुणांक हैं (अर्थात, स्थिरांक या पैरामीटर)
- शैली = लंबवत-संरेखण:-30%; > सामान्यतः या तो है या [3]
केवल दो गुणांक वाले समीकरण का सरल रूप कभी-कभी उपयोग किया जाता है:
वैगनर समीकरण[4] सर्वश्रेष्ठ में से देता है[5] प्रयोगात्मक डेटा के लिए फिट बैठता है किंतु अधिक जटिल है। यह कम वाष्प दबाव को कम तापमान के समारोह के रूप में व्यक्त करता है।
तरल पदार्थ के क्वथनांक से संबंध
एक सामान्य प्रवृत्ति के रूप में, परिवेश के तापमान पर तरल पदार्थ का वाष्प दबाव घटते क्वथनांक के साथ बढ़ता है। यह वाष्प दबाव चार्ट (दाएं देखें) में दिखाया गया है जो विभिन्न प्रकार के तरल पदार्थों के वाष्प दबाव बनाम तापमान के ग्राफ दिखाता है।[6] तरल के सामान्य क्वथनांक पर, वाष्प का दबाव मानक वायुमंडलीय दबाव के बराबर होता है जिसे 1 वायुमंडल के रूप में परिभाषित किया जाता है,[7] 760 टोर, 101.325 केपीए, या 14.69595 पीएसआई।
उदाहरण के लिए, किसी दिए गए तापमान पर, मिथाइल क्लोराइड में चार्ट में किसी भी तरल पदार्थ का उच्चतम वाष्प दबाव होता है। इसमें सबसे कम सामान्य क्वथनांक भी होता है −24.2 °C (−11.6 °F), जहां मिथाइल क्लोराइड (नीली रेखा) का वाष्प दबाव वक्र पूर्ण वाष्प दबाव के वायुमंडल (वातावरण (इकाई)) की क्षैतिज दबाव रेखा को काटता है।
चूंकि वाष्प दबाव और तापमान के बीच का संबंध गैर-रैखिक है, चार्ट थोड़ा घुमावदार रेखाओं का निर्माण करने के लिए लॉगरिदमिक वर्टिकल एक्सिस का उपयोग करता है, इसलिए चार्ट कई तरल पदार्थों को ग्राफ़ कर सकता है। वाष्प दाब के लघुगणक को 1/(T + 230) के विरुद्ध आलेखित करने पर लगभग सीधी रेखा प्राप्त होती है।[8] जहाँ T डिग्री सेल्सियस में तापमान है। क्वथनांक पर किसी द्रव का वाष्प दाब उसके आस-पास के वातावरण के दाब के बराबर होता है।
तरल मिश्रण: राउल्ट का नियम
राउल्ट का नियम तरल पदार्थों के मिश्रण के वाष्प दाब का अनुमान देता है। इसमें कहा गया है कि एकल-चरण मिश्रण की गतिविधि (दबाव या भगदड़) घटकों के वाष्प दबावों के मोल-अंश-भारित योग के बराबर है:
कहाँ पे मिश्रण का वाष्प दाब है, घटक का मोल अंश है तरल चरण में और घटक का मोल अंश है वाष्प चरण में क्रमशः। घटक का वाष्प दाब है . राउल्ट का नियम केवल गैर-इलेक्ट्रोलाइट्स (अपरिवर्तित प्रजातियों) पर लागू होता है; यह गैर-ध्रुवीय अणुओं के लिए सबसे उपयुक्त है, जिनमें केवल शक्तिहीन अंतर-आणविक आकर्षण (जैसे लंदन फोर्सेज) हैं।
उपरोक्त सूत्र द्वारा इंगित वाष्प दबाव वाले प्रणाली को सकारात्मक विचलन कहा जाता है। इस तरह का विचलन शुद्ध घटकों की तुलना में शक्तिहीन अंतर-आणविक आकर्षण का सुझाव देता है, जिससे कि अणुओं को तरल चरण में शुद्ध तरल की तुलना में कम दृढ़ता से आयोजित करने के बारे में सोचा जा सके। उदाहरण लगभग 95% इथेनॉल और पानी का अजिओट्रॉप है। क्योंकि अजिओट्रॉप का वाष्प दाब राउल्ट के नियम की भविष्यवाणी से अधिक है, यह किसी भी शुद्ध घटक के तापमान से कम तापमान पर उबलता है।
नकारात्मक विचलन वाली प्रणालियाँ भी हैं जिनमें वाष्प दबाव अपेक्षा से कम है। इस तरह का विचलन शुद्ध घटकों की तुलना में मिश्रण के घटकों के बीच शक्तिशाली अंतर-आणविक आकर्षण का प्रमाण है। इस प्रकार, जब कोई दूसरा अणु उपस्तिथ होता है तो अणु तरल में अधिक शक्तिशाली से बने रहते हैं। उदाहरण ट्राइक्लोरोमेथेन (क्लोरोफॉर्म) और 2-प्रोपेनोन (एसीटोन) का मिश्रण है, जो किसी भी शुद्ध घटक के क्वथनांक से ऊपर उबलता है।
मिश्रण के घटकों के ऊष्मागतिकी गतिविधि गुणांक निर्धारित करने के लिए नकारात्मक और सकारात्मक विचलन का उपयोग किया जा सकता है।
ठोस
संतुलन वाष्प दाब को उस दबाव के रूप में परिभाषित किया जा सकता है जब संघनित चरण अपने स्वयं के वाष्प के साथ संतुलन में होता है। संतुलन ठोस की स्थितियों में, जैसे कि क्रिस्टल, इसे दबाव के रूप में परिभाषित किया जा सकता है जब ठोस के उच्च बनाने की क्रिया (भौतिकी) की दर उसके वाष्प चरण के जमाव की दर से मेल खाती है। अधिकांश ठोस पदार्थों के लिए यह दबाव बहुत कम होता है, किंतु कुछ उल्लेखनीय अपवाद हैं नेफ़थलीन, सूखी बर्फ (शुष्क बर्फ का वाष्प दबाव 5.73 एम्पीए (831 पीएसआई, 56.5 एटीएम्) 20 °C पर होता है, जिसके कारण अधिकांश सीलबंद कंटेनर फट जाते हैं), और बर्फ। सभी ठोस पदार्थों में वाष्प का दबाव होता है। चूंकि, उनके अधिकांशतः अत्यधिक कम मूल्यों के कारण मापन अधिक जटिल हो सकता है। विशिष्ट तकनीकों में थर्मोग्रैविमेट्री और गैस वाष्पोत्सर्जन का उपयोग सम्मलित है।
किसी ठोस के उर्ध्वपातन दाब (अर्थात् वाष्प दाब) की गणना के लिए कई विधियाँ हैं। क्लॉसियस-क्लैपेरॉन संबंध के इस विशेष रूप का उपयोग करके, संलयन की तापीय धारिता ज्ञात होने पर, बहिर्वेशित तरल वाष्प दबावों (सुपरकूल्ड तरल के) से उर्ध्वपातन दबाव का अनुमान लगाने की विधि है:[9]
कहाँ पे:
- तापमान पर ठोस घटक का उर्ध्वपातन दबाव है .
- तापमान पर तरल घटक का अतिरिक्त वाष्प दबाव है .
- संलयन की गर्मी है।
- गैस नियतांक है।
- उर्ध्वपातन तापमान है।
- गलनांक तापमान है।
यह विधि मानती है कि संलयन की ऊष्मा तापमान-स्वतंत्र है, विभिन्न ठोस चरणों के बीच अतिरिक्त संक्रमण तापमान की उपेक्षा करती है, और यह तापमान के लिए उचित अनुमान देती है जो गलनांक से बहुत दूर नहीं है। यह भी दर्शाता है कि उर्ध्वपातन दाब बहिर्वेशित द्रव वाष्प दाब (Δfusएच> 0) और अंतर गलनांक से बढ़ी हुई दूरी के साथ बढ़ता है।
पानी का क्वथनांक
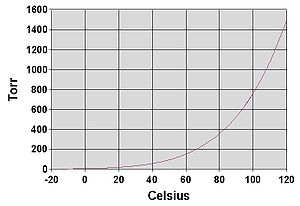
सभी तरल पदार्थों की तरह, पानी तब उबलता है जब उसका वाष्प दबाव उसके आसपास के दबाव तक पहुँच जाता है। प्रकृति में, उच्च ऊंचाई पर वायुमंडलीय दबाव कम होता है और पानी कम तापमान पर उबलता है। वायुमंडलीय दबावों के लिए पानी के उबलते तापमान को एंटोनी समीकरण द्वारा अनुमानित किया जा सकता है:
या इस तापमान-स्पष्ट रूप में परिवर्तित:
जहां तापमान डिग्री सेल्सीयस और दबाव में क्वथनांक है Torr में है.
डुह्रिंग का नियम
डुह्रिंग के नियम में कहा गया है कि तापमान के बीच रैखिक संबंध उपस्तिथ होता है जिस पर दो समाधान समान वाष्प दबाव डालते हैं।
उदाहरण
निम्नलिखित सारणी विभिन्न प्रकार के पदार्थों की सूची है जो बढ़ते हुए वाष्प दाब (पूर्ण इकाइयों में) द्वारा क्रमबद्ध हैं।
| पदार्थ | वाष्प का दबाव | तापमान
(°C) | ||
|---|---|---|---|---|
| (पीए) | (बार) | (एमएमएचजी) | ||
| ऑक्टेथिलीन ग्लाइकोल[10] | 9.2×10−8 पीए | 9.2×10−13 | 6.9×10−10 | 89.85 |
| ग्लिसरॉल | 0.4 पीए | 0.000004 | 0.003 | 50 |
| मरकरी | 1 पीए | 0.00001 | 0.0075 | 41.85 |
| टंगस्टन | 1 पीए | 0.00001 | 0.0075 | 3203 |
| क्सीनन फ्लोराइड | 600 पीए | 0.006 | 4.50 | 25 |
| वाटर (H2O) | 2.3 केपीए | 0.023 | 17.5 | 20 |
| प्रोपेनोल | 2.4 केपीए | 0.024 | 18.0 | 20 |
| मिथाइल आइसोबुटिल कीटोन | 2.66 केपीए | 0.0266 | 19.95 | 25 |
| इथेनॉल | 5.83 केपीए | 0.0583 | 43.7 | 20 |
| फ्रिओंन 113 | 37.9 केपीए | 0.379 | 284 | 20 |
| एसीटैल्डिहाइड | 98.7 केपीए | 0.987 | 740 | 20 |
| ब्यूटेन | 220 केपीए | 2.2 | 1650 | 20 |
| फॉर्मल्डेहाइड | 435.7 केपीए | 4.357 | 3268 | 20 |
| प्रोपेन[11] | 997.8 केपीए | 9.978 | 7584 | 26.85 |
| कार्बोनिल सल्फाइड | 1.255 एम् पीए | 12.55 | 9412 | 25 |
| नाइट्रस ऑक्साइड[12] | 5.660 एम् पीए | 56.60 | 42453 | 25 |
| कार्बन डाइऑक्साइड | 5.7 एम् पीए | 57 | 42753 | 20 |
आणविक संरचना से वाष्प दाब का आकलन
कार्बनिक अणुओं के लिए आणविक संरचना से वाष्प के दबाव का अनुमान लगाने के लिए कई अनुभवजन्य विधिया उपस्तिथ हैं। कुछ उदाहरण सिम्पोल.1 विधि हैं,[13] मोलर एट अल की विधि।[9] और वाष्पीकरण (ऑर्गेनिक्स के वाष्प दबाव का अनुमान, तापमान के लिए लेखांकन, इंट्रामोलेक्युलर, और गैर-एडिटिविटी प्रभाव)।[14][15]
मौसम विज्ञान में
मौसम विज्ञान में, वाष्प दाब शब्द का अर्थ है वातावरण में पानी का वाष्प दाब, यदि वह संतुलन में न हो।[16] यह अन्य विज्ञानों में इसके अर्थ से भिन्न है।[16] अमेरिकी मौसम विज्ञान सोसायटी ग्लोसरी ऑफ़ मेटेरोलॉजी के अनुसार, 'संतृप्ति वाष्प दबाव' ठीक से तरल पानी या ठोस बर्फ की सपाट सतह के ऊपर पानी के संतुलन वाष्प दबाव को संदर्भित करता है, और यह केवल तापमान का कार्य है और संघनित चरण तरल है या ठोस है ।[17]
सापेक्ष आर्द्रता को संतृप्ति वाष्प दाब के सापेक्ष परिभाषित किया जाता है।[18] संतुलन वाष्प दबाव के लिए संघनित चरण को समतल सतह होने की आवश्यकता नहीं होती है; इसमें छोटी-छोटी बूंदें हो सकती हैं जिनमें संभवतः विलेय (अशुद्धियाँ) हों, जैसे कि बादल ।[19][18] बूंदों के आकार और बादल संघनन नाभिक के रूप में कार्य करने वाले अन्य कणों की उपस्थिति के आधार पर संतुलन वाष्प दबाव संतृप्ति वाष्प दबाव से अधिक भिन्न हो सकता है।[19][18]
चूंकि, इन शब्दों का उपयोग असंगत रूप से किया जाता है, और कुछ लेखक एएम्एस शब्दावली द्वारा दिए गए संकीर्ण अर्थ के बाहर संतृप्ति वाष्प दबाव का उपयोग करते हैं। उदाहरण के लिए, वायुमंडलीय संवहन पर टेक्स्ट बताता है, केल्विन प्रभाव के कारण छोटी बूंद की घुमावदार सतह पर संतृप्ति वाष्प दबाव का कारण समतल पानी की सतह की तुलना में अधिक होता है (महत्व दिया जाता है)।[20]
अभी भी वर्तमान शब्द संतृप्ति वाष्प दबाव अप्रचलित सिद्धांत से निकला है कि जल वाष्प हवा में घुल जाता है, और किसी दिए गए तापमान पर हवा संतृप्त होने से पहले केवल निश्चित मात्रा में पानी पकड़ सकती है।[18] वास्तव में, जैसा कि डाल्टन के नियम (1802 से जाना जाता है) द्वारा कहा गया है, जल वाष्प या किसी पदार्थ का आंशिक दबाव हवा पर बिल्कुल भी निर्भर नहीं करता है, और प्रासंगिक तापमान तरल का होता है।[18] फिर भी, गलत धारणा जनता और यहां तक कि मौसम विज्ञानियों के बीच बनी रहती है, भ्रामक शर्तों संतृप्ति दबाव और सुपरसेटरेशन और सापेक्ष आर्द्रता की संबंधित परिभाषा से सहायता प्राप्त होती है।[18]
यह भी देखें
- पूर्ण आर्द्रता
- एंटोनी समीकरण
- ली-केसलर विधि
- आसमाटिक गुणांक
- राउल्ट का नियम: घोल में वाष्प का दबाव कम होना
- रीड वाष्प दबाव
- सापेक्षिक आर्द्रता
- सापेक्ष अस्थिरता
- संतृप्ति वाष्प घनत्व
- तीन बिंदु
- सही वाष्प दबाव
- वाष्प-तरल संतुलन
- तत्वों का वाष्प दबाव (डेटा पृष्ठ)
- पानी का वाष्प दाब
संदर्भ
- ↑ Růžička, K.; Fulem, M. & Růžička, V. "Vapor Pressure of Organic Compounds. Measurement and Correlation" (PDF). Archived from the original (PDF) on 2010-12-26. Retrieved 2009-10-18.
- ↑ 2.0 2.1 What is the Antoine Equation? (Chemistry Department, Frostburg State University, Maryland)
- ↑ 3.0 3.1 Sinnot, R.K. (2005). Chemical Engineering Design] (4th ed.). Butterworth-Heinemann. p. 331. ISBN 978-0-7506-6538-4.
- ↑ Wagner, W. (1973), "New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations", Cryogenics, 13 (8): 470–482, Bibcode:1973Cryo...13..470W, doi:10.1016/0011-2275(73)90003-9
- ↑ Perry's Chemical Engineers' Handbook, 7th Ed. pp. 4–15
- ↑ Perry, R.H.; Green, D.W., eds. (1997). Perry's Chemical Engineers' Handbook (7th ed.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ↑ Petrucci, Ralph H.; Harwood, William S.; Herring, F.Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 484. ISBN 978-0-13-014329-7.
- ↑ Dreisbach, R. R. & Spencer, R. S. (1949). "Infinite Points of Cox Chart Families and dt/dP Values at any Pressure". Industrial and Engineering Chemistry. Vol. 41, no. 1. p. 176. doi:10.1021/ie50469a040.
- ↑ 9.0 9.1 Moller B.; Rarey J.; Ramjugernath D. (2008). "Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions". Journal of Molecular Liquids. 143: 52–63. doi:10.1016/j.molliq.2008.04.020.
- ↑ Krieger, Ulrich K.; Siegrist, Franziska; Marcolli, Claudia; Emanuelsson, Eva U.; Gøbel, Freya M.; Bilde, Merete (8 January 2018). "A reference data set for validating vapor pressure measurement techniques: homologous series of polyethylene glycols" (PDF). Atmospheric Measurement Techniques. Copernicus Publications. 11 (1): 49–63. doi:10.5194/amt-11-49-2018. ISSN 1867-1381. Archived (PDF) from the original on 2022-10-09. Retrieved 7 April 2022.
- ↑ "Thermophysical Properties Of Fluids II – Methane, Ethane, Propane, Isobutane, And Normal Butane" Archived 2016-12-21 at the Wayback Machine (page 110 of PDF, page 686 of original document), BA Younglove and JF Ely.
- ↑ "Thermophysical Properties Of Nitrous Oxide" (page 14 of PDF, page 10 of original document), ESDU.
- ↑ Pankow, J. F.; et al. (2008). "SIMPOL.1: a simple group contribution method for predicting vapor pressures and enthalpies of vaporization of multifunctional organic compounds". Atmos. Chem. Phys. 8 (10): 2773–2796. Bibcode:2008ACP.....8.2773P. doi:10.5194/acp-8-2773-2008.
- ↑ "Vapour pressure of Pure Liquid Organic Compounds: Estimation by EVAPORATION". Tropospheric Chemistry Modelling at BIRA-IASB. 11 June 2014. Retrieved 2018-11-26.
- ↑ Compernolle, S.; et al. (2011). "EVAPORATION: a new vapour pressure estimation method for organic molecules including non-additivity and intramolecular interactions". Atmos. Chem. Phys. 11 (18): 9431–9450. Bibcode:2011ACP....11.9431C. doi:10.5194/acp-11-9431-2011.
- ↑ 16.0 16.1 American Meteorological Society (2012). "vapor pressure". Glossary of Meteorology. Retrieved 2022-11-28.
- ↑ American Meteorological Society (2020). "saturation vapor pressure". Glossary of Meteorology. Retrieved 2022-11-28.
- ↑ 18.0 18.1 18.2 18.3 18.4 18.5 Babin, Steven M. (1998). "Relative Humidity & Saturation Vapor Pressure: A Brief Tutorial". Johns Hopkins University Applied Physics Laboratory. Archived from the original on 1998-07-13. Retrieved 2022-11-28. (Alternate title: "Water Vapor Myths: A Brief Tutorial".)
- ↑ 19.0 19.1 American Meteorological Society (2012). "equilibrium vapor pressure". Glossary of Meteorology. Retrieved 2022-11-28.
- ↑ Raymond, David J. (2011-05-12). "Chapter 5: Cloud Microphysics" (PDF). Atmospheric Convection. New Mexico Institute of Mining and Technology. p. 73. Archived (PDF) from the original on 2017-03-29. Retrieved 2022-11-28.


