समन्वय बहुलक: Difference between revisions
No edit summary |
No edit summary |
||
| (11 intermediate revisions by 4 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Polymer consisting of repeating units of a coordination complex}} | {{Short description|Polymer consisting of repeating units of a coordination complex}} | ||
[[File:DimensionalityandCoordination.png|thumb|300px|right|चित्र 1. 1 | [[File:DimensionalityandCoordination.png|thumb|300px|right|चित्र 1. 1, 2 और 3 विमीयता का चित्रण।]]'''''समन्वय बहुलक''''' एक ऐसी [[ अकार्बनिक बहुलक |अकार्बनिक]] या कार्बधात्विक बहुलक संरचना है, जिसमें [[ लाइगैंडों |लिगैंड्स]] द्वारा जुड़े धातु के धनायन युक्त केंद्र होते हैं। तथा अधिक औपचारिक रूप से समन्वय बहुलक 1, 2 या 3 आयामों में विस्तारित समन्वय संस्थाओं के साथ एक समन्वय यौगिक होता है।<ref name=Batten13> | ||
{{cite journal |first1=Stuart R.|last1=Batten|first2=Neil R.|last2=Champness|first3=Xiao-Ming|last3=Chen|first4=Javier|last4=Garcia-Martinez|first5=Susumu|last5=Kitagawa|first6=Lars|last6=Öhrström|first7=Michael |last7=O'Keeffe|first8=Myunghyun P. |last8=Suh |first9=Jan|last9=Reedijk|title=Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013)|journal=Pure and Applied Chemistry|year=2013|doi=10.1351/PAC-REC-12-11-20|volume=85|issue=8|pages=1715|doi-access=free}}</ref> | {{cite journal |first1=Stuart R.|last1=Batten|first2=Neil R.|last2=Champness|first3=Xiao-Ming|last3=Chen|first4=Javier|last4=Garcia-Martinez|first5=Susumu|last5=Kitagawa|first6=Lars|last6=Öhrström|first7=Michael |last7=O'Keeffe|first8=Myunghyun P. |last8=Suh |first9=Jan|last9=Reedijk|title=Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013)|journal=Pure and Applied Chemistry|year=2013|doi=10.1351/PAC-REC-12-11-20|volume=85|issue=8|pages=1715|doi-access=free}}</ref> | ||
इसे एक बहुलक के रूप में भी वर्णित किया जा सकता है, जिसकी पुनरावृत्ति इकाइयाँ | इसे एक बहुलक के रूप में भी वर्णित किया जा सकता है, जिसकी पुनरावृत्ति इकाइयाँ [[ समन्वय परिसर |समन्वय परिसर (कॉम्प्लेक्स]]) होती हैं। तथा समन्वय बहुलक में उपवर्ग समन्वय नेटवर्क होते हैं, जो समन्वय यौगिकों को दोहराते हुए समन्वय संस्थाओं के माध्यम से 1 आयाम में दो या दो से अधिक व्यक्तिगत श्रृंखलाओं, लूपों या स्पाइरो-लिंक्स के बीच क्रॉस-लिंक के साथ या समन्वय यौगिकों का 2 या 3 आयामों की इकाइयों के माध्यम से विस्तार करते हैं। इनमें से एक उपवर्ग कार्बनिक धातु संरचना या MOFs होता हैं, जो संभावित रिक्तियों वाले कार्बनिक लिगैंड्स के साथ समन्वय नेटवर्क मे होता है।<ref name="Batten13"/> | ||
समन्वय बहुलक कई क्षेत्रों के लिए प्रासंगिक हैं, जिनमें कई संभावित अनुप्रयोग भी सम्मिलित होते हैं।<ref name="Fromm">{{cite journal|doi=10.1016/j.ccr.2007.10.032|last=Fromm|first=K.|title=एस-ब्लॉक धातु आयनों के साथ समन्वय बहुलक नेटवर्क|year=2008|journal=Coord. Chem. Rev.|volume=252|pages=856–885|issue=8–9|url=http://doc.rero.ch/record/9739/files/fromm_cpn.pdf}}</ref> समन्वय बहुलक को उनकी संरचना के अनुसार कई तरीकों से वर्गीकृत किया जा सकता है। तथा एक महत्वपूर्ण वर्गीकरण को विमीयता कहा जाता है। एक संरचना को 1, 2 या 3 आयामी होने के लिए निर्धारित किया जा सकता है, अंतरिक्ष में दिशाओं की संख्या के आधार पर सरणी फैली हुई है। जो एक-आयामी संरचना सीधी रेखा x अक्ष में फैली हुई होती है, द्वि-आयामी संरचना समतल दो दिशाओं (x और y अक्षों) में फैली होती है | समन्वय बहुलक कई क्षेत्रों के लिए प्रासंगिक हैं, जिनमें कई संभावित अनुप्रयोग भी सम्मिलित होते हैं।<ref name="Fromm">{{cite journal|doi=10.1016/j.ccr.2007.10.032|last=Fromm|first=K.|title=एस-ब्लॉक धातु आयनों के साथ समन्वय बहुलक नेटवर्क|year=2008|journal=Coord. Chem. Rev.|volume=252|pages=856–885|issue=8–9|url=http://doc.rero.ch/record/9739/files/fromm_cpn.pdf}}</ref> समन्वय बहुलक को उनकी संरचना के अनुसार कई तरीकों से वर्गीकृत किया जा सकता है। तथा एक महत्वपूर्ण वर्गीकरण को विमीयता कहा जाता है। एक संरचना को 1, 2 या 3 आयामी होने के लिए निर्धारित किया जा सकता है, अंतरिक्ष में दिशाओं की संख्या के आधार पर सरणी फैली हुई है। जो एक-आयामी संरचना सीधी रेखा x अक्ष में फैली हुई होती है, द्वि-आयामी संरचना समतल दो दिशाओं (x और y अक्षों) में फैली होती है तथा त्रि-आयामी संरचना तीनों दिशाओं (x, y और z अक्षों) में फैली हुई होती है।<ref name="Chen">{{cite journal|doi=10.1016/j.ccr.2004.07.006|last=Chen|first=X|author2=Ye, B. |author3=Tong, M. |year=2005|title=2,2′-बिपिरिडिल-जैसे और कार्बोक्जिलेट लिगैंड्स के साथ धातु-कार्बनिक आणविक वास्तुकला|journal=Coord. Chem. Rev.|volume=249|pages=545–565|issue=5–6}}</ref> यह चित्र 1 में दर्शाया गया है। | ||
==इतिहास== | ==इतिहास== | ||
[[ अल्फ्रेड वर्नर | अल्फ्रेड वर्नर]] | [[ अल्फ्रेड वर्नर |अल्फ्रेड वर्नर]] और उनके समकालीनों के कार्य ने समन्वय बहुलक के अध्ययन के लिए नींव रखी तथा कई बार उनकी सम्मानित सामग्रियों को समन्वय बहुलक के रूप में पहचाना जाता है। इनमें साइनाइड कॉम्प्लेक्स [[ हल्का नीला |हल्का नीला]] और [[ हॉफमैन क्लैथ्रेट्स |हॉफमैन क्लैथ्रेट्स]] सम्मिलित हैं।<ref name= Kitagawa>{{Cite journal | doi = 10.1002/anie.200300610| title = कार्यात्मक झरझरा समन्वय पॉलिमर| journal = Angewandte Chemie International Edition| volume = 43| issue = 18| pages = 2334–2375| year = 2004| last1 = Kitagawa | first1 = S. | last2 = Kitaura | first2 = R. | last3 = Noro | first3 = S. I. | pmid = 15114565}}</ref> | ||
==संश्लेषण और प्रसारण== | ==संश्लेषण और प्रसारण== | ||
समन्वय बहुलक | समन्वय बहुलक अधिकांश स्व-संयोजन द्वारा निर्मित किए जाते हैं, जिसमें लिगेंड के साथ धातु के [[ नमक (रसायन विज्ञान) |नमक]] का [[ क्रिस्टलीकरण |क्रिस्टलीकरण]] सम्मिलित होता है। जो [[ क्रिस्टल इंजीनियरिंग |क्रिस्टल अभियांत्रिकी]] और आणविक स्व-संयोजन तंत्र प्रासंगिक होते हैं।<ref name="Fromm" /> | ||
[[File:Planer3and6Coordination.png|thumb|300px|right|चित्रा 2. 3 समन्वय और 6 समन्वय के साथ तलीय ज्यामिति दिखाता है।]] | [[File:Planer3and6Coordination.png|thumb|300px|right|चित्रा 2. 3 समन्वय और 6 समन्वय के साथ तलीय ज्यामिति को दिखाता है।]] | ||
=== [[ अंतर-आणविक बल ]] और संबंध === | === [[ अंतर-आणविक बल |अंतराआण्विक बल]] और संबंध === | ||
धातु-लिगैंड परिसरों को निर्धारित करने वाले बलों में [[ वैन डेर वाल्स फोर्स ]], [[ पीआई-पीआई इंटरैक्शन ]], [[ हाइड्रोजन बंध ]] | धातु-लिगैंड परिसरों को निर्धारित करने वाले बलों में धातु और लिगैंड के बीच बने समन्वय बंधन के अतिरिक्त [[ वैन डेर वाल्स फोर्स |वान डर वाल्स बल]], [[ पीआई-पीआई इंटरैक्शन |पीआई-पीआई अन्तःक्रिया]], [[ हाइड्रोजन बंध |हाइड्रोजन बंध]] और ध्रुवीकृत बंध द्वारा पीआई बंध का स्थिरीकरण सम्मिलित होता है। जो सहसंयोजक बंधों की तुलना में लंबी संतुलन दूरी (बंधन की लंबाई) के साथ अंतर-आणविक बल कमजोर होते हैं। उदाहरण के लिए, [[ बेंजीन |बेंजीन]] वलय के बीच पीआई-पीआई अन्तः क्रिया में लगभग 5-10 kJ/mol ऊर्जा होती है, जो वलयों के समानांतर तल के बीच सर्वोत्तम 3.4–3.8 एंग्स्ट्रॉम अंतराल का होता है। | ||
===समन्वय === | ===समन्वय === | ||
समन्वय बहुलक की क्रिस्टल संरचना और | समन्वय बहुलक की क्रिस्टल संरचना और आयाम संयोजक की कार्य क्षमता को धातु केंद्र के समन्वय ज्यामिति द्वारा निर्धारित किया जाता है। विमीयता सामान्य रूप से धातु केंद्र द्वारा संचालित होती है, जो संयोजक पर 16 से अधिक कार्यात्मक स्थितियों को जोड़ने की क्षमता रखती है। हालाँकि यह हमेशा ऐसा नहीं होता है, क्योंकि संयोजक द्वारा आयाम को संचालित किया जा सकता है। जब संयोजक धातु केंद्र की तुलना में अधिक धातु केंद्रों से जुड़ता है।<ref>{{Cite journal|last1=Lamming|first1=Glenn|last2=El-Zubir|first2=Osama|last3=Kolokotroni|first3=James|last4=McGurk|first4=Christopher|last5=Waddell|first5=Paul G.|last6=Probert|first6=Michael R.|last7=Houlton|first7=Andrew|date=2016-10-03|title=Ag(I)-N बॉन्ड फॉर्मेशन पर आधारित दो-आयामी फ्रेमवर्क: सिंगल क्रिस्टल से सिंगल मॉलिक्यूलर शीट ट्रांसफॉर्मेशन|journal=Inorganic Chemistry|volume=55|issue=19|pages=9644–9652|doi=10.1021/acs.inorgchem.6b01365|pmid=27631950 |issn=0020-1669|doi-access=free}}</ref> तो समन्वय बहुलक की उच्चतम ज्ञात समन्वय संख्या 14 होती है,<ref>{{cite journal|title=यूरेनियम के दूसरे क्रिस्टलीय रूप की संरचना (चतुर्थ) टेट्राहाइड्रोबोरेट|journal=Acta Crystallographica Section C|year=1987|volume=43|issue=8|pages=1465–p1467|doi=10.1107/S0108270187091431|authors=Charpin, P.; Nierlich, M.; Vigner, D.; Lance, M.; Baudry, D.}}</ref> हालांकि इसकी समन्वय संख्या अधिकांश 2 से 10 के बीच होती है।<ref>{{cite journal|title=O- और N-दाताओं के साथ समन्वय बहुलक नेटवर्क: वे क्या हैं, क्यों और कैसे बनते हैं|journal=Coord. Chem. Rev. |year=2006|volume=250|issue=15–16|pages=2127–2157|doi=10.1016/j.ccr.2006.02.013|authors=Robin, A. Y.; Fromm, K. M.}}</ref> विभिन्न समन्वय संख्याओं के उदाहरण के लिए चित्र 2 में तलीय ज्यामिति को दिखाया गया हैं, और चित्र 1 में 1डी संरचना 2-समन्वित है तथा तलीय 4-समन्वित और 3डी मे 6-समन्वित को दिखाया गया है। | ||
==धातु केंद्र== | ==धातु केंद्र== | ||
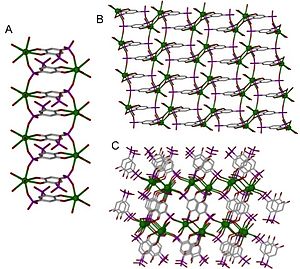
[[File:coordination figure.jpg|thumb|300px|right|चित्रा 3. विभिन्न | [[File:coordination figure.jpg|thumb|300px|right|चित्रा 3. विभिन्न आयामों के तीन समन्वय बहुलक। इन तीनों को एक ही लिगैंड 4,5-डायहाइड्रॉक्सीबेंजीन-1,3-डिसल्फोनेट (एल) का उपयोग करके बनाया गया था, लेकिन अलग-अलग धातु के पिंजरों का उपयोग किया गया था। सभी धातुएं [[ आवर्त सारणी |आवर्त सारणी]] ([[ क्षारीय पृथ्वी धातु |क्षारीय मृदा धातु]]) पर समूह 2 से आती हैं और इस स्थिति में, विमीयता कटियन आकार और ध्रुवीकरण के साथ बढ़ती है। A. [Ca(L)(H<sub>2</sub>O)<sub>4</sub>]•H<sub>2</sub>O B. [Sr(L)(H<sub>2</sub>O)4]•H<sub>2</sub>O C.[Ba(L)(H<sub>2</sub>O)]•H<sub>2</sub>O<ref name="alkaline earth">{{cite journal|doi=10.1002/chem.200305102|last=Cote|first=A|author2=Shimizu, G.|year=2003|title=अनुकूलनीय घटकों के संयोजन के माध्यम से समन्वय ठोस: क्षारीय पृथ्वी ऑर्गनोसल्फोनेट नेटवर्क में व्यवस्थित संरचनात्मक भिन्नता|journal=Chem. Eur. J.|volume=9|pages=5361–5370|issue=21|pmid=14613146}}</ref> प्रत्येक स्थिति में, धातु को हरे रंग में दर्शाया गया है। ]]धातु केंद्र, जिन्हें अधिकांश नोड(बिन्दु) या केंद्र भी कहा जाता है, ये धातु केंद्र एक अच्छी तरह से परिभाषित कोणों पर विशिष्ट संख्या के संयोजक से बंधते हैं तथा एक नोड से जुड़े संयोजको की संख्या को [[ समन्वय संख्या |समन्वय संख्या]] के रूप में भी जाना जाता है, जो कि उनके द्वारा आयोजित कोणों के साथ संरचना के आयाम को निर्धारित करता है। एक धातु केंद्र की समन्वय संख्या और [[ समन्वय ज्यामिति |समन्वय ज्यामिति]] उसके चारों ओर [[ इलेक्ट्रॉन घनत्व |इलेक्ट्रॉन घनत्व]] के गैर-समान वितरण द्वारा निर्धारित की जाती है, और सामान्य रूप से समन्वय संख्या धनायन आकार के साथ बढ़ जाती है। जो कई प्रारूप मे विशेष रूप से [[ कक्षीय संकरण |संकरण]] प्रारूप और [[ आणविक कक्षीय सिद्धांत |आणविक कक्षीय सिद्धांत]], या समन्वय ज्यामिति की पूर्वानुमान व्याख्या करने के लिए श्रोडिंगर समीकरण का उपयोग करते हैं, हालांकि इलेक्ट्रॉन घनत्व वितरण पर पर्यावरण के जटिल प्रभाव के कारण यह करना जटिल होता है।<ref name="Bernstein">{{cite book|last=Bernstein |first=Jeremy|author2=Paul M. Fishbane |author3=Stephen G. Gasiorowicz |title=आधुनिक भौतिकी|publisher=Prentice-Hall|date=April 3, 2000|pages=624|isbn=978-0-13-955311-0}}</ref> | ||
=== संक्रमण धातु === | === संक्रमण धातु === | ||
[[ संक्रमण धातुओं ]] | [[ संक्रमण धातुओं |संक्रमण धातुओं]] का उपयोग सामान्य रूप से नोड्स के रूप में किया जाता है। तथा आंशिक रूप से भरे हुए डी कक्षाओं या तो [[ परमाणु |परमाणु]] या [[ आयन |आयन]] में पर्यावरण के आधार पर अलग-अलग संकरण को कर सकते हैं। यह [[ इलेक्ट्रॉनिक संरचना |इलेक्ट्रॉनिक संरचना]] उनमें से कुछ को कई समन्वय ज्यामिति मे विशेष रूप से तांबे और सोने के आयनों को प्रदर्शित करने का कारण बनती है, जो तटस्थ परमाणुओं के रूप में उनके बाहरी आवरण में पूर्ण डी-कक्षक होते हैं। | ||
=== [[ लैंथेनाइड्स ]] === | === [[ लैंथेनाइड्स |लैंथेनाइड्स]] === | ||
लैंथेनाइड्स बड़े परमाणु होते हैं जिनकी समन्वय संख्या 7 से 14 | लैंथेनाइड्स बड़े परमाणु होते हैं जिनकी समन्वय संख्या 7 से 14 के बीच होती है। तथा उनके समन्वय वातावरण का पूर्वानुमान करना जटिल हो सकता है, जिससे उन्हें नोड्स के रूप में उपयोग करना चुनौतीपूर्ण हो जाता है। तथा वे ल्यूमिनेसेंट घटकों को सम्मिलित करने की संभावना को प्रदान करते हैं। | ||
=== क्षार धातु और क्षारीय | === क्षार धातु और क्षारीय मृदा धातु === | ||
क्षार | क्षार धातु और क्षारीय मृदा धातु स्थिर धनायन के रूप में उपस्थित होती हैं। क्षार धातुएं आसानी से स्थिर संयोजी आवरण के साथ धनायन बनाती हैं, जिससे उन्हें लैंथेनाइड्स और संक्रमण धातुओं की तुलना में अलग समन्वय आचरण मिलता है। तथा वे संश्लेषण में उपयोग किए जाने वाले नमक के [[ काउंटरियन |प्रतिवाद]] से बहुत प्रभावित होते हैं, जिससे उनको बचना जटिल होता है। चित्रा 3 में दिखाए गए समन्वय बहुलक समूह दो धातु हैं। इस स्थिति में इन संरचनाओं की विमीयता बढ़ जाती है, क्योंकि धातु की त्रिज्या समूह([[ कैल्शियम |कैल्शियम]] से [[ स्ट्रोंटियम |स्ट्रोंटियम]] से [[ बेरियम |बेरियम]] तक) में बढ़ जाती है। | ||
== [[ लिगैंड ]] | == [[ लिगैंड |लिगैंडस]] == | ||
अधिकांश समन्वय बहुलक में | अधिकांश समन्वय बहुलक में एक लिगैंड परमाणु या परमाणुओं का समूह औपचारिक रूप से धातु के धनायन के लिए [[ इलेक्ट्रॉन |इलेक्ट्रॉनों]] की एक एकल जोड़ी दान करता है। तथा एक [[ लुईस एसिड और बेस |लुईस अम्ल और क्षार]] के संबंध के माध्यम से एक समन्वय परिसर का निर्माण करेगा। तथा समन्वय बहुलक तब बनते हैं, जब एक लिगैंड में कई समन्वय बंध बनाने और कई धातु केंद्रों के बीच एक सेतु के रूप में कार्य करने की क्षमता होती है। लिगेंड जो एक समन्वय बंधन बना सकते हैं, उन्हें मोनोडेंटेट कहा जाता है, लेकिन वे जो बहु-सहसंयोजन बंध बनाते हैं, जिससे समन्वय बहुलक बन सकते हैं, बहुदंतक कहलाते हैं। [[ पॉलीडेंटेट |बहुदंतक]] लिगेंड विशेष रूप से महत्वपूर्ण होते हैं, क्योंकि ये लिगेंड के माध्यम से होता है जो कई धातु केंद्रों को एक साथ जोड़ता है जिससे एक अनंत सरणी बनती है। बहुदंतक लिगेंड भी एक ही धातु (जिसे [[ कटियन |प्रतिवादन]] कहा जाता है) में कई बंधन को बना सकते हैं। तथा मोनोडेंटेट लिगैंड्स को टर्मिनल भी कहा जाता है, क्योंकि वे नेटवर्क को जारी रखने के लिए जगह नहीं देते हैं। समन्वय बहुलक मे अधिकांश पॉली और मोनोडेंटेट, सेतुबंधन, चेलेटिंग तथा टर्मिनल लिगेंड का संयोजन होता है। | ||
===रासायनिक संरचना === | ===रासायनिक संरचना === | ||
इलेक्ट्रॉनों की | इलेक्ट्रॉनों की एकल जोड़ी के साथ लगभग किसी भी प्रकार के परमाणु को लिगैंड में सम्मिलित किया जा सकता है। तथा सामान्य रूप से समन्वय बहुलक में पाए जाने वाले लिगैंड्स में होते है। जो पॉलीपिरिडाइन्स, [[ मैचिंग पज़ल्स और आरओ लाइन |फेनेंथ्रोलाइन्स]], [[ हाइड्रोक्सीक्विनोलिन |हाइड्रॉक्सीक्विनोलिन्स]] और [[ पॉलीकार्बोक्सिलेट्स |पॉलीकार्बोक्सिलेट्स]] सम्मिलित होते हैं। ऑक्सीजन और नाइट्रोजन परमाणु सामान्य रूप से बाध्यकारी साइटों के रूप में पाए जाते हैं, लेकिन अन्य परमाणु, जैसे [[ गंधक |गंधक]] <ref name="Sulfur">{{Cite journal | doi = 10.1016/S0020-1693(01)00556-4| title = सिल्वर (I) चक्रीय सल्फर लिगैंड के समन्वय पॉलिमर, 2,2′,3,3′-टेट्राहाइड्रो-4,4′-डिथिया-1,1′-बिनाफ्थिलिडीन| journal = Inorganica Chimica Acta| volume = 322| issue = 1–2| pages = 133–137| year = 2001| last1 = Wen | first1 = M. | last2 = Munakata | first2 = M. | last3 = Suenaga | first3 = Y. | last4 = Kuroda-Sowa | first4 = T. | last5 = Maekawa | first5 = M. | last6 = Yan | first6 = S. G. }}</ref> और [[ फास्फोरस |फास्फोरस]] ,<ref name="Brannon">{{Cite journal | doi = 10.1016/j.ica.2008.04.032| title = 4-(डिपेनिलफॉस्फिनोमिथाइल) पाइरीडीन के स्व-इकट्ठे चांदी (I) परिसरों में आयनों और लिगैंड अनुपात का प्रभाव और बाइपिरिडीन लिगैंड के साथ उनके डेरिवेटिव| journal = Inorganica Chimica Acta| volume = 362| issue = 2| pages = 426| year = 2009| last1 = Hung-Low | first1 = F. | last2 = Klausmeyer | first2 = K. K. | last3 = Gary | first3 = J. B. }}</ref><ref name="Phosphorus">{{Cite journal | doi = 10.1016/j.ccr.2009.09.023| title = 1,3-डाइन्स पोलीमराइजेशन के लिए फॉस्फोरस और नाइट्रोजन लिगैंड्स के साथ अच्छी तरह से परिभाषित संक्रमण धातु परिसरों| journal = Coordination Chemistry Reviews| volume = 254| issue = 5–6| pages = 661| year = 2010| last1 = Ricci | first1 = G. | last2 = Sommazzi | first2 = A. | last3 = Masi | first3 = F. | last4 = Ricci | first4 = M. | last5 = Boglia | first5 = A. | last6 = Leone | first6 = G. }}</ref> देखे गए हैं। | ||
लिगेंड्स और धात्विक धनायन कठोर अम्ल क्षार का [[ HSAB |HSAB]] सिद्धान्त प्रवृत का पालन करते हैं। तथा इसका अर्थ यह होता है कि अधिक बड़े ध्रुवीकरण योग्य मृदु धातुएं, बड़े अधिक ध्रुवीकरण योग्य नरम लिगेंड के साथ अधिक सरलता से समन्वय करती है। तथा छोटे और गैर-ध्रुवीकरण योग्य कठोर धातुएं, छोटे कठोर लिगेंड के साथ समन्वय करती है। | |||
=== | === संरचनात्मक अभिविन्यास === | ||
[[File:Anti-gauche.svg|thumb|300px|right|1,2-बीआईएस (4-पाइरिडाइल) ईथेन एक लचीला लिगैंड है, जो गौचे या विरोधी अनुरूपता में | [[File:Anti-gauche.svg|thumb|300px|right|1,2-बीआईएस (4-पाइरिडाइल) ईथेन एक लचीला लिगैंड होता है, जो गौचे या विरोधी अनुरूपता में उपस्थित हो सकता है।]]लिगेंड लचीले या कठोर हो सकते हैं। तथा एक कठोर लिगैंड वह होता है, जिसे किसी संरचना के अन्दर बंधों के चारों ओर घूमने या पुन: पेश करने की स्वतंत्रता नहीं होती है। लचीले लिगेंड झुक सकते हैं, एवं बंध के चारों ओर घूम सकते हैं,तथा खुद को पुन: पेश भी कर सकते हैं। ये विभिन्न अनुरूपता संरचना में अधिक विविधता को उत्पन्न करते हैं। जो समन्वय बहुलक के उदाहरण हैं, जिनमें एक संरचना के अन्दर एक ही लिगैंड के दो विन्यास भी सम्मिलित होते हैं,<ref name="Knaust">{{Cite journal | doi = 10.1021/ic025836c| pmid = 12401066| title = सीटू में से एक मिश्रित-लिगैंड समन्वय पॉलिमर, बीआईएस (4-पाइरिडाइल) एथिलीन का सीयू (आई) -मध्यस्थ आइसोमेराइजेशन| journal = Inorganic Chemistry| volume = 41| issue = 22| pages = 5650–2| year = 2002| last1 = Knaust | first1 = J. M. | last2 = Keller | first2 = S. W.}}</ref> जो इसमे एक साथ ही दो अलग-अलग संरचनाएं होती हैं, जहां उनके बीच एकमात्र अंतर लिगैंड अभिविन्यास होता है। | ||
=== लिगैंड लंबाई === | === लिगैंड लंबाई === | ||
गैर-बहुलक (मोनो- या ओलिगोमेरिक) संरचनाओं की तुलना में एक बहुलक संरचना के निर्माण की संभावना निर्धारित करने में लिगैंड की लंबाई एक महत्वपूर्ण कारक हो सकती है।<ref>{{Cite journal|title = कॉपर में डिमेरिक ''बनाम'' पॉलिमरिक समन्वय (ii) बीआईएस (चेलेटिंग) ऑक्सीम और एमाइड लिगैंड के साथ धनायनित परिसरों|journal=Dalton Transactions |volume=39 |issue=27 |pages=6266–75 |doi=10.1039/C0DT00008F |pmid=20520918 |year=2010 |last1=Buvailo |first1=Andrii I. |last2=Gumienna-Kontecka |first2=Elzbieta |last3=Pavlova |first3=Svetlana V. |last4=Fritsky |first4=Igor O. |last5=Haukka |first5=Matti}}</ref> | |||
== अन्य कारक == | == अन्य कारक == | ||
=== | === प्रतिवाद === | ||
धातु और | धातु और लिगेंड चयन के अतिरिक्त कई अन्य कारक होते हैं, जो समन्वय बहुलक की संरचना को प्रभावित करते हैं। उदाहरण के लिए, अधिकांश धातु केंद्र धनायन रूप से आवेशित आयन होते हैं, जो लवण के रूप में उपस्थित रहते हैं। तथा नमक में प्रतिवाद समग्र संरचना को प्रभावित कर सकता है। उदाहरण के लिए,AgNO<sub>3</sub>, AgBF<sub>4</sub>, AgClO<sub>4</sub>, AgPF<sub>6</sub>, AgAsF<sub>6</sub> और AgSbF<sub>6</sub> जैसे चांदी के लवण सभी एक ही लिगैंड के साथ क्रिस्टलीकृत होते हैं, तथा धातु के समन्वय वातावरण के साथ-साथ संपूर्ण समन्वय बहुलक की आयाम के संदर्भ में संरचनाएं भिन्न होती हैं।<ref>{{Cite journal | doi = 10.1039/b201288j| title = सिल्वर (i) साल्ट और फ्लेक्सिबल लिगैंड 1,3-बीआईएस (4-पाइरिडाइल) प्रोपेन (बीपीपी) के सेल्फ-असेंबली से नए पॉलीमेरिक नेटवर्क। काउंटरों के प्रभावों की एक व्यवस्थित जांच और बीपीपी . पर आधारित समन्वय पॉलिमर का एक सर्वेक्षण| journal = CrystEngComm| volume = 4| issue = 22| pages = 121| year = 2002| last1 = Carlucci | first1 = L. | last2 = Ciani | first2 = G. | last3 = Proserpio | first3 = D. M. | last4 = Rizzato | first4 = S. }}</ref> | ||
=== क्रिस्टलीकरण पर्यावरण === | |||
इसके अतिरिक्त, क्रिस्टलीकरण वातावरण में विविधता भी संरचना को बदल सकती है। तथा [[ पीएच |pH]] में परिवर्तन,<ref>{{Cite journal | doi = 10.1016/j.jssc.2009.06.042| pmid = 20161370| title = PH- और mol-अनुपात पर निर्भर जिंक (II) समन्वय पॉलिमर का इमिनोडायसिटिक एसिड के साथ गठन: संश्लेषण, स्पेक्ट्रोस्कोपिक, क्रिस्टल संरचना और थर्मल अध्ययन| journal = Journal of Solid State Chemistry| volume = 182| issue = 10| pages = 2698–2706| year = 2009| last1 = Ni | first1 = L. B. | last2 = Zhang | first2 = R. H. | last3 = Liu | first3 = Q. X. | last4 = Xia | first4 = W. S. | last5 = Wang | first5 = H. | last6 = Zhou | first6 = Z. H. | bibcode = 2009JSSCh.182.2698N | pmc=2778864}}</ref> प्रकाश के संपर्क में आना या तापमान में परिवर्तन<ref name="Temperature">{{Cite journal | doi = 10.1021/cg049610r| title = कैडमियम हाइड्रॉक्साइड चरणों में सुपरमॉलेक्यूलर आइसोमेरिज्म। α- और β-Cd<sub>2</sub>(OH)<sub>2</sub>(2,4-pyda) के फोटोल्यूमिनसेंट कोऑर्डिनेशन पॉलिमर का तापमान-निर्भर संश्लेषण और संरचना| journal = Crystal Growth & Design| volume = 5| issue = 3| pages = 837| year = 2005| last1 = Tong | first1 = M. L. | last2 = Hu | first2 = S. | last3 = Wang | first3 = J. | last4 = Kitagawa | first4 = S. | last5 = Ng | first5 = S. W. }}</ref> सभी परिणामी संरचना को बदल सकते हैं। क्रिस्टलीकरण वातावरण में परिवर्तन के आधार पर संरचना पर प्रभाव स्थिति के आधार पर निर्धारित किया जाता है। | |||
===अम्यागत अणु === | |||
[[File:conformational change.jpg|thumb|300px|right|अम्यागत अणुओं को जोड़ने और हटाने से समन्वय बहुलक की परिणामी संरचना पर बड़ा प्रभाव पड़ सकता है। कुछ उदाहरण हैं (शीर्ष) एक रैखिक 1डी श्रृंखला को एक ज़िगज़ैग तरीके में बदलना, (मध्य) कंपित 2डी शीट को स्टैक्ड करना, और (नीचे) 3D क्यूब्स अधिक व्यापक रूप से स्थान बनाना होता है। ]]समन्वय बहुलक की संरचना में अधिकांश छिद्र या प्रणाली के रूप में खाली स्थान मे सम्मिलित होती है। यह खाली स्थान थर्मोडायनामिक रूप से प्रतिकूल होता है। संरचना को स्थिर करने और पतन को रोकने के लिए, छिद्र या प्रणाली को अम्यागत अणुओं द्वारा अधिकृत कर लिया जाता है। अम्यागत अणु प्रतिवेश जालक के साथ बंधन नहीं बनाते हैं, लेकिन कभी-कभी अंतराआण्विक बलों, जैसे हाइड्रोजन बन्ध या पाई स्टैकिंग के माध्यम से बातचीत करते हैं। तथा सबसे अधिक बार अम्यागत अणु विलायक होता है, जिसमें समन्वय बहुलक को क्रिस्टलीकृत किया जाता है। लेकिन वास्तव में अन्य लवण की उपस्थित कुछ भी हो सकता हैं।, वायुमंडलीय गैसें जैसे [[ ऑक्सीजन |ऑक्सीजन]], [[ नाइट्रोजन |नाइट्रोजन]], [[ कार्बन डाइआक्साइड |कार्बन डाइआक्साइड]], आदि। अम्यागत अणु की उपस्थिति कभी-कभी छिद्र या प्रणाली का समर्थन करके संरचना को प्रभावित कर सकती है अन्यथा कोई भी उपस्थित नहीं होता है। | |||
== | == अनुप्रयोग == | ||
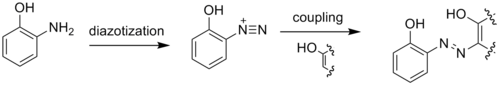
समन्वय बहुलक का द्रव्य(रंजित) के रूप में व्यावसायीकरण किया जाता है। तथा विशेष रूप से उपयोगी [[ -एमिनोफिनोल |एमिनोफिनोल]] के व्युत्पन्न होते हैं। तांबे या क्रोमियम का उपयोग करने वाले धातु जटिल द्रव्यों का उपयोग सामान्य रूप से हल्के द्रव्य के उत्पादन के लिए किया जाता है। [[ ट्राइडेंटेट लिगैंड |ट्राइडेंटेट लिगैंड]] रंजक उपयोगी होते हैं, क्योंकि वे अपने द्वि- या मोनो-डेंटेट समकक्षों की तुलना में अधिक स्थिर होते हैं।<ref>Grychtol, K.; Mennicke, W. (2002) "Metal-Complex Dyes." In ''Ullmann's Encyclopedia of Industrial Chemistry''. Wiley-VCH. {{doi|10.1002/14356007.a16_299}}.</ref><ref>Hunger, K.; Mischke, P.; Rieper, W.; Raue, R.; Kunde, K.; Engel, A. (2002) "Azo Dyes." In ''Ullmann's Encyclopedia of Industrial Chemistry''. Wiley-VCH. {{doi|10.1002/14356007.a03_245}}.</ref> | |||
[[Image:2-aminophenol diaz coup.png|500px]] | [[Image:2-aminophenol diaz coup.png|500px]] | ||
[[Image:2-aminophenol coord.png|350px]] | [[Image:2-aminophenol coord.png|350px]] | ||
==अनुसंधान | प्रारंभिक व्यावसायिक समन्वय बहुलक में से एक हॉफमैन यौगिक होता हैं, जिनका सूत्र Ni(CN)<sub>4</sub>Ni(NH<sub>3</sub>)<sub>2</sub> है। तथा ये सामग्री छोटे सुगंधित अम्यागत (बेंजीन, कुछ ज़ाइलीन) के साथ क्रिस्टलीकृत होती है। और इन हाइड्रोकार्बन को अलग करने के लिए व्यावसायिक रूप से इस चयनात्मकता का दोहन किया जाता है।<ref name="Ullmann">Atwood, J. L. (2012) "Inclusion Compounds" in ''Ullmann's Encyclopedia of Industrial Chemistry''. Wiley-VCH, Weinheim. {{doi| 10.1002/14356007.a14_119}}</ref> | ||
==अनुसंधान प्रवृत्तिया == | |||
===आणविक भंडारण === | ===आणविक भंडारण === | ||
हालांकि अभी तक | हालांकि अभी तक छिद्रित समन्वय बहुलक में छिद्रित कार्बन और जिओलाइट्स के समानांतर आणविक छलनी के रूप में व्यावहारिक नहीं क्षमता होती है।<ref name= Kitagawa/> छिद्र के आकार और आकृति को संयोजक के आकार और संग्लन लिगैंड्स की लंबाई और [[ कार्यात्मक समूह |कार्यात्मक समूहों]] द्वारा नियंत्रित किया जा सकता है। तथा प्रभावी [[ सोखना |अवशोषण]] प्राप्त करने के लिए छिद्र के आकार को संशोधित एवं कम करने के लिए गैर-वाष्पशील अम्यागत छिद्रित समन्वय को बहुलक स्थान में जोड़ा जाता है। सक्रिय सतह मे अम्यागत का उपयोग अवशोषण में योगदान के लिए भी किया जा सकता है। उदाहरण के लिए, बड़े-छिद्र MOF-177, 11.8 Å व्यास में, C60 अणुओं (व्यास में 6.83 Å) या अत्यधिक संयुग्मित प्रणाली वाले बहुलक द्वारा H<sub>2</sub> अवशोषण के लिए सतह क्षेत्र को बढ़ाने के लिए क्रम मे किया जा सकता है। | ||
लचीले | लचीले छिद्रित समन्वय बहुलक आणविक भंडारण के लिए संभावित रूप से आकर्षक होते हैं, क्योंकि उनके छिद्र के आकार को भौतिक परिवर्तनों द्वारा बदला जा सकता है। इसका उदाहरण एक बहुलक में देखा जा सकता है, जिसमें गैस के अणु अपनी सामान्य अवस्था में होते हैं, लेकिन संपीड़न पर बहुलक अवमुक्त हो जाता है। और संग्रहीत अणुओं को छोड़ देता है। बहुलक की संरचना पर निर्भर करते हुए, यह संभव होता है, कि संरचना पर्याप्त रूप से लचीली हो कि छिद्रों को बंद करना उत्क्रमणीय और बहुलक को फिर से गैस के अणुओं को ग्रहण करने के लिए पुन: उपयोग किया जा सकता है।<ref name="PDF1">{{Cite journal | doi = 10.1088/1468-6996/9/1/014108| pmid = 27877934| title = लचीला झरझरा समन्वय पॉलिमर का रसायन विज्ञान और अनुप्रयोग| journal = Science and Technology of Advanced Materials| volume = 9| issue = 1| pages = 014108| year = 2008| last1 = Bureekaew | first1 = S. | last2 = Shimomura | first2 = S. | last3 = Kitagawa | first3 = S. | bibcode = 2008STAdM...9a4108B|pmc=5099803}}</ref> मेटल-ऑर्गेनिक फ्रेमवर्क पेज में H<sub>2</sub> गैस भंडारण से संबंधित एक विस्तृत खंड होता है। | ||
=== ल्यूमिनेसेंस === | === ल्यूमिनेसेंस === | ||
ल्यूमिनसेंट समन्वय बहुलक में | ल्यूमिनसेंट समन्वय बहुलक में सामान्य रूप से कार्बनिक क्रोमोफोरिक लिगैंड होते हैं, जो प्रकाश को अवशोषित करते हैं, तथा धातु आयन को उत्तेजना ऊर्जा निकट करते हैं। जो समन्वय बहुलक संभावित रूप से सबसे बहुमुखी ल्यूमिनसेंट प्रजाति होती हैं, क्योंकि उनके उत्सर्जन गुणों को अम्यागत विनिमय के साथ जोड़ा जाता है। | ||
ल्यूमिनेसेंट अधिआण्विक संरचना ने हाल ही में प्रकाशीय इलेक्ट्रॉनिकी उपकरणों में या प्रतिदीप्त संवेदक और जांच के रूप में अपने संभावित अनुप्रयोगों के कारण बहुत रुचि को आकर्षित किया है। विशुद्ध रूप से कार्बनिक प्रजातियों की तुलना में समन्वय बहुलक अधिकांश अधिक स्थिर थर्मो- और विलायक-प्रतिरोधी होते हैं। धातु संयोजक (एलएमसीटी के कारण नहीं) की उपस्थिति के बिना प्रतिदीप्त करने वाले लिगैंड्स के लिए, इन सामग्रियों का तीव्र प्रतिदीप्त संवेदक उत्सर्जन को मुक्त लिगैंड की तुलना में अधिक क्रम का परिमाण होता है। इन सामग्रियों का उपयोग प्रकाश उत्सर्जक डायोड ([[ एलईडी |एलईडी]]) उपकरणों के संभावित उम्मीदवारों का प्रतिरूपण करने के लिए किया जा सकता है। प्रतिदीप्त में प्रभावशाली वृद्धि धातु केंद्र से समन्वयित करने पर लिगैंड की कठोरता और विषमता में वृद्धि के कारण होती है।।<ref name="MBook">{{cite book|title = समन्वय पॉलिमर: डिजाइन, विश्लेषण और अनुप्रयोग| author = Batten, Stuart R. | publisher = RSC Publishing| year = 2008 |pages = 297–307, 396–407|isbn=978-0-85404-837-3|doi=10.1039/9781847558862}}</ref> | |||
=== विद्युत चालकता === | === विद्युत चालकता === | ||
[[File:Coord Poly Conductivity.png|thumb|300px|right|समन्वय बहुलक की संरचना जो चालकता प्रदर्शित करती है, जहां | [[File:Coord Poly Conductivity.png|thumb|300px|right|समन्वय बहुलक की संरचना जो चालकता प्रदर्शित करती है, जहां M = Fe, Ru, OS; L = ऑक्टेइथाइलपोर्फिरिनैटो या थैलोसाइनिनाटो; N, पाइराज़िन या बाइपिरिडीन से संबंधित होती है।]]समन्वय बहुलक की संरचनाओं में छोटे अकार्बनिक और संयुग्मित कार्बनिक सेतु हो सकते हैं, जो [[ विद्युत चालन |विद्युत चालन]] के लिए मार्ग प्रदान करते हैं। ऐसे समन्वय बहुलक के उदाहरण [[ प्रवाहकीय धातु-कार्बनिक ढांचे |प्रवाहकीय धातु-कार्बनिक ढांचे]] होते हैं। कुछ आयामी समन्वय बहुलक जैसा कि चित्र में दिखाया गया है,कि 1x10−6 से 2x10−1 S/cm की सीमा में चालकता को प्रदर्शित करता है। चालकता धातु [[ डी-कक्षीय |डी-कक्षीय]] और ब्रिजिंग लिगैंड के pi* स्तर के बीच अन्योन्य क्रिया के कारण होती है। कुछ परिस्थितियों में समन्वय बहुलक में अर्धचालक व्यवहार हो सकता है। चांदी युक्त बहुलक की चादरों से युक्त त्रि-आयामी संरचनाएं अर्ध-चालकता प्रदर्शित करती हैं जब धातु केंद्र संरेखित होते हैं, और चालन कम हो जाता है, क्योंकि चांदी के परमाणु समानांतर से लंबवत तक जाते हैं।<ref name="MBook" /> | ||
=== [[ चुंबकत्व |चुंबकत्व]] === | |||
समन्वय बहुलक कई प्रकार के चुंबकत्व प्रदर्शित करते हैं। [[ फेरी चुम्बकत्व |प्रतिचुंबकत्व]], [[ लौह चुम्बकत्व |लघु लोह चुम्बकत्व]], और प्रतिलोह चुंबकत्व पैरामैग्नेटिक केंद्रों के स्पिन के बीच युग्मन से उत्पन्न ठोस के अंदर चुंबकीय स्पिन की सहकारी घटनाएं होती हैं। जो कुशल चुंबकीय की अनुमति देने के लिए, धातु आयनों को छोटे धातु-धातु संपर्कों (जैसे ऑक्सो, साइनो, और एजिडो ब्रिज) की अनुमति देने वाले छोटे लिगैंड्स द्वारा ब्रिज किया जाना चाहिए।<ref name="MBook" /> | |||
=== [[ चुंबकत्व ]] === | === संवेदक क्षमता === | ||
समन्वय बहुलक कई प्रकार के चुंबकत्व प्रदर्शित करते हैं। [[ | समन्वय बहुलक संरचना में सम्मिलित [[ विलायक |विलायक]] अणुओं के परिवर्तन पर रंजक परिवर्तन भी दिखा सकते हैं। इसका एक उदाहरण [Re<sub>6</sub>S<sub>8</sub>(CN)<sub>6</sub>]<sup>4−</sup> (गुच्छ) क्लस्टर के दो सह समन्वय बहुलक होते है, जिसमें पानी के लिगेंड होते हैं, जो कोबाल्ट परमाणुओं के साथ समन्वय करते हैं। यह मूल रूप से नारंगी समाधान [[ टेट्राहाइड्रोफुरान |टेट्राहाइड्रोफुरान]] के साथ पानी के प्रतिस्थापन के साथ बैंगनी या हरे रंग में परिवर्तित हो जाता है, और डायथाइल ईथर के हल्का नीला हो जाता है। बहुलक इस प्रकार विलायक संवेदक के रूप में कार्य कर सकता है, जो कुछ सॉल्वैंट्स की उपस्थिति में भौतिक रूप से रंग परिवर्तित करता है। रंग परिवर्तन कोबाल्ट परमाणुओं पर पानी के लिगेंड को विस्थापित करने वाले आने वाले विलायक के लिए जिम्मेदार ठहराया जाता है, जिसके परिणामस्वरूप ऑक्टाहेड्रल से टेट्राहेड्रल तक उनकी ज्यामिति में परिवर्तन होता है।<ref name="MBook" /> | ||
=== | |||
समन्वय बहुलक संरचना में | |||
==संदर्भ== | ==संदर्भ== | ||
{{reflist|30em}} | {{reflist|30em}} | ||
[[Category: | [[Category:Articles with short description]] | ||
[[Category:CS1 maint]] | |||
[[Category:Created On 18/10/2022]] | [[Category:Created On 18/10/2022]] | ||
[[Category:Machine Translated Page]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:पॉलिमर]] | |||
[[Category:समन्वय बहुलक|*]] | |||
Latest revision as of 14:23, 5 December 2022
समन्वय बहुलक एक ऐसी अकार्बनिक या कार्बधात्विक बहुलक संरचना है, जिसमें लिगैंड्स द्वारा जुड़े धातु के धनायन युक्त केंद्र होते हैं। तथा अधिक औपचारिक रूप से समन्वय बहुलक 1, 2 या 3 आयामों में विस्तारित समन्वय संस्थाओं के साथ एक समन्वय यौगिक होता है।[1]
इसे एक बहुलक के रूप में भी वर्णित किया जा सकता है, जिसकी पुनरावृत्ति इकाइयाँ समन्वय परिसर (कॉम्प्लेक्स) होती हैं। तथा समन्वय बहुलक में उपवर्ग समन्वय नेटवर्क होते हैं, जो समन्वय यौगिकों को दोहराते हुए समन्वय संस्थाओं के माध्यम से 1 आयाम में दो या दो से अधिक व्यक्तिगत श्रृंखलाओं, लूपों या स्पाइरो-लिंक्स के बीच क्रॉस-लिंक के साथ या समन्वय यौगिकों का 2 या 3 आयामों की इकाइयों के माध्यम से विस्तार करते हैं। इनमें से एक उपवर्ग कार्बनिक धातु संरचना या MOFs होता हैं, जो संभावित रिक्तियों वाले कार्बनिक लिगैंड्स के साथ समन्वय नेटवर्क मे होता है।[1]
समन्वय बहुलक कई क्षेत्रों के लिए प्रासंगिक हैं, जिनमें कई संभावित अनुप्रयोग भी सम्मिलित होते हैं।[2] समन्वय बहुलक को उनकी संरचना के अनुसार कई तरीकों से वर्गीकृत किया जा सकता है। तथा एक महत्वपूर्ण वर्गीकरण को विमीयता कहा जाता है। एक संरचना को 1, 2 या 3 आयामी होने के लिए निर्धारित किया जा सकता है, अंतरिक्ष में दिशाओं की संख्या के आधार पर सरणी फैली हुई है। जो एक-आयामी संरचना सीधी रेखा x अक्ष में फैली हुई होती है, द्वि-आयामी संरचना समतल दो दिशाओं (x और y अक्षों) में फैली होती है तथा त्रि-आयामी संरचना तीनों दिशाओं (x, y और z अक्षों) में फैली हुई होती है।[3] यह चित्र 1 में दर्शाया गया है।
इतिहास
अल्फ्रेड वर्नर और उनके समकालीनों के कार्य ने समन्वय बहुलक के अध्ययन के लिए नींव रखी तथा कई बार उनकी सम्मानित सामग्रियों को समन्वय बहुलक के रूप में पहचाना जाता है। इनमें साइनाइड कॉम्प्लेक्स हल्का नीला और हॉफमैन क्लैथ्रेट्स सम्मिलित हैं।[4]
संश्लेषण और प्रसारण
समन्वय बहुलक अधिकांश स्व-संयोजन द्वारा निर्मित किए जाते हैं, जिसमें लिगेंड के साथ धातु के नमक का क्रिस्टलीकरण सम्मिलित होता है। जो क्रिस्टल अभियांत्रिकी और आणविक स्व-संयोजन तंत्र प्रासंगिक होते हैं।[2]
अंतराआण्विक बल और संबंध
धातु-लिगैंड परिसरों को निर्धारित करने वाले बलों में धातु और लिगैंड के बीच बने समन्वय बंधन के अतिरिक्त वान डर वाल्स बल, पीआई-पीआई अन्तःक्रिया, हाइड्रोजन बंध और ध्रुवीकृत बंध द्वारा पीआई बंध का स्थिरीकरण सम्मिलित होता है। जो सहसंयोजक बंधों की तुलना में लंबी संतुलन दूरी (बंधन की लंबाई) के साथ अंतर-आणविक बल कमजोर होते हैं। उदाहरण के लिए, बेंजीन वलय के बीच पीआई-पीआई अन्तः क्रिया में लगभग 5-10 kJ/mol ऊर्जा होती है, जो वलयों के समानांतर तल के बीच सर्वोत्तम 3.4–3.8 एंग्स्ट्रॉम अंतराल का होता है।
समन्वय
समन्वय बहुलक की क्रिस्टल संरचना और आयाम संयोजक की कार्य क्षमता को धातु केंद्र के समन्वय ज्यामिति द्वारा निर्धारित किया जाता है। विमीयता सामान्य रूप से धातु केंद्र द्वारा संचालित होती है, जो संयोजक पर 16 से अधिक कार्यात्मक स्थितियों को जोड़ने की क्षमता रखती है। हालाँकि यह हमेशा ऐसा नहीं होता है, क्योंकि संयोजक द्वारा आयाम को संचालित किया जा सकता है। जब संयोजक धातु केंद्र की तुलना में अधिक धातु केंद्रों से जुड़ता है।[5] तो समन्वय बहुलक की उच्चतम ज्ञात समन्वय संख्या 14 होती है,[6] हालांकि इसकी समन्वय संख्या अधिकांश 2 से 10 के बीच होती है।[7] विभिन्न समन्वय संख्याओं के उदाहरण के लिए चित्र 2 में तलीय ज्यामिति को दिखाया गया हैं, और चित्र 1 में 1डी संरचना 2-समन्वित है तथा तलीय 4-समन्वित और 3डी मे 6-समन्वित को दिखाया गया है।
धातु केंद्र
धातु केंद्र, जिन्हें अधिकांश नोड(बिन्दु) या केंद्र भी कहा जाता है, ये धातु केंद्र एक अच्छी तरह से परिभाषित कोणों पर विशिष्ट संख्या के संयोजक से बंधते हैं तथा एक नोड से जुड़े संयोजको की संख्या को समन्वय संख्या के रूप में भी जाना जाता है, जो कि उनके द्वारा आयोजित कोणों के साथ संरचना के आयाम को निर्धारित करता है। एक धातु केंद्र की समन्वय संख्या और समन्वय ज्यामिति उसके चारों ओर इलेक्ट्रॉन घनत्व के गैर-समान वितरण द्वारा निर्धारित की जाती है, और सामान्य रूप से समन्वय संख्या धनायन आकार के साथ बढ़ जाती है। जो कई प्रारूप मे विशेष रूप से संकरण प्रारूप और आणविक कक्षीय सिद्धांत, या समन्वय ज्यामिति की पूर्वानुमान व्याख्या करने के लिए श्रोडिंगर समीकरण का उपयोग करते हैं, हालांकि इलेक्ट्रॉन घनत्व वितरण पर पर्यावरण के जटिल प्रभाव के कारण यह करना जटिल होता है।[9]
संक्रमण धातु
संक्रमण धातुओं का उपयोग सामान्य रूप से नोड्स के रूप में किया जाता है। तथा आंशिक रूप से भरे हुए डी कक्षाओं या तो परमाणु या आयन में पर्यावरण के आधार पर अलग-अलग संकरण को कर सकते हैं। यह इलेक्ट्रॉनिक संरचना उनमें से कुछ को कई समन्वय ज्यामिति मे विशेष रूप से तांबे और सोने के आयनों को प्रदर्शित करने का कारण बनती है, जो तटस्थ परमाणुओं के रूप में उनके बाहरी आवरण में पूर्ण डी-कक्षक होते हैं।
लैंथेनाइड्स
लैंथेनाइड्स बड़े परमाणु होते हैं जिनकी समन्वय संख्या 7 से 14 के बीच होती है। तथा उनके समन्वय वातावरण का पूर्वानुमान करना जटिल हो सकता है, जिससे उन्हें नोड्स के रूप में उपयोग करना चुनौतीपूर्ण हो जाता है। तथा वे ल्यूमिनेसेंट घटकों को सम्मिलित करने की संभावना को प्रदान करते हैं।
क्षार धातु और क्षारीय मृदा धातु
क्षार धातु और क्षारीय मृदा धातु स्थिर धनायन के रूप में उपस्थित होती हैं। क्षार धातुएं आसानी से स्थिर संयोजी आवरण के साथ धनायन बनाती हैं, जिससे उन्हें लैंथेनाइड्स और संक्रमण धातुओं की तुलना में अलग समन्वय आचरण मिलता है। तथा वे संश्लेषण में उपयोग किए जाने वाले नमक के प्रतिवाद से बहुत प्रभावित होते हैं, जिससे उनको बचना जटिल होता है। चित्रा 3 में दिखाए गए समन्वय बहुलक समूह दो धातु हैं। इस स्थिति में इन संरचनाओं की विमीयता बढ़ जाती है, क्योंकि धातु की त्रिज्या समूह(कैल्शियम से स्ट्रोंटियम से बेरियम तक) में बढ़ जाती है।
लिगैंडस
अधिकांश समन्वय बहुलक में एक लिगैंड परमाणु या परमाणुओं का समूह औपचारिक रूप से धातु के धनायन के लिए इलेक्ट्रॉनों की एक एकल जोड़ी दान करता है। तथा एक लुईस अम्ल और क्षार के संबंध के माध्यम से एक समन्वय परिसर का निर्माण करेगा। तथा समन्वय बहुलक तब बनते हैं, जब एक लिगैंड में कई समन्वय बंध बनाने और कई धातु केंद्रों के बीच एक सेतु के रूप में कार्य करने की क्षमता होती है। लिगेंड जो एक समन्वय बंधन बना सकते हैं, उन्हें मोनोडेंटेट कहा जाता है, लेकिन वे जो बहु-सहसंयोजन बंध बनाते हैं, जिससे समन्वय बहुलक बन सकते हैं, बहुदंतक कहलाते हैं। बहुदंतक लिगेंड विशेष रूप से महत्वपूर्ण होते हैं, क्योंकि ये लिगेंड के माध्यम से होता है जो कई धातु केंद्रों को एक साथ जोड़ता है जिससे एक अनंत सरणी बनती है। बहुदंतक लिगेंड भी एक ही धातु (जिसे प्रतिवादन कहा जाता है) में कई बंधन को बना सकते हैं। तथा मोनोडेंटेट लिगैंड्स को टर्मिनल भी कहा जाता है, क्योंकि वे नेटवर्क को जारी रखने के लिए जगह नहीं देते हैं। समन्वय बहुलक मे अधिकांश पॉली और मोनोडेंटेट, सेतुबंधन, चेलेटिंग तथा टर्मिनल लिगेंड का संयोजन होता है।
रासायनिक संरचना
इलेक्ट्रॉनों की एकल जोड़ी के साथ लगभग किसी भी प्रकार के परमाणु को लिगैंड में सम्मिलित किया जा सकता है। तथा सामान्य रूप से समन्वय बहुलक में पाए जाने वाले लिगैंड्स में होते है। जो पॉलीपिरिडाइन्स, फेनेंथ्रोलाइन्स, हाइड्रॉक्सीक्विनोलिन्स और पॉलीकार्बोक्सिलेट्स सम्मिलित होते हैं। ऑक्सीजन और नाइट्रोजन परमाणु सामान्य रूप से बाध्यकारी साइटों के रूप में पाए जाते हैं, लेकिन अन्य परमाणु, जैसे गंधक [10] और फास्फोरस ,[11][12] देखे गए हैं।
लिगेंड्स और धात्विक धनायन कठोर अम्ल क्षार का HSAB सिद्धान्त प्रवृत का पालन करते हैं। तथा इसका अर्थ यह होता है कि अधिक बड़े ध्रुवीकरण योग्य मृदु धातुएं, बड़े अधिक ध्रुवीकरण योग्य नरम लिगेंड के साथ अधिक सरलता से समन्वय करती है। तथा छोटे और गैर-ध्रुवीकरण योग्य कठोर धातुएं, छोटे कठोर लिगेंड के साथ समन्वय करती है।
संरचनात्मक अभिविन्यास
लिगेंड लचीले या कठोर हो सकते हैं। तथा एक कठोर लिगैंड वह होता है, जिसे किसी संरचना के अन्दर बंधों के चारों ओर घूमने या पुन: पेश करने की स्वतंत्रता नहीं होती है। लचीले लिगेंड झुक सकते हैं, एवं बंध के चारों ओर घूम सकते हैं,तथा खुद को पुन: पेश भी कर सकते हैं। ये विभिन्न अनुरूपता संरचना में अधिक विविधता को उत्पन्न करते हैं। जो समन्वय बहुलक के उदाहरण हैं, जिनमें एक संरचना के अन्दर एक ही लिगैंड के दो विन्यास भी सम्मिलित होते हैं,[13] जो इसमे एक साथ ही दो अलग-अलग संरचनाएं होती हैं, जहां उनके बीच एकमात्र अंतर लिगैंड अभिविन्यास होता है।
लिगैंड लंबाई
गैर-बहुलक (मोनो- या ओलिगोमेरिक) संरचनाओं की तुलना में एक बहुलक संरचना के निर्माण की संभावना निर्धारित करने में लिगैंड की लंबाई एक महत्वपूर्ण कारक हो सकती है।[14]
अन्य कारक
प्रतिवाद
धातु और लिगेंड चयन के अतिरिक्त कई अन्य कारक होते हैं, जो समन्वय बहुलक की संरचना को प्रभावित करते हैं। उदाहरण के लिए, अधिकांश धातु केंद्र धनायन रूप से आवेशित आयन होते हैं, जो लवण के रूप में उपस्थित रहते हैं। तथा नमक में प्रतिवाद समग्र संरचना को प्रभावित कर सकता है। उदाहरण के लिए,AgNO3, AgBF4, AgClO4, AgPF6, AgAsF6 और AgSbF6 जैसे चांदी के लवण सभी एक ही लिगैंड के साथ क्रिस्टलीकृत होते हैं, तथा धातु के समन्वय वातावरण के साथ-साथ संपूर्ण समन्वय बहुलक की आयाम के संदर्भ में संरचनाएं भिन्न होती हैं।[15]
क्रिस्टलीकरण पर्यावरण
इसके अतिरिक्त, क्रिस्टलीकरण वातावरण में विविधता भी संरचना को बदल सकती है। तथा pH में परिवर्तन,[16] प्रकाश के संपर्क में आना या तापमान में परिवर्तन[17] सभी परिणामी संरचना को बदल सकते हैं। क्रिस्टलीकरण वातावरण में परिवर्तन के आधार पर संरचना पर प्रभाव स्थिति के आधार पर निर्धारित किया जाता है।
अम्यागत अणु
समन्वय बहुलक की संरचना में अधिकांश छिद्र या प्रणाली के रूप में खाली स्थान मे सम्मिलित होती है। यह खाली स्थान थर्मोडायनामिक रूप से प्रतिकूल होता है। संरचना को स्थिर करने और पतन को रोकने के लिए, छिद्र या प्रणाली को अम्यागत अणुओं द्वारा अधिकृत कर लिया जाता है। अम्यागत अणु प्रतिवेश जालक के साथ बंधन नहीं बनाते हैं, लेकिन कभी-कभी अंतराआण्विक बलों, जैसे हाइड्रोजन बन्ध या पाई स्टैकिंग के माध्यम से बातचीत करते हैं। तथा सबसे अधिक बार अम्यागत अणु विलायक होता है, जिसमें समन्वय बहुलक को क्रिस्टलीकृत किया जाता है। लेकिन वास्तव में अन्य लवण की उपस्थित कुछ भी हो सकता हैं।, वायुमंडलीय गैसें जैसे ऑक्सीजन, नाइट्रोजन, कार्बन डाइआक्साइड, आदि। अम्यागत अणु की उपस्थिति कभी-कभी छिद्र या प्रणाली का समर्थन करके संरचना को प्रभावित कर सकती है अन्यथा कोई भी उपस्थित नहीं होता है।
अनुप्रयोग
समन्वय बहुलक का द्रव्य(रंजित) के रूप में व्यावसायीकरण किया जाता है। तथा विशेष रूप से उपयोगी एमिनोफिनोल के व्युत्पन्न होते हैं। तांबे या क्रोमियम का उपयोग करने वाले धातु जटिल द्रव्यों का उपयोग सामान्य रूप से हल्के द्रव्य के उत्पादन के लिए किया जाता है। ट्राइडेंटेट लिगैंड रंजक उपयोगी होते हैं, क्योंकि वे अपने द्वि- या मोनो-डेंटेट समकक्षों की तुलना में अधिक स्थिर होते हैं।[18][19]
प्रारंभिक व्यावसायिक समन्वय बहुलक में से एक हॉफमैन यौगिक होता हैं, जिनका सूत्र Ni(CN)4Ni(NH3)2 है। तथा ये सामग्री छोटे सुगंधित अम्यागत (बेंजीन, कुछ ज़ाइलीन) के साथ क्रिस्टलीकृत होती है। और इन हाइड्रोकार्बन को अलग करने के लिए व्यावसायिक रूप से इस चयनात्मकता का दोहन किया जाता है।[20]
अनुसंधान प्रवृत्तिया
आणविक भंडारण
हालांकि अभी तक छिद्रित समन्वय बहुलक में छिद्रित कार्बन और जिओलाइट्स के समानांतर आणविक छलनी के रूप में व्यावहारिक नहीं क्षमता होती है।[4] छिद्र के आकार और आकृति को संयोजक के आकार और संग्लन लिगैंड्स की लंबाई और कार्यात्मक समूहों द्वारा नियंत्रित किया जा सकता है। तथा प्रभावी अवशोषण प्राप्त करने के लिए छिद्र के आकार को संशोधित एवं कम करने के लिए गैर-वाष्पशील अम्यागत छिद्रित समन्वय को बहुलक स्थान में जोड़ा जाता है। सक्रिय सतह मे अम्यागत का उपयोग अवशोषण में योगदान के लिए भी किया जा सकता है। उदाहरण के लिए, बड़े-छिद्र MOF-177, 11.8 Å व्यास में, C60 अणुओं (व्यास में 6.83 Å) या अत्यधिक संयुग्मित प्रणाली वाले बहुलक द्वारा H2 अवशोषण के लिए सतह क्षेत्र को बढ़ाने के लिए क्रम मे किया जा सकता है।
लचीले छिद्रित समन्वय बहुलक आणविक भंडारण के लिए संभावित रूप से आकर्षक होते हैं, क्योंकि उनके छिद्र के आकार को भौतिक परिवर्तनों द्वारा बदला जा सकता है। इसका उदाहरण एक बहुलक में देखा जा सकता है, जिसमें गैस के अणु अपनी सामान्य अवस्था में होते हैं, लेकिन संपीड़न पर बहुलक अवमुक्त हो जाता है। और संग्रहीत अणुओं को छोड़ देता है। बहुलक की संरचना पर निर्भर करते हुए, यह संभव होता है, कि संरचना पर्याप्त रूप से लचीली हो कि छिद्रों को बंद करना उत्क्रमणीय और बहुलक को फिर से गैस के अणुओं को ग्रहण करने के लिए पुन: उपयोग किया जा सकता है।[21] मेटल-ऑर्गेनिक फ्रेमवर्क पेज में H2 गैस भंडारण से संबंधित एक विस्तृत खंड होता है।
ल्यूमिनेसेंस
ल्यूमिनसेंट समन्वय बहुलक में सामान्य रूप से कार्बनिक क्रोमोफोरिक लिगैंड होते हैं, जो प्रकाश को अवशोषित करते हैं, तथा धातु आयन को उत्तेजना ऊर्जा निकट करते हैं। जो समन्वय बहुलक संभावित रूप से सबसे बहुमुखी ल्यूमिनसेंट प्रजाति होती हैं, क्योंकि उनके उत्सर्जन गुणों को अम्यागत विनिमय के साथ जोड़ा जाता है।
ल्यूमिनेसेंट अधिआण्विक संरचना ने हाल ही में प्रकाशीय इलेक्ट्रॉनिकी उपकरणों में या प्रतिदीप्त संवेदक और जांच के रूप में अपने संभावित अनुप्रयोगों के कारण बहुत रुचि को आकर्षित किया है। विशुद्ध रूप से कार्बनिक प्रजातियों की तुलना में समन्वय बहुलक अधिकांश अधिक स्थिर थर्मो- और विलायक-प्रतिरोधी होते हैं। धातु संयोजक (एलएमसीटी के कारण नहीं) की उपस्थिति के बिना प्रतिदीप्त करने वाले लिगैंड्स के लिए, इन सामग्रियों का तीव्र प्रतिदीप्त संवेदक उत्सर्जन को मुक्त लिगैंड की तुलना में अधिक क्रम का परिमाण होता है। इन सामग्रियों का उपयोग प्रकाश उत्सर्जक डायोड (एलईडी) उपकरणों के संभावित उम्मीदवारों का प्रतिरूपण करने के लिए किया जा सकता है। प्रतिदीप्त में प्रभावशाली वृद्धि धातु केंद्र से समन्वयित करने पर लिगैंड की कठोरता और विषमता में वृद्धि के कारण होती है।।[22]
विद्युत चालकता
समन्वय बहुलक की संरचनाओं में छोटे अकार्बनिक और संयुग्मित कार्बनिक सेतु हो सकते हैं, जो विद्युत चालन के लिए मार्ग प्रदान करते हैं। ऐसे समन्वय बहुलक के उदाहरण प्रवाहकीय धातु-कार्बनिक ढांचे होते हैं। कुछ आयामी समन्वय बहुलक जैसा कि चित्र में दिखाया गया है,कि 1x10−6 से 2x10−1 S/cm की सीमा में चालकता को प्रदर्शित करता है। चालकता धातु डी-कक्षीय और ब्रिजिंग लिगैंड के pi* स्तर के बीच अन्योन्य क्रिया के कारण होती है। कुछ परिस्थितियों में समन्वय बहुलक में अर्धचालक व्यवहार हो सकता है। चांदी युक्त बहुलक की चादरों से युक्त त्रि-आयामी संरचनाएं अर्ध-चालकता प्रदर्शित करती हैं जब धातु केंद्र संरेखित होते हैं, और चालन कम हो जाता है, क्योंकि चांदी के परमाणु समानांतर से लंबवत तक जाते हैं।[22]
चुंबकत्व
समन्वय बहुलक कई प्रकार के चुंबकत्व प्रदर्शित करते हैं। प्रतिचुंबकत्व, लघु लोह चुम्बकत्व, और प्रतिलोह चुंबकत्व पैरामैग्नेटिक केंद्रों के स्पिन के बीच युग्मन से उत्पन्न ठोस के अंदर चुंबकीय स्पिन की सहकारी घटनाएं होती हैं। जो कुशल चुंबकीय की अनुमति देने के लिए, धातु आयनों को छोटे धातु-धातु संपर्कों (जैसे ऑक्सो, साइनो, और एजिडो ब्रिज) की अनुमति देने वाले छोटे लिगैंड्स द्वारा ब्रिज किया जाना चाहिए।[22]
संवेदक क्षमता
समन्वय बहुलक संरचना में सम्मिलित विलायक अणुओं के परिवर्तन पर रंजक परिवर्तन भी दिखा सकते हैं। इसका एक उदाहरण [Re6S8(CN)6]4− (गुच्छ) क्लस्टर के दो सह समन्वय बहुलक होते है, जिसमें पानी के लिगेंड होते हैं, जो कोबाल्ट परमाणुओं के साथ समन्वय करते हैं। यह मूल रूप से नारंगी समाधान टेट्राहाइड्रोफुरान के साथ पानी के प्रतिस्थापन के साथ बैंगनी या हरे रंग में परिवर्तित हो जाता है, और डायथाइल ईथर के हल्का नीला हो जाता है। बहुलक इस प्रकार विलायक संवेदक के रूप में कार्य कर सकता है, जो कुछ सॉल्वैंट्स की उपस्थिति में भौतिक रूप से रंग परिवर्तित करता है। रंग परिवर्तन कोबाल्ट परमाणुओं पर पानी के लिगेंड को विस्थापित करने वाले आने वाले विलायक के लिए जिम्मेदार ठहराया जाता है, जिसके परिणामस्वरूप ऑक्टाहेड्रल से टेट्राहेड्रल तक उनकी ज्यामिति में परिवर्तन होता है।[22]
संदर्भ
- ↑ 1.0 1.1 Batten, Stuart R.; Champness, Neil R.; Chen, Xiao-Ming; Garcia-Martinez, Javier; Kitagawa, Susumu; Öhrström, Lars; O'Keeffe, Michael; Suh, Myunghyun P.; Reedijk, Jan (2013). "Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013)". Pure and Applied Chemistry. 85 (8): 1715. doi:10.1351/PAC-REC-12-11-20.
- ↑ 2.0 2.1 Fromm, K. (2008). "एस-ब्लॉक धातु आयनों के साथ समन्वय बहुलक नेटवर्क" (PDF). Coord. Chem. Rev. 252 (8–9): 856–885. doi:10.1016/j.ccr.2007.10.032.
- ↑ Chen, X; Ye, B.; Tong, M. (2005). "2,2′-बिपिरिडिल-जैसे और कार्बोक्जिलेट लिगैंड्स के साथ धातु-कार्बनिक आणविक वास्तुकला". Coord. Chem. Rev. 249 (5–6): 545–565. doi:10.1016/j.ccr.2004.07.006.
- ↑ 4.0 4.1 Kitagawa, S.; Kitaura, R.; Noro, S. I. (2004). "कार्यात्मक झरझरा समन्वय पॉलिमर". Angewandte Chemie International Edition. 43 (18): 2334–2375. doi:10.1002/anie.200300610. PMID 15114565.
- ↑ Lamming, Glenn; El-Zubir, Osama; Kolokotroni, James; McGurk, Christopher; Waddell, Paul G.; Probert, Michael R.; Houlton, Andrew (2016-10-03). "Ag(I)-N बॉन्ड फॉर्मेशन पर आधारित दो-आयामी फ्रेमवर्क: सिंगल क्रिस्टल से सिंगल मॉलिक्यूलर शीट ट्रांसफॉर्मेशन". Inorganic Chemistry. 55 (19): 9644–9652. doi:10.1021/acs.inorgchem.6b01365. ISSN 0020-1669. PMID 27631950.
- ↑ Charpin, P.; Nierlich, M.; Vigner, D.; Lance, M.; Baudry, D. (1987). "यूरेनियम के दूसरे क्रिस्टलीय रूप की संरचना (चतुर्थ) टेट्राहाइड्रोबोरेट". Acta Crystallographica Section C. 43 (8): 1465–p1467. doi:10.1107/S0108270187091431.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Robin, A. Y.; Fromm, K. M. (2006). "O- और N-दाताओं के साथ समन्वय बहुलक नेटवर्क: वे क्या हैं, क्यों और कैसे बनते हैं". Coord. Chem. Rev. 250 (15–16): 2127–2157. doi:10.1016/j.ccr.2006.02.013.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Cote, A; Shimizu, G. (2003). "अनुकूलनीय घटकों के संयोजन के माध्यम से समन्वय ठोस: क्षारीय पृथ्वी ऑर्गनोसल्फोनेट नेटवर्क में व्यवस्थित संरचनात्मक भिन्नता". Chem. Eur. J. 9 (21): 5361–5370. doi:10.1002/chem.200305102. PMID 14613146.
- ↑ Bernstein, Jeremy; Paul M. Fishbane; Stephen G. Gasiorowicz (April 3, 2000). आधुनिक भौतिकी. Prentice-Hall. p. 624. ISBN 978-0-13-955311-0.
- ↑ Wen, M.; Munakata, M.; Suenaga, Y.; Kuroda-Sowa, T.; Maekawa, M.; Yan, S. G. (2001). "सिल्वर (I) चक्रीय सल्फर लिगैंड के समन्वय पॉलिमर, 2,2′,3,3′-टेट्राहाइड्रो-4,4′-डिथिया-1,1′-बिनाफ्थिलिडीन". Inorganica Chimica Acta. 322 (1–2): 133–137. doi:10.1016/S0020-1693(01)00556-4.
- ↑ Hung-Low, F.; Klausmeyer, K. K.; Gary, J. B. (2009). "4-(डिपेनिलफॉस्फिनोमिथाइल) पाइरीडीन के स्व-इकट्ठे चांदी (I) परिसरों में आयनों और लिगैंड अनुपात का प्रभाव और बाइपिरिडीन लिगैंड के साथ उनके डेरिवेटिव". Inorganica Chimica Acta. 362 (2): 426. doi:10.1016/j.ica.2008.04.032.
- ↑ Ricci, G.; Sommazzi, A.; Masi, F.; Ricci, M.; Boglia, A.; Leone, G. (2010). "1,3-डाइन्स पोलीमराइजेशन के लिए फॉस्फोरस और नाइट्रोजन लिगैंड्स के साथ अच्छी तरह से परिभाषित संक्रमण धातु परिसरों". Coordination Chemistry Reviews. 254 (5–6): 661. doi:10.1016/j.ccr.2009.09.023.
- ↑ Knaust, J. M.; Keller, S. W. (2002). "सीटू में से एक मिश्रित-लिगैंड समन्वय पॉलिमर, बीआईएस (4-पाइरिडाइल) एथिलीन का सीयू (आई) -मध्यस्थ आइसोमेराइजेशन". Inorganic Chemistry. 41 (22): 5650–2. doi:10.1021/ic025836c. PMID 12401066.
- ↑ Buvailo, Andrii I.; Gumienna-Kontecka, Elzbieta; Pavlova, Svetlana V.; Fritsky, Igor O.; Haukka, Matti (2010). "कॉपर में डिमेरिक बनाम पॉलिमरिक समन्वय (ii) बीआईएस (चेलेटिंग) ऑक्सीम और एमाइड लिगैंड के साथ धनायनित परिसरों". Dalton Transactions. 39 (27): 6266–75. doi:10.1039/C0DT00008F. PMID 20520918.
- ↑ Carlucci, L.; Ciani, G.; Proserpio, D. M.; Rizzato, S. (2002). "सिल्वर (i) साल्ट और फ्लेक्सिबल लिगैंड 1,3-बीआईएस (4-पाइरिडाइल) प्रोपेन (बीपीपी) के सेल्फ-असेंबली से नए पॉलीमेरिक नेटवर्क। काउंटरों के प्रभावों की एक व्यवस्थित जांच और बीपीपी . पर आधारित समन्वय पॉलिमर का एक सर्वेक्षण". CrystEngComm. 4 (22): 121. doi:10.1039/b201288j.
- ↑ Ni, L. B.; Zhang, R. H.; Liu, Q. X.; Xia, W. S.; Wang, H.; Zhou, Z. H. (2009). "PH- और mol-अनुपात पर निर्भर जिंक (II) समन्वय पॉलिमर का इमिनोडायसिटिक एसिड के साथ गठन: संश्लेषण, स्पेक्ट्रोस्कोपिक, क्रिस्टल संरचना और थर्मल अध्ययन". Journal of Solid State Chemistry. 182 (10): 2698–2706. Bibcode:2009JSSCh.182.2698N. doi:10.1016/j.jssc.2009.06.042. PMC 2778864. PMID 20161370.
- ↑ Tong, M. L.; Hu, S.; Wang, J.; Kitagawa, S.; Ng, S. W. (2005). "कैडमियम हाइड्रॉक्साइड चरणों में सुपरमॉलेक्यूलर आइसोमेरिज्म। α- और β-Cd2(OH)2(2,4-pyda) के फोटोल्यूमिनसेंट कोऑर्डिनेशन पॉलिमर का तापमान-निर्भर संश्लेषण और संरचना". Crystal Growth & Design. 5 (3): 837. doi:10.1021/cg049610r.
- ↑ Grychtol, K.; Mennicke, W. (2002) "Metal-Complex Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a16_299.
- ↑ Hunger, K.; Mischke, P.; Rieper, W.; Raue, R.; Kunde, K.; Engel, A. (2002) "Azo Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_245.
- ↑ Atwood, J. L. (2012) "Inclusion Compounds" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a14_119
- ↑ Bureekaew, S.; Shimomura, S.; Kitagawa, S. (2008). "लचीला झरझरा समन्वय पॉलिमर का रसायन विज्ञान और अनुप्रयोग". Science and Technology of Advanced Materials. 9 (1): 014108. Bibcode:2008STAdM...9a4108B. doi:10.1088/1468-6996/9/1/014108. PMC 5099803. PMID 27877934.
- ↑ 22.0 22.1 22.2 22.3 Batten, Stuart R. (2008). समन्वय पॉलिमर: डिजाइन, विश्लेषण और अनुप्रयोग. RSC Publishing. pp. 297–307, 396–407. doi:10.1039/9781847558862. ISBN 978-0-85404-837-3.