आण्विक कक्षक: Difference between revisions
mNo edit summary |
mNo edit summary |
||
| Line 30: | Line 30: | ||
:<math>\Psi^* = c_a \psi_a - c_b \psi_b</math> | :<math>\Psi^* = c_a \psi_a - c_b \psi_b</math> | ||
जहां <math>\Psi</math> तथा <math>\Psi^*</math> आबंधन और प्रतिआबंधन आण्विक कक्षकों के लिए आण्विक तरंग फलन हैं, क्रमशः, <math>\psi_a</math> तथा <math>\psi_b</math> क्रमशः aऔर b परमाणुओं से परमाणु तरंग हैं, और <math>c_a</math> तथा <math>c_b</math> समायोज्य गुणांक हैं। व्यक्तिगत परमाणु कक्षकों की ऊर्जा और समरूपता के आधार पर, ये गुणांक सकारात्मक या नकारात्मक हो सकते हैं। जैसे-जैसे दो परमाणु एक-दूसरे के करीब आते हैं, उनके परमाणु कक्षक उच्च इलेक्ट्रॉन घनत्व वाले क्षेत्रों का उत्पादन करने के लिए अतिव्याप्त होते हैं, और इसके परिणामस्वरूप, दो परमाणुओं के बीच आणविक कक्षक बनते हैं। परमाणुओं को सकारात्मक रूप से आवेशित नाभिक और बंधन आणविक कक्षाओं में रहने वाले नकारात्मक रूप से आवेशित इलेक्ट्रॉनों के बीच स्थिर वैद्युत विक्षेप आकर्षण द्वारा एक साथ रखा जाता है। | जहां <math>\Psi</math> तथा <math>\Psi^*</math> आबंधन और प्रतिआबंधन आण्विक कक्षकों के लिए आण्विक तरंग फलन हैं, क्रमशः, <math>\psi_a</math> तथा <math>\psi_b</math> क्रमशः aऔर b परमाणुओं से परमाणु तरंग हैं, और <math>c_a</math> तथा <math>c_b</math> समायोज्य गुणांक हैं। व्यक्तिगत परमाणु कक्षकों की ऊर्जा और समरूपता के आधार पर, ये गुणांक सकारात्मक या नकारात्मक हो सकते हैं। जैसे-जैसे दो परमाणु एक-दूसरे के करीब आते हैं, उनके परमाणु कक्षक उच्च इलेक्ट्रॉन घनत्व वाले क्षेत्रों का उत्पादन करने के लिए अतिव्याप्त होते हैं, और इसके परिणामस्वरूप, दो परमाणुओं के बीच आणविक कक्षक बनते हैं। परमाणुओं को सकारात्मक रूप से आवेशित नाभिक और बंधन आणविक कक्षाओं में रहने वाले नकारात्मक रूप से आवेशित इलेक्ट्रॉनों के बीच स्थिर वैद्युत विक्षेप आकर्षण द्वारा एक साथ रखा जाता है। | ||
=== बंधन , | === बंधन , प्रतिआबंधन,और अनाबंधी एम ओ- === | ||
जब परमाणु | जब परमाणु कक्षक परस्पर क्रिया करते हैं, तो परिणामी आणविक कक्षक तीन प्रकार के हो सकते हैं बंधन , प्रतिआबंधन,और अनाबंधी। । | ||
बंधन आणविक कक्षाएँ: | बंधन आणविक कक्षाएँ: | ||
* परमाणु | * परमाणु कक्षक के बीच बंधन अंतःक्रिया, रचनात्मक अंतःक्रिया हैं। | ||
* | * बंधन एम ओ उन परमाणु कक्षकों की तुलना में ऊर्जा में कम होते हैं जो उन्हें उत्पन्न करने के लिए गठबंधन करते हैं। | ||
प्रतिआबंधन आणविक कक्षक; | |||
* परमाणु | * परमाणु कक्षक के बीच प्रतिआबंधन अंतःक्रिया विनाशकारी (आउट-ऑफ-फेज) अंतःक्रिया हैं, एक [[नोड (भौतिकी)]] के साथ जहां दो अन्योन्यकारी परमाणुओं के बीच प्रतिआबंधन कक्षकों की तरंग क्रिया शून्य है। | ||
* एंटीबॉडी एमओ उन परमाणु ऑर्बिटल्स की तुलना में ऊर्जा में अधिक हैं जो उन्हें उत्पन्न करने के लिए गठबंधन करते हैं। | * एंटीबॉडी एमओ उन परमाणु ऑर्बिटल्स की तुलना में ऊर्जा में अधिक हैं जो उन्हें उत्पन्न करने के लिए गठबंधन करते हैं। | ||
गैर-बंधन कक्षक: | गैर-बंधन कक्षक: | ||
Revision as of 11:41, 4 January 2023
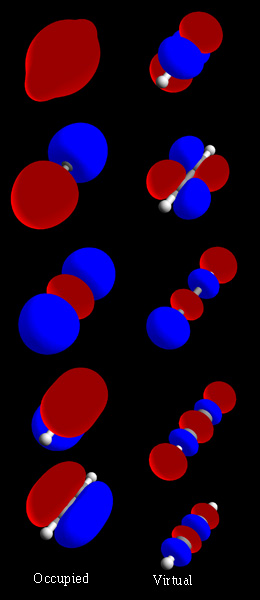
रसायन विज्ञान में, एक आणविक कक्षीय एक गणितीय कार्य है जो एक अणु में एक इलेक्ट्रॉन के स्थान और तरंग-समान व्यवहार का वर्णन करता है। इस फलन का उपयोग रासायनिक और भौतिक गुणों की गणना करने के लिए किया जा सकता है, जैसे कि किसी विशिष्ट क्षेत्र में इलेक्ट्रॉन के पाए जाने की संभावना।परमाणु कक्षीय और आणविक कक्षीय शब्द 1932 में रॉबर्ट एस मुल्लिकेन द्वारा एक-इलेक्ट्रॉन कक्षीय तरंग कार्यों का मतलब समझाने के लिए पेश किए गए थे।प्रारंभिक स्तर पर, इनका उपयोग अंतरिक्ष के उस क्षेत्र का वर्णन करने के लिए किया जाता है जिसमें फलन का एक महत्वपूर्ण आयाम होता है।
एक एकल परमाणु में, कक्षीय इलेक्ट्रॉनों का स्थान परमाणु कक्षाओं द्वारा निर्धारित किया जाता है। जब कई परमाणु रासायनिक रूप से एक अणु में संयोजित होते हैं, तो इलेक्ट्रॉनों के स्थान अणु द्वारा पूर्ण रूप से निर्धारित किए जाते हैं, इसलिए परमाणु कक्षाएँ आणविक कक्षाएँ बनाने के लिए संयोजित होती हैं। घटक परमाणुओं से इलेक्ट्रॉन आणविक कक्षाओं में प्रवेश करते हैं। गणितीय रूप से, आणविक कक्षाएँ अणु के परमाणु नाभिक के क्षेत्र में इलेक्ट्रॉनों के लिए श्रोडिंगर समीकरण का एक अनुमानित समाधान हैं। अणु के प्रत्येक परमाणु से परमाणु कक्षीय या संकर कक्षीय के रैखिक संयोजन या परमाणुओं के समूहों से अन्य आणविक कक्षाओं के संयोजन से निर्मित होते हैं।हार्ट्री-फॉक या स्व-सुसंगत क्षेत्र (एस सी एफ) विधियों का उपयोग करके उनकी मात्रात्मक गणना की जा सकती है।
आण्विक कक्षक तीन प्रकार के होते हैं: आबंधी आण्विक कक्षक जिनकी ऊर्जा उन परमाणु कक्षकों की ऊर्जा से कम होती है जो उन्हें बनाते हैं और इस प्रकार उन रासायनिक बंधों को बढ़ावा देते हैं जो अणु को एक साथ बांधे रखते हैं। प्रति-आबंधी आणविक कक्षक जिनकी ऊर्जा उनके घटक परमाणु कक्षकों की ऊर्जा से अधिक होती है, और इसलिए ये अणु के बंधन का विरोध करते हैं, और गैर-बंधन वाले कक्षकों में उनके घटक परमाणु कक्षकों के समान ऊर्जा होती है और इस प्रकार बंधन पर कोई प्रभाव नहीं पड़ता है।
अवलोकन-
एक अणु में उन क्षेत्रों का प्रतिनिधित्व करने के लिए एक आणविक कक्षीय(एम् ओ )का उपयोग किया जा सकता है जहां उस कक्षीय पर कब्जा करने वाला एक इलेक्ट्रॉन पाए जाने की संभावना है। आणविक कक्षाएँ अणु के परमाणु नाभिक के विद्युत क्षेत्र में इलेक्ट्रॉनों के लिए श्रोडिंगर समीकरण के अनुमानित समाधान हैं। यद्यपि इस समीकरण से सीधे कक्षाओं की गणना करना बहुत ही कठिन समस्या है। इसके बदले वे परमाणु कक्षकों के संयोजन से प्राप्त होते हैं, जो एक परमाणु में एक ऋणावेशित सूक्ष्म अणु के विन्यास के स्थान की भविष्यवाणी करते हैं। एक आणविक कक्षीय एक अणु के इलेक्ट्रॉन विन्यास को उल्लिखत कर सकता है: स्थानिक वितरण और एक (या एक जोड़ी) इलेक्ट्रॉन की ऊर्जा। पर एक एमओ को विशेष रूप से गुणात्मक या बहुत अनुमानित उपयोग में परमाणु ऑर्बिटल्स आणविक कक्षीय विधि (एलसीएओ-एमओ विधि) के रैखिक संयोजन के रूप में दर्शाया जाता है। वे आणविक कक्षीय सिद्धांत के माध्यम से समझे जाने वाले अणुओं में बंधन का एक सरल मॉडल प्रदान करने में अमूल्य हैं। कम्प्यूटेशनल रसायन शास्त्र में अधिकांश वर्तमान-दिन के तरीके सिस्टम के एमओ की गणना से शुरू होते हैं। एक आणविक कक्षीय नाभिक द्वारा उत्पन्न विद्युत क्षेत्र में एक इलेक्ट्रॉन के व्यवहार और अन्य इलेक्ट्रॉनों के कुछ औसत वितरण का वर्णन करता है। एक ही कक्षा में दो इलेक्ट्रॉनों के मामले में, पाउली सिद्धांत की मांग है कि उनके पास विपरीत स्पिन हो। अनिवार्य रूप से यह एक सन्निकटन है, और आणविक इलेक्ट्रॉनिक तरंग फ़ंक्शन के अत्यधिक सटीक विवरण में ऑर्बिटल्स नहीं हैं (कॉन्फ़िगरेशन इंटरैक्शन देखें)।
आण्विक कक्षक सामान्य रूप से पूरे अणु में विस्थानीकृत होते हैं। इसके अलावा, यदि अणु में समरूपता तत्व हैं, तो इसके गैर-अपघटित आणविक कक्षक इनमें से किसी भी समरूपता के संबंध में या तो सममित या विषम हैं। दूसरे शब्दों में, आणविक कक्षीय ψ पर सममिति संक्रिया S (उदाहरण के लिए, एक प्रतिबिंब, घूर्णन, या व्युत्क्रमण) के प्रयोग से आणविक कक्षीय अपरिवर्तित रहता है या इसके गणितीय चिह्न को उलट देता है: Sψ = ±ψ। तलीय अणुओं में, उदाहरण के लिए, आण्विक तल में परावर्तन के संबंध में आण्विक कक्षक या तो सममित (सिग्मा बंधन) या प्रतिसममित (पी आबंध) होते हैं। यदि पतित कक्षीय ऊर्जा वाले अणुओं पर भी विचार किया जाता है, तो एक अधिक सामान्य कथन है कि अणु के समरूपता समूह के अलघुकरणीय निरूपण के लिए आणविक कक्षाएँ आधार बनाती हैं।[1] आणविक ऑर्बिटल्स के समरूपता गुणों का अर्थ है कि निरूपण आणविक कक्षीय सिद्धांत की एक अंतर्निहित विशेषता है और इसे मूल रूप से (और पूरक) वैलेंस बॉन्ड सिद्धांत से अलग बनाता है, जिसमें अनुनाद (रसायन विज्ञान) के लिए भत्ता के साथ बांड को स्थानीयकृत इलेक्ट्रॉन जोड़े के रूप में देखा जाता है। निरूपण के लिए खाता।
इन समरूपता-अनुकूलित कैनोनिकल आणविक ऑर्बिटल्स के विपरीत, स्थानीयकृत आणविक ऑर्बिटल्स को कैनोनिकल ऑर्बिटल्स में कुछ गणितीय परिवर्तनों को लागू करके बनाया जा सकता है। इस दृष्टिकोण का लाभ यह है कि ऑर्बिटल्स एक अणु के बंधनों के अधिक निकटता से मेल खाते हैं जैसा कि लुईस संरचना द्वारा दर्शाया गया है। नुकसान के रूप में, इन स्थानीय ऑर्बिटल्स के ऊर्जा स्तरों का अब भौतिक अर्थ नहीं रह गया है। (इस लेख के बाकी हिस्सों में चर्चा विहित आणविक कक्षाओं पर केंद्रित होगी। स्थानीयकृत आणविक कक्षाओं पर आगे की चर्चा के लिए, देखें: प्राकृतिक बंधन कक्षीय और सिग्मा-पी और समकक्ष-कक्षीय मॉडल।)
आणविक कक्षकों का निर्माण-
आणविक कक्षक परमाणु कक्षक के बीच अनुमत अंतःक्रियाओं से उत्पन्न होते हैं, जिनकी अनुमति दी जाती है यदि परमाणु कक्षकों की समरूपता (समूह सिद्धांत से निर्धारित) एक दूसरे के साथ संगत हैं। परमाणु कक्षीय अन्योन्यक्रियाओं की दक्षता दो परमाणु कक्षकों के बीच कक्षीय अधिव्यापन (इस बात का माप है कि दो कक्षक एक दूसरे के साथ रचनात्मक रूप से कितनी अच्छी तरह परस्पर क्रिया करते हैं) से निर्धारित होती है, जो कि महत्वपूर्ण है यदि परमाणु कक्षक ऊर्जा के करीब हों। अंत में बनने वाले आणविक कक्षकों की संख्या अणु बनाने के लिए संयुक्त किए जा रहे परमाणुओं में परमाणु कक्षकों की संख्या के बराबर होनी चाहिए।
गुणात्मक चर्चा-
एक सटीक, लेकिन गुणात्मक रूप से उपयोगी, आणविक संरचना की चर्चा के लिए, आणविक कक्षक से परमाणु कक्षक आणविक कक्षीय विधि के रैखिक संयोजन से प्राप्त किया जा सकता है। यहाँ, आणविक कक्षक को परमाणु कक्षक के रैखिक संयोजन के रूप में व्यक्त किया जाता है।[2]
परमाणु कक्षकों का रैखिक संयोजन (एल सी ए ओ)-
1927 और 1928 में फ्रेडरिक हंड और रॉबर्ट एस मुल्लिकेन द्वारा पहली बार आणविक कक्षाओं की शुरुआत की गई थी।[3][4] आणविक कक्षकों के लिए परमाणु कक्षकों(एल सी ए ओ) या समीपता का रैखिक संयोजन 1929 में सर जॉन लेनार्ड-जोन्स द्वारा प्रस्तुत किया गया था।[5] उनके क्रांतिकारी पेपर ने दिखाया कि परिमाण सिद्धांतों से एक अधातु तत्त्व और ऑक्सीजन अणुओं की इलेक्ट्रॉनिक संरचना कैसे प्राप्त की जाए। आणविक कक्षीय सिद्धांत के लिए यह गुणात्मक दृष्टिकोण आधुनिक परिमाण रसायन विज्ञान की शुरुआत का हिस्सा है।परमाणु कक्षकों के रैखिक संयोजन (एल सी ए ओ)का उपयोग आणविक कक्षकों का अनुमान लगाने के लिए किया जा सकता है जो अणु के घटक परमाणुओं के बीच संबंध बनाने पर बनते हैं। एक परमाणु कक्षीय के समान एक श्रोडिंगर समीकरण जो एक इलेक्ट्रॉन के व्यवहार का वर्णन करता है एक आणविक कक्षीय के लिए भी बनाया जा सकता है। परमाणु कक्षकों के रैखिक संयोजन, या परमाणु तरंग क्रिया के योग और अंतर, हार्ट्री-फॉक विधि का अनुमानित समाधान प्रदान करते हैं। हार्ट्री-फॉक समीकरण जो आणविक श्रोडिंगर समीकरण के स्वतंत्र-कण समीपता के अनुरूप हैं। सरल द्विपरमाणुक अणुओं के लिए, प्राप्त तरंगों को समीकरणों द्वारा गणितीय रूप से दर्शाया जाता है-
जहां तथा आबंधन और प्रतिआबंधन आण्विक कक्षकों के लिए आण्विक तरंग फलन हैं, क्रमशः, तथा क्रमशः aऔर b परमाणुओं से परमाणु तरंग हैं, और तथा समायोज्य गुणांक हैं। व्यक्तिगत परमाणु कक्षकों की ऊर्जा और समरूपता के आधार पर, ये गुणांक सकारात्मक या नकारात्मक हो सकते हैं। जैसे-जैसे दो परमाणु एक-दूसरे के करीब आते हैं, उनके परमाणु कक्षक उच्च इलेक्ट्रॉन घनत्व वाले क्षेत्रों का उत्पादन करने के लिए अतिव्याप्त होते हैं, और इसके परिणामस्वरूप, दो परमाणुओं के बीच आणविक कक्षक बनते हैं। परमाणुओं को सकारात्मक रूप से आवेशित नाभिक और बंधन आणविक कक्षाओं में रहने वाले नकारात्मक रूप से आवेशित इलेक्ट्रॉनों के बीच स्थिर वैद्युत विक्षेप आकर्षण द्वारा एक साथ रखा जाता है।
बंधन , प्रतिआबंधन,और अनाबंधी एम ओ-
जब परमाणु कक्षक परस्पर क्रिया करते हैं, तो परिणामी आणविक कक्षक तीन प्रकार के हो सकते हैं बंधन , प्रतिआबंधन,और अनाबंधी। ।
बंधन आणविक कक्षाएँ:
- परमाणु कक्षक के बीच बंधन अंतःक्रिया, रचनात्मक अंतःक्रिया हैं।
- बंधन एम ओ उन परमाणु कक्षकों की तुलना में ऊर्जा में कम होते हैं जो उन्हें उत्पन्न करने के लिए गठबंधन करते हैं।
प्रतिआबंधन आणविक कक्षक;
- परमाणु कक्षक के बीच प्रतिआबंधन अंतःक्रिया विनाशकारी (आउट-ऑफ-फेज) अंतःक्रिया हैं, एक नोड (भौतिकी) के साथ जहां दो अन्योन्यकारी परमाणुओं के बीच प्रतिआबंधन कक्षकों की तरंग क्रिया शून्य है।
- एंटीबॉडी एमओ उन परमाणु ऑर्बिटल्स की तुलना में ऊर्जा में अधिक हैं जो उन्हें उत्पन्न करने के लिए गठबंधन करते हैं।
गैर-बंधन कक्षक:
- नॉनबॉन्डिंग एमओ संगत समरूपता की कमी के कारण परमाणु ऑर्बिटल्स के बीच कोई संपर्क नहीं होने का परिणाम है।
- नॉनबॉन्डिंग एमओ में अणु में किसी एक परमाणु के परमाणु ऑर्बिटल्स के समान ऊर्जा होगी।
=== एमओ === के लिए सिग्मा और पीआई लेबल परमाणु ऑर्बिटल्स के बीच परस्पर क्रिया के प्रकार को आणविक-कक्षीय समरूपता लेबल σ (सिग्मा), π (pi), δ (डेल्टा), φ (phi), γ (गामा) आदि द्वारा वर्गीकृत किया जा सकता है। ये यूनानी अक्षर हैं जो संबंधित हैं क्रमशः परमाणु कक्षकों s, p, d, f और g के लिए। संबंधित परमाणुओं के बीच आंतरिक अक्ष वाले नोडल विमानों की संख्या σ MOs के लिए शून्य, π के लिए एक, δ के लिए दो, φ के लिए तीन और γ के लिए चार है।
σ समरूपता
σ सममिति वाला एक MO या तो दो परमाणु s-ऑर्बिटल्स या दो परमाणु p की अन्योन्य क्रिया का परिणाम होता हैz-ऑर्बिटल्स। एक एमओ में σ-समरूपता होगी यदि कक्षीय दो परमाणु केंद्रों, आंतरिक परमाणु अक्ष को जोड़ने वाली धुरी के संबंध में सममित है। इसका मतलब यह है कि आंतरिक परमाणु अक्ष के बारे में एमओ के घूमने से चरण परिवर्तन नहीं होता है। एक σ* ऑर्बिटल, सिग्मा एंटीबॉन्डिंग ऑर्बिटल, आंतरिक परमाणु अक्ष के बारे में घुमाए जाने पर भी उसी चरण को बनाए रखता है। σ* कक्षीय में एक नोडल तल होता है जो नाभिक और आंतरिक नाभिकीय अक्ष के लंबवत के बीच होता है।[6]
π समरूपता
π समरूपता वाला एक MO या तो दो परमाणु p की परस्पर क्रिया का परिणाम हैx ऑर्बिटल्स या पीy ऑर्बिटल्स। एक एमओ में π समरूपता होगी यदि कक्षीय आंतरिक अक्ष के बारे में रोटेशन के संबंध में असममित है। इसका मतलब यह है कि आंतरिक परमाणु अक्ष के बारे में एमओ के घूमने से चरण परिवर्तन होगा। यदि परमाणु कक्षीय # वास्तविक कक्षकों पर विचार किया जाता है, तो एक नोडल तल होता है जिसमें आंतरिक अक्ष होता है।
एक π* ऑर्बिटल, पीआई एंटीबॉन्डिंग ऑर्बिटल भी आंतरिक परमाणु अक्ष के बारे में घुमाए जाने पर एक चरण परिवर्तन उत्पन्न करेगा। π* कक्षीय में नाभिकों के बीच एक दूसरा नोडल तल भी होता है।[6][7][8][9]
δ समरूपता ==
δ समरूपता वाला एक MO दो परमाणु d की परस्पर क्रिया से उत्पन्न होता हैxy या डीx2-y2 ऑर्बिटल्स। क्योंकि इन आणविक कक्षकों में निम्न-ऊर्जा d परमाणु कक्षक शामिल होते हैं, वे संक्रमण धातु|संक्रमण-धातु परिसरों में देखे जाते हैं। एक δ बॉन्डिंग ऑर्बिटल में इंटरन्यूक्लियर एक्सिस वाले दो नोडल प्लेन होते हैं, और एक δ* एंटीबॉन्डिंग ऑर्बिटल में न्यूक्लियर के बीच तीसरा नोडल प्लेन भी होता है।
φ समरूपता ==
सैद्धांतिक रसायनज्ञों ने अनुमान लगाया है कि उच्च-क्रम के बंधन, जैसे कि एफ परमाणु ऑर्बिटल्स के ओवरलैप के अनुरूप फाई बांड, संभव हैं। एक अणु का कोई ज्ञात उदाहरण नहीं है जिसमें कथित तौर पर फाई बांड शामिल हो।
गेरेड और अनगिरेड समरूपता
उन अणुओं के लिए जिनमें व्युत्क्रम (सेंट्रोसममिति) का केंद्र होता है, समरूपता के अतिरिक्त लेबल होते हैं जिन्हें आणविक ऑर्बिटल्स पर लागू किया जा सकता है। सेंट्रोसिमेट्रिक अणुओं में शामिल हैं:
- होमोन्यूक्लियर अणु डायटोमिक्स, एक्स2
- ऑक्टाहेड्रल आणविक ज्यामिति, पूर्व6
- स्क्वायर प्लानर आण्विक ज्यामिति, पूर्व4.
गैर-सेंट्रोसिमेट्रिक अणुओं में शामिल हैं:
- हेटेरोन्यूक्लियर अणु डायटोमिक्स, XY
- टेट्राहेड्रल आणविक ज्यामिति, पूर्व4.
यदि अणु में समरूपता के केंद्र के माध्यम से व्युत्क्रम आणविक कक्षीय के लिए समान चरणों में परिणाम देता है, तो एमओ को जर्मन शब्द सम के लिए गेरेड (जी) समरूपता कहा जाता है। यदि अणु में समरूपता के केंद्र के माध्यम से व्युत्क्रमण के परिणामस्वरूप आणविक कक्षीय के लिए एक चरण परिवर्तन होता है, तो एमओ को विषम के लिए जर्मन शब्द से अनगेरेड (यू) समरूपता कहा जाता है। σ-समरूपता वाले आबंधन MO के लिए कक्षीय σ हैg (s' + s सममित है), जबकि σ-समरूपता के साथ एक प्रति-बंधन MO कक्षीय σ हैu, क्योंकि s' – का व्युत्क्रम विषम है। π-समरूपता वाले बंधन MO के लिए कक्षीय π हैu क्योंकि समरूपता के केंद्र के माध्यम से व्युत्क्रम एक संकेत परिवर्तन उत्पन्न करेगा (दो पी परमाणु कक्षाएँ एक दूसरे के साथ चरण में हैं, लेकिन दो पालियों में विपरीत संकेत हैं), जबकि π-समरूपता के साथ एक प्रतिरक्षी MO π हैg क्योंकि समरूपता के केंद्र के माध्यम से व्युत्क्रम एक संकेत परिवर्तन का उत्पादन नहीं करेगा (दो पी ऑर्बिटल्स चरण द्वारा एंटीसिमेट्रिक हैं)।[6]
एमओ आरेख
एमओ विश्लेषण का गुणात्मक दृष्टिकोण एक अणु में बंधन की बातचीत को देखने के लिए एक आणविक कक्षीय आरेख का उपयोग करता है। इस प्रकार के आरेख में, आणविक कक्षकों को क्षैतिज रेखाओं द्वारा दर्शाया जाता है; एक रेखा जितनी ऊँची होती है, कक्षीय की ऊर्जा उतनी ही अधिक होती है, और पतित कक्षकों को उनके बीच एक स्थान के साथ समान स्तर पर रखा जाता है। फिर, आणविक कक्षा में रखे जाने वाले इलेक्ट्रॉनों को पाउली अपवर्जन सिद्धांत और हंड के अधिकतम बहुलता के नियम को ध्यान में रखते हुए एक-एक करके स्लॉट किया जाता है (केवल 2 इलेक्ट्रॉन, विपरीत स्पिन वाले, प्रति कक्षीय; एक पर कई अयुग्मित इलेक्ट्रॉनों को रखें। उन्हें पेयर करना शुरू करने से पहले ऊर्जा स्तर जितना संभव हो)। अधिक जटिल अणुओं के लिए, तरंग यांत्रिकी दृष्टिकोण संबंध की गुणात्मक समझ में उपयोगिता खो देता है (हालांकि मात्रात्मक दृष्टिकोण के लिए अभी भी आवश्यक है)। कुछ गुण:
- ऑर्बिटल्स के एक आधार सेट में वे परमाणु ऑर्बिटल्स शामिल होते हैं जो आणविक ऑर्बिटल इंटरैक्शन के लिए उपलब्ध होते हैं, जो बॉन्डिंग या एंटीबॉन्डिंग हो सकते हैं
- आणविक कक्षकों की संख्या रैखिक विस्तार या आधार सेट में शामिल परमाणु कक्षकों की संख्या के बराबर है
- यदि अणु में कुछ समरूपता है, तो पतित परमाणु ऑर्बिटल्स (समान परमाणु ऊर्जा के साथ) को रैखिक संयोजनों (सममिति-अनुकूलित परमाणु ऑर्बिटल्स (SO) कहा जाता है) में समूहीकृत किया जाता है, जो समरूपता समूह के परिमित समूहों के प्रतिनिधित्व सिद्धांत से संबंधित हैं, इसलिए समूह का वर्णन करने वाले तरंग कार्यों को समरूपता-अनुकूलित रैखिक संयोजन (एसएएलसी) के रूप में जाना जाता है।
- एक समूह निरूपण से संबंधित आणविक कक्षकों की संख्या इस निरूपण से संबंधित सममिति-अनुकूलित परमाणु कक्षकों की संख्या के बराबर है
- परिमित समूहों के एक विशेष प्रतिनिधित्व सिद्धांत के भीतर, समरूपता-अनुकूलित परमाणु ऑर्बिटल्स अधिक मिश्रण करते हैं यदि उनके परमाणु ऊर्जा स्तर करीब हैं।
यथोचित सरल अणु के लिए आणविक कक्षीय आरेख के निर्माण की सामान्य प्रक्रिया को निम्नानुसार संक्षेपित किया जा सकता है:
1. अणु को एक बिंदु समूह निर्दिष्ट करें।
2. SALCs के आकार को देखें।
3. ऊर्जा के बढ़ते क्रम में प्रत्येक आणविक खंड के SALCs को व्यवस्थित करें, पहले ध्यान दें कि क्या वे s, p, या d ऑर्बिटल्स से उत्पन्न होते हैं (और उन्हें s <'p <'d क्रम में रखें), और फिर उनकी आंतरिक परमाणु नोड्स की संख्या।
4. दो टुकड़ों से समान समरूपता प्रकार के SALCs को मिलाएं, और N SALCs से N आणविक कक्षाएँ बनाते हैं।
5. मूल कक्षकों के अतिव्यापन और सापेक्ष ऊर्जाओं के आधार पर आणविक कक्षकों की सापेक्ष ऊर्जाओं का अनुमान लगाएं, और आणविक कक्षीय ऊर्जा स्तर आरेख (कक्षकों की उत्पत्ति दिखाते हुए) पर स्तर बनाएं।
6. व्यावसायिक सॉफ़्टवेयर का उपयोग करके आणविक कक्षीय गणना करके इस गुणात्मक क्रम की पुष्टि, सही और संशोधित करें।[10]
आण्विक कक्षकों में आबंधन
कक्षीय अध: पतन
आण्विक कक्षकों को पतित कहा जाता है यदि उनमें समान ऊर्जा हो। उदाहरण के लिए, पहले दस तत्वों के समनाभिकीय द्विपरमाणुक अणुओं में, आण्विक कक्षकों की व्युत्पत्ति px और पीy परमाणु ऑर्बिटल्स के परिणामस्वरूप दो पतित बंधन ऑर्बिटल्स (कम ऊर्जा वाले) और दो पतित एंटीबॉन्डिंग ऑर्बिटल्स (उच्च ऊर्जा वाले) होते हैं।[11]
आयनिक बंधन
जब दो परमाणुओं के परमाणु ऑर्बिटल्स के बीच ऊर्जा अंतर काफी बड़ा होता है, तो एक परमाणु के ऑर्बिटल्स लगभग पूरी तरह से बॉन्डिंग ऑर्बिटल्स में योगदान करते हैं, और दूसरे परमाणु के ऑर्बिटल्स लगभग पूरी तरह से एंटीबॉन्डिंग ऑर्बिटल्स में योगदान करते हैं। इस प्रकार, स्थिति प्रभावी रूप से यह है कि एक परमाणु से दूसरे परमाणु में एक या एक से अधिक इलेक्ट्रॉन स्थानांतरित हो गए हैं। इसे (ज्यादातर) आयोनिक बंध कहा जाता है।[citation needed]
बंधन आदेश
बंधन क्रम, या बांड की संख्या, एक अणु के बंधन और एंटीबॉडी आणविक कक्षाओं में इलेक्ट्रॉनों की संख्या को जोड़कर निर्धारित किया जा सकता है। बॉन्डिंग ऑर्बिटल में इलेक्ट्रॉनों की एक जोड़ी एक बॉन्ड बनाती है, जबकि एक एंटीबॉन्डिंग ऑर्बिटल में इलेक्ट्रॉनों की एक जोड़ी एक बॉन्ड को नकारती है। उदाहरण के लिए, एन2, बॉन्डिंग ऑर्बिटल्स में आठ इलेक्ट्रॉनों और एंटीबॉन्डिंग ऑर्बिटल्स में दो इलेक्ट्रॉनों के साथ, तीन का बॉन्ड ऑर्डर होता है, जो ट्रिपल बॉन्ड का गठन करता है।
रिश्ते की ताक़त बॉन्ड ऑर्डर के समानुपाती होती है- बॉन्डिंग की अधिक मात्रा अधिक स्थिर बॉन्ड बनाती है- और बॉन्ड की लंबाई इसके व्युत्क्रमानुपाती होती है- एक मजबूत बॉन्ड छोटा होता है।
धनात्मक बंधन क्रम वाले अणु की आवश्यकता के लिए दुर्लभ अपवाद हैं। हालांकि रहो2 एमओ विश्लेषण के अनुसार 0 का बॉन्ड ऑर्डर है, अत्यधिक अस्थिर बी का प्रायोगिक साक्ष्य है2 अणु जिसकी बंधन लंबाई 245 pm और बंध ऊर्जा 10 kJ/mol है।[6][12]
होमो और लुमो
उच्चतम अधिकृत आणविक कक्षीय और निम्नतम खाली आणविक कक्षीय को अक्सर क्रमशः HOMO और LUMO के रूप में संदर्भित किया जाता है। HOMO और LUMO की ऊर्जाओं के अंतर को HOMO-LUMO गैप कहा जाता है। यह धारणा अक्सर साहित्य में भ्रम का विषय होती है और इस पर सावधानी से विचार किया जाना चाहिए। इसका मान आम तौर पर मौलिक अंतर (आयनीकरण क्षमता और इलेक्ट्रॉन संबंध के बीच अंतर) और ऑप्टिकल अंतर के बीच स्थित होता है। इसके अलावा, HOMO-LUMO गैप बल्क मटेरियल ऊर्जा अंतराल या ट्रांसपोर्ट गैप से संबंधित हो सकता है, जो आमतौर पर फंडामेंटल गैप से बहुत छोटा होता है।[citation needed]
उदाहरण
समनाभिकीय डायटोमिक्स
होमोन्यूक्लियर डायटोमिक एमओ में आधार सेट में प्रत्येक परमाणु कक्षीय से समान योगदान होता है। यह एच के लिए होमोन्यूक्लियर डायटोमिक एमओ आरेखों में दिखाया गया है2, वह2, और ली2, जिनमें से सभी में सममित कक्षाएँ हैं।[6]
एच2

एक सरल एमओ उदाहरण के रूप में, हाइड्रोजन अणु, एच में इलेक्ट्रॉनों पर विचार करें2 (एमओ आरेख # डायटोमिक एमओ आरेख देखें), दो परमाणुओं के साथ एच 'और एच लेबल किया गया। निम्नतम-ऊर्जा परमाणु कक्षक, 1s' और 1s, अणु की सममिति के अनुसार परिवर्तित नहीं होते हैं। हालाँकि, निम्नलिखित समरूपता अनुकूलित परमाणु ऑर्बिटल्स करते हैं:
| 1s' – 1s" | Antisymmetric combination: negated by reflection, unchanged by other operations |
|---|---|
| 1s' + 1s" | Symmetric combination: unchanged by all symmetry operations |
सममित संयोजन (आबंधी कक्षक कहलाता है) आधार कक्षकों की तुलना में ऊर्जा में कम होता है, और प्रतिसममित संयोजन (प्रतिबंध कक्षक कहा जाता है) अधिक होता है। क्योंकि एच2 अणु में दो इलेक्ट्रॉन होते हैं, वे दोनों बॉन्डिंग ऑर्बिटल में जा सकते हैं, जिससे सिस्टम दो मुक्त हाइड्रोजन परमाणुओं की तुलना में ऊर्जा में कम (इसलिए अधिक स्थिर) हो जाता है। इसे सहसंयोजक बंधन कहा जाता है। बॉन्ड ऑर्डर बॉन्डिंग इलेक्ट्रॉनों की संख्या माइनस एंटीबॉन्डिंग इलेक्ट्रॉनों की संख्या के बराबर है, जो 2 से विभाजित है। इस उदाहरण में, बॉन्डिंग ऑर्बिटल में 2 इलेक्ट्रॉन हैं और एंटीबॉन्डिंग ऑर्बिटल में कोई नहीं है; बंधन क्रम 1 है, और दो हाइड्रोजन परमाणुओं के बीच एक ही बंधन है।[citation needed]
वह2
दूसरी ओर, हे के काल्पनिक अणु पर विचार करें2 He' और He लेबल वाले परमाणुओं के साथ। जैसा कि एच2, सबसे कम ऊर्जा वाले परमाणु ऑर्बिटल्स 1s' और 1s हैं, और अणु की समरूपता के अनुसार परिवर्तित नहीं होते हैं, जबकि सममिति अनुकूलित परमाणु ऑर्बिटल्स करते हैं। सममित संयोजन-बॉन्डिंग ऑर्बिटल-आधार ऑर्बिटल्स की तुलना में ऊर्जा में कम है, और एंटीसिमेट्रिक संयोजन-एंटीबॉन्डिंग ऑर्बिटल-उच्च है। एच के विपरीत2, दो संयोजी इलेक्ट्रॉनों के साथ, He2 इसकी तटस्थ जमीनी अवस्था में चार हैं। दो इलेक्ट्रॉन निम्न-ऊर्जा बंधन कक्षीय, σ भरते हैंg(1s), जबकि शेष दो उच्च-ऊर्जा प्रति-बंधन कक्षक, σ भरते हैंu*(1s). इस प्रकार, अणु के चारों ओर परिणामी इलेक्ट्रॉन घनत्व दो परमाणुओं के बीच बंधन के गठन का समर्थन नहीं करता है; परमाणुओं को एक साथ रखने वाले स्थिर बंधन के बिना, अणु के अस्तित्व की उम्मीद नहीं की जाएगी। इसे देखने का एक अन्य तरीका यह है कि दो बंधन इलेक्ट्रॉन और दो प्रतिरक्षी इलेक्ट्रॉन हैं; इसलिए, बंधन क्रम 0 है और कोई बंधन मौजूद नहीं है (अणु में वान डेर वाल्स क्षमता द्वारा समर्थित एक बाध्य अवस्था है)।[citation needed]
वह2
डिलिथियम ली2 दो ली परमाणुओं के 1s और 2s परमाणु कक्षकों (आधार सेट) के ओवरलैप से बनता है। प्रत्येक ली परमाणु संबंध संबंधों के लिए तीन इलेक्ट्रॉनों का योगदान देता है, और छह इलेक्ट्रॉन निम्नतम ऊर्जा के तीन एमओ को भरते हैं, σg(1 एस), पीu*(1s), और पृg(2स). बॉन्ड ऑर्डर के समीकरण का उपयोग करते हुए, यह पाया जाता है कि डाइलिथियम में एक, एक बॉन्ड का बॉन्ड ऑर्डर होता है।[citation needed]
नोबल गैसें
He के एक काल्पनिक अणु को ध्यान में रखते हुए2, चूंकि परमाणु ऑर्बिटल्स का आधार सेट एच के मामले में समान है2, हम पाते हैं कि आबंधन और प्रतिआबंधी दोनों कक्षक भरे हुए हैं, इसलिए युग्म को कोई ऊर्जा लाभ नहीं है। HeH को थोड़ा ऊर्जा लाभ होगा, लेकिन H जितना नहीं2 + 2 वह, इसलिए अणु बहुत अस्थिर है और हाइड्रोजन और हीलियम में विघटित होने से पहले ही संक्षिप्त रूप से मौजूद है। सामान्य तौर पर, हम पाते हैं कि He जैसे परमाणु जिनके पास पूर्ण ऊर्जा के गोले हैं, शायद ही कभी अन्य परमाणुओं के साथ बंधते हैं। अल्पकालिक वैन डेर वाल्स बॉन्डिंग को छोड़कर, बहुत कम उत्कृष्ट गैस यौगिक ज्ञात हैं।[citation needed]
हेटेरोन्यूक्लियर डायटोमिक्स
जबकि होमोन्यूक्लियर डायटोमिक अणुओं के लिए एमओ में प्रत्येक परस्पर क्रिया करने वाले परमाणु कक्षीय से समान योगदान होता है, हेटरोन्यूक्लियर डायटोमिक्स के लिए एमओ में विभिन्न परमाणु कक्षीय योगदान होते हैं। विषमनाभिकीय द्विपरमाणुक में आबंधन या प्रतिआबंधी कक्षक उत्पन्न करने के लिए कक्षीय अन्योन्यक्रिया तब होती है जब परमाणु कक्षकों के बीच पर्याप्त अतिच्छादन होता है जैसा कि उनकी सममिति और कक्षीय ऊर्जाओं में समानता द्वारा निर्धारित होता है।[citation needed]
एचएफ
हाइड्रोजिन फ्लोराइड एचएफ में एच 1एस और एफ 2एस ऑर्बिटल्स के बीच ओवरलैप को समरूपता द्वारा अनुमति दी जाती है लेकिन दो परमाणु ऑर्बिटल्स के बीच ऊर्जा में अंतर उन्हें आणविक कक्षीय बनाने के लिए बातचीत करने से रोकता है। H 1s और F 2p के बीच ओवरलैपz ऑर्बिटल्स को भी समरूपता की अनुमति है, और इन दो परमाणु ऑर्बिटल्स में एक छोटी ऊर्जा जुदाई है। इस प्रकार, वे परस्पर क्रिया करते हैं, जिससे σ और σ* MOs और 1 के बंधन क्रम वाला एक अणु बनता है। चूंकि HF एक गैर-सेंट्रोसिमेट्रिक अणु है, सममिति लेबल g और u इसके आणविक कक्षकों पर लागू नहीं होते हैं।[13]
मात्रात्मक दृष्टिकोण
आणविक ऊर्जा स्तरों के लिए मात्रात्मक मान प्राप्त करने के लिए, आणविक ऑर्बिटल्स की आवश्यकता होती है जो ऐसे हों कि कॉन्फ़िगरेशन इंटरैक्शन (CI) विस्तार पूर्ण कॉन्फ़िगरेशन इंटरैक्शन सीमा की ओर तेजी से परिवर्तित हो। इस तरह के कार्यों को प्राप्त करने का सबसे आम तरीका हार्ट्री-फॉक विधि है, जो आणविक ऑर्बिटल्स को फॉक ऑपरेटर के eigenfunction के रूप में व्यक्त करता है। एक आम तौर पर परमाणु नाभिक पर केंद्रित गॉसियन कार्यों के रैखिक संयोजनों के रूप में आणविक कक्षाओं का विस्तार करके इस समस्या को हल करता है (परमाणु कक्षाओं के रैखिक संयोजन आणविक कक्षीय विधि और आधार सेट (रसायन विज्ञान) देखें)। इन रैखिक संयोजनों के गुणांकों के लिए समीकरण एक सामान्यीकृत eigenvalue समीकरण है जिसे रूथन समीकरण के रूप में जाना जाता है, जो वास्तव में हार्ट्री-फॉक समीकरण का एक विशेष प्रतिनिधित्व है। ऐसे कई कार्यक्रम हैं जिनमें स्पार्टन (रसायन विज्ञान सॉफ्टवेयर) सहित एमओ की क्वांटम रासायनिक गणना की जा सकती है।[citation needed] सरल खाते अक्सर सुझाव देते हैं कि प्रायोगिक आणविक कक्षीय ऊर्जा को वैलेंस ऑर्बिटल्स के लिए अल्ट्रा वायलेट फोटोइलेक्ट्रॉन स्पेक्ट्रोस्कोपी और कोर ऑर्बिटल्स के लिए एक्स - रे फ़ोटोइलैक्ट्रॉन स्पेक्ट्रोस्कोपी के तरीकों से प्राप्त किया जा सकता है। हालांकि, यह गलत है क्योंकि ये प्रयोग आयनीकरण ऊर्जा को मापते हैं, अणु के बीच ऊर्जा में अंतर और एक इलेक्ट्रॉन को हटाने के परिणामस्वरूप आयनों में से एक। कोपमन्स प्रमेय द्वारा आयनीकरण ऊर्जा लगभग कक्षीय ऊर्जा से जुड़ी हुई है। जबकि कुछ अणुओं के लिए इन दो मूल्यों के बीच समझौता करीब हो सकता है, यह अन्य मामलों में बहुत खराब हो सकता है।[citation needed]
टिप्पणियाँ
इस पेज में लापता आंतरिक लिंक की सूची
- परमाणु कक्षीय
- गैर बंधन कक्षीय
- एंटीबॉडी आणविक कक्षीय
- परमाणु कक्षाओं का रैखिक संयोजन
- बंधन आणविक कक्षीय
- अलघुकरणीय प्रतिनिधित्व
- पी बंधन
- परमाणु कक्षकों का रैखिक संयोजन आण्विक कक्षीय विधि
- कम्प्यूटेशनल रसायन विज्ञान
- वैलेंस बांड सिद्धांत
- सिग्मा-पाई और समतुल्य-कक्षीय मॉडल
- कक्षीय ओवरलैप
- स्क्वायर प्लानर आणविक ज्यामिति
- तरंग क्रिया
- परिमित समूहों का प्रतिनिधित्व सिद्धांत
- बॉन्ड लंबाई
- तरंग क्रिया
- खड़ी लहर
- प्रतिरक्षी
- अनुबंध आदेश
- महान गैस यौगिक
- गाऊसी समारोह
- रूठान समीकरण
- संयमी (रसायन विज्ञान सॉफ्टवेयर)
संदर्भ
- ↑ Cotton, F. Albert (1990). समूह सिद्धांत के रासायनिक अनुप्रयोग (3rd ed.). New York: Wiley. pp. 102. ISBN 0471510947. OCLC 19975337.
- ↑ Albright, T. A.; Burdett, J. K.; Whangbo, M.-H. (2013). रसायन विज्ञान में कक्षीय सहभागिता. Hoboken, N.J.: Wiley. ISBN 9780471080398.
- ↑ Friedrich Hund and Chemistry, Werner Kutzelnigg, on the occasion of Hund's 100th birthday, Angewandte Chemie International Edition, 35, 573–586, (1996)
- ↑ Robert S. Mulliken's Nobel Lecture, Science, 157, no. 3785, 13-24. Available on-line at: Nobelprize.org
- ↑ Lennard-Jones, John (Sir) (1929). "कुछ डायटोमिक अणुओं की इलेक्ट्रॉनिक संरचना". Transactions of the Faraday Society. 25: 668–686. Bibcode:1929FaTr...25..668L. doi:10.1039/tf9292500668.
- ↑ 6.0 6.1 6.2 6.3 6.4 Catherine E. Housecroft, Alan G. Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33.
- ↑ Peter Atkins; Julio De Paula. Atkins’ Physical Chemistry. Oxford University Press, 8th ed., 2006.
- ↑ Yves Jean; François Volatron. An Introduction to Molecular Orbitals. Oxford University Press, 1993.
- ↑ Michael Munowitz, Principles of Chemistry, Norton & Company, 2000, p. 229-233.
- ↑ Atkins, Peter; et al. (2006). अकार्बनिक रसायन शास्त्र (4. ed.). New York: W.H. Freeman. p. 208. ISBN 978-0-7167-4878-6.
- ↑ Miessler, G.L.; Tarr, Donald A. (2008). अकार्बनिक रसायन शास्त्र. Pearson Education. ISBN 978-81-317-1885-8.
- ↑ Bondybey, V.E. (1984). "Be2 की इलेक्ट्रॉनिक संरचना और बंधन". Chemical Physics Letters. 109 (5): 436–441. Bibcode:1984CPL...109..436B. doi:10.1016/0009-2614(84)80339-5.
- ↑ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, ISBN 0130-39913-2, p. 41-43.

