स्क्वायर प्लानर आणविक ज्यामिति: Difference between revisions
(Created page with "{{Infobox molecular geometry | Image_File=Square-planar-3D-balls.png| Symmetry_group= D<sub>4h</sub> | Atom_direction=4 | Bond_angle=...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Infobox molecular geometry | | {{Infobox molecular geometry | | ||
Image_File=Square-planar-3D-balls.png| | Image_File=Square-planar-3D-balls.png| | ||
Symmetry_group= [[ | Symmetry_group= [[तीन आयामों में द्वितल सममिति|D<sub>4h</sub>]] | | ||
Atom_direction=4 | | Atom_direction=4 | | ||
Bond_angle=90° | | Bond_angle=90° | | ||
mu=0 | | mu=0 | | ||
Examples= [[ | Examples= [[क्सीनन टेट्राफ्लोराइड|XeF<sub>4</sub>]], [[पोटेशियम टेट्राक्लोरोप्लाटिनेट|{{chem|PtCl|4|2−}}]] | ||
}} | }} | ||
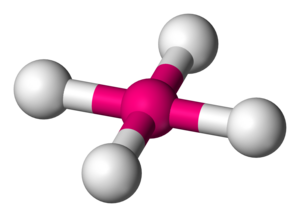
[[File:Cisplatin-3D-vdW.png|thumb|left|200px|[[सिस्प्लैटिन]] की संरचना, | [[File:Cisplatin-3D-vdW.png|thumb|left|200px|[[सिस्प्लैटिन]] की संरचना, वर्ग समतलीय समन्वय ज्यामिति के साथ अणु का एक उदाहरण।]][[रसायन विज्ञान]] में वर्ग समतलीय आण्विक ज्यामिति त्रिविम रसायन (परमाणुओं की स्थानिक व्यवस्था) का वर्णन करती है जिसे कुछ [[रासायनिक यौगिक]] द्वारा अपनाया जाता है। जैसा कि नाम से पता चलता है, इस ज्यामिति के अणुओं में उनके परमाणु शीर्षों (कोनों) पर स्थित होते हैं। | ||
== उदाहरण == | == उदाहरण == | ||
कई यौगिक इस ज्यामिति को अपनाते हैं, संक्रमण धातु | कई यौगिक इस ज्यामिति को अपनाते हैं, संक्रमण धातु क्रियाशील क्षेत्रों के लिए विशेष रूप से कई उदाहरण हैं। [[नोबल गैस]] यौगिक क्सीनन टेट्राफ्लोराइड XeF<sub>4</sub> [[वीएसईपीआर सिद्धांत]] द्वारा भविष्यवाणी के अनुसार इस संरचना को अपनाता है। d<sup>8</sup> के साथ संक्रमण धातु क्रियाशील क्षेत्रों के लिए ज्यामिति प्रचलित है। विन्यास संरूपण, जिसमें Rh(I), Ir(I), Pd(II), Pt(II), और Au(III) सम्मिलित हैं। उल्लेखनीय उदाहरणों में एंटीकैंसर ड्रग्स सिस्प्लैटिन [PtCl<sub>2</sub>(NH<sub>3</sub>)<sub>2</sub>] और [[कार्बोप्लैटिन]] कई सजातीय उत्प्रेरक अपनी स्थिर अवस्था में वर्ग समतलीय होते हैं, जैसे कि विल्किंसन उत्प्रेरक और क्रैबट्री उत्प्रेरक इसके मुख्य उदाहरण हैं। अन्य उदाहरणों में वास्का का कॉम्प्लेक्स और ज़ीस का नमक सम्मिलित हैं। कुछ लिगेंड (जैसे [[पॉरफाइरिन]]) इस ज्यामिति को स्थिर करते हैं। | ||
== डी-ऑर्बिटल्स का विभाजन == | == डी-ऑर्बिटल्स का विभाजन == | ||
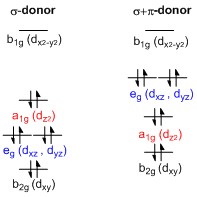
[[File:D-orbital splitting diagrams of square planar complexes.jpg|thumb|σ-डोनर (बाएं) और σ+π-डोनर (दाएं) लिगेंड वाले | [[File:D-orbital splitting diagrams of square planar complexes.jpg|thumb|σ-डोनर (बाएं) और σ+π-डोनर (दाएं) लिगेंड वाले वर्ग समतलीय कॉम्प्लेक्स के लिए प्रतिनिधि डी-ऑर्बिटल स्प्लिटिंग डायग्राम।]]वर्ग समतलीय के लिए एक सामान्य [[डी-कक्षीय|d-कक्षीय]] विभाजन आरेख (D<sub>4h</sub>) संक्रमण धातु क्रियाशील क्षेत्रों को सामान्य ऑक्टाहेड्रल आणविक ज्यामिति ऑक्टाहेड्रल (O<sub>h</sub>) विभाजन आरेख द्वारा प्राप्त किया जा सकता है, जिसमें d<sub>''z''<sup>2</sup></sub> और d<sub>''x''<sup>2</sup>−''y''<sup>2</sup></sub> ऑर्बिटल्स पतित हैं और d<sub>xy</sub> के पतित सेट की तुलना में ऊर्जा में d<sub>xz</sub> और d<sub>yz</sub> ऑर्बिटल्स अधिक हैं। जब दो अक्षीय लिगैंड्स को एक वर्ग समतलीय ज्यामितीय उत्पन्न करने के लिए हटा दिया जाता है, तो d<sub>''z''<sup>2</sup></sub> ऑर्बिटल ऊर्जा में कम संचालित होता है क्योंकि z-अक्ष पर लिगेंड के साथ इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अब उपलब्ध नहीं है। हालाँकि, विशुद्ध रूप से σ-दान करने वाले लिगेंड्स के लिए d<sub>''z''<sup>2</sup></sub> की तुलना में कक्षीय अभी भी ऊर्जा में d<sub>xy</sub> अधिक है, d<sub>xz</sub> और d<sub>yz</sub> के [[टोरस्र्स]] के आकार के लोब के कारण ऑर्बिटल्स d<sub>''z''<sup>2</sup></sub> कक्षीय ऊर्जा अधिक निर्गत करता है। यह x-अक्ष और y-अक्ष पर इलेक्ट्रॉन घनत्व रखता है और इसलिए भरे हुए लिगैंड ऑर्बिटल्स के साथ अंतःक्रिया करता है। d<sub>xy</sub>, d<sub>xz</sub> और d<sub>yz</sub> ऑर्बिटल्स को सामान्यतः अध: पतन के रूप में प्रस्तुत किया जाता है, लेकिन उन्हें [[बिंदु समूह]] d<sub>4h</sub> के इरेड्यूसबल प्रतिनिधित्व के संबंध में दो अलग-अलग ऊर्जा स्तरों में विभाजित करना पड़ता है। उनका क्रम सापेक्ष विशेष क्रियाशील क्षेत्रों की प्रकृति पर निर्भर करता है। इसके अलावा, [[ऑक्टाहेड्रल आणविक ज्यामिति]] के विपरीत, डी-ऑर्बिटल्स का विभाजन π-दान करने वाले लिगेंड द्वारा बाधित होता है। वर्ग समतलीय मामले में दृढ़ता से π-दान करने वाले लिगेंड का कारण d<sub>xz</sub> बन सकते हैं और d<sub>yz</sub> ऑर्बिटल्स d<sub>z</sub><sub><sup>2</sup></sub> की तुलना में ऊर्जा में अधिक होने के लिए कक्षीय, जबकि अष्टफलकीय स्थिति में π-दान करने वाले लिगेंड केवल d-कक्षक विपाटन के परिमाण को प्रभावित करते हैं और कक्षकों के सापेक्ष क्रम को संरक्षित किया जाता है।<ref>{{Cite journal|last=Börgel|first=Jonas|last2=Campbell|first2=Michael G.|last3=Ritter|first3=Tobias|date=2016-01-12|title=Transition Metal d-Orbital Splitting Diagrams: An Updated Educational Resource for Square Planar Transition Metal Complexes|journal=Journal of Chemical Education|volume=93|issue=1|pages=118–121|doi=10.1021/acs.jchemed.5b00542|issn=0021-9584|bibcode=2016JChEd..93..118B}}</ref> | ||
== यह भी देखें == | == यह भी देखें == | ||
* | * एक्स-ई विधि | ||
* [[आणविक ज्यामिति]] | * [[आणविक ज्यामिति]] | ||
Revision as of 21:53, 13 February 2023
| स्क्वायर प्लानर आणविक ज्यामिति | |
|---|---|
 | |
| Examples | XeF4, [[पोटेशियम टेट्राक्लोरोप्लाटिनेट|PtCl2− 4]] |
| Point group | D4h |
| Coordination number | 4 |
| Bond angle(s) | 90° |
| μ (Polarity) | 0 |

रसायन विज्ञान में वर्ग समतलीय आण्विक ज्यामिति त्रिविम रसायन (परमाणुओं की स्थानिक व्यवस्था) का वर्णन करती है जिसे कुछ रासायनिक यौगिक द्वारा अपनाया जाता है। जैसा कि नाम से पता चलता है, इस ज्यामिति के अणुओं में उनके परमाणु शीर्षों (कोनों) पर स्थित होते हैं।
उदाहरण
कई यौगिक इस ज्यामिति को अपनाते हैं, संक्रमण धातु क्रियाशील क्षेत्रों के लिए विशेष रूप से कई उदाहरण हैं। नोबल गैस यौगिक क्सीनन टेट्राफ्लोराइड XeF4 वीएसईपीआर सिद्धांत द्वारा भविष्यवाणी के अनुसार इस संरचना को अपनाता है। d8 के साथ संक्रमण धातु क्रियाशील क्षेत्रों के लिए ज्यामिति प्रचलित है। विन्यास संरूपण, जिसमें Rh(I), Ir(I), Pd(II), Pt(II), और Au(III) सम्मिलित हैं। उल्लेखनीय उदाहरणों में एंटीकैंसर ड्रग्स सिस्प्लैटिन [PtCl2(NH3)2] और कार्बोप्लैटिन कई सजातीय उत्प्रेरक अपनी स्थिर अवस्था में वर्ग समतलीय होते हैं, जैसे कि विल्किंसन उत्प्रेरक और क्रैबट्री उत्प्रेरक इसके मुख्य उदाहरण हैं। अन्य उदाहरणों में वास्का का कॉम्प्लेक्स और ज़ीस का नमक सम्मिलित हैं। कुछ लिगेंड (जैसे पॉरफाइरिन) इस ज्यामिति को स्थिर करते हैं।
डी-ऑर्बिटल्स का विभाजन
वर्ग समतलीय के लिए एक सामान्य d-कक्षीय विभाजन आरेख (D4h) संक्रमण धातु क्रियाशील क्षेत्रों को सामान्य ऑक्टाहेड्रल आणविक ज्यामिति ऑक्टाहेड्रल (Oh) विभाजन आरेख द्वारा प्राप्त किया जा सकता है, जिसमें dz2 और dx2−y2 ऑर्बिटल्स पतित हैं और dxy के पतित सेट की तुलना में ऊर्जा में dxz और dyz ऑर्बिटल्स अधिक हैं। जब दो अक्षीय लिगैंड्स को एक वर्ग समतलीय ज्यामितीय उत्पन्न करने के लिए हटा दिया जाता है, तो dz2 ऑर्बिटल ऊर्जा में कम संचालित होता है क्योंकि z-अक्ष पर लिगेंड के साथ इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अब उपलब्ध नहीं है। हालाँकि, विशुद्ध रूप से σ-दान करने वाले लिगेंड्स के लिए dz2 की तुलना में कक्षीय अभी भी ऊर्जा में dxy अधिक है, dxz और dyz के टोरस्र्स के आकार के लोब के कारण ऑर्बिटल्स dz2 कक्षीय ऊर्जा अधिक निर्गत करता है। यह x-अक्ष और y-अक्ष पर इलेक्ट्रॉन घनत्व रखता है और इसलिए भरे हुए लिगैंड ऑर्बिटल्स के साथ अंतःक्रिया करता है। dxy, dxz और dyz ऑर्बिटल्स को सामान्यतः अध: पतन के रूप में प्रस्तुत किया जाता है, लेकिन उन्हें बिंदु समूह d4h के इरेड्यूसबल प्रतिनिधित्व के संबंध में दो अलग-अलग ऊर्जा स्तरों में विभाजित करना पड़ता है। उनका क्रम सापेक्ष विशेष क्रियाशील क्षेत्रों की प्रकृति पर निर्भर करता है। इसके अलावा, ऑक्टाहेड्रल आणविक ज्यामिति के विपरीत, डी-ऑर्बिटल्स का विभाजन π-दान करने वाले लिगेंड द्वारा बाधित होता है। वर्ग समतलीय मामले में दृढ़ता से π-दान करने वाले लिगेंड का कारण dxz बन सकते हैं और dyz ऑर्बिटल्स dz2 की तुलना में ऊर्जा में अधिक होने के लिए कक्षीय, जबकि अष्टफलकीय स्थिति में π-दान करने वाले लिगेंड केवल d-कक्षक विपाटन के परिमाण को प्रभावित करते हैं और कक्षकों के सापेक्ष क्रम को संरक्षित किया जाता है।[1]
यह भी देखें
- एक्स-ई विधि
- आणविक ज्यामिति
संदर्भ
- ↑ Börgel, Jonas; Campbell, Michael G.; Ritter, Tobias (2016-01-12). "Transition Metal d-Orbital Splitting Diagrams: An Updated Educational Resource for Square Planar Transition Metal Complexes". Journal of Chemical Education. 93 (1): 118–121. Bibcode:2016JChEd..93..118B. doi:10.1021/acs.jchemed.5b00542. ISSN 0021-9584.
बाहरी संबंध
- 3D Chem – Chemistry, Structures, and 3D Molecules
- IUMSC – Indiana University Molecular Structure Center
- Interactive molecular examples for point groups
- [1] – Coordination numbers and complex ions