लैमिनोपैथी: Difference between revisions
No edit summary |
No edit summary |
||
| Line 23: | Line 23: | ||
| deaths = | | deaths = | ||
}} | }} | ||
लैमिनोपैथिस ( | लैमिनोपैथिस (''लैमिनो'' + ''पैथी'') दुर्लभ [[आनुवंशिक विकार|आनुवंशिक विकारों]] का समूह है, जो परमाणु लेमिना के जीन एन्कोडिंग प्रोटीन में [[उत्परिवर्तन]] के कारण होता है। वे परमाणु आवरण के दोषों से जुड़े रोगों के लिए, 2000 में गढ़े गए अधिक सामान्य शब्द परमाणु आवरण में सम्मिलित हैं।<ref name=Nagano>{{cite journal|vauthors=Nagano A, Arahata K | title = Nuclear envelope proteins and associated diseases | journal = Curr. Opin. Neurol. | year = 2000 | volume = 13 |pages=533–9 | pmid = 11073359 | doi = 10.1097/00019052-200010000-00005|issue= 5| s2cid = 12550140 }}</ref> 1990 के दशक के उत्तरार्ध में लैमिनोपैथियों की पहली सूची के बाद से, जानवरों में कोशिका और ऊतक अखंडता में परमाणु आवरण प्रोटीन की महत्वपूर्ण भूमिका को उजागर करने के लिए अनुसंधान प्रयासों में वृद्धि प्रारंभ हो गई है। | ||
== लक्षण और संकेत == | == लक्षण और संकेत == | ||
लैमिनोपैथियों और अन्य परमाणु आवरणों में कंकाल और/या कार्डियक [[मांसपेशीय दुर्विकास]], [[लिपोडिस्ट्रोफी]] और [[मधुमेह]], [[dysplasia|डिस्प्लेसिया]], डर्मो- या [[न्युरोपटी|न्यूरोपैथी]], [[ल्यूकोडिस्ट्रॉफी]] और [[progeria|प्रोजेरिया]] (समय से पहले बुढ़ापा) सहित नैदानिक लक्षणों की | लैमिनोपैथियों और अन्य परमाणु आवरणों में कंकाल और/या कार्डियक [[मांसपेशीय दुर्विकास]], [[लिपोडिस्ट्रोफी]] और [[मधुमेह]], [[dysplasia|डिस्प्लेसिया]], डर्मो- या [[न्युरोपटी|न्यूरोपैथी]], [[ल्यूकोडिस्ट्रॉफी]] और [[progeria|प्रोजेरिया]] (समय से पहले बुढ़ापा) सहित नैदानिक लक्षणों की विशाल विविधता है। इनमें से अधिकतर लक्षण जन्म के बाद विकसित होते हैं, सामान्यतः बचपन या किशोरावस्था के समय। चूंकि, कुछ लेमिनोपैथी से समय से पहले मृत्यु हो सकती है, और लैमिन B1 ([[गांठ1|LMNB1]] जीन) का उत्परिवर्तन जन्म से पहले या जन्म के समय घातक हो सकता है।<ref name=Vergnes>{{cite journal|vauthors=Vergnes L, Peterfy M, Bergo MO, Young SG, Reue K | title = Lamin B1 is required for mouse development and nuclear integrity | journal = Proc. Natl. Acad. Sci. U.S.A. | year = 2004 | volume = 101 |pages=10428–33 | pmid = 15232008 | doi = 10.1073/pnas.0401424101|issue= 28|pmc= 478588| bibcode = 2004PNAS..10110428V | doi-access = free }}</ref> | ||
== जेनेटिक्स == | == जेनेटिक्स == | ||
शास्त्रीय लेमिनोपैथी वाले मरीजों में लैमिन A/C | शास्त्रीय लेमिनोपैथी वाले मरीजों में लैमिन A/C ([[एलएमएनए|LMNA]] जीन) के लिए जीन कोडिंग में उत्परिवर्तन होता है। | ||
[[लेमिन बी|लेमिन B2]] (LMNB2 जीन) के लिए जीन कोडिंग में उत्परिवर्तन को बैराकेर-साइमन्स सिंड्रोम से जोड़ा गया है<ref>{{cite journal | author = Hegele RA, Cao H, Liu DM, Costain GA, Charlton-Menys V, Rodger NW, Durrington PN | year = 2006 | title = Sequencing of the reannotated LMNB2 gene reveals novel mutations in patients with acquired partial lipodystrophy | journal = Am J Hum Genet | volume = 79 | issue = 2 | pages = 383–389 | pmid = 16826530 | doi = 10.1086/505885 | pmc = 1559499 }}</ref> और लैमिन B1 (LMNB1 जीन) के लिए जीन कोडिंग में दोहराव ऑटोसोमल डोमिनेंट ल्यूकोडिस्ट्रॉफी का कारण बनता है।<ref>{{cite journal | author = Padiath QS, Saigoh K, Schiffmann R, Asahara H, Yamada T, Koeppen A, Hogan K, Ptácek LJ, Fu YH | year = 2006 | title = Lamin B1 duplications cause autosomal dominant leukodystrophy | journal = Nat Genet | volume = 38 | issue = 10 | pages = 1114–1123 | doi = 10.1038/ng1872 | pmid = 16951681 | s2cid = 25336497 }}</ref> | [[लेमिन बी|लेमिन B2]] (LMNB2 जीन) के लिए जीन कोडिंग में उत्परिवर्तन को बैराकेर-साइमन्स सिंड्रोम से जोड़ा गया है<ref>{{cite journal | author = Hegele RA, Cao H, Liu DM, Costain GA, Charlton-Menys V, Rodger NW, Durrington PN | year = 2006 | title = Sequencing of the reannotated LMNB2 gene reveals novel mutations in patients with acquired partial lipodystrophy | journal = Am J Hum Genet | volume = 79 | issue = 2 | pages = 383–389 | pmid = 16826530 | doi = 10.1086/505885 | pmc = 1559499 }}</ref> और लैमिन B1 (LMNB1 जीन) के लिए जीन कोडिंग में दोहराव ऑटोसोमल डोमिनेंट ल्यूकोडिस्ट्रॉफी का कारण बनता है।<ref>{{cite journal | author = Padiath QS, Saigoh K, Schiffmann R, Asahara H, Yamada T, Koeppen A, Hogan K, Ptácek LJ, Fu YH | year = 2006 | title = Lamin B1 duplications cause autosomal dominant leukodystrophy | journal = Nat Genet | volume = 38 | issue = 10 | pages = 1114–1123 | doi = 10.1038/ng1872 | pmid = 16951681 | s2cid = 25336497 }}</ref> | ||
लैमिन-बाइंडिंग प्रोटीन जैसे [[लैमिनेट बी रिसेप्टर|लैमिन B रिसेप्टर]] (LBR जीन), [[कस्र्न पत्थर|एमरिन]] (EMD जीन) और LEM डोमेन- के लिए जीन कोडिंग में अन्य परमाणु आवरणों में निहित उत्परिवर्तन पाए गए।<ref name=":0" /><ref name=":1" /><ref name=":2" /><ref name=":3" /><ref name=":4" /> इसमें प्रोटीन 3 (LEMD3 जीन) और प्रिलमिन ए-प्रोसेसिंग एंजाइम जैसे [[जिंक मेटालोप्रोटीनेज STE24|जिंक मेटालोप्रोटीनेज]] [[जिंक मेटालोप्रोटीनेज STE24|STE24]] (ZMPSTE24 जीन) सम्मिलित हैं। | लैमिन-बाइंडिंग प्रोटीन जैसे [[लैमिनेट बी रिसेप्टर|लैमिन B रिसेप्टर]] (LBR जीन), [[कस्र्न पत्थर|एमरिन]] (EMD जीन) और LEM डोमेन- के लिए जीन कोडिंग में अन्य परमाणु आवरणों में निहित उत्परिवर्तन पाए गए।<ref name=":0">{{Cite journal |last1=Hoffmann |first1=Katrin |last2=Dreger |first2=Christine K. |last3=Olins |first3=Ada L. |last4=Olins |first4=Donald E. |last5=Shultz |first5=Leonard D. |last6=Lucke |first6=Barbara |last7=Karl |first7=Hartmut |last8=Kaps |first8=Reinhard |last9=Müller |first9=Dietmar |last10=Vayá |first10=Amparo |last11=Aznar |first11=Justo |date=2002-07-15 |title=Mutations in the gene encoding the lamin B receptor produce an altered nuclear morphology in granulocytes (Pelger–Huët anomaly) |url=http://dx.doi.org/10.1038/ng925 |journal=Nature Genetics |volume=31 |issue=4 |pages=410–414 |doi=10.1038/ng925 |pmid=12118250 |s2cid=6020153 |issn=1061-4036}}</ref><ref name=":1">{{Cite journal |last1=Waterham |first1=Hans R. |last2=Koster |first2=Janet |last3=Mooyer |first3=Petra |last4=Noort |first4=Gerard van |last5=Kelley |first5=Richard I. |last6=Wilcox |first6=William R. |last7=Ronald Wanders |first7=J.A. |last8=Raoul Hennekam |first8=C.M. |last9=Jan Oosterwijk |first9=C. |date=April 2003 |title=Autosomal Recessive HEM/Greenberg Skeletal Dysplasia Is Caused by 3β-Hydroxysterol Δ14-Reductase Deficiency Due to Mutations in the Lamin B Receptor Gene |url=http://dx.doi.org/10.1086/373938 |journal=The American Journal of Human Genetics |volume=72 |issue=4 |pages=1013–1017 |doi=10.1086/373938 |pmid=12618959 |pmc=1180330 |issn=0002-9297}}</ref><ref name=":2">{{Cite journal |last1=Greenberg |first1=Cheryl R. |last2=Rimoin |first2=David L. |last3=Gruber |first3=Helen E. |last4=DeSa |first4=D. J. B. |last5=Reed |first5=M. |last6=Lachman |first6=Ralph S. |last7=Optiz |first7=John M. |last8=Reynolds |first8=James F. |date=March 1988 |title=A new autosomal recessive lethal chondrodystrophy with congenital hydrops |url=http://dx.doi.org/10.1002/ajmg.1320290321 |journal=American Journal of Medical Genetics |volume=29 |issue=3 |pages=623–632 |doi=10.1002/ajmg.1320290321 |pmid=3377005 |issn=0148-7299}}</ref><ref name=":3">{{Cite journal |last=Shultz |first=L. D. |date=2003-01-01 |title=Mutations at the mouse ichthyosis locus are within the lamin B receptor gene: a single gene model for human Pelger-Huet anomaly |url=http://dx.doi.org/10.1093/hmg/ddg003 |journal=Human Molecular Genetics |volume=12 |issue=1 |pages=61–69 |doi=10.1093/hmg/ddg003 |pmid=12490533 |issn=1460-2083|doi-access=free }}</ref><ref name=":4">{{Cite journal |last1=Young |first1=Alexander Neil |last2=Perlas |first2=Emerald |last3=Ruiz-Blanes |first3=Nerea |last4=Hierholzer |first4=Andreas |last5=Pomella |first5=Nicola |last6=Martin-Martin |first6=Belen |last7=Liverziani |first7=Alessandra |last8=Jachowicz |first8=Joanna W. |last9=Giannakouros |first9=Thomas |last10=Cerase |first10=Andrea |date=2021-04-12 |title=Deletion of LBR N-terminal domains recapitulates Pelger-Huet anomaly phenotypes in mouse without disrupting X chromosome inactivation |url=http://dx.doi.org/10.1038/s42003-021-01944-2 |journal=Communications Biology |volume=4 |issue=1 |page=478 |doi=10.1038/s42003-021-01944-2 |pmid=33846535 |pmc=8041748 |issn=2399-3642}}</ref> इसमें प्रोटीन 3 (LEMD3 जीन) और प्रिलमिन ए-प्रोसेसिंग एंजाइम जैसे [[जिंक मेटालोप्रोटीनेज STE24|जिंक मेटालोप्रोटीनेज]] [[जिंक मेटालोप्रोटीनेज STE24|STE24]] (ZMPSTE24 जीन) सम्मिलित हैं। | ||
लैमिनोपैथियों के कारण उत्परिवर्तन में रेसेसिव जीन के साथ-साथ [[प्रमुख जीन]] एलील सम्मिलित हैं जिनमें दुर्लभ डे नोवो उत्परिवर्तन प्रमुख एलील बनाते हैं जो अपने वाहक को मृत्यु से पहले पुन: उत्पन्न करने की अनुमति नहीं देते हैं। | |||
लैमिनोपैथियों के कारण उत्परिवर्तन में रेसेसिव जीन के साथ-साथ [[प्रमुख जीन]] एलील सम्मिलित हैं जिनमें दुर्लभ डे नोवो उत्परिवर्तन प्रमुख एलील बनाते हैं जो अपने वाहक को मृत्यु से पहले पुन: उत्पन्न करने की अनुमति नहीं देते हैं। | |||
मानव जनसंख्या में उच्चतम आवृत्ति वाला परमाणु एनवेलोपैथी एमरी-ड्रेफस मस्कुलर डिस्ट्रॉफी है, जो एमरिन के लिए ईएमडी जीन कोडिंग में [[सेक्स लिंकेज|एक्स-लिंक्ड]] उत्परिवर्तन के कारण होता है और 100,000 लोगों में अनुमानित 1 को प्रभावित करता है। | मानव जनसंख्या में उच्चतम आवृत्ति वाला परमाणु एनवेलोपैथी एमरी-ड्रेफस मस्कुलर डिस्ट्रॉफी है, जो एमरिन के लिए ईएमडी जीन कोडिंग में [[सेक्स लिंकेज|एक्स-लिंक्ड]] उत्परिवर्तन के कारण होता है और 100,000 लोगों में अनुमानित 1 को प्रभावित करता है। | ||
== आणविक तंत्र == | |||
लैमिन्स मध्यवर्ती फिलामेंट प्रोटीन होते हैं जो पशु कोशिकाओं में परमाणु आवरण के नीचे परमाणु लैमिना मचान बनाते हैं। वे फ़ार्नेसिल एंकर के माध्यम से परमाणु आवरण की झिल्ली से जुड़े होते हैं और [[आंतरिक परमाणु झिल्ली प्रोटीन]] जैसे लैमिन B रिसेप्टर और एमरिन के साथ संवाद करते हैं। परमाणु लैमिना जानवरों में गतिशीलता के लिए अनुकूलन प्रतीत होता है क्योंकि पौधों या [[कुकुरमुत्ता|कवक]] जैसे जीवों में लैमिन नहीं होते हैं<ref name=Mans>{{cite journal|vauthors=Mans BJ, Anantharaman V, Aravind L, Koonin EV | title = Comparative genomics, evolution and origins of the nuclear envelope and nuclear pore complex | journal = Cell Cycle | year = 2004 | volume = 3 |pages=1612–37 | pmid = 15611647|issue= 12 | doi = 10.4161/cc.3.12.1316 | doi-access = free }}</ref> और कई लैमिनोपैथियों के लक्षणों में मांसपेशियों के दोष सम्मिलित हैं। इन जीनों में उत्परिवर्तन से फिलामेंट असेंबली में दोष हो सकते हैं और परमाणु आवरण से जुड़ाव हो सकता है और इस तरह शारीरिक रूप से तनावग्रस्त ऊतकों जैसे मांसपेशी फाइबर, [[हड्डी]], [[त्वचा]] और [[संयोजी ऊतक]] में परमाणु आवरण की स्थिरता को संकट में डाल सकता है।<ref name=Houben>{{cite journal|vauthors=Houben F, Ramaekers FC, Snoeckx LH, Broers JL | title = Role of nuclear lamina-cytoskeleton interactions in the maintenance of cellular strength | journal = Biochim. Biophys. Acta |volume=1773 |issue=5 |pages=675–86 |date=May 2007 |pmid=17050008 |doi=10.1016/j.bbamcr.2006.09.018 |doi-access=free }}</ref> | |||
एलएमएनए जीन से उत्पन्न [[मैसेंजर आरएनए]] वैकल्पिक विभाजन से निकलता है और इसे लैमिन्स A और C में अनुवादित किया जाता है। लैमिन A प्रोटीन के लिए झिल्ली एंकर संलग्न करने के लिए [[गर्भावस्था]] से निकलता है। प्रोटीन के इस संस्करण को प्रिलमिन A के रूप में भी जाना जाता है। फार्नेसिलेटेड प्रिलमिन A को आगे चलकर परिपक्व लैमिन A में [[मेटेलोप्रोटीनेज]] द्वारा अंतिम 15 [[एमिनो एसिड]] और इसके फार्नेसिलेटेड [[सिस्टीन]] को हटाकर संसाधित किया जाता है। यह लैमिन A को परमाणु आवरण झिल्ली से अलग करने और परमाणु कार्यों को पूरा करने की अनुमति देता है। लैमिनोपैथी उत्पन्न करने वाले उत्परिवर्तन विभिन्न स्तरों पर इन प्रक्रियाओं में हस्तक्षेप करते हैं। | |||
=== निरर्थक और अनुचित उत्परिवर्तन === | === निरर्थक और अनुचित उत्परिवर्तन === | ||
लैमिन A/C रॉड और टेल डोमेन में [[गलत उत्तराधिकारी|अनुचित उत्तराधिकारी]] आनुवंशिक विकारों की | लैमिन A/C रॉड और टेल डोमेन में [[गलत उत्तराधिकारी|अनुचित उत्तराधिकारी]] आनुवंशिक विकारों की विस्तृत श्रृंखला का कारण हैं, यह सुझाव देते हुए कि लैमिन A/C प्रोटीन में अलग-अलग कार्यात्मक डोमेन होते हैं जो विभिन्न सेल वंशावली के देखभाल और अखंडता के लिए आवश्यक हैं। लैमिन A और न्यूक्लियर आवरण प्रोटीन एमेरिन के बीच इंटरेक्शन मांसपेशियों की कोशिकाओं में महत्वपूर्ण प्रतीत होता है, लैमिन में कुछ उत्परिवर्तन के साथ एमरिन में उत्परिवर्तन की नकल करता है और एमरी-ड्रेफस मस्कुलर डिस्ट्रॉफी का कारण बनता है। अलग-अलग उत्परिवर्तन प्रमुख-नकारात्मक और अप्रभावी एलील्स की ओर ले जाते हैं। लैमिन रॉड डोमेन में उत्परिवर्तन, लैमिन A और एमरिन दोनों के गलत स्थानीयकरण की ओर ले जाता है, जो मस्कुलर डिस्ट्रॉफी और कार्डियोमायोपैथी के ऑटोसोमल प्रमुख रूपों वाले रोगियों में होता है। | ||
लैमिनेट B1 में उत्परिवर्तन के साथ अधिकांश लैमिनेट B उत्परिवर्तन घातक प्रतीत होते हैं, जिससे चूहों में जन्म के समय मृत्यु हो जाती है।<ref name="Vergnes" /> 2006 में, अधिग्रहीत आंशिक लिपोडिस्ट्रॉफी वाले रोगियों में लैमिन B2 मिसेंस उत्परिवर्तन की पहचान की गई थी।<ref name="Hegele" /> | लैमिनेट B1 में उत्परिवर्तन के साथ अधिकांश लैमिनेट B उत्परिवर्तन घातक प्रतीत होते हैं, जिससे चूहों में जन्म के समय मृत्यु हो जाती है।<ref name="Vergnes" /> 2006 में, अधिग्रहीत आंशिक लिपोडिस्ट्रॉफी वाले रोगियों में लैमिन B2 मिसेंस उत्परिवर्तन की पहचान की गई थी।<ref name="Hegele" /> | ||
| Line 62: | Line 58: | ||
=== बिंदु उत्परिवर्तन === | === बिंदु उत्परिवर्तन === | ||
लैमिन A/C में सबसे सामान्य उत्परिवर्तन समयुग्मजी Arg527His (527 की स्थिति में हिस्टीडाइन द्वारा प्रतिस्थापित आर्गिनिन) एलएमएनए जीन के एक्सॉन 9 में प्रतिस्थापन | लैमिन A/C में सबसे सामान्य उत्परिवर्तन समयुग्मजी Arg527His (527 की स्थिति में हिस्टीडाइन द्वारा प्रतिस्थापित आर्गिनिन) एलएमएनए जीन के एक्सॉन 9 में प्रतिस्थापन है।<ref name="Novelli">{{cite journal|vauthors=Novelli G, Muchir A, Sangiuolo F, Helbling-Leclerc A, D'Apice MR, Massart C, Capon F, Sbraccia P, Federici M, Lauro R, Tudisco C, Pallotta R, Scarano G, Dallapiccola B, Merlini L, Bonne G | title = Mandibuloacral dysplasia is caused by a mutation in LMNA-encoding lamin A/C | journal = Am. J. Hum. Genet. | year = 2002 | volume = 71 |pages=426–31 | pmid = 12075506 | doi = 10.1086/341908|issue= 2|pmc= 379176}}</ref> अन्य ज्ञात उत्परिवर्तन Ala529Val और Arg527His/Val440Met हैं।<ref>{{cite journal |vauthors=Zirn B, Kress W, Grimm T, Berthold LD, etal |year= 2008|title= Association of homozygous LMNA mutation R471C with new phenotype: mandibuloacral dysplasia, progeria, and rigid spine muscular dystrophy.|journal= Am J Med Genet A|volume= 146A|issue= 8|pages= 1049–1054|doi= 10.1002/ajmg.a.32259|pmid=18348272|s2cid= 205309256}}</ref> इसके अतिरिक्त, कुछ उत्परिवर्तन जैसे Arg527Cys, Lys542Asn, Arg471Cys, Thr528Met/Met540Thr, और Arg471Cys/Arg527Cys, Arg527Leu का परिणाम प्रोजेरिया जैसी विशेषताओं के साथ [[मैंडीबुलोएक्रल डिसप्लेसिया|मेन्डिबुलोएक्रल डिसप्लेसिया]] होता है।<ref>{{cite journal |vauthors=Al-Haggar M, Madej-Pilarczyk A, Kozlowski L, Bujnicki JM, Yahia S, Abdel-Hadi D, Shams A, Ahmad N, Hamed S, Puzianowska-Kuznicka M |year= 2012|title= A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome.|journal= Eur J Hum Genet|volume= 20|issue= 11|pages= 1134–40|doi= 10.1038/ejhg.2012.77|pmc= 3476705|pmid= 22549407}} | ||
</ref> | |||
=== विभाजन दोष === | === विभाजन दोष === | ||
प्रोजेरिया उत्पन्न करने वाले उत्परिवर्तन स्प्लिसिंग (आनुवांशिकी) एलएमएनए एमआरएनए में दोषपूर्ण हैं, इसलिए असामान्य लैमिन A प्रोटीन का उत्पादन करते हैं, जिसे प्रोजेरिन भी कहा जाता है। उत्परिवर्तन जीन के [[एक्सॉन]] 11 के अंदर | प्रोजेरिया उत्पन्न करने वाले उत्परिवर्तन स्प्लिसिंग (आनुवांशिकी) एलएमएनए एमआरएनए में दोषपूर्ण हैं, इसलिए असामान्य लैमिन A प्रोटीन का उत्पादन करते हैं, जिसे प्रोजेरिन भी कहा जाता है। उत्परिवर्तन जीन के [[एक्सॉन]] 11 के अंदर क्रिप्टिक ब्याह स्थल को सक्रिय करते हैं, जिससे प्रिलमिन A पर प्रसंस्करण स्थल को हटा दिया जाता है।<ref name=Eriksson/> इसके परिणामस्वरूप प्रोजेरिन का संचय होता है जो लैमिन A में परिपक्व होने में असमर्थ होता है, जिससे मिशापेन नाभिक होता है। मिसप्लिसिंग भी एक्सॉन 11 के पूर्ण या आंशिक हानि की ओर जाता है और इसके परिणामस्वरूप नवजात घातक [[तंग त्वचा संकुचन सिंड्रोम]] में छोटा प्रीलामिन A प्रोटीन होता है।<ref name=Navarro/> | ||
=== प्रसंस्करण दोष === | === प्रसंस्करण दोष === | ||
चूंकि मेटालोप्रोटीनेज एसटीई24 को प्रिलमिन A को परिपक्व लैमिन A में संसाधित करने की आवश्यकता होती है, इसलिए इस जीन में उत्परिवर्तन [[प्रोटीज]] गतिविधि को समाप्त कर देता है, जिसके कारण लैमिनोपैथियों के समान दोष होते हैं, जो प्रिलमिन A के कारण काटे गए प्रसंस्करण स्थलों के कारण होता है। ZMPSTE24 उत्परिवर्तन वाले रोगियों में लक्षण मंडिबुलोएक्रल डिस्प्लेसिया, प्रोजेरॉइड उपस्थिति, और सामान्यीकृत लिपोडिस्ट्रोफी से लेकर शिशु-घातक [[प्रतिबंधात्मक डर्मोपैथी]] सम्मिलित हैं। | चूंकि मेटालोप्रोटीनेज एसटीई24 को प्रिलमिन A को परिपक्व लैमिन A में संसाधित करने की आवश्यकता होती है, इसलिए इस जीन में उत्परिवर्तन [[प्रोटीज]] गतिविधि को समाप्त कर देता है, जिसके कारण लैमिनोपैथियों के समान दोष होते हैं, जो प्रिलमिन A के कारण काटे गए प्रसंस्करण स्थलों के कारण होता है। ZMPSTE24 उत्परिवर्तन वाले रोगियों में लक्षण मंडिबुलोएक्रल डिस्प्लेसिया, प्रोजेरॉइड उपस्थिति, और सामान्यीकृत लिपोडिस्ट्रोफी से लेकर शिशु-घातक [[प्रतिबंधात्मक डर्मोपैथी]] सम्मिलित हैं। | ||
| Line 90: | Line 83: | ||
=== डीएनए का पुनर्निर्माण === | === डीएनए का पुनर्निर्माण === | ||
ए-टाइप लैमिन्स प्रोटीन के स्तर को बनाए रखते हुए आनुवंशिक स्थिरता को बढ़ावा देते हैं जिनकी [[गैर-होमोलॉगस एंड जॉइनिंग]] और [[सजातीय पुनर्संयोजन|होमोलॉगस रीकॉम्बिनेशन]] की प्रक्रियाओं के समय डीएनए डबल-स्ट्रैंड ब्रेक रिपेयर में महत्वपूर्ण भूमिका होती है।<ref name="pmid21701264">{{cite journal |vauthors=Redwood AB, Perkins SM, Vanderwaal RP, Feng Z, Biehl KJ, Gonzalez-Suarez I, Morgado-Palacin L, Shi W, Sage J, Roti-Roti JL, Stewart CL, Zhang J, Gonzalo S |title=A dual role for A-type lamins in DNA double-strand break repair |journal=Cell Cycle |volume=10 |issue=15 |pages=2549–60 |year=2011 |pmid=21701264 |pmc=3180193 |doi=10.4161/cc.10.15.16531 }}</ref> लैमिन A (एलएमएनए) में उत्परिवर्तन हचिंसन-गिलफोर्ड प्रोजेरिया सिंड्रोम का कारण बनता है, जो समय से पहले बूढ़ा होने का | ए-टाइप लैमिन्स प्रोटीन के स्तर को बनाए रखते हुए आनुवंशिक स्थिरता को बढ़ावा देते हैं जिनकी [[गैर-होमोलॉगस एंड जॉइनिंग]] और [[सजातीय पुनर्संयोजन|होमोलॉगस रीकॉम्बिनेशन]] की प्रक्रियाओं के समय डीएनए डबल-स्ट्रैंड ब्रेक रिपेयर में महत्वपूर्ण भूमिका होती है।<ref name="pmid21701264">{{cite journal |vauthors=Redwood AB, Perkins SM, Vanderwaal RP, Feng Z, Biehl KJ, Gonzalez-Suarez I, Morgado-Palacin L, Shi W, Sage J, Roti-Roti JL, Stewart CL, Zhang J, Gonzalo S |title=A dual role for A-type lamins in DNA double-strand break repair |journal=Cell Cycle |volume=10 |issue=15 |pages=2549–60 |year=2011 |pmid=21701264 |pmc=3180193 |doi=10.4161/cc.10.15.16531 }}</ref> लैमिन A (एलएमएनए) में उत्परिवर्तन हचिंसन-गिलफोर्ड प्रोजेरिया सिंड्रोम का कारण बनता है, जो समय से पहले बूढ़ा होने का नाटकीय रूप है।<ref name=Eriksson /> प्रिलमिन A की परिपक्वता के लिए कमी वाली माउस कोशिकाएं डीएनए की क्षति और गुणसूत्र विपथन को बढ़ाती हैं और डीएनए हानिकारक एजेंटों के प्रति अधिक संवेदनशील होती हैं।<ref name="pmid15980864">{{cite journal |vauthors=Liu B, Wang J, Chan KM, Tjia WM, Deng W, Guan X, Huang JD, Li KM, Chau PY, Chen DJ, Pei D, Pendas AM, Cadiñanos J, López-Otín C, Tse HF, Hutchison C, Chen J, Cao Y, Cheah KS, Tryggvason K, Zhou Z |title=Genomic instability in laminopathy-based premature aging |journal=Nat. Med. |volume=11 |issue=7 |pages=780–5 |year=2005 |pmid=15980864 |doi=10.1038/nm1266 |s2cid=11798376 }}</ref> ए-टाइप लैमिन्स दोषपूर्ण होने पर डीएनए क्षति की पर्याप्त रूप से पुनर्निर्माण करने में असमर्थता समय से पहले उम्र बढ़ने के कुछ पहलुओं के लिए उत्तरदायी है। | ||
| Line 148: | Line 140: | ||
== उपचार == | == उपचार == | ||
वर्तमान में, लैमिनोपैथी का कोई उपचार नहीं है और उपचार अधिक सीमा तक रोगसूचक और सहायक है। [[शारीरिक चिकित्सा|फिजिकल थेरेपी]] और सुधारात्मक [[आर्थोपेडिक सर्जरी]] मस्कुलर डिस्ट्रॉफी वाले रोगियों के लिए सहायक हो सकती है। हृदय की मांसपेशियों को प्रभावित करने वाली लैमिनोपेथी हृदय की विफलता का कारण बन सकती है जिसमें [[ऐस अवरोधक|एसीई अवरोधक]], [[बीटा–ब्लॉकर|बीटा–ब्लॉकर्स]] और [[एंटीमिनरलोकोर्टिकोइड|एल्डोस्टेरोन विरोधी]] सहित दवाओं के साथ उपचार की आवश्यकता होती है | वर्तमान में, लैमिनोपैथी का कोई उपचार नहीं है और उपचार अधिक सीमा तक रोगसूचक और सहायक है। [[शारीरिक चिकित्सा|फिजिकल थेरेपी]] और सुधारात्मक [[आर्थोपेडिक सर्जरी]] मस्कुलर डिस्ट्रॉफी वाले रोगियों के लिए सहायक हो सकती है। हृदय की मांसपेशियों को प्रभावित करने वाली लैमिनोपेथी हृदय की विफलता का कारण बन सकती है जिसमें [[ऐस अवरोधक|एसीई अवरोधक]], [[बीटा–ब्लॉकर|बीटा–ब्लॉकर्स]] और [[एंटीमिनरलोकोर्टिकोइड|एल्डोस्टेरोन विरोधी]] सहित दवाओं के साथ उपचार की आवश्यकता होती है, जबकि इन रोगियों में अधिकांशतः होने वाली असामान्य [[कृत्रिम कार्डियक पेसमेकर|असामान्य हृदय लय पेसमेकर]] या [[रोपने - योग्य कार्डियोवर्टर डिफ़िब्रिलेटर|इम्प्लांटेबल डीफिब्रिलेटर]] की आवश्यकता हो सकती है।<ref name=":5">{{Cite journal|last1=Captur|first1=Gabriella|last2=Arbustini|first2=Eloisa|last3=Bonne|first3=Gisèle|last4=Syrris|first4=Petros|last5=Mills|first5=Kevin|last6=Wahbi|first6=Karim|last7=Mohiddin|first7=Saidi A.|last8=McKenna|first8=William J.|last9=Pettit|first9=Stephen|date=2017-11-25|title=Lamin and the heart|journal=Heart|volume=104|issue=6|pages=468–479|doi=10.1136/heartjnl-2017-312338|issn=1468-201X|pmid=29175975|s2cid=3563474|url=https://hal.sorbonne-universite.fr/hal-03285171/file/Captur%20et%20al.%20-%202018%20-%20Lamin%20and%20the%20heart.pdf}}</ref> न्यूरोपैथी के उपचार में दौरे और लोच के लिए दवाएं सम्मिलित हो सकती हैं। | ||
== अनुसंधान == | == अनुसंधान == | ||
लैमिनोपैथियों में विषाक्त प्रोजेरिन गठन के आणविक तंत्र को उजागर करने में हाल की प्रगति ने समय से पहले उम्र बढ़ने के लिए लक्षित उपचार के विकास की संभावना खोल दी है। प्रीलामिन A और इसके पैथोलॉजिकल फॉर्म प्रोजेरिन का फार्नेसिलेशन एंजाइम [[फार्नेसिल ट्रांसफ़ेरेज़]] द्वारा किया जाता है। प्रोजेरिया के लिए दो माउस मॉडल सिस्टम में लक्षणों को कम करने और प्रोजेरॉइड सेल संस्कृतियों में असामान्य परमाणु आकारिकी को वापस लाने के लिए [[फ़ार्नेसिल ट्रांसफ़रेज़ इनहिबिटर]] (एफटीआई) का प्रभावी ढंग से उपयोग किया जा सकता है। दो मौखिक एफटीआई, [[लोनाफर्निब]] और [[टाइपिफर्निब]], पहले से ही मनुष्यों में एंटी-ट्यूमर दवा के रूप में उपयोग में हैं और लैमिनोपैथिक प्रोजेरिया वाले बच्चों के लिए उपचार के मार्ग बन सकते हैं। [[ऑस्टियोपोरोसिस]] के उपचार में उपयोग की जाने वाली नाइट्रोजन युक्त बिसफ़ॉस्फ़ेट दवाएं [[फार्नेसिल पायरोफॉस्फेट]] के उत्पादन को कम करती हैं और इस प्रकार प्रिलमिन A फ़ार्नेसिलेशन को प्रिलमिन करती हैं। इन दवाओं का परीक्षण प्रोजेरिया के उपचार में भी उपयोगी सिद्ध हो सकता है। प्रभावित कोशिकाओं में प्रोगेरिन संश्लेषण को बाधित करने के लिए [[एंटी-सेन्स]] [[oligonucleotide|ऑलिगोन्यूक्लियोटाइड्स]] का उपयोग एंटी-प्रोजेरिन दवाओं के विकास में वर्तमान शोध का एक और विधि है।<ref name=Rusinol>{{cite journal|vauthors=Rusinal AE, Sinensky MS | title = Farnesylated lamins, progeroid syndromes and farnesyl transferase inhibitors | journal = J. Cell Sci. | year = 2006 | volume = 119 |pages=3265–72 | pmid = 16899817 | doi = 10.1242/jcs.03156|issue= Pt 16| doi-access = free }}</ref><ref name=Meta>{{cite journal|vauthors=Meta M, Yang SH, Bergo MO, Fong LG, Young SG | title = Protein farnesyltransferase inhibitors and progeria | journal = Trends Mol. Med. | year = 2006 | volume = 12 |pages=480–7 | pmid = 16942914 | doi = 10.1016/j.molmed.2006.08.006|issue= 10}}</ref> | लैमिनोपैथियों में विषाक्त प्रोजेरिन गठन के आणविक तंत्र को उजागर करने में हाल की प्रगति ने समय से पहले उम्र बढ़ने के लिए लक्षित उपचार के विकास की संभावना खोल दी है। प्रीलामिन A और इसके पैथोलॉजिकल फॉर्म प्रोजेरिन का फार्नेसिलेशन एंजाइम [[फार्नेसिल ट्रांसफ़ेरेज़]] द्वारा किया जाता है। प्रोजेरिया के लिए दो माउस मॉडल सिस्टम में लक्षणों को कम करने और प्रोजेरॉइड सेल संस्कृतियों में असामान्य परमाणु आकारिकी को वापस लाने के लिए [[फ़ार्नेसिल ट्रांसफ़रेज़ इनहिबिटर]] (एफटीआई) का प्रभावी ढंग से उपयोग किया जा सकता है। दो मौखिक एफटीआई, [[लोनाफर्निब]] और [[टाइपिफर्निब]], पहले से ही मनुष्यों में एंटी-ट्यूमर दवा के रूप में उपयोग में हैं और लैमिनोपैथिक प्रोजेरिया वाले बच्चों के लिए उपचार के मार्ग बन सकते हैं। [[ऑस्टियोपोरोसिस]] के उपचार में उपयोग की जाने वाली नाइट्रोजन युक्त बिसफ़ॉस्फ़ेट दवाएं [[फार्नेसिल पायरोफॉस्फेट]] के उत्पादन को कम करती हैं और इस प्रकार प्रिलमिन A फ़ार्नेसिलेशन को प्रिलमिन करती हैं। इन दवाओं का परीक्षण प्रोजेरिया के उपचार में भी उपयोगी सिद्ध हो सकता है। प्रभावित कोशिकाओं में प्रोगेरिन संश्लेषण को बाधित करने के लिए [[एंटी-सेन्स]] [[oligonucleotide|ऑलिगोन्यूक्लियोटाइड्स]] का उपयोग एंटी-प्रोजेरिन दवाओं के विकास में वर्तमान शोध का एक और विधि है।<ref name=Rusinol>{{cite journal|vauthors=Rusinal AE, Sinensky MS | title = Farnesylated lamins, progeroid syndromes and farnesyl transferase inhibitors | journal = J. Cell Sci. | year = 2006 | volume = 119 |pages=3265–72 | pmid = 16899817 | doi = 10.1242/jcs.03156|issue= Pt 16| doi-access = free }}</ref><ref name=Meta>{{cite journal|vauthors=Meta M, Yang SH, Bergo MO, Fong LG, Young SG | title = Protein farnesyltransferase inhibitors and progeria | journal = Trends Mol. Med. | year = 2006 | volume = 12 |pages=480–7 | pmid = 16942914 | doi = 10.1016/j.molmed.2006.08.006|issue= 10}}</ref> | ||
Revision as of 00:46, 20 February 2023
| लमीनोपैथी | |
|---|---|
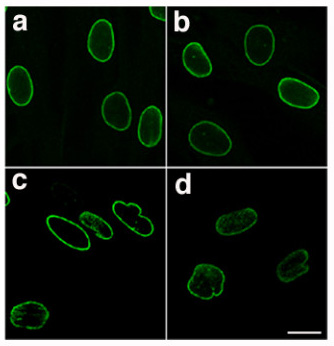 | |
| सामान्य परमाणु लामिना (A और B) और उत्परिवर्ती परमाणु लामिना (C और D) एक रोगी से एचजीपीएस, इम्यूनोफ्लोरेसेंस द्वारा कल्पना - लैमिनोपैथिक नाभिक के अनियमित और ऊबड़ -खाबड़ आकार पर ध्यान दें[1] | |
| Specialty | नैदानिक आनुवंशिकी |
| लक्षण | मांसपेशियों में कमजोरी, कम संवेदना, सांस लेने में कठिनाई, बेहोशी |
| जटिलताएं | मधुमेह, हृद्पात, अतालता |
| Usual onset | वेरिएबल |
| अवधि | आजीवन |
| कारण | आनुवंशिक |
| नैदानिक विधि | नैदानिक, आनुवंशिक परीक्षण |
| इलाज | फिजियोथेरेपी, ओर्थपेडीक सर्जरी, पेसमेकर, इम्प्लांटेबल डिफाइब्रिलेटर |
| दवा | ACE inhibitor, beta blocker, aldosterone antagonist |
| रोग का निदान | वेरिएबल |
लैमिनोपैथिस (लैमिनो + पैथी) दुर्लभ आनुवंशिक विकारों का समूह है, जो परमाणु लेमिना के जीन एन्कोडिंग प्रोटीन में उत्परिवर्तन के कारण होता है। वे परमाणु आवरण के दोषों से जुड़े रोगों के लिए, 2000 में गढ़े गए अधिक सामान्य शब्द परमाणु आवरण में सम्मिलित हैं।[2] 1990 के दशक के उत्तरार्ध में लैमिनोपैथियों की पहली सूची के बाद से, जानवरों में कोशिका और ऊतक अखंडता में परमाणु आवरण प्रोटीन की महत्वपूर्ण भूमिका को उजागर करने के लिए अनुसंधान प्रयासों में वृद्धि प्रारंभ हो गई है।
लक्षण और संकेत
लैमिनोपैथियों और अन्य परमाणु आवरणों में कंकाल और/या कार्डियक मांसपेशीय दुर्विकास, लिपोडिस्ट्रोफी और मधुमेह, डिस्प्लेसिया, डर्मो- या न्यूरोपैथी, ल्यूकोडिस्ट्रॉफी और प्रोजेरिया (समय से पहले बुढ़ापा) सहित नैदानिक लक्षणों की विशाल विविधता है। इनमें से अधिकतर लक्षण जन्म के बाद विकसित होते हैं, सामान्यतः बचपन या किशोरावस्था के समय। चूंकि, कुछ लेमिनोपैथी से समय से पहले मृत्यु हो सकती है, और लैमिन B1 (LMNB1 जीन) का उत्परिवर्तन जन्म से पहले या जन्म के समय घातक हो सकता है।[3]
जेनेटिक्स
शास्त्रीय लेमिनोपैथी वाले मरीजों में लैमिन A/C (LMNA जीन) के लिए जीन कोडिंग में उत्परिवर्तन होता है।
लेमिन B2 (LMNB2 जीन) के लिए जीन कोडिंग में उत्परिवर्तन को बैराकेर-साइमन्स सिंड्रोम से जोड़ा गया है[4] और लैमिन B1 (LMNB1 जीन) के लिए जीन कोडिंग में दोहराव ऑटोसोमल डोमिनेंट ल्यूकोडिस्ट्रॉफी का कारण बनता है।[5]
लैमिन-बाइंडिंग प्रोटीन जैसे लैमिन B रिसेप्टर (LBR जीन), एमरिन (EMD जीन) और LEM डोमेन- के लिए जीन कोडिंग में अन्य परमाणु आवरणों में निहित उत्परिवर्तन पाए गए।[6][7][8][9][10] इसमें प्रोटीन 3 (LEMD3 जीन) और प्रिलमिन ए-प्रोसेसिंग एंजाइम जैसे जिंक मेटालोप्रोटीनेज STE24 (ZMPSTE24 जीन) सम्मिलित हैं।
लैमिनोपैथियों के कारण उत्परिवर्तन में रेसेसिव जीन के साथ-साथ प्रमुख जीन एलील सम्मिलित हैं जिनमें दुर्लभ डे नोवो उत्परिवर्तन प्रमुख एलील बनाते हैं जो अपने वाहक को मृत्यु से पहले पुन: उत्पन्न करने की अनुमति नहीं देते हैं।
मानव जनसंख्या में उच्चतम आवृत्ति वाला परमाणु एनवेलोपैथी एमरी-ड्रेफस मस्कुलर डिस्ट्रॉफी है, जो एमरिन के लिए ईएमडी जीन कोडिंग में एक्स-लिंक्ड उत्परिवर्तन के कारण होता है और 100,000 लोगों में अनुमानित 1 को प्रभावित करता है।
आणविक तंत्र
लैमिन्स मध्यवर्ती फिलामेंट प्रोटीन होते हैं जो पशु कोशिकाओं में परमाणु आवरण के नीचे परमाणु लैमिना मचान बनाते हैं। वे फ़ार्नेसिल एंकर के माध्यम से परमाणु आवरण की झिल्ली से जुड़े होते हैं और आंतरिक परमाणु झिल्ली प्रोटीन जैसे लैमिन B रिसेप्टर और एमरिन के साथ संवाद करते हैं। परमाणु लैमिना जानवरों में गतिशीलता के लिए अनुकूलन प्रतीत होता है क्योंकि पौधों या कवक जैसे जीवों में लैमिन नहीं होते हैं[11] और कई लैमिनोपैथियों के लक्षणों में मांसपेशियों के दोष सम्मिलित हैं। इन जीनों में उत्परिवर्तन से फिलामेंट असेंबली में दोष हो सकते हैं और परमाणु आवरण से जुड़ाव हो सकता है और इस तरह शारीरिक रूप से तनावग्रस्त ऊतकों जैसे मांसपेशी फाइबर, हड्डी, त्वचा और संयोजी ऊतक में परमाणु आवरण की स्थिरता को संकट में डाल सकता है।[12]
एलएमएनए जीन से उत्पन्न मैसेंजर आरएनए वैकल्पिक विभाजन से निकलता है और इसे लैमिन्स A और C में अनुवादित किया जाता है। लैमिन A प्रोटीन के लिए झिल्ली एंकर संलग्न करने के लिए गर्भावस्था से निकलता है। प्रोटीन के इस संस्करण को प्रिलमिन A के रूप में भी जाना जाता है। फार्नेसिलेटेड प्रिलमिन A को आगे चलकर परिपक्व लैमिन A में मेटेलोप्रोटीनेज द्वारा अंतिम 15 एमिनो एसिड और इसके फार्नेसिलेटेड सिस्टीन को हटाकर संसाधित किया जाता है। यह लैमिन A को परमाणु आवरण झिल्ली से अलग करने और परमाणु कार्यों को पूरा करने की अनुमति देता है। लैमिनोपैथी उत्पन्न करने वाले उत्परिवर्तन विभिन्न स्तरों पर इन प्रक्रियाओं में हस्तक्षेप करते हैं।
निरर्थक और अनुचित उत्परिवर्तन
लैमिन A/C रॉड और टेल डोमेन में अनुचित उत्तराधिकारी आनुवंशिक विकारों की विस्तृत श्रृंखला का कारण हैं, यह सुझाव देते हुए कि लैमिन A/C प्रोटीन में अलग-अलग कार्यात्मक डोमेन होते हैं जो विभिन्न सेल वंशावली के देखभाल और अखंडता के लिए आवश्यक हैं। लैमिन A और न्यूक्लियर आवरण प्रोटीन एमेरिन के बीच इंटरेक्शन मांसपेशियों की कोशिकाओं में महत्वपूर्ण प्रतीत होता है, लैमिन में कुछ उत्परिवर्तन के साथ एमरिन में उत्परिवर्तन की नकल करता है और एमरी-ड्रेफस मस्कुलर डिस्ट्रॉफी का कारण बनता है। अलग-अलग उत्परिवर्तन प्रमुख-नकारात्मक और अप्रभावी एलील्स की ओर ले जाते हैं। लैमिन रॉड डोमेन में उत्परिवर्तन, लैमिन A और एमरिन दोनों के गलत स्थानीयकरण की ओर ले जाता है, जो मस्कुलर डिस्ट्रॉफी और कार्डियोमायोपैथी के ऑटोसोमल प्रमुख रूपों वाले रोगियों में होता है।
लैमिनेट B1 में उत्परिवर्तन के साथ अधिकांश लैमिनेट B उत्परिवर्तन घातक प्रतीत होते हैं, जिससे चूहों में जन्म के समय मृत्यु हो जाती है।[3] 2006 में, अधिग्रहीत आंशिक लिपोडिस्ट्रॉफी वाले रोगियों में लैमिन B2 मिसेंस उत्परिवर्तन की पहचान की गई थी।[13]
बिंदु उत्परिवर्तन
लैमिन A/C में सबसे सामान्य उत्परिवर्तन समयुग्मजी Arg527His (527 की स्थिति में हिस्टीडाइन द्वारा प्रतिस्थापित आर्गिनिन) एलएमएनए जीन के एक्सॉन 9 में प्रतिस्थापन है।[14] अन्य ज्ञात उत्परिवर्तन Ala529Val और Arg527His/Val440Met हैं।[15] इसके अतिरिक्त, कुछ उत्परिवर्तन जैसे Arg527Cys, Lys542Asn, Arg471Cys, Thr528Met/Met540Thr, और Arg471Cys/Arg527Cys, Arg527Leu का परिणाम प्रोजेरिया जैसी विशेषताओं के साथ मेन्डिबुलोएक्रल डिसप्लेसिया होता है।[16]
विभाजन दोष
प्रोजेरिया उत्पन्न करने वाले उत्परिवर्तन स्प्लिसिंग (आनुवांशिकी) एलएमएनए एमआरएनए में दोषपूर्ण हैं, इसलिए असामान्य लैमिन A प्रोटीन का उत्पादन करते हैं, जिसे प्रोजेरिन भी कहा जाता है। उत्परिवर्तन जीन के एक्सॉन 11 के अंदर क्रिप्टिक ब्याह स्थल को सक्रिय करते हैं, जिससे प्रिलमिन A पर प्रसंस्करण स्थल को हटा दिया जाता है।[17] इसके परिणामस्वरूप प्रोजेरिन का संचय होता है जो लैमिन A में परिपक्व होने में असमर्थ होता है, जिससे मिशापेन नाभिक होता है। मिसप्लिसिंग भी एक्सॉन 11 के पूर्ण या आंशिक हानि की ओर जाता है और इसके परिणामस्वरूप नवजात घातक तंग त्वचा संकुचन सिंड्रोम में छोटा प्रीलामिन A प्रोटीन होता है।[18]
प्रसंस्करण दोष
चूंकि मेटालोप्रोटीनेज एसटीई24 को प्रिलमिन A को परिपक्व लैमिन A में संसाधित करने की आवश्यकता होती है, इसलिए इस जीन में उत्परिवर्तन प्रोटीज गतिविधि को समाप्त कर देता है, जिसके कारण लैमिनोपैथियों के समान दोष होते हैं, जो प्रिलमिन A के कारण काटे गए प्रसंस्करण स्थलों के कारण होता है। ZMPSTE24 उत्परिवर्तन वाले रोगियों में लक्षण मंडिबुलोएक्रल डिस्प्लेसिया, प्रोजेरॉइड उपस्थिति, और सामान्यीकृत लिपोडिस्ट्रोफी से लेकर शिशु-घातक प्रतिबंधात्मक डर्मोपैथी सम्मिलित हैं।
जीन खुराक प्रभाव
ऑटोसोमल प्रमुख ल्यूकोडिस्ट्रोफी के स्थिति में, रोग लैमिन B जीन LMNB1 के दोहराव से जुड़ा हुआ है। कोशिकाओं में लैमिन B की स्पष्ट खुराक परमाणु अखंडता के लिए महत्वपूर्ण प्रतीत होती है क्योंकि लैमिन B की बढ़ी हुई अभिव्यक्ति ड्रोसोफिला में अपक्षयी फेनोटाइप का कारण बनती है और असामान्य परमाणु आकृति विज्ञान की ओर ले जाती है।[19]
स्व - प्रतिरक्षी रोग
ऑटोइम्यून रोगों वाले कुछ व्यक्तियों के सेरा में लैमिन्स के विरुद्ध एंटीबॉडी का पता लगाया जाता है।[20]
डीएनए का पुनर्निर्माण
ए-टाइप लैमिन्स प्रोटीन के स्तर को बनाए रखते हुए आनुवंशिक स्थिरता को बढ़ावा देते हैं जिनकी गैर-होमोलॉगस एंड जॉइनिंग और होमोलॉगस रीकॉम्बिनेशन की प्रक्रियाओं के समय डीएनए डबल-स्ट्रैंड ब्रेक रिपेयर में महत्वपूर्ण भूमिका होती है।[21] लैमिन A (एलएमएनए) में उत्परिवर्तन हचिंसन-गिलफोर्ड प्रोजेरिया सिंड्रोम का कारण बनता है, जो समय से पहले बूढ़ा होने का नाटकीय रूप है।[17] प्रिलमिन A की परिपक्वता के लिए कमी वाली माउस कोशिकाएं डीएनए की क्षति और गुणसूत्र विपथन को बढ़ाती हैं और डीएनए हानिकारक एजेंटों के प्रति अधिक संवेदनशील होती हैं।[22] ए-टाइप लैमिन्स दोषपूर्ण होने पर डीएनए क्षति की पर्याप्त रूप से पुनर्निर्माण करने में असमर्थता समय से पहले उम्र बढ़ने के कुछ पहलुओं के लिए उत्तरदायी है।
निदान
ज्ञात लेमिनोपथियों के प्रकार और अन्य परमाणु आवरण
| सिंड्रोम | ओमिम आईडी | लक्षण | उत्परिवर्तन में | में पहचाना गया |
|---|---|---|---|---|
| अटिक वर्नर सिंड्रोम | 277700 | सामान्य वर्नर सिंड्रोम की तुलना में बढ़ी हुई गंभीरता के साथ प्रोजेरिया | लेमिन A/C | 2003[23] |
| बारराक्वेर–सिमन्स सिंड्रोम | 608709 | लिपोडिस्ट्रॉफी | लेमिन B2 | 2006[13] |
| बुस्चके–ओलेंडोर्फ सिंड्रोम | 166700 | कंकाल डिस्प्लेसिया, त्वचा के घाव | प्रोटीन 3 युक्त LEM डोमेन (लेमिन- बाइंडिंग प्रोटीन) | 2004[24] |
| कार्डियोमायोपैथी, पतला, क्वाड्रिसेप्स मायोपैथी के साथ | 607920 | कार्डियोमायोपैथी | लेमिन A/C | 2003[26] |
| चारकोट -मैरी–दांत रोग, एक्सोनल, टाइप 2B1 | 605588 | न्यूरोपैथी | लेमिन A/C | 2002[27] |
| एमरी -ड्रेइफ़स मांसपेशीय दुर्विकास, एक्स-लिंक्ड (ईडीएमडी) | 310300 | कंकाल और हृदय मांसपेशीय दुर्विकास | एमरिन (लेमिन- बाइंडिंग प्रोटीन) | 1996,[28] 2000[29] |
| एमरी -ड्रेइफ़स मांसपेशीय दुर्विकास, ऑटोसोमल डोमिनेंट (EDMD2) | 181350 | कंकाल और हृदय मांसपेशीय दुर्विकास | लेमिन A/C | 1999[30] |
| एमरी -ड्रेइफ़स मांसपेशीय दुर्विकास, ओटोसोमल रेसेसिव(EDMD3) | 604929 | कंकाल और हृदय मांसपेशीय दुर्विकास | लेमिन A/C | 2000[31] |
| डनिगन प्रकार (FPLD) का पारिवारिक आंशिक लिपोडिस्ट्रॉफी | 151660 | लिपोट्रॉफिक डायबिटीज | लेमिन A/C | 2002[32] |
| ग्रीनबर्ग डिस्प्लेसिया | 215140 | कंकाल डिस्प्लेसिया | लेमिन B रिसेप्टर | 2003[33] |
| हचिंसन -गिलफोर्ड प्रोजेरिया सिंड्रोम (HGPS) | 176670 | प्रोजेरिया | लेमिन A/C | 2003[17] |
| ल्यूकोडिस्ट्रोफी, डिमाइलेटिंग, वयस्क-शुरुआत, ऑटोसोमल डोमिनेंट (एडीएलडी) | 169500 | केंद्रीय तंत्रिका तंत्र को प्रभावित करने वाले प्रगतिशील डिमाइलेटिंग विकार | लेमिन B1 (टंडम जीन दोहराव) | 2006[19] |
| लिम्ब-गर्डल मस्कुलर डिस्ट्रोफी (LGMD1B) प्रकार 1B के साथ | 159001 | कूल्हों और कंधों का, मांसपेशीय दुर्विकासकार्डियोमायोपैथी | लेमिन A/C | 2000[34] |
| डायबिटीज, हेपेटिक स्टीटोसिस, हाइपरट्रॉफिक कलेरा, के साथ लिपोआट्रोफी, फ्यूकोमेलनोडर्मिक पैपुल्स (एलडीएचसीपी) | 608056 | लिपोआट्रोफिक डायबिटीज, फैटी लिवर, हाइपरट्रॉफिक कार्डियोमायोपैथी, त्वचा के घाव | लेमिन A/C | 2003[35] |
| मैंडिबुलोक्राल डिस्प्लेसिया लिपोडिस्ट्रॉफी (एमएडीए) प्रकार A के साथ | 248370 | डिस्प्लेसिया और लिपोडिस्ट्रॉफी | लेमिन A/C | 2002[14] |
| मैंडिबुलोक्राल डिस्प्लेसिया लिपोडिस्ट्रॉफी (एमएडीबी) प्रकार B के साथ | 608612 | डिस्प्लेसिया और लिपोडिस्ट्रॉफी | जिंक मेटालोप्रोटीज STE24 (पूर्व-प्रसंस्करण एंजाइम) | 2003[36] |
| पेल्गर -हेट विसंगति (पीएचए) | 169400 | माइलोडिसप्लेसिया | लेमिन B रिसेप्टर | 2002[37] |
| प्रतिबंधात्मक डर्मोपैथी, घातक | 275210 | त्वच्य रोग | लेमिन A/C या जस्ता मेटालोप्रोटीज STE24 (पूर्व-प्रसंस्करण एंजाइम) | 2004[18] |
उपचार
वर्तमान में, लैमिनोपैथी का कोई उपचार नहीं है और उपचार अधिक सीमा तक रोगसूचक और सहायक है। फिजिकल थेरेपी और सुधारात्मक आर्थोपेडिक सर्जरी मस्कुलर डिस्ट्रॉफी वाले रोगियों के लिए सहायक हो सकती है। हृदय की मांसपेशियों को प्रभावित करने वाली लैमिनोपेथी हृदय की विफलता का कारण बन सकती है जिसमें एसीई अवरोधक, बीटा–ब्लॉकर्स और एल्डोस्टेरोन विरोधी सहित दवाओं के साथ उपचार की आवश्यकता होती है, जबकि इन रोगियों में अधिकांशतः होने वाली असामान्य असामान्य हृदय लय पेसमेकर या इम्प्लांटेबल डीफिब्रिलेटर की आवश्यकता हो सकती है।[38] न्यूरोपैथी के उपचार में दौरे और लोच के लिए दवाएं सम्मिलित हो सकती हैं।
अनुसंधान
लैमिनोपैथियों में विषाक्त प्रोजेरिन गठन के आणविक तंत्र को उजागर करने में हाल की प्रगति ने समय से पहले उम्र बढ़ने के लिए लक्षित उपचार के विकास की संभावना खोल दी है। प्रीलामिन A और इसके पैथोलॉजिकल फॉर्म प्रोजेरिन का फार्नेसिलेशन एंजाइम फार्नेसिल ट्रांसफ़ेरेज़ द्वारा किया जाता है। प्रोजेरिया के लिए दो माउस मॉडल सिस्टम में लक्षणों को कम करने और प्रोजेरॉइड सेल संस्कृतियों में असामान्य परमाणु आकारिकी को वापस लाने के लिए फ़ार्नेसिल ट्रांसफ़रेज़ इनहिबिटर (एफटीआई) का प्रभावी ढंग से उपयोग किया जा सकता है। दो मौखिक एफटीआई, लोनाफर्निब और टाइपिफर्निब, पहले से ही मनुष्यों में एंटी-ट्यूमर दवा के रूप में उपयोग में हैं और लैमिनोपैथिक प्रोजेरिया वाले बच्चों के लिए उपचार के मार्ग बन सकते हैं। ऑस्टियोपोरोसिस के उपचार में उपयोग की जाने वाली नाइट्रोजन युक्त बिसफ़ॉस्फ़ेट दवाएं फार्नेसिल पायरोफॉस्फेट के उत्पादन को कम करती हैं और इस प्रकार प्रिलमिन A फ़ार्नेसिलेशन को प्रिलमिन करती हैं। इन दवाओं का परीक्षण प्रोजेरिया के उपचार में भी उपयोगी सिद्ध हो सकता है। प्रभावित कोशिकाओं में प्रोगेरिन संश्लेषण को बाधित करने के लिए एंटी-सेन्स ऑलिगोन्यूक्लियोटाइड्स का उपयोग एंटी-प्रोजेरिन दवाओं के विकास में वर्तमान शोध का एक और विधि है।[39][40]
संदर्भ
- ↑ Paradisi M, McClintock D, Boguslavsky RL, Pedicelli C, Worman HJ, Djabali K (2005). "हचिंसन -जिलफोर्ड प्रोगेरिया सिंड्रोम में डर्मल फाइब्रोब्लास्ट्स लामिन के साथ एक G608G म्यूटेशन में डिस्मॉर्फिक नाभिक होता है और गर्मी के तनाव के लिए हाइपरसेंसिव होते हैं". BMC Cell Biol. 6: 27. doi:10.1186/1471-2121-6-27. PMC 1183198. PMID 15982412.
- ↑ Nagano A, Arahata K (2000). "Nuclear envelope proteins and associated diseases". Curr. Opin. Neurol. 13 (5): 533–9. doi:10.1097/00019052-200010000-00005. PMID 11073359. S2CID 12550140.
- ↑ 3.0 3.1 Vergnes L, Peterfy M, Bergo MO, Young SG, Reue K (2004). "Lamin B1 is required for mouse development and nuclear integrity". Proc. Natl. Acad. Sci. U.S.A. 101 (28): 10428–33. Bibcode:2004PNAS..10110428V. doi:10.1073/pnas.0401424101. PMC 478588. PMID 15232008.
- ↑ Hegele RA, Cao H, Liu DM, Costain GA, Charlton-Menys V, Rodger NW, Durrington PN (2006). "Sequencing of the reannotated LMNB2 gene reveals novel mutations in patients with acquired partial lipodystrophy". Am J Hum Genet. 79 (2): 383–389. doi:10.1086/505885. PMC 1559499. PMID 16826530.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Padiath QS, Saigoh K, Schiffmann R, Asahara H, Yamada T, Koeppen A, Hogan K, Ptácek LJ, Fu YH (2006). "Lamin B1 duplications cause autosomal dominant leukodystrophy". Nat Genet. 38 (10): 1114–1123. doi:10.1038/ng1872. PMID 16951681. S2CID 25336497.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Hoffmann, Katrin; Dreger, Christine K.; Olins, Ada L.; Olins, Donald E.; Shultz, Leonard D.; Lucke, Barbara; Karl, Hartmut; Kaps, Reinhard; Müller, Dietmar; Vayá, Amparo; Aznar, Justo (2002-07-15). "Mutations in the gene encoding the lamin B receptor produce an altered nuclear morphology in granulocytes (Pelger–Huët anomaly)". Nature Genetics. 31 (4): 410–414. doi:10.1038/ng925. ISSN 1061-4036. PMID 12118250. S2CID 6020153.
- ↑ Waterham, Hans R.; Koster, Janet; Mooyer, Petra; Noort, Gerard van; Kelley, Richard I.; Wilcox, William R.; Ronald Wanders, J.A.; Raoul Hennekam, C.M.; Jan Oosterwijk, C. (April 2003). "Autosomal Recessive HEM/Greenberg Skeletal Dysplasia Is Caused by 3β-Hydroxysterol Δ14-Reductase Deficiency Due to Mutations in the Lamin B Receptor Gene". The American Journal of Human Genetics. 72 (4): 1013–1017. doi:10.1086/373938. ISSN 0002-9297. PMC 1180330. PMID 12618959.
- ↑ Greenberg, Cheryl R.; Rimoin, David L.; Gruber, Helen E.; DeSa, D. J. B.; Reed, M.; Lachman, Ralph S.; Optiz, John M.; Reynolds, James F. (March 1988). "A new autosomal recessive lethal chondrodystrophy with congenital hydrops". American Journal of Medical Genetics. 29 (3): 623–632. doi:10.1002/ajmg.1320290321. ISSN 0148-7299. PMID 3377005.
- ↑ Shultz, L. D. (2003-01-01). "Mutations at the mouse ichthyosis locus are within the lamin B receptor gene: a single gene model for human Pelger-Huet anomaly". Human Molecular Genetics. 12 (1): 61–69. doi:10.1093/hmg/ddg003. ISSN 1460-2083. PMID 12490533.
- ↑ Young, Alexander Neil; Perlas, Emerald; Ruiz-Blanes, Nerea; Hierholzer, Andreas; Pomella, Nicola; Martin-Martin, Belen; Liverziani, Alessandra; Jachowicz, Joanna W.; Giannakouros, Thomas; Cerase, Andrea (2021-04-12). "Deletion of LBR N-terminal domains recapitulates Pelger-Huet anomaly phenotypes in mouse without disrupting X chromosome inactivation". Communications Biology. 4 (1): 478. doi:10.1038/s42003-021-01944-2. ISSN 2399-3642. PMC 8041748. PMID 33846535.
- ↑ Mans BJ, Anantharaman V, Aravind L, Koonin EV (2004). "Comparative genomics, evolution and origins of the nuclear envelope and nuclear pore complex". Cell Cycle. 3 (12): 1612–37. doi:10.4161/cc.3.12.1316. PMID 15611647.
- ↑ Houben F, Ramaekers FC, Snoeckx LH, Broers JL (May 2007). "Role of nuclear lamina-cytoskeleton interactions in the maintenance of cellular strength". Biochim. Biophys. Acta. 1773 (5): 675–86. doi:10.1016/j.bbamcr.2006.09.018. PMID 17050008.
- ↑ 13.0 13.1 Hegele RA, Cao H, Liu DM, Costain GA, Charlton-Menys V, Rodger NW, Durrington PN (2006). "Sequencing of the reannotated LMNB2 gene reveals novel mutations in patients with acquired partial lipodystrophy". Am. J. Hum. Genet. 79 (2): 383–9. doi:10.1086/505885. PMC 1559499. PMID 16826530.
- ↑ 14.0 14.1 Novelli G, Muchir A, Sangiuolo F, Helbling-Leclerc A, D'Apice MR, Massart C, Capon F, Sbraccia P, Federici M, Lauro R, Tudisco C, Pallotta R, Scarano G, Dallapiccola B, Merlini L, Bonne G (2002). "Mandibuloacral dysplasia is caused by a mutation in LMNA-encoding lamin A/C". Am. J. Hum. Genet. 71 (2): 426–31. doi:10.1086/341908. PMC 379176. PMID 12075506.
- ↑ Zirn B, Kress W, Grimm T, Berthold LD, et al. (2008). "Association of homozygous LMNA mutation R471C with new phenotype: mandibuloacral dysplasia, progeria, and rigid spine muscular dystrophy". Am J Med Genet A. 146A (8): 1049–1054. doi:10.1002/ajmg.a.32259. PMID 18348272. S2CID 205309256.
- ↑ Al-Haggar M, Madej-Pilarczyk A, Kozlowski L, Bujnicki JM, Yahia S, Abdel-Hadi D, Shams A, Ahmad N, Hamed S, Puzianowska-Kuznicka M (2012). "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome". Eur J Hum Genet. 20 (11): 1134–40. doi:10.1038/ejhg.2012.77. PMC 3476705. PMID 22549407.
- ↑ 17.0 17.1 17.2 Eriksson M, Brown WT, Gordon LB, Glynn MW, Singer J, Scott L, Erdos MR, Robbins CM, Moses TY, Berglund P, Dutra A, Pak E, Durkin S, Csoka AB, Boehnke M, Glover TW, Collins FS (2003). "Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome". Nature. 423 (6937): 293–8. Bibcode:2003Natur.423..293E. doi:10.1038/nature01629. hdl:2027.42/62684. PMID 12714972. S2CID 4420150.
- ↑ 19.0 19.1 Padiath QS, Saigoh K, Schiffmann R, Asahara H, Yamada T, Koeppen A, Hogan K, Ptacek LJ, Fu YH (2006). "Lamin B1 duplications cause autosomal dominant leukodystrophy". Nature Genetics. 38 (10): 1114–1123. doi:10.1038/ng1872. PMID 16951681. S2CID 25336497.
- ↑ Lassoued K, Guilly MN, Danon F, Andre C, Dhumeaux D, Clauvel JP, Brouet JC, Seligmann M, Courvalin JC (1988). "Antinuclear autoantibodies specific for lamins. Characterization and clinical significance". Ann Intern Med. 108 (6): 829–3. doi:10.7326/0003-4819-108-6-829. PMID 3285745.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Redwood AB, Perkins SM, Vanderwaal RP, Feng Z, Biehl KJ, Gonzalez-Suarez I, Morgado-Palacin L, Shi W, Sage J, Roti-Roti JL, Stewart CL, Zhang J, Gonzalo S (2011). "A dual role for A-type lamins in DNA double-strand break repair". Cell Cycle. 10 (15): 2549–60. doi:10.4161/cc.10.15.16531. PMC 3180193. PMID 21701264.
- ↑ Liu B, Wang J, Chan KM, Tjia WM, Deng W, Guan X, Huang JD, Li KM, Chau PY, Chen DJ, Pei D, Pendas AM, Cadiñanos J, López-Otín C, Tse HF, Hutchison C, Chen J, Cao Y, Cheah KS, Tryggvason K, Zhou Z (2005). "Genomic instability in laminopathy-based premature aging". Nat. Med. 11 (7): 780–5. doi:10.1038/nm1266. PMID 15980864. S2CID 11798376.
- ↑ Chen L, Lee L, Kudlow BA, Dos Santos HG, Sletvold O, Shafeghati Y, Botha EG, Garg E, Hanson NB, Martin GM, Mian IS, Kennedy BK, Oshima J (2003). "LMNA mutations in atypical Werner's syndrome". Lancet. 362 (9382): 440–5. doi:10.1016/S0140-6736(03)14069-X. PMID 12927431. S2CID 21980784.
- ↑ Hellemans J, Preobrazhenska O, Willaert A, Debeer P, Verdonk PCM, Costa T, Janssens K, Menten B, Van Roy N, Vermeulen SJT, Savarirayan R, Van Hul W, et al. (2004). "Loss-of-function mutations in LEMD3 result in osteopoikilosis, Buschke–Ollendorff syndrome and melorheostosis". Nature Genetics. 36 (11): 1213–8. doi:10.1038/ng1453. PMID 15489854.
- ↑ Fatkin D, MacRae C, Sasaki T, Wolff MR, Porcu M, Frenneaux M, Atherton J, Vidaillet HJ, Spudich S, De Girolami U, Seidman JG, Seidman CE (1999). "Missense mutations in the rod domain of the lamin A/C gene as causes of dilated cardiomyopathy and conduction-system disease" (PDF). N. Engl. J. Med. 341 (23): 1715–24. doi:10.1056/NEJM199912023412302. PMID 10580070. S2CID 22942654.
- ↑ Charniot JC, Pascal C, Bouchier C, Sebillon P, Salama J, Duboscq-Bidot L, Peuchmaurd M, Desnos M, Artigou JY, Komajda M (2003). "Functional consequences of an LMNA mutation associated with a new cardiac and non-cardiac phenotype". Hum. Mutat. 21 (5): 473–81. doi:10.1002/humu.10170. PMID 12673789. S2CID 32614095.
- ↑ De Sandre-Giovannoli A, Chaouch M, Kozlov S, Vallat JM, Tazir M, Kassouri N, Szepetowski P, Hammadouche T, Vandenberghe A, Stewart CL, Grid D, Levy N (2002). "Homozygous defects in LMNA, encoding lamin A/C nuclear-envelope proteins, cause autosomal recessive axonal neuropathy in human (Charcot–Marie–Tooth disorder type 2) and mouse". Am. J. Hum. Genet. 70 (3): 726–36. doi:10.1086/339274. PMC 384949. PMID 11799477.
- ↑ Manilal S, Nguyen TM, Sewry CA, Morris GE (1996). "The Emery–Dreifuss muscular dystrophy protein, emerin, is a nuclear membrane protein". Hum. Mol. Genet. 5 (6): 801–8. doi:10.1093/hmg/5.6.801. PMID 8776595.
- ↑ Clements L, Manilal S, Love DR, Morris GE (2000). "Direct interaction between emerin and lamin A". Biochem. Biophys. Res. Commun. 267 (3): 709–14. doi:10.1006/bbrc.1999.2023. PMID 10673356.
- ↑ Bonne G, Di Barletta MR, Varnous S, Becane HM, Hammouda EH, Merlini L, Muntoni F, Greenberg CR, Gary F, Urtizberea JA, Duboc D, Fardeau M, Toniolo D, Schwartz K (1999). "Mutations in the gene encoding lamin A/C cause autosomal dominant Emery–Dreifuss muscular dystrophy". Nature Genetics. 21 (3): 285–8. doi:10.1038/6799. PMID 10080180. S2CID 7327176.
- ↑ Raffaele di Barletta M, Ricci E, Galluzzi G, Tonali P, Mora M, Morandi L, Romorini A, Voit T, Orstavik KH, Merlini L, Trevisan C, Biancalana V, Hausmanowa-Petrusewicz I, Bione S, Ricotti R, Schwartz K, Bonne G, Toniolo D (2000). "Different mutations in the LMNA gene cause autosomal dominant and autosomal recessive Emery–Dreifuss muscular dystrophy". Am. J. Hum. Genet. 66 (4): 1407–12. doi:10.1086/302869. PMC 1288205. PMID 10739764.
- ↑ Cao H, Hegele RA (2002). "Nuclear lamin A/C R482Q mutation in Canadian kindreds with Dunnigan-type familial partial lipodystrophy". Hum. Mol. Genet. 9 (1): 109–12. doi:10.1093/hmg/9.1.109. PMID 10587585.
- ↑ Waterham HR, Koster J, Mooyer P, van Noort G, Kelley RI, Wilcox WR, Wanders RJ, Hennekam RC, Oosterwijk JC (2003). "Autosomal recessive HEM/Greenberg skeletal dysplasia is caused by 3-beta-hydroxysterol delta(14)-reductase deficiency due to mutations in the lamin B receptor gene". Am. J. Hum. Genet. 72 (4): 1013–17. doi:10.1086/373938. PMC 1180330. PMID 12618959.
- ↑ Muchir A, Bonne G, van der Kooi AJ, van Meegen M, Baas F, Bolhuis PA, de Visser M, Schwartz K (2000). "Identification of mutations in the gene encoding lamins A/C in autosomal dominant limb girdle muscular dystrophy with atrioventricular conduction disturbances (LGMD1B)". Hum. Mol. Genet. 9 (9): 1453–9. doi:10.1093/hmg/9.9.1453. PMID 10814726.
- ↑ Caux F, Dubosclard E, Lascols O, Buendia B, Chazouilleres O, Cohen A, Courvalin JC, Laroche L, Capeau J, Vigouroux C, Christin-Maitre S (2003). "A new clinical condition linked to a novel mutation in lamins A and C with generalized lipoatrophy, insulin-resistant diabetes, disseminated leukomelanodermic papules, liver steatosis, and cardiomyopathy". J. Clin. Endocrinol. Metab. 88 (3): 1006–13. doi:10.1210/jc.2002-021506. PMID 12629077.
- ↑ Agarwal AK, Fryns JP, Auchus RJ, Garg A (2003). "Zinc metalloproteinase, ZMPSTE24, is mutated in mandibuloacral dysplasia". Hum. Mol. Genet. 12 (16): 1995–2001. doi:10.1093/hmg/ddg213. PMID 12913070.
- ↑ Hoffmann K, Dreger CK, Olins AL, Olins DE, Shultz LD, Lucke B, Karl H, Kaps R, Muller D, Vaya A, Aznar J, Ware RE, Cruz NS, Lindner TH, Herrmann H, Reis A, Sperling K (2002). "Mutations in the gene encoding the lamin B receptor produce an altered nuclear morphology in granulocytes (Pelger-Huet anomaly)". Nature Genetics. 31 (4): 410–4. doi:10.1038/ng925. PMID 12118250. S2CID 6020153.
- ↑ Captur, Gabriella; Arbustini, Eloisa; Bonne, Gisèle; Syrris, Petros; Mills, Kevin; Wahbi, Karim; Mohiddin, Saidi A.; McKenna, William J.; Pettit, Stephen (2017-11-25). "Lamin and the heart" (PDF). Heart. 104 (6): 468–479. doi:10.1136/heartjnl-2017-312338. ISSN 1468-201X. PMID 29175975. S2CID 3563474.
- ↑ Rusinal AE, Sinensky MS (2006). "Farnesylated lamins, progeroid syndromes and farnesyl transferase inhibitors". J. Cell Sci. 119 (Pt 16): 3265–72. doi:10.1242/jcs.03156. PMID 16899817.
- ↑ Meta M, Yang SH, Bergo MO, Fong LG, Young SG (2006). "Protein farnesyltransferase inhibitors and progeria". Trends Mol. Med. 12 (10): 480–7. doi:10.1016/j.molmed.2006.08.006. PMID 16942914.