विद्युत सिनैप्स: Difference between revisions
No edit summary |
No edit summary |
||
| Line 14: | Line 14: | ||
| Lymph = | | Lymph = | ||
}} | }} | ||
विद्युत | '''विद्युत सिनैप्स''' दो निकटम [[न्यूरॉन|न्यूरॉन्स]] के मध्य ऐसा यांत्रिक और विद्युत [[कंडक्टर (सामग्री)|प्रवाहकीय]] लिंक है जो पूर्व और पोस्टसिनैप्सी न्यूरॉन्स के मध्य संकीर्ण अंतराल पर बनता है जिसे [[गैप जंक्शन]] के रूप में जाना जाता है। गैप जंक्शनों पर, ऐसी कोशिकाएं दूसरे कोशिकाओं के लगभग 3.8 nm के अंदर पहुंचती हैं,<ref name=Kandel00>{{cite book |last1=Kandel |first1=ER |last2=Schwartz |first2=JH |last3=Jessell |first3=TM |title=Principles of Neural Science |publisher=McGraw-Hill |location=New York |year=2000 |isbn=978-0-8385-7701-1 |edition=4th |author-link=Eric R. Kandel|title-link=Principles of Neural Science }}</ref> 20- से 40-नैनोमीटर की दूरी की अपेक्षा में अधिक अल्प दूरी जो रासायनिक सिनैप्स पर कोशिकाओं को भिन्न करती है।<ref name=Hormuzdi04>{{cite journal |vauthors=Hormuzdi SG, Filippov MA, Mitropoulou G, Monyer H, Bruzzone R |title=Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks |journal=Biochim. Biophys. Acta |volume=1662 |issue=1–2 |pages=113–37 |date=March 2004 |pmid=15033583 |doi=10.1016/j.bbamem.2003.10.023 |doi-access=free }}</ref> अनेक [[जानवर|जानवरों]] में{{specify}} विद्युत सिनैप्स-आधारित प्रणालियाँ रासायनिक सिनैप्स के साथ सह-अस्तित्व में हैं। | ||
रासायनिक | रासायनिक सिनैप्स की अपेक्षा में, विद्युत सिनैप्स तंत्रिका आवेगों को तीव्रता से संचालित करते हैं, लेकिन, रासायनिक सिनैप्स के विपरीत, उनमें लाभ (इलेक्ट्रॉनिक्स) की अल्पता होती है- पोस्टसिनैप्सी न्यूरॉन में संकेत मूल न्यूरॉन की अपेक्षा में समान या छोटा होता है। विद्युत सिनैप्स को मानने के लिए मूलभूत आधार उन कनेक्शनों के नीचे आते हैं जो दो न्यूरॉन्स के मध्य गैप जंक्शन में स्थित होते हैं। विद्युत सिनैप्स प्रायः तंत्रिका तंत्र में पाए जाते हैं जिन्हें सबसे तीव्र संभव प्रतिक्रिया की आवश्यकता होती है, जैसे कि रक्षात्मक सजगता है। विद्युत सिनैप्स की महत्वपूर्ण विशेषता यह है कि वे अधिकांशतः द्विदिश होते हैं (किसी भी दिशा में आवेग संचरण की अनुमति देते हैं)।<ref name="Purves">{{cite book | author = Purves, Dale | author2 = George J. Augustine | author3 = David Fitzpatrick | author4 = William C. Hall | author5 = Anthony-Samuel LaMantia | author6 = James O. McNamara | author7 = Leonard E. White | name-list-style = amp | title = Neuroscience | edition = 4th | publisher = Sinauer Associates | pages = 85–88 | year = 2008 | isbn = 978-0-87893-697-7}}</ref><ref>{{cite book | author = Purves, Dale | author2 = George J. Augustine | author3 = David Fitzpatrick | author4 = William C. Hall | author5 = Anthony-Samuel LaMantia | author6 = Richard D. Mooney | author7 = Leonard E. White | author8 = Michael L. Platt | name-list-style = amp | title = Neuroscience | edition = 6th | publisher = Oxford University Press | pages = 86–87 | year = 2018 | isbn = 978-1605353807}}</ref> | ||
== संरचना == | == संरचना == | ||
प्रत्येक गैप जंक्शन (उर्फ नेक्सस जंक्शन) में अनेक गैप जंक्शन [[आयन चैनल|चैनल]] होते हैं जो दोनों कोशिकाओं के [[कोशिका झिल्ली|प्लाज्मा झिल्ली]] को पार करते हैं।<ref name=Gibson05>{{cite journal |vauthors=Gibson JR, Beierlein M, Connors BW |title=Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4 |journal=J. Neurophysiol. |volume=93 |issue=1 |pages=467–80 |date=January 2005 |pmid=15317837 |doi=10.1152/jn.00520.2004 }}</ref> लगभग 1.2 से 2.0 nm के लुमेन व्यास के साथ,<ref name=Hormuzdi04/><ref name=Bennet04>{{cite journal |doi=10.1016/S0896-6273(04)00043-1 |vauthors=Bennett MV, Zukin RS |title=Electrical coupling and neuronal synchronization in the Mammalian brain |journal=Neuron |volume=41 |issue=4 |pages=495–511 |date=February 2004 |pmid=14980200 |s2cid=18566176 |doi-access=free }}</ref> गैप जंक्शन चैनल का छिद्र इतना चौड़ा होता है कि आयनों और यहां तक कि मध्यम आकार के अणुओं जैसे सिग्नलिंग अणुओं को किसी कोशिका से दूसरी कोशिका में प्रवाहित करने की अनुमति देता है,<ref name=Hormuzdi04/><ref>{{harvnb|Kandel|Schwartz|Jessell|2000|pp=178–180}}</ref> जिससे दो कोशिकाओं के [[कोशिका द्रव्य]] को जोड़ा जा सके। इस प्रकार जब किसी कोशिका की [[झिल्ली क्षमता]] में परिवर्तन होता है, तो [[आयन]] उस कोशिका से दूसरी कोशिका में जा सकते हैं, उनके साथ धनात्मक आवेश होता है और पश्च- | प्रत्येक गैप जंक्शन (उर्फ नेक्सस जंक्शन) में अनेक गैप जंक्शन [[आयन चैनल|चैनल]] होते हैं जो दोनों कोशिकाओं के [[कोशिका झिल्ली|प्लाज्मा झिल्ली]] को पार करते हैं।<ref name=Gibson05>{{cite journal |vauthors=Gibson JR, Beierlein M, Connors BW |title=Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4 |journal=J. Neurophysiol. |volume=93 |issue=1 |pages=467–80 |date=January 2005 |pmid=15317837 |doi=10.1152/jn.00520.2004 }}</ref> लगभग 1.2 से 2.0 nm के लुमेन व्यास के साथ,<ref name=Hormuzdi04/><ref name=Bennet04>{{cite journal |doi=10.1016/S0896-6273(04)00043-1 |vauthors=Bennett MV, Zukin RS |title=Electrical coupling and neuronal synchronization in the Mammalian brain |journal=Neuron |volume=41 |issue=4 |pages=495–511 |date=February 2004 |pmid=14980200 |s2cid=18566176 |doi-access=free }}</ref> गैप जंक्शन चैनल का छिद्र इतना चौड़ा होता है कि आयनों और यहां तक कि मध्यम आकार के अणुओं जैसे सिग्नलिंग अणुओं को किसी कोशिका से दूसरी कोशिका में प्रवाहित करने की अनुमति देता है,<ref name=Hormuzdi04/><ref>{{harvnb|Kandel|Schwartz|Jessell|2000|pp=178–180}}</ref> जिससे दो कोशिकाओं के [[कोशिका द्रव्य]] को जोड़ा जा सके। इस प्रकार जब किसी कोशिका की [[झिल्ली क्षमता]] में परिवर्तन होता है, तो [[आयन]] उस कोशिका से दूसरी कोशिका में जा सकते हैं, उनके साथ धनात्मक आवेश होता है और पश्च-सिनैप्सी कोशिका का विध्रुवण होता है। | ||
गैप जंक्शन फ़नल दो हेमी-चैनलों से बने होते हैं जिन्हें कशेरूकियों में [[संबंध]] कहा जाता है, [[निष्कर्ष]] में प्रत्येक कोशिका द्वारा योगदान दिया जाता है।<ref name=Hormuzdi04/><ref name=Bennet04/><ref>{{harvnb|Kandel|Schwartz|Jessell|2000|p=178}}</ref> सम्बन्ध छह 7.5 nm लंबे, चार-पास झिल्ली-विस्तारित हुए [[प्रोटीन]] सबयूनिट से बनते हैं, जिन्हें [[संबंध|कन्नेक्सीन]] कहा जाता है, जो समान या थोड़ा भिन्न हो सकते हैं।<ref name=Bennet04/> | गैप जंक्शन फ़नल दो हेमी-चैनलों से बने होते हैं जिन्हें कशेरूकियों में [[संबंध]] कहा जाता है, [[निष्कर्ष]] में प्रत्येक कोशिका द्वारा योगदान दिया जाता है।<ref name=Hormuzdi04/><ref name=Bennet04/><ref>{{harvnb|Kandel|Schwartz|Jessell|2000|p=178}}</ref> सम्बन्ध छह 7.5 nm लंबे, चार-पास झिल्ली-विस्तारित हुए [[प्रोटीन]] सबयूनिट से बनते हैं, जिन्हें [[संबंध|कन्नेक्सीन]] कहा जाता है, जो समान या थोड़ा भिन्न हो सकते हैं।<ref name=Bennet04/> | ||
[[उलझन में होना|ऑटोप्स]], विद्युत (या रासायनिक) | [[उलझन में होना|ऑटोप्स]], विद्युत (या रासायनिक) सिनैप्स है जो तब बनता है जब न्यूरॉन का अक्षतंतु अपने स्वयं के डेन्ड्राइट के साथ समन्वयित होता है। | ||
== प्रभाव == | == प्रभाव == | ||
यद्यपि भिन्न अल्पसंख्यक, मानव शरीर में कुछ क्षेत्रों में पाए जाते हैं, जैसे कि हाइपोथैलेमस हैं। विद्युत | यद्यपि भिन्न अल्पसंख्यक, मानव शरीर में कुछ क्षेत्रों में पाए जाते हैं, जैसे कि हाइपोथैलेमस हैं। विद्युत सिनैप्स की सरलता के परिणामस्वरूप ऐसे सिनेप्स होते हैं जो तीव्र होते हैं, किन्तु अधिक जटिल रासायनिक सिनैप्स की अपेक्षा में केवल सरल व्यवहार उत्पन्न कर सकते हैं।<ref>Kandal, et al., Chapter 10</ref> | ||
*रासायनिक संदेशवाहकों को पहचानने के लिए रिसेप्टर्स की आवश्यकता के बिना, विद्युत | *रासायनिक संदेशवाहकों को पहचानने के लिए रिसेप्टर्स की आवश्यकता के बिना, विद्युत सिनैप्स पर संकेत संचरण रासायनिक सिनैप्स में होने वाले संकेत संचरण की अपेक्षा में अधिक तीव्र होता है, जो न्यूरॉन्स के मध्य प्रमुख प्रकार के जंक्शन होते हैं। रासायनिक संचरण सिनैप्टिक विलंब प्रदर्शित करता है- स्क्वीड सिनैप्स और मेंढक के न्यूरोमस्कुलर जंक्शनों से रिकॉर्डिंग 0.5 से 4.0 मिलीसेकंड की देरी को प्रकट करती है जबकि विद्युत संचरण लगभग बिना किसी देरी के होता है। यद्यपि, रासायनिक और विद्युत सिनैप्स के मध्य गति में अंतर स्तनधारियों में उतना स्पष्ट नहीं है जितना कि ठंडे खून वाले जानवरों में है।<ref name=Bennet04/>चूंकि विद्युत सिनैप्स में न्यूरोट्रांसमीटर सम्मिलित नहीं होते हैं, विद्युत न्यूरोट्रांसमिशन रासायनिक न्यूरोट्रांसमिशन की अपेक्षा में अल्प संशोधित होता है। | ||
*प्रतिक्रिया सदैव स्रोत के समान संकेत होती है। उदाहरण के लिए, प्री-सिनैप्टिक झिल्ली का [[विध्रुवण]] सदैव पोस्ट-सिनैप्टिक झिल्ली में विध्रुवण को प्रेरित करेगा, और [[हाइपरपोलराइजेशन (जीव विज्ञान)]] के लिए इसके विपरीत होता है। | *प्रतिक्रिया सदैव स्रोत के समान संकेत होती है। उदाहरण के लिए, प्री-सिनैप्टिक झिल्ली का [[विध्रुवण]] सदैव पोस्ट-सिनैप्टिक झिल्ली में विध्रुवण को प्रेरित करेगा, और [[हाइपरपोलराइजेशन (जीव विज्ञान)]] के लिए इसके विपरीत होता है। | ||
* पोस्टसिनेप्टिक न्यूरॉन में प्रतिक्रिया सामान्य रूप से स्रोत की अपेक्षा में आयाम में छोटी होती है। संकेत के क्षीणन की मात्रा झिल्ली विद्युत प्रतिरोध और प्रीसानेप्टिक और पोस्टसिनेप्टिक न्यूरॉन्स के संचालन के कारण होती है। | * पोस्टसिनेप्टिक न्यूरॉन में प्रतिक्रिया सामान्य रूप से स्रोत की अपेक्षा में आयाम में छोटी होती है। संकेत के क्षीणन की मात्रा झिल्ली विद्युत प्रतिरोध और प्रीसानेप्टिक और पोस्टसिनेप्टिक न्यूरॉन्स के संचालन के कारण होती है। | ||
*विद्युत | *विद्युत सिनैप्स में दीर्घकालिक परिवर्तन देखे जा सकते हैं। उदाहरण के लिए, [[रेटिना]] में विद्युत सिनैप्स में परिवर्तन रेटिना के प्रकाश और अंधेरे अनुकूलन के समय देखा जाता है।<ref>[https://med.uth.edu/ibp/faculty/john-obrien/ Dr. John O'Brien || Faculty Biography || The Department of Ophthalmology and Visual Science at the University of Texas Medical School at Houston<!-- Bot generated title -->]</ref> | ||
विद्युत | विद्युत सिनैप्स की सापेक्ष गति भी अनेक न्यूरॉन्स को समकालिक रूप से सक्रिय होने की अनुमति देती है।<ref name=Gibson05/><ref name=Bennet04/><ref name=Kandel00_180>{{harvnb|Kandel|Schwartz|Jessell|2000|p=180}}</ रेफ> संचरण की गति के कारण, विद्युत सिनैप्स एस्केप तंत्र और अन्य प्रक्रियाओं में पाए जाते हैं जिनके लिए त्वरित प्रतिक्रिया की आवश्यकता होती है, जैसे कि [[समुद्री खरगोश]] [[अप्लीसिया]] के खतरे की प्रतिक्रिया, जो दुश्मनों की दृष्टि को अस्पष्ट करने के लिए बड़ी मात्रा में स्याही जारी करता है। .<ref name=Kandel00/> | ||
आम तौर पर, आयनों द्वारा प्रवाहित धारा इस प्रकार के सिनैप्स के माध्यम से किसी भी दिशा में यात्रा कर सकती है।<ref name=Hormuzdi04/>हालांकि, कभी-कभी जंक्शन सिनैप्स को ठीक कर रहे होते हैं,<ref name=Hormuzdi04/>जिसमें [[वोल्टेज-गेटेड आयन चैनल]] होते हैं जो अक्षतंतु की प्लाज्मा झिल्ली के विध्रुवण की प्रतिक्रिया में खुलते हैं, और वर्तमान को दो दिशाओं में से एक में यात्रा करने से रोकते हैं।<ref name=Kandel00_180/> जीव विज्ञान में बढ़े हुए कैल्शियम की प्रतिक्रिया में कुछ चैनल बंद भी हो सकते हैं ({{chem|Ca|2+}}) या [[हाइड्रोजन]] ({{chem|H|+}}) आयन सांद्रता, ताकि एक कोशिका से दूसरी कोशिका में क्षति न फैले।<ref name=Kandel00_180/> | आम तौर पर, आयनों द्वारा प्रवाहित धारा इस प्रकार के सिनैप्स के माध्यम से किसी भी दिशा में यात्रा कर सकती है।<ref name=Hormuzdi04/>हालांकि, कभी-कभी जंक्शन सिनैप्स को ठीक कर रहे होते हैं,<ref name=Hormuzdi04/>जिसमें [[वोल्टेज-गेटेड आयन चैनल]] होते हैं जो अक्षतंतु की प्लाज्मा झिल्ली के विध्रुवण की प्रतिक्रिया में खुलते हैं, और वर्तमान को दो दिशाओं में से एक में यात्रा करने से रोकते हैं।<ref name=Kandel00_180/> जीव विज्ञान में बढ़े हुए कैल्शियम की प्रतिक्रिया में कुछ चैनल बंद भी हो सकते हैं ({{chem|Ca|2+}}) या [[हाइड्रोजन]] ({{chem|H|+}}) आयन सांद्रता, ताकि एक कोशिका से दूसरी कोशिका में क्षति न फैले।<ref name=Kandel00_180/> | ||
| Line 36: | Line 36: | ||
[[सूत्रयुग्मक सुनम्यता]] का भी प्रमाण है जहां गतिविधि के परिणामस्वरूप स्थापित विद्युत कनेक्शन या तो मजबूत या कमजोर हो सकता है, या मैग्नीशियम की इंट्रासेल्युलर एकाग्रता में परिवर्तन के दौरान।<ref>{{cite journal | last1 = Palacios-Prado | first1 = Nicolas | display-authors = etal | date = Mar 2013 | title = Intracellular magnesium-dependent modulation of gap junction channels formed by neuronal connexin36 | journal = Journal of Neuroscience | volume = 33 | issue = 11| pages = 4741–53 | doi = 10.1523/JNEUROSCI.2825-12.2013 | pmid = 23486946 | pmc = 3635812}}</ref><ref>{{cite journal | last1 = Activity-Dependent | last2 = Synapses | first2 = Electrical | last3 = Haas | first3 = Julie S. | display-authors = etal | year = 2011 | title = Activity-dependent long-term depression of electrical synapses| journal = Science | volume = 334 | issue = 6054| pages = 389–93 | doi = 10.1126/science.1207502 | pmid=22021860| bibcode = 2011Sci...334..389H | s2cid = 35398480 }}</ref> | [[सूत्रयुग्मक सुनम्यता]] का भी प्रमाण है जहां गतिविधि के परिणामस्वरूप स्थापित विद्युत कनेक्शन या तो मजबूत या कमजोर हो सकता है, या मैग्नीशियम की इंट्रासेल्युलर एकाग्रता में परिवर्तन के दौरान।<ref>{{cite journal | last1 = Palacios-Prado | first1 = Nicolas | display-authors = etal | date = Mar 2013 | title = Intracellular magnesium-dependent modulation of gap junction channels formed by neuronal connexin36 | journal = Journal of Neuroscience | volume = 33 | issue = 11| pages = 4741–53 | doi = 10.1523/JNEUROSCI.2825-12.2013 | pmid = 23486946 | pmc = 3635812}}</ref><ref>{{cite journal | last1 = Activity-Dependent | last2 = Synapses | first2 = Electrical | last3 = Haas | first3 = Julie S. | display-authors = etal | year = 2011 | title = Activity-dependent long-term depression of electrical synapses| journal = Science | volume = 334 | issue = 6054| pages = 389–93 | doi = 10.1126/science.1207502 | pmid=22021860| bibcode = 2011Sci...334..389H | s2cid = 35398480 }}</ref> | ||
विद्युत | विद्युत सिनैप्स पूरे [[केंद्रीय तंत्रिका तंत्र]] में उपस्थित हैं और विशेष रूप से [[नियोकॉर्टेक्स]], [[समुद्री घोड़ा]], [[थैलेमिक जालीदार नाभिक]], [[ठिकाना coeruleus|लोकस केरुलुस]], [[अवर जैतून नाभिक]], ट्राइजेमिनल नर्व के मेसेंसेफिलिक न्यूक्लियस, घ्राण बल्ब, रेटिना और रीढ़ की हड्डी में अध्ययन किया गया है।<ref>Electrical synapses in the mammalian brain, Connors & Long, "Annu Rev Neurosci" 2004;27:393-418</ref> विवो में पाए जाने वाले कार्यात्मक गैप जंक्शनों के अन्य उदाहरण [[स्ट्रिएटम]], [[सेरिबैलम]] और [[सुपरचियासमतिक नाभिक]] में हैं।<ref>{{Cite journal|last1=Eugenin|first1=Eliseo A.|last2=Basilio|first2=Daniel|last3=Sáez|first3=Juan C.|last4=Orellana|first4=Juan A.|last5=Raine|first5=Cedric S.|last6=Bukauskas|first6=Feliksas|last7=Bennett|first7=Michael V. L.|last8=Berman|first8=Joan W.|date=2012-09-01|title=The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system|journal=Journal of Neuroimmune Pharmacology|volume=7|issue=3|pages=499–518|doi=10.1007/s11481-012-9352-5|issn=1557-1904|pmc=3638201|pmid=22438035}}</ref><ref>{{Cite journal|last1=Pereda|first1=Alberto E.|last2=Curti|first2=Sebastian|last3=Hoge|first3=Gregory|last4=Cachope|first4=Roger|last5=Flores|first5=Carmen E.|last6=Rash|first6=John E.|date=2013-01-01|title=Gap junction-mediated electrical transmission: regulatory mechanisms and plasticity|journal=Biochimica et Biophysica Acta (BBA) - Biomembranes|volume=1828|issue=1|pages=134–146|doi=10.1016/j.bbamem.2012.05.026|issn=0006-3002|pmc=3437247|pmid=22659675}}</ref> | ||
== इतिहास == | == इतिहास == | ||
20 वीं दशक के प्रारम्भ में तंत्रिका तंत्र के संगठन के लिए सीधे जुड़े हुए कोशिकाओं के जालीदार नेटवर्क का मॉडल प्रारंभिक परिकल्पनाओं में से था। इस जालीदार सिद्धांत को अब प्रमुख [[न्यूरॉन सिद्धांत]] के साथ सीधे संघर्ष करने के लिए माना जाता था, कोई मॉडल जिसमें पृथक, व्यक्तिगत न्यूरॉन्स को रासायनिक रूप से | 20 वीं दशक के प्रारम्भ में तंत्रिका तंत्र के संगठन के लिए सीधे जुड़े हुए कोशिकाओं के जालीदार नेटवर्क का मॉडल प्रारंभिक परिकल्पनाओं में से था। इस जालीदार सिद्धांत को अब प्रमुख [[न्यूरॉन सिद्धांत]] के साथ सीधे संघर्ष करने के लिए माना जाता था, कोई मॉडल जिसमें पृथक, व्यक्तिगत न्यूरॉन्स को रासायनिक रूप से सिनैप्सी अंतराल में संकेत देते हैं। ये दो मॉडल 1906 में [[फिजियोलॉजी या मेडिसिन में नोबेल पुरस्कार]] के लिए पुरस्कार समारोह में पूर्णं विपरीत थे, जिसमें यह पुरस्कार संयुक्त रूप से [[कैमिलस गोल्गी]], रेटिकुलिस्ट और व्यापक रूप से मान्यता प्राप्त सेल जीव-विज्ञानी, और न्यूरॉन के चैंपियन सैंटियागो रेमन वाई काजल को दिया गया था।जो कि सिद्धांत और आधुनिक तंत्रिका विज्ञान के जनक हैं। गोल्गी ने अपना नोबेल व्याख्यान सबसे पूर्व दिया, जिसमें तंत्रिका तंत्र के जालीदार मॉडल के लिए साक्ष्य का विवरण दिया गया था। इसके पश्चात रामोन वाई काजल ने मंच संभाला और अपने व्याख्यान में गोल्गी के निष्कर्षों का खंडन किया। यद्यपि, रासायनिक और विद्युत सिनैप्स के सह-अस्तित्व की आधुनिक समझ बताती है कि दोनों मॉडल शारीरिक रूप से महत्वपूर्ण हैं; यह कहा जा सकता है कि नोबेल पुरस्कार चयन ने संयुक्त रूप से पुरस्कार देने में बड़ी दूरदर्शिता के साथ कार्य किया। | ||
बीसवीं दशक के पूर्व दशकों में न्यूरॉन्स के मध्य सूचना का संचरण रासायनिक या विद्युत था, इस पर पर्याप्त अनुशय हुई थी, किन्तु ओटो लोई के न्यूरॉन्स और हृदय की मांसपेशियों के मध्य रासायनिक संचार के प्रदर्शन के पश्चात रासायनिक सिनैप्टिक संचरण को उत्तर के रूप में देखा गया था। इस प्रकार विद्युत संचार की शोध आश्चर्यजनक थी। | बीसवीं दशक के पूर्व दशकों में न्यूरॉन्स के मध्य सूचना का संचरण रासायनिक या विद्युत था, इस पर पर्याप्त अनुशय हुई थी, किन्तु ओटो लोई के न्यूरॉन्स और हृदय की मांसपेशियों के मध्य रासायनिक संचार के प्रदर्शन के पश्चात रासायनिक सिनैप्टिक संचरण को उत्तर के रूप में देखा गया था। इस प्रकार विद्युत संचार की शोध आश्चर्यजनक थी। | ||
1950 के दशक के अंत में [[क्रेफ़िश]] में एस्केप-संबंधी विशाल न्यूरॉन्स के मध्य प्रथम बार विद्युत | 1950 के दशक के अंत में [[क्रेफ़िश]] में एस्केप-संबंधी विशाल न्यूरॉन्स के मध्य प्रथम बार विद्युत सिनैप्स का प्रदर्शन किया गया था, और पश्चात में ये कशेरुकियों में पाए गए।<ref name="Purves" /> | ||
== यह भी देखें == | == यह भी देखें == | ||
* [[जंक्शन परिसर]] | * [[जंक्शन परिसर]] | ||
| Line 49: | Line 49: | ||
== संदर्भ == | == संदर्भ == | ||
{{Reflist|30em}} | {{Reflist|30em}} | ||
==अग्रिम पठन== | ==अग्रिम पठन== | ||
| Line 89: | Line 88: | ||
| bibcode = 2011Sci...334..315H | | bibcode = 2011Sci...334..315H | ||
}} | }} | ||
{{Authority control}} | {{Authority control}} | ||
Latest revision as of 15:15, 27 October 2023
| विद्युत सिनैप्स | |
|---|---|
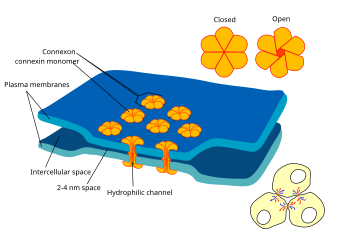 गैप जंक्शन की चित्र | |
| Anatomical terminology |
विद्युत सिनैप्स दो निकटम न्यूरॉन्स के मध्य ऐसा यांत्रिक और विद्युत प्रवाहकीय लिंक है जो पूर्व और पोस्टसिनैप्सी न्यूरॉन्स के मध्य संकीर्ण अंतराल पर बनता है जिसे गैप जंक्शन के रूप में जाना जाता है। गैप जंक्शनों पर, ऐसी कोशिकाएं दूसरे कोशिकाओं के लगभग 3.8 nm के अंदर पहुंचती हैं,[1] 20- से 40-नैनोमीटर की दूरी की अपेक्षा में अधिक अल्प दूरी जो रासायनिक सिनैप्स पर कोशिकाओं को भिन्न करती है।[2] अनेक जानवरों में[specify] विद्युत सिनैप्स-आधारित प्रणालियाँ रासायनिक सिनैप्स के साथ सह-अस्तित्व में हैं।
रासायनिक सिनैप्स की अपेक्षा में, विद्युत सिनैप्स तंत्रिका आवेगों को तीव्रता से संचालित करते हैं, लेकिन, रासायनिक सिनैप्स के विपरीत, उनमें लाभ (इलेक्ट्रॉनिक्स) की अल्पता होती है- पोस्टसिनैप्सी न्यूरॉन में संकेत मूल न्यूरॉन की अपेक्षा में समान या छोटा होता है। विद्युत सिनैप्स को मानने के लिए मूलभूत आधार उन कनेक्शनों के नीचे आते हैं जो दो न्यूरॉन्स के मध्य गैप जंक्शन में स्थित होते हैं। विद्युत सिनैप्स प्रायः तंत्रिका तंत्र में पाए जाते हैं जिन्हें सबसे तीव्र संभव प्रतिक्रिया की आवश्यकता होती है, जैसे कि रक्षात्मक सजगता है। विद्युत सिनैप्स की महत्वपूर्ण विशेषता यह है कि वे अधिकांशतः द्विदिश होते हैं (किसी भी दिशा में आवेग संचरण की अनुमति देते हैं)।[3][4]
संरचना
प्रत्येक गैप जंक्शन (उर्फ नेक्सस जंक्शन) में अनेक गैप जंक्शन चैनल होते हैं जो दोनों कोशिकाओं के प्लाज्मा झिल्ली को पार करते हैं।[5] लगभग 1.2 से 2.0 nm के लुमेन व्यास के साथ,[2][6] गैप जंक्शन चैनल का छिद्र इतना चौड़ा होता है कि आयनों और यहां तक कि मध्यम आकार के अणुओं जैसे सिग्नलिंग अणुओं को किसी कोशिका से दूसरी कोशिका में प्रवाहित करने की अनुमति देता है,[2][7] जिससे दो कोशिकाओं के कोशिका द्रव्य को जोड़ा जा सके। इस प्रकार जब किसी कोशिका की झिल्ली क्षमता में परिवर्तन होता है, तो आयन उस कोशिका से दूसरी कोशिका में जा सकते हैं, उनके साथ धनात्मक आवेश होता है और पश्च-सिनैप्सी कोशिका का विध्रुवण होता है।
गैप जंक्शन फ़नल दो हेमी-चैनलों से बने होते हैं जिन्हें कशेरूकियों में संबंध कहा जाता है, निष्कर्ष में प्रत्येक कोशिका द्वारा योगदान दिया जाता है।[2][6][8] सम्बन्ध छह 7.5 nm लंबे, चार-पास झिल्ली-विस्तारित हुए प्रोटीन सबयूनिट से बनते हैं, जिन्हें कन्नेक्सीन कहा जाता है, जो समान या थोड़ा भिन्न हो सकते हैं।[6]
ऑटोप्स, विद्युत (या रासायनिक) सिनैप्स है जो तब बनता है जब न्यूरॉन का अक्षतंतु अपने स्वयं के डेन्ड्राइट के साथ समन्वयित होता है।
प्रभाव
यद्यपि भिन्न अल्पसंख्यक, मानव शरीर में कुछ क्षेत्रों में पाए जाते हैं, जैसे कि हाइपोथैलेमस हैं। विद्युत सिनैप्स की सरलता के परिणामस्वरूप ऐसे सिनेप्स होते हैं जो तीव्र होते हैं, किन्तु अधिक जटिल रासायनिक सिनैप्स की अपेक्षा में केवल सरल व्यवहार उत्पन्न कर सकते हैं।[9]
- रासायनिक संदेशवाहकों को पहचानने के लिए रिसेप्टर्स की आवश्यकता के बिना, विद्युत सिनैप्स पर संकेत संचरण रासायनिक सिनैप्स में होने वाले संकेत संचरण की अपेक्षा में अधिक तीव्र होता है, जो न्यूरॉन्स के मध्य प्रमुख प्रकार के जंक्शन होते हैं। रासायनिक संचरण सिनैप्टिक विलंब प्रदर्शित करता है- स्क्वीड सिनैप्स और मेंढक के न्यूरोमस्कुलर जंक्शनों से रिकॉर्डिंग 0.5 से 4.0 मिलीसेकंड की देरी को प्रकट करती है जबकि विद्युत संचरण लगभग बिना किसी देरी के होता है। यद्यपि, रासायनिक और विद्युत सिनैप्स के मध्य गति में अंतर स्तनधारियों में उतना स्पष्ट नहीं है जितना कि ठंडे खून वाले जानवरों में है।[6]चूंकि विद्युत सिनैप्स में न्यूरोट्रांसमीटर सम्मिलित नहीं होते हैं, विद्युत न्यूरोट्रांसमिशन रासायनिक न्यूरोट्रांसमिशन की अपेक्षा में अल्प संशोधित होता है।
- प्रतिक्रिया सदैव स्रोत के समान संकेत होती है। उदाहरण के लिए, प्री-सिनैप्टिक झिल्ली का विध्रुवण सदैव पोस्ट-सिनैप्टिक झिल्ली में विध्रुवण को प्रेरित करेगा, और हाइपरपोलराइजेशन (जीव विज्ञान) के लिए इसके विपरीत होता है।
- पोस्टसिनेप्टिक न्यूरॉन में प्रतिक्रिया सामान्य रूप से स्रोत की अपेक्षा में आयाम में छोटी होती है। संकेत के क्षीणन की मात्रा झिल्ली विद्युत प्रतिरोध और प्रीसानेप्टिक और पोस्टसिनेप्टिक न्यूरॉन्स के संचालन के कारण होती है।
- विद्युत सिनैप्स में दीर्घकालिक परिवर्तन देखे जा सकते हैं। उदाहरण के लिए, रेटिना में विद्युत सिनैप्स में परिवर्तन रेटिना के प्रकाश और अंधेरे अनुकूलन के समय देखा जाता है।[10]
विद्युत सिनैप्स की सापेक्ष गति भी अनेक न्यूरॉन्स को समकालिक रूप से सक्रिय होने की अनुमति देती है।[5][6]Cite error: Closing </ref> missing for <ref> tag[11]
विद्युत सिनैप्स पूरे केंद्रीय तंत्रिका तंत्र में उपस्थित हैं और विशेष रूप से नियोकॉर्टेक्स, समुद्री घोड़ा, थैलेमिक जालीदार नाभिक, लोकस केरुलुस, अवर जैतून नाभिक, ट्राइजेमिनल नर्व के मेसेंसेफिलिक न्यूक्लियस, घ्राण बल्ब, रेटिना और रीढ़ की हड्डी में अध्ययन किया गया है।[12] विवो में पाए जाने वाले कार्यात्मक गैप जंक्शनों के अन्य उदाहरण स्ट्रिएटम, सेरिबैलम और सुपरचियासमतिक नाभिक में हैं।[13][14]
इतिहास
20 वीं दशक के प्रारम्भ में तंत्रिका तंत्र के संगठन के लिए सीधे जुड़े हुए कोशिकाओं के जालीदार नेटवर्क का मॉडल प्रारंभिक परिकल्पनाओं में से था। इस जालीदार सिद्धांत को अब प्रमुख न्यूरॉन सिद्धांत के साथ सीधे संघर्ष करने के लिए माना जाता था, कोई मॉडल जिसमें पृथक, व्यक्तिगत न्यूरॉन्स को रासायनिक रूप से सिनैप्सी अंतराल में संकेत देते हैं। ये दो मॉडल 1906 में फिजियोलॉजी या मेडिसिन में नोबेल पुरस्कार के लिए पुरस्कार समारोह में पूर्णं विपरीत थे, जिसमें यह पुरस्कार संयुक्त रूप से कैमिलस गोल्गी, रेटिकुलिस्ट और व्यापक रूप से मान्यता प्राप्त सेल जीव-विज्ञानी, और न्यूरॉन के चैंपियन सैंटियागो रेमन वाई काजल को दिया गया था।जो कि सिद्धांत और आधुनिक तंत्रिका विज्ञान के जनक हैं। गोल्गी ने अपना नोबेल व्याख्यान सबसे पूर्व दिया, जिसमें तंत्रिका तंत्र के जालीदार मॉडल के लिए साक्ष्य का विवरण दिया गया था। इसके पश्चात रामोन वाई काजल ने मंच संभाला और अपने व्याख्यान में गोल्गी के निष्कर्षों का खंडन किया। यद्यपि, रासायनिक और विद्युत सिनैप्स के सह-अस्तित्व की आधुनिक समझ बताती है कि दोनों मॉडल शारीरिक रूप से महत्वपूर्ण हैं; यह कहा जा सकता है कि नोबेल पुरस्कार चयन ने संयुक्त रूप से पुरस्कार देने में बड़ी दूरदर्शिता के साथ कार्य किया।
बीसवीं दशक के पूर्व दशकों में न्यूरॉन्स के मध्य सूचना का संचरण रासायनिक या विद्युत था, इस पर पर्याप्त अनुशय हुई थी, किन्तु ओटो लोई के न्यूरॉन्स और हृदय की मांसपेशियों के मध्य रासायनिक संचार के प्रदर्शन के पश्चात रासायनिक सिनैप्टिक संचरण को उत्तर के रूप में देखा गया था। इस प्रकार विद्युत संचार की शोध आश्चर्यजनक थी।
1950 के दशक के अंत में क्रेफ़िश में एस्केप-संबंधी विशाल न्यूरॉन्स के मध्य प्रथम बार विद्युत सिनैप्स का प्रदर्शन किया गया था, और पश्चात में ये कशेरुकियों में पाए गए।[3]
यह भी देखें
संदर्भ
- ↑ Kandel, ER; Schwartz, JH; Jessell, TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
- ↑ 2.0 2.1 2.2 2.3 Hormuzdi SG, Filippov MA, Mitropoulou G, Monyer H, Bruzzone R (March 2004). "Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks". Biochim. Biophys. Acta. 1662 (1–2): 113–37. doi:10.1016/j.bbamem.2003.10.023. PMID 15033583.
- ↑ 3.0 3.1 Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; James O. McNamara & Leonard E. White (2008). Neuroscience (4th ed.). Sinauer Associates. pp. 85–88. ISBN 978-0-87893-697-7.
- ↑ Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; Richard D. Mooney; Leonard E. White & Michael L. Platt (2018). Neuroscience (6th ed.). Oxford University Press. pp. 86–87. ISBN 978-1605353807.
- ↑ 5.0 5.1 Gibson JR, Beierlein M, Connors BW (January 2005). "Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4". J. Neurophysiol. 93 (1): 467–80. doi:10.1152/jn.00520.2004. PMID 15317837.
- ↑ 6.0 6.1 6.2 6.3 6.4 Bennett MV, Zukin RS (February 2004). "Electrical coupling and neuronal synchronization in the Mammalian brain". Neuron. 41 (4): 495–511. doi:10.1016/S0896-6273(04)00043-1. PMID 14980200. S2CID 18566176.
- ↑ Kandel, Schwartz & Jessell 2000, pp. 178–180
- ↑ Kandel, Schwartz & Jessell 2000, p. 178
- ↑ Kandal, et al., Chapter 10
- ↑ Dr. John O'Brien || Faculty Biography || The Department of Ophthalmology and Visual Science at the University of Texas Medical School at Houston
- ↑ Activity-Dependent; Synapses, Electrical; Haas, Julie S.; et al. (2011). "Activity-dependent long-term depression of electrical synapses". Science. 334 (6054): 389–93. Bibcode:2011Sci...334..389H. doi:10.1126/science.1207502. PMID 22021860. S2CID 35398480.
- ↑ Electrical synapses in the mammalian brain, Connors & Long, "Annu Rev Neurosci" 2004;27:393-418
- ↑ Eugenin, Eliseo A.; Basilio, Daniel; Sáez, Juan C.; Orellana, Juan A.; Raine, Cedric S.; Bukauskas, Feliksas; Bennett, Michael V. L.; Berman, Joan W. (2012-09-01). "The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system". Journal of Neuroimmune Pharmacology. 7 (3): 499–518. doi:10.1007/s11481-012-9352-5. ISSN 1557-1904. PMC 3638201. PMID 22438035.
- ↑ Pereda, Alberto E.; Curti, Sebastian; Hoge, Gregory; Cachope, Roger; Flores, Carmen E.; Rash, John E. (2013-01-01). "Gap junction-mediated electrical transmission: regulatory mechanisms and plasticity". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1828 (1): 134–146. doi:10.1016/j.bbamem.2012.05.026. ISSN 0006-3002. PMC 3437247. PMID 22659675.
अग्रिम पठन
- Andrew L. Harris; Darren Locke (2009). Connexins, a guide. New York: Springer. p. 574. ISBN 978-1-934115-46-6.
- Haas, Julie S.; Baltazar Zavala; Carole E. Landisman (2011). "Activity-dependent long-term depression of electrical synapses". Science. 334 (6054): 389–393. Bibcode:2011Sci...334..389H. doi:10.1126/science.1207502. PMID 22021860. S2CID 35398480.
- Hestrin, Shaul (2011). "The strength of electrical synapses". Science. 334 (6054): 315–316. Bibcode:2011Sci...334..315H. doi:10.1126/science.1213894. PMC 4458844. PMID 22021844.