काउंटरियन: Difference between revisions
mNo edit summary |
No edit summary |
||
| (10 intermediate revisions by 3 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Ion which negates another oppositely-charged ion in an ionic molecule}} | {{Short description|Ion which negates another oppositely-charged ion in an ionic molecule}} | ||
[[पॉलीस्टाइनिन सल्फोनेट]], एक काउंटर आयन -स्थानांतरक् राल है, जिसकी आपूर्ति सामान्यतः {{chem2|Na+}}काउंटर के रूप में की जाती है। | |||
रसायन विज्ञान में, | रसायन विज्ञान में, काउंटर आयन एक आयन है जो आयनिक प्रजातियों के साथ विद्युत तटस्थता बनाए रखता है। टेबल नमक में (NaCl, जिसे सोडियम क्लोराइड के रूप में भी जाना जाता है) सोडियम आयन (धनावेशित) क्लोराइड आयन (ऋणायन) और इसके विपरीत के लिए प्रतिरूप है। | ||
एक प्रतिरूप को सामान्यतः ऋणायन या धनायन के रूप में संदर्भित किया जाएगा, यह इस बात पर निर्भर करता है कि यह नकारात्मक या सकारात्मक रूप से | एक प्रतिरूप को सामान्यतः ऋणायन या धनायन के रूप में संदर्भित किया जाएगा, यह इस बात पर निर्भर करता है कि यह नकारात्मक या सकारात्मक रूप से आवेशित है या नहीं। इस प्रकार एक ऋणायन का प्रतिकार एक धनायन होगा,और धनायन का प्रतिकार एक ऋणायन होगा। | ||
जैव रसायन में, काउंटरों को सामान्यतः अस्पष्ट रूप से परिभाषित किया जाता है। उनके आवेश के आधार पर, [[प्रोटीन]] विभिन्न प्रकार के छोटे आयनों और धनायनों से जुड़े होते हैं। पादप कोशिकाओं में, | जैव रसायन में, काउंटरों को सामान्यतः अस्पष्ट रूप से परिभाषित किया जाता है। उनके आवेश के आधार पर, [[प्रोटीन]] विभिन्न प्रकार के छोटे आयनों और धनायनों से जुड़े होते हैं। पादप कोशिकाओं में, जल की क्षमता को कम करने और सेल के विस्तार को चलाने के लिए आयन मैलेट रिक्तिका में जमा होता है। तटस्थता बनाए रखने के लिए {{chem2|K+}} आयन काउंटर के रूप में जमा होते हैं। आयन परिवहन चैनलों द्वारा जल विरागी सेल की दीवारों के माध्यम से आयन पारगमन की मध्यस्थता की जाती है। न्यूक्लिक अम्ल ऋणायनी होते हैं, संबंधित उद्धरण प्रोटोनेटेड पॉलिएमाइन होते हैं। | ||
=== अंतरापृष्ठीय रसायन | === अंतरापृष्ठीय रसायन === | ||
आयन स्थानांतरण बहुलक | आयन स्थानांतरण बहुलक और [[कोलाइड]] में काउंटर आयन गतिशील आयन हैं।<ref>{{GoldBookRef |title=counter-ions |file=C01371 }}</ref> आयन स्थानांतरक् रेजिन शुद्ध नकारात्मक या सकारात्मक आवेश वाले बहुलक हैं। धनायन-स्थानांतरक् रेजिन सामान्यतः सोडियम में काउंटर ऋणायन के साथ ऋणायनी बहुलक होता है। जल के मृदुकरण में रेजिन में उदाहरण के लिए Ca<sup>2+</sup> (कैल्शियम) द्वारा अत्यधिक आवेशित किए गए काउंटरीकरण के लिए Ca<sup>2+</sup> और रेजिन में एक उच्च संबंध है। इसके विपरीत, आयन-विनिमय रेजिन क्लोराइड Cl <sup>-</sup> के रूप में प्रदान किए जाते हैं, जो एक अत्यधिक गतिशील काउंटर आयन है। | ||
चरण-स्थानांतरण उत्प्रेरक में काउंटरों का उपयोग किया जाता है। एक विशिष्ट अनुप्रयोग में वसारागी काउंटर धनायन जैसे बेंज़ालकोनियम कार्बनिक विलायक में अभिकर्मकों का विलेयीकरण करता है। | |||
== | === विलयन रसायन === | ||
कार्बनिक | कार्बनिक विलायक में लवण की विलेयता, धनायन और ऋणायन दोनों का एक ही कार्य है। आयन वसारागी होने पर कार्बनिक विलायक में उद्धरणों की घुलनशीलता को बढ़ाया जा सकता है। इसी तरह, कार्बनिक विलायक में आयनों की घुलनशीलता को वसारागीकरण द्वारा बढ़ाया जाता है। सबसे साधारण वसारागी धनायन चतुर्धातुक अमोनियम धनायन हैं, जिन्हें "क्वाट लवण" कहा जाता है। | ||
<gallery caption="Lipophilic counteranions" widths="180px" heights="120px" perrow="4"> | <gallery caption="Lipophilic counteranions" widths="180px" heights="120px" perrow="4"> | ||
| Line 29: | Line 29: | ||
File:Bis(12-crown-4)lithium-cation-from-xtal-3D-balls-B.png|Alkali metal cations bound by [[crown ether]]s are common lipophilic countercations, as illustrated by [Li(12-crown-4)<sub>2</sub>]<sup>+</sup>. | File:Bis(12-crown-4)lithium-cation-from-xtal-3D-balls-B.png|Alkali metal cations bound by [[crown ether]]s are common lipophilic countercations, as illustrated by [Li(12-crown-4)<sub>2</sub>]<sup>+</sup>. | ||
</gallery> | </gallery> | ||
कई | कई धनायनी कार्बधात्विक परिसरों को निष्क्रिय, गैर-समन्वय काउंटरों से अलग किया जाता है। फेरोसेनियम टेट्राफ्लोरोबोरेट ऐसा ही एक उदाहरण है। | ||
== | === वैद्युतरसायन === | ||
उच्च आयनिक चालकता प्राप्त करने के लिए | उच्च आयनिक चालकता प्राप्त करने के लिए अतिरिक्त विद्युत् अपघट्य की उपस्थिति में विद्युत रासायनिक मापे की जाते हैं। जल में विद्युत् अपघट्य साधारणतयः पोटेशियम क्लोराइड जैसा साधारण नमक होता है। गैर-जलीय विलयनों में मापन के लिए वसारागीकरण और आयन दोनों से बने लवणों का उपयोग किया जाता है, उदाहरण के लिए, टेट्राब्यूटाइल अमोनियम हेक्साफ्लोरोफॉस्फेट। एक ऐसा प्रभाव जो कम विशिष्ट स्थिरांक के विलायक में होता है ऐसी स्थिति में क्षमता आयन- युग्मन से प्रभावित होती है।<ref>Geiger, W. E., Barrière, F., "Organometallic Electrochemistry Based on Electrolytes Containing Weakly-Coordinating Fluoroarylborate Anions", Acc. Chem. Res. 2010, 43, 1030. {{doi|10.1021/ar1000023}}</ref> | ||
=== प्रतिपक्ष स्थिरता === | |||
कई अनुप्रयोगों के लिए, काउंटर आयन केवल आवेश और वसारागिता प्रदान करते है जो अपने साथी आयन को परिचालन की अनुमति देता है। काउंटर आयन रासायनिक रूप से निष्क्रिय है। काउंटर ऋणायन के लिए, [[लुईस बेस|लुईस क्षार]] के संदर्भ में जड़ता व्यक्त की जाती है। काउंटर आदर्श रूप से ऊबड़-खाबड़ और गैर-प्रतिक्रियाशील हैं। चतुष्कोणीय अमोनियम और फॉस्फोनियम प्रतिरूपण के लिए, जड़ता मजबूत आधारों और मजबूत नाभिकरागियो द्वारा गिरावट के प्रतिरोध से संबंधित है। | |||
===संदर्भ=== | |||
== | |||
= | |||
{{Reflist}} | {{Reflist}} | ||
[[Category:Created On 07/02/2023]] | [[Category:Created On 07/02/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:लवण]] | |||
[[Category:विद्युत रासायनिक अवधारणाएँ]] | |||
Latest revision as of 20:58, 26 April 2023
पॉलीस्टाइनिन सल्फोनेट, एक काउंटर आयन -स्थानांतरक् राल है, जिसकी आपूर्ति सामान्यतः Na+काउंटर के रूप में की जाती है।
रसायन विज्ञान में, काउंटर आयन एक आयन है जो आयनिक प्रजातियों के साथ विद्युत तटस्थता बनाए रखता है। टेबल नमक में (NaCl, जिसे सोडियम क्लोराइड के रूप में भी जाना जाता है) सोडियम आयन (धनावेशित) क्लोराइड आयन (ऋणायन) और इसके विपरीत के लिए प्रतिरूप है।
एक प्रतिरूप को सामान्यतः ऋणायन या धनायन के रूप में संदर्भित किया जाएगा, यह इस बात पर निर्भर करता है कि यह नकारात्मक या सकारात्मक रूप से आवेशित है या नहीं। इस प्रकार एक ऋणायन का प्रतिकार एक धनायन होगा,और धनायन का प्रतिकार एक ऋणायन होगा।
जैव रसायन में, काउंटरों को सामान्यतः अस्पष्ट रूप से परिभाषित किया जाता है। उनके आवेश के आधार पर, प्रोटीन विभिन्न प्रकार के छोटे आयनों और धनायनों से जुड़े होते हैं। पादप कोशिकाओं में, जल की क्षमता को कम करने और सेल के विस्तार को चलाने के लिए आयन मैलेट रिक्तिका में जमा होता है। तटस्थता बनाए रखने के लिए K+ आयन काउंटर के रूप में जमा होते हैं। आयन परिवहन चैनलों द्वारा जल विरागी सेल की दीवारों के माध्यम से आयन पारगमन की मध्यस्थता की जाती है। न्यूक्लिक अम्ल ऋणायनी होते हैं, संबंधित उद्धरण प्रोटोनेटेड पॉलिएमाइन होते हैं।
अंतरापृष्ठीय रसायन
आयन स्थानांतरण बहुलक और कोलाइड में काउंटर आयन गतिशील आयन हैं।[1] आयन स्थानांतरक् रेजिन शुद्ध नकारात्मक या सकारात्मक आवेश वाले बहुलक हैं। धनायन-स्थानांतरक् रेजिन सामान्यतः सोडियम में काउंटर ऋणायन के साथ ऋणायनी बहुलक होता है। जल के मृदुकरण में रेजिन में उदाहरण के लिए Ca2+ (कैल्शियम) द्वारा अत्यधिक आवेशित किए गए काउंटरीकरण के लिए Ca2+ और रेजिन में एक उच्च संबंध है। इसके विपरीत, आयन-विनिमय रेजिन क्लोराइड Cl - के रूप में प्रदान किए जाते हैं, जो एक अत्यधिक गतिशील काउंटर आयन है।
चरण-स्थानांतरण उत्प्रेरक में काउंटरों का उपयोग किया जाता है। एक विशिष्ट अनुप्रयोग में वसारागी काउंटर धनायन जैसे बेंज़ालकोनियम कार्बनिक विलायक में अभिकर्मकों का विलेयीकरण करता है।
विलयन रसायन
कार्बनिक विलायक में लवण की विलेयता, धनायन और ऋणायन दोनों का एक ही कार्य है। आयन वसारागी होने पर कार्बनिक विलायक में उद्धरणों की घुलनशीलता को बढ़ाया जा सकता है। इसी तरह, कार्बनिक विलायक में आयनों की घुलनशीलता को वसारागीकरण द्वारा बढ़ाया जाता है। सबसे साधारण वसारागी धनायन चतुर्धातुक अमोनियम धनायन हैं, जिन्हें "क्वाट लवण" कहा जाता है।
- Lipophilic counteranions
Lithium tetrakis(pentafluorophenyl)borate is the lithium salt of a highly lipophilic tetraarylborate anion, often referred to as a weakly coordinating anion.[2]
Tetraphenylborate is less lipophilic than the perfluorinated derivative, but widely used as a precipitating agent.
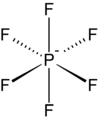
Hexafluorophosphate is a common weakly coordinating anion.
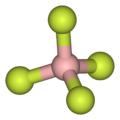
As illustrated by the small counteranion tetrafluoroborate (BF−
4), lipophilic cations tend to be symmetric and singly charged.
- Lipophilic countercations
Bis(triphenylphosphine)iminium chloride is the chloride salt of a bulky lipophilic phosphonium cation [Ph3PNPPh3]+.
Tetraphenylphosphonium chloride (C6H5)4PCl, abbreviated Ph4PCl or PPh4Cl is the chloride of a symmetrical phosphonium cation that is often used in organometallic chemistry. The arsonium salt is also well known.
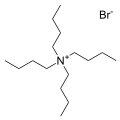
The bromide salt of tetrabutylammonium, one of the most common counter cations. Many analogous "quat salts" are known.
Alkali metal cations bound by crown ethers are common lipophilic countercations, as illustrated by [Li(12-crown-4)2]+.
कई धनायनी कार्बधात्विक परिसरों को निष्क्रिय, गैर-समन्वय काउंटरों से अलग किया जाता है। फेरोसेनियम टेट्राफ्लोरोबोरेट ऐसा ही एक उदाहरण है।
वैद्युतरसायन
उच्च आयनिक चालकता प्राप्त करने के लिए अतिरिक्त विद्युत् अपघट्य की उपस्थिति में विद्युत रासायनिक मापे की जाते हैं। जल में विद्युत् अपघट्य साधारणतयः पोटेशियम क्लोराइड जैसा साधारण नमक होता है। गैर-जलीय विलयनों में मापन के लिए वसारागीकरण और आयन दोनों से बने लवणों का उपयोग किया जाता है, उदाहरण के लिए, टेट्राब्यूटाइल अमोनियम हेक्साफ्लोरोफॉस्फेट। एक ऐसा प्रभाव जो कम विशिष्ट स्थिरांक के विलायक में होता है ऐसी स्थिति में क्षमता आयन- युग्मन से प्रभावित होती है।[3]
प्रतिपक्ष स्थिरता
कई अनुप्रयोगों के लिए, काउंटर आयन केवल आवेश और वसारागिता प्रदान करते है जो अपने साथी आयन को परिचालन की अनुमति देता है। काउंटर आयन रासायनिक रूप से निष्क्रिय है। काउंटर ऋणायन के लिए, लुईस क्षार के संदर्भ में जड़ता व्यक्त की जाती है। काउंटर आदर्श रूप से ऊबड़-खाबड़ और गैर-प्रतिक्रियाशील हैं। चतुष्कोणीय अमोनियम और फॉस्फोनियम प्रतिरूपण के लिए, जड़ता मजबूत आधारों और मजबूत नाभिकरागियो द्वारा गिरावट के प्रतिरोध से संबंधित है।
संदर्भ
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "counter-ions". doi:10.1351/goldbook.C01371
- ↑ I. Krossing and I. Raabe (2004). "Noncoordinating Anions - Fact or Fiction? A Survey of Likely Candidates". Angewandte Chemie International Edition. 43 (16): 2066–2090. doi:10.1002/anie.200300620. PMID 15083452.
- ↑ Geiger, W. E., Barrière, F., "Organometallic Electrochemistry Based on Electrolytes Containing Weakly-Coordinating Fluoroarylborate Anions", Acc. Chem. Res. 2010, 43, 1030. doi:10.1021/ar1000023
![Lithium tetrakis(pentafluorophenyl)borate is the lithium salt of a highly lipophilic tetraarylborate anion, often referred to as a weakly coordinating anion.[2]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png/152px-Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png)

![Bis(triphenylphosphine)iminium chloride is the chloride salt of a bulky lipophilic phosphonium cation [Ph3PNPPh3]+.](https://upload.wikimedia.org/wikipedia/commons/thumb/9/99/PPNCl.png/180px-PPNCl.png)

![Alkali metal cations bound by crown ethers are common lipophilic countercations, as illustrated by [Li(12-crown-4)2]+.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png/118px-Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png)