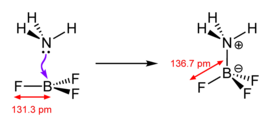लुईस अम्ल और क्षार: Difference between revisions
No edit summary |
No edit summary |
||
| (15 intermediate revisions by 3 users not shown) | |||
| Line 2: | Line 2: | ||
[[File:Lewis bases and acids.jpg|thumb|right|400px|कुछ लुईस का आरेख {{font color|blue|क्षार}} और {{font color|red|अम्ल}}]] | [[File:Lewis bases and acids.jpg|thumb|right|400px|कुछ लुईस का आरेख {{font color|blue|क्षार}} और {{font color|red|अम्ल}}]] | ||
{{Acids and bases}} | {{Acids and bases}} | ||
एक लुईस अम्ल (अमेरिकी भौतिक रसायनज्ञ गिल्बर्ट एन लुईस के नाम पर रखा गया है) एक रासायनिक प्रजाति है, जिसमें एक खाली कक्षा होती है जो एक लुईस [[आधार (रसायन विज्ञान)|क्षार]] से | एक लुईस अम्ल (अमेरिकी भौतिक रसायनज्ञ गिल्बर्ट एन लुईस के नाम पर रखा गया है) एक रासायनिक प्रजाति है, जिसमें एक खाली कक्षा होती है जो एक लुईस [[आधार (रसायन विज्ञान)|क्षार]] से C [[इलेक्ट्रॉन जोड़ी]] को स्वीकार करने में सक्षम होती है ताकि लुईस योगोत्पाद बनाया जा सके। एक लुईस क्षार, एक प्रजाति है जिसमें एक इलेक्ट्रॉन जोड़ी युक्त एक भरी हुआ कक्षा होती है जो [[सहसंयोजक बंधन|सहसंयोजक बंध]] में सम्मिलित नहीं होती है लेकिन एक लुईस अम्ल के साथ एक [[मूल बंधन|दाता बंध]] बना सकती है। उदाहरण के लिए, अमोनिया NH<sub>3</sub> लुईस क्षार है, क्योंकि यह इलेक्ट्रॉनों की एक जोड़ी दान कर सकता है। [[ट्राइमिथाइलबोरेन]] (Me<sub>3</sub>B) एक लुईस अम्ल है क्योंकि यह एक जोड़ी इलेक्ट्रॉन को स्वीकार करने में सक्षम है। एक लुईस जोड़े में, लुईस अम्ल और क्षार एक इलेक्ट्रॉन जोड़ी साझा करते हैं जो लुईस क्षार द्वारा प्रस्तुत किया जाता है, जो एक दाता बंध बनाता है।<ref name="Gold Book Lewis acid L03508">{{GoldBookRef |title=Lewis acid |file=L03508 }}</ref> NH<sub>3</sub> और Me<sub>3</sub>B के बीच एक विशिष्ट [[रासायनिक प्रतिक्रिया|रासायनिक अभिक्रिया]] के संदर्भ में NH<sub>3</sub> से एक अकेली जोड़ी Me<sub>3</sub>B के खाली कक्षा के साथ एक यौगिक NH3•BMe3 बनाने के लिए एक दाता बंध बनाएगी। यह शब्दावली गिल्बर्ट एन लुईस के योगदान को संदर्भित करती है।<ref name = lewisvalence>{{cite book |last1=Lewis |first1=Gilbert Newton |title=Valence and the Structure of Atoms and Molecules |series=American chemical society. Monograph series |date=1923 |publisher=Chemical Catalog Company |location=New York, New York, U.S.A. |page=142 |isbn=9780598985408 |url=https://books.google.com/books?id=2hxDAAAAIAAJ&pg=PA142 }} From p. 142: "We are inclined to think of substances as possessing acid or basic properties, without having a particular solvent in mind. It seems to me that with complete generality we may say that ''a basic substance is one which has a lone pair of electrons which may be used to complete the stable group of another atom'', and that ''an acid substance is one which can employ a lone pair from another molecule'' in completing the stable group of one of its own atoms. In other words, the basic substance furnishes a pair of electrons for a chemical bond, the acid substance accepts such a pair."</ref> [[न्यूक्लियोफाइल]] और [[इलेक्ट्रोफाइल]] शब्द क्रमशः लुईस क्षार और लुईस अम्ल के साथ विनिमेय हैं। सामान्यता, ये शब्द, विशेष रूप से उनके अमूर्त संज्ञा न्यूक्लियोफिलिसिटी और इलेक्ट्रोफिलिसिटी बनाते हैं, अभिक्रियाशीलता के [[गतिज ऊर्जा]] पहलू पर जोर देते हैं, जबकि लुईस क्षारता और लुईस अम्लता, लुईस योगोत्पाद के ऊष्मागतिकी पहलू पर जोर देते हैं | ||
[[न्यूक्लियोफाइल]] और [[इलेक्ट्रोफाइल]] शब्द क्रमशः लुईस क्षार और लुईस अम्ल के साथ विनिमेय हैं। सामान्यता, ये शब्द, विशेष रूप से उनके अमूर्त | |||
== | == योगोत्पाद का चित्रण == | ||
कई मामलों में, एक जटिल | कई मामलों में, एक जटिल लुईस क्षार और लुईस अम्ल के बीच की परस्पर क्रिया को एक तीर द्वारा इंगित किया जाता है जो लुईस क्षार के इलेक्ट्रॉनों को लुईस अम्ल की ओर एक दाता बंध के चिन्हांकन का उपयोग करते हुए दर्शाता है - उदाहरण के लिए, {{chem2|Me3B}}←{{chem2|NH3}} कुछ स्रोत लुईस क्षार को बिन्दुओ की एक जोड़ी (स्पष्ट इलेक्ट्रॉनों का दान किया जा रहा है) के साथ इंगित करते हैं, जो क्षार से ही अम्ल के साथ जटिल में संक्रमण के लगातार प्रतिनिधित्व की अनुमति देता है। | ||
:{{chem2|Me3B + :NH3 -> Me3B:NH3}} | :{{chem2|Me3B + :NH3 -> Me3B:NH3}} | ||
लुईस | लुईस योगोत्पाद का प्रतिनिधित्व करने के लिए एक केंद्र बिंदु का भी उपयोग किया जा सकता है, {{chem2|Me3B}}.{{chem2|NH3}} जैसे एक अन्य उदाहरण [[बोरोन ट्राइफ्लोराइड डायथाइल ईथेरेट]] है, {{chem2|BF3*Et2O}}. थोड़ा अलग उपयोग में, केंद्र बिंदु का उपयोग विभिन्न क्रिस्टल में क्रिस्टलीकरण के जल का प्रतिनिधित्व करने के लिए भी किया जाता है, जैसे कि {{chem2|MgSO4*7H2O}} जलयोजित [[मैग्नीशियम सल्फेट]] के लिए, भले ही जल धातु के साथ एक दाता बंध बनाता हो। | ||
यद्यपि गैर-दाता सहसंयोजक बंधों से दाता बंध को अलग करने के लिए संगणनात्मक, और प्रायोगिक ऊर्जावान मानदंड का उपयोग करने का प्रयास किया गया है,<ref>{{Cite journal|title=On the Nature of the Dative Bond: Coordination to Metals and Beyond. The Carbon Case|journal=Coordination Chemistry Reviews|volume=308|pages=59–75|doi=10.1016/j.ccr.2015.07.018|year=2016|last1=Lepetit|first1=Christine|last2=Maraval|first2=Valérie|last3=Canac|first3=Yves|last4=Chauvin|first4=Remi}}</ref> अधिकांश भाग के लिए,मुख्यता | यद्यपि गैर-दाता सहसंयोजक बंधों से दाता बंध को अलग करने के लिए संगणनात्मक, और प्रायोगिक ऊर्जावान मानदंड का उपयोग करने का प्रयास किया गया है,<ref>{{Cite journal|title=On the Nature of the Dative Bond: Coordination to Metals and Beyond. The Carbon Case|journal=Coordination Chemistry Reviews|volume=308|pages=59–75|doi=10.1016/j.ccr.2015.07.018|year=2016|last1=Lepetit|first1=Christine|last2=Maraval|first2=Valérie|last3=Canac|first3=Yves|last4=Chauvin|first4=Remi}}</ref> अधिकांश भाग के लिए, मुख्यता केवल इलेक्ट्रॉन जोड़ी के स्रोत पर ध्यान देता है, और दाता बंध एक बार बनने के बाद अन्य सहसंयोजक बन्धो के रूप में व्यवहार करते हैं, सामान्यता उनके पास काफी ध्रुवीय चरित्र होता है। इसके अलावा, कुछ मामलों में (जैसे, सल्फॉक्साइड्स और अमीन ऑक्साइड्स {{chem2|R2S->O}} और {{chem2|R3N->O}}), औपचारिक शुल्कों के आरेखण से बचने के लिए दाता बंध तीर का उपयोग सिर्फ एक सांकेतिक सुविधा है। सामान्य तौर पर, यद्पि, दाता-स्वीकर्ता बंध को आदर्श सहसंयोजक बंध और [[आयनिक बंध]] के बीच एक निरंतरता के रूप में देखा जाता है।<ref name="March"/> | ||
== लुईस अम्ल == | == लुईस अम्ल == | ||
[[File:NH3-BF3-adduct-bond-lengthening-2D.png|thumb|270px|left|प्रमुख संरचनात्मक परिवर्तन लुईस क्षार के समन्वयात्मक रूप से असंतृप्त, प्लेनर लुईस अम्ल BF<sub>3</sub> के | [[File:NH3-BF3-adduct-bond-lengthening-2D.png|thumb|270px|left|प्रमुख संरचनात्मक परिवर्तन लुईस क्षार के समन्वयात्मक रूप से असंतृप्त, प्लेनर लुईस अम्ल BF<sub>3</sub> के बंध के साथ होते हैं]]लुईस अम्ल विविध हैं और इस शब्द का प्रयोग शिथिल रूप से किया जाता है। सबसे सरल वे हैं जो लुईस क्षार के साथ सीधे अभिक्रिया करते हैं, जैसे कि बोरॉन ट्राइहैलाइड्स और फॉस्फोरस, आर्सेनिक और एंटीमनी के पेंटाहैलाइड्। | ||
इसी क्रम में CH<sub>3</sub><sup>+</sup> को मेथिलिकरण अभिक्रियाओं में लुईस अम्ल माना जा सकता है। तथापि, संघनित चरण में मिथाइल | इसी क्रम में CH<sub>3</sub><sup>+</sup> को मेथिलिकरण अभिक्रियाओं में लुईस अम्ल माना जा सकता है। तथापि, संघनित चरण में मिथाइल धनायन कभी भी एक मुक्त प्रजाति के रूप में नहीं होता है, और CH<sub>3</sub>I जैसे अभिकर्मकों द्वारा मेथिलिकरण अभिक्रियाएं नाभिकरागी से कार्बन तक एक बंध के एक साथ गठन के माध्यम से और कार्बन और आयोडीन के बीच बंध की विदलन (SN<sup>2</sup> प्रतिक्रिया) से होती है। पाठ्यपुस्तकें इस बिंदु पर असहमत हैं: कुछ का कहना है कि एल्काइल हलाइड् इलेक्ट्रॉनरागी हैं लेकिन लुईस अम्ल नहीं हैं,<ref>{{Cite book|last=Vollhardt|first=K. Peter C. |title=Organic chemistry : structure and function|date=2018|others=Neil Eric Schore|isbn=978-1-319-07945-1|edition=8th|location=New York|page=73|oclc=1007924903}}</ref> जबकि अन्य एल्काइल हलाइड् का वर्णन करते हैं (उदाहरण के लिए CH<sub>3</sub>Br) लुईस अम्ल के एक प्रकार के रूप में।<ref>{{Cite book|last=Carey|first=Francis A. |title=Organic chemistry|date=2003|publisher=McGraw-Hill|isbn=0-07-242458-3|edition=5th|location=Boston|page=46|oclc=48850987}}</ref> [[IUPAC गोल्ड बुक]] में कहा गया है कि लुईस अम्ल और लुईस क्षार अभिक्रिया करके लुईस योगोत्पाद बनाते हैं,<ref name="Gold Book Lewis acid L03508"/> और इलेक्ट्रॉनरागी को लुईस अम्ल के रूप में परिभाषित करते है।<ref>{{GoldBookRef |title=Electrophile (Electrophilic) |file=E02020 }}</ref> | ||
| Line 23: | Line 23: | ||
इस जोड़ में, सभी चार फ्लोराइड केंद्र (या अधिक सटीक रूप से, [[लिगेंड]]) समतुल्य हैं। | इस जोड़ में, सभी चार फ्लोराइड केंद्र (या अधिक सटीक रूप से, [[लिगेंड]]) समतुल्य हैं। | ||
:BF<sub>3</sub> + OMe<sub>2</sub> → BF<sub>3</sub>OMe<sub>2</sub> | :BF<sub>3</sub> + OMe<sub>2</sub> → BF<sub>3</sub>OMe<sub>2</sub> | ||
दोनों BF<sub>4</sub><sup>−</sup> और BF<sub>3</sub>OMe<sub>2</sub> बोरॉन ट्राइफ्लोराइड के लुईस क्षार | दोनों BF<sub>4</sub><sup>−</sup> और BF<sub>3</sub>OMe<sub>2</sub> बोरॉन ट्राइफ्लोराइड के लुईस क्षार योगोत्पाद हैं। | ||
कई | कई योगोत्पाद ऑक्टेट नियम का उल्लंघन करते हैं, जैसे [[ट्रायोड्स का]] ऋणायन | ||
:I<sub>2</sub> + I<sup>−</sup> → I<sub>3</sub><sup>−</sup> | :I<sub>2</sub> + I<sup>−</sup> → I<sub>3</sub><sup>−</sup> | ||
आयोडीन विलयन,के रंगों की परिवर्तनशीलता लुईस अम्ल I<sub>2</sub>के साथ | आयोडीन विलयन, के रंगों की परिवर्तनशीलता लुईस अम्ल I<sub>2</sub> के साथ योगोत्पादों को बनाने के लिए विलायक की परिवर्तनशील क्षमताओं को दर्शाती है: | ||
कुछ लुईस अम्ल दो लुईस क्षारों को बांधते हैं, एक प्रसिद्ध उदाहरण [[हेक्साफ्लोरोओसि्लेट| | कुछ लुईस अम्ल दो लुईस क्षारों को बांधते हैं, एक प्रसिद्ध उदाहरण [[हेक्साफ्लोरोओसि्लेट|हेक्साफ्लुओरोसिलिकेट]] का निर्माण होता है: | ||
: | :SiF<sub>4</sub> + 2 F<sup>−</sup> → SiF<sub>6</sub><sup>2−</sup> | ||
=== जटिल लुईस अम्ल === | === जटिल लुईस अम्ल === | ||
लुईस अम्ल माने जाने वाले अधिकांश यौगिकों को लुईस क्षार के साथ जोड़ के गठन से पहले एक सक्रियण चरण की आवश्यकता होती है। एथिलेलुमिनियम सेस्क्यूक्लोराइड Et<sub>3</sub>Al<sub>2</sub>Cl<sub>3</sub>और एल्यूमीनियम क्लोराइड AlCl<sub>3</sub> जैसे जटिल यौगिकों को ट्राइगोनल प्लानर लुईस अम्ल के रूप में माना जाता है ये लेकिन समुच्चय और बहुलक | लुईस अम्ल माने जाने वाले अधिकांश यौगिकों को लुईस क्षार के साथ जोड़ के गठन से पहले एक सक्रियण चरण की आवश्यकता होती है। एथिलेलुमिनियम सेस्क्यूक्लोराइड Et<sub>3</sub>Al<sub>2</sub>Cl<sub>3</sub>और एल्यूमीनियम क्लोराइड AlCl<sub>3</sub> जैसे जटिल यौगिकों को ट्राइगोनल प्लानर लुईस अम्ल के रूप में माना जाता है ये लेकिन समुच्चय और बहुलक के रूप में मौजूद होते है जिसे लुईस क्षार द्वारा अवक्रमित किया जाना चाहिए।<ref>Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. {{ISBN|0-7506-3365-4}}.{{page needed|date=September 2021}}</ref> एक सरल स्थिति बोरेन के योगोत्पादों का निर्माण है। मोनोमेरिक BH<sub>3</sub> पर्याप्त रूप से मौजूद नहीं है, इसलिए डाईबोरेन के क्षरण से बोरेन के योग उत्पन्न होते हैं: | ||
:B<sub>2</sub>H<sub>6</sub> + 2 H<sup>−</sup> → 2 BH<sub>4</sub><sup>−</sup> | :B<sub>2</sub>H<sub>6</sub> + 2 H<sup>−</sup> → 2 BH<sub>4</sub><sup>−</sup> | ||
इस मामले में, एक मध्यवर्ती B<sub>2</sub>H<sub>7</sub><sup>−</sup> अलग किया जा सकता है। | इस मामले में, एक मध्यवर्ती B<sub>2</sub>H<sub>7</sub><sup>−</sup> अलग किया जा सकता है। | ||
कई धातु परिसर लुईस अम्ल के रूप में काम करते हैं, लेकिन | कई धातु परिसर लुईस अम्ल के रूप में काम करते हैं, लेकिन सामान्यतः केवल अधिक कमजोर रूप से बंधे लुईस क्षार को अलग करने के बाद, प्रायः जल प्राप्त होता है। | ||
: [Mg(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> + 6 NH<sub>3</sub> → [Mg(NH<sub>3</sub>)<sub>6</sub>]<sup>2+</sup> + 6 H<sub>2</sub>O | : [Mg(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> + 6 NH<sub>3</sub> → [Mg(NH<sub>3</sub>)<sub>6</sub>]<sup>2+</sup> + 6 H<sub>2</sub>O | ||
'''<big>H<sup>+</sup> लुईस अम्ल के रूप में</big>''' | '''<big>H<sup>+</sup> लुईस अम्ल के रूप में</big>''' | ||
[[प्रोटॉन]] (H<sup>+</sup>)<ref name="hydron" />सबसे | [[प्रोटॉन]] (H<sup>+</sup>)<ref name="hydron" /> सबसे प्रबल लुईस अम्ल में से एक है, लेकिन सबसे जटिल लुईस अम्ल में से भी एक है। इस तथ्य को अनदेखा करने के लिए चलन है कि एक प्रोटॉन भारी विलायक (विलायक के लिए बाध्य) है। इस सरलीकरण को ध्यान में रखते हुए, अम्ल-क्षार अभिक्रियाओं को योगोत्पादों के निर्माण के रूप में देखा जा सकता है | ||
* H<sup>+</sup> + NH<sub>3</sub> → NH<sub>4</sub><sup>+</sup> | * H<sup>+</sup> + NH<sub>3</sub> → NH<sub>4</sub><sup>+</sup> | ||
| Line 48: | Line 48: | ||
===लुईस अम्ल के अनुप्रयोग=== | ===लुईस अम्ल के अनुप्रयोग=== | ||
लुईस अम्ल का एक विशिष्ट उदाहरण फ्रीडेल-क्राफ्ट्स एल्कलीकरण अभिक्रिया में है।<ref name=March>March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. {{ISBN|0-471-60180-2}}.{{page needed|date=September 2021}}</ref> AlCl<sub>3</sub> द्वारा एक क्लोराइड आयन अयुग्मित युग्म की स्वीकृति करता है जिससे AlCl<sub>4</sub> का निर्माण होता है और अत्यधिक अम्लीय, यानी इलेक्ट्रोफिलिक, कार्बोनियम आयन का निर्माण होता है। | |||
: RCl +AlCl<sub>3</sub> → R<sup>+</sup> + AlCl<sub>4</sub><sup>−</sup> | : RCl +AlCl<sub>3</sub> → R<sup>+</sup> + AlCl<sub>4</sub><sup>−</sup> | ||
== लुईस क्षार == | == लुईस क्षार == | ||
एक लुईस क्षार एक परमाणु या आणविक प्रजाति है जहां सबसे अधिक व्याप्त आणविक कक्षीय (HOMO) अत्यधिक स्थानीयकृत है। विशिष्ट लुईस क्षार अमोनिया और [[एल्काइल]] एमाइन जैसे पारंपरिक [[अमाइन]] हैं। अन्य | एक लुईस क्षार एक परमाणु या आणविक प्रजाति है जहां सबसे अधिक व्याप्त आणविक कक्षीय (HOMO) अत्यधिक स्थानीयकृत है। विशिष्ट लुईस क्षार अमोनिया और [[एल्काइल]] एमाइन जैसे पारंपरिक [[अमाइन]] हैं। अन्य साधारण लुईस क्षारों में [[पिरिडीन]] और इसके व्युत्पन्न सम्मिलित हैं। लुईस क्षार के कुछ मुख्य वर्ग हैं | ||
* सूत्र | * सूत्र NH<sub>3−<var>x</var></sub>R<sub><var>x</var></sub> की एमीन् ,जहाँ R = ऐल्किल या ऐरिल। इनसे संबंधित [[पिरिडीन]] और इसके व्युत्पन्न हैं। | ||
* फॉर्मूला | * फॉर्मूला [[फॉस्फीन|PR<sub>3−<var>x</var></sub>A<sub><var>x</var></sub>]] के [[फॉस्फीन|फॉस्फीन,]] जहाँ R =एल्काइल, A= एरील।<!-- sorry, "Ar" symbol is allocated statically since 1957 --> | ||
* O, S, Se और Te के यौगिक ऑक्सीकरण अवस्था -2 में, जिनमें | * O, S, Se और Te के यौगिक ऑक्सीकरण अवस्था -2 में, जिनमें जल, [[ईथर]], [[कीटोन्स|कीटोन]] सम्मिलित हैं | ||
सबसे | सबसे सामान्य लुईस क्षार ऋणायन हैं। लुईस क्षारकता की शक्ति मूल अम्ल <var>pK<sub>a</sub></var> के साथ संबंध रखती है उच्च <var>pK<sub>a</sub></var> अम्ल अच्छे लुईस क्षार देते हैं। हमेशा की तरह, एक कमजोर अम्ल का एक मजबूत संयुग्म क्षार होता है। | ||
* इलेक्ट्रॉन जोड़ी दाता की सामान्य परिभाषा के | * इलेक्ट्रॉन जोड़ी दाता की सामान्य परिभाषा के आधार पर लुईस क्षारों के उदाहरणों में सम्मिलित हैं: | ||
**सरल | **सरल ऋणायन, जैसे हाइड्राइड H<sup>−</sup> और फ्लोराइड F<sup>−</sup> | ||
**अन्य एकाकी-जोड़ी युक्त प्रजातियां, जैसे कि | **अन्य एकाकी-जोड़ी युक्त प्रजातियां, जैसे कि H<sub>2</sub>O, NH<sub>3</sub>, HO<sup>−</sup>और CH<sub>3</sub><sup>−</sup> | ||
** जटिल | ** जटिल ऋणायन, जैसे [[सल्फेट]] | ||
**इलेक्ट्रॉन से भरपूर {{pi}}- | **इलेक्ट्रॉन से भरपूर {{pi}}-प्रणाली लुईस क्षार, जैसे [[एथाइन]], एथीन और [[बेंजीन]] | ||
लुईस क्षार की | लुईस क्षार की शक्ति का मूल्यांकन विभिन्न लुईस अम्ल के लिए किया गया है, जैसे I<sub>2</sub>, SbCl<sub>5</sub>, and BF<sub>3</sub>.<ref>Christian Laurence and Jean-François Gal "Lewis Basicity and Affinity Scales : Data and Measurement" | ||
Wiley, 2009. {{ISBN|978-0-470-74957-9}}.{{page needed|date=September 2021}}</ref> | Wiley, 2009. {{ISBN|978-0-470-74957-9}}.{{page needed|date=September 2021}}</ref> | ||
{| class="wikitable collapsible" align="center" border="1" cellspacing="0" cellpadding="0" style="margin: 0 0 0 0em; background: #FFFFFF; border-collapse: collapse; border-color: #C0C030;" | {| class="wikitable collapsible" align="center" border="1" cellspacing="0" cellpadding="0" style="margin: 0 0 0 0em; background: #FFFFFF; border-collapse: collapse; border-color: #C0C030;" | ||
| Line 74: | Line 74: | ||
! style="background:#ffdead;"| Enthalpy of complexation (kJ/mol) | ! style="background:#ffdead;"| Enthalpy of complexation (kJ/mol) | ||
|- | |- | ||
| | |क्विन्यूक्लिडीन | ||
|N | |N | ||
|150 | |150 | ||
|- | |- | ||
| | |इट थ्रीएन | ||
|N | |N | ||
|135 | |135 | ||
|- | |- | ||
| | |पिरिडीन | ||
|N | |N | ||
|128 | |128 | ||
|- | |- | ||
| | |एसीटोनाइट्रिल | ||
|N | |N | ||
|60 | |60 | ||
|- | |- | ||
| | |डीएमओ | ||
|O | |O | ||
|112 | |112 | ||
|- | |- | ||
| | |डीएमएसओ | ||
|O | |O | ||
|105 | |105 | ||
|- | |- | ||
| | |टीएचएफ | ||
|O | |O | ||
|90.4 | |90.4 | ||
|- | |- | ||
| | |इटटूओ | ||
|O | |O | ||
|78.8 | |78.8 | ||
|- | |- | ||
| | |एसीटोन | ||
|O | |O | ||
|76.0 | |76.0 | ||
|- | |- | ||
| | |इटओऐसी | ||
|O | |O | ||
|75.5 | |75.5 | ||
|- | |- | ||
| | |ट्राईमिथाइलफॉस्फीन | ||
|P | |P | ||
|97.3 | |97.3 | ||
|- | |- | ||
| | |टेट्राहाइड्रोथियोफीन | ||
|S | |S | ||
|51.6 | |51.6 | ||
| Line 127: | Line 127: | ||
===लुईस क्षारों के अनुप्रयोग=== | ===लुईस क्षारों के अनुप्रयोग=== | ||
{{main|समांगी उत्प्रेरण}} | {{main|समांगी उत्प्रेरण}} | ||
लगभग सभी इलेक्ट्रॉन युग्म दाता जो बाध्यकारी संक्रमण तत्वों द्वारा यौगिकों का निर्माण करते हैं, उन्हें लुईस क्षार-या | लगभग सभी इलेक्ट्रॉन युग्म दाता जो बाध्यकारी संक्रमण तत्वों द्वारा यौगिकों का निर्माण करते हैं, उन्हें लुईस क्षार-या लिगैंड् के संग्रह के रूप में देखा जा सकता है। इस प्रकार लुईस क्षार का एक बड़ा अनुप्रयोग धातु उत्प्रेरक की गतिविधि और चयनात्मकता को संशोधित करना है। काइरल लुईस क्षार इस प्रकार एक उत्प्रेरक पर काइरलिटी प्रदान करते हैं,ये [[असममित कटैलिसीस|असममित उत्प्रेरक]] को सक्षम करते हैं, जो औषधि के उत्पादन के लिए उपयोगी है। | ||
कई | कई लुईस क्षार बहुदंतुक हैं, यानी वे लुईस अम्ल के लिए कई बंध बना सकते हैं। इन बहुदंतुक लुईस क्षारों को [[कीलेटिंग एजेंट]] कहा जाता है। | ||
== हार्ड और सॉफ्ट वर्गीकरण == | == हार्ड और सॉफ्ट वर्गीकरण == | ||
{{main|एचएसएबी सिद्धांत}} | {{main|एचएसएबी सिद्धांत}} | ||
लुईस अम्ल और क्षार को | लुईस अम्ल और क्षार को सामान्यतः उनकी कठोरता या कोमलता के अनुसार वर्गीकृत किया जाता है। इस संदर्भ में कठिन का तात्पर्य छोटे और गैर-ध्रुवीय से है और नरम का तात्पर्य उनसे है जो बड़े परमाणुओं को इंगित करते है जो अधिक ध्रुवीकरण योग्य हैं। | ||
* | *विशिष्ट कठोर अम्ल: H<sup>+</sup>, क्षार/क्षारीय मृदा धातु धनायन, बोरेन, Zn<sup>2+</sup> | ||
* | *विशिष्ट नरम अम्ल: Ag<sup>+</sup>, Mo(0), Ni(0), Pt<sup>2+</sup> | ||
*विशिष्ट कठोर क्षार: अमोनिया और एमाइन, | *विशिष्ट कठोर क्षार: अमोनिया और एमाइन, जल, कार्बोक्सिलेट्स, फ्लोराइड और क्लोराइड | ||
* | *विशिष्ट नरम क्षार: ऑर्गनोफॉस्फिन्स, थियोईथर, कार्बन मोनोऑक्साइड, आयोडाइड | ||
उदाहरण के लिए, एक अमाइन अम्ल | उदाहरण के लिए, एक अमाइन, अम्ल BF<sub>3</sub> के साथ फॉस्फीन को योगोत्पाद से विस्थापित कर देगा इसी प्रकार क्षारों का वर्गीकरण किया जा सकता है। उदाहरण के लिए, ऑक्सीजन परमाणु से एक अकेला जोड़ा दान करने वाले क्षार नाइट्रोजन परमाणु के माध्यम से दान करने वाले क्षारों की तुलना में कठिन होते हैं। यद्यपि वर्गीकरण को कभी भी परिमाणित नहीं किया गया था, यह प्रमुख अवधारणाओं का उपयोग करते हुए, कठोर अम्ल-कठोर क्षार और नरम अम्ल-नरम क्षार परस्पर क्रिया कठोर अम्ल-नरम क्षार या नरम अम्ल कठोर क्षार से अधिक मजबूत होते हैं, यह योगोत्पाद गठन की शक्ति का अनुमान लगाने में बहुत उपयोगी साबित हुआ। बाद में जाँच के ऊष्मप्रवैगिकी की जांच ने सुझाव दिया कि कठोर-कठोर अंतःक्रियाएं एन्थैल्पी पक्षधर हैं, जबकि नरम-नरम [[एन्ट्रापी]] के पक्षधर हैं। | ||
== लुईस अम्लता की मात्रा निर्धारित करना == | == लुईस अम्लता की मात्रा निर्धारित करना == | ||
लुईस अम्लता का मूल्यांकन और भविष्यवाणी करने के लिए कई तरीके तैयार किए गए हैं। कई स्पेक्ट्रोस्कोपिक हस्ताक्षरों पर | लुईस अम्लता का मूल्यांकन और भविष्यवाणी करने के लिए कई तरीके तैयार किए गए हैं। कई स्पेक्ट्रोस्कोपिक हस्ताक्षरों पर आधारित होते हैं जैसे शिफ्ट NMR सिग्नल या IR बैंड उदाहरण [[गुटमैन-बेकेट विधि]] और चिल्ड्स<ref>{{cite journal | last1 = Childs | first1 = R.F | last2 = Mulholland | first2 = D.L | last3 = Nixon | first3 = A. | year = 1982 | title = Lewis acid adducts of α,β-unsaturated carbonyl and nitrile compounds. A nuclear magnetic resonance study | journal = Can. J. Chem. | volume = 60 | issue = 6| pages = 801–808 | doi=10.1139/v82-117| doi-access = free }}</ref> तरीका। | ||
ECW मॉडल एक मात्रात्मक मॉडल है जो लुईस अम्ल क्षार | ECW मॉडल एक मात्रात्मक मॉडल है जो लुईस अम्ल क्षार परस्पर क्रिया -ΔH की शक्ति का वर्णन और भविष्यवाणी करता है। मॉडल ने कई लुईस अम्ल और क्षार को E और C पैरामीटर दिए। प्रत्येक अम्ल की विशेषता एक E<sub>A</sub> और एक C<sub>A</sub> है इसी तरह प्रत्येक क्षार की अपनी विशेषता E<sub>B</sub>और C<sub>B</sub> है। E और C पैरामीटर क्रमशः इलेक्ट्रोस्टैटिक और सहसंयोजक योगदान को संदर्भित करते हैं जो बंध की शक्ति में अम्ल और क्षार बनेंगे, समीकरण है: | ||
: −ΔH = | : −ΔH = E<sub>A</sub>E<sub>B</sub> + C<sub>A</sub>C<sub>B</sub> + W | ||
W पद अम्ल-क्षार अभिक्रिया के लिए निरंतर ऊर्जा योगदान का प्रतिनिधित्व करता है जैसे डाइमेरिक अम्ल या क्षार की दरार। समीकरण अम्ल और क्षार शक्ति के उलट होने की भविष्यवाणी करता है। समीकरण की चित्रमय प्रस्तुतियों से पता चलता है कि लुईस क्षार की शक्ति या लुईस अम्ल की शक्ति का एक ही क्रम नहीं है।<ref>{{cite journal |doi=10.1021/ed073p701 |title=The ECW Model |year=1996 |last1=Vogel |first1=Glenn C. |last2=Drago |first2=Russell S. |journal=Journal of Chemical Education |volume=73 |issue=8 |page=701 |bibcode=1996JChEd..73..701V }}</ref><ref>{{cite journal |doi=10.1021/ed054p612 |title=Great e and C plot. Graphical display of the enthalpies of adduct formation for Lewis acids and bases |year=1977 |last1=Cramer |first1=Roger E. |last2=Bopp |first2=Thomas T. |journal=Journal of Chemical Education |volume=54 |issue=10 |page=612 |bibcode=1977JChEd..54..612C }}</ref> और एकल गुण पैमाने अम्ल या क्षार की एक छोटी श्रेणी तक सीमित हैं। | |||
== इतिहास == | == इतिहास == | ||
[[Image:Dative covalent bond2.png|thumb|[[एमओ आरेख]] दो परमाणुओं के बीच मूल सहसंयोजक बंध के गठन को दर्शाता है]]अवधारणा की उत्पत्ति गिल्बर्ट एन. लुईस से हुई जिन्होंने रासायनिक | [[Image:Dative covalent bond2.png|thumb|[[एमओ आरेख]] दो परमाणुओं के बीच मूल सहसंयोजक बंध के गठन को दर्शाता है]]अवधारणा की उत्पत्ति गिल्बर्ट एन. लुईस से हुई जिन्होंने रासायनिक बंध का अध्ययन किया। 1923 में, लुईस ने लिखा था कि एक अम्ल वह पदार्थ है जो अपने स्वयं के परमाणुओं में से एक के स्थिर समूह को पूरा करने के लिए दूसरे अणु से एक इलेक्ट्रॉन अयुग्मित युग्म नियोजित कर सकता है।<ref name="lewisvalence"/><ref name="lewis_1">मिस्लर, एल.एम., टार, डी.ए., (1991) पृ. 166 - खोजों की तालिका लुईस सिद्धांत के लिए प्रकाशन/रिलीज़ की तारीख को 1923 मानती है। </ref> ब्रोंस्टेड-लोरी एसिड-बेस सिद्धांत उसी वर्ष प्रकाशित हुआ था। दो सिद्धांत अलग हैं लेकिन पूरक हैं। लुईस बेस भी ब्रोन्स्टेड-लोरी बेस है, लेकिन लुईस एसिड को ब्रोंस्टेड-लोरी एसिड होने की आवश्यकता नहीं है। 1963 में हार्ड और सॉफ्ट एसिड और बेस (एचएसएबी सिद्धांत) में वर्गीकरण। लुईस एसिड-बेस इंटरैक्शन की ताकत, जैसा कि एक जोड़ के गठन के मानक एन्थैल्पी द्वारा मापा जाता है, ड्रैगो-वेलैंड दो-पैरामीटर समीकरण द्वारा भविष्यवाणी की जा सकती है। | ||
===लुईस सिद्धांत का सुधार=== | ===लुईस सिद्धांत का सुधार=== | ||
लुईस ने 1916 में सुझाव दिया था कि इलेक्ट्रॉनों की जोड़ी साझा करके दो परमाणुओं को एक रासायनिक बंधन में एक साथ रखा जाता है।<ref>{{cite journal |last1=Lewis |first1=Gilbert N. |title=The atom and the molecule |journal=Journal of the American Chemical Society |date=April 1916 |volume=38 |issue=4 |pages=762–785 |doi=10.1021/ja02261a002 |s2cid=95865413 |url=https://babel.hathitrust.org/cgi/pt?id=hvd.hs1t2w;view=1up;seq=772}}</ref> जब प्रत्येक परमाणु ने | लुईस ने 1916 में सुझाव दिया था कि इलेक्ट्रॉनों की जोड़ी साझा करके दो परमाणुओं को एक रासायनिक बंधन में एक साथ रखा जाता है।<ref>{{cite journal |last1=Lewis |first1=Gilbert N. |title=The atom and the molecule |journal=Journal of the American Chemical Society |date=April 1916 |volume=38 |issue=4 |pages=762–785 |doi=10.1021/ja02261a002 |s2cid=95865413 |url=https://babel.hathitrust.org/cgi/pt?id=hvd.hs1t2w;view=1up;seq=772}}</ref> जब प्रत्येक परमाणु ने बंध में एक इलेक्ट्रॉन का योगदान दिया, तो इसे सहसंयोजक बंध कहा जाता था। जब दोनों इलेक्ट्रॉन एक परमाणु से आते हैं, तो इसे मूल सहसंयोजक बंध या [[समन्वय बंधन|समन्वय बंध]] कहा जाता है। भेद बहुत स्पष्ट नहीं है। उदाहरण के लिए, [[अमोनिया]] और हाइड्रोजन से अमोनियम आयन के निर्माण में अमोनिया अणु हाइड्रोजन को इलेक्ट्रॉनों की एक जोड़ी दान करता है;<ref name="hydron">Traditionally, but not precisely, [[hydron (chemistry)|H<sup>+</sup> ions]] are referred as "[[proton]]s". See {{GoldBookRef|title=hydron|file=H02904}}</ref> बनने वाले [[अमोनियम]] आयन में इलेक्ट्रॉनों की पहचान खो जाती है। फिर भी, लुईस ने सुझाव दिया कि एक इलेक्ट्रॉन-जोड़ी दाता को क्षार के रूप में वर्गीकृत किया जाना चाहिए और एक इलेक्ट्रॉन-जोड़ी स्वीकर्ता को अम्ल के रूप में वर्गीकृत किया जाना चाहिए। | ||
लुईस अम्ल की एक और अधिक आधुनिक परिभाषा एक परमाणु या आणविक प्रजाति है जो कम ऊर्जा के स्थानीय खाली [[परमाणु कक्षीय]] या [[आणविक कक्षीय]] | लुईस अम्ल की एक और अधिक आधुनिक परिभाषा एक परमाणु या आणविक प्रजाति है जो कम ऊर्जा के स्थानीय खाली [[परमाणु कक्षीय]] या [[आणविक कक्षीय]] है। यह निम्नतम-ऊर्जा आणविक कक्षीय ([[LUMO]]) इलेक्ट्रॉनों की एक जोड़ी को समायोजित कर सकता है। | ||
=== ब्रोंस्टेड-लोरी सिद्धांत के साथ तुलना === | === ब्रोंस्टेड-लोरी सिद्धांत के साथ तुलना === | ||
एक लुईस क्षार अक्सर ब्रोंस्टेड-लोरी क्षार होता है क्योंकि यह | एक लुईस क्षार अक्सर ब्रोंस्टेड-लोरी क्षार होता है क्योंकि यह H<sup>+</sup> को इलेक्ट्रॉनों की एक जोड़ी दान कर सकता है<sup>+</sup>;<ref name="hydron"/> प्रोटॉन एक लुईस अम्ल है क्योंकि यह इलेक्ट्रॉनों की एक जोड़ी को स्वीकार कर सकता है। ब्रोंस्टेड-लोरी अम्ल का संयुग्म क्षार भी डीप्रोटोनेशन के रूप में लुईस क्षार है जैसे H<sup>+</sup> की हानि अम्ल से उन इलेक्ट्रॉनों को छोड़ देता है जो संयुग्म क्षार पर एक अकेले जोड़े के रूप में A—H बंध के लिए उपयोग किए जाते थे। सामान्यतः, एक लुईस क्षार [[प्रोटोनेशन]] के लिए बहुत मुश्किल हो सकता है, फिर भी लुईस अम्ल के साथ अभिक्रिया करता है। उदाहरण के लिए, [[कार्बन मोनोआक्साइड]] एक बहुत कमजोर ब्रोंस्टेड-लोरी क्षार है लेकिन यह BF<sub>3</sub> के साथ एक मजबूत जोड़ बनाता है। | ||
ब्राउन और कनेर द्वारा लुईस और ब्रोंस्टेड-लोरी अम्लता की एक और तुलना में,<ref>{{cite journal |doi=10.1021/ja00957a023 |title=Preparation and Reactions of 2,6-Di-t-butylpyridine and Related Hindered Bases. A Case of Steric Hindrance toward the Proton |year=1966 |last1=Brown |first1=Herbert C. |last2=Kanner |first2=Bernard |journal=Journal of the American Chemical Society |volume=88 |issue=5 |pages=986–992 }}</ref> 2,6-डाइ-टी-ब्यूटिलपायरीडीन HCl के साथ हाइड्रोक्लोराइड नमक बनाने के लिए अभिक्रिया करता है लेकिन BF<sub>3</sub>के साथ अभिक्रिया नहीं करता है. यह उदाहरण दर्शाता है कि स्टायरिक कारक, इलेक्ट्रॉन विन्यास कारकों के अलावा, भारी डाइ-टी-ब्यूटिलपायरीडीन और छोटे प्रोटॉन के बीच परस्पर क्रिया की शक्ति का निर्धारण करने में एक भूमिका निभाते हैं। | |||
== यह भी देखें == | == यह भी देखें == | ||
| Line 180: | Line 191: | ||
*{{cite book|author1-link=William B. Jensen |title=The Lewis acid-base concepts : an overview |last=Jensen |first=W.B.|year=1980 |publisher=Wiley |location=New York |isbn=0-471-03902-0 }} | *{{cite book|author1-link=William B. Jensen |title=The Lewis acid-base concepts : an overview |last=Jensen |first=W.B.|year=1980 |publisher=Wiley |location=New York |isbn=0-471-03902-0 }} | ||
*{{cite book |title= Lewis acid reagents : a practical approach|last=Yamamoto |first=Hisashi |year=1999 |publisher= Oxford University Press|location=New York |isbn=0-19-850099-8}} | *{{cite book |title= Lewis acid reagents : a practical approach|last=Yamamoto |first=Hisashi |year=1999 |publisher= Oxford University Press|location=New York |isbn=0-19-850099-8}} | ||
[[Category: | [[Category:Articles with hatnote templates targeting a nonexistent page]] | ||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:Created On 08/02/2023]] | [[Category:Created On 08/02/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Pages with reference errors]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Template documentation pages|Short description/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia articles needing page number citations from September 2021]] | |||
[[Category:अम्ल-क्षार रसायन]] | |||
[[Category:आधार (रसायन विज्ञान)]] | |||
[[Category:एसिड]] | |||
Latest revision as of 20:47, 26 April 2023
एक लुईस अम्ल (अमेरिकी भौतिक रसायनज्ञ गिल्बर्ट एन लुईस के नाम पर रखा गया है) एक रासायनिक प्रजाति है, जिसमें एक खाली कक्षा होती है जो एक लुईस क्षार से C इलेक्ट्रॉन जोड़ी को स्वीकार करने में सक्षम होती है ताकि लुईस योगोत्पाद बनाया जा सके। एक लुईस क्षार, एक प्रजाति है जिसमें एक इलेक्ट्रॉन जोड़ी युक्त एक भरी हुआ कक्षा होती है जो सहसंयोजक बंध में सम्मिलित नहीं होती है लेकिन एक लुईस अम्ल के साथ एक दाता बंध बना सकती है। उदाहरण के लिए, अमोनिया NH3 लुईस क्षार है, क्योंकि यह इलेक्ट्रॉनों की एक जोड़ी दान कर सकता है। ट्राइमिथाइलबोरेन (Me3B) एक लुईस अम्ल है क्योंकि यह एक जोड़ी इलेक्ट्रॉन को स्वीकार करने में सक्षम है। एक लुईस जोड़े में, लुईस अम्ल और क्षार एक इलेक्ट्रॉन जोड़ी साझा करते हैं जो लुईस क्षार द्वारा प्रस्तुत किया जाता है, जो एक दाता बंध बनाता है।[1] NH3 और Me3B के बीच एक विशिष्ट रासायनिक अभिक्रिया के संदर्भ में NH3 से एक अकेली जोड़ी Me3B के खाली कक्षा के साथ एक यौगिक NH3•BMe3 बनाने के लिए एक दाता बंध बनाएगी। यह शब्दावली गिल्बर्ट एन लुईस के योगदान को संदर्भित करती है।[2] न्यूक्लियोफाइल और इलेक्ट्रोफाइल शब्द क्रमशः लुईस क्षार और लुईस अम्ल के साथ विनिमेय हैं। सामान्यता, ये शब्द, विशेष रूप से उनके अमूर्त संज्ञा न्यूक्लियोफिलिसिटी और इलेक्ट्रोफिलिसिटी बनाते हैं, अभिक्रियाशीलता के गतिज ऊर्जा पहलू पर जोर देते हैं, जबकि लुईस क्षारता और लुईस अम्लता, लुईस योगोत्पाद के ऊष्मागतिकी पहलू पर जोर देते हैं
योगोत्पाद का चित्रण
कई मामलों में, एक जटिल लुईस क्षार और लुईस अम्ल के बीच की परस्पर क्रिया को एक तीर द्वारा इंगित किया जाता है जो लुईस क्षार के इलेक्ट्रॉनों को लुईस अम्ल की ओर एक दाता बंध के चिन्हांकन का उपयोग करते हुए दर्शाता है - उदाहरण के लिए, Me3B←NH3 कुछ स्रोत लुईस क्षार को बिन्दुओ की एक जोड़ी (स्पष्ट इलेक्ट्रॉनों का दान किया जा रहा है) के साथ इंगित करते हैं, जो क्षार से ही अम्ल के साथ जटिल में संक्रमण के लगातार प्रतिनिधित्व की अनुमति देता है।
- Me3B + :NH3 → Me3B:NH3
लुईस योगोत्पाद का प्रतिनिधित्व करने के लिए एक केंद्र बिंदु का भी उपयोग किया जा सकता है, Me3B.NH3 जैसे एक अन्य उदाहरण बोरोन ट्राइफ्लोराइड डायथाइल ईथेरेट है, BF3·Et2O. थोड़ा अलग उपयोग में, केंद्र बिंदु का उपयोग विभिन्न क्रिस्टल में क्रिस्टलीकरण के जल का प्रतिनिधित्व करने के लिए भी किया जाता है, जैसे कि MgSO4·7H2O जलयोजित मैग्नीशियम सल्फेट के लिए, भले ही जल धातु के साथ एक दाता बंध बनाता हो।
यद्यपि गैर-दाता सहसंयोजक बंधों से दाता बंध को अलग करने के लिए संगणनात्मक, और प्रायोगिक ऊर्जावान मानदंड का उपयोग करने का प्रयास किया गया है,[3] अधिकांश भाग के लिए, मुख्यता केवल इलेक्ट्रॉन जोड़ी के स्रोत पर ध्यान देता है, और दाता बंध एक बार बनने के बाद अन्य सहसंयोजक बन्धो के रूप में व्यवहार करते हैं, सामान्यता उनके पास काफी ध्रुवीय चरित्र होता है। इसके अलावा, कुछ मामलों में (जैसे, सल्फॉक्साइड्स और अमीन ऑक्साइड्स R2S → O और R3N → O), औपचारिक शुल्कों के आरेखण से बचने के लिए दाता बंध तीर का उपयोग सिर्फ एक सांकेतिक सुविधा है। सामान्य तौर पर, यद्पि, दाता-स्वीकर्ता बंध को आदर्श सहसंयोजक बंध और आयनिक बंध के बीच एक निरंतरता के रूप में देखा जाता है।[4]
लुईस अम्ल
लुईस अम्ल विविध हैं और इस शब्द का प्रयोग शिथिल रूप से किया जाता है। सबसे सरल वे हैं जो लुईस क्षार के साथ सीधे अभिक्रिया करते हैं, जैसे कि बोरॉन ट्राइहैलाइड्स और फॉस्फोरस, आर्सेनिक और एंटीमनी के पेंटाहैलाइड्।
इसी क्रम में CH3+ को मेथिलिकरण अभिक्रियाओं में लुईस अम्ल माना जा सकता है। तथापि, संघनित चरण में मिथाइल धनायन कभी भी एक मुक्त प्रजाति के रूप में नहीं होता है, और CH3I जैसे अभिकर्मकों द्वारा मेथिलिकरण अभिक्रियाएं नाभिकरागी से कार्बन तक एक बंध के एक साथ गठन के माध्यम से और कार्बन और आयोडीन के बीच बंध की विदलन (SN2 प्रतिक्रिया) से होती है। पाठ्यपुस्तकें इस बिंदु पर असहमत हैं: कुछ का कहना है कि एल्काइल हलाइड् इलेक्ट्रॉनरागी हैं लेकिन लुईस अम्ल नहीं हैं,[5] जबकि अन्य एल्काइल हलाइड् का वर्णन करते हैं (उदाहरण के लिए CH3Br) लुईस अम्ल के एक प्रकार के रूप में।[6] IUPAC गोल्ड बुक में कहा गया है कि लुईस अम्ल और लुईस क्षार अभिक्रिया करके लुईस योगोत्पाद बनाते हैं,[1] और इलेक्ट्रॉनरागी को लुईस अम्ल के रूप में परिभाषित करते है।[7]
सरल लुईस अम्ल
इस तरह के लुईस अम्ल के कुछ सबसे अधिक अध्ययन किए गए उदाहरण बोरॉन ट्राइहैलाइड्स और ओर्गेनोबोरेनस हैं:[8]
- BF3 + F− → BF4−
इस जोड़ में, सभी चार फ्लोराइड केंद्र (या अधिक सटीक रूप से, लिगेंड) समतुल्य हैं।
- BF3 + OMe2 → BF3OMe2
दोनों BF4− और BF3OMe2 बोरॉन ट्राइफ्लोराइड के लुईस क्षार योगोत्पाद हैं।
कई योगोत्पाद ऑक्टेट नियम का उल्लंघन करते हैं, जैसे ट्रायोड्स का ऋणायन
- I2 + I− → I3−
आयोडीन विलयन, के रंगों की परिवर्तनशीलता लुईस अम्ल I2 के साथ योगोत्पादों को बनाने के लिए विलायक की परिवर्तनशील क्षमताओं को दर्शाती है:
कुछ लुईस अम्ल दो लुईस क्षारों को बांधते हैं, एक प्रसिद्ध उदाहरण हेक्साफ्लुओरोसिलिकेट का निर्माण होता है:
- SiF4 + 2 F− → SiF62−
जटिल लुईस अम्ल
लुईस अम्ल माने जाने वाले अधिकांश यौगिकों को लुईस क्षार के साथ जोड़ के गठन से पहले एक सक्रियण चरण की आवश्यकता होती है। एथिलेलुमिनियम सेस्क्यूक्लोराइड Et3Al2Cl3और एल्यूमीनियम क्लोराइड AlCl3 जैसे जटिल यौगिकों को ट्राइगोनल प्लानर लुईस अम्ल के रूप में माना जाता है ये लेकिन समुच्चय और बहुलक के रूप में मौजूद होते है जिसे लुईस क्षार द्वारा अवक्रमित किया जाना चाहिए।[9] एक सरल स्थिति बोरेन के योगोत्पादों का निर्माण है। मोनोमेरिक BH3 पर्याप्त रूप से मौजूद नहीं है, इसलिए डाईबोरेन के क्षरण से बोरेन के योग उत्पन्न होते हैं:
- B2H6 + 2 H− → 2 BH4−
इस मामले में, एक मध्यवर्ती B2H7− अलग किया जा सकता है।
कई धातु परिसर लुईस अम्ल के रूप में काम करते हैं, लेकिन सामान्यतः केवल अधिक कमजोर रूप से बंधे लुईस क्षार को अलग करने के बाद, प्रायः जल प्राप्त होता है।
- [Mg(H2O)6]2+ + 6 NH3 → [Mg(NH3)6]2+ + 6 H2O
H+ लुईस अम्ल के रूप में
प्रोटॉन (H+)[10] सबसे प्रबल लुईस अम्ल में से एक है, लेकिन सबसे जटिल लुईस अम्ल में से भी एक है। इस तथ्य को अनदेखा करने के लिए चलन है कि एक प्रोटॉन भारी विलायक (विलायक के लिए बाध्य) है। इस सरलीकरण को ध्यान में रखते हुए, अम्ल-क्षार अभिक्रियाओं को योगोत्पादों के निर्माण के रूप में देखा जा सकता है
- H+ + NH3 → NH4+
- H+ + OH− → H2O
लुईस अम्ल के अनुप्रयोग
लुईस अम्ल का एक विशिष्ट उदाहरण फ्रीडेल-क्राफ्ट्स एल्कलीकरण अभिक्रिया में है।[4] AlCl3 द्वारा एक क्लोराइड आयन अयुग्मित युग्म की स्वीकृति करता है जिससे AlCl4 का निर्माण होता है और अत्यधिक अम्लीय, यानी इलेक्ट्रोफिलिक, कार्बोनियम आयन का निर्माण होता है।
- RCl +AlCl3 → R+ + AlCl4−
लुईस क्षार
एक लुईस क्षार एक परमाणु या आणविक प्रजाति है जहां सबसे अधिक व्याप्त आणविक कक्षीय (HOMO) अत्यधिक स्थानीयकृत है। विशिष्ट लुईस क्षार अमोनिया और एल्काइल एमाइन जैसे पारंपरिक अमाइन हैं। अन्य साधारण लुईस क्षारों में पिरिडीन और इसके व्युत्पन्न सम्मिलित हैं। लुईस क्षार के कुछ मुख्य वर्ग हैं
- सूत्र NH3−xRx की एमीन् ,जहाँ R = ऐल्किल या ऐरिल। इनसे संबंधित पिरिडीन और इसके व्युत्पन्न हैं।
- फॉर्मूला PR3−xAx के फॉस्फीन, जहाँ R =एल्काइल, A= एरील।
- O, S, Se और Te के यौगिक ऑक्सीकरण अवस्था -2 में, जिनमें जल, ईथर, कीटोन सम्मिलित हैं
सबसे सामान्य लुईस क्षार ऋणायन हैं। लुईस क्षारकता की शक्ति मूल अम्ल pKa के साथ संबंध रखती है उच्च pKa अम्ल अच्छे लुईस क्षार देते हैं। हमेशा की तरह, एक कमजोर अम्ल का एक मजबूत संयुग्म क्षार होता है।
- इलेक्ट्रॉन जोड़ी दाता की सामान्य परिभाषा के आधार पर लुईस क्षारों के उदाहरणों में सम्मिलित हैं:
लुईस क्षार की शक्ति का मूल्यांकन विभिन्न लुईस अम्ल के लिए किया गया है, जैसे I2, SbCl5, and BF3.[11]
| Lewis base | Donor atom | Enthalpy of complexation (kJ/mol) |
|---|---|---|
| क्विन्यूक्लिडीन | N | 150 |
| इट थ्रीएन | N | 135 |
| पिरिडीन | N | 128 |
| एसीटोनाइट्रिल | N | 60 |
| डीएमओ | O | 112 |
| डीएमएसओ | O | 105 |
| टीएचएफ | O | 90.4 |
| इटटूओ | O | 78.8 |
| एसीटोन | O | 76.0 |
| इटओऐसी | O | 75.5 |
| ट्राईमिथाइलफॉस्फीन | P | 97.3 |
| टेट्राहाइड्रोथियोफीन | S | 51.6 |
लुईस क्षारों के अनुप्रयोग
लगभग सभी इलेक्ट्रॉन युग्म दाता जो बाध्यकारी संक्रमण तत्वों द्वारा यौगिकों का निर्माण करते हैं, उन्हें लुईस क्षार-या लिगैंड् के संग्रह के रूप में देखा जा सकता है। इस प्रकार लुईस क्षार का एक बड़ा अनुप्रयोग धातु उत्प्रेरक की गतिविधि और चयनात्मकता को संशोधित करना है। काइरल लुईस क्षार इस प्रकार एक उत्प्रेरक पर काइरलिटी प्रदान करते हैं,ये असममित उत्प्रेरक को सक्षम करते हैं, जो औषधि के उत्पादन के लिए उपयोगी है।
कई लुईस क्षार बहुदंतुक हैं, यानी वे लुईस अम्ल के लिए कई बंध बना सकते हैं। इन बहुदंतुक लुईस क्षारों को कीलेटिंग एजेंट कहा जाता है।
हार्ड और सॉफ्ट वर्गीकरण
लुईस अम्ल और क्षार को सामान्यतः उनकी कठोरता या कोमलता के अनुसार वर्गीकृत किया जाता है। इस संदर्भ में कठिन का तात्पर्य छोटे और गैर-ध्रुवीय से है और नरम का तात्पर्य उनसे है जो बड़े परमाणुओं को इंगित करते है जो अधिक ध्रुवीकरण योग्य हैं।
- विशिष्ट कठोर अम्ल: H+, क्षार/क्षारीय मृदा धातु धनायन, बोरेन, Zn2+
- विशिष्ट नरम अम्ल: Ag+, Mo(0), Ni(0), Pt2+
- विशिष्ट कठोर क्षार: अमोनिया और एमाइन, जल, कार्बोक्सिलेट्स, फ्लोराइड और क्लोराइड
- विशिष्ट नरम क्षार: ऑर्गनोफॉस्फिन्स, थियोईथर, कार्बन मोनोऑक्साइड, आयोडाइड
उदाहरण के लिए, एक अमाइन, अम्ल BF3 के साथ फॉस्फीन को योगोत्पाद से विस्थापित कर देगा इसी प्रकार क्षारों का वर्गीकरण किया जा सकता है। उदाहरण के लिए, ऑक्सीजन परमाणु से एक अकेला जोड़ा दान करने वाले क्षार नाइट्रोजन परमाणु के माध्यम से दान करने वाले क्षारों की तुलना में कठिन होते हैं। यद्यपि वर्गीकरण को कभी भी परिमाणित नहीं किया गया था, यह प्रमुख अवधारणाओं का उपयोग करते हुए, कठोर अम्ल-कठोर क्षार और नरम अम्ल-नरम क्षार परस्पर क्रिया कठोर अम्ल-नरम क्षार या नरम अम्ल कठोर क्षार से अधिक मजबूत होते हैं, यह योगोत्पाद गठन की शक्ति का अनुमान लगाने में बहुत उपयोगी साबित हुआ। बाद में जाँच के ऊष्मप्रवैगिकी की जांच ने सुझाव दिया कि कठोर-कठोर अंतःक्रियाएं एन्थैल्पी पक्षधर हैं, जबकि नरम-नरम एन्ट्रापी के पक्षधर हैं।
लुईस अम्लता की मात्रा निर्धारित करना
लुईस अम्लता का मूल्यांकन और भविष्यवाणी करने के लिए कई तरीके तैयार किए गए हैं। कई स्पेक्ट्रोस्कोपिक हस्ताक्षरों पर आधारित होते हैं जैसे शिफ्ट NMR सिग्नल या IR बैंड उदाहरण गुटमैन-बेकेट विधि और चिल्ड्स[12] तरीका।
ECW मॉडल एक मात्रात्मक मॉडल है जो लुईस अम्ल क्षार परस्पर क्रिया -ΔH की शक्ति का वर्णन और भविष्यवाणी करता है। मॉडल ने कई लुईस अम्ल और क्षार को E और C पैरामीटर दिए। प्रत्येक अम्ल की विशेषता एक EA और एक CA है इसी तरह प्रत्येक क्षार की अपनी विशेषता EBऔर CB है। E और C पैरामीटर क्रमशः इलेक्ट्रोस्टैटिक और सहसंयोजक योगदान को संदर्भित करते हैं जो बंध की शक्ति में अम्ल और क्षार बनेंगे, समीकरण है:
- −ΔH = EAEB + CACB + W
W पद अम्ल-क्षार अभिक्रिया के लिए निरंतर ऊर्जा योगदान का प्रतिनिधित्व करता है जैसे डाइमेरिक अम्ल या क्षार की दरार। समीकरण अम्ल और क्षार शक्ति के उलट होने की भविष्यवाणी करता है। समीकरण की चित्रमय प्रस्तुतियों से पता चलता है कि लुईस क्षार की शक्ति या लुईस अम्ल की शक्ति का एक ही क्रम नहीं है।[13][14] और एकल गुण पैमाने अम्ल या क्षार की एक छोटी श्रेणी तक सीमित हैं।
इतिहास

अवधारणा की उत्पत्ति गिल्बर्ट एन. लुईस से हुई जिन्होंने रासायनिक बंध का अध्ययन किया। 1923 में, लुईस ने लिखा था कि एक अम्ल वह पदार्थ है जो अपने स्वयं के परमाणुओं में से एक के स्थिर समूह को पूरा करने के लिए दूसरे अणु से एक इलेक्ट्रॉन अयुग्मित युग्म नियोजित कर सकता है।[2][15] ब्रोंस्टेड-लोरी एसिड-बेस सिद्धांत उसी वर्ष प्रकाशित हुआ था। दो सिद्धांत अलग हैं लेकिन पूरक हैं। लुईस बेस भी ब्रोन्स्टेड-लोरी बेस है, लेकिन लुईस एसिड को ब्रोंस्टेड-लोरी एसिड होने की आवश्यकता नहीं है। 1963 में हार्ड और सॉफ्ट एसिड और बेस (एचएसएबी सिद्धांत) में वर्गीकरण। लुईस एसिड-बेस इंटरैक्शन की ताकत, जैसा कि एक जोड़ के गठन के मानक एन्थैल्पी द्वारा मापा जाता है, ड्रैगो-वेलैंड दो-पैरामीटर समीकरण द्वारा भविष्यवाणी की जा सकती है।
लुईस सिद्धांत का सुधार
लुईस ने 1916 में सुझाव दिया था कि इलेक्ट्रॉनों की जोड़ी साझा करके दो परमाणुओं को एक रासायनिक बंधन में एक साथ रखा जाता है।[16] जब प्रत्येक परमाणु ने बंध में एक इलेक्ट्रॉन का योगदान दिया, तो इसे सहसंयोजक बंध कहा जाता था। जब दोनों इलेक्ट्रॉन एक परमाणु से आते हैं, तो इसे मूल सहसंयोजक बंध या समन्वय बंध कहा जाता है। भेद बहुत स्पष्ट नहीं है। उदाहरण के लिए, अमोनिया और हाइड्रोजन से अमोनियम आयन के निर्माण में अमोनिया अणु हाइड्रोजन को इलेक्ट्रॉनों की एक जोड़ी दान करता है;[10] बनने वाले अमोनियम आयन में इलेक्ट्रॉनों की पहचान खो जाती है। फिर भी, लुईस ने सुझाव दिया कि एक इलेक्ट्रॉन-जोड़ी दाता को क्षार के रूप में वर्गीकृत किया जाना चाहिए और एक इलेक्ट्रॉन-जोड़ी स्वीकर्ता को अम्ल के रूप में वर्गीकृत किया जाना चाहिए।
लुईस अम्ल की एक और अधिक आधुनिक परिभाषा एक परमाणु या आणविक प्रजाति है जो कम ऊर्जा के स्थानीय खाली परमाणु कक्षीय या आणविक कक्षीय है। यह निम्नतम-ऊर्जा आणविक कक्षीय (LUMO) इलेक्ट्रॉनों की एक जोड़ी को समायोजित कर सकता है।
ब्रोंस्टेड-लोरी सिद्धांत के साथ तुलना
एक लुईस क्षार अक्सर ब्रोंस्टेड-लोरी क्षार होता है क्योंकि यह H+ को इलेक्ट्रॉनों की एक जोड़ी दान कर सकता है+;[10] प्रोटॉन एक लुईस अम्ल है क्योंकि यह इलेक्ट्रॉनों की एक जोड़ी को स्वीकार कर सकता है। ब्रोंस्टेड-लोरी अम्ल का संयुग्म क्षार भी डीप्रोटोनेशन के रूप में लुईस क्षार है जैसे H+ की हानि अम्ल से उन इलेक्ट्रॉनों को छोड़ देता है जो संयुग्म क्षार पर एक अकेले जोड़े के रूप में A—H बंध के लिए उपयोग किए जाते थे। सामान्यतः, एक लुईस क्षार प्रोटोनेशन के लिए बहुत मुश्किल हो सकता है, फिर भी लुईस अम्ल के साथ अभिक्रिया करता है। उदाहरण के लिए, कार्बन मोनोआक्साइड एक बहुत कमजोर ब्रोंस्टेड-लोरी क्षार है लेकिन यह BF3 के साथ एक मजबूत जोड़ बनाता है।
ब्राउन और कनेर द्वारा लुईस और ब्रोंस्टेड-लोरी अम्लता की एक और तुलना में,[17] 2,6-डाइ-टी-ब्यूटिलपायरीडीन HCl के साथ हाइड्रोक्लोराइड नमक बनाने के लिए अभिक्रिया करता है लेकिन BF3के साथ अभिक्रिया नहीं करता है. यह उदाहरण दर्शाता है कि स्टायरिक कारक, इलेक्ट्रॉन विन्यास कारकों के अलावा, भारी डाइ-टी-ब्यूटिलपायरीडीन और छोटे प्रोटॉन के बीच परस्पर क्रिया की शक्ति का निर्धारण करने में एक भूमिका निभाते हैं।
यह भी देखें
- अम्ल
- क्षार (रसायन विज्ञान)
- अम्ल-क्षार अभिक्रिया
- ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत
- चिरल लुईस अम्ल
- निराश लुईस जोड़ी
- गुटमैन-बेकेट विधि
- ईसीडब्ल्यू मॉडल
संदर्भ
- ↑ 1.0 1.1 IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Lewis acid". doi:10.1351/goldbook.L03508
- ↑ 2.0 2.1 Lewis, Gilbert Newton (1923). Valence and the Structure of Atoms and Molecules. American chemical society. Monograph series. New York, New York, U.S.A.: Chemical Catalog Company. p. 142. ISBN 9780598985408. From p. 142: "We are inclined to think of substances as possessing acid or basic properties, without having a particular solvent in mind. It seems to me that with complete generality we may say that a basic substance is one which has a lone pair of electrons which may be used to complete the stable group of another atom, and that an acid substance is one which can employ a lone pair from another molecule in completing the stable group of one of its own atoms. In other words, the basic substance furnishes a pair of electrons for a chemical bond, the acid substance accepts such a pair."
- ↑ Lepetit, Christine; Maraval, Valérie; Canac, Yves; Chauvin, Remi (2016). "On the Nature of the Dative Bond: Coordination to Metals and Beyond. The Carbon Case". Coordination Chemistry Reviews. 308: 59–75. doi:10.1016/j.ccr.2015.07.018.
- ↑ 4.0 4.1 March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.[page needed]
- ↑ Vollhardt, K. Peter C. (2018). Organic chemistry : structure and function. Neil Eric Schore (8th ed.). New York. p. 73. ISBN 978-1-319-07945-1. OCLC 1007924903.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Carey, Francis A. (2003). Organic chemistry (5th ed.). Boston: McGraw-Hill. p. 46. ISBN 0-07-242458-3. OCLC 48850987.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Electrophile (Electrophilic)". doi:10.1351/goldbook.E02020
- ↑ Rowsell, Bryan D.; Gillespie, Ronald J.; Heard, George L. (1999). "Ligand Close-Packing and the Lewis Acidity of BF3 and BCl3". Inorganic Chemistry. 38 (21): 4659–4662. doi:10.1021/ic990713m. PMID 11671188.
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.[page needed]
- ↑ 10.0 10.1 10.2 Traditionally, but not precisely, H+ ions are referred as "protons". See IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hydron". doi:10.1351/goldbook.H02904
- ↑ Christian Laurence and Jean-François Gal "Lewis Basicity and Affinity Scales : Data and Measurement" Wiley, 2009. ISBN 978-0-470-74957-9.[page needed]
- ↑ Childs, R.F; Mulholland, D.L; Nixon, A. (1982). "Lewis acid adducts of α,β-unsaturated carbonyl and nitrile compounds. A nuclear magnetic resonance study". Can. J. Chem. 60 (6): 801–808. doi:10.1139/v82-117.
- ↑ Vogel, Glenn C.; Drago, Russell S. (1996). "The ECW Model". Journal of Chemical Education. 73 (8): 701. Bibcode:1996JChEd..73..701V. doi:10.1021/ed073p701.
- ↑ Cramer, Roger E.; Bopp, Thomas T. (1977). "Great e and C plot. Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54 (10): 612. Bibcode:1977JChEd..54..612C. doi:10.1021/ed054p612.
- ↑ मिस्लर, एल.एम., टार, डी.ए., (1991) पृ. 166 - खोजों की तालिका लुईस सिद्धांत के लिए प्रकाशन/रिलीज़ की तारीख को 1923 मानती है।
- ↑ Lewis, Gilbert N. (April 1916). "The atom and the molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002. S2CID 95865413.
- ↑ Brown, Herbert C.; Kanner, Bernard (1966). "Preparation and Reactions of 2,6-Di-t-butylpyridine and Related Hindered Bases. A Case of Steric Hindrance toward the Proton". Journal of the American Chemical Society. 88 (5): 986–992. doi:10.1021/ja00957a023.
अग्रिम पठन
- Jensen, W.B. (1980). The Lewis acid-base concepts : an overview. New York: Wiley. ISBN 0-471-03902-0.
- Yamamoto, Hisashi (1999). Lewis acid reagents : a practical approach. New York: Oxford University Press. ISBN 0-19-850099-8.