एन्ट्रापी (चिरसम्मत ऊष्मप्रवैगिकी): Difference between revisions
No edit summary |
No edit summary |
||
| (5 intermediate revisions by 3 users not shown) | |||
| Line 6: | Line 6: | ||
[[लुडविग बोल्ट्जमैन]] ने एन्ट्रॉपी को प्रणाली के व्यक्तिगत परमाणुओं और अणुओं (माइक्रोस्टेट्स) के संभावित सूक्ष्म विन्यास Ω की संख्या के माप के रूप में समझाया, जो प्रणाली के मैक्रोस्कोपिक स्टेट (मैक्रोस्टेट) के अनुरूप है। उन्होंने दिखाया कि थर्मोडायनामिक एन्ट्रापी {{math|''k'' ln Ω}} है, जहां कारक k तब से [[बोल्ट्जमैन स्थिरांक]] के रूप में जाना जाता है। | [[लुडविग बोल्ट्जमैन]] ने एन्ट्रॉपी को प्रणाली के व्यक्तिगत परमाणुओं और अणुओं (माइक्रोस्टेट्स) के संभावित सूक्ष्म विन्यास Ω की संख्या के माप के रूप में समझाया, जो प्रणाली के मैक्रोस्कोपिक स्टेट (मैक्रोस्टेट) के अनुरूप है। उन्होंने दिखाया कि थर्मोडायनामिक एन्ट्रापी {{math|''k'' ln Ω}} है, जहां कारक k तब से [[बोल्ट्जमैन स्थिरांक]] के रूप में जाना जाता है। | ||
== अवधारणा == | == अवधारणा == | ||
[[Image:system boundary.svg|175px|thumb|चित्रा 1. थर्मोडायनामिक मॉडल प्रणाली]]थर्मोडायनामिक प्रणाली के दबाव, घनत्व और तापमान में अंतर समय के साथ समान हो जाता है। उदाहरण के लिए, कमरे में पिघलने वाली बर्फ का गिलास, गर्म कमरे और बर्फ और पानी के ठंडे गिलास के बीच के तापमान के अंतर को कमरे से ठंडे बर्फ और पानी के मिश्रण में गर्मी के रूप में बहने वाली ऊर्जा के समान किया जाता है। समय के साथ, कांच और उसकी सामग्री का तापमान और कमरे का तापमान संतुलन प्राप्त कर लेता है। कमरे की एन्ट्रॉपी कम हो गई है। चूँकि , बर्फ और पानी के गिलास की एन्ट्रापी कमरे की एन्ट्रापी की तुलना में अधिक बढ़ गई है। पृथक प्रणाली में, जैसे कि कमरे और बर्फ के पानी को साथ ले जाने पर, गर्म से ठंडे क्षेत्रों में ऊर्जा का फैलाव सदैव एन्ट्रापी में शुद्ध वृद्धि का परिणाम होता है। इस प्रकार, जब कमरे और बर्फ के पानी की प्रणाली थर्मल संतुलन तक पहुंच गई है, प्रारंभिक अवस्था से एन्ट्रापी परिवर्तन अपने अधिकतम पर है। ऊष्मप्रवैगिकी प्रणाली की एन्ट्रापी समीकरण की प्रगति का उपाय है। | [[Image:system boundary.svg|175px|thumb|चित्रा 1. थर्मोडायनामिक मॉडल प्रणाली]]थर्मोडायनामिक प्रणाली के दबाव, घनत्व और तापमान में अंतर समय के साथ समान हो जाता है। उदाहरण के लिए, कमरे में पिघलने वाली बर्फ का गिलास, गर्म कमरे और बर्फ और पानी के ठंडे गिलास के बीच के तापमान के अंतर को कमरे से ठंडे बर्फ और पानी के मिश्रण में गर्मी के रूप में बहने वाली ऊर्जा के समान किया जाता है। समय के साथ, कांच और उसकी सामग्री का तापमान और कमरे का तापमान संतुलन प्राप्त कर लेता है। कमरे की एन्ट्रॉपी कम हो गई है। चूँकि , बर्फ और पानी के गिलास की एन्ट्रापी कमरे की एन्ट्रापी की तुलना में अधिक बढ़ गई है। पृथक प्रणाली में, जैसे कि कमरे और बर्फ के पानी को साथ ले जाने पर, गर्म से ठंडे क्षेत्रों में ऊर्जा का फैलाव सदैव एन्ट्रापी में शुद्ध वृद्धि का परिणाम होता है। इस प्रकार, जब कमरे और बर्फ के पानी की प्रणाली थर्मल संतुलन तक पहुंच गई है, प्रारंभिक अवस्था से एन्ट्रापी परिवर्तन अपने अधिकतम पर है। ऊष्मप्रवैगिकी प्रणाली की एन्ट्रापी समीकरण की प्रगति का उपाय है। | ||
कई अपरिवर्तनीय प्रक्रियाओं के परिणामस्वरूप एन्ट्रापी में वृद्धि होती है। उनमें से दो या दो से अधिक विभिन्न पदार्थों का मिश्रण है, जो तापमान और दबाव को स्थिर रखते हुए, उन्हें अलग करने वाली दीवार को हटाकर उन्हें साथ लाकर किया जाता है। मिश्रण [[मिश्रण की एन्ट्रापी]] के साथ होता है। आदर्श गैसों के मिश्रण के महत्वपूर्ण स्थितियों में संयुक्त प्रणाली कार्य या ताप हस्तांतरण द्वारा अपनी आंतरिक ऊर्जा को नहीं बदलती है; एन्ट्रापी वृद्धि तब पूरी तरह से विभिन्न पदार्थों के उनके नए सामान्य आयतन में फैलने के कारण होती है।<ref>[http://entropysite.oxy.edu/calpoly_talk.html Notes for a "Conversation About Entropy"]</ref> | कई अपरिवर्तनीय प्रक्रियाओं के परिणामस्वरूप एन्ट्रापी में वृद्धि होती है। उनमें से दो या दो से अधिक विभिन्न पदार्थों का मिश्रण है, जो तापमान और दबाव को स्थिर रखते हुए, उन्हें अलग करने वाली दीवार को हटाकर उन्हें साथ लाकर किया जाता है। मिश्रण [[मिश्रण की एन्ट्रापी]] के साथ होता है। आदर्श गैसों के मिश्रण के महत्वपूर्ण स्थितियों में संयुक्त प्रणाली कार्य या ताप हस्तांतरण द्वारा अपनी आंतरिक ऊर्जा को नहीं बदलती है; एन्ट्रापी वृद्धि तब पूरी तरह से विभिन्न पदार्थों के उनके नए सामान्य आयतन में फैलने के कारण होती है।<ref>[http://entropysite.oxy.edu/calpoly_talk.html Notes for a "Conversation About Entropy"]</ref> | ||
मैक्रोस्कोपिक दृष्टिकोण से क्लासिकल ऊष्मप्रवैगिकी में एन्ट्रापी थर्मोडायनामिक प्रणाली का राज्य कार्य है: अर्थात, संपत्ति जो केवल प्रणाली की वर्तमान स्थिति पर निर्भर करती है, इस बात से स्वतंत्र कि वह राज्य कैसे प्राप्त हुआ। एन्ट्रॉपी ऊष्मप्रवैगिकी के दूसरे नियम का प्रमुख घटक है, जिसके महत्वपूर्ण परिणाम हैं उदा। ताप इंजन रेफ्रिजरेटर और ताप पंप के प्रदर्शन के लिए होता है | मैक्रोस्कोपिक दृष्टिकोण से क्लासिकल ऊष्मप्रवैगिकी में एन्ट्रापी थर्मोडायनामिक प्रणाली का राज्य कार्य है: अर्थात, संपत्ति जो केवल प्रणाली की वर्तमान स्थिति पर निर्भर करती है, इस बात से स्वतंत्र कि वह राज्य कैसे प्राप्त हुआ। एन्ट्रॉपी ऊष्मप्रवैगिकी के दूसरे नियम का प्रमुख घटक है, जिसके महत्वपूर्ण परिणाम हैं उदा। ताप इंजन रेफ्रिजरेटर और ताप पंप के प्रदर्शन के लिए होता है | ||
== परिभाषा == | == परिभाषा == | ||
उत्कृष्ट प्रमेय के अनुसार, बंद सजातीय प्रणाली के लिए, जिसमें केवल उत्क्रमणीय प्रक्रियाएं होती हैं, | उत्कृष्ट प्रमेय के अनुसार, बंद सजातीय प्रणाली के लिए, जिसमें केवल उत्क्रमणीय प्रक्रियाएं होती हैं, | ||
:<math>\oint \frac{\delta Q}{T}=0.</math> | :<math>\oint \frac{\delta Q}{T}=0.</math> | ||
| Line 22: | Line 22: | ||
अवस्था फलन S, जिसे एंट्रॉपी कहा जाता है परिभाषित किया जा सकता है जो संतुष्ट करता है | अवस्था फलन S, जिसे एंट्रॉपी कहा जाता है परिभाषित किया जा सकता है जो संतुष्ट करता है | ||
:<math>\mathrm{d}S = \frac{\delta Q}{T}.</math> | :<math>\mathrm{d}S = \frac{\delta Q}{T}.</math> | ||
== एंट्रॉपी माप == | == एंट्रॉपी माप == | ||
समान बंद प्रणाली की थर्मोडायनामिक स्थिति इसके तापमान T और दबाव P द्वारा निर्धारित की जाती है। एन्ट्रापी में परिवर्तन के रूप में लिखा जा सकता है | समान बंद प्रणाली की थर्मोडायनामिक स्थिति इसके तापमान T और दबाव P द्वारा निर्धारित की जाती है। एन्ट्रापी में परिवर्तन के रूप में लिखा जा सकता है | ||
| Line 61: | Line 59: | ||
{{see also|एन्ट्रापी उत्पादन}} | {{see also|एन्ट्रापी उत्पादन}} | ||
अब हम विषम प्रणालियों पर विचार करते हैं जिनमें आंतरिक परिवर्तन (प्रक्रियाएं) हो सकती हैं। यदि हम इस तरह की आंतरिक प्रक्रिया से पहले एन्ट्रापी ''S''<sub>1</sub>और ''S''<sub>2</sub> की गणना करते हैं, तो ऊष्मप्रवैगिकी का दूसरा नियम मांग करता है कि ''S''<sub>2</sub> ≥ ''S''<sub>1</sub> | अब हम विषम प्रणालियों पर विचार करते हैं जिनमें आंतरिक परिवर्तन (प्रक्रियाएं) हो सकती हैं। यदि हम इस तरह की आंतरिक प्रक्रिया से पहले एन्ट्रापी ''S''<sub>1</sub>और ''S''<sub>2</sub> की गणना करते हैं, तो ऊष्मप्रवैगिकी का दूसरा नियम मांग करता है कि ''S''<sub>2</sub> ≥ ''S''<sub>1</sub> जहां प्रक्रिया प्रतिवर्ती होने पर समानता चिह्न धारण करता है। [[अपरिवर्तनीय प्रक्रिया]] के कारण अंतर ''S''<sub>i</sub> = ''S''<sub>2</sub> − ''S''<sub>1</sub> [[एन्ट्रापी उत्पादन]] है। दूसरा नियम मांग करता है कि पृथक प्रणाली की एंट्रॉपी कम नहीं हो सकती है। | ||
मान लीजिए कि प्रणाली थर्मल और यांत्रिक रूप से पर्यावरण (पृथक प्रणाली) से अलग है। उदाहरण के लिए, जंगम विभाजन द्वारा विभाजित इन्सुलेट कठोर बॉक्स पर विचार करें, प्रत्येक गैस से भरा हुआ है। यदि गैस का दबाव अधिक है, तो यह विभाजन को आगे बढ़ाकर विस्तार करेगा, इस प्रकार दूसरी गैस पर काम करेगा। इसके अतिरिक्त यदि गैसें अलग-अलग तापमान पर हैं तो गर्मी गैस से दूसरी गैस में प्रवाहित हो सकती है, परंतु विभाजन गर्मी चालन की अनुमति देता है। हमारा उपरोक्त परिणाम इंगित करता है कि इन प्रक्रियाओं के समय पूरे प्रणाली की एन्ट्रापी बढ़ेगी। परिस्थितियों में प्रणाली के पास अधिकतम मात्रा में एंट्रॉपी उपस्थित हो सकती है। यह एन्ट्रापी स्थिर संतुलन की स्थिति से मेल खाती है, क्योंकि किसी अन्य संतुलन स्थिति में परिवर्तन से एन्ट्रॉपी कम हो जाएगी जो कि वर्जित है। | मान लीजिए कि प्रणाली थर्मल और यांत्रिक रूप से पर्यावरण (पृथक प्रणाली) से अलग है। उदाहरण के लिए, जंगम विभाजन द्वारा विभाजित इन्सुलेट कठोर बॉक्स पर विचार करें, प्रत्येक गैस से भरा हुआ है। यदि गैस का दबाव अधिक है, तो यह विभाजन को आगे बढ़ाकर विस्तार करेगा, इस प्रकार दूसरी गैस पर काम करेगा। इसके अतिरिक्त यदि गैसें अलग-अलग तापमान पर हैं तो गर्मी गैस से दूसरी गैस में प्रवाहित हो सकती है, परंतु विभाजन गर्मी चालन की अनुमति देता है। हमारा उपरोक्त परिणाम इंगित करता है कि इन प्रक्रियाओं के समय पूरे प्रणाली की एन्ट्रापी बढ़ेगी। परिस्थितियों में प्रणाली के पास अधिकतम मात्रा में एंट्रॉपी उपस्थित हो सकती है। यह एन्ट्रापी स्थिर संतुलन की स्थिति से मेल खाती है, क्योंकि किसी अन्य संतुलन स्थिति में परिवर्तन से एन्ट्रॉपी कम हो जाएगी जो कि वर्जित है। जब प्रणाली इस अधिकतम-एन्ट्रॉपी स्थिति में पहुँच जाता है, तो प्रणाली का कोई भी भाग किसी अन्य भाग पर कार्य नहीं कर सकता है। यह इस अर्थ में है कि एंट्रॉपी प्रणाली में ऊर्जा का उपाय है जिसे काम करने के लिए उपयोग नहीं किया जा सकता है। | ||
अपरिवर्तनीय प्रक्रिया थर्मोडायनामिक प्रणाली के प्रदर्शन को कम करती है, जिसे काम करने या शीतलन उत्पन्न करने के लिए डिज़ाइन किया गया है, और एंट्रॉपी उत्पादन में परिणाम होता है। उत्क्रमणीय प्रक्रिया के समय एन्ट्रापी उत्पादन शून्य होता है। इस प्रकार एन्ट्रापी उत्पादन अपरिवर्तनीयता का उपाय है और इसका उपयोग इंजीनियरिंग प्रक्रियाओं और मशीनों की तुलना करने के लिए किया जा सकता है। | अपरिवर्तनीय प्रक्रिया थर्मोडायनामिक प्रणाली के प्रदर्शन को कम करती है, जिसे काम करने या शीतलन उत्पन्न करने के लिए डिज़ाइन किया गया है, और एंट्रॉपी उत्पादन में परिणाम होता है। उत्क्रमणीय प्रक्रिया के समय एन्ट्रापी उत्पादन शून्य होता है। इस प्रकार एन्ट्रापी उत्पादन अपरिवर्तनीयता का उपाय है और इसका उपयोग इंजीनियरिंग प्रक्रियाओं और मशीनों की तुलना करने के लिए किया जा सकता है। | ||
== थर्मल मशीनें == | == थर्मल मशीनें == | ||
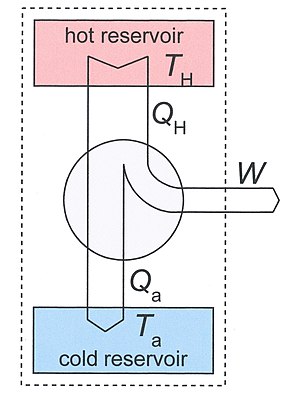
[[Image:Schematic_diagram_of_a_heat_engine02.jpg|300px|thumb|right|चित्रा 3: | [[Image:Schematic_diagram_of_a_heat_engine02.jpg|300px|thumb|right|चित्रा 3: उष्म इंजन आरेख। पाठ में चर्चा की गई प्रणाली को बिंदीदार आयत द्वारा इंगित किया गया है। इसमें दो जलाशय और ऊष्मा इंजन सम्मिलित हैं। तीर ऊष्मा और कार्य के प्रवाह की सकारात्मक दिशाओं को परिभाषित करते हैं।]]महत्वपूर्ण मात्रा के रूप में क्लॉज़ियस की एस की पहचान प्रतिवर्ती और अपरिवर्तनीय थर्मोडायनामिक परिवर्तनों के अध्ययन से प्रेरित थी। ऊष्मा इंजन थर्मोडायनामिक प्रणाली है जो परिवर्तनों के क्रम से गुजर सकती है जो अंततः इसे अपनी मूल स्थिति में लौटा देती है। इस तरह के अनुक्रम को [[चक्रीय प्रक्रिया]] या केवल चक्र कहा जाता है। कुछ परिवर्तनों के समय इंजन अपने पर्यावरण के साथ ऊर्जा का आदान-प्रदान कर सकता है। चक्र का शुद्ध परिणाम है | ||
# प्रणाली द्वारा किया गया [[यांत्रिक कार्य]] (जो [[संकेत (गणित)]] हो सकता है, बाद का अर्थ है कि इंजन पर काम किया जाता है), | # प्रणाली द्वारा किया गया [[यांत्रिक कार्य]] (जो [[संकेत (गणित)]] हो सकता है, बाद का अर्थ है कि इंजन पर काम किया जाता है), | ||
# गर्मी पर्यावरण के भाग | # गर्मी पर्यावरण के भाग से दूसरे भाग में स्थानांतरित हो जाती है। स्थिर अवस्था में, ऊर्जा के संरक्षण से, पर्यावरण द्वारा खोई हुई शुद्ध ऊर्जा इंजन द्वारा किए गए कार्य के समान होती है। | ||
यदि चक्र में प्रत्येक परिवर्तन उत्क्रमणीय है, तो चक्र उत्क्रमणीय है, और इसे विपरीत दिशा में चलाया जा सकता है, जिससे गर्मी हस्तांतरण विपरीत दिशाओं में हो और किए गए कार्य की मात्रा स्विच संकेत देती है। | यदि चक्र में प्रत्येक परिवर्तन उत्क्रमणीय है, तो चक्र उत्क्रमणीय है, और इसे विपरीत दिशा में चलाया जा सकता है, जिससे गर्मी हस्तांतरण विपरीत दिशाओं में हो और किए गए कार्य की मात्रा स्विच संकेत देती है। | ||
=== | === उष्म इंजन === | ||
दो तापमानों T<sub>H</sub> और T<sub>a</sub>.के बीच काम कर रहे ऊष्मा इंजन पर विचार करें। T के साथ T<sub>a</sub> हमारे मन में परिवेश का तापमान है, लेकिन, सिद्धांत रूप में यह कुछ अन्य कम तापमान भी हो सकता है। ऊष्मा इंजन दो ऊष्मा जलाशयों के साथ तापीय संपर्क में है, जिनके बारे में माना जाता है कि उनकी ऊष्मा क्षमता बहुत अधिक होती है, जिससे यदि ऊष्मा ''Q''<sub>H</sub> को गर्म जलाशय से हटा दिया जाए और ''Q''<sub>a</sub> को निचले जलाशय में जोड़ दिया जाए, तो उनका तापमान महत्वपूर्ण रूप से नहीं बदलता है। सामान्य ऑपरेशन के अनुसार ''T''<sub>H</sub> > ''T''<sub>a</sub> और ''Q''<sub>H</sub>, ''Q''<sub>a</sub> और W सभी धनात्मक हैं। | दो तापमानों T<sub>H</sub> और T<sub>a</sub>.के बीच काम कर रहे ऊष्मा इंजन पर विचार करें। T के साथ T<sub>a</sub> हमारे मन में परिवेश का तापमान है, लेकिन, सिद्धांत रूप में यह कुछ अन्य कम तापमान भी हो सकता है। ऊष्मा इंजन दो ऊष्मा जलाशयों के साथ तापीय संपर्क में है, जिनके बारे में माना जाता है कि उनकी ऊष्मा क्षमता बहुत अधिक होती है, जिससे यदि ऊष्मा ''Q''<sub>H</sub> को गर्म जलाशय से हटा दिया जाए और ''Q''<sub>a</sub> को निचले जलाशय में जोड़ दिया जाए, तो उनका तापमान महत्वपूर्ण रूप से नहीं बदलता है। सामान्य ऑपरेशन के अनुसार ''T''<sub>H</sub> > ''T''<sub>a</sub> और ''Q''<sub>H</sub>, ''Q''<sub>a</sub> और W सभी धनात्मक हैं। | ||
| Line 125: | Line 123: | ||
*Goldstein, Martin, and Inge F., 1993. ''The Refrigerator and the Universe''. Harvard Univ. Press. A gentle introduction at a lower level than this entry. | *Goldstein, Martin, and Inge F., 1993. ''The Refrigerator and the Universe''. Harvard Univ. Press. A gentle introduction at a lower level than this entry. | ||
{{DEFAULTSORT:Entropy (Classical Thermodynamics)}} | {{DEFAULTSORT:Entropy (Classical Thermodynamics)}} | ||
[[Category: | [[Category:Articles with hatnote templates targeting a nonexistent page|Entropy (Classical Thermodynamics)]] | ||
[[Category:Created On 03/06/2023]] | [[Category:Created On 03/06/2023|Entropy (Classical Thermodynamics)]] | ||
[[Category:Lua-based templates|Entropy (Classical Thermodynamics)]] | |||
[[Category:Machine Translated Page|Entropy (Classical Thermodynamics)]] | |||
[[Category:Pages with script errors|Entropy (Classical Thermodynamics)]] | |||
[[Category:Templates Vigyan Ready|Entropy (Classical Thermodynamics)]] | |||
[[Category:Templates that add a tracking category|Entropy (Classical Thermodynamics)]] | |||
[[Category:Templates that generate short descriptions|Entropy (Classical Thermodynamics)]] | |||
[[Category:Templates using TemplateData|Entropy (Classical Thermodynamics)]] | |||
[[Category:थर्मोडायनामिक एन्ट्रापी|Entropy (Classical Thermodynamics)]] | |||
Latest revision as of 20:00, 5 July 2023
|
Conjugate variables of thermodynamics | ||||||||
|
मौलिक ऊष्मप्रवैगिकी में, एन्ट्रॉपी (from Greek τρoπή (tropḗ) 'transformation') ऊष्मप्रवैगिकी प्रणाली की संपत्ति है जो प्रणाली में सहज परिवर्तनों की दिशा या परिणाम को व्यक्त करती है। 19वीं शताब्दी के मध्य में रुडोल्फ क्लॉसियस द्वारा यह शब्द प्रस्तुत किया गया था जिससे आंतरिक ऊर्जा के संबंध की व्याख्या की जा सके जो ऊष्मा और कार्य के रूप में परिवर्तनों के लिए उपलब्ध या अनुपलब्ध है। एंट्रॉपी भविष्यवाणी करती है कि ऊर्जा के संरक्षण का उल्लंघन न करने के अतिरिक्त कुछ प्रक्रियाएं प्रतिवर्ती प्रक्रिया (थर्मोडायनामिक्स) या असंभव हैं।[1] एन्ट्रापी की परिभाषा ऊष्मप्रवैगिकी के दूसरे नियम की स्थापना के लिए केंद्रीय है, जिसमें कहा गया है कि पृथक प्रणालियों की एन्ट्रापी समय के साथ कम नहीं हो सकती है, क्योंकि वे सदैव थर्मोडायनामिक संतुलन की स्थिति में पहुंचती हैं, जहां एन्ट्रापी उच्चतम होती है। एंट्रॉपी को इसलिए प्रणाली में विकार का उपाय भी माना जाता है।
लुडविग बोल्ट्जमैन ने एन्ट्रॉपी को प्रणाली के व्यक्तिगत परमाणुओं और अणुओं (माइक्रोस्टेट्स) के संभावित सूक्ष्म विन्यास Ω की संख्या के माप के रूप में समझाया, जो प्रणाली के मैक्रोस्कोपिक स्टेट (मैक्रोस्टेट) के अनुरूप है। उन्होंने दिखाया कि थर्मोडायनामिक एन्ट्रापी k ln Ω है, जहां कारक k तब से बोल्ट्जमैन स्थिरांक के रूप में जाना जाता है।
अवधारणा
थर्मोडायनामिक प्रणाली के दबाव, घनत्व और तापमान में अंतर समय के साथ समान हो जाता है। उदाहरण के लिए, कमरे में पिघलने वाली बर्फ का गिलास, गर्म कमरे और बर्फ और पानी के ठंडे गिलास के बीच के तापमान के अंतर को कमरे से ठंडे बर्फ और पानी के मिश्रण में गर्मी के रूप में बहने वाली ऊर्जा के समान किया जाता है। समय के साथ, कांच और उसकी सामग्री का तापमान और कमरे का तापमान संतुलन प्राप्त कर लेता है। कमरे की एन्ट्रॉपी कम हो गई है। चूँकि , बर्फ और पानी के गिलास की एन्ट्रापी कमरे की एन्ट्रापी की तुलना में अधिक बढ़ गई है। पृथक प्रणाली में, जैसे कि कमरे और बर्फ के पानी को साथ ले जाने पर, गर्म से ठंडे क्षेत्रों में ऊर्जा का फैलाव सदैव एन्ट्रापी में शुद्ध वृद्धि का परिणाम होता है। इस प्रकार, जब कमरे और बर्फ के पानी की प्रणाली थर्मल संतुलन तक पहुंच गई है, प्रारंभिक अवस्था से एन्ट्रापी परिवर्तन अपने अधिकतम पर है। ऊष्मप्रवैगिकी प्रणाली की एन्ट्रापी समीकरण की प्रगति का उपाय है।
कई अपरिवर्तनीय प्रक्रियाओं के परिणामस्वरूप एन्ट्रापी में वृद्धि होती है। उनमें से दो या दो से अधिक विभिन्न पदार्थों का मिश्रण है, जो तापमान और दबाव को स्थिर रखते हुए, उन्हें अलग करने वाली दीवार को हटाकर उन्हें साथ लाकर किया जाता है। मिश्रण मिश्रण की एन्ट्रापी के साथ होता है। आदर्श गैसों के मिश्रण के महत्वपूर्ण स्थितियों में संयुक्त प्रणाली कार्य या ताप हस्तांतरण द्वारा अपनी आंतरिक ऊर्जा को नहीं बदलती है; एन्ट्रापी वृद्धि तब पूरी तरह से विभिन्न पदार्थों के उनके नए सामान्य आयतन में फैलने के कारण होती है।[2]
मैक्रोस्कोपिक दृष्टिकोण से क्लासिकल ऊष्मप्रवैगिकी में एन्ट्रापी थर्मोडायनामिक प्रणाली का राज्य कार्य है: अर्थात, संपत्ति जो केवल प्रणाली की वर्तमान स्थिति पर निर्भर करती है, इस बात से स्वतंत्र कि वह राज्य कैसे प्राप्त हुआ। एन्ट्रॉपी ऊष्मप्रवैगिकी के दूसरे नियम का प्रमुख घटक है, जिसके महत्वपूर्ण परिणाम हैं उदा। ताप इंजन रेफ्रिजरेटर और ताप पंप के प्रदर्शन के लिए होता है
परिभाषा
उत्कृष्ट प्रमेय के अनुसार, बंद सजातीय प्रणाली के लिए, जिसमें केवल उत्क्रमणीय प्रक्रियाएं होती हैं,
T के साथ बंद प्रणाली का एकसमान तापमान और डेल्टा Q उस प्रणाली में ऊष्मा ऊर्जा का वृद्धिशील उत्क्रमणीय स्थानांतरण है।
इसका कारण लाइन इंटीग्रल है पथ-स्वतंत्र है।
अवस्था फलन S, जिसे एंट्रॉपी कहा जाता है परिभाषित किया जा सकता है जो संतुष्ट करता है
एंट्रॉपी माप
समान बंद प्रणाली की थर्मोडायनामिक स्थिति इसके तापमान T और दबाव P द्वारा निर्धारित की जाती है। एन्ट्रापी में परिवर्तन के रूप में लिखा जा सकता है
पहला योगदान के माध्यम से निरंतर दबाव CP पर ताप क्षमता पर निर्भर करता है
यह δQ = CP dT और T dS = δQ द्वारा ताप क्षमता की परिभाषा का परिणाम है। दूसरे पद को मैक्सवेल संबंधों में से के साथ फिर से लिखा जा सकता है
और आयतन तापीय-विस्तार गुणांक की परिभाषा
जिससे
इस अभिव्यक्ति के साथ इच्छानुसार से P और T पर एंट्रॉपी S एंट्रॉपी S0 से कुछ संदर्भ स्थिति में P0 और T0 के अनुसार संबंधित हो सकता है
मौलिक ऊष्मप्रवैगिकी में, संदर्भ राज्य की एन्ट्रॉपी को किसी भी सुविधाजनक तापमान और दबाव पर शून्य के समान रखा जा सकता है। उदाहरण के लिए शुद्ध पदार्थों के लिए ठोस की एन्ट्रापी को गलनांक पर 1 बार शून्य के समान ले सकते हैं। अधिक मौलिक दृष्टिकोण से ऊष्मप्रवैगिकी के तीसरे नियम से पता चलता है कि क्रिस्टल जैसे पूरी तरह से आदेशित सामग्री के लिए T = 0 (पूर्ण शून्य) पर S = 0 लेने की प्राथमिकता है।
S(P, T) पीटी आरेख में विशिष्ट पथ का पालन करके निर्धारित किया जाता है: निरंतर दबाव P0 पर T पर एकीकरण, जिससे dP = 0, और दूसरे अभिन्न में निरंतर तापमान T पर P पर एकीकृत हो, जिससे dT = 0. चूंकि एंट्रॉपी राज्य का कार्य है, परिणाम पथ से स्वतंत्र है।
उपरोक्त संबंध से पता चलता है कि एन्ट्रापी के निर्धारण के लिए ताप क्षमता और स्थिति के समीकरण (जो कि सम्मिलित पदार्थ के P, V और T के बीच का संबंध है) के ज्ञान की आवश्यकता होती है। सामान्यतः ये जटिल कार्य होते हैं और संख्यात्मक एकीकरण की आवश्यकता होती है। सरल स्थितियों में एंट्रॉपी के लिए विश्लेषणात्मक अभिव्यक्ति प्राप्त करना संभव है। आदर्श गैस के स्थितियों में, ताप क्षमता स्थिर होती है और आदर्श गैस नियम PV = nRT देता है कि αVV = V/T = nR/p, n मोल की संख्या और R मोलर आदर्श-गैस स्थिरांक के साथ है । तो आदर्श गैस की दाढ़ एन्ट्रापी किसके द्वारा दी जाती है
इस अभिव्यक्ति में CP अब दाढ़ ताप क्षमता है।
विषम प्रणालियों की एन्ट्रापी विभिन्न उप प्रणालियों की एन्ट्रापी का योग है। ऊष्मप्रवैगिकी के नियम विषम प्रणालियों के लिए विस्तार से प्रयुक्त होते हैं तथापि वे आंतरिक संतुलन से दूर हों। एकमात्र नियम यह है कि कंपोजिंग सबसिस्टम के थर्मोडायनामिक पैरामीटर (यथोचित) अच्छी तरह से परिभाषित हैं।
तापमान-एन्ट्रापी आरेख

महत्वपूर्ण पदार्थों के एन्ट्रॉपी मूल्य संदर्भ कार्यों से या वाणिज्यिक सॉफ्टवेयर के साथ सारणीबद्ध रूप में या आरेखों के रूप में प्राप्त किए जा सकते हैं। सबसे आम आरेखों में से तापमान-एन्ट्रॉपी आरेख (टीएस-आरेख) है। उदाहरण के लिए, Fig.2 नाइट्रोजन का टीएस-आरेख दिखाता है,[3] पिघलने की अवस्था और संतृप्त तरल और वाष्प मूल्यों को आइसोबार और आइसेंथेल्प्स के साथ दर्शाता है।
अपरिवर्तनीय परिवर्तनों में एंट्रॉपी परिवर्तन
अब हम विषम प्रणालियों पर विचार करते हैं जिनमें आंतरिक परिवर्तन (प्रक्रियाएं) हो सकती हैं। यदि हम इस तरह की आंतरिक प्रक्रिया से पहले एन्ट्रापी S1और S2 की गणना करते हैं, तो ऊष्मप्रवैगिकी का दूसरा नियम मांग करता है कि S2 ≥ S1 जहां प्रक्रिया प्रतिवर्ती होने पर समानता चिह्न धारण करता है। अपरिवर्तनीय प्रक्रिया के कारण अंतर Si = S2 − S1 एन्ट्रापी उत्पादन है। दूसरा नियम मांग करता है कि पृथक प्रणाली की एंट्रॉपी कम नहीं हो सकती है।
मान लीजिए कि प्रणाली थर्मल और यांत्रिक रूप से पर्यावरण (पृथक प्रणाली) से अलग है। उदाहरण के लिए, जंगम विभाजन द्वारा विभाजित इन्सुलेट कठोर बॉक्स पर विचार करें, प्रत्येक गैस से भरा हुआ है। यदि गैस का दबाव अधिक है, तो यह विभाजन को आगे बढ़ाकर विस्तार करेगा, इस प्रकार दूसरी गैस पर काम करेगा। इसके अतिरिक्त यदि गैसें अलग-अलग तापमान पर हैं तो गर्मी गैस से दूसरी गैस में प्रवाहित हो सकती है, परंतु विभाजन गर्मी चालन की अनुमति देता है। हमारा उपरोक्त परिणाम इंगित करता है कि इन प्रक्रियाओं के समय पूरे प्रणाली की एन्ट्रापी बढ़ेगी। परिस्थितियों में प्रणाली के पास अधिकतम मात्रा में एंट्रॉपी उपस्थित हो सकती है। यह एन्ट्रापी स्थिर संतुलन की स्थिति से मेल खाती है, क्योंकि किसी अन्य संतुलन स्थिति में परिवर्तन से एन्ट्रॉपी कम हो जाएगी जो कि वर्जित है। जब प्रणाली इस अधिकतम-एन्ट्रॉपी स्थिति में पहुँच जाता है, तो प्रणाली का कोई भी भाग किसी अन्य भाग पर कार्य नहीं कर सकता है। यह इस अर्थ में है कि एंट्रॉपी प्रणाली में ऊर्जा का उपाय है जिसे काम करने के लिए उपयोग नहीं किया जा सकता है।
अपरिवर्तनीय प्रक्रिया थर्मोडायनामिक प्रणाली के प्रदर्शन को कम करती है, जिसे काम करने या शीतलन उत्पन्न करने के लिए डिज़ाइन किया गया है, और एंट्रॉपी उत्पादन में परिणाम होता है। उत्क्रमणीय प्रक्रिया के समय एन्ट्रापी उत्पादन शून्य होता है। इस प्रकार एन्ट्रापी उत्पादन अपरिवर्तनीयता का उपाय है और इसका उपयोग इंजीनियरिंग प्रक्रियाओं और मशीनों की तुलना करने के लिए किया जा सकता है।
थर्मल मशीनें
महत्वपूर्ण मात्रा के रूप में क्लॉज़ियस की एस की पहचान प्रतिवर्ती और अपरिवर्तनीय थर्मोडायनामिक परिवर्तनों के अध्ययन से प्रेरित थी। ऊष्मा इंजन थर्मोडायनामिक प्रणाली है जो परिवर्तनों के क्रम से गुजर सकती है जो अंततः इसे अपनी मूल स्थिति में लौटा देती है। इस तरह के अनुक्रम को चक्रीय प्रक्रिया या केवल चक्र कहा जाता है। कुछ परिवर्तनों के समय इंजन अपने पर्यावरण के साथ ऊर्जा का आदान-प्रदान कर सकता है। चक्र का शुद्ध परिणाम है
- प्रणाली द्वारा किया गया यांत्रिक कार्य (जो संकेत (गणित) हो सकता है, बाद का अर्थ है कि इंजन पर काम किया जाता है),
- गर्मी पर्यावरण के भाग से दूसरे भाग में स्थानांतरित हो जाती है। स्थिर अवस्था में, ऊर्जा के संरक्षण से, पर्यावरण द्वारा खोई हुई शुद्ध ऊर्जा इंजन द्वारा किए गए कार्य के समान होती है।
यदि चक्र में प्रत्येक परिवर्तन उत्क्रमणीय है, तो चक्र उत्क्रमणीय है, और इसे विपरीत दिशा में चलाया जा सकता है, जिससे गर्मी हस्तांतरण विपरीत दिशाओं में हो और किए गए कार्य की मात्रा स्विच संकेत देती है।
उष्म इंजन
दो तापमानों TH और Ta.के बीच काम कर रहे ऊष्मा इंजन पर विचार करें। T के साथ Ta हमारे मन में परिवेश का तापमान है, लेकिन, सिद्धांत रूप में यह कुछ अन्य कम तापमान भी हो सकता है। ऊष्मा इंजन दो ऊष्मा जलाशयों के साथ तापीय संपर्क में है, जिनके बारे में माना जाता है कि उनकी ऊष्मा क्षमता बहुत अधिक होती है, जिससे यदि ऊष्मा QH को गर्म जलाशय से हटा दिया जाए और Qa को निचले जलाशय में जोड़ दिया जाए, तो उनका तापमान महत्वपूर्ण रूप से नहीं बदलता है। सामान्य ऑपरेशन के अनुसार TH > Ta और QH, Qa और W सभी धनात्मक हैं।
हमारे ऊष्मप्रवैगिकी प्रणाली के रूप में हम बड़ी प्रणाली लेते हैं जिसमें इंजन और दो जलाशय सम्मिलित हैं। यह Fig.3 में बिंदीदार आयत द्वारा दर्शाया गया है। यह विषम, बंद (अपने परिवेश के साथ पदार्थ का कोई आदान-प्रदान नहीं), और रुद्धोष्म (अपने परिवेश के साथ गर्मी का कोई आदान-प्रदान नहीं) है। यह अलग-थलग नहीं है क्योंकि प्रति चक्र निश्चित मात्रा में कार्य W ऊष्मप्रवैगिकी के पहले नियम द्वारा दी गई प्रणाली द्वारा निर्मित होता है
हमने इस तथ्य का उपयोग किया कि इंजन ही आवधिक है, इसलिए इसकी आंतरिक ऊर्जा चक्र के बाद नहीं बदली है। इसकी एंट्रॉपी के लिए भी यही सच है, इसलिए एंट्रॉपी S2 − S1 को बढ़ाती है हमारे प्रणाली का चक्र के बाद गर्म स्रोत की एन्ट्रापी में कमी और ठंडे सिंक की वृद्धि के द्वारा दिया जाता है। इंजन में अपरिवर्तनीय प्रक्रियाओं के कारण कुल प्रणाली S2 − S1 की एन्ट्रापी वृद्धि एन्ट्रापी उत्पादन Si के समान है
द्वितीय नियम की मांग है किSi ≥ 0. Qa को दो संबंधों से विलोपित करने पर प्राप्त होता है
पहला शब्द ऊष्मा इंजन के लिए अधिकतम संभव कार्य है जो उत्क्रमणीय इंजन द्वारा दिया जाता है, जैसा कि कार्नाट चक्र के साथ काम करता है। आखिरकार
यह समीकरण हमें बताता है कि एंट्रॉपी के उत्पादन से काम का उत्पादन कम हो जाता है। TaSi शब्द मशीन द्वारा खोया हुआ काम, या विलुप्त ऊर्जा देता है।
इसलिए शीत सिंक में छोड़ी गई गर्मी की मात्रा एंट्रॉपी पीढ़ी द्वारा बढ़ जाती है
इन महत्वपूर्ण संबंधों को ताप जलाशयों को सम्मिलित किए बिना भी प्राप्त किया जा सकता है। एंट्रॉपी उत्पादन पर आलेख देखें।
रेफ्रिजरेटर
कम तापमान TL और परिवेश के तापमान के बीच काम करने वाले रेफ्रिजरेटर पर भी यही सिद्धांत प्रयुक्त किया जा सकता है। आरेखीय रेखाचित्र बिल्कुल Fig.3 के समान है जिसमें TH को TL से, QH को QL से और W के चिह्न को उलट दिया गया है। इस स्थितियों में एन्ट्रापी उत्पादन है
और ठंडे स्रोत से QL ऊष्मा निकालने के लिए आवश्यक कार्य है
पहला शब्द न्यूनतम आवश्यक कार्य है जो प्रतिवर्ती रेफ्रिजरेटर से मेल खाता है इसलिए हमारे पास है
अर्थात रेफ्रिजरेटर के कंप्रेसर को अपरिवर्तनीय प्रक्रियाओं के कारण नष्ट हुई ऊर्जा की भरपाई के लिए अतिरिक्त काम करना पड़ता है जिससे एन्ट्रापी उत्पादन होता है।
यह भी देखें
- एंट्रॉपी
- तापीय धारिता
- एंट्रॉपी उत्पादन
- मौलिक थर्मोडायनामिक संबंध
- थर्मोडायनामिक मुक्त ऊर्जा
- एन्ट्रापी का इतिहास
- एंट्रॉपी (सांख्यिकीय विचार)
संदर्भ
- ↑ Lieb, E. H.; Yngvason, J. (1999). "ऊष्मप्रवैगिकी के दूसरे नियम का भौतिकी और गणित". Physics Reports. 310 (1): 1–96. arXiv:cond-mat/9708200. Bibcode:1999PhR...310....1L. doi:10.1016/S0370-1573(98)00082-9. S2CID 119620408.
- ↑ Notes for a "Conversation About Entropy"
- ↑ Figure composed with data obtained with RefProp, NIST Standard Reference Database 23
अग्रिम पठन
- E.A. Guggenheim Thermodynamics, an advanced treatment for chemists and physicists North-Holland Publishing Company, Amsterdam, 1959.
- C. Kittel and H. Kroemer Thermal Physics W.H. Freeman and Company, New York, 1980.
- Goldstein, Martin, and Inge F., 1993. The Refrigerator and the Universe. Harvard Univ. Press. A gentle introduction at a lower level than this entry.