समन्वय संख्या: Difference between revisions
No edit summary |
No edit summary |
||
| (2 intermediate revisions by 2 users not shown) | |||
| Line 71: | Line 71: | ||
{{MolecularGeometry}} | {{MolecularGeometry}} | ||
[[Category:CS1 English-language sources (en)]] | |||
[[Category: | [[Category:CS1 maint]] | ||
[[Category:Collapse templates]] | |||
[[Category:Created On 12/12/2022]] | [[Category:Created On 12/12/2022]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:आण्विक ज्यामिति]] | |||
[[Category:त्रिविम रसायन]] | |||
[[Category:रासायनिक बंधन]] | |||
[[Category:समन्वय रसायन]] | |||
[[Category:सामग्री विज्ञान]] | |||
Latest revision as of 09:59, 15 February 2023
रसायन विज्ञान, क्रिस्टलोग्राफी, और सामग्री विज्ञान में, एक अणु या क्रिस्टल में एक केंद्रीय परमाणु की उपसहसंयोजन संख्या, जिसे लिगेंसी भी कहा जाता है, परमाणुओं, अणुओं या आयनों की संख्या से बंधी होती है। केंद्रीय आयन/अणु/परमाणु के आसपास के आयन/अणु/परमाणु को लिगेंड कहा जाता है। यह संख्या क्रिस्टल की तुलना में अणुओं के लिए कुछ भिन्न रूप से निर्धारित की जाती है।
अणुओं और बहुपरमाणुक आयनों के लिए एक परमाणु की उपसहसंयोजन संख्या केवल उन अन्य परमाणुओं की गणना करके निर्धारित की जाती है जिनसे यह बंधा हुआ है (या तो एकल या एकाधिक बंधनों द्वारा)।[1] उदाहरण के लिए, [Cr(NH3)2Cl2Br2]− में Cr3+ इसके केंद्रीय धनायन के रूप में, जिसकी उपसहसंयोजन संख्या 6 है और इसे हेक्साकोर्डिनेट के रूप में वर्णित किया गया है। सामान्य उपसहसंयोजन संख्याएँ '4', '6' और '8' हैं।
अणु, बहुपरमाणुक आयन और उपसहसंयोजन सीमा कार्यक्षेत्र


रसायन विज्ञान में, उपसहसंयोजन संख्या, मूल रूप से 1893 में अल्फ्रेड वर्नर द्वारा परिभाषित, एक अणु या आयन में एक केंद्रीय परमाणु के सन्निकटों की कुल संख्या है।[1][3] यह अवधारणा सबसे अधिक उपसहसंयोजन सीमा कार्यक्षेत्रों पर लागू होती है।
सरल और सामान्य स्थितियां
d-ब्लॉक परिवर्ती धातु सीमा कार्यक्षेत्रों के लिए सबसे साधारण उपसहसंयोजन संख्या 6 है। जो कि बहुपरमाणुक आयन होते हैं। दूसरी ओर, सहसंयोजक बंधन, परमाणुओं को बहुपरमाणुक आयनों में एक साथ रखते हैं। आयनिक रसायन वे रसायन होते हैं जिनमें बहुपरमाणुक आयन होते हैं। मौलिक नियम के अनुसार, जब एक सकारात्मक आयनिक धातु एक नकारात्मक आयनिक गैर-धातु के साथ प्रतिक्रिया करती है, तो आयनिक यौगिक बनते हैं। मेटलॉइड लैडर के बाईं ओर से एक आयन और मेटलॉइड लैडर के दाईं ओर से एक आयन मेटलॉइड लैडर के दाईं ओर से दो अधातुओं के बीच उत्पन्न अणु को आणविक यौगिक कहा जाता है। वैलेंस इलेक्ट्रॉनों को साझा करके, प्रत्येक अधातु ऑक्टेट नियम को पूरा करता है। उपसहसंयोजन संख्या ऐसे सीमा कार्यक्षेत्रों की ज्यामिति को अलग नहीं करती है, अर्थात ऑक्टाहेड्रल त्रिकोणीय प्रिज्मीय संरचना से प्रतिकूल प्रभाव डालती है।
परिवर्ती धातु सीमा कार्यक्षेत्रों के लिए, उपसहसंयोजन संख्या 2 होती है (उदाहरण के लिए,Ph3PAuCl में AuI) से 9 (जैसे, ReVII in [ReH9]2−) एफ-ब्लॉक (लैंथेनाइड और एक्टिनाइड) में धातुएं अपने अधिक आयनिक त्रिज्या और बंधन के लिए अधिक ऑर्बिटल्स की उपलब्धता के कारण उच्च उपसहसंयोजन संख्या को समायोजित कर सकती हैं। f-ब्लॉक तत्वों के लिए सामान्यतः 8 से 12 की उपसहसंयोजन संख्या देखी जाती है। उदाहरण के लिए, बिडेंटेट नाइट्रेट आयनों के साथ लिगेंड्स के रूप में, CeIV और ThIV 12-समन्वयित आयन बनाते हैं।
[Ce(NO3)6]2− (सेरिक अमोनियम नाइट्रेट) और [Th(NO3)6]2− जब आस-पास के लिगेंड केंद्रीय परमाणु से बहुत छोटे होते हैं, तो उच्चतर उपसहसंयोजन संख्याएँ भी संभव हो सकती हैं। एक कम्प्यूटेशनल रसायन शास्त्र अध्ययन ने विशेष रूप से स्थिर होने की भविष्यवाणी की PbHe2+
15 15 से कम हीलियम परमाणुओं के साथ समन्वयित एक केंद्रीय प्रमुख आयन से बना आयन[4] फ्रैंक-कैस्पर चरणों में, धात्विक परमाणुओं की पैकिंग 16 तक की उपसहसंयोजन संख्या दे सकती है।[5] विपरीत चरम पर, त्रिविम परिरक्षण असामान्य रूप से कम उपसहसंयोजन संख्या को उत्पन्न कर सकता है। 1 की उपसहसंयोजन संख्या को अपनाने वाली धातु का एक अत्यंत दुर्लभ उदाहरण टेरफिनाइल-आधारित एरिथैलियम (I) कॉम्प्लेक्स 2,6-Tipp2C6H3Tl में होता है, जहां टिप 2,4,6-ट्राइसोप्रोपाइलफेनिल समूह है।[6]
पॉलीहैप्टो लिगैंड्स
पॉलीहैप्टो लिगैंड्स के साथ व्यवहार करते समय उपसहसंयोजन संख्याएं अस्पष्ट हो जाती हैं।
π-इलेक्ट्रॉन लिगैंड्स के लिए जैसे साइक्लोपेंटैडिएनाइड आयन [C5H5]−, एल्केन और साइक्लोएक्टेटेट्राएनाइड आयन [C8H8]2−, π-इलेक्ट्रॉन प्रणाली में केंद्रीय परमाणु से जुड़ने वाले आसन्न परमाणुओं की संख्या को हेप्टिसिटी कहा जाता है।[7] फेरोसीन में हैप्टिसिटी, η, प्रत्येक साइक्लोपेंटैडिएनाइड आयनों की संख्या पांच है, Fe(η5-C5H5)2 प्रत्येक साइक्लोपेंटैडिएनाइड लिगैंड द्वारा केंद्रीय लोहे के परमाणु के उपसहसंयोजन संख्या में किए गए योगदान को निर्दिष्ट करने के लिए विभिन्न तरीके मौजूद हैं। योगदान को एक के रूप में निर्दिष्ट किया जा सकता है क्योंकि एक लिगैंड है, या पांच के रूप में पांच निकटतम परमाणु हैं, या तीन के रूप में तीन इलेक्ट्रॉन जोड़े सम्मिलित हैं। सामान्यतः इलेक्ट्रॉन जोड़े की गिनती ली जाती है।[8]
सतहें और पुनर्निर्माण
उपसहसंयोजन संख्या एक क्रिस्टल लैटिस के इंटीरियर में परमाणुओं के लिए अच्छी तरह से परिभाषित हैं: सभी दिशाओं में निकटतम सन्निकटों की गणना करता है। एक आंतरिक परमाणु के सन्निकटों की संख्या को सामूहिक उपसहसंयोजन संख्या कहा जाता है। सतहों के लिए, सन्निकटों की संख्या अधिक सीमित होती है, इसलिए सतह उपसहसंयोजन संख्या सामूहिक उपसहसंयोजन संख्या से छोटी होती है। प्रायः सतह उपसहसंयोजन संख्या अज्ञात या परिवर्तनशील होती है।[9] सतह उपसहसंयोजन संख्या सतह के मिलर सूचकांक पर भी निर्भर करती है। एक घन क्रिस्टल प्रणाली बॉडी-सेंटर्ड क्यूबिक (बीसीसी) क्रिस्टल में, सामूहिक उपसहसंयोजन संख्या 8 है, जबकि (100) सतह के लिए, सतह उपसहसंयोजन संख्या 4 है।[10]
प्रकरण का अध्ययन
एक्स -रे क्रिस्टलोग्राफी द्वारा परमाणु की उपसहसंयोजन संख्या निर्धारित करने का एक सामान्य तरीका है। संबंधित तकनीकों में न्यूट्रॉन विवर्तन या इलेक्ट्रॉन विवर्तन सम्मिलित हैं।[11] निकटतम सन्निकटों की गिनती करके परमाणु की उपसहसंयोजन संख्या सीधे निर्धारित की जा सकती है।
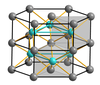
α-एल्युमिनियम में एक नियमित क्यूबिक क्लोज पैक्ड स्ट्रक्चर, फलक केंद्रित घन होता है, जहां प्रत्येक एल्युमीनियम परमाणु के 12 निकटतम होते हैं, 6 एक ही समतल में और 3 ऊपर और नीचे और उपसहसंयोजन पॉलीहेड्रॉन एक सूबोक्टाहेड्रॉन होता है। α-आयरन में एक क्यूबिक क्रिस्टल सिस्टम संरचना होती है जहां प्रत्येक लोहे के परमाणु के 8 निकटतम घन के कोनों पर स्थित होते हैं।
कार्बन के दो सबसे साधारण आवंटनों में अलग-अलग उपसहसंयोजन संख्याएँ होती हैं। हीरे में, प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं द्वारा गठित एक नियमित चतुर्पाश्वीय के केंद्र में होता है, उपसहसंयोजन संख्या चार होती है, जैसा कि मीथेन के लिए होता है। सीसा द्वि-आयामी परतों से बना होता है जिसमें प्रत्येक कार्बन सहसंयोजक रूप से तीन अन्य कार्बन से जुड़ा होता है; अन्य परतों में परमाणु और दूर हैं और निकटतम नहीं हैं, जो 3 की उपसहसंयोजन संख्या निर्गत करता है।[12]
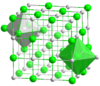
सोडियम क्लोराइड और सीज़ियम क्लोराइड जैसे नियमित जाली वाले रासायनिक यौगिकों के लिए, निकटतम सन्निकटों की गिनती आयनों के पर्यावरण की अच्छी तस्वीर देती है। सोडियम क्लोराइड में प्रत्येक सोडियम आयन में अष्टफलक के कोनों पर निकटतम सन्निकटों (276 pm पर) के रूप में 6 क्लोराइड आयन होते हैं और प्रत्येक क्लोराइड आयन में ऑक्टाहेड्रॉन के कोनों पर 6 सोडियम परमाणु (276 pm पर भी) होते हैं। सीज़ियम क्लोराइड में प्रत्येक सीज़ियम में 8 क्लोराइड आयन (356 pm पर) घन के कोनों पर स्थित होते हैं और प्रत्येक क्लोराइड में घन के कोनों पर आठ सीज़ियम आयन (356 pm पर भी) होते हैं।
जटिलता
कुछ यौगिकों में धातु-लिगंड बांड सभी समान दूरी पर नहीं हो सकते हैं। उदाहरण के लिए पीबीसीएल में2, Pb की उपसहसंयोजन संख्या2+ को सात या नौ कहा जा सकता है, यह इस बात पर निर्भर करता है कि किस क्लोराइड को लिगेंड के रूप में नियत किया गया है। सात क्लोराइड लिगेंड में Pb-Cl की दूरी 280–309 pm है। 370 pm की Pb-Cl दूरी के साथ दो क्लोराइड लिगेंड अधिक दूर हैं।[13]
कुछ स्थिति में उपसहसंयोजन संख्या की एक अलग परिभाषा का उपयोग किया जाता है जिसमें निकटतम सन्निकटों की तुलना में अधिक दूरी पर परमाणु सम्मिलित होते हैं। क्रिस्टलोग्राफी का अंतर्राष्ट्रीय संघ, IUCR द्वारा अपनाई गई बहुत व्यापक परिभाषा में कहा गया है कि क्रिस्टलीय ठोस में एक परमाणु की उपसहसंयोजन संख्या रासायनिक बंधन मॉडल पर निर्भर करती है और जिस तरह से उपसहसंयोजन संख्या की गणना की जाती है।[14][15]
कुछ धातुओं में अनियमित संरचनाएँ होती हैं। उदाहरण के लिए, जिंक में विकृत हेक्सागोनल निविड संकुलित संरचना होती है। गोले के नियमित हेक्सागोनल क्लोज पैकिंग से यह अनुमान लगाया जा सकता है कि प्रत्येक परमाणु के 12 निकटतम निकटतम और एक त्रिकोणीय ऑर्थोबिक्यूपोला (जिसे एक एंटीक्यूबोक्टाहेड्रोन या ट्विनड क्यूबोक्टाहेड्रोन भी कहा जाता है) उपसहसंयोजन पॉलीहेड्रॉन है।[12][16] जिंक में 266 pm पर केवल 6 निकटतम निकटतम होते हैं, उसी क्लोज पैक्ड प्लेन में छह अन्य, अगले-निकटतम निकटतम, समान दूरी पर, 291 pm पर ऊपर और नीचे प्रत्येक क्लोज पैक प्लेन में तीन होते हैं। उपसहसंयोजन संख्या को 6 के बजाय 12 के रूप में वर्णित करना उचित माना जाता है।[15]इसी तरह के विचारों को नियमित शरीर केंद्रित घन संरचना पर लागू किया जा सकता है जहां 8 निकटतम सन्निकटों के अलावा 6 और, लगभग 15% अधिक दूर,[12]और इस स्थितियां में उपसहसंयोजन संख्या को प्रायः 14 माना जाता है।
कई रासायनिक यौगिकों में विकृत संरचनाएं होती हैं। निकल आर्सेनाइड, NiAs की एक संरचना है जहां निकल और आर्सेनिक परमाणु 6-उपसहसंयोजन हैं। सोडियम क्लोराइड के विपरीत जहां क्लोराइड आयन क्यूबिक क्लोज पैक होते हैं, आर्सेनिक आयन हेक्सागोनल क्लोज पैक होते हैं। निकेल आयन एक विकृत अष्टफलकीय उपसहसंयोजन पॉलीहेड्रॉन के साथ 6-उपसहसंयोजन करते हैं जहां अष्टाहेड्रा के स्तंभ विपरीत फलकों को साझा करते हैं। आर्सेनिक आयन अष्टकोणीय रूप से समन्वित नहीं होते हैं, लेकिन एक त्रिकोणीय प्रिज्मीय उपसहसंयोजन पॉलीहेड्रॉन होता है। इस व्यवस्था का एक परिणाम यह है कि निकल परमाणु एक दूसरे के काफी करीब हैं। अन्य यौगिक जो इस संरचना को साझा करते हैं, या एक निकट से संबंधित कुछ परिवर्ती धातु सल्फाइड जैसे आयरन (II) सल्फाइड और कोबाल्ट (II) सल्फाइड, साथ ही कुछ इंटरमेटेलिक्स हैं। कोबाल्ट (II) टेल्यूराइड, CoTe में, छह टेल्यूरियम और दो कोबाल्ट परमाणु सभी केंद्रीय Co परमाणु से समान दूरी पर हैं।[12]
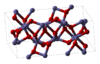
सामान्यतः मिलने वाले रसायनों के दो अन्य उदाहरण आयरन (III) ऑक्साइड Fe2O3और टाइटेनियम डाइऑक्साइड TiO2. Fe2O3 एक क्रिस्टल संरचना है जिसे ऑक्टाहेड्रल छिद्रों के दो तिहाई हिस्से को भरने वाले लोहे के परमाणुओं के साथ ऑक्सीजन परमाणुओं के करीब पैक किए गए सरणी के रूप में वर्णित किया जा सकता है। हालाँकि प्रत्येक लोहे के परमाणु के 3 निकटतम निकटतम और 3 अन्य कुछ दूर हैं। संरचना काफी जटिल है, ऑक्सीजन परमाणुओं को चार लोहे के परमाणुओं के साथ समन्वित किया जाता है और बदले में लोहे के परमाणु विकृत ऑक्टाहेड्रा के किनारों और फलकों को साझा करते हैंजो कि[12]TiO2 रूटाइल संरचना है। थोड़ा विकृत ऑक्टाहेड्रॉन में टाइटेनियम परमाणु 6-समन्वय, 2 परमाणु 198.3 pm पर और 4 परमाणु 194.6 pm पर टाइटेनियम परमाणुओं के चारों ओर का ऑक्टाहेड्रा 3-डी नेटवर्क बनाने के लिए किनारों और कोने को साझा करता है। त्रिकोणीय प्लानर कॉन्फ़िगरेशन में ऑक्साइड आयन 3-उपसहसंयोजन हैं।[17]
क्वासिक क्रिस्टल, तरल और अन्य अव्यवस्थित प्रणालियों में उपयोग

विकार वाली प्रणालियों की उपसहसंयोजन संख्या को सटीक रूप से परिभाषित नहीं किया जा सकता है।
पहली उपसहसंयोजन संख्या को रेडियल वितरण फ़ंक्शन g(r) का उपयोग करके परिभाषित किया जा सकता है:[18][19]
'द्वितीय उपसहसंयोजन संख्या' को इसी तरह परिभाषित किया गया है:
संदर्भ
- ↑ 1.0 1.1 IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "coordination number". doi:10.1351/goldbook.C01331
- ↑ Haaland, Arne; Shorokhov, Dmitry J.; Tutukin, Andrey V.; Volden, Hans Vidar; Swang, Ole; McGrady, G. Sean; Kaltsoyannis, Nikolas; Downs, Anthony J.; Tang, Christina Y.; Turner, John F. C. (2002). "दो धातु टेट्राकिस (टेट्राहाइड्रोबोरेट्स) की आणविक संरचनाएं, Zr(BH4)4 और U(BH4)4: ट्रिपल ब्रिजिंग बीएच <उप>4</उप> समूहों के आंतरिक रोटेशन के लिए संतुलन अनुरूपता और बाधाएं". Inorganic Chemistry. 41 (25): 6646–6655. doi:10.1021/ic020357z. PMID 12470059.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ De, A.K. (2003). अकार्बनिक रसायन विज्ञान की एक पाठ्य पुस्तक. New Age International Publishers. p. 88. ISBN 978-8122413847.
- ↑ Hermann, Andreas; Lein, Matthias; Schwerdtfeger, Peter (2007). "उच्चतम समन्वय संख्या वाली प्रजातियों की खोज". Angewandte Chemie International Edition. 46 (14): 2444–7. doi:10.1002/anie.200604148. PMID 17315141.
- ↑ Sinha, Ashok K. (1972). "ट्रांज़िशन मेटल एलॉय की टोपोलॉजिकली क्लोज़-पैक्ड स्ट्रक्चर्स". Progress in Materials Science. Elsevier BV. 15 (2): 81–185. doi:10.1016/0079-6425(72)90002-3. ISSN 0079-6425.
- ↑ Niemeyer, Mark; Power, Philip P. (1998-05-18). "2,6-Trip2C6H3Tl (ट्रिप = 2,4,6-iPr3C6H2) का संश्लेषण और ठोस-अवस्था संरचना: एकल समन्वित थैलियम परमाणु के साथ एक मोनोमेरिक एरिथैलियम (I) यौगिक". Angewandte Chemie International Edition (in English). 37 (9): 1277–1279. doi:10.1002/(SICI)1521-3773(19980518)37:9<1277::AID-ANIE1277>3.0.CO;2-1. ISSN 1521-3773. PMID 29711226.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hapticity". doi:10.1351/goldbook.H01881
- ↑ Crabtree, Robert H. (2009). संक्रमण धातुओं का ऑर्गेनोमेटेलिक रसायन. John Wiley & Sons. ISBN 9780470257623.
- ↑ De Graef, Marc; McHenry, Michael E. (2007). सामग्री की संरचना: क्रिस्टलोग्राफी, विवर्तन और समरूपता का परिचय (PDF). Cambridge University Press. p. 515. ISBN 978-0-521-65151-6. Retrieved 15 March 2019.
- ↑ "निकटतम पैक्ड संरचनाएं". Chemistry LibreTexts. 2 October 2013. Retrieved 28 July 2020.
- ↑ Massa, Werner (1999). क्रिस्टल संरचना निर्धारण (English ed.). Springer. pp. 67–92.
- ↑ 12.0 12.1 12.2 12.3 12.4 Wells, A.F. (1984). संरचनात्मक अकार्बनिक रसायन (5th ed.). Oxford Science Publications. ISBN 978-0198553700.
- ↑ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ "द्वितीय। परमाणुओं का समन्वय". Archived from the original on 2012-06-13. Retrieved 2014-11-09.
- ↑ 15.0 15.1 Mittemeijer, Eric J. (2010). सामग्री विज्ञान के मूल सिद्धांत: मॉडल सिस्टम के रूप में धातुओं का उपयोग करके माइक्रोस्ट्रक्चर-संपत्ति संबंध. Springer. ISBN 9783642105005.
- ↑ Piróth, A.; Sólyom, Jenö (2007). ठोस पदार्थों के भौतिकी के मूल सिद्धांत: खंड 1: संरचना और गतिकी. Springer. p. 227. ISBN 9783540726005.
- ↑ Diebold, Ulrike (2003). "टाइटेनियम डाइऑक्साइड की सतह विज्ञान". Surface Science Reports. 48 (5–8): 53–229. Bibcode:2003SurSR..48...53D. doi:10.1016/S0167-5729(02)00100-0. ISSN 0167-5729.
- ↑ Waseda, Y. (1980). गैर-क्रिस्टलीय सामग्री की संरचना: तरल पदार्थ और अनाकार ठोस. Advanced Book Program. McGraw-Hill International Book Company. ISBN 978-0-07-068426-3. Retrieved 16 October 2020.
- ↑ Vahvaselkä, K. S.; Mangs, J. M. (1988). "तरल सल्फर का एक्स-रे विवर्तन अध्ययन". Physica Scripta. 38 (5): 737. Bibcode:1988PhyS...38..737V. doi:10.1088/0031-8949/38/5/017. S2CID 250801367.
- ↑ Toofan, Jahansooz (1994). "क्रिटिकल त्रिज्या अनुपात और समन्वय संख्या के बीच एक सरल अभिव्यक्ति". Journal of Chemical Education. 71 (2): 147. Bibcode:1994JChEd..71..147T. doi:10.1021/ed071p147. Retrieved 3 January 2022.
- ↑ "शुद्धिपत्र". Journal of Chemical Education. 71 (9): 749. 1994. Bibcode:1994JChEd..71..749.. doi:10.1021/ed071p749. Retrieved 3 January 2022.