ऑर्थोसिलिकेट: Difference between revisions
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
{{short description|Anion SiO4−4, or any of its salts and esters}} | {{short description|Anion SiO4−4, or any of its salts and esters}} | ||
[[File:Orthosilicate-2D-dimensions.png|190px|right|thumb|आयनों की संरचना]]रसायन शास्त्र में, ऑर्थोसिलिकेट आयन {{chem|SiO|4|4−}}, या इसका कोई भी [[नमक (रसायन विज्ञान)|लवण (रसायन विज्ञान)]] और [[एस्टर]] है। यह [[सिलिकेट]] आयनों में से एक है। इसे कभी-कभी सिलिकॉन टेट्रोक्साइड आयन या [[मोइटी (रसायन विज्ञान)]] कहा जाता है।<ref name="ublue">C. A. Kumins, and A. E. Gessler (1953), "Short-Cycle Syntheses of Ultramarine Blue". ''Indunstrial & Engineering Chemistry'', volume 45, issue 3, pages 567–572. {{doi|10.1021/ie50519a031}}</ref> | [[File:Orthosilicate-2D-dimensions.png|190px|right|thumb|आयनों की संरचना]]रसायन शास्त्र में, ऑर्थोसिलिकेट आयन {{chem|SiO|4|4−}}, या इसका कोई भी [[नमक (रसायन विज्ञान)|लवण (रसायन विज्ञान)]] और [[एस्टर]] है। यह [[सिलिकेट]] आयनों में से एक है। इसे कभी-कभी सिलिकॉन टेट्रोक्साइड आयन या [[मोइटी (रसायन विज्ञान)]] कहा जाता है।<ref name="ublue">C. A. Kumins, and A. E. Gessler (1953), "Short-Cycle Syntheses of Ultramarine Blue". ''Indunstrial & Engineering Chemistry'', volume 45, issue 3, pages 567–572. {{doi|10.1021/ie50519a031}}</ref> | ||
ऑर्थोसिलिकेट लवण, जैसे [[सोडियम ऑर्थोसिलिकेट]], स्थिर होते हैं, और प्रकृति में व्यापक रूप से [[सिलिकेट खनिज]] के रूप में पाए जाते हैं, जो सिलिकेट खनिजों या नेसोसिलिकेट्स या ऑर्थोसिलिकेट्स की परिभाषित विशेषता है।<ref>[https://www.wou.edu/las/physci/ch412/poly_si.htm Western Oregon University]</ref> [[ओलीवाइन]], | ऑर्थोसिलिकेट लवण, जैसे [[सोडियम ऑर्थोसिलिकेट]], स्थिर होते हैं, और प्रकृति में व्यापक रूप से [[सिलिकेट खनिज]] के रूप में पाए जाते हैं, जो सिलिकेट खनिजों या नेसोसिलिकेट्स या ऑर्थोसिलिकेट्स की परिभाषित विशेषता है।<ref>[https://www.wou.edu/las/physci/ch412/poly_si.htm Western Oregon University]</ref> [[ओलीवाइन]], मैग्नीशियम या आयरन (II) ऑर्थोसिलिकेट, ऊपरी मेंटल (पृथ्वी) में सबसे प्रचुर मात्रा में खनिज है। | ||
ऑर्थोसिलिकेट आयन एक शक्तिशाली आधार (रसायन) है, अत्यंत कमजोर [[सिलिकिक एसिड]] का संयुग्म आधार {{chem|H|4|SiO|4}} (p''K''<sub>a2</sub> = 13.2 at 25 °C) है। इस संतुलन का अध्ययन करना जटिल है क्योंकि एसिड एक [[ जलमिश्रित पत्थर ]] कंडेनसेट में विघटित हो जाता है।<ref name="JurkićCepanec2013">{{cite journal|last1=Jurkić|first1=Lela Munjas|last2=Cepanec|first2=Ivica|last3=Pavelić|first3=Sandra Kraljević|last4=Pavelić|first4=Krešimir|title=ऑर्थो-सिलिकिक एसिड और कुछ ऑर्थो-सिलिकिक एसिड-रिलीजिंग यौगिकों के जैविक और चिकित्सीय प्रभाव: चिकित्सा के लिए नए दृष्टिकोण|journal=Nutrition & Metabolism|volume=10|issue=1|year=2013|pages=2|issn=1743-7075|doi=10.1186/1743-7075-10-2|pmc=3546016}}</ref> | ऑर्थोसिलिकेट आयन एक शक्तिशाली आधार (रसायन) है, अत्यंत कमजोर [[सिलिकिक एसिड]] का संयुग्म आधार {{chem|H|4|SiO|4}} (p''K''<sub>a2</sub> = 13.2 at 25 °C) है। इस संतुलन का अध्ययन करना जटिल है क्योंकि एसिड एक [[ जलमिश्रित पत्थर |जलमिश्रित पत्थर]] कंडेनसेट में विघटित हो जाता है।<ref name="JurkićCepanec2013">{{cite journal|last1=Jurkić|first1=Lela Munjas|last2=Cepanec|first2=Ivica|last3=Pavelić|first3=Sandra Kraljević|last4=Pavelić|first4=Krešimir|title=ऑर्थो-सिलिकिक एसिड और कुछ ऑर्थो-सिलिकिक एसिड-रिलीजिंग यौगिकों के जैविक और चिकित्सीय प्रभाव: चिकित्सा के लिए नए दृष्टिकोण|journal=Nutrition & Metabolism|volume=10|issue=1|year=2013|pages=2|issn=1743-7075|doi=10.1186/1743-7075-10-2|pmc=3546016}}</ref> | ||
== संरचना == | == संरचना == | ||
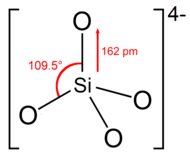
ऑर्थोसिलिकेट आयन या समूह में [[ चतुर्पाश्वीय ]] आकार होता है, जिसमें | ऑर्थोसिलिकेट आयन या समूह में [[ चतुर्पाश्वीय |चतुर्पाश्वीय]] आकार होता है, जिसमें सिलिकॉन परमाणु चार ऑक्सीजन परमाणुओं से घिरा होता है। | ||
आयनों में, प्रत्येक ऑक्सीजन में एक इकाई ऋणात्मक आवेश होता है।<ref name="SahooCharan">{{cite book|author1=Balaram Sahoo|author2=Nayak Nimai Charan|author3=Samantaray Asutosh|author4=Pujapanda Prafulla Kumar|title=अकार्बनिक रसायन शास्त्र|url=https://books.google.com/books?id=8KAemlQzOj8C&pg=PA306|publisher=PHI Learning Pvt. Ltd.|isbn=978-81-203-4308-5|page=306}}</ref> Si–O बॉन्ड 162 pm लंबा है।<ref name="BergnaRoberts2005">{{cite book|author1=Horacio E. Bergna|author2=William O. Roberts|title=Colloidal Silica: Fundamentals and Applications|url=https://books.google.com/books?id=xZ0nNHdFCKsC&pg=PA10|date=19 December 2005|publisher=CRC Press|isbn=978-1-4200-2870-6|page=10}}</ref> | आयनों में, प्रत्येक ऑक्सीजन में एक इकाई ऋणात्मक आवेश होता है।<ref name="SahooCharan">{{cite book|author1=Balaram Sahoo|author2=Nayak Nimai Charan|author3=Samantaray Asutosh|author4=Pujapanda Prafulla Kumar|title=अकार्बनिक रसायन शास्त्र|url=https://books.google.com/books?id=8KAemlQzOj8C&pg=PA306|publisher=PHI Learning Pvt. Ltd.|isbn=978-81-203-4308-5|page=306}}</ref> Si–O बॉन्ड 162 pm लंबा है।<ref name="BergnaRoberts2005">{{cite book|author1=Horacio E. Bergna|author2=William O. Roberts|title=Colloidal Silica: Fundamentals and Applications|url=https://books.google.com/books?id=xZ0nNHdFCKsC&pg=PA10|date=19 December 2005|publisher=CRC Press|isbn=978-1-4200-2870-6|page=10}}</ref> | ||
[[टेट्रामेथिल ऑर्थोसिलिकेट]] जैसे कार्बनिक यौगिकों में, प्रत्येक ऑक्सीजन औपचारिक रूप से तटस्थ होता है और शेष अणु से | [[टेट्रामेथिल ऑर्थोसिलिकेट]] जैसे कार्बनिक यौगिकों में, प्रत्येक ऑक्सीजन औपचारिक रूप से तटस्थ होता है और शेष अणु से [[सहसंयोजक बंधन]] से जुड़ा होता है। | ||
== उपयोग करता है == | == उपयोग करता है == | ||
[[यूरोप|युरोपियम]] डोप्ड बेरियम ऑर्थोसिलिकेट (Ba<sub>2</sub>SiO<sub>4</sub>) हरे [[प्रकाश उत्सर्जक डायोड]] (एलईडी) में उपयोग होने वाला | [[यूरोप|युरोपियम]] डोप्ड बेरियम ऑर्थोसिलिकेट (Ba<sub>2</sub>SiO<sub>4</sub>) हरे [[प्रकाश उत्सर्जक डायोड]] (एलईडी) में उपयोग होने वाला सामान्य [[ भास्वर |फॉस्फोर]] है। ब्लू एल ई डी के लिए फॉस्फर [[स्ट्रोंटियम]] डोप्ड बेरियम ऑर्थोसिलिकेट के साथ बनाया जा सकता है।<ref>Huayna Cerqueira Streit, Jennifer Kramer, Markus Suta, Claudia Wickleder, [https://pubmed.ncbi.nlm.nih.gov/28811423/ "Red, green, and blue photoluminescence of Ba₂SiO<sub>4</sub>:M (M = Eu<sup>3+</sup>, Eu<sup>2+</sup>, Sr<sup>2+</sup>) nanophosphors"], ''Materials (Basel)'', vol. 6, iss. 8, pp. 3079–3093, 24 July 2013 {{doi|10.3390/ma6083079}}.</ref> बेरियम ऑर्थोसिलिकेट [[ वेक्यूम - ट्यूब |वेक्यूम - ट्यूब]] में [[कैथोड विषाक्तता]] का एक प्रमुख कारण है।<ref>{{Cite book|last=Jones, Morgan (Electronics engineer)|url=https://www.worldcat.org/oclc/760157359|title=वाल्व एम्पलीफायरों|date=2011|publisher=Newnes|isbn=978-0-08-096640-3|edition=4th|location=Oxford|pages=301|oclc=760157359}}</ref> | ||
== कार्बनिक रसायन == | == कार्बनिक रसायन == | ||
चूंकि अकार्बनिक रसायन विज्ञान और भू-रसायन में बहुत महत्वपूर्ण है, कार्बनिक रसायन विज्ञान में ऑर्थोसिलिकेट आयन संभवतः ही कभी देखा जाता है। चूंकि, दो सिलिकेट यौगिकों का उपयोग [[कार्बनिक संश्लेषण]] में किया जाता है: [[टेट्राएथिल ओर्थोसिलिकेट]] या टीईओएस का उपयोग पॉलिमर को जोड़ने के लिए किया जाता है, और विशेष रूप से एरोगल्स के निर्माण में महत्वपूर्ण है। टेट्रामेथिल ऑर्थोसिलिकेट या टीएमओएस का उपयोग टीईओएस के विकल्प के रूप में किया जाता है, और इसमें अभिकर्मक के रूप में कई अन्य उपयोग भी होते हैं। टीईओएस को टीएमओएस से अधिक पसंद किया जाता है क्योंकि टीएमओएस जहरीले [[मेथनॉल]] की उच्च सांद्रता का उत्पादन करने के लिए विघटित होता है। टीएमओएस को सूंघने से फेफड़ों में सिलिका का विषैला निर्माण हो सकता है। | चूंकि अकार्बनिक रसायन विज्ञान और भू-रसायन में बहुत महत्वपूर्ण है, कार्बनिक रसायन विज्ञान में ऑर्थोसिलिकेट आयन संभवतः ही कभी देखा जाता है। चूंकि, दो सिलिकेट यौगिकों का उपयोग [[कार्बनिक संश्लेषण]] में किया जाता है: [[टेट्राएथिल ओर्थोसिलिकेट]] या टीईओएस का उपयोग पॉलिमर को जोड़ने के लिए किया जाता है, और विशेष रूप से एरोगल्स के निर्माण में महत्वपूर्ण है। टेट्रामेथिल ऑर्थोसिलिकेट या टीएमओएस का उपयोग टीईओएस के विकल्प के रूप में किया जाता है, और इसमें अभिकर्मक के रूप में कई अन्य उपयोग भी होते हैं। टीईओएस को टीएमओएस से अधिक पसंद किया जाता है क्योंकि टीएमओएस जहरीले [[मेथनॉल]] की उच्च सांद्रता का उत्पादन करने के लिए विघटित होता है। टीएमओएस को सूंघने से फेफड़ों में सिलिका का विषैला निर्माण हो सकता है। | ||
==संदर्भ== | ==संदर्भ== | ||
Revision as of 12:50, 25 March 2023
रसायन शास्त्र में, ऑर्थोसिलिकेट आयन SiO4−
4, या इसका कोई भी लवण (रसायन विज्ञान) और एस्टर है। यह सिलिकेट आयनों में से एक है। इसे कभी-कभी सिलिकॉन टेट्रोक्साइड आयन या मोइटी (रसायन विज्ञान) कहा जाता है।[1]
ऑर्थोसिलिकेट लवण, जैसे सोडियम ऑर्थोसिलिकेट, स्थिर होते हैं, और प्रकृति में व्यापक रूप से सिलिकेट खनिज के रूप में पाए जाते हैं, जो सिलिकेट खनिजों या नेसोसिलिकेट्स या ऑर्थोसिलिकेट्स की परिभाषित विशेषता है।[2] ओलीवाइन, मैग्नीशियम या आयरन (II) ऑर्थोसिलिकेट, ऊपरी मेंटल (पृथ्वी) में सबसे प्रचुर मात्रा में खनिज है।
ऑर्थोसिलिकेट आयन एक शक्तिशाली आधार (रसायन) है, अत्यंत कमजोर सिलिकिक एसिड का संयुग्म आधार H
4SiO
4 (pKa2 = 13.2 at 25 °C) है। इस संतुलन का अध्ययन करना जटिल है क्योंकि एसिड एक जलमिश्रित पत्थर कंडेनसेट में विघटित हो जाता है।[3]
संरचना
ऑर्थोसिलिकेट आयन या समूह में चतुर्पाश्वीय आकार होता है, जिसमें सिलिकॉन परमाणु चार ऑक्सीजन परमाणुओं से घिरा होता है।
आयनों में, प्रत्येक ऑक्सीजन में एक इकाई ऋणात्मक आवेश होता है।[4] Si–O बॉन्ड 162 pm लंबा है।[5]
टेट्रामेथिल ऑर्थोसिलिकेट जैसे कार्बनिक यौगिकों में, प्रत्येक ऑक्सीजन औपचारिक रूप से तटस्थ होता है और शेष अणु से सहसंयोजक बंधन से जुड़ा होता है।
उपयोग करता है
युरोपियम डोप्ड बेरियम ऑर्थोसिलिकेट (Ba2SiO4) हरे प्रकाश उत्सर्जक डायोड (एलईडी) में उपयोग होने वाला सामान्य फॉस्फोर है। ब्लू एल ई डी के लिए फॉस्फर स्ट्रोंटियम डोप्ड बेरियम ऑर्थोसिलिकेट के साथ बनाया जा सकता है।[6] बेरियम ऑर्थोसिलिकेट वेक्यूम - ट्यूब में कैथोड विषाक्तता का एक प्रमुख कारण है।[7]
कार्बनिक रसायन
चूंकि अकार्बनिक रसायन विज्ञान और भू-रसायन में बहुत महत्वपूर्ण है, कार्बनिक रसायन विज्ञान में ऑर्थोसिलिकेट आयन संभवतः ही कभी देखा जाता है। चूंकि, दो सिलिकेट यौगिकों का उपयोग कार्बनिक संश्लेषण में किया जाता है: टेट्राएथिल ओर्थोसिलिकेट या टीईओएस का उपयोग पॉलिमर को जोड़ने के लिए किया जाता है, और विशेष रूप से एरोगल्स के निर्माण में महत्वपूर्ण है। टेट्रामेथिल ऑर्थोसिलिकेट या टीएमओएस का उपयोग टीईओएस के विकल्प के रूप में किया जाता है, और इसमें अभिकर्मक के रूप में कई अन्य उपयोग भी होते हैं। टीईओएस को टीएमओएस से अधिक पसंद किया जाता है क्योंकि टीएमओएस जहरीले मेथनॉल की उच्च सांद्रता का उत्पादन करने के लिए विघटित होता है। टीएमओएस को सूंघने से फेफड़ों में सिलिका का विषैला निर्माण हो सकता है।
संदर्भ
- ↑ C. A. Kumins, and A. E. Gessler (1953), "Short-Cycle Syntheses of Ultramarine Blue". Indunstrial & Engineering Chemistry, volume 45, issue 3, pages 567–572. doi:10.1021/ie50519a031
- ↑ Western Oregon University
- ↑ Jurkić, Lela Munjas; Cepanec, Ivica; Pavelić, Sandra Kraljević; Pavelić, Krešimir (2013). "ऑर्थो-सिलिकिक एसिड और कुछ ऑर्थो-सिलिकिक एसिड-रिलीजिंग यौगिकों के जैविक और चिकित्सीय प्रभाव: चिकित्सा के लिए नए दृष्टिकोण". Nutrition & Metabolism. 10 (1): 2. doi:10.1186/1743-7075-10-2. ISSN 1743-7075. PMC 3546016.
- ↑ Balaram Sahoo; Nayak Nimai Charan; Samantaray Asutosh; Pujapanda Prafulla Kumar. अकार्बनिक रसायन शास्त्र. PHI Learning Pvt. Ltd. p. 306. ISBN 978-81-203-4308-5.
- ↑ Horacio E. Bergna; William O. Roberts (19 December 2005). Colloidal Silica: Fundamentals and Applications. CRC Press. p. 10. ISBN 978-1-4200-2870-6.
- ↑ Huayna Cerqueira Streit, Jennifer Kramer, Markus Suta, Claudia Wickleder, "Red, green, and blue photoluminescence of Ba₂SiO4:M (M = Eu3+, Eu2+, Sr2+) nanophosphors", Materials (Basel), vol. 6, iss. 8, pp. 3079–3093, 24 July 2013 doi:10.3390/ma6083079.
- ↑ Jones, Morgan (Electronics engineer) (2011). वाल्व एम्पलीफायरों (4th ed.). Oxford: Newnes. p. 301. ISBN 978-0-08-096640-3. OCLC 760157359.