अणु कक्षीय सिद्धांत: Difference between revisions
(Created page with "{{Short description|Method for describing the electronic structure of molecules using quantum mechanics}} {{see also|Molecular orbital}} {{Use American English|date = February...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Short description|Method for describing the electronic structure of molecules using quantum mechanics}} | {{Short description|Method for describing the electronic structure of molecules using quantum mechanics}} | ||
{{Electronic structure methods}} | {{Electronic structure methods}} | ||
आणविक कक्षीय सिद्धांत ने परमाणु कक्षाओं ( | [[रसायन विज्ञान]] में, आणविक कक्षीय सिद्धांत (एमओ सिद्धांत या एमओटी) [[क्वांटम यांत्रिकी]] का उपयोग करके अणुओं की [[इलेक्ट्रॉनिक इंजीनियरिंग|इलेक्ट्रॉनिक]] संरचना का वर्णन करने की एक विधि है। यह 20वीं शताब्दी के प्रारंभ में प्रस्तावित किया गया था। | ||
आणविक कक्षीय सिद्धांत में, एक अणु में इलेक्ट्रॉनों को परमाणुओं के बीच अलग-अलग रासायनिक बंधनों को नहीं सौंपा जाता है, लेकिन पूरे अणु में परमाणु नाभिक के प्रभाव में चलने के लिए माना जाता है।<ref>{{cite book|author=Daintith, J. |title=ऑक्सफोर्ड डिक्शनरी ऑफ केमिस्ट्री|location=New York | publisher=Oxford University Press|year=2004|isbn=978-0-19-860918-6}}</ref> क्वांटम यांत्रिकी इलेक्ट्रॉनों के स्थानिक और ऊर्जावान गुणों का वर्णन आणविक कक्षाओं के रूप में करती है जो एक अणु में दो या दो से अधिक परमाणुओं को घेरते हैं और परमाणुओं के बीच [[रासायनिक संयोजन इलेक्ट्रॉन]] होते हैं। | |||
आणविक कक्षीय सिद्धांत ने परमाणु कक्षाओं (एलसीओ) के रैखिक संयोजन के रूप में बंधुआ इलेक्ट्रॉनों-आणविक कक्षाओं के स्थिति को अनुमानित करके रासायनिक बंधन के अध्ययन में क्रांतिकारी बदलाव किया। श्रोडिंगर समीकरण में घनत्व कार्यात्मक सिद्धांत (डीएफटी) या हार्ट्री-फॉक (एचएफ) मॉडल को लागू करके ये अनुमान लगाए गए हैं। | |||
आणविक कक्षीय सिद्धांत और संयोजकता आबंध सिद्धांत [[क्वांटम रसायन]] विज्ञान के मूलभूत सिद्धांत हैं। | आणविक कक्षीय सिद्धांत और संयोजकता आबंध सिद्धांत [[क्वांटम रसायन]] विज्ञान के मूलभूत सिद्धांत हैं। | ||
| Line 15: | Line 16: | ||
<math display="block"> \psi_j = \sum_{i=1}^{n} c_{ij} \chi_i.</math> | <math display="block"> \psi_j = \sum_{i=1}^{n} c_{ij} \chi_i.</math> | ||
श्रोडिंगर समीकरण में इस समीकरण को प्रतिस्थापित करके और परिवर्तनशील सिद्धांत को लागू करके कोई भी ''c<sub>ij</sub>'' गुणांकों को संख्यात्मक रूप से निर्धारित कर सकता है। परिवर्तनशील सिद्धांत एक गणितीय तकनीक है जिसका उपयोग क्वांटम यांत्रिकी में प्रत्येक परमाणु कक्षीय आधार के गुणांकों के निर्माण के लिए किया जाता है। एक बड़े गुणांक का मतलब है कि कक्षीय आधार उस विशेष योगदान देने वाले परमाणु कक्षीय से अधिक बना है- इसलिए, आणविक कक्षीय उस प्रकार की सबसे अच्छी विशेषता है। परमाणु कक्षकों के एक रैखिक संयोजन के रूप में कक्षीय योगदान की मात्रा निर्धारित करने की इस पद्धति का उपयोग [[कम्प्यूटेशनल रसायन विज्ञान]] में किया जाता है। कुछ कम्प्यूटेशनल योजनाओं में अभिसरण में तेजी लाने के लिए पद्धति पर एक अतिरिक्त [[एकात्मक परिवर्तन]] लागू किया जा सकता है। 1930 के दशक में आणविक कक्षीय सिद्धांत को संयोजकता आबंध सिद्धांत के एक प्रतियोगी के रूप में देखा गया था, इससे पहले कि यह महसूस किया गया कि दो विधियां निकटता से संबंधित हैं और जब विस्तारित होती हैं तो वे समकक्ष हो जाती हैं। | |||
अनुमानित आणविक कक्षकों के रूप में उपयुक्त होने के लिए परमाणु कक्षीय संयोजनों के लिए तीन मुख्य आवश्यकताएं हैं। | अनुमानित आणविक कक्षकों के रूप में उपयुक्त होने के लिए परमाणु कक्षीय संयोजनों के लिए तीन मुख्य आवश्यकताएं हैं। | ||
| Line 24: | Line 25: | ||
== इतिहास == | == इतिहास == | ||
मुख्य रूप से [[फ्रेडरिक | मुख्य रूप से [[फ्रेडरिक हंड|फ्रेडरिक हंड,]] रॉबर्ट मुल्लिकेन, जॉन सी. स्लेटर और जॉन लेनार्ड-जोन्स के प्रयासों के माध्यम से वैलेंस बांड सिद्धांत की स्थापना (1927) के बाद आणविक कक्षीय सिद्धांत विकसित किया गया था। एमओ सिद्धांत को मूल रूप से हंड-मुल्लिकेन सिद्धांत कहा जाता था।<ref name="Mulliken" >{{cite press release |url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1966/mulliken-lecture.pdf |orig-year=1966 |year=1972 |author=Mulliken, Robert S.|title=स्पेक्ट्रोस्कोपी, आणविक ऑर्बिटल्स और रासायनिक बंधन|series=Nobel Lectures, Chemistry 1963–1970 |publisher=Elsevier Publishing Company |location=Amsterdam}}</ref> भौतिक विज्ञानी और भौतिक रसायनज्ञ एरिच हुकेल के अनुसार, आणविक कक्षीय सिद्धांत का पहला मात्रात्मक उपयोग जॉन लेनार्ड-जोन्स | लेनार्ड-जोन्स का 1929 का लेख्य था।<ref>{{cite journal |last=Hückel |first=Erich |year=1934 |journal=Trans. Faraday Soc. |volume=30 |doi=10.1039/TF9343000040 |title=कार्बनिक रसायन विज्ञान के मुक्त कणों का सिद्धांत|pages=40–52}}</ref><ref>{{cite journal |last=Lennard-Jones |first=J.E. |year=1929 |journal=Trans. Faraday Soc. |volume=25 |doi= 10.1039/TF9292500668 |title=कुछ डायटोमिक अणुओं की इलेक्ट्रॉनिक संरचना|pages=668–686|bibcode=1929FaTr...25..668L }}</ref> इस लेख्य ने [[डाइऑक्सीजन अणु]] के लिए एक [[त्रिक अवस्था]] निम्नतम अवस्था की भविष्यवाणी की जिसने इसके अनुचुम्बकत्व की व्याख्या की<ref>Coulson, C.A. ''Valence'' (2nd ed., Oxford University Press 1961), p.103</ref> (देखना {{slink|अणु कक्षीय आरेख|डाइऑक्सीजन}}) संयोजकता आबंध सिद्धांत से पहले, जो 1931 में अपनी व्याख्या के साथ आया था।<ref>{{cite journal |last=Pauling |first=Linus |year=1931 |journal=J. Am. Chem. Soc. |volume=53 |issue=9 |doi= 10.1021/ja01360a004 |title= रासायनिक बंधन की प्रकृति। द्वितीय। वन-इलेक्ट्रॉन बॉन्ड और थ्री-इलेक्ट्रॉन बॉन्ड।|pages=3225–3237}}</ref> कक्षीय शब्द 1932 में मुल्लिकेन द्वारा पेश किया गया था।<ref name="Mulliken" />1933 तक, आणविक कक्षीय सिद्धांत को एक मान्य और उपयोगी सिद्धांत के रूप में स्वीकार कर लिया गया था।<ref>{{cite journal |url=http://www.quantum-chemistry-history.com/LeJo_Dat/LJ-Hall1.htm |title=1929 का लेनार्ड-जोन्स पेपर और आणविक कक्षीय सिद्धांत की नींव|first=George G. |last=Hall |journal=Advances in Quantum Chemistry |volume=22 |pages=1–6 |issn=0065-3276 |isbn=978-0-12-034822-0 |doi=10.1016/S0065-3276(08)60361-5|bibcode = 1991AdQC...22....1H |year=1991 }}</ref> | ||
Erich Hückel ने 1931 में अपने Hückel method | |||
Erich Hückel ने 1931 में अपने Hückel method आणविक कक्षीय (एचएमओ) विधि के साथ असंतृप्त हाइड्रोकार्बन अणुओं के लिए आणविक कक्षीय सिद्धांत लागू किया, जो कि पाई इलेक्ट्रॉन के लिए एमओ ऊर्जा के निर्धारण के लिए था, जिसे उन्होंने संयुग्मित और सुगंधित हाइड्रोकार्बन पर लागू किया था।<ref>E. Hückel, ''[[Zeitschrift für Physik]]'', '''70''', 204 (1931); '''72''', 310 (1931); '''76''', 628 (1932); '''83''', 632 (1933).</ref><ref>''Hückel Theory for Organic Chemists'', [[Charles A. Coulson|C. A. Coulson]], B. O'Leary and R. B. Mallion, Academic Press, 1978.</ref> इस पद्धति ने [[बेंजीन]] जैसे छह पाई-इलेक्ट्रॉनों के साथ अणुओं की स्थिरता की व्याख्या प्रदान की थी। | |||
आणविक कक्षीय तरंग की पहली सटीक गणना 1938 में [[चार्ल्स कूलसन]] द्वारा हाइड्रोजन अणु पर की गई थी।<ref>{{citation |last=Coulson |first=C.A. |author-link=Charles_Coulson |title=Self-consistent field for molecular hydrogen |journal=Mathematical Proceedings of the Cambridge Philosophical Society |volume=34 |issue=2 |pages=204–212 |year=1938 |doi=10.1017/S0305004100020089|bibcode = 1938PCPS...34..204C }}</ref> 1950 तक, आणविक कक्षाओं को पूरी तरह से स्व-सुसंगत क्षेत्र [[हैमिल्टनियन (क्वांटम यांत्रिकी)]] के ईजेनफलन (वेव फलन) के रूप में परिभाषित किया गया था और यह इस बिंदु पर था कि आणविक कक्षीय सिद्धांत पूरी तरह से कठोर और सुसंगत हो गया।<ref>{{cite journal |doi=10.1098/rspa.1950.0104 |last=Hall |first=G.G. |journal=Proc. R. Soc. A |volume=202 |pages=336–344 |issue=1070 |date=7 August 1950 |title= रासायनिक संयोजकता का आणविक कक्षीय सिद्धांत। छठी। समतुल्य कक्षाओं के गुण|bibcode = 1950RSPSA.202..336H |s2cid=123260646 }}</ref> इस कठोर दृष्टिकोण को अणुओं के लिए हार्ट्री-फॉक विधि के रूप में जाना जाता है, हालांकि इसकी उत्पत्ति परमाणुओं पर गणना में हुई थी। अणुओं पर गणना में, आणविक कक्षाओं को एक परमाणु कक्षीय [[आधार सेट (रसायन विज्ञान)]] के संदर्भ में विस्तारित किया जाता है, जिससे रूथान समीकरण बनते हैं।<ref name="Frank">{{cite book |first=Frank |last=Jensen |title=कम्प्यूटेशनल रसायन विज्ञान का परिचय|publisher=John Wiley and Sons |year=1999 |isbn=978-0-471-98425-2}}</ref> इससे कई आरंभिक क्वांटम रसायन विधियों का विकास हुआ। समानांतर में, आणविक कक्षीय सिद्धांत को कुछ अनुभवजन्य रूप से व्युत्पन्न मापदंडों का उपयोग करके अधिक अनुमानित तरीके से लागू किया गया था, जिसे अब अर्ध-अनुभवजन्य क्वांटम रसायन विज्ञान विधियों के रूप में जाना जाता है।<ref name="Frank"/> | आणविक कक्षीय तरंग की पहली सटीक गणना 1938 में [[चार्ल्स कूलसन]] द्वारा हाइड्रोजन अणु पर की गई थी।<ref>{{citation |last=Coulson |first=C.A. |author-link=Charles_Coulson |title=Self-consistent field for molecular hydrogen |journal=Mathematical Proceedings of the Cambridge Philosophical Society |volume=34 |issue=2 |pages=204–212 |year=1938 |doi=10.1017/S0305004100020089|bibcode = 1938PCPS...34..204C }}</ref> 1950 तक, आणविक कक्षाओं को पूरी तरह से स्व-सुसंगत क्षेत्र [[हैमिल्टनियन (क्वांटम यांत्रिकी)]] के ईजेनफलन (वेव फलन) के रूप में परिभाषित किया गया था और यह इस बिंदु पर था कि आणविक कक्षीय सिद्धांत पूरी तरह से कठोर और सुसंगत हो गया।<ref>{{cite journal |doi=10.1098/rspa.1950.0104 |last=Hall |first=G.G. |journal=Proc. R. Soc. A |volume=202 |pages=336–344 |issue=1070 |date=7 August 1950 |title= रासायनिक संयोजकता का आणविक कक्षीय सिद्धांत। छठी। समतुल्य कक्षाओं के गुण|bibcode = 1950RSPSA.202..336H |s2cid=123260646 }}</ref> इस कठोर दृष्टिकोण को अणुओं के लिए हार्ट्री-फॉक विधि के रूप में जाना जाता है, हालांकि इसकी उत्पत्ति परमाणुओं पर गणना में हुई थी। अणुओं पर गणना में, आणविक कक्षाओं को एक परमाणु कक्षीय [[आधार सेट (रसायन विज्ञान)]] के संदर्भ में विस्तारित किया जाता है, जिससे रूथान समीकरण बनते हैं।<ref name="Frank">{{cite book |first=Frank |last=Jensen |title=कम्प्यूटेशनल रसायन विज्ञान का परिचय|publisher=John Wiley and Sons |year=1999 |isbn=978-0-471-98425-2}}</ref> इससे कई आरंभिक क्वांटम रसायन विधियों का विकास हुआ। समानांतर में, आणविक कक्षीय सिद्धांत को कुछ अनुभवजन्य रूप से व्युत्पन्न मापदंडों का उपयोग करके अधिक अनुमानित तरीके से लागू किया गया था, जिसे अब अर्ध-अनुभवजन्य क्वांटम रसायन विज्ञान विधियों के रूप में जाना जाता है।<ref name="Frank"/> | ||
| Line 32: | Line 34: | ||
== कक्षकों के प्रकार == | == कक्षकों के प्रकार == | ||
[[Image:MO diagram dihydrogen.png|thumb|right|300px|H के आणविक कक्षकों के निर्माण को दर्शाने वाला MO आरेख<sub>2</sub> (केंद्र) दो H परमाणुओं के परमाणु कक्षाओं से। निम्न-ऊर्जा MO दो H नाभिकों के बीच केंद्रित इलेक्ट्रॉन घनत्व के साथ बंध रहा है। उच्च-ऊर्जा MO प्रत्येक इंच नाभिक के पीछे केंद्रित इलेक्ट्रॉन घनत्व के साथ प्रति-बंधक है।]]आणविक कक्षीय ( | आणविक कक्षीय (MO) सिद्धांत परमाणुओं के बीच बंधन से उत्पन्न आणविक कक्षाओं का प्रतिनिधित्व करने के लिए परमाणु कक्षाओं (LCO) के एक रैखिक संयोजन का उपयोग करता है। इन्हें अक्सर तीन प्रकारों में विभाजित किया जाता है, [[बंधन आणविक कक्षीय]], [[एंटीबॉडी आणविक कक्षीय]] और [[गैर बंधन कक्षीय]] | गैर-बंधन। एक बंधन कक्षीय परमाणुओं की एक जोड़ी के बीच के क्षेत्र में इलेक्ट्रॉन घनत्व को केंद्रित करता है, ताकि इसका इलेक्ट्रॉन घनत्व दो नाभिकों में से प्रत्येक को दूसरे की ओर आकर्षित करे और दोनों परमाणुओं को एक साथ जोड़े।[[Image:MO diagram dihydrogen.png|thumb|right|300px|H के आणविक कक्षकों के निर्माण को दर्शाने वाला MO आरेख<sub>2</sub> (केंद्र) दो H परमाणुओं के परमाणु कक्षाओं से। निम्न-ऊर्जा MO दो H नाभिकों के बीच केंद्रित इलेक्ट्रॉन घनत्व के साथ बंध रहा है। उच्च-ऊर्जा MO प्रत्येक इंच नाभिक के पीछे केंद्रित इलेक्ट्रॉन घनत्व के साथ प्रति-बंधक है।]] | ||
आणविक कक्षीय (एमओ) सिद्धांत परमाणुओं के बीच बंधन से उत्पन्न आणविक कक्षाओं का प्रतिनिधित्व करने के लिए परमाणु कक्षाओं (एलसीएओ) के रैखिक संयोजन का उपयोग करता है। इन्हें अक्सर तीन प्रकारों में विभाजित किया जाता है, बॉन्डिंग, एंटीबांडिंग और नॉन-बॉन्डिंग। एक बॉन्डिंग ऑर्बिटल परमाणुओं की एक जोड़ी के बीच क्षेत्र में इलेक्ट्रॉन घनत्व को केंद्रित करता है, ताकि इसका इलेक्ट्रॉन घनत्व दो नाभिकों में से प्रत्येक को दूसरे की ओर आकर्षित करे और दोनों परमाणुओं को एक साथ जोड़े रखे।<ref name="Tarr 2013">Miessler and Tarr (2013), ''Inorganic Chemistry'', 5th ed, 117-165, 475-534.</ref> एक प्रति-बंधक कक्षीय प्रत्येक नाभिक के पीछे इलेक्ट्रॉन घनत्व को केंद्रित करता है (अर्थात प्रत्येक परमाणु की तरफ जो दूसरे परमाणु से सबसे दूर होता है), और इसलिए दो नाभिकों में से प्रत्येक को दूसरे से दूर खींचता है और वास्तव में दोनों के बीच के बंधन को कमजोर करता है। नाभिक। गैर-बंधन कक्षाओं में इलेक्ट्रॉन परमाणु कक्षाओं से जुड़े होते हैं जो एक दूसरे के साथ सकारात्मक या नकारात्मक रूप से बातचीत नहीं करते हैं, और इन कक्षाओं में इलेक्ट्रॉन न तो बंधन शक्ति में योगदान करते हैं और न ही कम करते हैं।<ref name="Tarr 2013" /> | |||
आणविक कक्षाओं को उन परमाणु कक्षाओं के प्रकार के अनुसार विभाजित किया जाता है जिनसे वे बनते हैं। यदि रासायनिक पदार्थ एक-दूसरे के साथ परस्पर क्रिया करते हैं, तो उनके कक्षाओं ऊर्जा में कम हो जाते हैं, तो वे बंधन बनाते हैं। अलग-अलग बंधन कक्षाओं को प्रतिष्ठित किया जाता है जो [[ऋणावेशित सूक्ष्म अणु का विन्यास]] (इलेक्ट्रॉन अभ्र आकार) और [[ऊर्जा स्तर]]ों से भिन्न होते हैं। | आणविक कक्षाओं को उन परमाणु कक्षाओं के प्रकार के अनुसार विभाजित किया जाता है जिनसे वे बनते हैं। यदि रासायनिक पदार्थ एक-दूसरे के साथ परस्पर क्रिया करते हैं, तो उनके कक्षाओं ऊर्जा में कम हो जाते हैं, तो वे बंधन बनाते हैं। अलग-अलग बंधन कक्षाओं को प्रतिष्ठित किया जाता है जो [[ऋणावेशित सूक्ष्म अणु का विन्यास]] (इलेक्ट्रॉन अभ्र आकार) और [[ऊर्जा स्तर]]ों से भिन्न होते हैं। | ||
Revision as of 00:16, 26 April 2023
रसायन विज्ञान में, आणविक कक्षीय सिद्धांत (एमओ सिद्धांत या एमओटी) क्वांटम यांत्रिकी का उपयोग करके अणुओं की इलेक्ट्रॉनिक संरचना का वर्णन करने की एक विधि है। यह 20वीं शताब्दी के प्रारंभ में प्रस्तावित किया गया था।
आणविक कक्षीय सिद्धांत में, एक अणु में इलेक्ट्रॉनों को परमाणुओं के बीच अलग-अलग रासायनिक बंधनों को नहीं सौंपा जाता है, लेकिन पूरे अणु में परमाणु नाभिक के प्रभाव में चलने के लिए माना जाता है।[1] क्वांटम यांत्रिकी इलेक्ट्रॉनों के स्थानिक और ऊर्जावान गुणों का वर्णन आणविक कक्षाओं के रूप में करती है जो एक अणु में दो या दो से अधिक परमाणुओं को घेरते हैं और परमाणुओं के बीच रासायनिक संयोजन इलेक्ट्रॉन होते हैं।
आणविक कक्षीय सिद्धांत ने परमाणु कक्षाओं (एलसीओ) के रैखिक संयोजन के रूप में बंधुआ इलेक्ट्रॉनों-आणविक कक्षाओं के स्थिति को अनुमानित करके रासायनिक बंधन के अध्ययन में क्रांतिकारी बदलाव किया। श्रोडिंगर समीकरण में घनत्व कार्यात्मक सिद्धांत (डीएफटी) या हार्ट्री-फॉक (एचएफ) मॉडल को लागू करके ये अनुमान लगाए गए हैं।
आणविक कक्षीय सिद्धांत और संयोजकता आबंध सिद्धांत क्वांटम रसायन विज्ञान के मूलभूत सिद्धांत हैं।
परमाणु कक्षाओं (LCAO) विधि का रैखिक संयोजन
एलसीएओ पद्धति में, प्रत्येक अणु में आणविक कक्षाओं का एक समूह होता है। यह माना जाता है कि आणविक कक्षीय तरंग फलन ψjn घटक परमाणु कक्षाओं χ के सरल भारित योग के रूप में लिखा जा सकता हैi, निम्नलिखित समीकरण के अनुसार:[2]
अनुमानित आणविक कक्षकों के रूप में उपयुक्त होने के लिए परमाणु कक्षीय संयोजनों के लिए तीन मुख्य आवश्यकताएं हैं।
- परमाणु कक्षीय संयोजन में सही समरूपता होनी चाहिए, जिसका अर्थ है कि यह आणविक समरूपता के सही अलघुकरणीय प्रतिनिधित्व से संबंधित होना चाहिए। परमाणु कक्षाओं , या SALCs के रैखिक संयोजन का उपयोग करके, सही समरूपता के आणविक कक्षाओं का निर्माण किया जा सकता है।
- अंतरिक्ष के भीतर परमाणु कक्षाओं को भी अधिव्यापन करना चाहिए। यदि वे एक दूसरे से बहुत दूर हैं तो वे आणविक कक्षा बनाने के लिए गठबंधन नहीं कर सकते हैं।
- परमाणु कक्षाओं को आणविक कक्षाओं के रूप में संयोजित करने के लिए समान ऊर्जा स्तरों पर होना चाहिए।
इतिहास
मुख्य रूप से फ्रेडरिक हंड, रॉबर्ट मुल्लिकेन, जॉन सी. स्लेटर और जॉन लेनार्ड-जोन्स के प्रयासों के माध्यम से वैलेंस बांड सिद्धांत की स्थापना (1927) के बाद आणविक कक्षीय सिद्धांत विकसित किया गया था। एमओ सिद्धांत को मूल रूप से हंड-मुल्लिकेन सिद्धांत कहा जाता था।[3] भौतिक विज्ञानी और भौतिक रसायनज्ञ एरिच हुकेल के अनुसार, आणविक कक्षीय सिद्धांत का पहला मात्रात्मक उपयोग जॉन लेनार्ड-जोन्स | लेनार्ड-जोन्स का 1929 का लेख्य था।[4][5] इस लेख्य ने डाइऑक्सीजन अणु के लिए एक त्रिक अवस्था निम्नतम अवस्था की भविष्यवाणी की जिसने इसके अनुचुम्बकत्व की व्याख्या की[6] (देखना अणु कक्षीय आरेख § डाइऑक्सीजन) संयोजकता आबंध सिद्धांत से पहले, जो 1931 में अपनी व्याख्या के साथ आया था।[7] कक्षीय शब्द 1932 में मुल्लिकेन द्वारा पेश किया गया था।[3]1933 तक, आणविक कक्षीय सिद्धांत को एक मान्य और उपयोगी सिद्धांत के रूप में स्वीकार कर लिया गया था।[8]
Erich Hückel ने 1931 में अपने Hückel method आणविक कक्षीय (एचएमओ) विधि के साथ असंतृप्त हाइड्रोकार्बन अणुओं के लिए आणविक कक्षीय सिद्धांत लागू किया, जो कि पाई इलेक्ट्रॉन के लिए एमओ ऊर्जा के निर्धारण के लिए था, जिसे उन्होंने संयुग्मित और सुगंधित हाइड्रोकार्बन पर लागू किया था।[9][10] इस पद्धति ने बेंजीन जैसे छह पाई-इलेक्ट्रॉनों के साथ अणुओं की स्थिरता की व्याख्या प्रदान की थी।
आणविक कक्षीय तरंग की पहली सटीक गणना 1938 में चार्ल्स कूलसन द्वारा हाइड्रोजन अणु पर की गई थी।[11] 1950 तक, आणविक कक्षाओं को पूरी तरह से स्व-सुसंगत क्षेत्र हैमिल्टनियन (क्वांटम यांत्रिकी) के ईजेनफलन (वेव फलन) के रूप में परिभाषित किया गया था और यह इस बिंदु पर था कि आणविक कक्षीय सिद्धांत पूरी तरह से कठोर और सुसंगत हो गया।[12] इस कठोर दृष्टिकोण को अणुओं के लिए हार्ट्री-फॉक विधि के रूप में जाना जाता है, हालांकि इसकी उत्पत्ति परमाणुओं पर गणना में हुई थी। अणुओं पर गणना में, आणविक कक्षाओं को एक परमाणु कक्षीय आधार सेट (रसायन विज्ञान) के संदर्भ में विस्तारित किया जाता है, जिससे रूथान समीकरण बनते हैं।[13] इससे कई आरंभिक क्वांटम रसायन विधियों का विकास हुआ। समानांतर में, आणविक कक्षीय सिद्धांत को कुछ अनुभवजन्य रूप से व्युत्पन्न मापदंडों का उपयोग करके अधिक अनुमानित तरीके से लागू किया गया था, जिसे अब अर्ध-अनुभवजन्य क्वांटम रसायन विज्ञान विधियों के रूप में जाना जाता है।[13]
आणविक कक्षीय सिद्धांत की सफलता ने लिगेंड क्षेत्र सिद्धांत को भी जन्म दिया, जिसे 1930 और 1940 के दशक के दौरान क्रिस्टल क्षेत्र सिद्धांत के विकल्प के रूप में विकसित किया गया था।
कक्षकों के प्रकार
आणविक कक्षीय (MO) सिद्धांत परमाणुओं के बीच बंधन से उत्पन्न आणविक कक्षाओं का प्रतिनिधित्व करने के लिए परमाणु कक्षाओं (LCO) के एक रैखिक संयोजन का उपयोग करता है। इन्हें अक्सर तीन प्रकारों में विभाजित किया जाता है, बंधन आणविक कक्षीय, एंटीबॉडी आणविक कक्षीय और गैर बंधन कक्षीय | गैर-बंधन। एक बंधन कक्षीय परमाणुओं की एक जोड़ी के बीच के क्षेत्र में इलेक्ट्रॉन घनत्व को केंद्रित करता है, ताकि इसका इलेक्ट्रॉन घनत्व दो नाभिकों में से प्रत्येक को दूसरे की ओर आकर्षित करे और दोनों परमाणुओं को एक साथ जोड़े।
आणविक कक्षीय (एमओ) सिद्धांत परमाणुओं के बीच बंधन से उत्पन्न आणविक कक्षाओं का प्रतिनिधित्व करने के लिए परमाणु कक्षाओं (एलसीएओ) के रैखिक संयोजन का उपयोग करता है। इन्हें अक्सर तीन प्रकारों में विभाजित किया जाता है, बॉन्डिंग, एंटीबांडिंग और नॉन-बॉन्डिंग। एक बॉन्डिंग ऑर्बिटल परमाणुओं की एक जोड़ी के बीच क्षेत्र में इलेक्ट्रॉन घनत्व को केंद्रित करता है, ताकि इसका इलेक्ट्रॉन घनत्व दो नाभिकों में से प्रत्येक को दूसरे की ओर आकर्षित करे और दोनों परमाणुओं को एक साथ जोड़े रखे।[14] एक प्रति-बंधक कक्षीय प्रत्येक नाभिक के पीछे इलेक्ट्रॉन घनत्व को केंद्रित करता है (अर्थात प्रत्येक परमाणु की तरफ जो दूसरे परमाणु से सबसे दूर होता है), और इसलिए दो नाभिकों में से प्रत्येक को दूसरे से दूर खींचता है और वास्तव में दोनों के बीच के बंधन को कमजोर करता है। नाभिक। गैर-बंधन कक्षाओं में इलेक्ट्रॉन परमाणु कक्षाओं से जुड़े होते हैं जो एक दूसरे के साथ सकारात्मक या नकारात्मक रूप से बातचीत नहीं करते हैं, और इन कक्षाओं में इलेक्ट्रॉन न तो बंधन शक्ति में योगदान करते हैं और न ही कम करते हैं।[14]
आणविक कक्षाओं को उन परमाणु कक्षाओं के प्रकार के अनुसार विभाजित किया जाता है जिनसे वे बनते हैं। यदि रासायनिक पदार्थ एक-दूसरे के साथ परस्पर क्रिया करते हैं, तो उनके कक्षाओं ऊर्जा में कम हो जाते हैं, तो वे बंधन बनाते हैं। अलग-अलग बंधन कक्षाओं को प्रतिष्ठित किया जाता है जो ऋणावेशित सूक्ष्म अणु का विन्यास (इलेक्ट्रॉन अभ्र आकार) और ऊर्जा स्तरों से भिन्न होते हैं।
एक अणु के आणविक कक्षकों को आणविक कक्षीय आरेखों में चित्रित किया जा सकता है।
सामान्य बंधन कक्षाओं हैं सिग्मा बंधन | सिग्मा (σ) कक्षाओं जो बंधन अक्ष के बारे में समलित हैं,और या पीआई बंधन | पीआई (Π) कक्षाओं बंधन अक्ष के साथ एक नोड (भौतिकी) के साथ हैं। कम आम हैं डेल्टा बंधन | डेल्टा (δ) कक्षाओं और फी बंधन | फी (φ) कक्षाए क्रमशः दो और तीन नोडल विमानों के साथ बंधन अक्ष के साथ। गैर-बंधन कक्षाओं को एक तारक के जोड़ से दर्शाया जाता है। उदाहरण के लिए, एक गैर-बंधन पाई कक्षाओं को π* के रूप में दिखाया जा सकता है।
सिंहावलोकन
This section needs additional citations for verification. (September 2020) (Learn how and when to remove this template message) |
MOT रासायनिक बंधन पर एक वैश्विक, मुखर परिप्रेक्ष्य प्रदान करता है। MO सिद्धांत में, अणु में कोई भी इलेक्ट्रॉन अणु में कहीं भी पाया जा सकता है, क्योंकि क्वांटम स्थितियां इलेक्ट्रॉनों को मनमाने ढंग से बड़ी संख्या में नाभिक के प्रभाव में यात्रा करने की अनुमति देती हैं, जब तक कि वे कुछ क्वांटम नियमों द्वारा अनुमत ईजेनस्थिति में हैं। इस प्रकार, जब उच्च-आवृत्ति वाले प्रकाश या अन्य माध्यमों से आवश्यक मात्रा में ऊर्जा से उत्साहित होते हैं, तो इलेक्ट्रॉन उच्च-ऊर्जा आणविक कक्षा में संक्रमण कर सकते हैं। उदाहरण के लिए, हाइड्रोजन द्विपरमाणुक अणु के साधारण मामले में, UV विकिरण के तहत बंधन कक्षाओं से गैर-बंधन कक्षीय तक एकल इलेक्ट्रॉन का प्रचार हो सकता है। यह पदोन्नति दो हाइड्रोजन परमाणुओं के बीच के बंधन को कमजोर करती है और प्रकाश के अवशोषण के कारण एक रासायनिक बंधन को तोड़कर प्रकाश-विघटन का कारण बन सकती है।
आणविक कक्षीय सिद्धांत का उपयोग पराबैंगनी-दृश्यमान स्पेक्ट्रोस्कोपी (UV-VIS) की व्याख्या के लिए किया जाता है। विशिष्ट तरंग दैर्ध्य पर प्रकाश के अवशोषण से अणुओं की इलेक्ट्रॉनिक संरचना में परिवर्तन देखा जा सकता है। निम्न ऊर्जा वाले एक कक्षीय से उच्च ऊर्जा वाले कक्षक में जाने वाले इलेक्ट्रॉनों के संक्रमण द्वारा दर्शाए गए इन संकेतों को समनुदेशन किया जा सकता है। अंतिम अवस्था के लिए आणविक कक्षीय आरेख एक उत्तेजित अवस्था में अणु की इलेक्ट्रॉनिक प्रकृति का वर्णन करता है।
हालांकि MO सिद्धांत में कुछ आणविक कक्षाओं इलेक्ट्रॉनों को धारण कर सकते हैं जो आणविक परमाणुओं के विशिष्ट जोड़े के बीच अधिक स्थानीयकृत होते हैं, अन्य कक्षाओं इलेक्ट्रॉनों को धारण कर सकते हैं जो अणु पर अधिक समान रूप से फैले हुए हैं। इस प्रकार, कुल मिलाकर, बंधन MO सिद्धांत में कहीं अधिक स्पष्ट है, जो इसे गुंजयमान अणुओं के लिए अधिक लागू करता है जिनके पास संयोजकता आबंध (VB) सिद्धांत की तुलना में गैर-पूर्णांक बंधन ऑर्डर के बराबर है। यह MO सिद्धांत को विस्तारित प्रणालियों के विवरण के लिए अधिक उपयोगी बनाता है।
रॉबर्ट एस मुल्लिकेन, जिन्होंने आणविक कक्षीय सिद्धांत के आगमन में सक्रिय रूप से भाग लिया, प्रत्येक अणु को एक आत्मनिर्भर इकाई मानते हैं। उन्होंने अपने लेख में दावा किया है: <ब्लॉकक्वोट>... एक अणु को विशिष्ट परमाणु या आयनिक इकाइयों के रूप में मानने का प्रयास करता है, जो बंधन इलेक्ट्रॉनों या इलेक्ट्रॉन-जोड़ों की असतत संख्या द्वारा एक साथ रखे जाते हैं, कमोबेश अर्थहीन माने जाते हैं, सिवाय एक सन्निकटन के विशेष मामले, या गणना की एक विधि के रूप में […] एक अणु को यहां नाभिकों का एक समूह माना जाता है, जिनमें से प्रत्येक के चारों ओर एक बाहरी क्षेत्र में एक मुक्त परमाणु के समान एक इलेक्ट्रॉन विन्यास को समूहीकृत किया जाता है, सिवाय इसके कि प्रत्येक नाभिक के आसपास के इलेक्ट्रॉन विन्यास के बाहरी भाग आमतौर पर भाग में होते हैं। , संयुक्त रूप से दो या दो से अधिक नाभिक ….[15]C6H6 का MO विवरण एक उदाहरण है, C
6H
6, जो छह कार्बन परमाणुओं और तीन दोहरे बंधनों का एक सुगंधित हेक्सागोनल वलय है। इस अणु में, 30 कुल संयोजकता बंध इलेक्ट्रॉनों में से 24 - कार्बन परमाणुओं से आने वाले 24 और हाइड्रोजन परमाणुओं से आने वाले - 12 σ (सिग्मा) बंधन कक्षाओं में स्थित हैं, जो ज्यादातर परमाणुओं के जोड़े (CC या C-H) के बीच स्थित हैं। संयोजकता आबंध विवरण में इलेक्ट्रॉनों के समान। हालांकि, C6H6 में शेष छह बंधन इलेक्ट्रॉन तीन π (पीआई) आणविक बंधन कक्षाओं में स्थित होते हैं जो रिंग के चारों ओर विस्थानित होते हैं। इनमें से दो इलेक्ट्रॉन एक एमओ में हैं जिसका सभी छह परमाणुओं से समान कक्षीय योगदान है। अन्य चार इलेक्ट्रॉन एक दूसरे से समकोण पर लंबवत बिंदु वाले कक्षाओं में हैं। जैसा कि VB सिद्धांत में है, ये सभी छह विस्थानित π इलेक्ट्रॉन एक बड़े स्थान में रहते हैं जो रिंग प्लेन के ऊपर और नीचे मौजूद होता है। C6H6 में सभी कार्बन-कार्बन बंधन रासायनिक रूप से समतुल्य हैं। MO सिद्धांत में यह इस तथ्य का प्रत्यक्ष परिणाम है कि तीन आणविक π कक्षाओं गठबंधन करते हैं और छह कार्बन परमाणुओं पर अतिरिक्त छह इलेक्ट्रॉनों को समान रूप से फैलाते हैं।
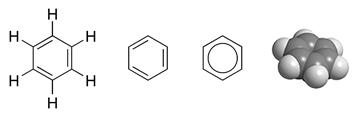 मीथेन जैसे अणुओं में, CH
मीथेन जैसे अणुओं में, CH
4, आठ संयोजन इलेक्ट्रॉन चार एमओ में पाए जाते हैं जो सभी पांच परमाणुओं में फैले हुए हैं। MO को चार स्थानीय एसपी में बदलना संभव है3 कक्षाओं। लाइनस पॉलिंग ने 1931 में कार्बन 2s और 2p कक्षाओं को संकरणित किया ताकि वे सीधे हाइड्रोजन 1s आधार कार्यों की ओर इशारा करें और अधिकतम अधिव्यापन को प्रदर्शित करें। हालांकि, आयनीकरण ऊर्जा और वर्णक्रमीय अवशोषण बैंड की स्थिति की भविष्यवाणी करने के लिए विस्थानित MO विवरण अधिक उपयुक्त है। जब CH₄ को आयनित किया जाता है, तो संयोजक MO से एक एकल इलेक्ट्रॉन लिया जाता है, जो एस बंधन या ट्रिपल डीजनरेट पी बंधन स्तरों से आ सकता है, जिससे दो आयनीकरण ऊर्जा उत्पन्न होती है। इसकी तुलना में, संयोजकता आबंध सिद्धांत में स्पष्टीकरण अधिक जटिल है। जब एक एसपी से एक इलेक्ट्रॉन निकाला जाता है3 कक्षीय, अनुनाद (रसायन विज्ञान) को चार संयोजकता आबंध संरचनाओं के बीच लागू किया जाता है, जिनमें से प्रत्येक में एक एकल-इलेक्ट्रॉन बंधन और तीन दो-इलेक्ट्रॉन बंधन होते हैं। त्रिगुण पतित टी2 और ए1 आयनित अवस्थाएँ (CH4+) इन चार संरचनाओं के विभिन्न रैखिक संयोजनों से निर्मित होते हैं। आयनित और जमीनी अवस्था के बीच ऊर्जा का अंतर दो आयनीकरण ऊर्जा देता है।
C6H6 की तरह, बीटा कैरोटीन, क्लोरोफिल, या हीम जैसे पदार्थों में, π कक्षाओं में कुछ इलेक्ट्रॉन अणु में लंबी दूरी पर आणविक कक्षाओं में फैले होते हैं, जिसके परिणामस्वरूप कम ऊर्जा (दृश्यमान स्पेक्ट्रम) में प्रकाश अवशोषण होता है, जो खाता है इन पदार्थों के विशिष्ट रंगों के लिए।[16] अणुओं के लिए यह और अन्य स्पेक्ट्रोस्कोपिक डेटा MO सिद्धांत में अच्छी तरह से समझाया गया है, जिसमें बहुकेंद्रीय कक्षाओं से जुड़े इलेक्ट्रॉनिक राज्यों पर जोर दिया गया है, जिसमें कक्षीय समरूपता मिलान के सिद्धांतों पर आधारित कक्षाओं का मिश्रण शामिल है।[14]वही MO सिद्धांत भी स्वाभाविक रूप से कुछ विद्युत घटनाओं की व्याख्या करते हैं, जैसे सीसा में मौजूद हेक्सागोनल परमाणु विस्तार की प्लेनर दिशा में उच्च विद्युत चालकता। यह आधे भरे पी कक्षाओं के निरंतर बंधन अधिव्यापन का परिणाम है और विद्युत चालन की व्याख्या करता है। MO सिद्धांत मानता है कि सीसा परमाणु विस्तार में कुछ इलेक्ट्रॉन मनमानी दूरी पर पूरी तरह से इलेक्ट्रॉन होते हैं, और बहुत बड़े आणविक कक्षाओं में रहते हैं जो पूरे सीसा को आवरण करते हैं, और कुछ इलेक्ट्रॉन इस प्रकार स्थानांतरित करने के लिए स्वतंत्र होते हैं और इसलिए विस्तार में बिजली का संचालन करते हैं। , मानो वे किसी धातु में रहते हों।
यह भी देखें
- सीआईएस प्रभाव
- कॉन्फ़िगरेशन इंटरैक्शन
- युग्मित क्लस्टर
- सीमांत आणविक कक्षीय सिद्धांत
- लिगैंड क्षेत्र सिद्धांत (संक्रमण धातु परिसरों के लिए एमओ सिद्धांत)
- मोलर-प्लेसेट पर्टर्बेशन थ्योरी
- क्वांटम रसायन विज्ञान कंप्यूटर प्रोग्राम
- अर्ध-अनुभवजन्य क्वांटम रसायन पद्धति
संदर्भ
- ↑ Daintith, J. (2004). ऑक्सफोर्ड डिक्शनरी ऑफ केमिस्ट्री. New York: Oxford University Press. ISBN 978-0-19-860918-6.
- ↑ Licker, Mark, J. (2004). मैकग्रा-हिल कंसाइस एनसाइक्लोपीडिया ऑफ केमिस्ट्री. New York: McGraw-Hill. ISBN 978-0-07-143953-4.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ 3.0 3.1 Mulliken, Robert S. (1972) [1966]. "स्पेक्ट्रोस्कोपी, आणविक ऑर्बिटल्स और रासायनिक बंधन" (PDF) (Press release). Nobel Lectures, Chemistry 1963–1970. Amsterdam: Elsevier Publishing Company.
- ↑ Hückel, Erich (1934). "कार्बनिक रसायन विज्ञान के मुक्त कणों का सिद्धांत". Trans. Faraday Soc. 30: 40–52. doi:10.1039/TF9343000040.
- ↑ Lennard-Jones, J.E. (1929). "कुछ डायटोमिक अणुओं की इलेक्ट्रॉनिक संरचना". Trans. Faraday Soc. 25: 668–686. Bibcode:1929FaTr...25..668L. doi:10.1039/TF9292500668.
- ↑ Coulson, C.A. Valence (2nd ed., Oxford University Press 1961), p.103
- ↑ Pauling, Linus (1931). "रासायनिक बंधन की प्रकृति। द्वितीय। वन-इलेक्ट्रॉन बॉन्ड और थ्री-इलेक्ट्रॉन बॉन्ड।". J. Am. Chem. Soc. 53 (9): 3225–3237. doi:10.1021/ja01360a004.
- ↑ Hall, George G. (1991). "1929 का लेनार्ड-जोन्स पेपर और आणविक कक्षीय सिद्धांत की नींव". Advances in Quantum Chemistry. 22: 1–6. Bibcode:1991AdQC...22....1H. doi:10.1016/S0065-3276(08)60361-5. ISBN 978-0-12-034822-0. ISSN 0065-3276.
- ↑ E. Hückel, Zeitschrift für Physik, 70, 204 (1931); 72, 310 (1931); 76, 628 (1932); 83, 632 (1933).
- ↑ Hückel Theory for Organic Chemists, C. A. Coulson, B. O'Leary and R. B. Mallion, Academic Press, 1978.
- ↑ Coulson, C.A. (1938), "Self-consistent field for molecular hydrogen", Mathematical Proceedings of the Cambridge Philosophical Society, 34 (2): 204–212, Bibcode:1938PCPS...34..204C, doi:10.1017/S0305004100020089
- ↑ Hall, G.G. (7 August 1950). "रासायनिक संयोजकता का आणविक कक्षीय सिद्धांत। छठी। समतुल्य कक्षाओं के गुण". Proc. R. Soc. A. 202 (1070): 336–344. Bibcode:1950RSPSA.202..336H. doi:10.1098/rspa.1950.0104. S2CID 123260646.
- ↑ 13.0 13.1 Jensen, Frank (1999). कम्प्यूटेशनल रसायन विज्ञान का परिचय. John Wiley and Sons. ISBN 978-0-471-98425-2.
- ↑ 14.0 14.1 14.2 Miessler and Tarr (2013), Inorganic Chemistry, 5th ed, 117-165, 475-534.
- ↑ Mulliken, R. S. (October 1955). "एलसीएओ-एमओ आणविक तरंग कार्यों पर इलेक्ट्रॉनिक जनसंख्या विश्लेषण। मैं". The Journal of Chemical Physics. 23 (10): 1833–1840. Bibcode:1955JChPh..23.1833M. doi:10.1063/1.1740588. ISSN 0021-9606.
- ↑ Griffith, J.S. and L.E. Orgel. "Ligand Field Theory". Q. Rev. Chem. Soc. 1957, 11, 381-383
बाहरी संबंध
- Molecular Orbital Theory - Purdue University
- Molecular Orbital Theory - Sparknotes
- Molecular Orbital Theory - Mark Bishop's Chemistry Site
- Introduction to MO Theory - Queen Mary, London University
- Molecular Orbital Theory - a related terms table
- An introduction to Molecular Group Theory - Oxford University
