जीवित प्रणाली में लोहे की भूमिका: Difference between revisions
No edit summary |
No edit summary |
||
| Line 5: | Line 5: | ||
* नॉन- हीम डाइ आयरन ऑक्सो-ब्रिज्ड यौगिक जैसे कि कार्बोक्सिलेट्स (हेमेरिथ्रिन, रिबोन्यूक्लियोटाइड रिडक्टेस और मीथेन मोनोऑक्सीजिनेज) | * नॉन- हीम डाइ आयरन ऑक्सो-ब्रिज्ड यौगिक जैसे कि कार्बोक्सिलेट्स (हेमेरिथ्रिन, रिबोन्यूक्लियोटाइड रिडक्टेस और मीथेन मोनोऑक्सीजिनेज) | ||
कुछ महत्वपूर्ण जीवित प्रणालियों में पाए जाने वाले आयरन प्रोटीन और उनके कार्य तालिका में सूचीबद्ध हैं। | कुछ महत्वपूर्ण जीवित प्रणालियों में पाए जाने वाले आयरन प्रोटीन और उनके कार्य तालिका में सूचीबद्ध हैं।<ref>{{Cite book|last=Kumar|first=Ajai|title=Bioinorganic Chemistry|publisher=Aaryush Education|year=2014|isbn=978-81-930437-1-4|location=Ghaziabad (UP)|pages=9-3|language=English}}</ref> | ||
[[File:Hematoporphyrin 200.svg|thumb|पोर्फिरिन]] | [[File:Hematoporphyrin 200.svg|thumb|पोर्फिरिन]] | ||
{| class="wikitable" | {| class="wikitable" | ||
| Line 94: | Line 94: | ||
|} | |} | ||
[[File:Heme.svg|alt=हीम समूह|thumb|हीम समूह]] | [[File:Heme.svg|alt=हीम समूह|thumb|हीम समूह]] | ||
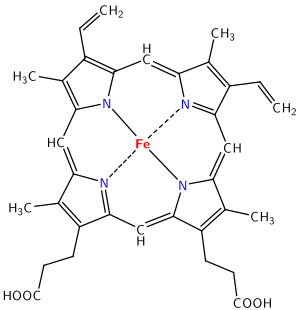
हीमोग्लोबिन में दो भाग होते हैं: हीम समूह और ग्लोबिन प्रोटीन। Fe परमाणु युक्त पोर्फिरिन वलय को हीम समूह कहा जाता है। पोर्फिरिन के छल्ले मैक्रोसाइक्लिक लिगैंड के डेरिवेटिव हैं जिन्हें पोर्फिन कहा जाता है। पोर्फिरिन वलय दो हाइड्रोजन आयनों को संकेत (यानी, +2 डाइ अम्ल ) बनाने के लिए स्वीकार कर सकता है या दो प्रोटॉन को डाइ एनायन बनाने के लिए दान कर सकता है। जिनमें आयरन युक्त पोर्फिरिन वलय होती है उन्हें हीम समूह कहा जाता है और जिनमे आयरन युक्त पोर्फिरिन वलय नहीं होती उसे नानहीम समूह कहते हैं। इसमें लोहे के परमाणु से जुड़ा पोर्फिरिन रिंग होता है। पोर्फिरिन रिंग में संयुग्मित द्विबंध और परिधि से जुड़े विभिन्न समूहों के साथ एक मैक्रोसाइक्लिक पाइरोल सिस्टम होता है। हम इन प्रतिस्थापनों की प्रकृति और विविधता से चिंतित नहीं होंगे सिवाय इसके कि उनके इलेक्ट्रॉन दान या इलेक्ट्रॉन वापस लेने की क्षमता से वे परिसर के संयुग्मित आणविक ऑर्बिटल्स को ट्यून कर सकते हैं और इस प्रकार इसके रेडॉक्स गुणों को बदल सकते हैं। पोर्फिरिन वलय बहुत दृढ़ होता है। | हीमोग्लोबिन में दो भाग होते हैं: हीम समूह और ग्लोबिन प्रोटीन। Fe परमाणु युक्त पोर्फिरिन वलय को हीम समूह कहा जाता है। पोर्फिरिन के छल्ले मैक्रोसाइक्लिक लिगैंड के डेरिवेटिव हैं जिन्हें पोर्फिन कहा जाता है। पोर्फिरिन वलय दो हाइड्रोजन आयनों को संकेत (यानी, +2 डाइ अम्ल ) बनाने के लिए स्वीकार कर सकता है या दो प्रोटॉन को डाइ एनायन बनाने के लिए दान कर सकता है। जिनमें आयरन युक्त पोर्फिरिन वलय होती है उन्हें हीम समूह कहा जाता है और जिनमे आयरन युक्त पोर्फिरिन वलय नहीं होती उसे नानहीम समूह कहते हैं। इसमें लोहे के परमाणु से जुड़ा पोर्फिरिन रिंग होता है। पोर्फिरिन रिंग में संयुग्मित द्विबंध और परिधि से जुड़े विभिन्न समूहों के साथ एक मैक्रोसाइक्लिक पाइरोल सिस्टम होता है। हम इन प्रतिस्थापनों की प्रकृति और विविधता से चिंतित नहीं होंगे सिवाय इसके कि उनके इलेक्ट्रॉन दान या इलेक्ट्रॉन वापस लेने की क्षमता से वे परिसर के संयुग्मित आणविक ऑर्बिटल्स को ट्यून कर सकते हैं और इस प्रकार इसके रेडॉक्स गुणों को बदल सकते हैं। पोर्फिरिन वलय बहुत दृढ़ होता है।<ref>{{Cite book|last=Keiter|first=Huheey|title=Principles of Structure and Reactivity (Fourth Edition)|publisher=Pearson|year=2006|isbn=978-81-775-8130-0|location=South Asia|pages=676-677|language=English}}</ref> | ||
== हीम समूह और नॉन हीम समूह में अंतर == | == हीम समूह और नॉन हीम समूह में अंतर == | ||
| Line 107: | Line 107: | ||
===== उदाहरण - फेरेडॉक्सिन, रुबेरोडॉक्सिन, हेमरिथ्रिन, फेरिटिन, ट्रांसफ़रिटिन, FeMo प्रोटीन ===== | ===== उदाहरण - फेरेडॉक्सिन, रुबेरोडॉक्सिन, हेमरिथ्रिन, फेरिटिन, ट्रांसफ़रिटिन, FeMo प्रोटीन ===== | ||
== सन्दर्भ == | |||
Revision as of 13:24, 2 May 2023
लोहा सबसे महत्वपूर्ण संक्रमण धातु है जो जीवित प्राणियों में पाया जाता है, यह पौधों और जानवरों दोनों के लिए महत्वपूर्ण है। जीवित प्रणालियों में, लोहा पौधों और जानवरों दोनों के लिए महत्वपूर्ण है। सजीवों में, लोहे में तीन विशिष्ट प्रणालियाँ होती हैं।
- प्रोटीन जिसमें हीमोग्लोबिन, मायोग्लोबिन और साइटोक्रोम P450 जैसे एक या एक से अधिक पोर्फिरिन वलय होते हैं।
- प्रोटीन जिसमें नॉन-हीम आयरन होता है जैसे कि आयरन-सल्फर यौगिक (रुबेरडॉक्सिन, फेरेडॉक्सिन, नाइट्रोजन)
- नॉन- हीम डाइ आयरन ऑक्सो-ब्रिज्ड यौगिक जैसे कि कार्बोक्सिलेट्स (हेमेरिथ्रिन, रिबोन्यूक्लियोटाइड रिडक्टेस और मीथेन मोनोऑक्सीजिनेज)
कुछ महत्वपूर्ण जीवित प्रणालियों में पाए जाने वाले आयरन प्रोटीन और उनके कार्य तालिका में सूचीबद्ध हैं।[1]
| प्रोटीन | अणु भार | Fe परमाणुओं की संख्या प्रति अणु | ऑक्सीकरण संख्या | आयरन की प्रकृति, हीम या नॉन-हीम | प्रकार्य |
|---|---|---|---|---|---|
| हीमोग्लोबिन | 64500 | 4 | II | हीम | ऑक्सीजन परिवहन |
| मायोग्लोबिन | 17500 | 1 | II | हीम | ऑक्सीजन भंडारण |
| साइटोक्रोम | 12500 | 4 | II | हीम | इलेक्ट्रॉन परिवहन |
| फेरेडॉक्सिन | 6000-12000 | 2-8 | II, III | नॉन-हीम | इलेक्ट्रॉन परिवहन |
| रुबेरोडॉक्सिन | 6000 | 1 | III | नॉन-हीम | इलेक्ट्रॉन परिवहन |
| हेमरिथ्रिन | 108000 | 2 | II | नॉन-हीम | ऑक्सीजन परिवहन |
| फेरिटिन | 45000 | - | II | नॉन-हीम | लोहे का भंडारण |
| ट्रांसफ़रिटिन | 76000 | 2 | III | नॉन-हीम | लोहे का अपमार्जन |
| FeMo प्रोटीन | 220000 | 24-36 | - | नॉन-हीम | नाइट्रोजन स्थिरीकरण |
| केटालेज़ | 280000 | - | III | हीम | H2O2 का अपघटन |
| पेरॉक्सिडेस | 44000 | - | III | हीम | H2O2 का अपघटन |
हीमोग्लोबिन में दो भाग होते हैं: हीम समूह और ग्लोबिन प्रोटीन। Fe परमाणु युक्त पोर्फिरिन वलय को हीम समूह कहा जाता है। पोर्फिरिन के छल्ले मैक्रोसाइक्लिक लिगैंड के डेरिवेटिव हैं जिन्हें पोर्फिन कहा जाता है। पोर्फिरिन वलय दो हाइड्रोजन आयनों को संकेत (यानी, +2 डाइ अम्ल ) बनाने के लिए स्वीकार कर सकता है या दो प्रोटॉन को डाइ एनायन बनाने के लिए दान कर सकता है। जिनमें आयरन युक्त पोर्फिरिन वलय होती है उन्हें हीम समूह कहा जाता है और जिनमे आयरन युक्त पोर्फिरिन वलय नहीं होती उसे नानहीम समूह कहते हैं। इसमें लोहे के परमाणु से जुड़ा पोर्फिरिन रिंग होता है। पोर्फिरिन रिंग में संयुग्मित द्विबंध और परिधि से जुड़े विभिन्न समूहों के साथ एक मैक्रोसाइक्लिक पाइरोल सिस्टम होता है। हम इन प्रतिस्थापनों की प्रकृति और विविधता से चिंतित नहीं होंगे सिवाय इसके कि उनके इलेक्ट्रॉन दान या इलेक्ट्रॉन वापस लेने की क्षमता से वे परिसर के संयुग्मित आणविक ऑर्बिटल्स को ट्यून कर सकते हैं और इस प्रकार इसके रेडॉक्स गुणों को बदल सकते हैं। पोर्फिरिन वलय बहुत दृढ़ होता है।[2]
हीम समूह और नॉन हीम समूह में अंतर
हीम समूह
Fe परमाणु युक्त पोर्फिरिन वलय को हीम समूह कहा जाता है। जिनमें आयरन युक्त पोर्फिरिन वलय होती है उन्हें हीम समूह कहा जाता है।
उदाहरण - हीमोग्लोबिन, मायोग्लोबिन, केटालेज़, पेरॉक्सिडेस
नॉन हीम समूह
जिनमे आयरन युक्त पोर्फिरिन वलय नहीं होती उसे नानहीम समूह कहते हैं।
उदाहरण - फेरेडॉक्सिन, रुबेरोडॉक्सिन, हेमरिथ्रिन, फेरिटिन, ट्रांसफ़रिटिन, FeMo प्रोटीन
सन्दर्भ
- ↑ Kumar, Ajai (2014). Bioinorganic Chemistry (in English). Ghaziabad (UP): Aaryush Education. pp. 9–3. ISBN 978-81-930437-1-4.
- ↑ Keiter, Huheey (2006). Principles of Structure and Reactivity (Fourth Edition) (in English). South Asia: Pearson. pp. 676–677. ISBN 978-81-775-8130-0.