डिसोडियम टेट्राकार्बोनिलफेरेट: Difference between revisions
No edit summary |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 87: | Line 87: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 02/03/2023]] | [[Category:Created On 02/03/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 08:27, 2 May 2023
| |
| Names | |
|---|---|
| IUPAC name
disodium tetracarbonylferrate
| |
| Systematic IUPAC name
disodium tetracarbonylferrate | |
| Other names
disodium iron tetracarbonyl,
Collman's reagent
| |
| Identifiers | |
3D model (JSmol)
|
|
| EC Number |
|
PubChem CID
|
|
| |
| |
| Properties | |
| C4FeNa2O4 | |
| Molar mass | 213.87 |
| Appearance | Colorless solid |
| Density | 2.16 g/cm3, solid |
| Decomposes | |
| Solubility | tetrahydrofuran, dimethylformamide, dioxane |
| Structure | |
| Distorted tetrahedron | |
| Tetrahedral | |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
Main hazards
|
Pyrophoric |
| Related compounds | |
Related compounds
|
Iron pentacarbonyl |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
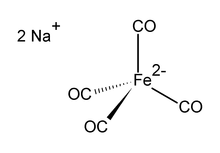
डाइसोडियम टेट्राकार्बोनिलफेरेट लौह कार्बनिक यौगिक है जिसका सूत्र Na2[Fe(CO)4] है। यह हमेशा विलायक के रूप में प्रयोग किया जाता है, उदाहरण के लिए, टेट्राहाइड्रोफ्यूरान या डाईमेथोक्सीएथेन के साथ, जो सोडियम धनायन से जुड़ता है।[1] यह एक ऑक्सीजन-संवेदनशील रंगहीन ठोस है, जो कार्बधात्विक और कार्बनिक रसायन में एक अभिकर्मक है। विलायकयोजित डाइऑक्सेन सोडियम लवण को कोलमैन अभिकर्मक के रूप में जाना जाता है, जेम्स पी कोलमैन की मान्यता में, इसके शुरुआती उपयोग लोकप्रिय बनाने वाले है। ।[2]
संरचना
Ni(CO)4, द्विऋणायन [Fe(CO)]4]2− के साथ समइलेक्ट्रॉनिक है[3][4] लौह केंद्र के साथ Na+---OCFe का पारस्परिक प्रभाव चतुष्फलकीय है । यह सामान्यतः सोडियम धनायन का निर्माण करने के लिए जटिल डाइऑक्सेन के साथ प्रयोग किया जाता है।
संश्लेषण
इस अभिकर्मक को मूल रूप से अपचायक लौह पेंटाकारबोनील और सोडियम अमलगम के साथ सीटू में उत्पन्न किया गया था।[5] आधुनिक संश्लेषण में सोडियम नेफ़थलीन या सोडियम बेंजोफेनोन केटिल्स का उपयोग अपचायक के रूप में करते हैं:[1][6]
- Fe(CO)5 + 2 Na → Na2[Fe(CO)4] + CO
- जब सोडियम अल्पता का उपयोग किया जाता है, तो गहरे पीले रंग के ऑक्टाकारबोनील अलग-अलग हो जाते हैं :
- 2 Fe(CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
- कुछ विशिष्ट विधियाँ लौह कार्बोनिल से शुरू नहीं होती हैं।[7]
अभिक्रियाएँ
इसका उपयोग एल्किल हैलाइड से एल्डिहाइड को संश्लेषित करने के लिए किया जाता है।[8]इस अभिकर्मक को मूल रूप से दो-चरणों में होने वाली एक-पॉट अभिक्रिया एल्डिहाइड में प्राथमिक एल्किल ब्रोमाइड के रूपांतरण के लिए वर्णित किया गया था:[5]:
Na2[Fe(CO)4] + RBr → Na[RFe(CO)4] + NaBr
इसके बाद इस घोल को एल्डिहाइड, RCHO देने के लिए PPh3 और फिर एसीटिक अम्ल के साथ क्रमिक रूप से उपचारित किया जाता है ।
डाइसोडियमटेट्राकार्बोनिलफेरेट का उपयोग क्लोराइड अम्ल को एल्डिहाइड में बदलने के लिए किया जा सकता है। यह अभिक्रिया जटिल लौह एसाइल की मध्यस्थता के माध्यम से आगे बढ़ती है।
- Na2[Fe(CO)4] + RCOCl → Na[RC(O)Fe(CO)4] + NaCl
- Na[RC(O)Fe(CO)4] + HCl → RCHO + "Fe(CO)4" + NaCl
- डाइसोडियमटेट्राकार्बोनिलफेरेट जटिल एल्किल बनाने के लिए एल्किल हैलाइड (RX) के साथ अभिक्रिया करता है:
- Na2[Fe(CO)4] + RX → Na[RFe(CO)4] + NaX
- इस तरह के लौह एल्किलों को संबंधित कार्बोक्सिलिक अम्ल और हैलाइड अम्ल में परिवर्तित किया जा सकता है
- Na[RFe(CO)4] + O2, H+ →→ RCO2H + Fe...
- Na[RFe(CO)4] + 2 X2 → RC(O)X + FeX2 + 3 CO + NaX
संदर्भ
- ↑ 1.0 1.1 Strong, H.; Krusic, P. J.; San Filippo, J. (1990). "Sodium Carbonyl Ferrates, Na2[Fe(CO)4], Na2[Fe2(CO)8], and Na2[Fe3(CO)11]. Bis[μ-Nitrido-Bis(triphenylphosphorus)1+] Undeca-Carbonyltriferrate2−, [(Ph3P)2N]2[Fe3(CO)11]". Inorganic Syntheses. 28: 203–207. doi:10.1002/9780470132593.ch52. ISBN 0-471-52619-3.
- ↑ Miessler, G. L.; Tarr, D. A. (2004). अकार्बनिक रसायन शास्त्र. Upper Saddle River, NJ: Pearson.
- ↑ Chin, H. B.; Bau, R. (1976). "The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate2− Anion in the Solid State". Journal of the American Chemical Society. 98 (9): 2434–2439. doi:10.1021/ja00425a009.
- ↑ Teller, R. G.; Finke, R. G.; Collman, J. P.; Chin, H. B.; Bau, R. (1977). "Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N]". Journal of the American Chemical Society. 99 (4): 1104–1111. doi:10.1021/ja00446a022.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ 5.0 5.1 Cooke, M. P. (1970). "सोडियम टेट्राकार्बोनिलफेरेट (-II) का उपयोग करके अल्काइल ब्रोमाइड्स का एल्डिहाइड में सुगम रूपांतरण". Journal of the American Chemical Society. 92 (20): 6080–6082. doi:10.1021/ja00723a056.
- ↑ Richard G. Finke, Thomas N. Sorrell (1979). "Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-Oxoöctanoate". Organic Syntheses. 59: 102. doi:10.15227/orgsyn.059.0102.
- ↑ Scholsser, M. (2013). सिंथेसिस में ऑर्गेनोमेटेलिक्स, तीसरा मैनुअल. Chicester, England: Wiley.
- ↑ Pike, R. D. (2001). "डिसोडियम टेट्राकार्बोनिलफेरेट (-II)". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd465.
अग्रिम पठन
- Collman, J. P. (1975). "Disodium Tetracarbonylferrate, a Transition Metal Analog of a Grignard Reagent". Accounts of Chemical Research. 8 (10): 342–347. doi:10.1021/ar50094a004.
- Ungurenasu, C.; Cotzur, C. (1982). "Disodium Tetracarbonylferrate: A Reagent for Acid Functionalization of Halogenated Polymers". Polymer Bulletin. 6 (5–6): 299–303. doi:10.1007/BF00255401. S2CID 101154955.
- Hieber, V. W.; Braun, G. (1959). "Notizen: "Rheniumcarbonylwasserstoff" und Methylpentacarbonylrhenium". Zeitschrift für Naturforschung B. 14 (2): 132–133. doi:10.1515/znb-1959-0214. S2CID 94402946.