इलेक्ट्राइड: Difference between revisions
(Created page with "{{Short description|Ionic compound with electrons as the anion}} Image:Electride 01.jpg|thumb|right|एक इलेक्ट्राइड में कैविटी औ...") |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Short description|Ionic compound with electrons as the anion}} | {{Short description|Ionic compound with electrons as the anion}} | ||
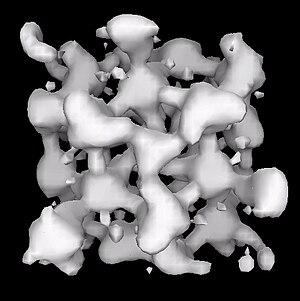
[[Image:Electride 01.jpg|thumb|right|एक इलेक्ट्राइड में कैविटी और चैनल]] | [[Image:Electride 01.jpg|thumb|right|एक इलेक्ट्राइड में कैविटी और चैनल]]इलेक्ट्राइड एक [[आयनिक यौगिक]] होता है जिसमें एक [[इलेक्ट्रॉन]] आयन होता है।<ref>{{cite journal |author=Dye, J. L. |title=आयनों के रूप में इलेक्ट्रॉन|journal=[[Science (journal)|Science]] |year=2003 |volume=301 |pages=607–608 |doi=10.1126/science.1088103 |pmid=12893933 |issue=5633 |s2cid=93768664}}</ref> [[अमोनिया]] में क्षार धातुओं के समाधान इलेक्ट्राइड लवण होते हैं।<ref>Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. {{ISBN|0-12-352651-5}}</ref> सोडियम के स्थितियों में, इन नीले समाधान [Na(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup>(रसायन विज्ञान) में और सोल्वेटेड इलेक्ट्रॉन्स से मिलते हैं: | ||
: | : Na + 6 NH<sub>3</sub> → [Na(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup> + e<sup>−</sup> | ||
[(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup> कैटायन एक अक्टाहेड्रल आणविक ज्यामिति समन्वय संकुल है। | |||
== ठोस लवण == | == ठोस लवण == | ||
[[ताज ईथर]] या 2.2.2-Cryptand | [[ताज ईथर|क्राउन ईथर]] या 2.2.2-Cryptand जैसे कॉम्प्लेक्सेंट को [Na(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup>e<sup>−</sup> के समाधान में मिलाने से [Na(2,2,2-crypt)]<sup>+</sup>e<sup>−</sup> या [Na(2,2,2-crypt)]<sup>+</sup>e<sup>−</sup> उत्पन्न होता है। इन समाधानों का वाष्पीकरण से नीले-काले अनुचुंबकीय ठोस पदार्थ का निर्माण करता है, जिसका सूत्र [Na(2,2,2-crypt)]<sup>+</sup>e<sup>−</sup> होता है। | ||
अधिकांश ठोस इलेक्ट्राइड लवण 240 K से ऊपर विघटितहो जाते हैं, हालांकि [Ca<sub>24</sub>Al<sub>28</sub>O<sub>64</sub>]<sup>4+</sup>(e<sup>−</sup>)<sub>4</sub> को कमरे के तापमान पर स्थिर माना जाता है।<ref>{{cite journal |author=Buchammagari, H. |year=2007 |title=Room Temperature-Stable Electride as a Synthetic Organic Reagent: Application to Pinacol Coupling Reaction in Aqueous Media |journal=Org. Lett. |volume=9 |issue=21 |pages=4287–4289 |doi=10.1021/ol701885p |pmid= 17854199|display-authors=etal}}</ref> इन लवणों में, इलेक्ट्रॉनों को कटायनों के बीच निरूपित किया जाता है। इलेक्ट्राइड [[ अनुचुंबकत्व | अनुचुंबकत्व]] होते हैं, और [[मोट इंसुलेटर]] होते हैं। इन लवणों के गुणों का विश्लेषण किया गया है।<ref>{{cite journal |author=Wagner, M. J.; Huang, R. H.; Eglin, J. L.; Dye, J. L. |year=1994 |title=एक बड़े छह-इलेक्ट्रॉन रिंग वाला एक इलेक्ट्राइड|journal=Nature |volume=368 |issue=6473 |pages=726–729 |doi=10.1038/368726a0 |bibcode=1994Natur.368..726W |s2cid=4242499}}.</ref> | |||
ThI<sub>2</sub> और ThI<sub>3</sub> इलेक्ट्राइड यौगिक के रूप में रिपोर्ट किए गए हैं।<ref>{{cite book |last1=Wickleder |first1=Mathias S. |first2=Blandine |last2=Fourest |first3=Peter K. |last3=Dorhout |ref=Wickleder et al. |contribution=Thorium |title=एक्टिनाइड और ट्रांसएक्टिनाइड तत्वों की रसायन|editor1-first=Lester R. |editor1-last=Morss |editor2-first=Norman M. |editor2-last=Edelstein |editor3-first=Jean |editor3-last=Fuger |edition=3rd |date=2006 |volume=3 |publisher=Springer |location=Dordrecht, the Netherlands |pages=78–94 |url=http://radchem.nevada.edu/classes/rdch710/files/thorium.pdf |doi=10.1007/1-4020-3598-5_3 |url-status=dead |archiveurl=https://web.archive.org/web/20160307160941/http://radchem.nevada.edu/classes/rdch710/files/Thorium.pdf |archivedate=2016-03-07}}</ref> इसी प्रकार {{chem|Ce|I|2}}, {{chem|La|I|2}}, {{chem|Gd|I|2}}, और {{chem|Pr|I|2}} लैंथेनाइड#Ln(II) और Ln(IV) यौगिक हैं जो ट्राइकेशनिक धातु आयन के साथ विद्युतीय लवण हैं।<ref>{{Greenwood&Earnshaw2nd|pages=1240-2}}</ref><ref>{{cite journal |author=Nief, F. |title=गैर-शास्त्रीय द्विसंयोजक लैंथेनाइड परिसरों|journal=Dalton Trans. |year=2010 |volume=39 |issue=29 |pages=6589–6598 |doi=10.1039/c001280g |pmid=20631944}}</ref> | |||
== प्रतिक्रियाएं == | == प्रतिक्रियाएं == | ||
इलेक्ट्राइड लवण के समाधान शक्तिशाली कम करने वाले | इलेक्ट्राइड लवण के समाधान शक्तिशाली कम करने वाले योजक होते हैं, जैसा कि बर्च कटौती में उनके उपयोग किया गया है। इन नीले समाधानों के वाष्पीकरण से ना धातु का दर्पण मिलता है। यदि वाष्पित नहीं होता है, तो ऐसे समाधान धीरे-धीरे अपना रंग खो देते हैं क्योंकि इलेक्ट्रॉन अमोनिया को कम करते हैं: | ||
: 2 [ | : 2[Na(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup>e<sup>−</sup> → 2NaNH<sub>2</sub> + 10NH<sub>3</sub> + H<sub>2</sub> | ||
यह रूपांतरण विभिन्न धातुओं द्वारा उत्प्रेरित होता है।<ref>{{Cite book |author1=Greenlee, K. W. |author2=Henne, A. L. |title=सोडियम एमाइड|series=Inorganic Syntheses |year=1946 |volume=2 |pages=128–135 |doi=10.1002/9780470132333.ch38 |isbn=9780470132333}}</ref> एक इलेक्ट्राइड, [ | यह रूपांतरण विभिन्न धातुओं द्वारा उत्प्रेरित होता है।<ref>{{Cite book |author1=Greenlee, K. W. |author2=Henne, A. L. |title=सोडियम एमाइड|series=Inorganic Syntheses |year=1946 |volume=2 |pages=128–135 |doi=10.1002/9780470132333.ch38 |isbn=9780470132333}}</ref> एक इलेक्ट्राइड, [Na(NH<sub>3</sub>)<sub>6</sub>]<sup>+</sup>e<sup>−</sup>, [[प्रतिक्रिया मध्यवर्ती]] के रूप में बनता है। | ||
== उच्च दबाव वाले तत्व == | == उच्च दबाव वाले तत्व == | ||
सैद्धांतिक साक्ष्य पोटेशियम, सोडियम और लिथियम के उच्च दबाव रूपों को इन्सुलेट करने में इलेक्ट्राइड व्यवहार का समर्थन करता है। यहाँ पृथक इलेक्ट्रॉन को कुशल पैकिंग द्वारा स्थिर किया जाता है, जो बाहरी दबाव में एन्थैल्पी को कम करता है। इलेक्ट्राइड की पहचान इलेक्ट्रॉन स्थानीयकरण फ़ंक्शन में अधिकतम द्वारा की जाती है, जो इलेक्ट्राइड को दबाव-प्रेरित धातुकरण से अलग करता है। इलेक्ट्राइड चरण | सैद्धांतिक साक्ष्य पोटेशियम, सोडियम और लिथियम के उच्च दबाव रूपों को इन्सुलेट करने में इलेक्ट्राइड व्यवहार का समर्थन करता है। यहाँ पृथक इलेक्ट्रॉन को कुशल पैकिंग द्वारा स्थिर किया जाता है, जो बाहरी दबाव में एन्थैल्पी को कम करता है। इलेक्ट्राइड की पहचान इलेक्ट्रॉन स्थानीयकरण फ़ंक्शन में अधिकतम द्वारा की जाती है, जो इलेक्ट्राइड को दबाव-प्रेरित धातुकरण से अलग करता है। इलेक्ट्राइड चरण सामान्यतः अर्धचालक होते हैं या उनमें बहुत कम चालकता होती है,<ref>{{cite journal |author=Marques M. |year=2009 |title=Potassium under Pressure: A Pseudobinary Ionic Compound | ||
|journal=[[Physical Review Letters]] |volume=103 |issue=11 |page=115501 |doi=10.1103/PhysRevLett.103.115501 |bibcode=2009PhRvL.103k5501M |display-authors=etal |pmid=19792381}}</ref><ref>{{cite journal |author=Gatti M. |year=2010 |title=Sodium: A Charge-Transfer Insulator at High Pressures | |journal=[[Physical Review Letters]] |volume=103 |issue=11 |page=115501 |doi=10.1103/PhysRevLett.103.115501 |bibcode=2009PhRvL.103k5501M |display-authors=etal |pmid=19792381}}</ref><ref>{{cite journal |author=Gatti M. |year=2010 |title=Sodium: A Charge-Transfer Insulator at High Pressures | ||
|journal=[[Physical Review Letters]] |volume=104 |issue=11 |page=216404 |doi=10.1103/PhysRevLett.104.216404 |arxiv=1003.0540 |bibcode=2010PhRvL.104u6404G |display-authors=etal |pmid=20867123 |s2cid=18359072}}</ref><ref>{{cite journal |author=Marques M. |year=2011 |title=Crystal Structures of Dense Lithium: A Metal-Semiconductor-Metal Transition |journal=[[Physical Review Letters]] |volume=106 |issue=9 |page=095502 |doi=10.1103/PhysRevLett.106.095502 |bibcode=2011PhRvL.106i5502M |display-authors=etal |pmid=21405633 |url=http://discovery.ucl.ac.uk/1301752/1/1301752.pdf}}</ref> | |journal=[[Physical Review Letters]] |volume=104 |issue=11 |page=216404 |doi=10.1103/PhysRevLett.104.216404 |arxiv=1003.0540 |bibcode=2010PhRvL.104u6404G |display-authors=etal |pmid=20867123 |s2cid=18359072}}</ref><ref>{{cite journal |author=Marques M. |year=2011 |title=Crystal Structures of Dense Lithium: A Metal-Semiconductor-Metal Transition |journal=[[Physical Review Letters]] |volume=106 |issue=9 |page=095502 |doi=10.1103/PhysRevLett.106.095502 |bibcode=2011PhRvL.106i5502M |display-authors=etal |pmid=21405633 |url=http://discovery.ucl.ac.uk/1301752/1/1301752.pdf}}</ref> सामान्यतः एक जटिल ऑप्टिकल प्रतिक्रिया के साथ,<ref>{{Cite journal |last1=Yu |first1=Zheng |last2=Geng |first2=Hua Y. |last3=Sun |first3=Y. |last4=Chen |first4=Y. |year=2018 |title=प्रथम-सिद्धांतों की गणना द्वारा इलेक्ट्राइड चरणों में घने लिथियम के ऑप्टिकल गुण|journal=[[Scientific Reports]] |volume=8 |issue=1 |pages=3868 |doi=10.1038/s41598-018-22168-1 |pmid=29497122 |pmc=5832767 |arxiv=1803.05234 |bibcode=2018NatSR...8.3868Y}}</ref> [[डिसोडियम ध्वनि]] नामक सोडियम यौगिक के अंतर्गत बनाया गया है {{convert|113|GPa|e6atm}} दबाव के अनुसार बनाया गया है।<ref>{{Cite journal |last1=Wang |first1=Hui-Tian |last2=Boldyrev |first2=Alexander I. |last3=Popov |first3=Ivan A. |last4=Konôpková |first4=Zuzana |last5=Prakapenka |first5=Vitali B. |last6=Zhou |first6=Xiang-Feng |last7=Dronskowski |first7=Richard |last8=Deringer |first8=Volker L. |last9=Gatti |first9=Carlo |date=May 2017 |title=उच्च दबाव पर हीलियम और सोडियम का एक स्थिर यौगिक|journal=Nature Chemistry |volume=9 |issue=5 |pages=440–445 |doi=10.1038/nchem.2716 |pmid=28430195 |issn=1755-4349 |arxiv=1309.3827 |bibcode=2017NatCh...9..440D |s2cid=20459726}}</ref> | ||
== स्तरित इलेक्ट्राइड्स (इलेक्ट्रेन्स) == | == स्तरित इलेक्ट्राइड्स (इलेक्ट्रेन्स) == | ||
स्तरित इलेक्ट्राइड्स या इलेक्ट्रेन [[एकल-परत सामग्री]] हैं जिसमें इलेक्ट्रॉनों और आयनित परमाणुओं की परमाणु रूप से पतली द्वि-आयामी परतें होती हैं।<ref name=Druffel2016>{{cite journal |last1=Druffel |first1=Daniel L. |last2=Kuntz |first2=Kaci L. |last3=Woomer |first3=Adam H. |last4=Alcorn |first4=Francis M. |last5=Hu |first5=Jun |last6=Donley |first6=Carrie L. |last7=Warren |first7=Scott C. |title=Experimental Demonstration of an Electride as a 2D Material |journal=Journal of the American Chemical Society |date=2016 |volume=138 |issue=49 |pages=16089–16094 |doi=10.1021/jacs.6b10114 |pmid=27960319 |arxiv=1706.02774 |s2cid=19062953 |url=https://pubs.acs.org/doi/10.1021/jacs.6b10114 |access-date=12 October 2021}}</ref><ref>{{cite journal |last1=Druffel |first1=Daniel L. |last2=Woomer |first2=Adam H. |last3=Kuntz |first3=Kaci L. |last4=Pawlik |first4=Jacob T. |last5=Warren |first5=Scott C. |title=Electrons on the surface of 2D materials: from layered electrides to 2D electrenes |journal=Journal of Materials Chemistry C |date=2017 |volume=5 |issue=43 |pages=11196–11213 |doi=10.1039/C7TC02488F |url=https://pubs.rsc.org/en/content/articlelanding/2017/tc/c7tc02488f |access-date=11 October 2021}}</ref> पहला उदाहरण | स्तरित इलेक्ट्राइड्स या इलेक्ट्रेन [[एकल-परत सामग्री]] होते हैं जिसमें इलेक्ट्रॉनों और आयनित परमाणुओं की परमाणु रूप से पतली द्वि-आयामी परतें होती हैं।<ref name=Druffel2016>{{cite journal |last1=Druffel |first1=Daniel L. |last2=Kuntz |first2=Kaci L. |last3=Woomer |first3=Adam H. |last4=Alcorn |first4=Francis M. |last5=Hu |first5=Jun |last6=Donley |first6=Carrie L. |last7=Warren |first7=Scott C. |title=Experimental Demonstration of an Electride as a 2D Material |journal=Journal of the American Chemical Society |date=2016 |volume=138 |issue=49 |pages=16089–16094 |doi=10.1021/jacs.6b10114 |pmid=27960319 |arxiv=1706.02774 |s2cid=19062953 |url=https://pubs.acs.org/doi/10.1021/jacs.6b10114 |access-date=12 October 2021}}</ref><ref>{{cite journal |last1=Druffel |first1=Daniel L. |last2=Woomer |first2=Adam H. |last3=Kuntz |first3=Kaci L. |last4=Pawlik |first4=Jacob T. |last5=Warren |first5=Scott C. |title=Electrons on the surface of 2D materials: from layered electrides to 2D electrenes |journal=Journal of Materials Chemistry C |date=2017 |volume=5 |issue=43 |pages=11196–11213 |doi=10.1039/C7TC02488F |url=https://pubs.rsc.org/en/content/articlelanding/2017/tc/c7tc02488f |access-date=11 October 2021}}</ref> पहला उदाहरण Ca<sub>2</sub>N था, जिसमें दो कैल्शियम आयनों (+4) के चार्ज को आयन परत में एक नाइट्राइड आयन (-3) के आवेश और इलेक्ट्रॉन परत में एक आवेश (-1) द्वारा संतुलित होता है।<ref name=Druffel2016/> | ||
Revision as of 22:41, 1 June 2023
इलेक्ट्राइड एक आयनिक यौगिक होता है जिसमें एक इलेक्ट्रॉन आयन होता है।[1] अमोनिया में क्षार धातुओं के समाधान इलेक्ट्राइड लवण होते हैं।[2] सोडियम के स्थितियों में, इन नीले समाधान [Na(NH3)6]+(रसायन विज्ञान) में और सोल्वेटेड इलेक्ट्रॉन्स से मिलते हैं:
- Na + 6 NH3 → [Na(NH3)6]+ + e−
[(NH3)6]+ कैटायन एक अक्टाहेड्रल आणविक ज्यामिति समन्वय संकुल है।
ठोस लवण
क्राउन ईथर या 2.2.2-Cryptand जैसे कॉम्प्लेक्सेंट को [Na(NH3)6]+e− के समाधान में मिलाने से [Na(2,2,2-crypt)]+e− या [Na(2,2,2-crypt)]+e− उत्पन्न होता है। इन समाधानों का वाष्पीकरण से नीले-काले अनुचुंबकीय ठोस पदार्थ का निर्माण करता है, जिसका सूत्र [Na(2,2,2-crypt)]+e− होता है।
अधिकांश ठोस इलेक्ट्राइड लवण 240 K से ऊपर विघटितहो जाते हैं, हालांकि [Ca24Al28O64]4+(e−)4 को कमरे के तापमान पर स्थिर माना जाता है।[3] इन लवणों में, इलेक्ट्रॉनों को कटायनों के बीच निरूपित किया जाता है। इलेक्ट्राइड अनुचुंबकत्व होते हैं, और मोट इंसुलेटर होते हैं। इन लवणों के गुणों का विश्लेषण किया गया है।[4]
ThI2 और ThI3 इलेक्ट्राइड यौगिक के रूप में रिपोर्ट किए गए हैं।[5] इसी प्रकार CeI
2, LaI
2, GdI
2, और PrI
2 लैंथेनाइड#Ln(II) और Ln(IV) यौगिक हैं जो ट्राइकेशनिक धातु आयन के साथ विद्युतीय लवण हैं।[6][7]
प्रतिक्रियाएं
इलेक्ट्राइड लवण के समाधान शक्तिशाली कम करने वाले योजक होते हैं, जैसा कि बर्च कटौती में उनके उपयोग किया गया है। इन नीले समाधानों के वाष्पीकरण से ना धातु का दर्पण मिलता है। यदि वाष्पित नहीं होता है, तो ऐसे समाधान धीरे-धीरे अपना रंग खो देते हैं क्योंकि इलेक्ट्रॉन अमोनिया को कम करते हैं:
- 2[Na(NH3)6]+e− → 2NaNH2 + 10NH3 + H2
यह रूपांतरण विभिन्न धातुओं द्वारा उत्प्रेरित होता है।[8] एक इलेक्ट्राइड, [Na(NH3)6]+e−, प्रतिक्रिया मध्यवर्ती के रूप में बनता है।
उच्च दबाव वाले तत्व
सैद्धांतिक साक्ष्य पोटेशियम, सोडियम और लिथियम के उच्च दबाव रूपों को इन्सुलेट करने में इलेक्ट्राइड व्यवहार का समर्थन करता है। यहाँ पृथक इलेक्ट्रॉन को कुशल पैकिंग द्वारा स्थिर किया जाता है, जो बाहरी दबाव में एन्थैल्पी को कम करता है। इलेक्ट्राइड की पहचान इलेक्ट्रॉन स्थानीयकरण फ़ंक्शन में अधिकतम द्वारा की जाती है, जो इलेक्ट्राइड को दबाव-प्रेरित धातुकरण से अलग करता है। इलेक्ट्राइड चरण सामान्यतः अर्धचालक होते हैं या उनमें बहुत कम चालकता होती है,[9][10][11] सामान्यतः एक जटिल ऑप्टिकल प्रतिक्रिया के साथ,[12] डिसोडियम ध्वनि नामक सोडियम यौगिक के अंतर्गत बनाया गया है 113 gigapascals (1.12×106 atm) दबाव के अनुसार बनाया गया है।[13]
स्तरित इलेक्ट्राइड्स (इलेक्ट्रेन्स)
स्तरित इलेक्ट्राइड्स या इलेक्ट्रेन एकल-परत सामग्री होते हैं जिसमें इलेक्ट्रॉनों और आयनित परमाणुओं की परमाणु रूप से पतली द्वि-आयामी परतें होती हैं।[14][15] पहला उदाहरण Ca2N था, जिसमें दो कैल्शियम आयनों (+4) के चार्ज को आयन परत में एक नाइट्राइड आयन (-3) के आवेश और इलेक्ट्रॉन परत में एक आवेश (-1) द्वारा संतुलित होता है।[14]
यह भी देखें
- एफ-केंद्र
संदर्भ
- ↑ Dye, J. L. (2003). "आयनों के रूप में इलेक्ट्रॉन". Science. 301 (5633): 607–608. doi:10.1126/science.1088103. PMID 12893933. S2CID 93768664.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ Buchammagari, H.; et al. (2007). "Room Temperature-Stable Electride as a Synthetic Organic Reagent: Application to Pinacol Coupling Reaction in Aqueous Media". Org. Lett. 9 (21): 4287–4289. doi:10.1021/ol701885p. PMID 17854199.
- ↑ Wagner, M. J.; Huang, R. H.; Eglin, J. L.; Dye, J. L. (1994). "एक बड़े छह-इलेक्ट्रॉन रिंग वाला एक इलेक्ट्राइड". Nature. 368 (6473): 726–729. Bibcode:1994Natur.368..726W. doi:10.1038/368726a0. S2CID 4242499.
{{cite journal}}: CS1 maint: multiple names: authors list (link). - ↑ Wickleder, Mathias S.; Fourest, Blandine; Dorhout, Peter K. (2006). "Thorium". In Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). एक्टिनाइड और ट्रांसएक्टिनाइड तत्वों की रसायन (PDF). Vol. 3 (3rd ed.). Dordrecht, the Netherlands: Springer. pp. 78–94. doi:10.1007/1-4020-3598-5_3. Archived from the original (PDF) on 2016-03-07.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1240–2. ISBN 978-0-08-037941-8.
- ↑ Nief, F. (2010). "गैर-शास्त्रीय द्विसंयोजक लैंथेनाइड परिसरों". Dalton Trans. 39 (29): 6589–6598. doi:10.1039/c001280g. PMID 20631944.
- ↑ Greenlee, K. W.; Henne, A. L. (1946). सोडियम एमाइड. Inorganic Syntheses. Vol. 2. pp. 128–135. doi:10.1002/9780470132333.ch38. ISBN 9780470132333.
- ↑ Marques M.; et al. (2009). "Potassium under Pressure: A Pseudobinary Ionic Compound". Physical Review Letters. 103 (11): 115501. Bibcode:2009PhRvL.103k5501M. doi:10.1103/PhysRevLett.103.115501. PMID 19792381.
- ↑ Gatti M.; et al. (2010). "Sodium: A Charge-Transfer Insulator at High Pressures". Physical Review Letters. 104 (11): 216404. arXiv:1003.0540. Bibcode:2010PhRvL.104u6404G. doi:10.1103/PhysRevLett.104.216404. PMID 20867123. S2CID 18359072.
- ↑ Marques M.; et al. (2011). "Crystal Structures of Dense Lithium: A Metal-Semiconductor-Metal Transition" (PDF). Physical Review Letters. 106 (9): 095502. Bibcode:2011PhRvL.106i5502M. doi:10.1103/PhysRevLett.106.095502. PMID 21405633.
- ↑ Yu, Zheng; Geng, Hua Y.; Sun, Y.; Chen, Y. (2018). "प्रथम-सिद्धांतों की गणना द्वारा इलेक्ट्राइड चरणों में घने लिथियम के ऑप्टिकल गुण". Scientific Reports. 8 (1): 3868. arXiv:1803.05234. Bibcode:2018NatSR...8.3868Y. doi:10.1038/s41598-018-22168-1. PMC 5832767. PMID 29497122.
- ↑ Wang, Hui-Tian; Boldyrev, Alexander I.; Popov, Ivan A.; Konôpková, Zuzana; Prakapenka, Vitali B.; Zhou, Xiang-Feng; Dronskowski, Richard; Deringer, Volker L.; Gatti, Carlo (May 2017). "उच्च दबाव पर हीलियम और सोडियम का एक स्थिर यौगिक". Nature Chemistry. 9 (5): 440–445. arXiv:1309.3827. Bibcode:2017NatCh...9..440D. doi:10.1038/nchem.2716. ISSN 1755-4349. PMID 28430195. S2CID 20459726.
- ↑ 14.0 14.1 Druffel, Daniel L.; Kuntz, Kaci L.; Woomer, Adam H.; Alcorn, Francis M.; Hu, Jun; Donley, Carrie L.; Warren, Scott C. (2016). "Experimental Demonstration of an Electride as a 2D Material". Journal of the American Chemical Society. 138 (49): 16089–16094. arXiv:1706.02774. doi:10.1021/jacs.6b10114. PMID 27960319. S2CID 19062953. Retrieved 12 October 2021.
- ↑ Druffel, Daniel L.; Woomer, Adam H.; Kuntz, Kaci L.; Pawlik, Jacob T.; Warren, Scott C. (2017). "Electrons on the surface of 2D materials: from layered electrides to 2D electrenes". Journal of Materials Chemistry C. 5 (43): 11196–11213. doi:10.1039/C7TC02488F. Retrieved 11 October 2021.
अग्रिम पठन
- J. L. Dye; M. J. Wagner; G. Overney; R. H. Huang; T. F. Nagy; D. Tománek (1996). "Cavities and Channels in Electrides". J. Am. Chem. Soc. 118 (31): 7329–7336. doi:10.1021/ja960548z.
- JCTC