द्विध्रुवी विद्युत् रसायन: Difference between revisions
No edit summary |
m (Neeraja moved page द्विध्रुवी इलेक्ट्रोकैमिस्ट्री to द्विध्रुवी विद्युत् रसायन without leaving a redirect) |
(No difference)
| |
Revision as of 11:47, 6 October 2023
द्विध्रुवी विद्युत् रसायन विद्युत् रसायन में विद्युत क्षेत्रों में वस्तुओं के संचालन के ध्रुवीकरण पर आधारित एक घटना है। प्रायः यह ध्रुवीकरण कार्यद्रव्य के दो छोरों के बीच एक संभावित अंतर उत्पन्न करता है जो वस्तु के आकार से गुणा किए गए विद्युत क्षेत्र के मान के बराबर होता है। यदि यह संभावित अंतर पर्याप्त महत्वपूर्ण है, तो रेडॉक्स अभिक्रियाएं वस्तु के छोर पर उत्पन्न हो सकती हैं एक छोर पर ऑक्सीकरण दूसरे छोर पर अपचयन के साथ-साथ होगा।[1][2] Ph सूचक विलयन वाली वजन वाली नाव में प्लैटिनम तार से युक्त एक सरल प्रयोगात्मक सेटअप में, दो इलेक्ट्रोडों में 30 V वोल्टेज तार के एक छोर (कैथोड) पर जल के अपचयन और PH वृद्धि (OH गठन) का कारण बनेगा। और एनोडिक सिरे पर जल का ऑक्सीकरण और पीएच में कमी होती है। द्विध्रुवी इलेक्ट्रोड के ध्रुव भी स्वयं को लागू विद्युत क्षेत्र के साथ संरेखित करते हैं।[3]
बुनियादी बातें
जब एक विद्युत प्रवाहकीय इलेक्ट्रोड को सीधे कनेक्शन के बिना, एक ही विद्युत् अपघट्य में, एकविद्युत् रासायनिक सेल में एनोड और कैथोड के बीच पर्याप्त वोल्टेज के साथ रखा जाता है; इलेक्ट्रोड दोनों चरम पर एक साथ कैथोडिक और एनोडिक अभिक्रिया का अनुभव करेगा। इसका अर्थ यह है,कि प्रवाहकीय इलेक्ट्रोड द्विध्रुवी इलेक्ट्रोड (BPE) बन जाएगा; आयनिक रूप से प्रवाहकीय विद्युत् अपघट्य के संपर्क में एक विद्युत प्रवाहकीय सामग्री जिसका बिजली के साथ कोई सीधा इलेक्ट्रॉनिक संबंध नहीं है जो इसके दोनों सिरों (ध्रुवों) पर विद्युत् रासायनिक (अपचयन और ऑक्सीकरण) अभिक्रियाओं को बढ़ावा देता है; जिसका अर्थ है कि यह एक ही समय में कैथोड और एनोड है।[4][5] ऐसा इसके कारण होता है:
केस (A)
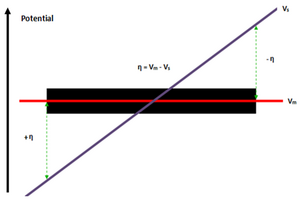
विद्युत प्रवाहकीय इलेक्ट्रोड (Vm) और विद्युत् अपघट्य (Vs) के बीच संभावित अंतर (η) एक संभावित ढाल का कारण बनता है जो बाद में BPE-इलेक्ट्रोलाइट इंटरफ़ेस में वितरित होता है, जिसमें एक चरम उच्चतम क्षमता (एनोड η) होता है और दूसरा चरम होता है सबसे कम क्षमता वाला (कैथोड -η)।[5] इलेक्ट्रोलाइट क्षमता (बनाम) ग्रेडिएंट/ड्रॉप की तुलना;।[5]इलेक्ट्रोड क्षमता (Vm) बीपीई ध्रुवों के बीच नहीं बदलती है, यह इलेक्ट्रोड की उच्च चालकता के कारण है जो कि अधिकांश स्टील मिश्र धातुओं के लिए 106 S/m से अधिक है, जबकि विलयन चालकता आयनीकृत जल के लिए 5.5 μS/m और समुद्री जल के लिए 5 S/m की सीमा में है।[5]
केस (B)
BPE में धारा प्रवाहित होता है क्योंकि यह विद्युत् अपघट्य की तुलना में कम प्रतिरोधी धारा पथ प्रदान करता है। जैसा कि चित्र में दिखाया गया है; एनोड से धारा (D/नीला) में प्रवेश करने के परिणामस्वरूप, पक्ष D कैथोडिक रूप से ध्रुवीकृत हो जाएगा (संभावना अधिक ऋणात्मक हो जाएगी)। दूसरी ओर, जिस तरफ (B/लाल) से धारा निकल रहा है, वह एनोडिक रूप से ध्रुवीकृत हो जाएगा (क्षमता अधिक धनात्मक हो जाएगी) और संक्षारित हो जाएगी। यह ध्रुवीकरण के कारण होता है जो वर्तमान दिशा के विपरीत होता है।[6] यह सिद्धांत लगभग सभी क्लासिकों में स्वीकृत है [7] और हाल की कैथोडिक सुरक्षा पुस्तकें,[8] और सामग्री संरक्षण और प्रदर्शन प्रकाशन और मानकों के लिए एसोसिएशन,[9] पाइपलाइनों और और विभिन्न संरचनाओं (उदाहरण के लिए कैथोडिक रूप से संरक्षित या) के बीच DC हस्तक्षेप के कारण होने वाले क्षरण और कोटिंग विघटन की व्याख्या के रूप में स्वीकार किया गया है। असुरक्षित संरचनाएं, रेलवे और HVDC)। ऐसा इसलिए क्योंकि यह अत्यधिक प्रतिरोधी, विषम वातावरण में बड़े पैमाने की संरचनाओं के लिए अधिक उपयुक्त है जहां विलयन क्षमता (Vs) कम महत्वपूर्ण भूमिका निभाती है और अभिक्रियाएँ मुख्य रूप से केवल ध्रुवों पर केंद्रित होती हैं (जहाँ विद्युत धारा प्रवेश करती है और निकल जाती है)।[7]
केस (C)
BPE के प्रत्येक ध्रुव पर संभावित अंतर (जो विद्युत रासायनिक अभिक्रियाओं के लिए पर्याप्त हो भी सकता है और नहीं भी)।[4]
ध्यान दें कि विलयन क्षमता सीधे किसी शक्ति स्रोत (जैसे पोटेंशियोस्टेट) द्वारा नियंत्रित नहीं होती है क्योंकि यह विलयन संरचना पर भी निर्भर करती है। इसलिए, विलयन में प्रजातियों को कम करने के लिए इलेक्ट्रॉनों को स्थानांतरित करने के लिए, कार्यशील इलेक्ट्रोड की क्षमता को विलयन में इलेक्ट्रोएक्टिव अणु की तुलना में अधिक ऋणात्मक मान पर सेट करने की आवश्यकता होती है,और फिर - गतिकी के आधार पर - इलेक्ट्रॉन स्थानांतरित हो सकते हैं। इसी प्रकार, ऑक्सीकरण अभिक्रियाएँ होती हैं।[4]इसके अतिरिक्त ओम के नियम के अनुसार, विद्युत क्षेत्र और विलयन क्षमता (Vs) बढ़ती विलयन की प्रतिरोधकता और बाहरी सर्किट पर लागू धारा के साथ बढ़ेगी।[6]
उपयोग
द्विध्रुवी विद्युत् रसायन की घटना 1970 के दशक से ज्ञात है[10]और उद्योग में कुछ इलेक्ट्रोलाइटिक रिएक्टरों में इसका उपयोग किया जाता है। इस अवधारणा के प्रति वैज्ञानिक समुदाय की रुचि काफी बढ़ गई है क्योंकि मार्टिन फ्लेशमैन और सहकर्मियों ने प्रदर्शित किया है कि माइक्रोमीटर आकार के द्विध्रुवी इलेक्ट्रोड का उपयोग करके जल का विभाजन संभव है।[11]हाल ही में, असममित सूक्ष्म और नैनो-संरचनाओं के संश्लेषण जैसे डोमेन में कई अनुप्रयोग[12][13] विश्लेषणात्मक रसायनशास्त्र[14][15][16] भौतिक विज्ञान,[17][18] माइक्रोइलेक्ट्रॉनिक् [19] और सूक्ष्म वस्तु प्रणोदन[20][21] विकसित किया गया है।
संदर्भ
- ↑ G. Loget; A. Kuhn (2011). "द्विध्रुवी इलेक्ट्रोकैमिस्ट्री का उपयोग करके सूक्ष्म और नैनोवर्ल्ड को आकार देना और उसकी खोज करना". Analytical and Bioanalytical Chemistry. 400 (6): 1691–704. doi:10.1007/s00216-011-4862-1. PMID 21455656. S2CID 44000438.
- ↑ F. Mavré; R. K. Anand; D. R. Laws; K.-F. Chow; B.-Y. Chang; J. A. Crooks; R. M. Crooks (2010). "Feature Bipolar Electrodes: A Useful Tool for Concentration, Separation, and Detection of Analytes in Microelectrochemical Systems". Anal. Chem. 82 (21): 8766–74. doi:10.1021/ac101262v. PMID 20815405.
- ↑ Fosdick, S. E.; Knust, K. N.; Scida, K.; Crooks, R. M. (2013). "द्विध्रुवी इलेक्ट्रोकैमिस्ट्री". Angew. Chem. Int. Ed. 52 (40): 10438–10456. doi:10.1002/anie.201300947. PMID 23843205.
- ↑ 4.0 4.1 4.2 Mavré, François; Anand, Robbyn K.; Laws, Derek R.; Chow, Kwok-Fan; Chang, Byoung-Yong; Crooks, John A.; Crooks, Richard M. (2010-09-03). "Bipolar Electrodes: A Useful Tool for Concentration, Separation, and Detection of Analytes in Microelectrochemical Systems". Analytical Chemistry. 82 (21): 8766–8774. doi:10.1021/ac101262v. ISSN 0003-2700.
- ↑ 5.0 5.1 5.2 Ulrich, Christian; Andersson, Olof; Nyholm, Leif; Björefors, Fredrik (2008-04-07). "द्विध्रुवी इलेक्ट्रोड पर आणविक ग्रेडियेंट का गठन". Angewandte Chemie. 120 (16): 3076–3078. doi:10.1002/ange.200705824. ISSN 0044-8249.
- ↑ 6.0 6.1 Abdalrhaman Saeed (2017). "Application of Bipolar Electrochemistry for Corrosion Screening of Type 420 Stainless Steel in Sodium Chloride Solution" (in English). doi:10.13140/RG.2.2.31999.71845.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ 7.0 7.1 Bohnes, H.; Richter, B. (1997), "Cathodic Protection of Ships", Handbook of Cathodic Corrosion Protection, Elsevier, pp. 391–414, retrieved 2023-02-12
- ↑ Ahmad, Zaki (2006), "CORROSION PREVENTION BY DESIGN", Principles of Corrosion Engineering and Corrosion Control, Elsevier, pp. 438–478, retrieved 2023-02-12
- ↑ Winston., Revie, R. (2011). उहलिग की संक्षारण पुस्तिका।. Wiley. ISBN 978-1-118-11003-4. OCLC 927504000.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Goodridge, F.; King, C. J. H.; Wright, A. R. (1977-04-01). "द्विध्रुवी पैक-बेड इलेक्ट्रोड का व्यवहार". Electrochimica Acta (in English). 22 (4): 347–352. doi:10.1016/0013-4686(77)85085-8. ISSN 0013-4686.
- ↑ M. Fleischmann; J. Ghoroghchian; D. Rolison; S. Pons (1986). "गोलाकार अल्ट्रामाइक्रोइलेक्ट्रोड के फैलाव का विद्युत रासायनिक व्यवहार". J. Phys. Chem. 90 (23): 6392. doi:10.1021/j100281a065. Archived from the original on September 23, 2017.
- ↑ G. Loget; V. Lapeyre; P. Garrigue; C. Warakulwit; J. Limtrakul; M.-H. Delville; A. Kuhn (2011). "जानूस-प्रकार की कार्बन ट्यूबों के संश्लेषण के लिए बहुमुखी प्रक्रिया". Chem. Mater. 23 (10): 2595. doi:10.1021/cm2001573.
- ↑ C. Warakulwit; T. Nguyen; J. Majimel; M.-H. Delville; V. Lapeyre; P. Garrigue; V.Ravaine; J. Limtrakul; A. Kuhn (2008). "द्विध्रुवी इलेक्ट्रोकैमिस्ट्री द्वारा असममित कार्बन नैनोट्यूब". Nano Lett. 8 (2): 500–4. Bibcode:2008NanoL...8..500W. doi:10.1021/nl072652s. PMID 18189438.
- ↑ K.-F. Chow; B.-Y. Chang; B. A. Zaccheo; F. Mavré; R. M. Crooks (2010). "एजी बाइपोलर इलेक्ट्रोड के इलेक्ट्रोडिसोल्यूशन पर आधारित एक सेंसिंग प्लेटफॉर्म". J. Am. Chem. Soc. 132 (27): 9228. doi:10.1021/ja103715u. PMID 20557051.
- ↑ Hlushkou D, Perdue RK, Dhopeshwarkar R, Crooks RM, Tallarek U (2009). "एम्बेडेड द्विध्रुवी इलेक्ट्रोड के साथ माइक्रोचैनल में ध्यान केंद्रित करने वाला विद्युत क्षेत्र ढाल". Lab Chip. 9 (13): 1903. doi:10.1039/b822404h. PMID 19532966.
- ↑ Ulrich C, Andersson O, Nyholm L, Björefors F (2009). "द्विध्रुवी पैटर्निंग के लिए इच्छित इलेक्ट्रोड पर संभावित और वर्तमान घनत्व वितरण". Anal. Chem. 81 (1): 453–459. doi:10.1021/ac801871c. PMID 19125451.
- ↑ Ramakrishnan S, Shannon C (2010). "द्विध्रुवी इलेक्ट्रोकैमिस्ट्री का उपयोग करके ठोस-अवस्था सामग्री का प्रदर्शन". Langmuir. 26 (7): 4602–4606. doi:10.1021/la100292u. PMID 20229995.
- ↑ Abdalrhaman Saeed (2017). "Application of Bipolar Electrochemistry for Corrosion Screening of Type 420 Stainless Steel in Sodium Chloride Solution" (in English). doi:10.13140/RG.2.2.31999.71845.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ J. C. Bradley; H. M. Chen; J. Crawford; J. Eckert; K. Ernazarova; T. Kurzeja; M. Lin; M. McGee; W. Nadler; S. G. Stephens (1997). "निर्देशित विद्युत रासायनिक वृद्धि का उपयोग करके धातु के कणों के बीच विद्युत संपर्क बनाना". Nature. 389 (6648): 268. Bibcode:1997Natur.389..268B. doi:10.1038/38464. S2CID 4329476.
- ↑ G. Loget; A. Kuhn (2010). "गतिशील द्विध्रुवी स्व-पुनर्जनन द्वारा सूक्ष्म वस्तुओं का प्रणोदन". J. Am. Chem. Soc. 132 (45): 15918–9. doi:10.1021/ja107644x. PMID 20964295.
- ↑ G. Loget; A. Kuhn (2011). "संचालन करने वाली वस्तुओं की विद्युत क्षेत्र-प्रेरित रासायनिक गति". Nature Communications. 2 (11): 535. Bibcode:2011NatCo...2E.535L. doi:10.1038/ncomms1550. PMID 22086336.