कैल्शियम हेक्साबोराइड: Difference between revisions
(→उपयोग) |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 102: | Line 102: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 25/04/2023]] | [[Category:Created On 25/04/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 15:45, 15 May 2023
| |
| Names | |
|---|---|
| IUPAC name
Calcium hexaboride
| |
| Other names
Calcium boride
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
| EC Number |
|
PubChem CID
|
|
| |
| |
| Properties | |
| CaB6 | |
| Molar mass | 104.94 g/mol |
| Appearance | black powder |
| Density | 2.45 g/cm3 |
| Melting point | 2,235 °C (4,055 °F; 2,508 K) |
| insoluble | |
| Structure | |
| Cubic | |
| Pm3m ; Oh[1] | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
कैल्शियम हेक्साबोराइड (कभी-कभी कैल्शियम बोराइड) रासायनिक सूत्र CaB6 के साथ कैल्शियम और बोरॉन का एक यौगिक है| इसकी उच्च विद्युत चालकता, कठोरता, रासायनिक स्थिरता और गलनांक के कारण यह महत्वपूर्ण सामग्री है। यह कम घनत्व वाला एक काला, चमकदार, रासायनिक रूप से अक्रिय पाउडर है। इसमें धातु हेक्साबोराइड्स के लिए विशिष्ट क्यूबिक संरचना है, जिसमें कैल्शियम परमाणुओं के साथ संयुक्त 6 बोरॉन परमाणुओं की ऑक्टाहेड्रल इकाइयां हैं।[2] CaB6 और लेण्टेनियुम-डोप्ड CaB6 दोनों कमजोर लोह चुंबकत्व गुण दिखाते हैं, जो उल्लेखनीय तथ्य है क्योंकि कैल्शियम और बोरोन न तो चुंबकीय होते हैं, न ही आंतरिक 3d या 4f इलेक्ट्रॉनिक कोश होते हैं, जो सामान्यतौर पर लौह चुंबकत्व के लिए आवश्यक होते हैं।
गुण
CaB6 अतिचालकता, वैलेंस अस्थिरता और कोंडो प्रभाव जैसे कई विचित्र भौतिक गुणों के कारण पहले जांच की गई है।[3] चूँकि, CaB6 की सबसे उल्लेखनीय गुण इसका लौह चुंबकत्व है। यह अप्रत्याशित रूप से उच्च तापमान (600 K) और कम चुंबकीय क्षण (0.07 बोह्र मैग्नेटॉन से नीचे प्रति परमाणु) पर होता है। इस उच्च तापमान लौह चुंबकत्व की उत्पत्ति एक तनु इलेक्ट्रॉन गैस का लौह चुम्बकीय चरण है, कैल्शियम बोराइड में प्रकल्पित उत्तेजित अवस्था से जुड़ाव, या प्रारूप की सतह पर बाहरी अशुद्धियाँ होती हैं। अशुद्धियों में लोहा और निकल सम्मिलित हो सकते हैं, संभव है की प्रारूप तैयार करने के लिए उपयोग किए जाने वाले बोरॉन में अशुद्धियों से आ रहे हैं। [4] CaB6 H2O में अघुलनशील है, MeOH (मेथनॉल), और EtOH (इथेनॉल) और एसिड में धीरे-धीरे घुल जाता है।[5] इसकी सूक्ष्म कठोरता 27 GPa है, नूप कठोरता 2600 kg/mm2), नया मॉड्यूलस 379 GPa है, और विद्युत प्रतिरोधकता 2·1010 Ω·m शुद्ध क्रिस्टल के लिए अत्यधिक है।[6][7]CaB6 1.0 eV अनुमानित ऊर्जा अंतराल वाला अर्धचालक है। कई CaB6 की निम्न, अर्ध-धात्विक चालकता प्रारूपों को अशुद्धियों और संभावित अस्टोइकोमेट्री (रशसमीकरणमिति) के कारण बिना जाने अपमिश्रण द्वारा समझाया जा सकता है।[8]
संरचनात्मक जानकारी
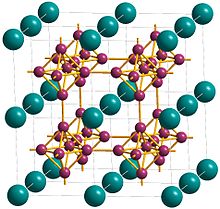
कैल्शियम हेक्साबोराइड की क्रिस्टल संरचना कोशिका केंद्र में कैल्शियम के साथ एक घन जाली है और त्रि-आयामी बोरॉन नेटवर्क देने के लिए B-B बंध द्वारा शीर्ष पर जुड़े बोरॉन परमाणुओं के सघन, नियमित ऑक्टाहेड्रा हैं।[5]प्रत्येक कैल्शियम में 24 निकटतम-समूह बोरॉन परमाणु होते हैं[1] कैल्शियम परमाणुओं को सरल घन बंधन में व्यवस्थित किया जाता है जिससे कि घन के शीर्ष पर स्थित आठ कैल्शियम परमाणुओं के समूह के बीच छिद्र हो।[9] सरल घन संरचना का विस्तार ऑक्टाहेड्रल B6 की प्रारम्भ से होता है समूह और संरचना कैल्शियम और हेक्साबोराइड समूहों की CsCl जैसी बंध है।[9]कैल्शियम हेक्साबोराइड का वर्णन करने का एक अन्य तरीका धातु और B62− होने के रूप में है | CsCl-प्रकार की संरचना में ऑक्टाहेड्रल पॉलीमेरिक आयन जहां कैल्शियम परमाणु Cs समूहों और B6 सीएल समूहों में ऑक्टाहेड्रा संगृहीत कर लेता है।[10] Ca-B बंध की लंबाई 3.05 Å और B-B बंध की लंबाई 1.7 Å है।[9]
43Ca NMR डेटा में δpeak -56.0 होता है ppm और δiso -41.3 ppm पर जहां δiso शिखर अधिकतम +0.85 चौड़ाई के रूप में लिया जाता है, ऋणात्मक बदलाव उच्च समन्वय संख्या के कारण होता है।[10]
रमन डेटा: कैल्शियम हेक्साबोराइड में 754.3, 1121.8, और 1246.9 cm-1 सक्रिय मोड A1g, Eg, और T2g क्रमश पर तीन रमन शिखर हैं।[1]
देखे गए कंपन की आवृत्ति cm−1: A1g से 1270 (मजबूत) तनाव, 1154 (मध्य) और 1125 (आधार) Eg से तनाव, 526, 520, 485, और F1g से 470 से घूर्णन, F1g से 775 (मजबूत) और 762 (आधार) बंध, F1u से 1125 (मजबूत) और 1095 (कमजोर) बंध, F1u से 330 और 250 अनुवाद, और 880 (मध्य) F2u से और 779 बंध होता है।[1]
तैयारी
- औद्योगिक उत्पादन के लिए मुख्य प्रतिक्रियाओं में से एक है:[6]
- CaO + 3 B2O3 + 10 Mg → CaB6 + 10 MgO
CaB6 के उत्पादन में अन्य तरीके पाउडर में सम्मिलित हैं:
- 1000°C पर कैल्शियम या कैल्शियम ऑक्साइड और बोरॉन की सीधी प्रतिक्रिया है;
- Ca + 6 B → CaB6
- Ca(OH)2 लगभग 1700 °C (उष्मीय कार्बन में कमी) पर निर्वात में बोरॉन के साथ;[11]: Ca (OH)2 +7B → CaB6 + BO (g) + H2O (g) कि प्रतिक्रिया है।
- 1400 1700 °C (उष्मीय कार्बन में कमी) से ऊपर वैक्यूम में बोरान कार्बाइड के साथ कैल्शियम कार्बोनेट की प्रतिक्रिया है |
- CaO और H3BO3 और मिली ग्राम से 1100 °C कि प्रतिक्रिया है| [5]
- कम तापमान (500°C) संश्लेषण
- CaCl2 + 6NaBH4 → CaB6 + 2NaCl + 12H2 + 4Na
अपेक्षाकृत खराब गुणवत्ता वाली सामग्री का परिणाम है।[12]
- शुद्ध CaB6 का उत्पादन करने के लिए एकल क्रिस्टल, उदाहरण के लिए, कैथोड सामग्री के रूप में उपयोग के लिए, इस प्रकार CaB6 प्राप्त किया पाउडर को फिर से क्रिस्टलीकृत किया जाता है और गलन क्षेत्र तकनीक से शुद्ध किया जाता है। सामान्य वृद्धि दर 30 से cm/h और जालक का आकार ~1x10 cm है।[11]
- एकल-जालक CaB6 नैनोवायर्स (व्यास 15-40 nm, लंबाई 1-10 माइक्रोमीटर) द्वी बोरेन (B2H6) Ni उत्प्रेरक की उपस्थिति में 860–900 °C पर कैल्शियम ऑक्साइड (CaO) पाउडर पर तापीय अपघटन द्वारा प्राप्त किया जा सकता है।[7]
उपयोग
कैल्शियम हेक्साबोराइड का उपयोग बोरॉन-मिश्र धातु इस्पात के निर्माण में किया जाता है[5]और ऑक्सीजन रहित तांबे के उत्पादन में वी आक्सीकरण एजेंट के रूप में किया जाता है। तांबे में बोरॉन की कम विलेयता के कारण परमाणु रहित रूप से फॉस्फोरस-वी आक्सीकृत तांबे की तुलना में बाद में उच्च चालकता होती है।[6]CaB6 एक उच्च तापमान सामग्री, सतह संरक्षण, अपघर्षक, उपकरण और प्रतिरोधी सामग्री धारण करने के रूप में भी काम कर सकता है।
CaB6 अत्यधिक प्रवाहकीय है, कम कार्य करता है, और इस प्रकार इसे गर्म कैथोड सामग्री के रूप में उपयोग किया जा सकता है। जब ऊंचे तापमान पर उपयोग किया जाता है, तो कैल्शियम हेक्साबोराइड इसके गुणों को कम करके ऑक्सीकरण करेगा और इसके उपयोगी जीवनकाल को छोटा कर देगा।[13]CaB6 n-प्रकार ताप विद्युत सामग्री के लिए भी एक आशाजनक प्रतिभागी है, क्योंकि इसकी शक्ति का कारक BiTe3 और PbTe सामान्य विद्युत ताप सामग्रियों की तुलना में बड़ा या तुलनीय है।
CaB का उपयोग उच्च तापीय कार्बन बंधन में अआक्सीकृत के रूप में भी किया जा सकता है।
सावधानियां
कैल्शियम हेक्साबोराइड आंखों, त्वचा और श्वसन प्रणाली को हानि पहुँचाता है। इस उत्पाद को उचित सुरक्षात्मक चश्मा और कपड़ों के साथ संभाला जाना चाहिए। कैल्शियम हेक्साबोराइड को कभी भी नाली में न डालें और न ही उसमे पानी में डालना चाहिए।
यह भी देखें
- बोराइड
- कैल्शियम
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 Yahia, S.; Turrell, S.; Turrell, G.; Mercurio, J. P. (1990). "Infrared and Raman spectra of hexaborides: force-field calculations, and isotopic effects". J. Mol. Struct. 224 (1–2): 303–312. Bibcode:1990JMoSt.224..303Y. doi:10.1016/0022-2860(90)87025-S.
- ↑ Matkovich, V. I. (1977). बोरॉन और आग रोक बोराइड्स. Berlin: Springer-Verlag. ISBN 0-387-08181-X.
- ↑ J. Etourneau; P. Hagenmuller (1985). "दुर्लभ-पृथ्वी बोराइड्स की संरचना और भौतिक विशेषताएं". Philos. Mag. B. 52 (3): 589. Bibcode:1985PMagB..52..589E. doi:10.1080/13642818508240625..
- ↑ Young, D. P.; et al. (1999). "कम घनत्व वाली मुक्त-इलेक्ट्रॉन गैस में उच्च तापमान कमजोर फेरोमैग्नेटिज्म". Nature. 397 (6718): 412–414. Bibcode:1999Natur.397..412Y. doi:10.1038/17081. PMID 29667965. S2CID 204991033.
- ↑ 5.0 5.1 5.2 5.3 "Calcium boride – Dictionary of Inorganic Compounds". University Press. Cambridge. 1. 1992.
- ↑ 6.0 6.1 6.2 "Borides: Solid State Chemistry". अकार्बनिक रसायन विज्ञान का विश्वकोश. Vol. 1. West Sussex, England: John Wiley & Sons. 1994.
- ↑ 7.0 7.1 Terry T. Xu; Jian-Guo Zheng; Alan W. Nicholls; Sasha Stankovich; Richard D. Piner; Rodney S. Ruoff (2004). "Single-Crystal Calcium Hexaboride Nanowires: Synthesis and Characterization". Nano Lett. 4 (10): 2051–2055. Bibcode:2004NanoL...4.2051X. doi:10.1021/nl0486620.
- ↑ S. Souma; et al. (2003). "Electronic Band Structure and Fermi Surface of CaB6 Studied by Angle-Resolved Photoemission Spectroscopy". Phys. Rev. Lett. 90 (2): 027202. Bibcode:2003PhRvL..90b7202S. doi:10.1103/PhysRevLett.90.027202. PMID 12570575.
- ↑ 9.0 9.1 9.2 Wells, A. F. (1984). संरचनात्मक अकार्बनिक रसायन. Oxford: Clarendon Press. pp. 1055–1056. ISBN 0-19-855125-8.
- ↑ 10.0 10.1 Zhongijie, L.; Smith, M. E.; Sowrey, F. E.; Newport, R. J. (2004). "Probing the local structural environment of calcium by natural-abundance solid-state 43Ca NMR" (PDF). Physical Review B. 69 (22): 224107. Bibcode:2004PhRvB..69v4107L. doi:10.1103/PhysRevB.69.224107.
- ↑ 11.0 11.1 S. Otani (1998). "Preparation of CaB6 crystals by the floating zone method". Journal of Crystal Growth. 192 (1–2): 346–349. Bibcode:1998JCrGr.192..346O. doi:10.1016/S0022-0248(98)00444-8.
- ↑ Shi, L.; et al. (2003). "Low Temperature Synthesis and Characterization of Cubic CaB6 Ultrafine Powders". Chem. Lett. 32 (10): 958. doi:10.1246/cl.2003.958.
- ↑ Zhigang R. Li; Hong Meng (2006). कार्बनिक प्रकाश उत्सर्जक सामग्री और उपकरण. CRC Press. p. 516. ISBN 1-57444-574-X.
अग्रिम पठन
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.