चौगुना बंधन: Difference between revisions
No edit summary |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 57: | Line 57: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 18/05/2023]] | [[Category:Created On 18/05/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 12:08, 2 June 2023
चतुष्क बंध आठ इलेक्ट्रॉनों वाले दो परमाणुओं के बीच एक प्रकार का रासायनिक आबंध है। यह बंध अधिक परिचित प्रकार के द्वि-आबंध और त्रि-आबंध का विस्तार है।[1] रेनियम, टंगस्टन, टेक्नेटियम, मोलिब्डेनम और क्रोमियम जैसे d-ब्लॉक के मध्य में संक्रमण धातुओं में स्थिर चतुष्क-आबंध सबसे सामान्य हैं। सामान्य रूप से चतुष्क-आबंध का समर्थन करने वाले लिगेंड π-प्रदाता, π-स्वीकर्ता नहीं होते हैं।
इतिहास
क्रोमियम (II) एसीटेट, Cr2(μ-O2CCH3)4(H2O)2, पहला रासायनिक यौगिक था जिसमें संश्लेषित होने वाला चतुष्क-आबंध था। इसका वर्णन 1844 में ई पेलिगोट द्वारा किया गया था, हालांकि इसके विशिष्ट आबंध को एक शताब्दी से अधिक समय तक पहचाना नहीं गया था।[2]
Re
2Cl2−
8 के लवण के लिए सोवियत रसायनज्ञों द्वारा चतुष्क-आबंध वाले यौगिक का पहला क्रिस्टल-संरचनात्मक अध्ययन प्रदान किया गया था। [3] बहुत कम Re–Re दूरी नोट की गई थी। इस छोटी दूरी (और लवण का प्रतिचुंबकत्व) ने Re–Re आबंध का संकेत दिया। हालांकि इन शोधकर्ताओं ने ऋणायन को पुनः (II),अर्थात, Re
2Cl4−
8 के यौगिक के रूप में गलत रूप से प्रस्तुत किया
इसके तुरंत बाद, एफ. अल्बर्ट कॉटन और सी.बी. हैरिस ने पोटेशियम ऑक्टाक्लोरोडिरहेनेट या K2[Re2Cl8]·2H2O की क्रिस्टल संरचना की सूचना दी।[4] इस संरचनात्मक विश्लेषण ने संकेत दिया कि पूर्व लक्षण वर्णन गलत था। कॉटन और हैरिस ने आबंध के लिए एक आणविक कक्षीय औचित्य तैयार किया जो स्पष्ट रूप से चतुष्क आबंध का संकेत देता है।[2] इस यौगिक में रेनियम-रेनियम आबंध की लंबाई केवल 224 पिकोमीटर है। आणविक कक्षीय सिद्धांत में, आबंध को σ2π4δ2 के रूप में वर्णित किया गया है जिसमें एक सिग्मा आबंध, दो पाई आबन्ध और एक डेल्टा आबंध है।
संरचना और संबंध
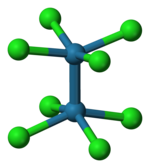
[Re2Cl8]2− आयन एक ग्रहणित रचना को स्वीकृति है जैसा कि बाईं ओर दिखाया गया है। डेल्टा आबन्ध ऑर्बिटल तब प्रत्येक रेनियम परमाणु पर d कक्षीय के अतिव्याप्त द्वारा बनता है, जो Re-Re अक्ष के लंबवत होते हैं और Re-Cl आबन्ध के बीच में स्थित होते हैं। Re-Cl आबन्ध के साथ निर्देशित d कक्षीय क्लोरीन लिगैंड कक्षीय के साथ परस्पर क्रिया द्वारा स्थिर होते हैं और Re-Re आबन्ध में योगदान नहीं करते हैं।[5] इसके विपरीत, [Os2Cl8]2− आयन दो और इलेक्ट्रॉनों (σ2π4δ2δ*2) के साथ एक Os-Os त्रिक आबन्ध और कंपित ज्यामिति है।[6]
संक्रमण धातु परमाणुओं के बीच चतुष्क बंध वाले कई अन्य यौगिकों का वर्णन प्रायः कपास और उनके सहकर्मियों द्वारा किया गया है। डायरेनियम यौगिक के साथ आइसोइलेक्ट्रॉनिक लवण K4[Mo2Cl8] (पोटेशियम ऑक्टाक्लोरोडिमोलीबडेट) है।[7] चतुष्क बंध के साथ एक डिटुंगस्टन यौगिक का एक उदाहरण डिटुंगस्टन टेट्रा (एचपीपी) है।
मुख्य-समूह तत्व के परमाणुओं के बीच चतुष्क बंध अज्ञात हैं। आणविक कक्षीय सिद्धांत से पता चलता है कि सिग्मा प्रणाली (एक आबंध, एक प्रति-आबंधन) में युग्मित इलेक्ट्रॉनों के दो समूह होते हैं, और युग्मित इलेक्ट्रॉनों के दो समूह कक्षीय के पतित π-आबन्ध समूह में होते हैं। यह 2 का आबंध क्रम देने के लिए जोड़ता है, जिसका अर्थ है कि डाइकार्बन अणु (C2) में दो कार्बन परमाणुओं के बीच एक दोहरा आबंध सम्मिलित है। द्वि-परमाणुक कार्बन के आणविक कक्षीय आरेख से पता चलता है कि दो पाई आबन्ध हैं और सिग्मा आबन्ध नहीं हैं। हालाँकि, एस शैक एट अल द्वारा हाल ही में एक पत्र। मे सुझाव दिया है कि द्वि-परमाणुक कार्बन में एक चतुष्क आबंध सम्मिलित है,[8] लेकिन यह विवादित है।[9]
यह भी देखें
- सहसंयोजक आबंध
- अनुबंध क्रम
संदर्भ
- ↑ Radius, U.; Breher, F. (2006). "'To Boldly Pass the Metal–Metal Quadruple Bond". Angew. Chem. Int. Ed. 45 (19): 3006–3010. doi:10.1002/anie.200504322.
- ↑ 2.0 2.1 Cotton, F. A.; Walton, R. A. (1993). धातु परमाणुओं के बीच एकाधिक बंधन. Oxford: Oxford University Press. ISBN 0-19-855649-7.
- ↑ Kuznetsov, V. G.; Koz'min, P. A. "The structure of (pyH)HReCl4" Zhurnal Strukturnoi Khimii 1963, 4, 55-62.
- ↑ Cotton, F. A.; Harris, C. B. (1965). "The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O". Inorg. Chem. 4 (3): 330–333. doi:10.1021/ic50025a015.
- ↑ Miessler, G. L.; Tarr, D. A. (1999). अकार्बनिक रसायन शास्त्र (2nd ed.). Prentice-Hall. p. 531. ISBN 0-13-841891-8.
- ↑ Miessler, G. L.; Tarr, D. A. (1999). Inorganic Chemistry (2nd ed.). Prentice-Hall. p. 531. ISBN 0-13-841891-8.
- ↑ Girolami, G. S.; Rauchfuss, T. B.; Angelici, R. J. (1999). अकार्बनिक रसायन विज्ञान में संश्लेषण और तकनीक. Mill Valley, CA: University Science Books. ISBN 0935702482.
- ↑ Shaik, Sason; Danovich, David; Wu, Wei; Su, Peifeng; Rzepa, Henry S.; Hiberty, Philippe C. (2012). "Quadruple bonding in C2 and analogous eight-valence electron species". Nature Chemistry. 4: 195–200. Bibcode:2012NatCh...4..195S. doi:10.1038/nchem.1263.
- ↑ Grunenberg, Jörg (2012). "Quantum chemistry: Quadruply bonded carbon". Nature Chemistry. 4 (3): 154–155. Bibcode:2012NatCh...4..154G. doi:10.1038/nchem.1274. PMID 22354425.
अग्रिम पठन
- Cotton, F. A.; Harris, C. B. (1965). "The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O". Inorg. Chem. 4 (3): 330–333. doi:10.1021/ic50025a015.