हाइपोनाइट्रस एसिड: Difference between revisions
(Created page with "{{Chembox | Watchedfields= changed | ImageFile = Hyponitrous acid trans.svg | ImageSize = 250 | ImageFileL1 = Hyponitrous acid Ball and Stick (Tautomer 1).png | ImageFileR1 =...") |
No edit summary |
||
| Line 34: | Line 34: | ||
| AutoignitionPt = }} | | AutoignitionPt = }} | ||
}} | }} | ||
हाइपोनाइट्रस | हाइपोनाइट्रस अम्ल सूत्र H<sub>2</sub>N<sub>2</sub>O<sub>2</sub> या HON = NOH के साथ एक रासायनिक यौगिक है। यह नाइट्रामाइड का एक समभारी है, H<sub>2</sub>N−NO<sub>2</sub>; और अज़ानोन, HNO का एक औपचारिक द्वितय है।। | ||
हाइपोनाइट्रस | हाइपोनाइट्रस अम्ल लवणों की दो श्रृंखलाएँ बनाता है, हाइपोनाइट्राइट्स जिसमें [ON=NO]2- ऋणायन होता है, और "अम्ल हाइपोनाइट्राइट्स" जिसमें [HON=NO]- ऋणायन होता है।<ref name = "Wiberg&Holleman"/> | ||
=== संरचना और गुण === | |||
हाइपोनाइट्रस अम्ल, ट्रांस और सिस की दो संभावित संरचनाएं हैं। ट्रांस-हाइपोनाइट्रस अम्ल सफेद क्रिस्टल बनाता है जो सूखने पर विस्फोटक होता है। जलीय घोल में, यह एक दुर्बल अम्ल (pKa1 = 7.21, pKa2 = 11.54) है, और नाइट्रस ऑक्साइड और जल को 16 दिनों के आधे जीवन के साथ 25 ° C पर pH 1–3 पर विघटित करता है: | |||
== संरचना और गुण == | |||
हाइपोनाइट्रस | |||
:{{chem|H|2|N|2|O|2}} → {{chem|H|2|O}} + {{chem|N|2|O}} | :{{chem|H|2|N|2|O|2}} → {{chem|H|2|O}} + {{chem|N|2|O}} | ||
चूँकि यह अभिक्रिया उत्क्रमणीय नहीं है,अतः N<sub>2</sub>O को H<sub>2</sub>N<sub>2</sub>O<sub>2</sub> का एनहाइड्राइड नहीं माना जाना चाहिए.<ref name = "Wiberg&Holleman">{{cite book|first1=Egon |last1=Wiberg |first2=Arnold Frederick |last2=Holleman |date=2001 |title=अकार्बनिक रसायन शास्त्र|publisher=Elsevier |isbn=0-12-352651-5}}</ref>,सिस अम्ल ज्ञात नहीं है<ref name="Wiberg&Holleman"/>लेकिन इसका सोडियम लवण प्राप्त किया जा सकता है।<ref name="InorgChem" /> | |||
=== तैयारी === | |||
हाइपोनाइट्रस अम्ल (ट्रांस) चांदी (आई) हाइपोनाइट्राइट और ईथर में निर्जल HCl से तैयार किया जा सकता है: | |||
:{{chem|Ag|2|N|2|O|2}} + 2 HCl → {{chem|H|2|N|2|O|2}} + 2 AgCl | |||
== तैयारी == | स्पेक्ट्रोस्कोपिक डेटा परिणामी अम्ल के लिए एक ट्रांस समाकृति का संकेत देते हैं।<ref name="InorgChem">{{cite book | title = अकार्बनिक रसायन शास्त्र| url = https://archive.org/details/inorganicchemist00hous_159 | url-access = limited | edition = 3rd | chapter = Chapter 15: The group 15 elements | author1 = Catherine E. Housecroft | author2 = Alan G. Sharpe| publisher = Pearson | year = 2008 | isbn = 978-0-13-175553-6 | page = [https://archive.org/details/inorganicchemist00hous_159/page/n506 468]}}</ref> | ||
<br />इसे हाइड्रॉक्सिलामाइन और नाइट्रस अम्ल से भी संश्लेषित किया जा सकता है: | |||
:{{chem|Ag|2|N|2|O|2}} + 2 | |||
स्पेक्ट्रोस्कोपिक डेटा परिणामी | |||
<br/> | |||
इसे | |||
:{{chem|N|H|2|O|H}} + {{chem|H|N|O|2}} → {{chem|H|2|N|2|O|2}} + {{chem|H|2|O}} | :{{chem|N|H|2|O|H}} + {{chem|H|N|O|2}} → {{chem|H|2|N|2|O|2}} + {{chem|H|2|O}} | ||
== जैविक पहलू == | === जैविक पहलू === | ||
एंजाइमोलॉजी में, हाइपोनाइट्राइट रिडक्टेस एक एंजाइम है जो रासायनिक अभिक्रिया को उत्प्रेरित करता है<ref>{{Cite web|url=http://enzyme.expasy.org/EC/1.7.1.5|title = ENZYME - 1.7.1.5 Hyponitrite reductase}}</ref> | |||
: | :H<sub>2</sub>N<sub>2</sub>O<sub>2</sub> + 2 NADH + 2 H<sup>+</sup> ↔ 2 NH<sub>2</sub>OH + 2 NAD<sup>+</sup> | ||
==संदर्भ== | ===संदर्भ=== | ||
{{reflist}} | {{reflist}} | ||
Revision as of 12:54, 28 May 2023
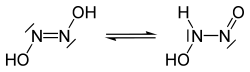
| |||
|
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
Diazenediol | |||
| Systematic IUPAC name
N-(Hydroxyimino)hydroxylamine | |||
| Other names
Hyponitrous acid dimer
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| ChEBI | |||
| ChemSpider | |||
| 141300 | |||
| KEGG | |||
PubChem CID
|
|||
| |||
| |||
| Properties | |||
| H2N2O2 | |||
| Molar mass | 62.0282 g/mol | ||
| Appearance | white crystals | ||
| Conjugate base | Hyponitrite | ||
| Hazards | |||
| Occupational safety and health (OHS/OSH): | |||
Main hazards
|
explosive when dry | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
हाइपोनाइट्रस अम्ल सूत्र H2N2O2 या HON = NOH के साथ एक रासायनिक यौगिक है। यह नाइट्रामाइड का एक समभारी है, H2N−NO2; और अज़ानोन, HNO का एक औपचारिक द्वितय है।।
हाइपोनाइट्रस अम्ल लवणों की दो श्रृंखलाएँ बनाता है, हाइपोनाइट्राइट्स जिसमें [ON=NO]2- ऋणायन होता है, और "अम्ल हाइपोनाइट्राइट्स" जिसमें [HON=NO]- ऋणायन होता है।[1]
संरचना और गुण
हाइपोनाइट्रस अम्ल, ट्रांस और सिस की दो संभावित संरचनाएं हैं। ट्रांस-हाइपोनाइट्रस अम्ल सफेद क्रिस्टल बनाता है जो सूखने पर विस्फोटक होता है। जलीय घोल में, यह एक दुर्बल अम्ल (pKa1 = 7.21, pKa2 = 11.54) है, और नाइट्रस ऑक्साइड और जल को 16 दिनों के आधे जीवन के साथ 25 ° C पर pH 1–3 पर विघटित करता है:
- H
2N
2O
2 → H
2O + N
2O
चूँकि यह अभिक्रिया उत्क्रमणीय नहीं है,अतः N2O को H2N2O2 का एनहाइड्राइड नहीं माना जाना चाहिए.[1],सिस अम्ल ज्ञात नहीं है[1]लेकिन इसका सोडियम लवण प्राप्त किया जा सकता है।[2]
तैयारी
हाइपोनाइट्रस अम्ल (ट्रांस) चांदी (आई) हाइपोनाइट्राइट और ईथर में निर्जल HCl से तैयार किया जा सकता है:
- Ag
2N
2O
2 + 2 HCl → H
2N
2O
2 + 2 AgCl
स्पेक्ट्रोस्कोपिक डेटा परिणामी अम्ल के लिए एक ट्रांस समाकृति का संकेत देते हैं।[2]
इसे हाइड्रॉक्सिलामाइन और नाइट्रस अम्ल से भी संश्लेषित किया जा सकता है:
- NH
2OH + HNO
2 → H
2N
2O
2 + H
2O
जैविक पहलू
एंजाइमोलॉजी में, हाइपोनाइट्राइट रिडक्टेस एक एंजाइम है जो रासायनिक अभिक्रिया को उत्प्रेरित करता है[3]
- H2N2O2 + 2 NADH + 2 H+ ↔ 2 NH2OH + 2 NAD+
संदर्भ
- ↑ 1.0 1.1 1.2 Wiberg, Egon; Holleman, Arnold Frederick (2001). अकार्बनिक रसायन शास्त्र. Elsevier. ISBN 0-12-352651-5.
- ↑ 2.0 2.1 Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". अकार्बनिक रसायन शास्त्र (3rd ed.). Pearson. p. 468. ISBN 978-0-13-175553-6.
- ↑ "ENZYME - 1.7.1.5 Hyponitrite reductase".

