ट्राइमर: Difference between revisions
No edit summary |
m (Abhishek moved page ट्रिमर (रसायन विज्ञान) to ट्राइमर without leaving a redirect) |
(No difference)
| |
Revision as of 17:33, 30 June 2023
रसायन विज्ञान में, एक ट्राइमर (प्राचीन ग्रीक त्रि- 'तीन', और -मेर 'भागों' से) एक अणु या बहुपरमाणुक आयन है जो एक ही पदार्थ के तीन अणुओं या आयनों के संयोजन से बनता है। तकनीकी शब्दजाल में, एक ट्राइमर एक प्रकार का ऑलिगोमर है जो प्रायः बहुलकीकरण के साथ प्रतिस्पर्धा में तीन समान पूर्ववर्तियों से प्राप्त होता है। रसायन विज्ञान में, एक ट्राइमर एक अणु या बहुपरमाणुक आयन है जो एक ही पदार्थ के तीन अणुओं या आयनों के संयोजन या संयोजन से बनता है।
उदाहरण
एल्काइन त्रितयन
त्रितयन चक्रीकरण अभिक्रिया को इस योजना से समझा जा सकता है।
1866 में, मार्सेलिन बर्थेलॉट ने साइक्लोट्रिमराइजेशन का पहला उदाहरण एसिटिलीन का बेंजीन में रूपांतरण बताया।[1] इस प्रक्रिया का व्यावसायीकरण किया गया था:
नाइट्राइल त्रितयन
सममित 1,3,5-ट्राईज़ीन कुछ नाइट्राइल जैसे सायनोजेन क्लोराइड या साइनीमाइड के त्रितयन द्वारा तैयार किए जाते हैं।
सायनोजेन क्लोराइड और सायनोजेन ब्रोमाइड प्रत्येक कार्बन उत्प्रेरक के ऊपर ऊंचे तापमान पर त्रितय करते हैं।[1]क्लोराइड सायन्यूरिक क्लोराइड देता है:
 प्रशीतित होने पर ब्रोमाइड का अचल जीवन लम्बा हो जाता है। क्लोराइड की तरह, यह सायन्यूरिक ब्रोमाइड बनाने के लिए ऊष्माशोषी त्रितयन से गुजरता है। यह अभिक्रिया ब्रोमीन, धातु लवण, अम्ल और क्षार के अंशों द्वारा उत्प्रेरित होती है।[2] इस कारण से,ये प्रयोगवादी भूरे रंग के नमूनों से बचते हैं।
प्रशीतित होने पर ब्रोमाइड का अचल जीवन लम्बा हो जाता है। क्लोराइड की तरह, यह सायन्यूरिक ब्रोमाइड बनाने के लिए ऊष्माशोषी त्रितयन से गुजरता है। यह अभिक्रिया ब्रोमीन, धातु लवण, अम्ल और क्षार के अंशों द्वारा उत्प्रेरित होती है।[2] इस कारण से,ये प्रयोगवादी भूरे रंग के नमूनों से बचते हैं।सायन्यूरिक अम्ल के लिए एक औद्योगिक मार्ग में अमोनिया की रिहाई के साथ यूरिया का उष्मीय अपघटन सम्मिलित है। इसका रूपांतरण लगभग 175 डिग्री सेल्सियस पर शुरू होता है:[3]
मेलामाइन के ऊष्माशोषी संश्लेषण को दो चरणों में समझा जा सकता है।
फिर दूसरे चरण में, सायनिक अम्ल बहुलीकृत होकर सायन्यूरिक अम्ल बनाता है, जो पहले चरण से मुक्त अमोनिया के साथ संघनित होकर मेलामाइन और जल छोड़ता है।
यह जल उपस्थित सायनिक अम्ल के साथ अभिक्रिया करता है, जो त्रितयन अभिक्रिया को चलाने में सहायता करता है, जिससे कार्बन डाइऑक्साइड और अमोनिया उत्पन्न होता है।
कुल मिलाकर, दूसरा चरण ऊष्माक्षेपी है:
लेकिन समग्र प्रक्रिया ऊष्माशोषी है।
डायन त्रितयन
साइक्लोडोडेकेट्रिएन का 1,5,9-ट्रांस-ट्रांस-सीस समावयव, जिसका कुछ औद्योगिक महत्व है, टाइटेनियम टेट्राक्लोराइड और एक कार्बनिक एल्यूमिनियम सह-उत्प्रेरक के साथ ब्यूटाडीन के साइक्लोत्रितयन द्वारा प्राप्त किया जाता है:[4]
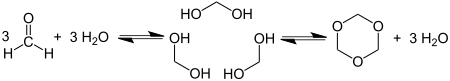
कार्बन-हेटरो दोहरे बंधन को तोड़ने से सममित संतृप्त 1,3,5-हेटरोसायकल बनता है:फॉर्मेल्डिहाइड का साइक्लोत्रितयन 1,3,5-ट्रायोक्सेन प्रदान करता है:
 1,3,5-ट्रिथिएन अन्यथा अस्थिर प्रजाति थायोफॉर्मेल्डिहाइड का चक्रीय त्रितय है। इस हेटरोसायकल में बारी-बारी से मेथिलीन सेतु और थायोथर समूहों के साथ छह-सदस्यीय रिंग होती है। इसे हाइड्रोजन सल्फाइड के साथ फॉर्मेल्डिहाइड की अभिक्रिया द्वारा तैयार किया जाता है।[5]
1,3,5-ट्रिथिएन अन्यथा अस्थिर प्रजाति थायोफॉर्मेल्डिहाइड का चक्रीय त्रितय है। इस हेटरोसायकल में बारी-बारी से मेथिलीन सेतु और थायोथर समूहों के साथ छह-सदस्यीय रिंग होती है। इसे हाइड्रोजन सल्फाइड के साथ फॉर्मेल्डिहाइड की अभिक्रिया द्वारा तैयार किया जाता है।[5]
एसीटैल्डिहाइड के तीन अणु संघनित होकर पैराल्डिहाइड बनाते हैं, एक चक्रीय त्रितय जिसमें C - O एकल बंधन होता है।
सल्फ्यूरिक अम्ल द्वारा उत्प्रेरित और निर्जलीकरण, एल्डोल संघनन के माध्यम से एसीटोन का त्रितयन कराने पर यह मेसिटिलीन प्रदान करता है[6]
ट्राईसिलोक्सेन
डाइमिथाइलसिलानेडियोल Me2SiO के साथ-साथ पॉलीडिमिथाइलसिलोक्सेन के एक त्रितय को निर्जलित करता है। अभिक्रिया त्रितयन और बहुलकीकरण के बीच प्रतिस्पर्धा को दर्शाती है। बहुलक और त्रितय औपचारिक रूप से काल्पनिक सिला-कीटोन Me2Si=O से प्राप्त होते हैं, यद्यपि यह प्रजाति मध्यवर्ती नहीं है।
समन्वय रसायन
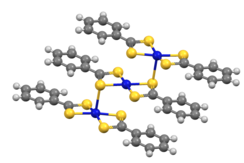
डाइथियोबेंजोएट परिसर [M(S2CPh)2] त्रितय(M = Ni, Pd) के रूप में क्रिस्टलीकृत होते हैं।[7]
यह भी देखें
- ओलिगोमर
- प्रोटीन ट्राइमर
संदर्भ
- ↑ 1.0 1.1 Hillis O. Folkins (2005). "Benzene". Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_475. ISBN 3527306730.
- ↑ {{cite book|last1=Morris|first1=Joel|title=कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश|last2=Kovács|first2=Lajos|last3=Ohe|first3=Kouichi|chapter=Cyanogen Bromide|year=2015|pages=1–8|doi=10.1002/047084289X.rc269.pub3|isbn=9780470842898}
- ↑ Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a08 191
- ↑ Industrial Organic Chemistry, Klaus Weissermel, Hans-Jurgen Arpe John Wiley & Sons; 3rd 1997 ISBN 3-527-28838-4
- ↑ Bost, R. W.; Constable, E. W. "sym-Trithiane" Organic Syntheses, Collected Volume 2, p.610 (1943). "Archived copy" (PDF). Archived from the original (PDF) on 2012-03-29. Retrieved 2014-05-05.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ Cumming, W. M. (1937). Systematic organic chemistry (3E). New York, USA: D. Van Nostrand Company. p. 57.
- ↑ Bonamico, M.; Dessy, G.; Fares, V.; Scaramuzza, L. (1975). "सल्फर युक्त बिडेंटेट लिगेंड्स के साथ धातु परिसरों का संरचनात्मक अध्ययन। भाग I. त्रिमेरिक बिस-(डाइथियोबेंजोएटो)-निकेल (II) और -पैलेडियम (II) के क्रिस्टल और आणविक संरचनाएं". Journal of the Chemical Society, Dalton Transactions (21): 2250–2255. doi:10.1039/DT9750002250.