आणविक कक्षक: Difference between revisions
No edit summary |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 180: | Line 180: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 06/07/2023]] | [[Category:Created On 06/07/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 16:45, 14 July 2023
रसायन विज्ञान में, आणविक कक्षक (/ɒrbədl/) फलन (गणित) है जो अणु में इलेक्ट्रॉन के स्थान और पदार्थ तरंग जैसे व्यवहार का वर्णन करता है। इस फलन का उपयोग रासायनिक और भौतिक गुणों की गणना करने के लिए किया जा सकता है जैसे कि किसी विशिष्ट क्षेत्र में इलेक्ट्रॉन खोजने की संभावना परमाणु कक्षक और आणविक कक्षक शब्द [lower-alpha 1] को 1932 में रॉबर्ट एस. मुल्लिकेन द्वारा एक-इलेक्ट्रॉन कक्षीय तरंग कार्यों के अर्थ में प्रयुक्त किया गया था।[2] प्रारंभिक स्तर पर, उनका उपयोग अंतरिक्ष के उस क्षेत्र का वर्णन करने के लिए किया जाता है जिसमें किसी फलन का महत्वपूर्ण आयाम होता है।
एक पृथक परमाणु में, कक्षीय इलेक्ट्रॉनों का स्थान परमाणु कक्षक नामक कार्यों द्वारा निर्धारित होता है। जब कई परमाणु रासायनिक रूप से अणु में संयोजित होते हैं, जिससे इलेक्ट्रॉनों का स्थान समग्र रूप से अणु द्वारा निर्धारित होता है, इसलिए परमाणु कक्षाएँ मिलकर आणविक कक्षाएँ बनाती हैं। घटक परमाणुओं से इलेक्ट्रॉन आणविक कक्षाओं पर अभिग्रहण कर लेते हैं। गणितीय रूप से, आणविक कक्षाएँ अणु के परमाणु नाभिक के क्षेत्र में इलेक्ट्रॉनों के लिए श्रोडिंगर समीकरण का अनुमानित समाधान हैं। इनका निर्माण सामान्यतः अणु के प्रत्येक परमाणु से परमाणु ऑर्बिटल्स परमाणु ऑर्बिटल्स या संकर कक्षीय या परमाणुओं के समूहों से अन्य आणविक ऑर्बिटल्स के रैखिक संयोजन द्वारा किया जाता है। उन्हें हार्ट्री-फॉक विधि हार्ट्री-फॉक या सेल्फ-कंसिस्टेंट फील्ड (एससीएफ) विधियों का उपयोग करके मात्रात्मक रूप से गणना की जा सकती है।
आणविक कक्षाएँ तीन प्रकार की होती हैं: आबंधन आणविक कक्षाएँ जिनकी ऊर्जा उन्हें बनाने वाले परमाणु कक्षाओं की ऊर्जा से कम होती है, और इस प्रकार उन रासायनिक बंधों को बढ़ावा देती है जो अणु को साथ रखते हैं; प्रतिरक्षी आणविक ऑर्बिटल्स जिनकी ऊर्जा उनके घटक परमाणु ऑर्बिटल्स की ऊर्जा से अधिक होती है, और इसलिए अणु के बंध का विरोध करते हैं, और गैर-बंध ऑर्बिटल्स जिनकी ऊर्जा उनके घटक परमाणु ऑर्बिटल्स के समान होती है और इस प्रकार बॉन्डिंग पर कोई प्रभाव नहीं पड़ता है .
अवलोकन
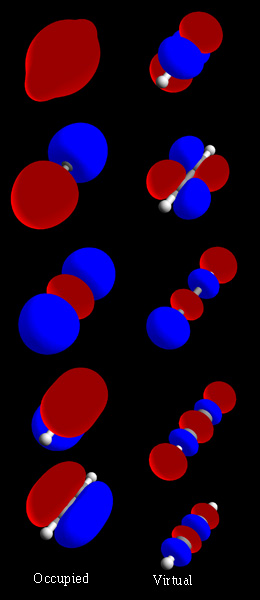
एक आणविक कक्षक (एमओ) का उपयोग अणु में उन क्षेत्रों का प्रतिनिधित्व करने के लिए किया जा सकता है जहां उस कक्षक पर अभिग्रहण करने वाले ऋणावेशित सूक्ष्म अणु का विन्यास पाए जाने की संभावना है। आणविक कक्षाएँ अणु के परमाणु नाभिक के विद्युत क्षेत्र में इलेक्ट्रॉनों के लिए श्रोडिंगर समीकरण के अनुमानित समाधान हैं। चूँकि इस समीकरण से सीधे ऑर्बिटल्स की गणना करना बहुत ही कठिन समस्या है। इसके अतिरिक्त वे परमाणु कक्षाओं के संयोजन से प्राप्त होते हैं, जो परमाणु में इलेक्ट्रॉन के स्थान की पूर्वानुमान करते हैं। आणविक कक्षक अणु के इलेक्ट्रॉन विन्यास को निर्दिष्ट कर सकता है: (या जोड़ी) इलेक्ट्रॉन का स्थानिक वितरण और ऊर्जा सामान्यतः एमओ को परमाणु कक्षाओं के रैखिक संयोजन आणविक कक्षीय विधि (एलसीएओ-एमओ विधि) के रूप में दर्शाया जाता है, विशेष रूप से गुणात्मक या बहुत अनुमानित उपयोग में वे आणविक कक्षीय सिद्धांत के माध्यम से समझे गए अणुओं में बंध का सरल मॉडल प्रदान करने में अमूल्य हैं।
कम्प्यूटेशनल रसायन विज्ञान में अधिकांश वर्तमान विधियां सिस्टम के एमओ की गणना से प्रारंभ होती हैं। आणविक कक्षक नाभिक द्वारा उत्पन्न विद्युत क्षेत्र में इलेक्ट्रॉन के व्यवहार और अन्य इलेक्ट्रॉनों के कुछ औसत वितरण का वर्णन करता है। एक ही कक्षा में रहने वाले दो इलेक्ट्रॉनों के स्थिति में, पाउली सिद्धांत की मांग है कि उनके पास विपरीत स्पिन हो आवश्यक रूप से यह अनुमान है, और आणविक इलेक्ट्रॉनिक तरंग फलन के अत्यधिक स्पष्ट विवरण में ऑर्बिटल्स नहीं होते हैं (विन्यास इंटरेक्शन देखें)।
सामान्यतः, आणविक कक्षाएँ पूरे अणु में स्थानीयकृत होती हैं। इसके अतिरिक्त, यदि अणु में समरूपता तत्व हैं, तो इसके गैर-अपक्षयी आणविक कक्षाएँ इनमें से किसी भी समरूपता के संबंध में या तो सममित या एंटीसिमेट्रिक हैं। दूसरे शब्दों में, आणविक कक्षीय ψ में समरूपता ऑपरेशन s (उदाहरण के लिए, प्रतिबिंब, घूर्णन, या व्युत्क्रम) के अनुप्रयोग के परिणामस्वरूप आणविक कक्षक अपरिवर्तित होता है या इसके गणितीय चिह्न को उलट देता है: Sψ = ±ψ। उदाहरण के लिए, तलीय अणुओं में, आणविक तल में परावर्तन के संबंध में आणविक कक्षाएँ या तो सममित (सिग्मा बांड) या एंटीसिमेट्रिक (पीआई बांड) होती हैं। यदि विकृत कक्षीय ऊर्जा वाले अणुओं पर भी विचार किया जाता है, तो अधिक सामान्य कथन यह है कि आणविक कक्षाएँ अणु के समरूपता समूह के अघुलनशील प्रतिनिधित्व के लिए आधार बनाती हैं।[4] आणविक ऑर्बिटल्स के समरूपता गुणों का कारण है कि डेलोकलाइज़ेशन आणविक ऑर्बिटल सिद्धांत की अंतर्निहित विशेषता है और इसे मूल रूप से (और पूरक) वैलेंस बॉन्ड सिद्धांत से अलग बनाता है, जिसमें बॉन्ड को स्थानीयकृत इलेक्ट्रॉन जोड़े के रूप में देखा जाता है, अनुनाद (रसायन विज्ञान) के लिए छूट के साथ स्थानीयकरण के लिए किया जाता है.
इन समरूपता-अनुकूलित विहित आणविक कक्षाओं के विपरीत, विहित कक्षाओं में कुछ गणितीय परिवर्तन प्रयुक्त करके स्थानीयकृत आणविक कक्षाएँ बनाई जा सकती हैं। इस दृष्टिकोण का लाभ यह है कि ऑर्बिटल्स अणु के बंधनों के अधिक निकट से मेल खाएंगे जैसा कि लुईस संरचना द्वारा दर्शाया गया है। इस प्रकार हानि के रूप में, इन स्थानीयकृत कक्षाओं के ऊर्जा स्तर का अब भौतिक अर्थ नहीं रह गया है। (इस लेख के अतिरिक्त भाग में चर्चा कैनोनिकल आणविक ऑर्बिटल्स पर केंद्रित होगी। स्थानीयकृत आणविक ऑर्बिटल्स पर आगे की चर्चा के लिए, देखें: प्राकृतिक बॉन्ड ऑर्बिटल और सिग्मा-पीआई और समकक्ष-ऑर्बिटल मॉडल।)
आणविक कक्षकों का निर्माण
आणविक कक्षाएँ परमाणु कक्षाओं के बीच अनुमत अंतःक्रियाओं से उत्पन्न होती हैं, जिन्हें अनुमति दी जाती है यदि परमाणु कक्षाओं की समरूपता (समूह सिद्धांत से निर्धारित) दूसरे के साथ संगत हैं। परमाणु कक्षीय अंतःक्रियाओं की दक्षता दो परमाणु कक्षकों के बीच कक्षीय ओवरलैप (दो कक्षक दूसरे के साथ कितनी अच्छी तरह से रचनात्मक रूप से परस्पर क्रिया करते हैं इसका माप) से निर्धारित की जाती है, जो महत्वपूर्ण है यदि परमाणु कक्षक ऊर्जा में निकट हैं। अंत में, बनने वाले आणविक कक्षकों की संख्या अणु बनाने के लिए संयोजित होने वाले परमाणुओं में परमाणु कक्षकों की संख्या के सामान्य होनी चाहिए।
गुणात्मक चर्चा
आणविक संरचना की अस्पष्ट, किन्तु गुणात्मक रूप से उपयोगी चर्चा के लिए, आणविक कक्षकों को परमाणु कक्षकों के रैखिक संयोजन आणविक कक्षीय विधि एएनसाटीजेड से प्राप्त किया जा सकता है। यहां, आणविक कक्षाओं को परमाणु कक्षाओं के रैखिक संयोजन के रूप में व्यक्त किया गया है।[5]
परमाणु कक्षकों का रैखिक संयोजन (एलसीएओ)
आणविक कक्षाएँ पहली बार फ्रेडरिक कुत्ता द्वारा प्रस्तुत की गईं [6][7] और रॉबर्ट एस. मुल्लिकेन [8][9] 1927 और 1928 में.[10][11] परमाणु ऑर्बिटल्स का रैखिक संयोजन या आणविक ऑर्बिटल्स के लिए एलसीएओ सन्निकटन 1929 में जॉन लेनार्ड-जोन्स द्वारा प्रयुक्त किया गया था।[12] उनके अभूतपूर्व पेपर में दिखाया गया कि क्वांटम सिद्धांतों से अधातु तत्त्व और ऑक्सीजन अणुओं की इलेक्ट्रॉनिक संरचना कैसे प्राप्त की जाए। आणविक कक्षीय सिद्धांत का यह गुणात्मक दृष्टिकोण आधुनिक क्वांटम रसायन विज्ञान की प्रारंभ का भाग है।
परमाणु ऑर्बिटल्स (एलसीएओ) के रैखिक संयोजन का उपयोग आणविक ऑर्बिटल्स का अनुमान लगाने के लिए किया जा सकता है जो अणु के घटक परमाणुओं के बीच बंध पर बनते हैं। परमाणु कक्षक के समान, श्रोडिंगर समीकरण, जो इलेक्ट्रॉन के व्यवहार का वर्णन करता है, आणविक कक्षक के लिए भी बनाया जा सकता है। परमाणु कक्षाओं के रैखिक संयोजन, या परमाणु तरंग कार्यों के योग और अंतर, हार्ट्री-फॉक विधि के लिए अनुमानित समाधान प्रदान करते हैं। हार्ट्री-फॉक समीकरण जो आणविक श्रोडिंगर समीकरण के स्वतंत्र-कण सन्निकटन के अनुरूप हैं। सरल द्विपरमाणुक अणुओं के लिए, प्राप्त तरंगक्रियाओं को समीकरणों द्वारा गणितीय रूप से दर्शाया जाता है
जहाँ और क्रमशः आबंधन और प्रतिरक्षी आण्विक कक्षकों के लिए आण्विक तरंगक्रियाएँ हैं इस प्रकार और क्रमशः परमाणु a और b से परमाणु तरंग फलन हैं, और और समायोज्य गुणांक हैं. ये गुणांक व्यक्तिगत परमाणु कक्षाओं की ऊर्जा और समरूपता के आधार पर सकारात्मक या नकारात्मक हो सकते हैं। जैसे-जैसे दो परमाणु एक-दूसरे के निकट आते हैं, उनके परमाणु कक्षक उच्च इलेक्ट्रॉन घनत्व के क्षेत्रों का निर्माण करने के लिए ओवरलैप होते हैं, और, परिणामस्वरूप, दोनों परमाणुओं के बीच आणविक कक्षक बनते हैं। परमाणु सकारात्मक रूप से चार्ज किए गए नाभिक और बॉन्डिंग आणविक कक्षाओं में उपस्थित नकारात्मक चार्ज वाले इलेक्ट्रॉनों के बीच इलेक्ट्रोस्टैटिक आकर्षण द्वारा साथ बंधे रहते हैं।[13]
बॉन्डिंग, एंटीबॉन्डिंग, और नॉनबॉन्डिंग एमओ
जब परमाणु ऑर्बिटल्स परस्पर क्रिया करते हैं, जिससे परिणामी आणविक ऑर्बिटल बॉन्डिंग, एंटीबॉन्डिंग, या नॉनबॉन्डिंग तीन प्रकार के हो सकते हैं।
बंध आणविक कक्षाएँ:
- परमाणु कक्षकों के बीच आबंधन अंतःक्रियाएं रचनात्मक (इन-फेज) अंतःक्रियाएं हैं।
- बॉन्डिंग एमओ उन परमाणु ऑर्बिटल्स की तुलना में ऊर्जा में कम होते हैं जो उन्हें उत्पन्न करने के लिए संयोजित होते हैं।
प्रतिरक्षी आण्विक कक्षाएँ:
- परमाणु ऑर्बिटल्स के बीच एंटीबॉन्डिंग इंटरैक्शन विनाशकारी (आउट-ऑफ़-फ़ेज़) इंटरैक्शन हैं, नोड (भौतिकी) के साथ जहां दो इंटरैक्टिंग परमाणुओं के बीच एंटीबॉन्डिंग ऑर्बिटल की तरंग फलन शून्य है
- एंटीबॉन्डिंग एमओ उन परमाणु ऑर्बिटल्स की तुलना में ऊर्जा में अधिक होते हैं जो उन्हें उत्पन्न करने के लिए संयोजित होते हैं।
गैर-बंध कक्षक:
- संगत समरूपता की कमी के कारण नॉनबॉन्डिंग एमओ परमाणु ऑर्बिटल्स के बीच कोई परस्पर क्रिया नहीं होने का परिणाम हैं।
- नॉनबॉन्डिंग एमओ में अणु में किसी परमाणु के परमाणु ऑर्बिटल्स के समान ऊर्जा होगी।
एमओ के लिए सिग्मा और पीआई लेबल
परमाणु कक्षाओं के बीच परस्पर क्रिया के प्रकार को आणविक-कक्षीय समरूपता लेबल σ (सिग्मा), π (pi), δ (डेल्टा), φ (phi), γ (गामा) आदि द्वारा वर्गीकृत किया जा सकता है। ये संबंधित ग्रीक अक्षर हैं परमाणु कक्षाओं में क्रमशः s, p, d, f और g संबंधित परमाणुओं के बीच आंतरिक परमाणु अक्ष वाले नोडल विमानों की संख्या σ MOs के लिए शून्य है, π के लिए एक, δ के लिए दो, φ के लिए तीन और γ के लिए चार है।
σ समरूपता
इस प्रकार σ समरूपता वाला MO या तो दो परमाणु s-ऑर्बिटल्स या दो परमाणु pz की परस्पर क्रिया से उत्पन्न होता है ऑर्बिटल्स. MO में σ-समरूपता होगी यदि कक्षक दो परमाणु केंद्रों, आंतरिक परमाणु अक्ष को जोड़ने वाली धुरी के संबंध में सममित है। इसका कारण यह है कि आंतरिक परमाणु अक्ष के बारे में एमओ के घूमने से चरण परिवर्तन नहीं होता है। σ* ऑर्बिटल, सिग्मा एंटीबॉन्डिंग ऑर्बिटल, आंतरिक परमाणु अक्ष के चारों ओर घूमने पर भी उसी चरण को बनाए रखता है। σ* ऑर्बिटल में नोडल प्लेन होता है जो नाभिक के बीच होता है और आंतरिक अक्ष के लंबवत होता है।[14]
π समरूपता
π समरूपता वाला MO दो परमाणु px की परस्पर क्रिया से उत्पन्न होता है ऑर्बिटल्स या py कक्षाएँ यदि आंतरिक परमाणु अक्ष के बारे में घूर्णन के संबंध में कक्षीय असममित है तो MO में π समरूपता होगी। इसका कारण यह है कि आंतरिक परमाणु अक्ष के बारे में एमओ के घूमने से चरण परिवर्तन होगा। यदि परमाणु कक्षक वास्तविक कक्षकों पर विचार किया जाए तो नोडल तल है जिसमें आंतरिक अक्ष होता है।
एक π* ऑर्बिटल, पीआई एंटीबॉन्डिंग ऑर्बिटल, आंतरिक परमाणु अक्ष के बारे में घुमाए जाने पर भी चरण परिवर्तन उत्पन्न करेगा। π* कक्षक में नाभिक के बीच दूसरा नोडल तल भी होता है।[14][15][16][17]
δ समरूपता
δ समरूपता वाला MO दो परमाणु dxy या dx2-y2 कक्षाएँ की परस्पर क्रिया से उत्पन्न होता है। क्योंकि इन आणविक कक्षाओं में कम-ऊर्जा डी परमाणु कक्षाएँ सम्मिलित होती हैं, उन्हें संक्रमण धातु परिसरों में देखा जाता है। δ आबंधन कक्षक में आंतरिक नाभिकीय अक्ष वाले दो नोडल तल होते हैं, और δ* प्रतिरक्षी कक्षक में नाभिक के बीच तीसरा नोडल तल भी होता है।
φ समरूपता
सैद्धांतिक रसायनज्ञों ने अनुमान लगाया है कि उच्च-क्रम के बंध, जैसे कि एफ परमाणु कक्षाओं के ओवरलैप के अनुरूप फाई बांड, संभव हैं। फाई बांड युक्त अणु का कोई ज्ञात उदाहरण नहीं है।
गेरेड और अनगेरेड समरूपता
उन अणुओं के लिए जिनमें व्युत्क्रम केंद्र (सेंट्रोसममेट्री ) होता है, समरूपता के अतिरिक्त लेबल होते हैं जिन्हें आणविक कक्षाओं पर प्रयुक्त किया जा सकता है।सेंट्रोसिमेट्रिक अणुओं में सम्मिलित हैं:
- होमोन्यूक्लियर अणु डायटोमिक्स, x2
- अष्टफलकीय आणविक ज्यामिति, EX6
- वर्ग तलीय आणविक ज्यामिति, EX4.
गैर-सेंट्रोसिमेट्रिक अणुओं में सम्मिलित हैं:
- हेटेरोन्यूक्लियर अणु डायटोमिक्स, XY
- टेट्राहेड्रल आणविक ज्यामिति, EX4.
यदि किसी अणु में समरूपता के केंद्र के माध्यम से व्युत्क्रमण के परिणामस्वरूप आणविक कक्षीय के लिए समान चरण होते हैं, तो एमओ को जर्मन शब्द सम से गेराडे (g) समरूपता कहा जाता है। यदि किसी अणु में समरूपता के केंद्र के माध्यम से व्युत्क्रमण के परिणामस्वरूप आणविक कक्षक के लिए चरण परिवर्तन होता है, तो एमओ को विषम के लिए जर्मन शब्द से अनगेरेड (यू) समरूपता कहा जाता है। σ-समरूपता के साथ बंध MO के लिए, कक्षीय σg (s'+ s सममित है) है, जबकि σ-समरूपता के साथ प्रतिरक्षी MO कक्षीय σu है, क्योंकि s' – s का व्युत्क्रमण प्रतिसममिति है।
π-समरूपता के साथ बंध MO के लिए कक्षीय πu है क्योंकि समरूपता के केंद्र के माध्यम से व्युत्क्रमण संकेत परिवर्तन उत्पन्न करेगा (दो p परमाणु कक्षाएँ दूसरे के साथ चरण में हैं किन्तु दो पालियों के विपरीत संकेत हैं), जबकि π-समरूपता के साथ प्रतिरक्षी MO πg है क्योंकि समरूपता के केंद्र के माध्यम से व्युत्क्रमण से कोई संकेत परिवर्तन नहीं होगा (दो p ऑर्बिटल्स चरण द्वारा एंटीसिमेट्रिक हैं)।[14]
एमओ आरेख
एमओ विश्लेषण का गुणात्मक दृष्टिकोण अणु में बॉन्डिंग इंटरैक्शन को देखने के लिए आणविक कक्षीय आरेख का उपयोग करता है। इस प्रकार के आरेख में, आणविक कक्षाओं को क्षैतिज रेखाओं द्वारा दर्शाया जाता है; रेखा जितनी ऊँची होगी, कक्षक की ऊर्जा उतनी ही अधिक होगी, और विकृत कक्षकों को उनके बीच स्थान के साथ समान स्तर पर रखा जाएगा। फिर, पॉली अपवर्जन सिद्धांत और हंड के अधिकतम बहुलता के नियम को ध्यान में रखते हुए, आणविक कक्षाओं में रखे जाने वाले इलेक्ट्रॉनों को एक-एक करके व्यवस्थित किया जाता है (केवल 2 इलेक्ट्रॉन, विपरीत स्पिन वाले, प्रति कक्षक; पर कई अयुग्मित इलेक्ट्रॉन रखें उन्हें जोड़ना प्रारंभ करने से पहले जितना संभव हो सके ऊर्जा स्तर)। अधिक जटिल अणुओं के लिए, तरंग यांत्रिकी दृष्टिकोण संबंध की गुणात्मक समझ में उपयोगिता खो देता है (चूँकि मात्रात्मक दृष्टिकोण के लिए अभी भी आवश्यक है)।कुछ गुण:
- ऑर्बिटल्स के आधार सेट में वे परमाणु ऑर्बिटल्स सम्मिलित होते हैं जो आणविक ऑर्बिटल इंटरैक्शन के लिए उपलब्ध होते हैं, जो बॉन्डिंग या एंटीबॉन्डिंग हो सकते हैं
- आणविक कक्षकों की संख्या रैखिक विस्तार या आधार सेट में सम्मिलित परमाणु कक्षकों की संख्या के सामान्य है
- यदि अणु में कुछ समरूपता है, तो विकृत परमाणु कक्षाएँ (समान परमाणु ऊर्जा के साथ) रैखिक संयोजनों में समूहीकृत की जाती हैं (जिन्हें समरूपता-अनुकूलित परमाणु कक्षाएँ (एसओ) कहा जाता है), जो समरूपता समूह के परिमित समूहों के प्रतिनिधित्व सिद्धांत से संबंधित हैं, इसलिए समूह का वर्णन करने वाले तरंग कार्यों को समरूपता-अनुकूलित रैखिक संयोजन (एसएएलसी) के रूप में जाना जाता है।
- एक समूह प्रतिनिधित्व से संबंधित आणविक कक्षाओं की संख्या इस प्रतिनिधित्व से संबंधित समरूपता-अनुकूलित परमाणु कक्षाओं की संख्या के सामान्य है
- परिमित समूहों के विशेष प्रतिनिधित्व सिद्धांत के अन्दर, समरूपता-अनुकूलित परमाणु कक्षाएँ अधिक मिश्रित होती हैं यदि उनकी परमाणु ऊर्जा का स्तर निकट हो।
एक यथोचित सरल अणु के लिए आणविक कक्षीय आरेख के निर्माण की सामान्य प्रक्रिया को निम्नानुसार संक्षेपित किया जा सकता है:
1. अणु को बिंदु समूह निर्दिष्ट करें।
2. एसएएलसी की आकृतियों को देखें।
3. प्रत्येक आणविक टुकड़े के एसएएलसी को ऊर्जा के क्रम में व्यवस्थित करें, पहले यह ध्यान दें कि क्या वे s, p, या d ऑर्बिटल्स से आते हैं (और उन्हें s < p < d क्रम में रखें), और फिर उनके आंतरिक नोड्स की संख्या है।
4. दो टुकड़ों से समान समरूपता प्रकार के एसएएलसी को मिलाएं, और N एसएएलसी से N आणविक कक्षाएँ बनाएं जाते है।
5. ओवरलैप और मूल ऑर्बिटल्स की सापेक्ष ऊर्जाओं पर विचार करके आणविक ऑर्बिटल्स की सापेक्ष ऊर्जा का अनुमान लगाएं, और आणविक ऑर्बिटल्स ऊर्जा स्तर आरेख (ऑर्बिटल्स की उत्पत्ति दिखाते हुए) पर स्तर बनाएं जाते है।
6. वाणिज्यिक सॉफ़्टवेयर का उपयोग करके आणविक कक्षीय गणना करके इस गुणात्मक क्रम की पुष्टि करें, सही करें और संशोधित करें।[18]
आणविक कक्षाओं में बंध
कक्षीय अध:पतन
यदि आणविक कक्षाओं में समान ऊर्जा हो तो उन्हें विकृत कहा जाता है। उदाहरण के लिए, पहले दस तत्वों के होमोन्यूक्लियर डायटोमिक अणुओं में, px और पीy से प्राप्त आणविक कक्षाएँ परमाणु के परिणामस्वरूप दो विकृत बंध कक्षाएँ (कम ऊर्जा की) और दो विकृत प्रतिरक्षी कक्षाएँ (उच्च ऊर्जा की) बनती हैं।[13]
आयनिक बंध
जब दो परमाणुओं के परमाणु ऑर्बिटल्स के बीच ऊर्जा का अंतर अधिक बड़ा होता है, जिससे परमाणु के ऑर्बिटल्स लगभग पूरी तरह से बॉन्डिंग ऑर्बिटल्स में योगदान करते हैं, और दूसरे परमाणु के ऑर्बिटल्स लगभग पूरी तरह से एंटीबॉन्डिंग ऑर्बिटल्स में योगदान करते हैं। इस प्रकार, स्थिति प्रभावी रूप से यह है कि या अधिक इलेक्ट्रॉनों को परमाणु से दूसरे में स्थानांतरित कर दिया गया है। इसे (अधिकतर) आयनिक बंध कहा जाता है।
बांड आदेश
किसी अणु का बंध क्रम, या बंधनों की संख्या, बंध और प्रतिरक्षी आणविक कक्षाओं में इलेक्ट्रॉनों की संख्या को मिलाकर निर्धारित की जा सकती है। बॉन्डिंग ऑर्बिटल में इलेक्ट्रॉनों की जोड़ी बंध बनाती है, जबकि एंटीबॉडी ऑर्बिटल में इलेक्ट्रॉनों की जोड़ी बॉन्ड को अस्वीकार देती है। उदाहरण के लिए, एन2 बॉन्डिंग ऑर्बिटल्स में आठ इलेक्ट्रॉनों और एंटीबॉन्डिंग ऑर्बिटल्स में दो इलेक्ट्रॉनों के साथ, तीन का बॉन्ड ऑर्डर होता है, जो ट्रिपल बॉन्ड का गठन करता है।
बॉन्ड की ताकत बॉन्ड ऑर्डर के समानुपाती होती है बॉन्डिंग की अधिक मात्रा अधिक स्थिर बॉन्ड बनाती है और बॉन्ड की लंबाई इसके व्युत्क्रमानुपाती होती है सशक्त बॉन्ड छोटा होता है।
सकारात्मक बंध क्रम वाले अणु की आवश्यकता के दुर्लभ अपवाद हैं। यद्यपि हो mo2 विश्लेषण के अनुसार 0 का बॉन्ड ऑर्डर है, अत्यधिक अस्थिर be2 का प्रयोगात्मक प्रमाण है अणु की बंध लंबाई 245 pm और बंध ऊर्जा 10 kJ/mol है।[14][19]
होमो और लूमो
उच्चतम व्याप्त आणविक कक्षक और सबसे कम रिक्त आणविक कक्षक को अधिकांशतः क्रमशः होमो और लूमो कहा जाता है। होमो और लूमो की ऊर्जाओं के अंतर को होमो-लूमो अंतर कहा जाता है। यह धारणा अधिकांशतः साहित्य में भ्रम का विषय है और इस पर सावधानी से विचार किया जाना चाहिए। इसका मान सामान्यतः मूलभूत अंतर (आयनीकरण क्षमता और इलेक्ट्रॉन आत्मीयता के बीच अंतर) और ऑप्टिकल अंतर के बीच स्थित होता है। इसके अतिरिक्त, होमो-लूमो गैप थोक सामग्री ऊर्जा अंतराल या ट्रांसपोर्ट गैप से संबंधित हो सकता है, जो सामान्यतः मौलिक गैप से बहुत छोटा होता है।
उदाहरण
होमोन्यूक्लियर डायटोमिक्स
होमोन्यूक्लियर डायटोमिक एमओ में आधार सेट में प्रत्येक परमाणु कक्षक से समान योगदान होता है। इसे H2, He2 और Li2 के लिए होमोन्यूक्लियर डायटोमिक MO आरेखों में दिखाया गया है, जिनमें से सभी में सममित कक्षाएँ हैं। [14]
H2

एक सरल MO उदाहरण के रूप में, हाइड्रोजन अणु, H2 में इलेक्ट्रॉनों पर विचार करें (MO आरेख डायटोमिक MO आरेख देखें), दो परमाणुओं को H' और H लेबल के साथ। सबसे कम ऊर्जा वाले परमाणु कक्षक, 1s' और 1s, अणु की समरूपता के अनुसार परिवर्तित नहीं होते हैं। चूँकि, निम्नलिखित समरूपता अनुकूलित परमाणु कक्षाएँ करती हैं:
| 1s' – 1s" | एंटीसिमेट्रिक संयोजन: प्रतिबिंब द्वारा नकारा गया, अन्य परिचालनों द्वारा अपरिवर्तित |
|---|---|
| 1s' + 1s" | सममित संयोजन: सभी समरूपता परिचालनों द्वारा अपरिवर्तित |
सममित संयोजन (जिसे बॉन्डिंग ऑर्बिटल कहा जाता है) आधार ऑर्बिटल्स की तुलना में ऊर्जा में कम है, और एंटीसिमेट्रिक संयोजन ( प्रतिरक्षी ऑर्बिटल कहा जाता है) अधिक है। क्योंकि H2 अणु में दो इलेक्ट्रॉन होते हैं, वे दोनों बंध कक्ष में जा सकते हैं, जिससे प्रणाली दो मुक्त हाइड्रोजन परमाणुओं की तुलना में कम ऊर्जा (इसलिए अधिक स्थिर) हो जाती है। इसे सहसंयोजक बंध कहा जाता है। अनुबंध आदेश, बॉन्डिंग इलेक्ट्रॉनों की संख्या घटा एंटीबॉडी इलेक्ट्रॉनों की संख्या के सामान्य है, जिसे 2 से विभाजित किया गया है। इस उदाहरण में, बॉन्डिंग ऑर्बिटल में 2 इलेक्ट्रॉन हैं और एंटीबॉन्डिंग ऑर्बिटल में कोई भी नहीं है; बंध क्रम 1 है, और दो हाइड्रोजन परमाणुओं के बीच एकल बंध है।
He2
दूसरी ओर, He2 के काल्पनिक अणु पर विचार करें He' और He लेबल वाले परमाणुओं के साथ। जैसा कि H2 के साथ है, सबसे कम ऊर्जा वाले परमाणु ऑर्बिटल्स 1s' और 1s हैं, और अणु की समरूपता के अनुसार परिवर्तित नहीं होते हैं, जबकि समरूपता अनुकूलित परमाणु ऑर्बिटल्स करते हैं। सममित संयोजन - बॉन्डिंग ऑर्बिटल - आधार ऑर्बिटल्स की तुलना में ऊर्जा में कम है, और एंटीसिमेट्रिक संयोजन - एंटीबॉन्डिंग ऑर्बिटल - अधिक है। H2 के विपरीत, दो वैलेंस इलेक्ट्रॉनों के साथ, He2 इसकी तटस्थ जमीनी अवस्था में चार हैं। दो इलेक्ट्रॉन निम्न-ऊर्जा बंध कक्षक, σg(1s) को भरते हैं, जबकि शेष दो उच्च-ऊर्जा प्रतिरक्षी कक्षक, σu*(1s) को भरते हैं. इस प्रकार, अणु के चारों ओर परिणामी इलेक्ट्रॉन घनत्व दो परमाणुओं के बीच बंध के गठन का समर्थन नहीं करता है; परमाणुओं को साथ बांधे रखने वाले स्थिर बंध के बिना, अणु के अस्तित्व की उम्मीद नहीं की जा सकती है। इसे देखने का दूसरा तरीका यह है कि दो बंधनकारी इलेक्ट्रॉन और दो प्रतिरक्षी इलेक्ट्रॉन हैं; इसलिए, बंध क्रम 0 है और कोई बंध उपस्थित नहीं है (अणु में वान डेर वाल्स क्षमता द्वारा समर्थित बाध्य अवस्था है)।
He2
डिलिथियम Li2 दो ली परमाणुओं के 1s और 2s परमाणु कक्षाओं (आधार सेट) के ओवरलैप से बनता है। प्रत्येक ली परमाणु बॉन्डिंग इंटरैक्शन के लिए तीन इलेक्ट्रॉनों का योगदान देता है, और छह इलेक्ट्रॉन सबसे कम ऊर्जा के तीन एमओ को भरते हैं, σg(1s), pu*(1s), और pg(2s). बांड क्रम के लिए समीकरण का उपयोग करते हुए, यह पाया गया है कि डाइलिथियम का बंध क्रम एक, एकल बंध है।[20]
उत्कृष्ट गैसें
He2 के काल्पनिक अणु पर विचार करना, चूँकि परमाणु कक्षकों का आधार समुच्चय H2 के स्थिति जैसा ही है, हम पाते हैं कि बॉन्डिंग और एंटीबॉन्डिंग ऑर्बिटल्स दोनों भरे हुए हैं, इसलिए जोड़ी को कोई ऊर्जा लाभ नहीं है। He को थोड़ा ऊर्जा लाभ होगा, किन्तु H2 + 2 जितना नहीं वह, इसलिए अणु बहुत अस्थिर है और हाइड्रोजन और हीलियम में विघटित होने से पहले केवल कुछ समय के लिए ही उपस्थित रहता है। सामान्यतः, हम पाते हैं कि हे जैसे परमाणु जिनमें पूर्ण ऊर्जा कोश होते हैं वे संभवतः ही कभी अन्य परमाणुओं के साथ बंधते हैं। अल्पकालिक वैन डेर वाल्स बॉन्डिंग को छोड़कर, बहुत कम उत्कृष्ट गैस यौगिक ज्ञात हैं।
हेटेरोन्यूक्लियर डायटोमिक्स
जबकि होमोन्यूक्लियर डायटोमिक अणुओं के लिए एमओ में प्रत्येक परस्पर क्रिया करने वाले परमाणु कक्षक का समान योगदान होता है, हेटेरोन्यूक्लियर डायटोमिक अणुओं के लिए एमओ में अलग-अलग परमाणु कक्षीय योगदान होता है। हेटेरोन्यूक्लियर डायटोमिक्स में बॉन्डिंग या एंटीबॉन्डिंग ऑर्बिटल्स का उत्पादन करने के लिए ऑर्बिटल इंटरैक्शन तब होता है, जब परमाणु ऑर्बिटल्स के बीच पर्याप्त ओवरलैप होता है, जैसा कि उनकी समरूपता और ऑर्बिटल ऊर्जा में समानता से निर्धारित होता है।
एचएफ
हाइड्रोजिन फ्लोराइड में H 1 s और एफ 2 s ऑर्बिटल्स के बीच एचएफ ओवरलैप को समरूपता द्वारा अनुमति दी जाती है किन्तु दो परमाणु ऑर्बिटल्स के बीच ऊर्जा में अंतर उन्हें आणविक ऑर्बिटल बनाने के लिए परस्पर क्रिया करने से रोकता है। H 1s और F 2pz के बीच ओवरलैप ऑर्बिटल्स में भी समरूपता की अनुमति है, और इन दो परमाणु ऑर्बिटल्स में थोड़ी ऊर्जा पृथक्करण है। इस प्रकार, वे परस्पर क्रिया करते हैं, जिससे σ और σ* MOs और 1 के बंध क्रम के साथ अणु का निर्माण होता है। चूंकि HF गैर-सेंट्रोसिमेट्रिक अणु है, समरूपता लेबल g और u इसके आणविक कक्षाओं पर प्रयुक्त नहीं होते हैं।[21]
मात्रात्मक दृष्टिकोण
आणविक ऊर्जा स्तरों के लिए मात्रात्मक मान प्राप्त करने के लिए, किसी को ऐसे आणविक ऑर्बिटल्स की आवश्यकता होती है जो विन्यास इंटरैक्शन (सीआई) विस्तार पूर्ण विन्यास इंटरैक्शन सीमा की ओर तेजी से परिवर्तित हो जाती है। ऐसे कार्यों को प्राप्त करने की सबसे सामान्य विधि हार्ट्री-फॉक विधि है, जो आणविक कक्षाओं को फॉक ऑपरेटर के ईजेनफंक्शन के रूप में व्यक्त करती है। सामान्यतः परमाणु नाभिक पर केंद्रित गाऊसी कार्यों के रैखिक संयोजन के रूप में आणविक कक्षाओं का विस्तार करके इस समस्या को हल किया जाता है (परमाणु कक्षाओं का रैखिक संयोजन आणविक कक्षीय विधि और आधार सेट (रसायन विज्ञान) देखें)। इन रैखिक संयोजनों के गुणांकों के लिए समीकरण सामान्यीकृत आइजेनवैल्यू समीकरण है जिसे रूथान समीकरण के रूप में जाना जाता है, जो वास्तव में हार्ट्री-फॉक समीकरण का विशेष प्रतिनिधित्व है। ऐसे कई कार्य हैं जिनमें स्पार्टन (रसायन विज्ञान सॉफ्टवेयर) सहित एमओ की क्वांटम रासायनिक गणना की जा सकती है।
सरल खाते अधिकांशतः सुझाव देते हैं कि प्रयोगात्मक आणविक कक्षीय ऊर्जा वैलेंस ऑर्बिटल्स के लिए पराबैंगनी फोटोइलेक्ट्रॉन स्पेक्ट्रोस्कोपी और कोर ऑर्बिटल्स के लिए एक्स रे फ़ोटोइलैक्ट्रॉन स्पेक्ट्रोस्कोपी के विधियों से प्राप्त की जा सकती है। चूँकि, यह गलत है क्योंकि ये प्रयोग आयनीकरण ऊर्जा को मापते हैं, अणु और इलेक्ट्रॉन को हटाने के परिणामस्वरूप आयनों में से के बीच ऊर्जा में अंतर कूपमैन्स प्रमेय द्वारा आयनीकरण ऊर्जाएँ लगभग कक्षीय ऊर्जाओं से जुड़ी होती हैं। जबकि कुछ अणुओं के लिए इन दोनों मूल्यों के बीच समझौता निकट हो सकता है, अन्य मामलों में यह बहुत व्यर्थ हो सकता है।
टिप्पणियाँ
- ↑ Prior to Mulliken, the word "orbital" was used only as an adjective, for example "orbital velocity" or "orbital wave function."[1] Mulliken used orbital as a noun, when he suggested the terms "atomic orbitals" and "molecular orbitals" to describe the electronic structures of polyatomic molecules.[2][3]
संदर्भ
- ↑ orbital. Retrieved April 18, 2021.
{{cite book}}:|work=ignored (help) - ↑ 2.0 2.1 Mulliken, Robert S. (July 1932). "बहुपरमाणुक अणुओं और संयोजकता की इलेक्ट्रॉनिक संरचनाएँ। द्वितीय. सामान्य विचार". Physical Review. 41 (1): 49–71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ↑ Brown, Theodore (2002). Chemistry : the central science. Upper Saddle River, NJ: Prentice Hall. ISBN 0-13-066997-0.
- ↑ Cotton, F. Albert (1990). समूह सिद्धांत के रासायनिक अनुप्रयोग (3rd ed.). New York: Wiley. pp. 102. ISBN 0471510947. OCLC 19975337.
- ↑ Albright, T. A.; Burdett, J. K.; Whangbo, M.-H. (2013). रसायन विज्ञान में कक्षीय अंतःक्रियाएँ. Hoboken, N.J.: Wiley. ISBN 9780471080398.
- ↑ Hund, F. (1926). "आणविक स्पेक्ट्रा में कुछ घटनाओं की व्याख्या पर" [On the interpretation of some phenomena in molecular spectra]. Zeitschrift für Physik (in Deutsch). Springer Science and Business Media LLC. 36 (9–10): 657–674. Bibcode:1926ZPhy...36..657H. doi:10.1007/bf01400155. ISSN 1434-6001. S2CID 123208730.
- ↑ F. Hund, "Zur Deutung der Molekelspektren", Zeitschrift für Physik, Part I, vol. 40, pages 742-764 (1927); Part II, vol. 42, pages 93–120 (1927); Part III, vol. 43, pages 805-826 (1927); Part IV, vol. 51, pages 759-795 (1928); Part V, vol. 63, pages 719-751 (1930).
- ↑ Mulliken, Robert S. (1 May 1927). "Electronic States and Band Spectrum Structure in Diatomic Molecules. IV. Hund's Theory; Second Positive Nitrogen and Swan Bands; Alternating Intensities". Physical Review. American Physical Society (APS). 29 (5): 637–649. Bibcode:1927PhRv...29..637M. doi:10.1103/physrev.29.637. ISSN 0031-899X.
- ↑ Mulliken, Robert S. (1928). "The assignment of quantum numbers for electrons in molecules. Extracts from Phys. Rev. 32, 186-222 (1928), plus currently written annotations". International Journal of Quantum Chemistry. Wiley. 1 (1): 103–117. doi:10.1002/qua.560010106. ISSN 0020-7608.
- ↑ Friedrich Hund and Chemistry, Werner Kutzelnigg, on the occasion of Hund's 100th birthday, Angewandte Chemie International Edition, 35, 573–586, (1996)
- ↑ Robert S. Mulliken's Nobel Lecture, Science, 157, no. 3785, 13-24. Available on-line at: Nobelprize.org
- ↑ Lennard-Jones, John (Sir) (1929). "कुछ द्विपरमाणुक अणुओं की इलेक्ट्रॉनिक संरचना". Transactions of the Faraday Society. 25: 668–686. Bibcode:1929FaTr...25..668L. doi:10.1039/tf9292500668.
- ↑ 13.0 13.1 Miessler, G.L.; Tarr, Donald A. (2008). अकार्बनिक रसायन शास्त्र. Pearson Education. ISBN 978-81-317-1885-8.
- ↑ 14.0 14.1 14.2 14.3 14.4 Catherine E. Housecroft, Alan G. Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33.
- ↑ Peter Atkins; Julio De Paula. Atkins’ Physical Chemistry. Oxford University Press, 8th ed., 2006.
- ↑ Yves Jean; François Volatron. An Introduction to Molecular Orbitals. Oxford University Press, 1993.
- ↑ Michael Munowitz, Principles of Chemistry, Norton & Company, 2000, p. 229-233.
- ↑ Atkins, Peter; et al. (2006). अकार्बनिक रसायन शास्त्र (4. ed.). New York: W.H. Freeman. p. 208. ISBN 978-0-7167-4878-6.
- ↑ Bondybey, V.E. (1984). "Electronic structure and bonding of Be2". Chemical Physics Letters. 109 (5): 436–441. Bibcode:1984CPL...109..436B. doi:10.1016/0009-2614(84)80339-5.
- ↑ König, Burkhard (1995-02-21). "Chemical Bonding. VonM. J. Winter. 90 S., ISBN 0-19-855694-2. – Organometallics 1. Complexes with Transition Metal-Carbon σ-Bonds. VonM. Bochmann. 91 S., ISBN 0-19-855751-5. – Organometallics 2. Complexes with Transition Metal-Carbon π-Bonds. VonM. Bochmann. 89 S., ISBN 0-19-855813-9. – Bifunctional Compounds. VonR. S. Ward. 90 S., ISBN 0-19-855808-2. – Alle aus der Reihe: Oxford Chemistry Primers, Oxford University Press, Oxford, 1994, Broschur, je 4.99 £". Angewandte Chemie (in Deutsch). 107 (4): 540–540. doi:10.1002/ange.19951070434.
- ↑ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, ISBN 0130-39913-2, p. 41-43.