बोल्ट्ज़मान वितरण: Difference between revisions
No edit summary |
No edit summary |
||
| Line 3: | Line 3: | ||
[[File:Exponential probability density.svg|upright=1.75|right|thumb|बोल्ट्ज़मैन का वितरण घातांकीय वितरण है।]] | [[File:Exponential probability density.svg|upright=1.75|right|thumb|बोल्ट्ज़मैन का वितरण घातांकीय वितरण है।]] | ||
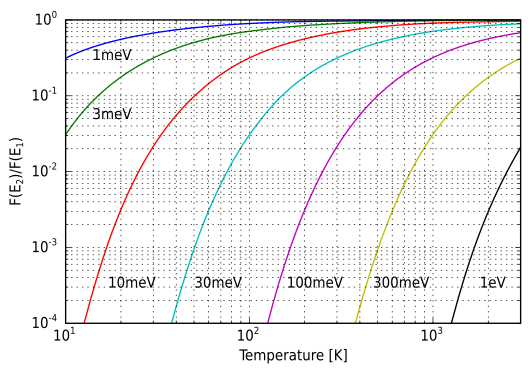
[[File:Boltzmann distribution graph.svg|upright=1.75|right|thumb|बोल्ट्ज़मान कारक {{tmath|\tfrac{p_i}{p_j} }} (ऊर्ध्वाधर अक्ष) तापमान के फलन के रूप में {{mvar|T}} कई ऊर्जा अंतरों के लिए {{math|''ε<sub>i</sub>'' − ''ε<sub>j</sub>''}}.]][[सांख्यिकीय यांत्रिकी]] और गणित में, '''बोल्ट्ज़मैन वितरण''' (जिसे गिब्स वितरण भी कहा जाता है<ref name ="landau">{{cite book | author=Landau, Lev Davidovich |author2=Lifshitz, Evgeny Mikhailovich |name-list-style=amp | title=सांख्यिकीय भौतिकी|volume=5 |series=Course of Theoretical Physics |edition=3 |orig-year=1976 |year=1980 |place=Oxford |publisher=Pergamon Press|isbn=0-7506-3372-7|author-link=Lev Landau |author2-link=Evgeny Lifshitz }} Translated by J.B. Sykes and M.J. Kearsley. See section 28</ref>) संभाव्यता वितरण या [[संभाव्यता माप]] है, जो | [[File:Boltzmann distribution graph.svg|upright=1.75|right|thumb|बोल्ट्ज़मान कारक {{tmath|\tfrac{p_i}{p_j} }} (ऊर्ध्वाधर अक्ष) तापमान के फलन के रूप में {{mvar|T}} कई ऊर्जा अंतरों के लिए {{math|''ε<sub>i</sub>'' − ''ε<sub>j</sub>''}}.]][[सांख्यिकीय यांत्रिकी]] और गणित में, '''बोल्ट्ज़मैन वितरण''' (जिसे गिब्स वितरण भी कहा जाता है<ref name ="landau">{{cite book | author=Landau, Lev Davidovich |author2=Lifshitz, Evgeny Mikhailovich |name-list-style=amp | title=सांख्यिकीय भौतिकी|volume=5 |series=Course of Theoretical Physics |edition=3 |orig-year=1976 |year=1980 |place=Oxford |publisher=Pergamon Press|isbn=0-7506-3372-7|author-link=Lev Landau |author2-link=Evgeny Lifshitz }} Translated by J.B. Sykes and M.J. Kearsley. See section 28</ref>) संभाव्यता वितरण या [[संभाव्यता माप]] होता है, जो प्रणाली की निश्चित स्थिति में होने की प्रायिकता को उस स्थिति की ऊर्जा और प्रणाली के तापमान के फ़ंक्शन के रूप में देता है। वितरण को इस प्रकार व्यक्त किया जाता है: | ||
:<math>p_i \propto \exp\left(- \frac{\varepsilon_i}{kT} \right)</math> | :<math>p_i \propto \exp\left(- \frac{\varepsilon_i}{kT} \right)</math> | ||
यहाँ {{mvar|p<sub>i</sub>}} प्रणाली के स्थिति {{mvar|i}} में होने की प्रायिकता है, {{math|exp}} गणनात्मक फ़ंक्शन है, {{mvar|ε<sub>i</sub>}} उस अवस्था की ऊर्जा है, और वितरण का स्थिरांक {{mvar|kT}} बोल्ट्जमान स्थिरांक {{mvar|k}} और [[थर्मोडायनामिक तापमान]] {{mvar|T}} का उत्पाद है। चिन्ह <math display="inline">\propto</math> [[आनुपातिकता (गणित)]] को दर्शाता है (इसके लिए {{section link||प्रमाणितता }} का वितरण देखें)। | |||
यहाँ प्रणाली शब्द का व्यापक अर्थ है; यह परमाणुओं की 'पर्याप्त संख्या' के संग्रह या एकल परमाणु तक हो सकता है{{r|landau}} [[प्राकृतिक गैस भंडारण]] जैसी स्थूल प्रणाली के लिए होता है । इसलिए बोल्ट्ज़मैन वितरण का उपयोग विभिन्न प्रकार की समस्याओं को | यहाँ प्रणाली शब्द का व्यापक अर्थ है; यह परमाणुओं की 'पर्याप्त संख्या' के संग्रह या एकल परमाणु तक हो सकता है{{r|landau}} [[प्राकृतिक गैस भंडारण]] जैसी स्थूल प्रणाली के लिए होता है । इसलिए बोल्ट्ज़मैन वितरण का उपयोग विभिन्न प्रकार की समस्याओं को समाधान करने के लिए किया जा सकता है। वितरण दिखाता है कि कम ऊर्जा वाली स्थितियों का हमेशा अधिकार बनने की प्रायिकता होगी। | ||
दो स्थितियों की संभावनाओं के अनुपात को 'बोल्ट्ज़मैन कारक' के रूप में जाना जाता है और यह विशेष रूप से केवल स्थितियों के ऊर्जा अंतर पर निर्भर करता है: | दो स्थितियों की संभावनाओं के अनुपात को 'बोल्ट्ज़मैन कारक' के रूप में जाना जाता है और यह विशेष रूप से केवल स्थितियों के ऊर्जा अंतर पर निर्भर करता है: | ||
| Line 18: | Line 18: | ||
|trans-title=Studies on the balance of living force between moving material points | |trans-title=Studies on the balance of living force between moving material points | ||
|journal=Wiener Berichte |volume=58 |pages=517–560 | |journal=Wiener Berichte |volume=58 |pages=517–560 | ||
}}</ref> बोल्ट्ज़मैन का सांख्यिकीय कार्य उनके पेपर "थर्मल इक्विलिब्रियम के लिए शर्तों के संबंध में गर्मी के यांत्रिक सिद्धांत के दूसरे मौलिक प्रमेय और संभाव्यता गणना के बीच संबंध पर" में सामने आया है।<ref>{{Cite web |url=http://crystal.med.upenn.edu/sharp-lab-pdfs/2015SharpMatschinsky_Boltz1877_Entropy17.pdf |title=संग्रहीत प्रति|access-date=2017-05-11 |archive-date=2021-03-05 |archive-url=https://web.archive.org/web/20210305005604/http://crystal.med.upenn.edu/sharp-lab-pdfs/2015SharpMatschinsky_Boltz1877_Entropy17.pdf |url-status=dead }}</ref> | }}</ref> बोल्ट्ज़मैन का सांख्यिकीय कार्य उनके पेपर "थर्मल इक्विलिब्रियम के लिए शर्तों के संबंध में गर्मी के यांत्रिक सिद्धांत के दूसरे मौलिक प्रमेय और संभाव्यता गणना के बीच संबंध पर" में सामने आया है।<ref>{{Cite web |url=http://crystal.med.upenn.edu/sharp-lab-pdfs/2015SharpMatschinsky_Boltz1877_Entropy17.pdf |title=संग्रहीत प्रति|access-date=2017-05-11 |archive-date=2021-03-05 |archive-url=https://web.archive.org/web/20210305005604/http://crystal.med.upenn.edu/sharp-lab-pdfs/2015SharpMatschinsky_Boltz1877_Entropy17.pdf |url-status=dead }}</ref> यह वितरण बाद में [[जोशिया विलार्ड गिब्स]] द्वारा उसके मॉडर्न सामान्य रूप में विस्तार से जांचा गया।<ref name="gibbs">{{cite book |last=Gibbs |first=Josiah Willard |author-link=Josiah Willard Gibbs |title=सांख्यिकीय यांत्रिकी में प्राथमिक सिद्धांत|year=1902 |publisher=[[Charles Scribner's Sons]] | ||
|location=New York|title-link=सांख्यिकीय यांत्रिकी में प्राथमिक सिद्धांत}}</ref> | |location=New York|title-link=सांख्यिकीय यांत्रिकी में प्राथमिक सिद्धांत}}</ref> | ||
बोल्ट्ज़मैन वितरण को मैक्सवेल-बोल्ट्ज़मैन वितरण या मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी के साथ भ्रमित नहीं किया जाना चाहिए। | |||
बोल्ट्ज़मैन वितरण को मैक्सवेल-बोल्ट्ज़मैन वितरण या मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी के साथ भ्रमित नहीं किया जाना चाहिए। ल्ट्जमान वितरण उस प्रायिकता को देता है जिसके रूप में प्रणाली निश्चित स्थिति में होने की प्रायिकता होती है,<ref name="Atkins, P. W. 2010">Atkins, P. W. (2010) Quanta, W. H. Freeman and Company, New York</ref> जबकि मैक्सवेल-बोल्ट्ज़मैन वितरण आदर्श गैसों में कण गति या ऊर्जा की प्रायिकता देता है। चूँकि , <em>एक-आयामी</em> गैस में ऊर्जा का वितरण बोल्ट्ज़मैन वितरण का पालन करता है। | |||
==वितरण== | ==वितरण== | ||
बोल्ट्जमान वितरण प्रायिकता वितरण है जो निश्चित स्थिति की प्रायिकता देता है और जिसका आधार उस [[प्रणाली]] की ऊर्जा और प्रणाली के तापमान होता है जिस पर वितरण लागू होता है।[6] यह निम्नलिखित रूप में दिया गया है:<ref name="McQuarrie, A. 2000">{{cite book |last=McQuarrie |first=A. |year=2000 |title=सांख्यिकीय यांत्रिकी|publisher=University Science Books |location=Sausalito, CA |isbn=1-891389-15-7 }}</ref> | |||
<math display="block"> | <math display="block"> | ||
p_i=\frac{1}{Q} \exp\left(- \frac{\varepsilon_i}{kT} \right) = \frac{ \exp\left(- \tfrac{\varepsilon_i}{kT} \right) }{ \displaystyle \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) } | p_i=\frac{1}{Q} \exp\left(- \frac{\varepsilon_i}{kT} \right) = \frac{ \exp\left(- \tfrac{\varepsilon_i}{kT} \right) }{ \displaystyle \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) } | ||
</math> | </math> | ||
यहाँ: | |||
*{{math|exp()}} | *{{math|exp()}} गणितीय फलन है, | ||
*{{mvar|p<sub>i</sub>}} | *{{mvar|p<sub>i</sub>}} स्थिति {{mvar|i}} की प्रायिकता है , | ||
*{{mvar|ε<sub>i</sub>}} | *{{mvar|ε<sub>i</sub>}} स्थिति {{mvar|i}} की ऊर्जा है , | ||
*{{mvar|k}} बोल्ट्ज़मैन स्थिरांक है, | *{{mvar|k}} बोल्ट्ज़मैन स्थिरांक है, | ||
*{{mvar|T}} प्रणाली का पूर्ण तापमान है, | *{{mvar|T}} प्रणाली का पूर्ण तापमान है, | ||
*{{mvar|M}} ब्याज की प्रणाली के लिए सुलभ सभी स्थितियों की संख्या है,<ref name="McQuarrie, A. 2000"/><ref name="Atkins, P. W. 2010"/> | *{{mvar|M}} ब्याज की प्रणाली के लिए सुलभ सभी स्थितियों की संख्या है,<ref name="McQuarrie, A. 2000"/><ref name="Atkins, P. W. 2010"/> | ||
*{{mvar|Q}} (कुछ लेखकों द्वारा इसे | *{{mvar|Q}} (कुछ लेखकों द्वारा इसे {{mvar|Z}} दर्शाया गया है ) सामान्यीकरण विभाजक है, जो [[विहित विभाजन फ़ंक्शन]] है<math display=block> | ||
Q = \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) | Q = \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) | ||
</math> यह इस | </math> यह इस शर्त से परिणामित होता है कि सभी उपलब्ध स्थितियों की प्रायिकताएं 1 के समकक्ष होनी चाहिए। | ||
बोल्ट्ज़मैन वितरण वह वितरण है जो [[एन्ट्रापी]] को अधिकतम करता है | बोल्ट्ज़मैन वितरण वह वितरण है जो [[एन्ट्रापी]] को अधिकतम करता है | ||
<math display=block>S(p_1,p_2,\cdots,p_M) = -\sum_{i=1}^{M} p_i\log_2 p_i</math> | <math display=block>S(p_1,p_2,\cdots,p_M) = -\sum_{i=1}^{M} p_i\log_2 p_i</math> | ||
सामान्यता नियमितता और शरीरिक माध्यम की औसत ऊर्जा मान के बराबर होने की शर्त के साथ। यह [[लैग्रेंज गुणक]] का उपयोग करके सिद्ध किया जा सकता है। | |||
यदि | यदि हमें उन स्थितियों की ऊर्जाओं को जानते हैं जो संबंधित प्रणाली के लिए उपलब्ध होती हैं, तो हम कैननिक पार्टीशन फ़ंक्शन की गणना कर सकते हैं। अणुओं के लिए, पार्टीशन फ़ंक्शन मानों को एनआईएसटी अणु स्पेक्ट्रा डेटाबेस में उपलब्ध होते हैं।<ref>[http://physics.nist.gov/PhysRefData/ASD/levels_form.html NIST Atomic Spectra Database Levels Form] at nist.gov</ref> | ||
वितरण | वितरण दिखाता है कि कम ऊर्जा वाली स्थितियों को हमेशा अधिक प्रायिकता होती है जबकि ऊर्जा वाली स्थितियों की प्रायिकता कम होती है। यह हमें दो स्थितियों की प्रायिकताओं के बीच की मात्रात्मक संबंध भी दे सकता है। स्थिति {{mvar|i}} और {{mvar|j}} की प्रायिकता के अनुपात को दिया जाता है | ||
<math display="block">\frac{p_i}{p_j} = \exp\left( \frac{\varepsilon_j - \varepsilon_i}{kT} \right)</math> | <math display="block">\frac{p_i}{p_j} = \exp\left( \frac{\varepsilon_j - \varepsilon_i}{kT} \right)</math> | ||
यहाँ: | |||
*{{mvar|p<sub>i</sub>}} | *{{mvar|p<sub>i</sub>}} स्थिति {{mvar|i}} की संभावना है , | ||
*{{mvar|p<sub>j</sub>}} | *{{mvar|p<sub>j</sub>}} स्थिति {{mvar|j}} की संभावना , | ||
*{{mvar|ε<sub>i</sub>}} | *{{mvar|ε<sub>i</sub>}} स्थिति {{mvar|i}} की ऊर्जा है , | ||
*{{mvar|ε<sub>j</sub>}} | *{{mvar|ε<sub>j</sub>}} स्थिति {{mvar|j}} की ऊर्जा है . | ||
ऊर्जा स्तरों की | ऊर्जा स्तरों की जनसंख्या का अनुपात भी उनकी [[अध:पतन (क्वांटम यांत्रिकी)]] को भी ध्यान में रखना जाता है । | ||
बोल्ट्जमान वितरण आमतौर पर कणों, जैसे अणु या अणुओं के वितरण को वर्णित करने के लिए उपयोग किया जाता है जो उनके लिए उपलब्ध बंधित स्थितियों पर होते हैं। यदि हमारे पास बहुत सारे कणों से मिलकर बनी प्रणाली है, तो कण {{mvar|i}} के स्थिति में कण की प्रायिकता वास्तव में यह प्रायिकता होती है कि हम उस प्रणाली से यादृच्छिक कण चुनते हैं और देखते हैं कि वह किस स्थिति में है। यह प्रायिकता स्थिति {{mvar|i}} में कणों की संख्या को प्रणाली में कुल कणों की संख्या से विभाजित करने के बराबर होती है, जो स्थिति {{mvar|i}} में निवास करने वाले कणों का अंश है। | |||
:<math>p_i = \frac{N_i}{N}</math> | :<math>p_i = \frac{N_i}{N}</math> | ||
यहाँ {{mvar|N<sub>i</sub>}} अवस्था {{mvar|i}} में कणों की संख्या है और {{mvar|N}} प्रणाली में कुल कणों की संख्या है। हम इस संभाव्यता को खोजने के लिए बोल्ट्ज़मान वितरण का उपयोग कर सकते हैं, जो कि हमने देखा है, स्थिति {{mvar|i}} में निवास करने वाले कणों की प्रायिकता के बराबर होती है। इसलिए, स्थिति की ऊर्जा के आधार पर स्थिति में कणों का अंश देने वाला समीकरण है <ref name="Atkins, P. W. 2010"/> | |||
<math display=block> | <math display=block> | ||
\frac{N_i}{N} = \frac{ \exp\left(- \frac{\varepsilon_i}{kT} \right) }{ \displaystyle \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) } | \frac{N_i}{N} = \frac{ \exp\left(- \frac{\varepsilon_i}{kT} \right) }{ \displaystyle \sum_{j=1}^{M} \exp\left(- \tfrac{\varepsilon_j}{kT} \right) } | ||
</math> | </math> | ||
यह समीकरण [[स्पेक्ट्रोस्कोपी]] के लिए बहुत महत्वपूर्ण है। | यह समीकरण [[स्पेक्ट्रोस्कोपी|वित्रोस्कोपी]] के लिए बहुत महत्वपूर्ण है। वित्रोस्कोपी में हम अणु या अणु के स्थिति से दूसरी स्थिति में संक्रमण करने वाली अणुओं की [[वर्णक्रमीय रेखा]] देखते हैं।<ref name="Atkins, P. W. 2010"/><ref>{{cite book |last1=Atkins |first1=P. W. |last2=de Paula |first2=J. |year=2009 |title=भौतिक रसायन|edition=9th |publisher=Oxford University Press |location=Oxford |isbn=978-0-19-954337-3 }}</ref> इसके लिए, पहली स्थिति में कुछ कण होना चाहिए जो संक्रमण करें। हम यह शर्त पूरी होने पर पाएंगे कि जो प्राथमिक स्थिति में कणों का अंश होना चाहिए। यदि यह उपयुक्त नहीं होता है, तो संक्रमण को संभावित रूप से तापमान के लिए गणना की गई है, वह रेखा अधिक संभावित रूप से देखी नहीं जाती है। सामान्यतः, प्राथमिक स्थिति में अधिकांश अणुओं का अंश दूसरी स्थिति में संक्रमणों की अधिक संख्या का कारण होता है।<ref>{{cite book |last1=Skoog |first1=D. A. |last2=Holler |first2=F. J. |last3=Crouch |first3=S. R. |year=2006 |title=वाद्य विश्लेषण के सिद्धांत|publisher=Brooks/Cole |location=Boston, MA |isbn=978-0-495-12570-9 }}</ref> इससे मजबूत स्पेक्ट्रल रेखा मिलती है। हालांकि, अनुमत या [[निषिद्ध संक्रमण]] के रूप में क्या होने वाले संक्रमण की प्रभावशीलता पर भी अन्य कारक प्रभाव डालते हैं। | ||
मशीन लर्निंग में सामान्यतः उपयोग किया जाने वाला [[सॉफ्टमैक्स फ़ंक्शन]] बोल्ट्ज़मैन वितरण से संबंधित है: | मशीन लर्निंग में सामान्यतः उपयोग किया जाने वाला [[सॉफ्टमैक्स फ़ंक्शन]] बोल्ट्ज़मैन वितरण से संबंधित है: | ||
| Line 73: | Line 73: | ||
== सामान्यीकृत बोल्ट्ज़मैन वितरण == | == सामान्यीकृत बोल्ट्ज़मैन वितरण == | ||
कुछ लेखकों द्वारा, निम्नलिखित रूप के वितरण को "सामान्य बोल्ट्जमान वितरण" कहा जाता है:<ref name="Gao2019">{{cite journal |last1= Gao |first1= Xiang |last2= Gallicchio |first2= Emilio |first3= Adrian |last3= Roitberg |date= 2019 |title= सामान्यीकृत बोल्ट्ज़मान वितरण एकमात्र वितरण है जिसमें गिब्स-शैनन एन्ट्रॉपी थर्मोडायनामिक एन्ट्रॉपी के बराबर होती है|url= https://aip.scitation.org/doi/abs/10.1063/1.5111333|journal= The Journal of Chemical Physics|volume= 151|issue= 3|pages= 034113|doi= 10.1063/1.5111333|pmid= 31325924 |arxiv= 1903.02121 |bibcode= 2019JChPh.151c4113G |s2cid= 118981017 |access-date= }}</ref> | |||
:<math>\Pr\left(\omega\right)\propto\exp\left[\sum_{\eta=1}^{n}\frac{X_{\eta}x_{\eta}^{\left(\omega\right)}}{k_{B}T}-\frac{E^{\left(\omega\right)}}{k_{B}T}\right]</math> | :<math>\Pr\left(\omega\right)\propto\exp\left[\sum_{\eta=1}^{n}\frac{X_{\eta}x_{\eta}^{\left(\omega\right)}}{k_{B}T}-\frac{E^{\left(\omega\right)}}{k_{B}T}\right]</math> | ||
बोल्ट्ज़मान वितरण सामान्यीकृत बोल्ट्ज़मान वितरण का विशेष स्थिति है। सामान्यीकृत बोल्ट्ज़मैन वितरण का उपयोग सांख्यिकीय यांत्रिकी में [[विहित पहनावा|विहित समूह]], [[भव्य विहित पहनावा|भव्य विहित समूह]] और तापीय-बारीय समूह का वर्णन करने के लिए किया जाता है। सामान्य बोल्ट्जमान वितरण आमतौर पर अधिकतम अनुपात के सिद्धान्त से प्राप्त किया जाता है, लेकिन अन्य निर्धारण भी हो सकते हैं।<ref name="Gao2019" /><ref name="Gao2022">{{cite journal |last1= Gao |first1= Xiang |date= March 2022 |title= एन्सेम्बल थ्योरी का गणित|url= https://www.sciencedirect.com/science/article/pii/S2211379722000390|journal= Results in Physics|volume= 34|pages= 105230|doi= 10.1016/j.rinp.2022.105230 |bibcode= 2022ResPh..3405230G |s2cid= 221978379 }}</ref> | |||
बोल्ट्ज़मान वितरण सामान्यीकृत बोल्ट्ज़मान वितरण का विशेष स्थिति है। सामान्यीकृत बोल्ट्ज़मैन वितरण का उपयोग सांख्यिकीय यांत्रिकी में [[विहित पहनावा]], [[भव्य विहित पहनावा]] और | |||
सामान्य बोल्ट्जमान वितरण के निम्नलिखित गुण होते हैं: | |||
* यह वितरण एकमात्र वितरण है जिसके लिए जिब्स एंट्रोपी सूत्र द्वारा परिभाषित [[एन्ट्रॉपी (शास्त्रीय थर्मोडायनामिक्स)]] में परिभाषित एन्ट्रॉपी से मेल खाती है।<ref name="Gao2019" /> | |||
*यह वितरण एकमात्र वितरण है जो [[मौलिक थर्मोडायनामिक संबंध|मानक थर्मोडायनामिक संबंध]] के अनुरूप है जहां स्थिति कार्यों को औसत द्वारा वर्णित किया जाता है।<ref name="Gao2022" /> | |||
==सांख्यिकीय यांत्रिकी में == | ==सांख्यिकीय यांत्रिकी में == | ||
{{main|कैनोनिकल एन्सेम्बल |मैक्सवेल-बोल्ट्ज़मैन आँकड़े}} | {{main|कैनोनिकल एन्सेम्बल |मैक्सवेल-बोल्ट्ज़मैन आँकड़े}} | ||
बोल्ट्जमान वितरण सांख्यिकीय मेकेनिक्स में प्रकट होता है जब बंद आवयविता वाली निर्धारित संघों को विचार किया जाता है जो ऊर्जा विनिमय के संबंध में थर्मल संतुलन में होते हैं (ऊर्जा विनिमय के संबंध में संतुलन)। सबसे सामान्य स्थिति कैननिक समूह के लिए प्रायिकता वितरण है। कुछ विशेष स्थिति (कैननिक समूह से प्राप्त किए जाने योग्य) विभिन्न पहलुओं में बोल्ट्जमान वितरण दिखाते हैं: | |||
; विहित | ; विहित समूह (सामान्य स्थिति ) | ||
: विहित | : विहित समूह ऊष्मा स्नान के साथ तापीय संतुलन में, निश्चित आयतन की बंद प्रणाली की विभिन्न संभावित स्थितियों की संभावनाएँ देता है। विहित समूह में बोल्ट्ज़मैन फॉर्म के साथ स्थिति संभाव्यता वितरण होता है। | ||
; उपप्रणालियों की स्थिति की [[सांख्यिकीय आवृत्ति]]याँ (गैर-अंतःक्रियात्मक संग्रह में) | ; उपप्रणालियों की स्थिति की [[सांख्यिकीय आवृत्ति]]याँ (गैर-अंतःक्रियात्मक संग्रह में) | ||
: जब रुचि की प्रणाली छोटे उपप्रणाली की कई गैर-अंतःक्रियात्मक प्रतियों का संग्रह होती है, तो संग्रह के बीच किसी दिए गए उपप्रणाली स्थिति की सांख्यिकीय आवृत्ति का पता लगाना कभी-कभी उपयोगी होता है। ऐसे संग्रह पर लागू होने पर विहित समुच्चय में पृथक्करण की संपत्ति होती है: जब तक गैर-अंतःक्रियात्मक उपप्रणालियों की संरचना निश्चित होती है, तब तक प्रत्येक उपप्रणाली की स्थिति दूसरों से स्वतंत्र होती है और विहित समुच्चय की विशेषता भी होती है। परिणामस्वरूप, उपप्रणाली स्थितियों के अपेक्षित मूल्य सांख्यिकीय आवृत्ति वितरण में बोल्ट्ज़मैन रूप होता है। | : जब रुचि की प्रणाली छोटे उपप्रणाली की कई गैर-अंतःक्रियात्मक प्रतियों का संग्रह होती है, तो संग्रह के बीच किसी दिए गए उपप्रणाली स्थिति की सांख्यिकीय आवृत्ति का पता लगाना कभी-कभी उपयोगी होता है। ऐसे संग्रह पर लागू होने पर विहित समुच्चय में पृथक्करण की संपत्ति होती है: जब तक गैर-अंतःक्रियात्मक उपप्रणालियों की संरचना निश्चित होती है, तब तक प्रत्येक उपप्रणाली की स्थिति दूसरों से स्वतंत्र होती है और विहित समुच्चय की विशेषता भी होती है। परिणामस्वरूप, उपप्रणाली स्थितियों के अपेक्षित मूल्य सांख्यिकीय आवृत्ति वितरण में बोल्ट्ज़मैन रूप होता है। | ||
| Line 97: | Line 93: | ||
चूँकि इन स्थितियों में मजबूत समानताएँ हैं, किन्तु इन्हें अलग करना मददगार है क्योंकि जब महत्वपूर्ण धारणाएँ बदल जाती हैं तो वे अलग-अलग विधियों से सामान्यीकरण करते हैं: | चूँकि इन स्थितियों में मजबूत समानताएँ हैं, किन्तु इन्हें अलग करना मददगार है क्योंकि जब महत्वपूर्ण धारणाएँ बदल जाती हैं तो वे अलग-अलग विधियों से सामान्यीकरण करते हैं: | ||
* जब कोई प्रणाली ऊर्जा विनिमय और कण विनिमय दोनों के संबंध में थर्मोडायनामिक संतुलन में होती है, तो निश्चित संरचना की आवश्यकता में छूट दी जाती है और विहित | * जब कोई प्रणाली ऊर्जा विनिमय और कण विनिमय दोनों के संबंध में थर्मोडायनामिक संतुलन में होती है, तो निश्चित संरचना की आवश्यकता में छूट दी जाती है और विहित समूह के अतिरिक्त भव्य विहित समूह प्राप्त होता है। दूसरी ओर, यदि संरचना और ऊर्जा दोनों निश्चित हैं, तो इसके स्थान पर [[माइक्रोकैनोनिकल पहनावा|माइक्रोकैनोनिकल]] समूह लागू होता है। | ||
* यदि किसी संग्रह के भीतर उपप्रणालियाँ एक-दूसरे के साथ परस्पर क्रिया करती हैं, तो उपप्रणाली स्थितियों की अपेक्षित आवृत्तियाँ अब बोल्ट्ज़मान वितरण का पालन नहीं करती हैं, और यहां तक कि उनका कोई [[विश्लेषणात्मक समाधान]] भी नहीं हो सकता है।<ref>A classic example of this is [[magnetic ordering]]. Systems of non-interacting [[Spin (physics)|spins]] show [[paramagnetic]] behaviour that can be understood with a single-particle canonical ensemble (resulting in the [[Brillouin function]]). Systems of ''interacting'' spins can show much more complex behaviour such as [[ferromagnetism]] or [[antiferromagnetism]].</ref> चूँकि , विहित | * यदि किसी संग्रह के भीतर उपप्रणालियाँ एक-दूसरे के साथ परस्पर क्रिया करती हैं, तो उपप्रणाली स्थितियों की अपेक्षित आवृत्तियाँ अब बोल्ट्ज़मान वितरण का पालन नहीं करती हैं, और यहां तक कि उनका कोई [[विश्लेषणात्मक समाधान]] भी नहीं हो सकता है।<ref>A classic example of this is [[magnetic ordering]]. Systems of non-interacting [[Spin (physics)|spins]] show [[paramagnetic]] behaviour that can be understood with a single-particle canonical ensemble (resulting in the [[Brillouin function]]). Systems of ''interacting'' spins can show much more complex behaviour such as [[ferromagnetism]] or [[antiferromagnetism]].</ref> चूँकि , विहित समूह अभी भी पूरे प्रणाली की सामूहिक अवस्थाओं पर लागू किया जा सकता है, बशर्ते कि पूरा प्रणाली थर्मल संतुलन में हो। | ||
* संतुलन में गैर-अंतःक्रियात्मक कणों की [[क्वांटम यांत्रिकी]] गैसों के साथ, किसी दिए गए एकल-कण अवस्था में पाए जाने वाले कणों की संख्या मैक्सवेल-बोल्ट्ज़मैन आंकड़ों का पालन नहीं करती है, और विहित समूह में क्वांटम गैसों के लिए कोई सरल बंद रूप अभिव्यक्ति नहीं है। भव्य विहित समूह में क्वांटम गैसों के राज्य-भरण आँकड़ों का वर्णन फर्मी-डिराक आँकड़ों या बोस-आइंस्टीन आँकड़ों द्वारा किया जाता है, जो इस बात पर निर्भर करता है कि कण क्रमशः [[फर्मियन]] या [[बोसॉन]] हैं। | * संतुलन में गैर-अंतःक्रियात्मक कणों की [[क्वांटम यांत्रिकी]] गैसों के साथ, किसी दिए गए एकल-कण अवस्था में पाए जाने वाले कणों की संख्या मैक्सवेल-बोल्ट्ज़मैन आंकड़ों का पालन नहीं करती है, और विहित समूह में क्वांटम गैसों के लिए कोई सरल बंद रूप अभिव्यक्ति नहीं है। भव्य विहित समूह में क्वांटम गैसों के राज्य-भरण आँकड़ों का वर्णन फर्मी-डिराक आँकड़ों या बोस-आइंस्टीन आँकड़ों द्वारा किया जाता है, जो इस बात पर निर्भर करता है कि कण क्रमशः [[फर्मियन]] या [[बोसॉन]] हैं। | ||
Revision as of 10:07, 18 July 2023
सांख्यिकीय यांत्रिकी और गणित में, बोल्ट्ज़मैन वितरण (जिसे गिब्स वितरण भी कहा जाता है[1]) संभाव्यता वितरण या संभाव्यता माप होता है, जो प्रणाली की निश्चित स्थिति में होने की प्रायिकता को उस स्थिति की ऊर्जा और प्रणाली के तापमान के फ़ंक्शन के रूप में देता है। वितरण को इस प्रकार व्यक्त किया जाता है:
यहाँ pi प्रणाली के स्थिति i में होने की प्रायिकता है, exp गणनात्मक फ़ंक्शन है, εi उस अवस्था की ऊर्जा है, और वितरण का स्थिरांक kT बोल्ट्जमान स्थिरांक k और थर्मोडायनामिक तापमान T का उत्पाद है। चिन्ह आनुपातिकता (गणित) को दर्शाता है (इसके लिए § प्रमाणितता का वितरण देखें)।
यहाँ प्रणाली शब्द का व्यापक अर्थ है; यह परमाणुओं की 'पर्याप्त संख्या' के संग्रह या एकल परमाणु तक हो सकता है[1] प्राकृतिक गैस भंडारण जैसी स्थूल प्रणाली के लिए होता है । इसलिए बोल्ट्ज़मैन वितरण का उपयोग विभिन्न प्रकार की समस्याओं को समाधान करने के लिए किया जा सकता है। वितरण दिखाता है कि कम ऊर्जा वाली स्थितियों का हमेशा अधिकार बनने की प्रायिकता होगी।
दो स्थितियों की संभावनाओं के अनुपात को 'बोल्ट्ज़मैन कारक' के रूप में जाना जाता है और यह विशेष रूप से केवल स्थितियों के ऊर्जा अंतर पर निर्भर करता है:
बोल्ट्ज़मैन वितरण का नाम लुडविग बोल्ट्ज़मान के नाम पर रखा गया है, जिन्होंने पहली बार 1868 में थर्मल संतुलन में गैसों के सांख्यिकीय यांत्रिकी के अध्ययन के समय इसे तैयार किया था।[2] बोल्ट्ज़मैन का सांख्यिकीय कार्य उनके पेपर "थर्मल इक्विलिब्रियम के लिए शर्तों के संबंध में गर्मी के यांत्रिक सिद्धांत के दूसरे मौलिक प्रमेय और संभाव्यता गणना के बीच संबंध पर" में सामने आया है।[3] यह वितरण बाद में जोशिया विलार्ड गिब्स द्वारा उसके मॉडर्न सामान्य रूप में विस्तार से जांचा गया।[4]
बोल्ट्ज़मैन वितरण को मैक्सवेल-बोल्ट्ज़मैन वितरण या मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी के साथ भ्रमित नहीं किया जाना चाहिए। ल्ट्जमान वितरण उस प्रायिकता को देता है जिसके रूप में प्रणाली निश्चित स्थिति में होने की प्रायिकता होती है,[5] जबकि मैक्सवेल-बोल्ट्ज़मैन वितरण आदर्श गैसों में कण गति या ऊर्जा की प्रायिकता देता है। चूँकि , एक-आयामी गैस में ऊर्जा का वितरण बोल्ट्ज़मैन वितरण का पालन करता है।
वितरण
बोल्ट्जमान वितरण प्रायिकता वितरण है जो निश्चित स्थिति की प्रायिकता देता है और जिसका आधार उस प्रणाली की ऊर्जा और प्रणाली के तापमान होता है जिस पर वितरण लागू होता है।[6] यह निम्नलिखित रूप में दिया गया है:[6]
- exp() गणितीय फलन है,
- pi स्थिति i की प्रायिकता है ,
- εi स्थिति i की ऊर्जा है ,
- k बोल्ट्ज़मैन स्थिरांक है,
- T प्रणाली का पूर्ण तापमान है,
- M ब्याज की प्रणाली के लिए सुलभ सभी स्थितियों की संख्या है,[6][5]
- Q (कुछ लेखकों द्वारा इसे Z दर्शाया गया है ) सामान्यीकरण विभाजक है, जो विहित विभाजन फ़ंक्शन हैयह इस शर्त से परिणामित होता है कि सभी उपलब्ध स्थितियों की प्रायिकताएं 1 के समकक्ष होनी चाहिए।
बोल्ट्ज़मैन वितरण वह वितरण है जो एन्ट्रापी को अधिकतम करता है
यदि हमें उन स्थितियों की ऊर्जाओं को जानते हैं जो संबंधित प्रणाली के लिए उपलब्ध होती हैं, तो हम कैननिक पार्टीशन फ़ंक्शन की गणना कर सकते हैं। अणुओं के लिए, पार्टीशन फ़ंक्शन मानों को एनआईएसटी अणु स्पेक्ट्रा डेटाबेस में उपलब्ध होते हैं।[7]
वितरण दिखाता है कि कम ऊर्जा वाली स्थितियों को हमेशा अधिक प्रायिकता होती है जबकि ऊर्जा वाली स्थितियों की प्रायिकता कम होती है। यह हमें दो स्थितियों की प्रायिकताओं के बीच की मात्रात्मक संबंध भी दे सकता है। स्थिति i और j की प्रायिकता के अनुपात को दिया जाता है
- pi स्थिति i की संभावना है ,
- pj स्थिति j की संभावना ,
- εi स्थिति i की ऊर्जा है ,
- εj स्थिति j की ऊर्जा है .
ऊर्जा स्तरों की जनसंख्या का अनुपात भी उनकी अध:पतन (क्वांटम यांत्रिकी) को भी ध्यान में रखना जाता है ।
बोल्ट्जमान वितरण आमतौर पर कणों, जैसे अणु या अणुओं के वितरण को वर्णित करने के लिए उपयोग किया जाता है जो उनके लिए उपलब्ध बंधित स्थितियों पर होते हैं। यदि हमारे पास बहुत सारे कणों से मिलकर बनी प्रणाली है, तो कण i के स्थिति में कण की प्रायिकता वास्तव में यह प्रायिकता होती है कि हम उस प्रणाली से यादृच्छिक कण चुनते हैं और देखते हैं कि वह किस स्थिति में है। यह प्रायिकता स्थिति i में कणों की संख्या को प्रणाली में कुल कणों की संख्या से विभाजित करने के बराबर होती है, जो स्थिति i में निवास करने वाले कणों का अंश है।
यहाँ Ni अवस्था i में कणों की संख्या है और N प्रणाली में कुल कणों की संख्या है। हम इस संभाव्यता को खोजने के लिए बोल्ट्ज़मान वितरण का उपयोग कर सकते हैं, जो कि हमने देखा है, स्थिति i में निवास करने वाले कणों की प्रायिकता के बराबर होती है। इसलिए, स्थिति की ऊर्जा के आधार पर स्थिति में कणों का अंश देने वाला समीकरण है [5]
मशीन लर्निंग में सामान्यतः उपयोग किया जाने वाला सॉफ्टमैक्स फ़ंक्शन बोल्ट्ज़मैन वितरण से संबंधित है:
सामान्यीकृत बोल्ट्ज़मैन वितरण
कुछ लेखकों द्वारा, निम्नलिखित रूप के वितरण को "सामान्य बोल्ट्जमान वितरण" कहा जाता है:[10]
बोल्ट्ज़मान वितरण सामान्यीकृत बोल्ट्ज़मान वितरण का विशेष स्थिति है। सामान्यीकृत बोल्ट्ज़मैन वितरण का उपयोग सांख्यिकीय यांत्रिकी में विहित समूह, भव्य विहित समूह और तापीय-बारीय समूह का वर्णन करने के लिए किया जाता है। सामान्य बोल्ट्जमान वितरण आमतौर पर अधिकतम अनुपात के सिद्धान्त से प्राप्त किया जाता है, लेकिन अन्य निर्धारण भी हो सकते हैं।[10][11]
सामान्य बोल्ट्जमान वितरण के निम्नलिखित गुण होते हैं:
- यह वितरण एकमात्र वितरण है जिसके लिए जिब्स एंट्रोपी सूत्र द्वारा परिभाषित एन्ट्रॉपी (शास्त्रीय थर्मोडायनामिक्स) में परिभाषित एन्ट्रॉपी से मेल खाती है।[10]
- यह वितरण एकमात्र वितरण है जो मानक थर्मोडायनामिक संबंध के अनुरूप है जहां स्थिति कार्यों को औसत द्वारा वर्णित किया जाता है।[11]
सांख्यिकीय यांत्रिकी में
बोल्ट्जमान वितरण सांख्यिकीय मेकेनिक्स में प्रकट होता है जब बंद आवयविता वाली निर्धारित संघों को विचार किया जाता है जो ऊर्जा विनिमय के संबंध में थर्मल संतुलन में होते हैं (ऊर्जा विनिमय के संबंध में संतुलन)। सबसे सामान्य स्थिति कैननिक समूह के लिए प्रायिकता वितरण है। कुछ विशेष स्थिति (कैननिक समूह से प्राप्त किए जाने योग्य) विभिन्न पहलुओं में बोल्ट्जमान वितरण दिखाते हैं:
- विहित समूह (सामान्य स्थिति )
- विहित समूह ऊष्मा स्नान के साथ तापीय संतुलन में, निश्चित आयतन की बंद प्रणाली की विभिन्न संभावित स्थितियों की संभावनाएँ देता है। विहित समूह में बोल्ट्ज़मैन फॉर्म के साथ स्थिति संभाव्यता वितरण होता है।
- उपप्रणालियों की स्थिति की सांख्यिकीय आवृत्तियाँ (गैर-अंतःक्रियात्मक संग्रह में)
- जब रुचि की प्रणाली छोटे उपप्रणाली की कई गैर-अंतःक्रियात्मक प्रतियों का संग्रह होती है, तो संग्रह के बीच किसी दिए गए उपप्रणाली स्थिति की सांख्यिकीय आवृत्ति का पता लगाना कभी-कभी उपयोगी होता है। ऐसे संग्रह पर लागू होने पर विहित समुच्चय में पृथक्करण की संपत्ति होती है: जब तक गैर-अंतःक्रियात्मक उपप्रणालियों की संरचना निश्चित होती है, तब तक प्रत्येक उपप्रणाली की स्थिति दूसरों से स्वतंत्र होती है और विहित समुच्चय की विशेषता भी होती है। परिणामस्वरूप, उपप्रणाली स्थितियों के अपेक्षित मूल्य सांख्यिकीय आवृत्ति वितरण में बोल्ट्ज़मैन रूप होता है।
- शास्त्रीय गैसों के मैक्सवेल-बोल्ट्ज़मैन आँकड़े (गैर-अंतःक्रियात्मक कणों की प्रणाली)
- कण प्रणालियों में, कई कण ही स्थान साझा करते हैं और नियमित रूप से दूसरे के साथ स्थान बदलते हैं; वे जिस एकल-कण अवस्था स्थान पर कब्जा करते हैं वह साझा स्थान है। मैक्सवेल-बोल्ट्ज़मैन आँकड़े संतुलन में गैर-अंतःक्रियात्मक कणों की शास्त्रीय यांत्रिकी गैस में दिए गए एकल-कण अवस्था में पाए जाने वाले कणों की अपेक्षित संख्या देते हैं। इस अपेक्षित संख्या वितरण में बोल्ट्ज़मैन फॉर्म है।
चूँकि इन स्थितियों में मजबूत समानताएँ हैं, किन्तु इन्हें अलग करना मददगार है क्योंकि जब महत्वपूर्ण धारणाएँ बदल जाती हैं तो वे अलग-अलग विधियों से सामान्यीकरण करते हैं:
- जब कोई प्रणाली ऊर्जा विनिमय और कण विनिमय दोनों के संबंध में थर्मोडायनामिक संतुलन में होती है, तो निश्चित संरचना की आवश्यकता में छूट दी जाती है और विहित समूह के अतिरिक्त भव्य विहित समूह प्राप्त होता है। दूसरी ओर, यदि संरचना और ऊर्जा दोनों निश्चित हैं, तो इसके स्थान पर माइक्रोकैनोनिकल समूह लागू होता है।
- यदि किसी संग्रह के भीतर उपप्रणालियाँ एक-दूसरे के साथ परस्पर क्रिया करती हैं, तो उपप्रणाली स्थितियों की अपेक्षित आवृत्तियाँ अब बोल्ट्ज़मान वितरण का पालन नहीं करती हैं, और यहां तक कि उनका कोई विश्लेषणात्मक समाधान भी नहीं हो सकता है।[12] चूँकि , विहित समूह अभी भी पूरे प्रणाली की सामूहिक अवस्थाओं पर लागू किया जा सकता है, बशर्ते कि पूरा प्रणाली थर्मल संतुलन में हो।
- संतुलन में गैर-अंतःक्रियात्मक कणों की क्वांटम यांत्रिकी गैसों के साथ, किसी दिए गए एकल-कण अवस्था में पाए जाने वाले कणों की संख्या मैक्सवेल-बोल्ट्ज़मैन आंकड़ों का पालन नहीं करती है, और विहित समूह में क्वांटम गैसों के लिए कोई सरल बंद रूप अभिव्यक्ति नहीं है। भव्य विहित समूह में क्वांटम गैसों के राज्य-भरण आँकड़ों का वर्णन फर्मी-डिराक आँकड़ों या बोस-आइंस्टीन आँकड़ों द्वारा किया जाता है, जो इस बात पर निर्भर करता है कि कण क्रमशः फर्मियन या बोसॉन हैं।
गणित में
अधिक सामान्य गणितीय सेटिंग्स में, बोल्ट्ज़मैन वितरण को गिब्स माप के रूप में भी जाना जाता है। सांख्यिकी और यंत्र अधिगम में, इसे लॉग-रैखिक मॉडल कहा जाता है। गहन शिक्षण में, बोल्ट्ज़मैन वितरण का उपयोग बोल्ट्ज़मान मशीन, प्रतिबंधित बोल्ट्ज़मैन मशीन, ऊर्जा आधारित मॉडल ऊर्जा-आधारित मॉडल और डीप बोल्ट्ज़मैन मशीन जैसे स्टोकेस्टिक तंत्रिका नेटवर्क के नमूना वितरण में किया जाता है। गहन शिक्षण में, बोल्ट्ज़मैन मशीन को बिना पर्यवेक्षित शिक्षण मॉडल में से माना जाता है। गहन शिक्षण में बोल्ट्ज़मैन मशीन के डिज़ाइन में, जैसे-जैसे नोड्स की संख्या बढ़ती है, वास्तविक समय अनुप्रयोगों में कार्यान्वयन की कठिनाई महत्वपूर्ण हो जाती है, इसलिए प्रतिबंधित बोल्ट्ज़मैन मशीन नामक अलग प्रकार की वास्तुकला प्रस्तुत की जाती है।
अर्थशास्त्र में
उत्सर्जन व्यापार में परमिट आवंटित करने के लिए बोल्ट्ज़मैन वितरण प्रारंभ किया जा सकता है।[13][14] बोल्ट्ज़मैन वितरण का उपयोग करने वाली नई आवंटन विधि कई देशों के बीच उत्सर्जन परमिट के सबसे संभावित, प्राकृतिक और निष्पक्ष वितरण का वर्णन कर सकती है।
बोल्ट्ज़मैन वितरण का रूप बहुराष्ट्रीय लॉजिस्टिक प्रतिगमन मॉडल के समान है। अलग विकल्प मॉडल के रूप में, यह अर्थशास्त्र में बहुत अच्छी प्रकार से जाना जाता है क्योंकि डेनियल मैकफैडेन ने यादृच्छिक उपयोगिता अधिकतमकरण से संबंध बनाया है।[15]
यह भी देखें
- बोस-आइंस्टीन आँकड़े
- फ़र्मी-डिराक आँकड़े
- नकारात्मक तापमान
- सॉफ्टमैक्स फ़ंक्शन
संदर्भ
- ↑ 1.0 1.1 Landau, Lev Davidovich & Lifshitz, Evgeny Mikhailovich (1980) [1976]. सांख्यिकीय भौतिकी. Course of Theoretical Physics. Vol. 5 (3 ed.). Oxford: Pergamon Press. ISBN 0-7506-3372-7. Translated by J.B. Sykes and M.J. Kearsley. See section 28
- ↑ Boltzmann, Ludwig (1868). "Studien über das Gleichgewicht der lebendigen Kraft zwischen bewegten materiellen Punkten" [Studies on the balance of living force between moving material points]. Wiener Berichte. 58: 517–560.
- ↑ "संग्रहीत प्रति" (PDF). Archived from the original (PDF) on 2021-03-05. Retrieved 2017-05-11.
- ↑ Gibbs, Josiah Willard (1902). सांख्यिकीय यांत्रिकी में प्राथमिक सिद्धांत. New York: Charles Scribner's Sons.
- ↑ 5.0 5.1 5.2 5.3 Atkins, P. W. (2010) Quanta, W. H. Freeman and Company, New York
- ↑ 6.0 6.1 McQuarrie, A. (2000). सांख्यिकीय यांत्रिकी. Sausalito, CA: University Science Books. ISBN 1-891389-15-7.
- ↑ NIST Atomic Spectra Database Levels Form at nist.gov
- ↑ Atkins, P. W.; de Paula, J. (2009). भौतिक रसायन (9th ed.). Oxford: Oxford University Press. ISBN 978-0-19-954337-3.
- ↑ Skoog, D. A.; Holler, F. J.; Crouch, S. R. (2006). वाद्य विश्लेषण के सिद्धांत. Boston, MA: Brooks/Cole. ISBN 978-0-495-12570-9.
- ↑ 10.0 10.1 10.2 Gao, Xiang; Gallicchio, Emilio; Roitberg, Adrian (2019). "सामान्यीकृत बोल्ट्ज़मान वितरण एकमात्र वितरण है जिसमें गिब्स-शैनन एन्ट्रॉपी थर्मोडायनामिक एन्ट्रॉपी के बराबर होती है". The Journal of Chemical Physics. 151 (3): 034113. arXiv:1903.02121. Bibcode:2019JChPh.151c4113G. doi:10.1063/1.5111333. PMID 31325924. S2CID 118981017.
- ↑ 11.0 11.1 Gao, Xiang (March 2022). "एन्सेम्बल थ्योरी का गणित". Results in Physics. 34: 105230. Bibcode:2022ResPh..3405230G. doi:10.1016/j.rinp.2022.105230. S2CID 221978379.
- ↑ A classic example of this is magnetic ordering. Systems of non-interacting spins show paramagnetic behaviour that can be understood with a single-particle canonical ensemble (resulting in the Brillouin function). Systems of interacting spins can show much more complex behaviour such as ferromagnetism or antiferromagnetism.
- ↑ Park, J.-W., Kim, C. U. and Isard, W. (2012) Permit allocation in emissions trading using the Boltzmann distribution. Physica A 391: 4883–4890
- ↑ The Thorny Problem Of Fair Allocation. Technology Review blog. August 17, 2011. Cites and summarizes Park, Kim and Isard (2012).
- ↑ Amemiya, Takeshi (1985). "Multinomial Logit Model". उन्नत अर्थमिति. Oxford: Basil Blackwell. pp. 295–299. ISBN 0-631-13345-3.