धातु एक्वा संकुल: Difference between revisions
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
[[रसायन विज्ञान]] में, धातु एक्वा संकुल [[समन्वय यौगिक]] होते हैं जिनमें धातु के आयन होते हैं जिनमें [[लिगेंड|संलग्नी]] के रूप में केवल [[पानी|जल]] होता है। ये संकुल धातु [[नाइट्रेट]], [[सल्फेट]] और [[perchlorate|परक्लोरेट]] जैसे कई धातु [[नमक (रसायन विज्ञान)|अम्ल (रसायन विज्ञान)]] के [[जलीय घोल]] में प्रमुख रासायनिक प्रजातियां हैं। उनके पास सामान्य [[स्तुईचिओमेटरी|रससमीकरणमिति]] {{chem2|[M(H2O)_{''n''}]^{''z''+} }} है। उनका व्यवहार [[पर्यावरण रसायन]] विज्ञान, जैव रसायन और [[औद्योगिक रसायन]] विज्ञान के कई पहलुओं को रेखांकित करता है। यह लेख उन संकुलों पर केंद्रित है जहां जल ही एकमात्र संलग्नी ([[होमोलेप्टिक]] सजल संकुल) है, लेकिन निश्चित रूप से कई संकुल सजल और अन्य संलग्नी के मिश्रण से बने होते हैं।<ref>Mark I. Ogden and Paul D. Beer "Water & ''O''-Donor Ligands" in Encyclopedia of Inorganic Chemistry, Wiley-VCH, 2006, Weinheim. {{doi|10.1002/0470862106.ia255}}</ref><ref>{{cite book |doi=10.1016/B0-08-043748-6/01055-0|chapter=Metal Aqua Ions|title=Comprehensive Coordination Chemistry II|year=2003|last1=Lincoln|first1=S.F.|last2=Richens|first2=D.T.|last3=Sykes|first3=A.G.|pages=515–555|isbn=9780080437484}}</ref> | |||
[[रसायन विज्ञान]] में, धातु | |||
| Line 6: | Line 5: | ||
=== षटक-सजल संकुल === | === षटक-सजल संकुल === | ||
[[Image:M(H2O)6 cation.png|thumb|170px|[[ऑक्टाहेड्रल आणविक ज्यामिति|अष्टभुजाकार आणविक ज्यामिति]] धातु | [[Image:M(H2O)6 cation.png|thumb|170px|[[ऑक्टाहेड्रल आणविक ज्यामिति|अष्टभुजाकार आणविक ज्यामिति]] धातु एक्वा संकुल की संरचना।]] | ||
[[File:Chromium (II) ion in aqueous solution.jpg|thumb|170px|जलीय घोल में क्रोमियम (II) आयन।]]सामान्य सूत्र {{chem2|[M(H2O)6]^{''n''+} }} के साथ अधिकांश सजल संकुल एककेंद्रक होते हैं, {{nowrap|1=''n'' = 2}} या 3 के साथ उनके पास एक अष्टभुजाकार आणविक ज्यामिति है। जल के अणु [[लुईस बेस|लूइस क्षारक]] के रूप में कार्य करते हैं, धातु आयन को अतिसूक्ष्म परमाणुों की एक जोड़ी दान करते हैं और इसके साथ मूल सहसंयोजक बंधन बनाते हैं। विशिष्ट उदाहरण निम्न तालिका में सूचीबद्ध हैं। | [[File:Chromium (II) ion in aqueous solution.jpg|thumb|170px|जलीय घोल में क्रोमियम (II) आयन।]]सामान्य सूत्र {{chem2|[M(H2O)6]^{''n''+} }} के साथ अधिकांश सजल संकुल एककेंद्रक होते हैं, {{nowrap|1=''n'' = 2}} या 3 के साथ उनके पास एक अष्टभुजाकार आणविक ज्यामिति है। जल के अणु [[लुईस बेस|लूइस क्षारक]] के रूप में कार्य करते हैं, धातु आयन को अतिसूक्ष्म परमाणुों की एक जोड़ी दान करते हैं और इसके साथ मूल सहसंयोजक बंधन बनाते हैं। विशिष्ट उदाहरण निम्न तालिका में सूचीबद्ध हैं। | ||
:{| class=wikitable style=text-align:center | :{| class=wikitable style=text-align:center | ||
| Line 148: | Line 147: | ||
===अम्ल-क्षार प्रतिक्रियाएँ=== | ===अम्ल-क्षार प्रतिक्रियाएँ=== | ||
जल के संलग्नी से प्रोटॉन के आयनीकरण के कारण धातु | जल के संलग्नी से प्रोटॉन के आयनीकरण के कारण धातु एक्वा संकुल के समाधान अम्लीय होते हैं। तनु घोल में क्रोमियम (III) सजल संकुल में pK<sub>a</sub>लगभग 4.3 एक अम्ल पृथक्करण स्थिरांक होता है|: | ||
:{{chem2|[Cr(H2O)6](3+) <-> [Cr(H2O)5(OH)](2+) + H+}} | :{{chem2|[Cr(H2O)6](3+) <-> [Cr(H2O)5(OH)](2+) + H+}} | ||
इस प्रकार, सजल आयन [[एसीटिक अम्ल|शौक्त्तिक अम्ल]] (pK<sub>a</sub> लगभग 4.8)। यह pK<sub>a</sub> त्रिसंयोजक आयनों की विशेषता है। अम्लता पर अतिसूक्ष्म परमाणुिक समाकृति का प्रभाव इस तथ्य से दिखाया गया है कि {{chem2|[Ru(H2O)6](3+)}} ({{nowrap|1=p''K''<sub>a</sub> = 2.7}}) से अधिक अम्लीय है {{chem2|[Rh(H2O)6](3+)}} ({{nowrap|1=p''K''<sub>a</sub> = 4}}), इस तथ्य के होने पर भी कि Rh(III) के अधिक विद्युतीय होने की उम्मीद है। यह प्रभाव pi-संदाता हाइड्रॉक्साइड संलग्नी (t<sub>2g</sub>)<sup>5</sup> Ru (III) केंद्र के स्थिरीकरण से संबंधित है।<ref name=Lincoln>{{cite book|first1=S. F. |last1=Lincoln|first2=D. T.|last2=Richens|first3=A. G.|last3=Sykes|title=Comprehensive Coordination Chemistry II|chapter=Metal Aqua Ions|series=Comprehensive Coordination Chemistry II | इस प्रकार, सजल आयन [[एसीटिक अम्ल|शौक्त्तिक अम्ल]] (pK<sub>a</sub> लगभग 4.8)। यह pK<sub>a</sub> त्रिसंयोजक आयनों की विशेषता है। अम्लता पर अतिसूक्ष्म परमाणुिक समाकृति का प्रभाव इस तथ्य से दिखाया गया है कि {{chem2|[Ru(H2O)6](3+)}} ({{nowrap|1=p''K''<sub>a</sub> = 2.7}}) से अधिक अम्लीय है {{chem2|[Rh(H2O)6](3+)}} ({{nowrap|1=p''K''<sub>a</sub> = 4}}), इस तथ्य के होने पर भी कि Rh(III) के अधिक विद्युतीय होने की उम्मीद है। यह प्रभाव pi-संदाता हाइड्रॉक्साइड संलग्नी (t<sub>2g</sub>)<sup>5</sup> Ru (III) केंद्र के स्थिरीकरण से संबंधित है।<ref name=Lincoln>{{cite book|first1=S. F. |last1=Lincoln|first2=D. T.|last2=Richens|first3=A. G.|last3=Sykes|title=Comprehensive Coordination Chemistry II|chapter=Metal Aqua Ions|series=Comprehensive Coordination Chemistry II | ||
Latest revision as of 15:51, 3 November 2023
रसायन विज्ञान में, धातु एक्वा संकुल समन्वय यौगिक होते हैं जिनमें धातु के आयन होते हैं जिनमें संलग्नी के रूप में केवल जल होता है। ये संकुल धातु नाइट्रेट, सल्फेट और परक्लोरेट जैसे कई धातु अम्ल (रसायन विज्ञान) के जलीय घोल में प्रमुख रासायनिक प्रजातियां हैं। उनके पास सामान्य रससमीकरणमिति [M(H2O)n]z+ है। उनका व्यवहार पर्यावरण रसायन विज्ञान, जैव रसायन और औद्योगिक रसायन विज्ञान के कई पहलुओं को रेखांकित करता है। यह लेख उन संकुलों पर केंद्रित है जहां जल ही एकमात्र संलग्नी (होमोलेप्टिक सजल संकुल) है, लेकिन निश्चित रूप से कई संकुल सजल और अन्य संलग्नी के मिश्रण से बने होते हैं।[1][2]
रससमीकरणमिति और संरचना
षटक-सजल संकुल
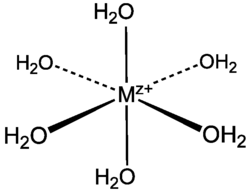
सामान्य सूत्र [M(H2O)6]n+ के साथ अधिकांश सजल संकुल एककेंद्रक होते हैं, n = 2 या 3 के साथ उनके पास एक अष्टभुजाकार आणविक ज्यामिति है। जल के अणु लूइस क्षारक के रूप में कार्य करते हैं, धातु आयन को अतिसूक्ष्म परमाणुों की एक जोड़ी दान करते हैं और इसके साथ मूल सहसंयोजक बंधन बनाते हैं। विशिष्ट उदाहरण निम्न तालिका में सूचीबद्ध हैं।
संमिश्र रंग अतिसूक्ष्म परमाणु विन्यास. M−O दूरी (Å)[3] जल विनिमय दर (s−1, 25 °C)[4]
M2+/3+ आत्म विनिमय दर (M−1s−1, 25 °C)
[Ti(H2O)6]3+ बैंगनी (t2g)1 2.025 1.8×105 — [[Vanadium(II) sulfate|[V(H2O)6]2+]] बैंगनी (t2g)3 2.12 8.7×101 तीव्र [[Vanadium(III) sulfate|[V(H2O)6]3+]] हरा (t2g)2 1.991[5] 5.0×102 तीव्र [[Chromium(II) sulfate|[Cr(H2O)6]2+]] नीला (t2g)3(eg)1 2.06 and 2.33 1.2×108 धीमा [[Chromium(III) sulfate|[Cr(H2O)6]3+]] बैंगनी (t2g)3 1.961 2.4×10−6 धीमा [[Manganese(II) sulfate|[Mn(H2O)6]2+]] क्षीण गुलाबी (t2g)3(eg)2 2.177 2.1×107 — [[Iron(II) sulfate|[Fe(H2O)6]2+]] क्षीण नीला-हरा (t2g)4(eg)2 2.095 4.4×106 तीव्र [[Iron(III) sulfate|[Fe(H2O)6]3+]] क्षीण बैंगनी (t2g)3(eg)2 1.990 1.6×102 तीव्र[6] [[Cobalt(II) sulfate|[Co(H2O)6]2+]] गुलाबी (t2g)5(eg)2 2.08 3.2×106 — [[Nickel(II) sulfate|[Ni(H2O)6]2+]] हरा (t2g)6(eg)2 2.05 3.2×104 — [[Copper(II) sulfate|[Cu(H2O)6]2+]] नीला (t2g)6(eg)3 1.97 and 2.30 5.7×109 — [[Zinc sulfate|[Zn(H2O)6]2+]] रंगहीन (t2g)6(eg)4 2.03-2.10 तीव्र —
टुटन के लवण सामान्य सूत्र (NH4)2M(SO4)2·(H2O)6 के साथ पारदर्शी यौगिक हैं (जहाँ M = V2+, Cr2+, Mn2+, Co2+, Ni2+, या Cu2+)। फिटकरी, MM′(SO4)2(H2O)12, दोहरा लवण भी हैं। लवण के दोनों सम्मुच्चयों में षटक-सजल धातु धनायन होते हैं।
चतुष्क-सजल संकुल
चांदी (I) [Ag(H2O)4]+ बनाती है, चतुष्फलकीय आण्विक ज्यामिति जलीय संकुल का एक दुर्लभ उदाहरण।[7]पैलेडियम (II) और प्लेटिनम (II) को एक बार वर्ग समतली आण्विक ज्यामिति सजल संकुल बनाने के लिए विचार गया था।[8]
ऑक्टा- और नोना- सजल संकुल
लैंथेनाइड (III) आयनों के सजल संकुल आठ- और नौ-समन्वयित हैं, जो धातु केंद्रों के बड़े आकार को दर्शाते हैं।
द्विपरमाणु-सजल संकुल
द्विकेंद्रकी आयन में [Co2(OH2)10]4+ प्रत्येक ब्रिजिंग जल अणु कोबाल्ट आयन को एक जोड़ी अतिसूक्ष्म परमाणु और दूसरे कोबाल्ट आयन को एक और जोड़ी देता है। Co-O आबंध की लंबाई 213 पिकोमीटर है, और Co-O (अवसानक) आबंध की लंबाई 10 pm कम है।[9]
संकुल [Mo2(H2O)8]4+ और [Rh2(H2O)10]4+ में धातु-धातु बंधन होते हैं।[7]
हाइड्रॉक्सो- और ऑक्सो- सजल आयनों के संकुल
ऑक्सीकरण अभिव्यक्त करता है कि +4 से +7 में Nb, Ta, Mo, W, Mn, Tc, Re, और Os के एकलकी एक्वा संकुल का प्रतिवेदन नहीं किया गया है।[8] उदाहरण के लिए, [Ti(H2O)6]4+ अज्ञात है: हाइड्रोलाइज्ड प्रजातियां [Ti(OH)2(H2O)n]2+ तनु विलयनों में प्रमुख प्रजाति है।[10] उच्च ऑक्सीकरण अभिव्यक्त करता है कि ऑक्सो-संकुल के गठन से धनायन पर प्रभावी विद्युत आवेश और कम हो जाता है।
लैंथेनाइड के सजल संकुल
लैंथेनाइड लवण प्रायः या संभवतः विशेष रूप से सजल संकुल बनाते हैं। होमोलेप्टिक ट्रिकेशनिक सजल संकुल में नौ जल संलग्नी होते हैं।[11]
प्रतिक्रियाएं
धातु सजल आयनों के व्यवहार के लिए मूलभूत मानी जाने वाली कुछ प्रतिक्रियाएं संलग्नी विनिमय, अतिसूक्ष्म परमाणु-स्थानांतरण और अम्ल क्षार प्रतिक्रियाएं हैं।
जल विनिमय
संलग्नी विनिमय में जल के संलग्नी (समन्वित जल) को समाधान (थोक जल) में जल के साथ बदलना सम्मिलित है। प्रायः प्रक्रिया को वर्गीकृत जल H2O·का उपयोग करके दर्शाया जाता है :[Ir(H2O)6]3+
समस्थानिक लेबलिंग के अभाव में, प्रतिक्रिया पतित होती है, जिसका अर्थ है कि मुक्त ऊर्जा परिवर्तन शून्य है।
परिमाण के कई आदेशों में दरें भिन्न होती हैं। दरों को प्रभावित करने वाला मुख्य कारक प्रभार है: अत्यधिक आवेशित धात्विक सजल धनायन एकल आवेशित धनायन की तुलना में अपने जल का आदान-प्रदान अधिक धीरे-धीरे करते हैं। इस प्रकार, [Na(H2O)6]+ और [Al(H2O)6]3 के लिए विनिमय दरें 109 के एक कारक से भिन्न होती हैं। अतिसूक्ष्म परमाणु विन्यास भी एक प्रमुख कारक है, जो इस तथ्य से स्पष्ट होता है कि जल विनिमय की दरें [Al(H2O)6]3+ और [Ir(H2O)6]3+ 109 के कारक से भी भिन्न होते हैं। [4] जल विनिमय सामान्यतः एक विघटनकारी प्रतिस्थापन मार्ग का अनुसरण करता है, इसलिए दर स्थिरांक पहले क्रम की प्रतिक्रियाओं का संकेत देते हैं
अतिसूक्ष्म परमाणु विनिमय
यह प्रतिक्रिया सामान्यतः di- और त्रिसंयोजक धातु आयनों के अंतर्संबंध पर लागू होती है, जिसमें केवल एक अतिसूक्ष्म परमाणु का आदान-प्रदान होता है। प्रक्रिया को स्व-विनिमय कहा जाता है, जिसका अर्थ है कि आयन स्वयं के साथ अतिसूक्ष्म परमाणु का आदान-प्रदान करता प्रतीत होता है। निम्नलिखित संतुलन के लिए मानक विद्युतद्वार क्षमता:
- [M(H2O)6]2+ + [M'(H2O)6]3+ ⇌ [M(H2O)6]3+ + [M'(H2O)6]2+
परमाणु संख्या बढ़ने पर निम्न ऑक्सीकरण अवस्था की बढ़ती स्थिरता को दर्शाता है। मैंगनीज युगल के लिए बहुत बड़ा मूल्य इस तथ्य का परिणाम है कि अष्टभुजाकार मैंगनीज (II) में शून्य स्फटिक क्षेत्र स्थिरीकरण ऊर्जा (CFSE) है लेकिन मैंगनीज (III) में CFSE की 3 इकाइयाँ हैं।[12]
धातुओं पके पथानुसरण के लिए वर्गीकरण का उपयोग करते हुए स्व-विनिमय प्रक्रिया को इस प्रकार लिखा जाता है:
अतिसूक्ष्म परमाणु विनिमय की दरें व्यापक रूप से भिन्न होती हैं, विभिन्न पुनर्गठन ऊर्जाओं के कारण होने वाली विविधताएं: जब 2+ और 3+ आयन संरचना में व्यापक रूप से भिन्न होते हैं, तो दरें धीमी होती हैं।[13] अतिसूक्ष्म परमाणु स्थानांतरण प्रतिक्रिया एक बाहरी क्षेत्र अतिसूक्ष्म परमाणु हस्तांतरण के माध्यम से आगे बढ़ती है। eg स्तर की जनसंख्या में कम से कम अष्टभुजाकार संकुलों के लिए परिवर्तन के साथ प्रायः बड़ी पुनर्गठन ऊर्जा जुड़ी होती है।
अम्ल-क्षार प्रतिक्रियाएँ
जल के संलग्नी से प्रोटॉन के आयनीकरण के कारण धातु एक्वा संकुल के समाधान अम्लीय होते हैं। तनु घोल में क्रोमियम (III) सजल संकुल में pKaलगभग 4.3 एक अम्ल पृथक्करण स्थिरांक होता है|:
- [Cr(H2O)6]3+ ⇌ [Cr(H2O)5(OH)]2+ + H+
इस प्रकार, सजल आयन शौक्त्तिक अम्ल (pKa लगभग 4.8)। यह pKa त्रिसंयोजक आयनों की विशेषता है। अम्लता पर अतिसूक्ष्म परमाणुिक समाकृति का प्रभाव इस तथ्य से दिखाया गया है कि [Ru(H2O)6]3+ (pKa = 2.7) से अधिक अम्लीय है [Rh(H2O)6]3+ (pKa = 4), इस तथ्य के होने पर भी कि Rh(III) के अधिक विद्युतीय होने की उम्मीद है। यह प्रभाव pi-संदाता हाइड्रॉक्साइड संलग्नी (t2g)5 Ru (III) केंद्र के स्थिरीकरण से संबंधित है।[7]
संकेंद्रित विलयनों में, कुछ धातु हाइड्रॉक्सो संकुल संघनन प्रतिक्रियाओं से पारित होते हैं, जिन्हें ओलेशन के रूप में जाना जाता है, जिससे बहुलक प्रजातियां बनती हैं। द्विसंयोजक धातु आयनों के सजल आयन त्रिसंयोजक धनायनों की तुलना में कम अम्लीय होते हैं।
हाइड्रोलाइज्ड प्रजातियां प्रायः अग्रदूत षटकक्वो संकुल से बहुत अलग गुण प्रदर्शित करती हैं। उदाहरण के लिए, [Al(H2O)5OH]2+ में जल विनिमय [Al(H2O)6]3+ की तुलना में 20000 गुना तीव्र है।
यह भी देखें
- जलयोजन संख्या
- संलग्नी क्षेत्र सिद्धांत
- धातु अमीन संकुल
संदर्भ
- ↑ Mark I. Ogden and Paul D. Beer "Water & O-Donor Ligands" in Encyclopedia of Inorganic Chemistry, Wiley-VCH, 2006, Weinheim. doi:10.1002/0470862106.ia255
- ↑ Lincoln, S.F.; Richens, D.T.; Sykes, A.G. (2003). "Metal Aqua Ions". Comprehensive Coordination Chemistry II. pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0. ISBN 9780080437484.
- ↑ For Mn(II), Fe(II), Fe(III):Sham, T. K.; Hastings, J. B.; Perlman, M. L. (1980). "Structure and Dynamic Behavior of Transition-Metal Ions in Aqueous Aolution: an EXAFS Study of Electron-Exchange Reactions". J. Am. Chem. Soc. 102 (18): 5904–5906. doi:10.1021/ja00538a033.. For Ti(III), V(III), Cr(III): Kallies, B.; Meier, R. (2001). "Electronic Structure of 3d [M(H2O)6]3+ Ions from ScIII to FeIII: A Quantum Mechanical Study Based on DFT Computations and Natural Bond Orbital Analyses". Inorg. Chem. 40 (13): 3101–3112. doi:10.1021/ic001258t. PMID 11399179.
- ↑ Helm, Lothar; Merbach, André E. (2005). "Inorganic and Bioinorganic Solvent Exchange Mechanisms". Chemical Reviews. 105 (6): 1923–1959. doi:10.1021/cr030726o. PMID 15941206.
- ↑ Cotton, F. A.; Fair, C. K.; Lewis, G. E.; Mott, G. N.; Ross, F. K.; Schultz, A. J.; Williams, J. M. (1984). "Precise Structural Characterizations of the Hexaaquovanadium(III) and Diaquohydrogen Ions. X-ray and Neutron Diffraction Studies of [V(H2O)6][H5O2](CF3SO3)4". Journal of the American Chemical Society. 106 (18): 5319–5323. doi:10.1021/ja00330a047.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Grant, M.; Jordan, R. B. (1981). "Kinetics of Solvent Water Exchange on Iron(III)". Inorganic Chemistry. 20: 55–60. doi:10.1021/ic50215a014.
- ↑ 7.0 7.1 7.2 Lincoln, S. F.; Richens, D. T.; Sykes, A. G. (2003). "Metal Aqua Ions". Comprehensive Coordination Chemistry II. Comprehensive Coordination Chemistry II. Vol. 1. pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0. ISBN 9780080437484.
- ↑ 8.0 8.1 Persson, Ingmar (2010). "Hydrated Metal Ions in Aqueous Solution: How Regular are Their Structures?". Pure and Applied Chemistry. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- ↑ Han, Yin-Feng; Li, Min; Wang, Tian-Wei; Li, Yi-Zhi; Shen, Zhen; Song, You; You, Xiao-Zeng (2008). "A Novel Microporous Hydrogen-Bonding Framework Constructed with Tetrathiafulvalene Tetracarboxylate Ligand: Synthesis, Structure and Magnetic Properties". Inorganic Chemistry Communications. 11 (9): 945–947. doi:10.1016/j.inoche.2008.04.028.
- ↑ Baes, C.F.; Mesmer, R.E. The Hydrolysis of Cations, (1976), Wiley, New York
- ↑ Parker, David; Dickins, Rachel S.; Puschmann, Horst; Crossland, Clare; Howard, Judith A. K. (2002). "Being Excited by Lanthanide Coordination Complexes: Aqua Species, Chirality, Excited-State Chemistry, and Exchange Dynamics". Chemical Reviews. 102 (6): 1977–2010. doi:10.1021/cr010452+. PMID 12059260.
- ↑ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. ISBN 0-85312-027-7. p. 236.
- ↑ Wilkins, R. G. (1991). Kinetics and Mechanism of Reactions of Transition Metal Complexes (2 ed.). Weinheim: VCH. ISBN 1-56081-125-0.

