सेंट्रोमेरे (गुणसूत्रबिंदु): Difference between revisions
No edit summary |
No edit summary |
||
| Line 80: | Line 80: | ||
=== एक्रोकेंट्रिक === | === एक्रोकेंट्रिक === | ||
एक एक्रोकेंट्रिक क्रोमोसोम का सेंट्रोमियर इस प्रकार से स्थित होता है कि क्रोमोसोम की एक भुजा दूसरे की तुलना में बहुत छोटी होती है। एक्रोकेंट्रिक में "एक्रो-" ग्रीक शब्द "पीक" के लिए संदर्भित करता है। [[मानव जीनोम|मानव]] [[मानव जीनोम|जीनोम]] में छह एक्रोकेंट्रिक गुणसूत्र सम्मिलित | एक एक्रोकेंट्रिक क्रोमोसोम का सेंट्रोमियर इस प्रकार से स्थित होता है कि क्रोमोसोम की एक भुजा दूसरे की तुलना में बहुत छोटी होती है। एक्रोकेंट्रिक में "एक्रो-" ग्रीक शब्द "पीक" के लिए संदर्भित करता है। [[मानव जीनोम|मानव]] [[मानव जीनोम|जीनोम]] में छह एक्रोकेंट्रिक गुणसूत्र सम्मिलित हैं।पांच ऑटोसोमल एक्रोसेंट्रिक क्रोमोसोम: [[गुणसूत्र 13 (मानव)|13]], [[गुणसूत्र 14 (मानव)|14]] , [[गुणसूत्र 15 (मानव)|15]], [[गुणसूत्र 21 (मानव)|21]], [[गुणसूत्र 22 (मानव)|22]] और [[वाई गुणसूत्र|वाई क्रोमोसोम]] भी एक्रोकेंट्रिक है। | ||
छोटी एक्रोसेंट्रिक p-भुजा में बहुत कम आनुवंशिक सामग्री होती है और बिना किसी महत्वपूर्ण हानि के ट्रांसलोकेशन किया जा सकता है, जैसा कि एक संतुलित [[रॉबर्ट्सोनियन अनुवाद]] में होता है। कुछ प्रोटीन कोडिंग जीन के अलावा, मानव एक्रोसेंट्रिक p-भुजा में [[न्यूक्लियोलस आयोजक क्षेत्र]] (NORs) भी होते हैं, जिनसे [[राइबोसोमल आरएनए|राइबोसोमल RNA]] का प्रतिलेखन होता है। चूंकि, सामान्य मानव दाताओं से सेल लाइनों और ऊतकों में एक्रोकेंट्रिक p-भुजा के अनुपात में पता लगाने योग्य एनओआर नहीं होते हैं।<ref>{{cite journal | vauthors = van Sluis M, van Vuuren C, Mangan H, McStay B | title = NORs on human acrocentric chromosome p-arms are active by default and can associate with nucleoli independently of rDNA | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 117 | issue = 19 | pages = 10368–10377 | date = May 2020 | pmid = 32332163 | pmc = 7229746 | doi = 10.1073/pnas.2001812117 | doi-access = free }}</ref> [[घोड़ा|घरेलू घोड़े]] के जीनोम में एक मेटाकेंट्रिक क्रोमोसोम सम्मिलित होता है जो कि दो एक्रोकेंट्रिक क्रोमोसोमों के समरूप होता है, लेकिन प्रेज़वल्स्की के घोड़े को असंबद्ध करता है। यह या तो घरेलू घोड़ों में एक संतुलित रॉबर्ट्सोनियन अनुवाद के निर्धारण को दर्शाता है या, इसके विपरीत, प्रेज़वल्स्की के घोड़ों में एक मेटासेंट्रिक गुणसूत्र के दो एक्रोकेंट्रिक गुणसूत्रों में विखंडन का निर्धारण। इसी प्रकार की स्थिति मानव और महान वानर जीनोम के बीच उपस्थित है, महान वानरों में दो एक्रोकेंट्रिक गुणसूत्रों की कमी के साथ मनुष्यों में एक मेटासेंट्रिक गुणसूत्र (एनीप्लोइडी और [[मानव गुणसूत्र 2]] देखें)। | छोटी एक्रोसेंट्रिक p-भुजा में बहुत कम आनुवंशिक सामग्री होती है और बिना किसी महत्वपूर्ण हानि के ट्रांसलोकेशन किया जा सकता है, जैसा कि एक संतुलित [[रॉबर्ट्सोनियन अनुवाद]] में होता है। कुछ प्रोटीन कोडिंग जीन के अलावा, मानव एक्रोसेंट्रिक p-भुजा में [[न्यूक्लियोलस आयोजक क्षेत्र]] (NORs) भी होते हैं, जिनसे [[राइबोसोमल आरएनए|राइबोसोमल RNA]] का प्रतिलेखन होता है। चूंकि, सामान्य मानव दाताओं से सेल लाइनों और ऊतकों में एक्रोकेंट्रिक p-भुजा के अनुपात में पता लगाने योग्य एनओआर नहीं होते हैं।<ref>{{cite journal | vauthors = van Sluis M, van Vuuren C, Mangan H, McStay B | title = NORs on human acrocentric chromosome p-arms are active by default and can associate with nucleoli independently of rDNA | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 117 | issue = 19 | pages = 10368–10377 | date = May 2020 | pmid = 32332163 | pmc = 7229746 | doi = 10.1073/pnas.2001812117 | doi-access = free }}</ref> [[घोड़ा|घरेलू घोड़े]] के जीनोम में एक मेटाकेंट्रिक क्रोमोसोम सम्मिलित होता है जो कि दो एक्रोकेंट्रिक क्रोमोसोमों के समरूप होता है, लेकिन प्रेज़वल्स्की के घोड़े को असंबद्ध करता है। यह या तो घरेलू घोड़ों में एक संतुलित रॉबर्ट्सोनियन अनुवाद के निर्धारण को दर्शाता है या, इसके विपरीत, प्रेज़वल्स्की के घोड़ों में एक मेटासेंट्रिक गुणसूत्र के दो एक्रोकेंट्रिक गुणसूत्रों में विखंडन का निर्धारण। इसी प्रकार की स्थिति मानव और महान वानर जीनोम के बीच उपस्थित है, महान वानरों में दो एक्रोकेंट्रिक गुणसूत्रों की कमी के साथ मनुष्यों में एक मेटासेंट्रिक गुणसूत्र (एनीप्लोइडी और [[मानव गुणसूत्र 2]] देखें)। | ||
| Line 95: | Line 95: | ||
=== एसेंट्रिक === | === एसेंट्रिक === | ||
एक एसेंट्रिक क्रोमोसोम एक क्रोमोसोम का टुकड़ा होता है जिसमें सेंट्रोमियर का अभाव होता है। चूंकि सेंट्रोमर्स कोशिका विभाजन में धुरी तंतुओं के लिए लगाव बिंदु हैं, इसलिए कोशिका विभाजन के समय | एक एसेंट्रिक क्रोमोसोम एक क्रोमोसोम का टुकड़ा होता है जिसमें सेंट्रोमियर का अभाव होता है। चूंकि सेंट्रोमर्स कोशिका विभाजन में धुरी तंतुओं के लिए लगाव बिंदु हैं, इसलिए कोशिका विभाजन के समय अनुजात कोशिकाओं को समान रूप से वितरित नहीं किया जाता है। परिणामस्वरुप, एक अनुजात सेल में एसेंट्रिक टुकड़े की कमी होगी और हानिकारक परिणाम हो सकते हैं। | ||
क्रोमोसोम-ब्रेकिंग इवेंट एसेंट्रिक क्रोमोसोम या एसेंट्रिक टुकड़े भी उत्पन्न कर सकते हैं। | क्रोमोसोम-ब्रेकिंग इवेंट एसेंट्रिक क्रोमोसोम या एसेंट्रिक टुकड़े भी उत्पन्न कर सकते हैं। | ||
| Line 101: | Line 101: | ||
=== डाइसेंट्रिक === | === डाइसेंट्रिक === | ||
एक [[डाइसेंट्रिक गुणसूत्र]] दो सेंट्रोमर्स वाला एक असामान्य क्रोमोसोम होता है, जो कोशिका विभाजन के माध्यम से अस्थिर हो सकता है। यह दो गुणसूत्र खंडों के बीच अनुवाद या संलयन के माध्यम से प्रत्येक एक सेंट्रोमियर के साथ बन सकता है। कुछ पुनर्व्यवस्थाएं डाइसेन्ट्रिक क्रोमोसोम और एसेंट्रिक टुकड़े दोनों का उत्पादन करती हैं जो माइटोसिस में स्पिंडल से नहीं जुड़ सकते हैं।<ref name=":01">{{Cite book|title = Thompson & Thompson Genetics in Medicine| vauthors = Nussbaum R, McInnes R, Willard H, Hamosh A |first4 = Ada|publisher = Saunders|year = 2007|isbn = 978-1-4160-3080-5|location = Philadelphia(PA)|pages = 72}}</ref> डाइसेंट्रिक गुणसूत्रों के निर्माण के लिए आनुवंशिक प्रक्रियाओं को उत्तरदायी ठहराया गया है, जैसे कि रॉबर्ट्सोनियन ट्रांसलोकेशन'''<ref name=":0">{{cite book|title=Thompson & Thompson Genetics in Medicine | edition = 7th |pages=62}}</ref>''' और पैरासेंट्रिक इनवर्जन<ref name=":5">{{cite book|title = Genetics From Genes to Genomes | edition = 4th | vauthors = Hartwell L, Hood L, Goldberg M, Reynolds A, Lee S |publisher = McGraw-Hill|year = 2011|isbn = 9780073525266|location = New York}}</ref>। डाइसेन्ट्रिक गुणसूत्रों में माइटोटिक स्थिरता सहित विभिन्न प्रकार के भाग्य हो सकते हैं।<ref name=":1">{{cite journal | vauthors = Lynch SA, Ashcroft KA, Zwolinski S, Clarke C, Burn J | title = Kabuki syndrome-like features in monozygotic twin boys with a pseudodicentric chromosome 13 | journal = Journal of Medical Genetics | volume = 32 | issue = 3 | pages = 227–230 | date = March 1995 | pmid = 7783176 | pmc = 1050324 | doi = 10.1136/jmg.32.3.227 }}</ref> कुछ स्थितियों में, उनकी स्थिरता कोशिका विभाजन के समय | एक [[डाइसेंट्रिक गुणसूत्र]] दो सेंट्रोमर्स वाला एक असामान्य क्रोमोसोम होता है, जो कोशिका विभाजन के माध्यम से अस्थिर हो सकता है। यह दो गुणसूत्र खंडों के बीच अनुवाद या संलयन के माध्यम से प्रत्येक एक सेंट्रोमियर के साथ बन सकता है। कुछ पुनर्व्यवस्थाएं डाइसेन्ट्रिक क्रोमोसोम और एसेंट्रिक टुकड़े दोनों का उत्पादन करती हैं जो माइटोसिस में स्पिंडल से नहीं जुड़ सकते हैं।<ref name=":01">{{Cite book|title = Thompson & Thompson Genetics in Medicine| vauthors = Nussbaum R, McInnes R, Willard H, Hamosh A |first4 = Ada|publisher = Saunders|year = 2007|isbn = 978-1-4160-3080-5|location = Philadelphia(PA)|pages = 72}}</ref> डाइसेंट्रिक गुणसूत्रों के निर्माण के लिए आनुवंशिक प्रक्रियाओं को उत्तरदायी ठहराया गया है, जैसे कि रॉबर्ट्सोनियन ट्रांसलोकेशन'''<ref name=":0">{{cite book|title=Thompson & Thompson Genetics in Medicine | edition = 7th |pages=62}}</ref>''' और पैरासेंट्रिक इनवर्जन<ref name=":5">{{cite book|title = Genetics From Genes to Genomes | edition = 4th | vauthors = Hartwell L, Hood L, Goldberg M, Reynolds A, Lee S |publisher = McGraw-Hill|year = 2011|isbn = 9780073525266|location = New York}}</ref>। डाइसेन्ट्रिक गुणसूत्रों में माइटोटिक स्थिरता सहित विभिन्न प्रकार के भाग्य हो सकते हैं।<ref name=":1">{{cite journal | vauthors = Lynch SA, Ashcroft KA, Zwolinski S, Clarke C, Burn J | title = Kabuki syndrome-like features in monozygotic twin boys with a pseudodicentric chromosome 13 | journal = Journal of Medical Genetics | volume = 32 | issue = 3 | pages = 227–230 | date = March 1995 | pmid = 7783176 | pmc = 1050324 | doi = 10.1136/jmg.32.3.227 }}</ref> कुछ स्थितियों में, उनकी स्थिरता कोशिका विभाजन के समय अनुजात कोशिकाओं को सामान्य संचरण के लिए सक्षम एक कार्यात्मक मोनोसेंट्रिक क्रोमोसोम बनाने के लिए दो सेंट्रोमर्स में से एक की निष्क्रियता से आती है। [https://doi.org/10.1007/s10577-012-9302-3 ] | ||
=== [[मोनोसेंट्रिक]] === | === [[मोनोसेंट्रिक]] === | ||
Revision as of 19:29, 19 February 2023

कोशिका विभाजन के समय सेंट्रोमियर सिस्टर क्रोमैटिड की एक जोड़ी को एक साथ जोड़ता है। गुणसूत्रों का यह संकुचित क्षेत्र सिस्टर क्रोमैटिड्स को जोड़ता है, क्रोमैटिड्स पर एक छोटी भुजा (p) और एक लंबी भुजा (q) बनाता है। माइटोसिस के समय, स्पिंडल फाइबर काइनेटोकोर के माध्यम से सेंट्रोमियर से जुड़ जाता है।
सेंट्रोमियर की भौतिक भूमिका गुणसूत्रबिंदुओं के असेंबली के स्थल के रूप में कार्य करना है - एक अत्यधिक जटिल मल्टीप्रोटीन संरचना जो क्रोमोसोम पृथक्रकरण की वास्तविक घटनाओं के लिए उत्तरदायी है - अर्थात सूक्ष्मनलिकाएं बांधना और सेल चक्र मशीनरी को संकेत देना जब सभी क्रोमोसोम सही होते हैं। स्पिंडल तंत्र से जुड़ाव, जिससे कोशिका विभाजन को पूरा करने के लिए आगे बढ़ना और कोशिकाओं के लिए एनाफ़ेज़ में प्रवेश करना सुरक्षित रहे।
मोटे तौर पर सेंट्रोमियर दो प्रकार के होते हैं। "प्वाइंट सेंट्रोमियर" विशिष्ट प्रोटीन से जुड़ते हैं जो उच्च दक्षता के साथ विशेष डीएनए न्यूक्लिक एसिड अनुक्रमों को पहचानते हैं। बिंदु सेंट्रोमियर डीएनए अनुक्रम के साथ डीएनए का कोई भी टुकड़ा सामान्यतः उपयुक्त प्रजातियों में उपस्थित होने पर सेंट्रोमियर का निर्माण कर सकता है। सबसे अच्छी विशेषता बिंदु सेंट्रोमर्स नवोदित यीस्ट, सैक्रोमाइसेस सेरेविसिया के हैं। क्षेत्रीय सेंट्रोमियर शब्द अधिकांश सेंट्रोमर्स का वर्णन करने के लिए गढ़ा गया है, जो सामान्यतः पसंदीदा डीएनए अनुक्रम के क्षेत्रों पर बनता है, किन्तु अन्य डीएनए अनुक्रमों पर भी बन सकता है। एक क्षेत्रीय सेंट्रोमियर के गठन का संकेत एपिजेनेटिक्स प्रतीत होता है। अधिकांश जीवों, विखंडन यीस्ट स्किज़ोसैक्रोमाइसेस पॉम्बे से लेकर मनुष्यों तक, में क्षेत्रीय सेंट्रोमियर होते हैं।
माइटोटिक क्रोमोसोम संरचना के संबंध में, सेंट्रोमर्स क्रोमोसोम के एक संकुचित क्षेत्र का प्रतिनिधित्व करते हैं (जिसे अधिकांशतः प्राथमिक कसना कहा जाता है) जहां दो समान सिस्टर क्रोमैटिड संपर्क में सबसे निकट होते हैं। जब कोशिकाएं माइटोसिस में प्रवेश करती हैं, तो सिस्टर क्रोमैटिड्स (क्रोमैटिन रूप में डीएनए प्रतिकृति से उत्पन्न प्रत्येक क्रोमोसोमल डीएनए अणु की दो प्रतियां) कोहेसिन परिसर की क्रिया द्वारा उनकी लंबाई के साथ जुड़ी होती हैं। अब यह माना जाता है कि प्रोफ़ेज़ के समय यह परिसर अधिकतर क्रोमोसोम भुजा्स से रिलीज़ होता है, जिससे जब तक क्रोमोसोम माइटोटिक स्पिंडल (जिसे मेटाफ़ेज़ प्लेट के रूप में भी जाना जाता है) के मध्य-तल पर पंक्तिबद्ध हो जाए, तो अंतिम स्थान जहाँ वे जुड़े होते हैं एक दूसरे के साथ क्रोमेटिन में और सेंट्रोमियर के आसपास होता है।
स्थिति

| I | Telocentric | सेंट्रोमियर प्लेसमेंट शीर्ष के बहुत निकट है, p शस्त्र कठिनाई से दिखाई देते हैं यदि बिल्कुल भी दिखाई दे। |
| II | अग्रकेंद्रिक | q भुजाएँ अभी भी p भुजाओं की तुलना में अधिक लंबी हैं, लेकिन p भुजाएँ टेलोसेंट्रिक की तुलना में अधिक लंबी हैं। |
| III | उप मेटासेंट्रिक | p और q भुजाएँ लंबाई में बहुत निकट हैं लेकिन समान नहीं हैं। |
| IV | मेटासेंट्रिक | p और q भुजाएँ लंबाई में बराबर होती हैं। |
B: सेंट्रोमियर
C: लांग भुजा (q भुजा)
D: सिस्टर क्रोमैटिड्स
मनुष्यों में, सेंट्रोमियर स्थिति क्रोमोसोमल कैरियोटाइप को परिभाषित करती है, जिसमें प्रत्येक क्रोमोसोम की दो भुजाएँ p (दो में से छोटी) और q (लंबी) होती हैं। छोटी भुजा 'p' कथित तौर पर फ्रांसीसी शब्द पेटिट के लिए नामित किया गया है जिसका अर्थ है 'छोटा'।[1] किसी विशेष रेखीय गुणसूत्र के सापेक्ष सेंट्रोमियर की स्थिति का उपयोग गुणसूत्रों को मेटासेंट्रिक, सबमेटेसेंट्रिक, एक्रोसेंट्रिक, टेलोसेंट्रिक या होलोसेंट्रिक के रूप में वर्गीकृत करने के लिए किया जाता है।[2][3]
| क्रोमियम का वर्गीकरण भुजाओं की आपेक्षिक लंबाई के अनुसार किया जाता है[3] | ||||||
| सेंट्रोमियर स्थिति | शस्त्र लंबाई अनुपात | चिह्न | विवरण | |||
| मेडियल सेंसु स्ट्रिक्टो | 1.0 – 1.6 | M | मेटासेंट्रिक | |||
| मध्य क्षेत्र | 1.7 | m | मेटासेंट्रिक | |||
| उपमध्यस्थ | 3.0 | sm | उप मेटासेंट्रिक | |||
| सबटर्मिनल | 3.1 – 6.9 | st | सबटेलोसेंट्रिक | |||
| टर्मिनल क्षेत्र | 7.0 | t | अग्रकेंद्रिक | |||
| टर्मिनल सेंसु स्ट्रिक्टो | ∞ | T | टेलोसेंट्रिक | |||
| टिप्पणियाँ | – | मेटासेंट्रिक: M+m | अटेलोसेंट्रिक: M+m+sm+st+t | |||
मेटासेंट्रिक
मेटाकेंट्रिक का अर्थ है कि सेंट्रोमियर क्रोमोसोम सिरों के बीच में स्थित होता है, जिसके परिणामस्वरूप भुजाएँ लंबाई में लगभग बराबर होती हैं। जब सेंट्रोमियर मेटासेंट्रिक होते हैं, तो क्रोमोसोम x-आकार के दिखाई देते हैं।
सबमेटासेंट्रिक
सबमेटासेंट्रिक का अर्थ है कि सेंट्रोमियर मध्य के नीचे स्थित होता है, जिसमें एक क्रोमोसोम बांह दूसरे से छोटा होता है, जिसके परिणामस्वरूप अधिकांशतः L आकार का होता है।
एक्रोकेंट्रिक
एक एक्रोकेंट्रिक क्रोमोसोम का सेंट्रोमियर इस प्रकार से स्थित होता है कि क्रोमोसोम की एक भुजा दूसरे की तुलना में बहुत छोटी होती है। एक्रोकेंट्रिक में "एक्रो-" ग्रीक शब्द "पीक" के लिए संदर्भित करता है। मानव जीनोम में छह एक्रोकेंट्रिक गुणसूत्र सम्मिलित हैं।पांच ऑटोसोमल एक्रोसेंट्रिक क्रोमोसोम: 13, 14 , 15, 21, 22 और वाई क्रोमोसोम भी एक्रोकेंट्रिक है।
छोटी एक्रोसेंट्रिक p-भुजा में बहुत कम आनुवंशिक सामग्री होती है और बिना किसी महत्वपूर्ण हानि के ट्रांसलोकेशन किया जा सकता है, जैसा कि एक संतुलित रॉबर्ट्सोनियन अनुवाद में होता है। कुछ प्रोटीन कोडिंग जीन के अलावा, मानव एक्रोसेंट्रिक p-भुजा में न्यूक्लियोलस आयोजक क्षेत्र (NORs) भी होते हैं, जिनसे राइबोसोमल RNA का प्रतिलेखन होता है। चूंकि, सामान्य मानव दाताओं से सेल लाइनों और ऊतकों में एक्रोकेंट्रिक p-भुजा के अनुपात में पता लगाने योग्य एनओआर नहीं होते हैं।[4] घरेलू घोड़े के जीनोम में एक मेटाकेंट्रिक क्रोमोसोम सम्मिलित होता है जो कि दो एक्रोकेंट्रिक क्रोमोसोमों के समरूप होता है, लेकिन प्रेज़वल्स्की के घोड़े को असंबद्ध करता है। यह या तो घरेलू घोड़ों में एक संतुलित रॉबर्ट्सोनियन अनुवाद के निर्धारण को दर्शाता है या, इसके विपरीत, प्रेज़वल्स्की के घोड़ों में एक मेटासेंट्रिक गुणसूत्र के दो एक्रोकेंट्रिक गुणसूत्रों में विखंडन का निर्धारण। इसी प्रकार की स्थिति मानव और महान वानर जीनोम के बीच उपस्थित है, महान वानरों में दो एक्रोकेंट्रिक गुणसूत्रों की कमी के साथ मनुष्यों में एक मेटासेंट्रिक गुणसूत्र (एनीप्लोइडी और मानव गुणसूत्र 2 देखें)।
असंतुलित ट्रांसलोकेशन के परिणाम से होने वाली कई बीमारियों में अन्य गैर-एक्रोसेंट्रिक क्रोमोसोम की तुलना में अधिक बार एक्रोसेंट्रिक क्रोमोसोम सम्मिलित होते हैं। एक्रोकेंट्रिक गुणसूत्र सामान्यतः न्यूक्लियस में और उसके आसपास स्थित होते हैं। परिणामस्वरूप ये गुणसूत्र परमाणु परिधि में गुणसूत्रों की तुलना में कम सघन रूप से भरे होते हैं। निरन्तर, क्रोमोसोमल क्षेत्र जो कम सघन रूप से भरे होते हैं, कैंसर में क्रोमोसोमल ट्रांसलोकेशन के लिए भी अधिक प्रवण होते हैं।
टेलीसेंट्रिक
टेलोसेंट्रिक क्रोमोसोम में क्रोमोसोम के एक छोर पर एक सेंट्रोमियर होता है और इसलिए साइटोलॉजिकल (सूक्ष्म) स्तर पर केवल एक हाथ का प्रदर्शन होता है। वे मानव में उपस्थित नहीं हैं किन्तु सेलुलर क्रोमोसोमल त्रुटियों के माध्यम से बना सकते हैं। टेलोसेंट्रिक क्रोमोसोम कई प्रजातियों में स्वाभाविक रूप से होते हैं, जैसे कि घर का चूहा, जिसमें Y को छोड़कर सभी क्रोमोसोम टेलोसेंट्रिक होते हैं।
सबटेलोसेंट्रिक
सबटेलोसेंट्रिक क्रोमोसोम के सेंट्रोमियर क्रोमोसोम के मध्य और अंत के बीच स्थित होते हैं, किन्तु क्रोमोसोम के अंत के निकट रहते हैं।
सेंट्रोमियर प्रकार
एसेंट्रिक
एक एसेंट्रिक क्रोमोसोम एक क्रोमोसोम का टुकड़ा होता है जिसमें सेंट्रोमियर का अभाव होता है। चूंकि सेंट्रोमर्स कोशिका विभाजन में धुरी तंतुओं के लिए लगाव बिंदु हैं, इसलिए कोशिका विभाजन के समय अनुजात कोशिकाओं को समान रूप से वितरित नहीं किया जाता है। परिणामस्वरुप, एक अनुजात सेल में एसेंट्रिक टुकड़े की कमी होगी और हानिकारक परिणाम हो सकते हैं।
क्रोमोसोम-ब्रेकिंग इवेंट एसेंट्रिक क्रोमोसोम या एसेंट्रिक टुकड़े भी उत्पन्न कर सकते हैं।
डाइसेंट्रिक
एक डाइसेंट्रिक गुणसूत्र दो सेंट्रोमर्स वाला एक असामान्य क्रोमोसोम होता है, जो कोशिका विभाजन के माध्यम से अस्थिर हो सकता है। यह दो गुणसूत्र खंडों के बीच अनुवाद या संलयन के माध्यम से प्रत्येक एक सेंट्रोमियर के साथ बन सकता है। कुछ पुनर्व्यवस्थाएं डाइसेन्ट्रिक क्रोमोसोम और एसेंट्रिक टुकड़े दोनों का उत्पादन करती हैं जो माइटोसिस में स्पिंडल से नहीं जुड़ सकते हैं।[5] डाइसेंट्रिक गुणसूत्रों के निर्माण के लिए आनुवंशिक प्रक्रियाओं को उत्तरदायी ठहराया गया है, जैसे कि रॉबर्ट्सोनियन ट्रांसलोकेशन[6] और पैरासेंट्रिक इनवर्जन[7]। डाइसेन्ट्रिक गुणसूत्रों में माइटोटिक स्थिरता सहित विभिन्न प्रकार के भाग्य हो सकते हैं।[8] कुछ स्थितियों में, उनकी स्थिरता कोशिका विभाजन के समय अनुजात कोशिकाओं को सामान्य संचरण के लिए सक्षम एक कार्यात्मक मोनोसेंट्रिक क्रोमोसोम बनाने के लिए दो सेंट्रोमर्स में से एक की निष्क्रियता से आती है। [1]
मोनोसेंट्रिक
मोनोसेंट्रिक क्रोमोसोम एक क्रोमोसोम होता है जिसमें एक क्रोमोसोम में केवल एक सेंट्रोमियर होता है और एक संकीर्ण कसना बनाता है।
पौधों और जानवरों में अत्यधिक दोहराव वाले डीएनए पर मोनोसेंट्रिक सेंट्रोमर्स सबसे सामान्य संरचना है।[9]
होलोसेंट्रिक
मोनोसेन्ट्रिक क्रोमोसोम के विपरीत, माइटोसिस में देखे जाने पर होलोसेंट्रिक क्रोमोसोम का कोई अलग प्राथमिक अवरोध नहीं होता है। इसके अतिरिक्त, स्पिंडल फाइबर क्रोमोसोम की लगभग पूरी (ग्रीक: होलो-) लंबाई के साथ संलग्न होते हैं। होलोसेंट्रिक क्रोमोसोम में सेंट्रोमेरिक प्रोटीन, जैसे CENPA (CenH3) पूरे क्रोमोसोम में फैले होते हैं।[10] नेमाटोड, कैनोर्हाडाइटिस एलिगेंस, होलोकेंट्रिक क्रोमोसोम वाले जीव का एक प्रसिद्ध उदाहरण है,[11] किन्तु इस प्रकार के सेंट्रोमियर यूकेरियोट्स में विभिन्न प्रजातियों, पौधों और जानवरों में पाए जा सकते हैं। होलोसेंट्रोमेरेस वास्तव में कई वितरित सेंट्रोमियर इकाइयों से बने होते हैं जो माइटोसिस के समय गुणसूत्रों के साथ एक रेखा जैसी संरचना बनाते हैं।[12] यौन प्रजनन के लिए व्यवहार्य युग्मकों या गैमेटोफाइट्स का उत्पादन करने के लिए आवश्यक समरूप गुणसूत्र युग्मन और पृथक्रकरण को प्राप्त करने के लिए वैकल्पिक या गैर-पारंपरिक रणनीतियों को अर्धसूत्रीविभाजन पर नियत किया जाता है।
अलग-अलग प्रजातियों में विभिन्न प्रकार के होलोसेंट्रोमर्स उपस्थित हैं, अर्थात् सेंट्रोमेरिक दोहराव वाले डीएनए अनुक्रमों के साथ या बिना और CENPA के साथ या बिना। विभिन्न हरे शैवाल, प्रोटोजोआ, अकशेरूकीय और विभिन्न पौधों के परिवारों में स्वतंत्र रूप से कम से कम 13 बार समग्रता विकसित हुई है।[13] मोनोसेंट्रिक प्रजातियों के विपरीत जहां कोशिका विभाजन के समय सामान्यतः एसेंट्रिक टुकड़े खो जाते हैं, होलोसेंट्रिक क्रोमोसोम का टूटना सामान्य स्पिंडल फाइबर अटैचमेंट साइट्स के साथ टुकड़े बनाता है।[14] इस कारण से, होलोसेंट्रिक क्रोमोसोम वाले जीव अधिक शीघ्रता से कैरियोटाइप भिन्नता विकसित कर सकते हैं, टूटने के स्थलों पर टेलोमेयर कैप के बाद के जोड़ के माध्यम से खंडित क्रोमोसोम को ठीक करने में सक्षम होते हैं।[15]
बहुकेंद्रित
मानव गुणसूत्र
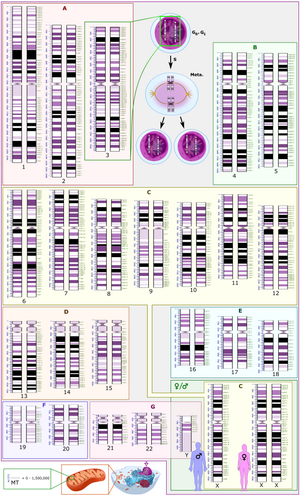
| क्रोमोसाम | गुणसूत्रबिंदु स्थिति (Mbp) |
वर्ग | क्रोमोसाम आकार (Mbp) |
सेंट्रोमियर आकार (Mbp) |
|---|---|---|---|---|
| 1 | 125.0 | मेटासेंट्रिक | 247.2 | 7.4 |
| 2 | 93.3 | उप मेटासेंट्रिक | 242.8 | 6.3 |
| 3 | 91.0 | मेटासेंट्रिक | 199.4 | 6.0 |
| 4 | 50.4 | उप मेटासेंट्रिक | 191.3 | — |
| 5 | 48.4 | उप मेटासेंट्रिक | 180.8 | — |
| 6 | 61.0 | उप मेटासेंट्रिक | 170.9 | — |
| 7 | 59.9 | उप मेटासेंट्रिक | 158.8 | — |
| 8 | 45.6 | उप मेटासेंट्रिक | 146.3 | — |
| 9 | 49.0 | उप मेटासेंट्रिक | 140.4 | — |
| 10 | 40.2 | उप मेटासेंट्रिक | 135.4 | — |
| 11 | 53.7 | उप मेटासेंट्रिक | 134.5 | — |
| 12 | 35.8 | उप मेटासेंट्रिक | 132.3 | — |
| 13 | 17.9 | अग्रकेंद्रिक | 114.1 | — |
| 14 | 17.6 | अग्रकेंद्रिक | 106.3 | — |
| 15 | 19.0 | अग्रकेंद्रिक | 100.3 | — |
| 16 | 36.6 | मेटासेंट्रिक | 88.8 | — |
| 17 | 24.0 | उप मेटासेंट्रिक | 78.7 | — |
| 18 | 17.2 | उप मेटासेंट्रिक | 76.1 | — |
| 19 | 26.5 | मेटासेंट्रिक | 63.8 | — |
| 20 | 27.5 | मेटासेंट्रिक | 62.4 | — |
| 21 | 13.2 | अग्रकेंद्रिक | 46.9 | — |
| 22 | 14.7 | अग्रकेंद्रिक | 49.5 | — |
| X | 60.6 | उप मेटासेंट्रिक | 154.9 | — |
| Y | 12.5 | अग्रकेंद्रिक | 57.7 | — |
आकार की माइक्रोग्राफिक विशेषताओं, सेंट्रोमियर की स्थिति और कभी-कभी क्रोमोसोमल उपग्रह की उपस्थिति के आधार पर, मानव गुणसूत्रों को निम्नलिखित समूहों में वर्गीकृत किया जाता है:[16]
| समूह | क्रोमोसोम | विशेषताएँ |
|---|---|---|
| समूह A | क्रोमोसाम 1-3 | विशाल, मेटासेंट्रिक और उप मेटासेंट्रिक |
| समूह B | क्रोमोसाम 4-5 | विशाल, उप मेटासेंट्रिक |
| समूह C | क्रोमोसाम 6-12, X | मध्यम-आकार, उप मेटासेंट्रिक |
| समूह D | क्रोमोसाम 13-15 | मध्यम-आकार, अग्रकेंद्रिक, उपग्रह के साथ |
| समूह E | क्रोमोसाम 16-18 | छोटा, मेटासेंट्रिक और उप मेटासेंट्रिक |
| समूह F | क्रोमोसाम 19-20 | बहुत छोटा, मेटासेंट्रिक |
| समूह G | क्रोमोसाम 21-22, Y | बहुत छोटा, अग्रकेंद्रिक, उपग्रह के साथ |
अनुक्रम
सेंट्रोमियर दो प्रकार के होते हैं।[17] क्षेत्रीय सेंट्रोमियर में, डीएनए अनुक्रम योगदान करते हैं किन्तु कार्य को परिभाषित नहीं करते हैं। क्षेत्रीय सेंट्रोमियर में बड़ी मात्रा में डीएनए होता है और अधिकांशतः हेट्रोक्रोमैटिन में पैक किया जाता है। अधिकांश यूकैर्योसाइटों में, सेंट्रोमियर के डीएनए अनुक्रम में दोहराए जाने वाले डीएनए (जैसे उपग्रह डीएनए) के बड़े सरणी होते हैं, जहां अलग-अलग दोहराने वाले तत्वों के अनुक्रम समान होते हैं किन्तु समान नहीं होते हैं। मनुष्यों में, प्राथमिक सेंट्रोमेरिक रिपीट यूनिट को α-सैटेलाइट (या अल्फॉइड) कहा जाता है, चूंकि इस क्षेत्र में कई अन्य अनुक्रम प्रकार पाए जाते हैं।[18] सेंट्रोमियर उपग्रह प्रजातियों के बीच शीघ्र से विकसित होते हैं, और जंगली चूहों में विश्लेषण से पता चलता है कि उपग्रह प्रतिलिपि संख्या और विषमता जनसंख्या उत्पत्ति और उप-प्रजातियों से संबंधित है।[19] इसके अतिरिक्त, अंतर्प्रजनन से उपग्रह अनुक्रम प्रभावित हो सकते हैं।[19]
प्वाइंट सेंट्रोमियर छोटे और अधिक सघन होते हैं। बिंदु सेंट्रोमर्स वाले जीवों में सेंट्रोमियर पहचान और कार्य को निर्दिष्ट करने के लिए डीएनए अनुक्रम आवश्यक और पर्याप्त दोनों हैं। नवोदित यीस्ट में, सेंट्रोमियर क्षेत्र अपेक्षाकृत छोटा (लगभग 125 बीपी डीएनए) होता है और इसमें दो उच्च संरक्षित डीएनए अनुक्रम होते हैं जो आवश्यक किनेटोकोर प्रोटीन के लिए बाध्यकारी साइटों के रूप में काम करते हैं।[18]
उत्तराधिकार
चूंकि सेंट्रोमेरिक डीएनए अनुक्रम मेटाज़ोन्स में सेंट्रोमेरिक पहचान का प्रमुख निर्धारक नहीं है, इसलिए यह माना जाता है कि सेंट्रोमियर को निर्दिष्ट करने में एपिजेनेटिक वंशानुक्रम एक प्रमुख भूमिका निभाता है।[20] संतति गुणसूत्र सेंट्रोमियरों को उसी स्थान पर एकत्रित करेंगे जहां माता-पिता गुणसूत्र अनुक्रम से स्वतंत्र होते हैं। यह प्रस्तावित किया गया है कि हिस्टोन H3 वैरिएंट CENP-A (सेंट्रोमेयर प्रोटीन A) सेंट्रोमियर का एपिजेनेटिक चिह्न है।[21] प्रश्न उठता है कि क्या अभी भी कुछ मूल विधि होनी चाहिए जिसमें सेंट्रोमियर निर्दिष्ट किया गया हो, तथापि इसे बाद में एपिजेनेटिक रूप से प्रचारित किया गया हो। यदि सेंट्रोमियर को एक पीढ़ी से दूसरी पीढ़ी तक एपिजेनेटिक रूप से विरासत में मिला है, तो समस्या को पहले मेटाज़ोन्स के मूल में वापस धकेल दिया जाता है।
दूसरी ओर, X गुणसूत्रों में सेंट्रोमर्स की तुलना के लिए धन्यवाद, इन क्षेत्रों में एपिजेनेटिक और संरचनात्मक विविधताएं देखी गई हैं। इसके अतिरिक्त, मानव जीनोम की एक हालिया असेंबली ने एक संभावित तंत्र का पता लगाया है कि αSat अनुक्रमों के लिए एक स्तरित विस्तार मॉडल के माध्यम से पेरीसेंट्रोमेरिक और सेंट्रोमेरिक संरचनाएं कैसे विकसित होती हैं। यह मॉडल प्रस्तावित करता है कि अलग-अलग αSat अनुक्रम समय-समय पर उभर कर आते हैं और एक सक्रिय सदिश के अंदर विस्तार करते हैं, पुराने अनुक्रमों को विस्थापित करते हैं, और कीनेटोकोर असेंबली की साइट बन जाते हैं। ΑSat उसी से, या विभिन्न सदिशों से उत्पन्न हो सकता है। जैसे-जैसे यह प्रक्रिया समय के साथ दोहराई जाती है, सक्रिय सेंट्रोमियर के किनारे की परतें सिकुड़ती और बिगड़ती जाती हैं। यह प्रक्रिया इस गतिशील विकासवादी प्रक्रिया और सेंट्रोमियर की स्थिति के बीच संबंध के बारे में प्रश्न उठाती है।[22]
संरचना
सेंट्रोमेरिक डीएनए सामान्य रूप से हेटरोक्रोमैटिन अवस्था में होता है, जो कोइसीन परिसर की भराई के लिए आवश्यक है जो डीएनए प्रतिकृति के बाद सिस्टर क्रोमैटिड सामंजस्य की मध्यस्थता करता है और साथ ही एनाफेज के समय सिस्टर क्रोमैटिड पृथक्करण का समन्वय करता है। इस क्रोमैटिन में, सामान्य हिस्टोन H3 को मनुष्यों में सेंट्रोमियर-विशिष्ट वैरिएंट, CENP-A से बदल दिया जाता है।[23] माना जाता है कि सेंट्रोमियर पर कीनेटोकोर की असेंबली के लिए CENP-A की उपस्थिति महत्वपूर्ण है। CENP-C को लगभग अनन्य रूप से CENP-A संबद्ध क्रोमैटिन के इन क्षेत्रों में स्थानीयकृत करने के लिए दिखाया गया है। मानव कोशिकाओं में, H4K20me3 और H3K9me3 के लिए हिस्टोन सबसे समृद्ध पाए जाते हैं,[24] जिन्हें हेटरोक्रोमैटिक संशोधनों के रूप में जाना जाता है। ड्रोसोफिला में, प्रतितत्वों के द्वीप सेंट्रोमियर के प्रमुख घटक हैं। रेफरी>Chang CH, Chavan A, Palladino J, Wei X, Martins NM, Santinello B, et al. (May 2019). "रेट्रोलेमेंट्स के द्वीप ड्रोसोफिला सेंट्रोमर्स के प्रमुख घटक हैं". PLOS Biology. 17 (5): e3000241. doi:10.1371/journal.pbio.3000241. PMC 6516634. PMID 31086362.</रेफरी>
स्किज़ोसैक्रोमाइसेस पॉम्बे यीस्ट में (और संभवतया अन्य यूकेरियोट्स में), सेंट्रोमेरिक हेटरोक्रोमैटिन का गठन आरएनएआई से जुड़ा हुआ है।
<रेफरी>Volpe TA, Kidner C, Hall IM, Teng G, Grewal SI, Martienssen RA (September 2002). "आरएनएआई द्वारा हेटेरोक्रोमैटिक साइलेंसिंग और हिस्टोन एच3 लाइसिन-9 मेथिलिकरण का विनियमन". Science. 297 (5588): 1833–1837. Bibcode:2002Sci...297.1833V. doi:10.1126/science.1074973. PMID 12193640. S2CID 2613813.</ रेफ> नेमाटोड में जैसे कि कैनोर्हाडाइटिस एलिगेंस, कुछ पौधे, और कीट ऑर्डर लेपिडोप्टेरा और हेमिप्टेरा, क्रोमोसोम होलोसेंट्रिक होते हैं, यह दर्शाता है कि सूक्ष्मनलिका संलग्नक या प्राथमिक कसना की प्राथमिक साइट नहीं है, और एक फैलाना कीनेटोकोर पूरे के साथ इकट्ठा होता है गुणसूत्र की लंबाई।
सेंट्रोमेरिक विपथन
दुर्लभ स्थितियों में, सेंट्रोमियर के पुनर्स्थापन के परिणामस्वरूप नियोसेंट्रोमियर क्रोमोसोम पर नई साइटों पर बना सकते हैं। यह घटना मानव नैदानिक अध्ययनों से सबसे अच्छी प्रकार से जानी जाती है और वर्तमान में 20 विभिन्न गुणसूत्रों पर पहचाने जाने वाले 90 से अधिक ज्ञात मानव नियोसेंट्रोमर्स हैं।[25][26] नियोसेंट्रोमियर के गठन को पिछले सेंट्रोमियर की निष्क्रियता के साथ जोड़ा जाना चाहिए, क्योंकि क्रोमोसोम दो कार्यात्मक सेंट्रोमर्स (डिकेंट्रिक क्रोमोसोम) के साथ माइटोसिस के समय क्रोमोसोम टूटना होगा। कुछ असामान्य स्थितियों में खंडित गुणसूत्रों पर अनायास मानव नियोसेंट्रोमर्स बनते देखे गए हैं। इन नए पदों में से कुछ मूल रूप से यूक्रोमैटिक थे और अल्फा उपग्रह डीएनए की पूरी प्रकार से कमी थी। नियोसेंट्रोमीयर में सामान्य सेंट्रोमियर में देखी जाने वाली दोहराव वाली संरचना की कमी होती है जो बताता है कि सेंट्रोमियर का गठन मुख्य रूप से एपिजेनेटिक रूप से नियंत्रित होता है।<रेफरी नाम= रोच्ची 59-67>Rocchi M, Archidiacono N, Schempp W, Capozzi O, Stanyon R (January 2012). "स्तनधारियों में सेंट्रोमियर का पुनर्स्थापन". Heredity. 108 (1): 59–67. doi:10.1038/hdy.2011.101. PMC 3238114. PMID 22045381.</रेफरी>[27] समय के साथ एक नियोसेंट्रोमियर दोहराए जाने वाले तत्वों को जमा कर सकता है और एक विकासवादी नए सेंट्रोमियर के रूप में जाना जाता है। प्राइमेट क्रोमोसोम में ऐसे कई प्रसिद्ध उदाहरण हैं जहां सेंट्रोमियर की स्थिति एक ही क्रोमोसोम के मानव सेंट्रोमियर से भिन्न होती है और इसे विकासवादी नए सेंट्रोमियर माना जाता है। सेंट्रोमियर रिपोजिशनिंग और विकासवादी नए सेंट्रोमर्स के गठन को जाति उद्भवन का एक तंत्र होने का सुझाव दिया गया है।[28]
सेंट्रोमियर प्रोटीन भी कुछ परमाणु-विरोधी एंटीबॉडी के लिए ऑटोएन्टीजेनिक टारगेट हैं, जैसे एंटी-सेंट्रोमियर एंटीबॉडीज।
विकार और रोग
यह ज्ञात है कि सेंट्रोमीयर मिसरेगुलेशन गुणसूत्रों के गलत पृथक्रकरण में योगदान देता है, जो कैंसर और गर्भपात से दृढ़ता से संबंधित है। विशेष रूप से, कई सेंट्रोमियर जीनों के ओवरएक्प्रेशन को कैंसर के घातक फेनोटाइप से जोड़ा गया है। इन सेंट्रोमियर जीनों के ओवरएक्प्रेशन से कैंसर में जीनोमिक अस्थिरता बढ़ सकती है। एक ओर उन्नत जीनोमिक अस्थिरता घातक फेनोटाइप से संबंधित है; दूसरी ओर, यह ट्यूमर कोशिकाओं को विशिष्ट सहायक चिकित्सा जैसे कि कुछ कीमोथेरपी और रेडियोथेरेपी के लिए अधिक संवेदनशील बनाता है।[29] सेंट्रोमियर दोहराव वाले डीएनए की अस्थिरता को हाल ही में कैंसर और उम्र बढ़ने में दिखाया गया है।[30]
सेंट्रोमेरिक डीएनए का पुनर्निर्माण
जब सेल चक्र के G1 चरण में सेंट्रोमर्स पर डीएनए क्षति होती है, तो कोशिकाएँ क्षतिग्रस्त साइट पर सजातीय क्रोमैटिड की अनुपस्थिति में भी समरूप पुनर्संयोजन, पुनर्निर्माण मशीनरी की भराई करने में सक्षम होती है। ऐसा प्रतीत होता है कि गलत उत्परिवर्तजन डीएनए पुनर्निर्माण मार्गों की सक्रियता को रोकने और सेंट्रोमेरिक अखंडता को बनाए रखने के लिए समजात पुनर्संयोजी, पुनर्निर्माण पूरे सेल चक्र में सेंट्रोमेरिक ब्रेक पर हो सकती है।[31][32]
यह भी देखें
संदर्भ
- ↑ "p + q = Solved, Being the True Story of How the Chromosome Got Its Name". 2011-05-03.
- ↑ "What different types of chromosomes exist?", Nikolay's Genetics Lessons, YouTube, 2013-10-12, archived from the original on 2021-12-11, retrieved 2017-05-28
- ↑ 3.0 3.1 Levan A, Fredga K, Sandberg AA (December 1964). "Nomenclature for centromeric position on chromosomes". Hereditas. 52 (2): 201–220. doi:10.1111/j.1601-5223.1964.tb01953.x.
- ↑ van Sluis M, van Vuuren C, Mangan H, McStay B (May 2020). "NORs on human acrocentric chromosome p-arms are active by default and can associate with nucleoli independently of rDNA". Proceedings of the National Academy of Sciences of the United States of America. 117 (19): 10368–10377. doi:10.1073/pnas.2001812117. PMC 7229746. PMID 32332163.
- ↑ Nussbaum R, McInnes R, Willard H, Hamosh A (2007). Thompson & Thompson Genetics in Medicine. Philadelphia(PA): Saunders. p. 72. ISBN 978-1-4160-3080-5.
- ↑ Thompson & Thompson Genetics in Medicine (7th ed.). p. 62.
- ↑ Hartwell L, Hood L, Goldberg M, Reynolds A, Lee S (2011). Genetics From Genes to Genomes (4th ed.). New York: McGraw-Hill. ISBN 9780073525266.
- ↑ Lynch SA, Ashcroft KA, Zwolinski S, Clarke C, Burn J (March 1995). "Kabuki syndrome-like features in monozygotic twin boys with a pseudodicentric chromosome 13". Journal of Medical Genetics. 32 (3): 227–230. doi:10.1136/jmg.32.3.227. PMC 1050324. PMID 7783176.
- ↑ Barra V, Fachinetti D (October 2018). "The dark side of centromeres: types, causes and consequences of structural abnormalities implicating centromeric DNA". Nature Communications. 9 (1): 4340. Bibcode:2018NatCo...9.4340B. doi:10.1038/s41467-018-06545-y. PMC 6194107. PMID 30337534.
- ↑ Neumann P, Navrátilová A, Schroeder-Reiter E, Koblížková A, Steinbauerová V, Chocholová E, et al. (2012). "Stretching the rules: monocentric chromosomes with multiple centromere domains". PLOS Genetics. 8 (6): e1002777. doi:10.1371/journal.pgen.1002777. PMC 3380829. PMID 22737088.
- ↑ Dernburg AF (June 2001). "Here, there, and everywhere: kinetochore function on holocentric chromosomes". The Journal of Cell Biology. 153 (6): F33–F38. doi:10.1083/jcb.153.6.F33. PMC 2192025. PMID 11402076.
- ↑ Marques A, Ribeiro T, Neumann P, Macas J, Novák P, Schubert V, et al. (November 2015). "Holocentromeres in Rhynchospora are associated with genome-wide centromere-specific repeat arrays interspersed among euchromatin". Proceedings of the National Academy of Sciences of the United States of America. 112 (44): 13633–13638. Bibcode:2015PNAS..11213633M. doi:10.1073/pnas.1512255112. PMC 4640781. PMID 26489653.
- ↑ Melters DP, Paliulis LV, Korf IF, Chan SW (July 2012). "Holocentric chromosomes: convergent evolution, meiotic adaptations, and genomic analysis". Chromosome Research. 20 (5): 579–593. doi:10.1007/s10577-012-9292-1. PMID 22766638. S2CID 3351527.
- ↑ Hughes-Schrader S, Ris H (August 1941). "The diffuse spindle attachment of coccids, verified by the mitotic behavior of induced chromosome fragments". Journal of Experimental Zoology (in English). 87 (3): 429–456. doi:10.1002/jez.1400870306. ISSN 0022-104X.
- ↑ Jankowska M, Fuchs J, Klocke E, Fojtová M, Polanská P, Fajkus J, et al. (December 2015). "Holokinetic centromeres and efficient telomere healing enable rapid karyotype evolution". Chromosoma. 124 (4): 519–528. doi:10.1007/s00412-015-0524-y. PMID 26062516. S2CID 2530401.
- ↑ Erwinsyah, R., Riandi, & Nurjhani, M. (2017). "Relevance of human chromosome analysis activities against mutation concept in genetics course. IOP Conference Series". Materials Science and Engineering. doi:10.1088/1757-899x/180/1/012285. S2CID 90739754.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Pluta AF, Mackay AM, Ainsztein AM, Goldberg IG, Earnshaw WC (December 1995). "The centromere: hub of chromosomal activities". Science. 270 (5242): 1591–1594. Bibcode:1995Sci...270.1591P. doi:10.1126/science.270.5242.1591. PMID 7502067. S2CID 44632550.
- ↑ 18.0 18.1 Mehta GD, Agarwal MP, Ghosh SK (August 2010). "Centromere identity: a challenge to be faced". Molecular Genetics and Genomics. 284 (2): 75–94. doi:10.1007/s00438-010-0553-4. PMID 20585957. S2CID 24881938.
- ↑ 19.0 19.1 Arora UP, Charlebois C, Lawal RA, Dumont BL (April 2021). "Population and subspecies diversity at mouse centromere satellites". BMC Genomics. 22 (1): 279. doi:10.1186/s12864-021-07591-5. PMC 8052823. PMID 33865332.
- ↑ Dalal Y (February 2009). "Epigenetic specification of centromeres". Biochemistry and Cell Biology. 87 (1): 273–282. doi:10.1139/O08-135. PMID 19234541.
- ↑ Bernad R, Sánchez P, Losada A (November 2009). "Epigenetic specification of centromeres by CENP-A". Experimental Cell Research. 315 (19): 3233–3241. doi:10.1016/j.yexcr.2009.07.023. PMID 19660450.
- ↑ Altemose, Nicolas; Logsdon, Glennis A.; Bzikadze, Andrey V.; Sidhwani, Pragya; Langley, Sasha A.; Caldas, Gina V.; Hoyt, Savannah J.; Uralsky, Lev; Ryabov, Fedor D.; Shew, Colin J.; Sauria, Michael E. G.; Borchers, Matthew; Gershman, Ariel; Mikheenko, Alla; Shepelev, Valery A. (April 2022). "Complete genomic and epigenetic maps of human centromeres". Science (in English). 376 (6588): eabl4178. doi:10.1126/science.abl4178. ISSN 0036-8075. PMC 9233505. PMID 35357911.
- ↑ Chueh AC, Wong LH, Wong N, Choo KH (January 2005). "Variable and hierarchical size distribution of L1-retroelement-enriched CENP-A clusters within a functional human neocentromere". Human Molecular Genetics. 14 (1): 85–93. doi:10.1093/hmg/ddi008. PMID 15537667.
- ↑ Rosenfeld JA, Wang Z, Schones DE, Zhao K, DeSalle R, Zhang MQ (March 2009). "मानव जीनोम के गैर-जीनिक भागों में समृद्ध हिस्टोन संशोधनों का निर्धारण". BMC Genomics. 10: 143. doi:10.1186/1471-2164-10-143. PMC 2667539. PMID 19335899.
- ↑ Marshall OJ, Chueh AC, Wong LH, Choo KH (February 2008). "Neocentromeres: new insights into centromere structure, disease development, and karyotype evolution". American Journal of Human Genetics. 82 (2): 261–282. doi:10.1016/j.ajhg.2007.11.009. PMC 2427194. PMID 18252209.
- ↑ Warburton PE (2004). "Chromosomal dynamics of human neocentromere formation". Chromosome Research. 12 (6): 617–626. doi:10.1023/B:CHRO.0000036585.44138.4b. PMID 15289667. S2CID 29472338.
- ↑ Tolomeo D, Capozzi O, Stanyon RR, Archidiacono N, D'Addabbo P, Catacchio CR, et al. (February 2017). "Epigenetic origin of evolutionary novel centromeres". Scientific Reports. 7 (1): 41980. Bibcode:2017NatSR...741980T. doi:10.1038/srep41980. PMC 5290474. PMID 28155877.
- ↑ Brown JD, O'Neill RJ (September 2010). "Chromosomes, conflict, and epigenetics: chromosomal speciation revisited". Annual Review of Genomics and Human Genetics. 11 (1): 291–316. doi:10.1146/annurev-genom-082509-141554. PMID 20438362.
- ↑ Zhang W, Mao JH, Zhu W, Jain AK, Liu K, Brown JB, Karpen GH (August 2016). "Centromere and kinetochore gene misexpression predicts cancer patient survival and response to radiotherapy and chemotherapy". Nature Communications. 7: 12619. Bibcode:2016NatCo...712619Z. doi:10.1038/ncomms12619. PMC 5013662. PMID 27577169.
- ↑ Giunta S, Funabiki H (February 2017). "Integrity of the human centromere DNA repeats is protected by CENP-A, CENP-C, and CENP-T". Proceedings of the National Academy of Sciences of the United States of America. 114 (8): 1928–1933. doi:10.1073/pnas.1615133114. PMC 5338446. PMID 28167779.
- ↑ Yilmaz D, Furst A, Meaburn K, Lezaja A, Wen Y, Altmeyer M, Reina-San-Martin B, Soutoglou E (December 2021). "G1 में सजातीय पुनर्संयोजन की सक्रियता सेंट्रोमेरिक अखंडता को संरक्षित करती है". Nature. 600 (7890): 748–753. Bibcode:2021Natur.600..748Y. doi:10.1038/s41586-021-04200-z. PMID 34853474. S2CID 244800481.</ रेफ> ऐसा प्रतीत होता है कि गलत उत्परिवर्ती डीएनए मरम्मत मार्गों के सक्रियण को रोकने और सेंट्रोमेरिक अखंडता को संरक्षित करने के लिए समरूप पुनर्संयोजन मरम्मत पूरे सेल चक्र में सेंट्रोमेरिक ब्रेक पर हो सकती है।
व्युत्पत्ति और उच्चारण
सेंट्रोमियर शब्द (/ˈsɛntrəˌmɪər/<ref>"Centromere". Merriam-Webster Dictionary.
- ↑ "Centromere". Dictionary.com Unabridged (Online). n.d.
अग्रिम पठन
- Mehta GD, Agarwal MP, Ghosh SK (August 2010). "Centromere identity: a challenge to be faced". Molecular Genetics and Genomics. 284 (2): 75–94. doi:10.1007/s00438-010-0553-4. PMID 20585957. S2CID 24881938.
- Lodish H, Berk A, Kaiser CA, Kaiser C, Krieger M, Scott MP, Bretscher A, Ploegh H, Matsudaira (2008). Molecular Cell Biology (6th ed.). New York: W.H. Freeman. ISBN 978-0-7167-7601-7.
- Nagaki K, Cheng Z, Ouyang S, Talbert PB, Kim M, Jones KM, et al. (February 2004). "Sequencing of a rice centromere uncovers active genes". Nature Genetics. 36 (2): 138–145. doi:10.1038/ng1289. PMID 14716315.
बाहरी संबंध
- "Rice Centromere, Supposedly Quiet Genetic Domain, Surprises". ScienceDaily (Press release). January 13, 2004.