आयरन-सल्फर प्रोटीन
आयरन-सल्फर प्रोटीन आयरन-सल्फर क्लस्टर्स की उपस्थिति वाले प्रोटीन होते हैं, जिनमें लोहे-लिंक्ड डी-, ट्राई- और टेट्रैरॉन केंद्र होते हैं जो चर ऑक्सीकरण राज्यों में पाए जाते हैं। आयरन-सल्फर क्लस्टर विभिन्न प्रकार के मेटालोप्रोटीन में होते हैं जैसे कि फेरेडॉक्सिन, साथ ही एनएडीएच डिनाइट्रोजनेस, हाइड्रोजनेस, कोएंजाइम क्यू-साइटोक्रोम सी रिडक्टेस, सक्सिनेट डिहाइड्रोजनेज।[1] माइटोकांड्रिया और क्लोरोप्लास्ट में इलेक्ट्रॉन परिवहन की ऑक्सीकरण-कमी प्रतिक्रियाओं में आयरन-सल्फर क्लस्टर अपनी भूमिका के लिए सबसे अच्छी तरह से जाने जाते हैं। ऑक्सीडेटिव फास्फारिलीकरण के कॉम्प्लेक्स I और कॉम्प्लेक्स II दोनों में कई Fe-S क्लस्टर हैं। जिनमें कटैलिसीस सम्मिलित हैं जैसा कि अकितासे द्वारा सचित्र किया गया है एस-एडेनोसिलमेथिओनिन-आश्रित एंजाइमों द्वारा सचित्र रेडिकल्स की पीढ़ी और लिपोइक एसिड और बायोटिन के जैवसंश्लेषण में सल्फर दाताओं के रूप में उनके पास कई अन्य कार्य हैं । इसके अतिरिक्त कुछ Fe-S प्रोटीन जीन अभिव्यक्ति को नियंत्रित करते हैं। Fe-S प्रोटीन बायोजेनिक नाइट्रिक ऑक्साइड द्वारा हमला करने के लिए कमजोर होते हैं, जिससे डिनिट्रोसिल आयरन कॉम्प्लेक्स बनते हैं। अधिकांश Fe-S प्रोटीनों में, Fe पर टर्मिनल लिगेंड थिओलेट होते हैं लेकिन अपवाद मौजूद हैं।[2]
अधिकांश जीवों के चयापचय मार्ग पर इन प्रोटीनों का प्रसार कुछ वैज्ञानिकों को यह सिद्धांत देने के लिए प्रेरित करता है कि लौह-सल्फर यौगिकों की लौह-सल्फर विश्व सिद्धांत में जीवन की उत्पत्ति में महत्वपूर्ण भूमिका थी।
संरचनात्मक रूपांकनों
लगभग सभी Fe-S प्रोटीनों में, Fe केंद्र चतुष्फलकीय होते हैं और टर्मिनल लिगेंड सिस्टीनिल अवशेषों से थिओलेटो सल्फर केंद्र होते हैं। लोहे समूह या तो दो या तीन-समन्वित हैं। इन विशेषताओं के साथ तीन अलग-अलग प्रकार के Fe-S क्लस्टर सबसे प्रचलित हैं।
संरचना-कार्य सिद्धांत
अपनी विभिन्न जैविक भूमिकाओं को पूरा करने के लिए लौह-सल्फर प्रोटीन तेजी से इलेक्ट्रॉन स्थानान्तरण को प्रभावित करते हैं और -600 mV से +460 mV तक शारीरिक रेडॉक्स क्षमता की पूरी श्रृंखला को फैलाते हैं।
आयरन-सल्फर प्रोटीन विभिन्न जैविक इलेक्ट्रॉन परिवहन प्रक्रियाओं में सम्मिलित होते हैं, जैसे प्रकाश संश्लेषण और सेलुलर श्वसन, जिसके लिए जीव की ऊर्जा या जैव रासायनिक आवश्यकताओं को बनाए रखने के लिए तेजी से इलेक्ट्रॉन हस्तांतरण की आवश्यकता होती है।
Fe3+-SR बॉन्ड में असामान्य रूप से उच्च सहसंयोजकता होती है जिसकी अपेक्षा की जाती है। Fe की सहसंयोजकता की तुलना करते समय Fe3+ की सहसंयोजकता के साथ, Fe3+ में Fe2+ की सहसंयोजकता लगभग (20% से 38.4%) दोगुनी होती है ।[3] Fe3+ भी Fe2+ की तुलना में बहुत अधिक स्थिर है। Fe2+ जैसे कठोर आयन3+ सामान्य रूप से कम सहसंयोजकता होती है क्योंकि धातु की ऊर्जा बेमेल सबसे कम खाली आणविक कक्षीय लिगैंड उच्चतम अधिकृत आणविक कक्षीय के साथ होती है।
सक्रिय साइट के निकटस्थ प्रोटीन द्वारा की स्थिति बाहरी H2O से HO-H-S-Cys H-बंधन है और यह H-बंधन Cys-S दाता से Fe 3+/2+ के लिए अलोन जोड़ी इलेक्ट्रॉन दान को कम करता है। इन बाहरी H2O के परिणामों को हटाने के लिए लियोफिलाइजेशन का उपयोग Fe-S सहसंयोजकता में वृद्धि करते हैं, जिसका अर्थ है कि H2O की सहसंयोजकता कम हो रही है क्योंकि HOH-S हाइड्रोजन-बंधन सल्फर इलेक्ट्रॉनों को खींचती है। चूंकि सहसंयोजकता Fe3+ को Fe2+ अधिक स्थिर करती है इसलिए Fe3+ HOH-S हाइड्रोजन-बंधन द्वारा अधिक अस्थिर है।
Fe3+ 3डी कक्षीय ऊर्जाएं "उलटा" बंधन योजना का पालन करती हैं, जो सौभाग्य से Fe3+d- कक्षकों को सल्फर 3p कक्षकों के साथ ऊर्जा में निकटता से मेल खाती हैं जो परिणामी बंधन आणविक कक्षीय में उच्च सहसंयोजकता प्रदान करती है।[4] यह उच्च सहसंयोजकता आंतरिक क्षेत्र पुनर्गठन ऊर्जा को कम करती है[4]और अंततः तेजी से इलेक्ट्रॉन हस्तांतरण में योगदान देता है।
2Fe–2S क्लस्टर
सबसे सरल बहुधात्विक प्रणाली [Fe2S2] क्लस्टर, दो लोहे के आयनों द्वारा गठित होता है जो दो लोहे आयनों द्वारा पाटा जाता है और चार सिस्टीनिल लिगैंड्स द्वारा समन्वित होता है (Fe2 S2 फेरेडॉक्सिन में) या दो सिस्टीन और दो हिस्टडीन (रिस्क प्रोटीन में) द्वारा समन्वित है। ऑक्सीकृत प्रोटीन में दो Fe3+ आयन होते हैं, जबकि कम प्रोटीन में एक Fe3+ और एक Fe2+ आयन होता है, ये प्रजातियाँ दो ऑक्सीकरण अवस्थाओं (FeIII)2 और FeIIIFeII में उपस्थित हैं सीडीजीएसएच आयरन सल्फर डोमेन भी 2Fe-2S क्लस्टर से जुड़ा है।
4Fe–4S क्लस्टर
एक सामान्य आकृति में चार लोहे के आयनों और चार लोहे आयनों को क्यूबन-प्रकार के क्लस्टर के कोने पर रखा गया है। Fe केंद्रों को प्रायः सिस्टीनिल लिगैंड्स द्वारा आगे समन्वित किया जाता है [Fe4S4] इलेक्ट्रॉन-स्थानांतरण प्रोटीन ([Fe4S4] फेरेडॉक्सिन) को आगे निम्न-क्षमता (जीवाणु-प्रकार) और HIPIP (उच्च-क्षमता) फेरेडॉक्सिन में उप-विभाजित किया जा सकता है निम्न- और उच्च-क्षमता वाले फेरेडॉक्सिन निम्नलिखित रेडॉक्स योजना से संबंधित हैं:
HIPIP में, क्लस्टर [2Fe3+, 2Fe2+] (Fe4S42+) और [3Fe3+, Fe2+] (Fe4S43+) के बीच शटल करता है।इस रेडॉक्स युगल की क्षमता 0.4 से 0.1 V तक होती है। जीवाणु फेरेडॉक्सिन में, ऑक्सीकरण अवस्थाओं की जोड़ी होती है [Fe3+, 3Fe2+] (Fe4S4+) और [2Fe3+, 2Fe2+] (Fe4S42+) हैं। इस रेडॉक्स युगल की क्षमता -0.3 से -0.7 वी तक है। 4Fe-4S समूहों के दो परिवार Fe4S42+ ऑक्सीकरण अवस्था साझा करते हैं । रेडॉक्स जोड़े में अंतर को हाइड्रोजन बंधन की डिग्री के लिए जिम्मेदार ठहराया जाता है, जो सिस्टीनिल थिओलेट लिगैंड्स की मौलिकता को दृढ़ता से संशोधित करता है।[citation needed] [उद्धरण वांछित] एक और रेडॉक्स युगल, जो अभी भी बैक्टीरियल फेरेडॉक्सिन की तुलना में अधिक कम कर रहा है, नाइट्रोजनेज में फंसा हुआ है।
कुछ 4Fe-4S क्लस्टर सबस्ट्रेट्स को बांधते हैं और इस प्रकार उन्हें एंजाइम कॉफ़ेक्टर्स के रूप में वर्गीकृत किया जाता है। एकोनिटेस में, Fe-S क्लस्टर एक Fe केंद्र पर एकोनाइट को बांधता है जिसमें थिओलेट लिगैंड की कमी होती है। क्लस्टर रेडॉक्स से नहीं गुजरता है, लेकिन साइट्रेट को आइसोसिट्रेट में बदलने के लिए लुईस एसिड उत्प्रेरक के रूप में कार्य करता है। रैडिकल एसएएम एंजाइमों में, क्लस्टर एक रैडिकल उत्पन्न करने के लिए एस-एडेनोसिलमेथिओनिन को बांधता है और कम करता है, जो कई जैवसंश्लेषण में सम्मिलित होता है।[5]
मिश्रित वैलेंस जोड़े (2 Fe3+ और 2 Fe2+) के साथ यहां दिखाए गए दूसरे क्यूबन में सहसंयोजक संचार से अधिक स्थिरता है और कम Fe2+ से "अतिरिक्त" इलेक्ट्रॉन का मजबूत सहसंयोजक डेलोकलाइज़ेशन है जिसके परिणामस्वरूप पूर्ण फेरोमैग्नेटिक युग्मन होता है।
3Fe–4S क्लस्टर
प्रोटीन में [Fe3S4] केंद्र भी पाया जाता है, जिनमें अधिक सामान्य [Fe4S4]कोर की तुलना में एक लोहा कम होता है । तीन लोहे आयन दो लोहे के आयनों को पुल करते हैं, जबकि चौथा लोहे तीन लोहे के आयनों को पुल करता है। उनकी औपचारिक ऑक्सीकरण अवस्थाएं [Fe3S4]+ (ऑल-Fe3+ फ़ॉर्म) से [Fe3S4]2− (ऑल-Fe2+ फ़ॉर्म)से भिन्न हो सकती हैं । कई आयरन-सल्फर प्रोटीन में, [Fe4S4] क्लस्टर को प्रतिवर्ती रूप से ऑक्सीकरण द्वारा परिवर्तित किया जा सकता है और एक लोहे के आयन को [Fe3S4] झुंड में खो दिया जा सकता है। उदाहरण के लिए, एकोनिटेज के निष्क्रिय रूप में एक [Fe3S4] और Fe2+ और रिडक्टेंट के योग से सक्रिय होता है।
अन्य Fe-S क्लस्टर
अधिक जटिल पॉलीमेटेलिक सिस्टम प्रचलित हैं उदाहरणों में नाइट्रोजिनेज़ में 8Fe और 7Fe क्लस्टर दोनों सम्मिलित हैं, कार्बन मोनोऑक्साइड डिहाइड्रोजनेज और [FeFe]-हाइड्रोजनेज में भी असामान्य Fe-S क्लस्टर होते हैं एक विशेष 6 सिस्टीन-समन्वित [Fe4S3] क्लस्टर ऑक्सीजन-सहिष्णु झिल्ली-बद्ध [NiFe] हाइड्रोजन गैसों में पाया गया।[6][7]
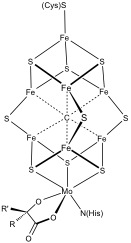
जैवसंश्लेषण
Fe-S समूहों के जैवसंश्लेषण का अच्छी तरह से अध्ययन किया गया है।[8][9][10]
एस्चेरिचिया कोली|ई बैक्टीरिया में लौह सल्फर समूहों के जैवजनन का सबसे व्यापक रूप से अध्ययन किया गया है। कोलाई और एज़ोटोबैक्टर विनलैंडी | ए। विनलैंडी और यीस्ट सैक्रोमाइसेस सेरेविसिया | एस। सेरेविसिया|अब तक कम से कम तीन अलग-अलग बायोसिंथेटिक सिस्टम की पहचान की गई है, अर्थात् एनआईएफ, एसयूएफ और आईएससी सिस्टम, जिन्हें पहले बैक्टीरिया में पहचाना गया था। एनआईएफ प्रणाली एंजाइम नाइट्रोजिनेस में समूहों के लिए जिम्मेदार है। suf और isc प्रणालियाँ अधिक सामान्य हैं।
यीस्ट आईएससी प्रणाली का सबसे अच्छा वर्णन किया गया है। कई प्रोटीन आईएससी मार्ग के माध्यम से बायोसिंथेटिक मशीनरी का निर्माण करते हैं। प्रक्रिया दो प्रमुख चरणों में होती है:(1) Fe/S क्लस्टर को पाड़ प्रोटीन पर इकट्ठा किया जाता है, और उसके बाद (2) प्राप्तकर्ता प्रोटीन को पूर्वनिर्मित क्लस्टर का स्थानांतरण किया जाता है। इस प्रक्रिया का पहला चरण प्रोकैरियोट जीवों के कोशिका द्रव्य या यूकेरियोट जीवों के माइटोकॉन्ड्रिया में होता है। उच्च जीवों में समूहों को इसलिए माइटोकॉन्ड्रियन से बाहर ले जाया जाता है ताकि एक्स्ट्रामाइटोकॉन्ड्रियल एंजाइम में सम्मिलित किया जा सके। इन जीवों में Fe/S क्लस्टर ट्रांसपोर्ट और निगमन प्रक्रियाओं में सम्मिलित प्रोटीन का एक सेट भी होता है जो प्रोकैरियोटिक सिस्टम में पाए जाने वाले प्रोटीन के अनुरूप नहीं होते हैं।
सिंथेटिक अनुरूप
स्वाभाविक रूप से पाए जाने वाले Fe-S समूहों के सिंथेटिक एनालॉग्स को सबसे पहले रिचर्ड एच. होल्म और सहकर्मियों द्वारा रिपोर्ट किया गया था।[11] थिओलेट्स और लोहे के मिश्रण के साथ लोहे के लवण का उपचार डेरिवेटिव प्रदान करता है जैसे (Et4N)2Fe4S4(SCH2Ph)4]।[12][13]
यह भी देखें
संदर्भ
- ↑ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ↑ Bak, D. W.; Elliott, S. J. (2014). "Alternative FeS cluster ligands: tuning redox potentials and chemistry". Curr. Opin. Chem. Biol. 19: 50–58. doi:10.1016/j.cbpa.2013.12.015. PMID 24463764.
- ↑ Sun, Ning; Dey, Abhishek; Xiao, Zhiguang; Wedd, Anthony G.; Hodgson, Keith O.; Hedman, Britt; Solomon, Edward I. (2010-08-20). "Solvation Effects on S K-Edge XAS Spectra of Fe−S Proteins: Normal and Inverse Effects on WT and Mutant Rubredoxin". Journal of the American Chemical Society. 132 (36): 12639–12647. doi:10.1021/ja102807x. ISSN 0002-7863. PMC 2946794. PMID 20726554.
- ↑ 4.0 4.1 Kennepohl, Pierre; Solomon, Edward I. (2003-01-16). "Electronic Structure Contributions to Electron-Transfer Reactivity in Iron−Sulfur Active Sites: 3. Kinetics of Electron Transfer". Inorganic Chemistry. 42 (3): 696–708. doi:10.1021/ic0203320. ISSN 0020-1669. PMID 12562183.
- ↑ Susan C. Wang; Perry A. Frey (2007). "S-adenosylmethionine as an oxidant: the radical SAM superfamily". Trends in Biochemical Sciences. 32 (3): 101–10. doi:10.1016/j.tibs.2007.01.002. PMID 17291766.
- ↑ Fritsch, J; Scheerer, P; Frielingsdorf, S; Kroschinsky, S; Friedrich, B; Lenz, O; Spahn, CMT (2011-10-16). "The crystal structure of an oxygen-tolerant hydrogenase uncovers a novel iron-sulphur centre". Nature. 479 (7372): 249–252. Bibcode:2011Natur.479..249F. doi:10.1038/nature10505. PMID 22002606. S2CID 4411671.
- ↑ Shomura, Y; Yoon, KS; Nishihara, H; Higuchi, Y (2011-10-16). "Structural basis for a [4Fe-3S] cluster in the oxygen-tolerant membrane-bound [NiFe]-hydrogenase". Nature. 479 (7372): 253–256. Bibcode:2011Natur.479..253S. doi:10.1038/nature10504. PMID 22002607. S2CID 4313414.
- ↑ Johnson D, Dean DR, Smith AD, Johnson MK (2005). "Structure, function and formation of biological iron–sulfur clusters". Annual Review of Biochemistry. 74 (1): 247–281. doi:10.1146/annurev.biochem.74.082803.133518. PMID 15952888.
- ↑ Johnson, M.K. and Smith, A.D. (2005) Iron–sulfur proteins in: Encyclopedia of Inorganic Chemistry (King, R.B., Ed.), 2nd edn, John Wiley & Sons, Chichester.
- ↑ Lill R, Mühlenhoff U (2005). "Iron–sulfur-protein biogenesis in eukaryotes". Trends in Biochemical Sciences. 30 (3): 133–141. doi:10.1016/j.tibs.2005.01.006. PMID 15752985.
- ↑ T. Herskovitz; B. A. Averill; R. H. Holm; J. A. Ibers; W. D. Phillips; J. F. Weiher (1972). "Structure and Properties of a Synthetic Analogue of Bacterial Iron-Sulfur Proteins". Proceedings of the National Academy of Sciences. 69 (9): 2437–2441. Bibcode:1972PNAS...69.2437H. doi:10.1073/pnas.69.9.2437. PMC 426959. PMID 4506765.
- ↑ Holm, R. H.; Lo, W. (2016). "Structural Conversions of Synthetic and Protein-Bound Iron-Sulfur Clusters". Chem. Rev. 116 (22): 13685–13713. doi:10.1021/acs.chemrev.6b00276. PMID 27933770.
- ↑ Lee, S. C.; Lo, W.; Holm, R. H. (2014). "Developments in the Biomimetic Chemistry of Cubane-Type and Higher Nuclearity Iron–Sulfur Clusters". Chemical Reviews. 114 (7): 3579–3600. doi:10.1021/cr4004067. PMC 3982595. PMID 24410527.
- Sticht, हेनरिक; Rösch, पॉल (1998-09-01). "आयरन-सल्फर प्रोटीन की संरचना". बायोफिज़िक्स और आणविक जीव विज्ञान में प्रगति (in English). 70 (2): 95–136. doi:10.1016/S0079-6107(98)00027-3. ISSN 0079-6107. PMID 9785959.
{{cite journal}}: Invalid|doi-access=मुक्त(help)
अग्रिम पठन
- बेइनर्ट, एच। (2000). "आयरन-सल्फर प्रोटीन: प्राचीन संरचनाएं, अभी भी आश्चर्य से भरी हैं". जे बायोल। इनऑर्ग। रसायन।. 5 (1): 2–15. doi:10.1007/s007750050002. PMID 10766431. S2CID 20714007.
- बेइनर्ट, एच।; केली, पी.जे. (1999). "संवेदन और नियामक कार्यों में Fe-S प्रोटीन". कुर. राय. रसायन. बायोल. 3 (2): 152–157. doi:10.1016/S1367-5931(99)80027-1. PMID 10226040.
- जॉनसन, एम.के. (1998). "लौह-सल्फर प्रोटीन: पुराने समूहों के लिए नई भूमिकाएँ". कुर. राय. रसायन. बायोल।. 2 (2): 173–181. doi:10.1016/S1367-5931(98)80058-6. PMID 9667933.
- इंटरनेशनल यूनियन ऑफ बायोकैमिस्ट्री (NC-IUB) की नामकरण समिति (1979). "आयरन-सल्फर प्रोटीन का नामकरण. सिफारिशें 1978". ईयूआर.जे बायोकेम. 93 (3): 427–430. doi:10.1111/j.1432-1033.1979.tb12839.x. PMID 421685.
{{cite journal}}: Invalid|doi-access=मुक्त(help) - नूडलमैन, एल., लोवेल, टी., लिउ, टी., हिमो, एफ. और टोरेस, आर.ए. (2002). "आयरन-सल्फर प्रोटीन के सरल समूहों से नाइट्रोजिनेज़ के गुणों और ऊर्जावान में अंतर्दृष्टि". कुर. राय. रसायन. बायोल. 6 (2): 259–273. doi:10.1016/S1367-5931(02)00309-5. PMID 12039013.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - स्पाइरो, टी.जी., एड. (1982). आयरन-सल्फर प्रोटीन. न्यूयॉर्क: विले. ISBN 0-471-07738-0.
{{cite book}}: CS1 maint: multiple names: authors list (link)
बाहरी संबंध
- आयरन-सल्फर+प्रोटीन at the US National Library of Medicine Medical Subject Headings (MeSH)
- Examples of iron-sulfur clusters



