हाइड्रोजन आयन
This article needs additional citations for verification. (October 2014) (Learn how and when to remove this template message) |
एक हाइड्रोजन आयन तब बनता है जब एक हाइड्रोजन परमाणु एक इलेक्ट्रॉन खोता या प्राप्त करता है। एक सकारात्मक रूप से आवेशित हाइड्रोजन आयन (या प्रोटॉन) आसानी से अन्य कणों के साथ संयोजन कर सकता है और इसलिए इसे केवल तभी पृथक देखा जाता है जब यह गैसीय अवस्था या लगभग कण-मुक्त स्थान में होता है।[1] लगभग 2×10 के अत्यधिक उच्च चार्ज घनत्व के कारणसोडियम आयन से 10 गुना अधिक मुक्त हाइड्रोजन आयन विलयन में स्वतंत्र रूप से मौजूद नहीं हो सकता क्योंकि यह आसानी से जलयोजित करता है, अर्थात जल्दी बंध जाता है।[2] हाइड्रोजन और इसके समस्थानिकों के सभी आयनों के लिए एक सामान्य शब्द के रूप में शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ द्वारा हाइड्रोजन आयन की सिफारिश की जाती है।[3] आयन के विद्युत आवेश के आधार पर, दो अलग-अलग वर्गों को प्रतिष्ठित किया जा सकता है: सकारात्मक रूप से आवेशित आयन और ऋणात्मक रूप से आवेशित आयन।
धनायन (सकारात्मक आवेशित)
एक हाइड्रोजन परमाणु +1 आवेश वाले एक नाभिक और एक इलेक्ट्रॉन से बना होता है। इसलिए, केवल सकारात्मक रूप से चार्ज किए गए आयन का चार्ज +1 है। उल्लेखनीय है कि एच+.
प्रश्न में आइसोटोप के आधार पर, हाइड्रोजन केशन के अलग-अलग नाम हैं:
- हाइड्रोन (रसायन विज्ञान): सामान्य नाम किसी भी हाइड्रोजन समस्थानिक (एच+)
- प्रोटॉन: 1एच+ (अर्थात हाइड्रोजन परमाणु का धनायन)
- ड्युटेरॉन: 2एच+, डी+
- ट्राइटन (भौतिकी): 3एच+, टी+
इसके अलावा, पानी के साथ-साथ उनके हाइड्रेट्स के साथ इन धनायनों की प्रतिक्रिया से उत्पन्न आयनों को हाइड्रोजन आयन कहा जाता है:
- हाइड्रोनियम आयन: एच3O+
- ज़ुंडेल कटियन : एच5O2+ (जॉर्ज ज़ुंडेल के नाम पर)
- खुद का धनायन: एच9O4+ (या एच{{sub|3}ओ+ •3ह2O) (मैनफ्रेड ईजेन के नाम पर)
ग्रोथस तंत्र के अनुसार, ज़ुंडेल केशन और ईजेन केशन प्रोटॉन प्रसार में महत्वपूर्ण भूमिका निभाते हैं।
एसिड के संबंध में, हाइड्रोजन आयन आमतौर पर हाइड्रोन को संदर्भित करते हैं।
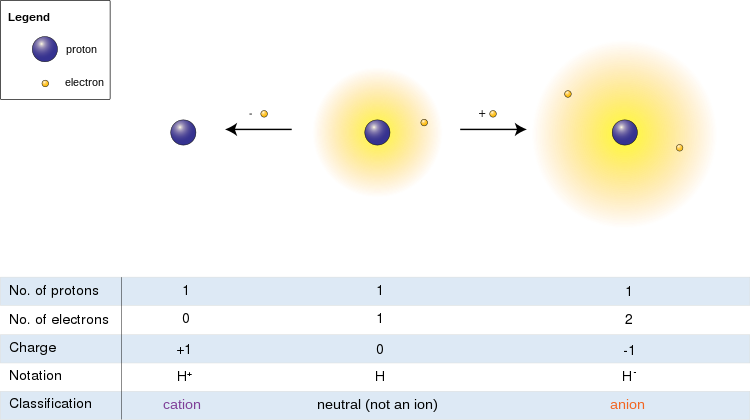
बाईं ओर की छवि में हाइड्रोजन परमाणु (केंद्र) में एक प्रोटॉन और एक इलेक्ट्रॉन होता है। इलेक्ट्रॉन को हटाने से एक धनायन (बाएं) मिलता है, जबकि एक इलेक्ट्रॉन के जुड़ने से एक ऋणायन (दाएं) मिलता है। हाइड्रोजन आयन, अपने ढीले-ढाले दो-इलेक्ट्रॉन बादल के साथ, तटस्थ परमाणु की तुलना में एक बड़ा त्रिज्या है, जो बदले में कटियन के नंगे प्रोटॉन से बहुत बड़ा है। हाइड्रोजन एकमात्र ऐसा धनायन बनाता है जिसमें कोई इलेक्ट्रॉन नहीं होता है, लेकिन यहां तक कि (हाइड्रोजन के विपरीत) अभी भी एक या एक से अधिक इलेक्ट्रॉनों को बनाए रखने वाले धनायन तटस्थ परमाणुओं या अणुओं से छोटे होते हैं जिनसे वे व्युत्पन्न होते हैं।
ऋणायन (नकारात्मक रूप से आवेशित)
अतिरिक्त इलेक्ट्रॉन प्राप्त होने पर हाइड्रोजन आयन बनते हैं:
- हाइड्राइड: सामान्य नाम किसी भी हाइड्रोजन समस्थानिक (H−)
- प्रोटाइड: 1एच-
- ड्युटेराइड : 2एच-, डी -
- ट्राइटाइड : 3एच-, टी -
उपयोग करता है
हाइड्रोजन आयन प्रकाश संश्लेषण में एटीपी सिंथेज़ चलाते हैं। ऐसा तब होता है जब हाइड्रोजन आयन झिल्ली के आर-पार धकेले जाते हैं जिससे थायलाकोइड झिल्ली के अंदर एक उच्च सांद्रता और साइटोप्लाज्म में कम सांद्रता बनती है। हालांकि, ऑस्मोसिस के कारण, एच+ एटीपी सिंथेज़ के माध्यम से खुद को झिल्ली से बाहर कर देगा। बचने के लिए अपनी गतिज ऊर्जा का उपयोग करते हुए, प्रोटॉन एटीपी सिंथेज़ को स्पिन करेंगे जो बदले में एडेनोसाइन ट्रायफ़ोस्फेट का निर्माण करेगा। यह सेलुलर श्वसन में भी होता है, हालांकि केंद्रित झिल्ली इसके बजाय माइटोकॉन्ड्रिया की आंतरिक झिल्ली होगी।
हाइड्रोजन आयनों की सांद्रता, जिसे पीएच के रूप में मापा जाता है, एक यौगिक की अम्लीय या बुनियादी (रसायन विज्ञान) प्रकृति के लिए भी जिम्मेदार है। पानी के अणु विभाजित होकर H बनाते हैं+ और हाइड्रोक्साइड आयन। इस प्रक्रिया को जल का स्व-आयनीकरण कहते हैं।
महासागर अम्लीकरण
हाइड्रोजन आयनों और पीएच की सांद्रता व्युत्क्रमानुपाती होती है; एक जलीय घोल में, हाइड्रोजन आयनों की बढ़ी हुई सांद्रता एक कम पीएच और बाद में एक अम्लीय उत्पाद उत्पन्न करती है। परिभाषा के अनुसार, एक एसिड एक आयन या अणु है जो एक प्रोटॉन दान कर सकता है, और जब एक समाधान के लिए पेश किया जाता है तो यह पानी के अणुओं (एचएच) के साथ प्रतिक्रिया करेगा।2O) हाइड्रोनियम आयन बनाने के लिए (H3O+), पानी का एक संयुग्मित अम्ल।[4] सरलीकृत तर्क के लिए, हाइड्रोजन आयन (H+) अक्सर हाइड्रोनियम आयन को संक्षिप्त करने के लिए प्रयोग किया जाता है।
कार्बन डाइऑक्साइड (सीओ) के महत्वपूर्ण अवशोषण से हाइड्रोजन आयनों और कार्बोनेट संतृप्ति की उच्च सांद्रता का प्रत्यक्ष परिणाम महासागर अम्लीकरण है।2) दुनिया के महासागरों द्वारा।[5] समुद्र के कार्बोनेट रसायन की पूर्व-औद्योगिक स्थिति उल्लेखनीय रूप से स्थिर रही है, जिसमें इसके पीएच का संतुलन भी शामिल है।[6] औद्योगिक क्रांति के बाद, जलते हुए जीवाश्म ईंधन के मानवजनित उत्सर्जन, सीमेंट उत्पादन और भूमि उपयोग में परिवर्तन ने महासागरों को वायुमंडल से कार्बन डाइऑक्साइड के अवशोषण में 30% की वृद्धि की है।[7] समुद्र में नीला कार्बन वातावरण की तुलना में 59 गुना अधिक है;[8] महासागर ग्रह पर सबसे बड़े कार्बन सिंक के रूप में कार्य करता है, जो जलवायु नियमन में महत्वपूर्ण भूमिका निभाता है।[9] कार्बन फ्लक्स के अलावा, वातावरण से गहरे समुद्र में कार्बन पृथक्करण की प्राकृतिक प्रक्रिया को दो प्रणालियों, जैविक पंप और घुलनशीलता पंप द्वारा सुगम बनाया जाता है। घुलनशीलता पंप एक भौतिक-रासायनिक प्रक्रिया है जो सीओ को स्थानांतरित करती है2 हवा-समुद्र इंटरफेस पर।[10] हेनरी के नियम के आधार पर, भंग CO की मात्रा2 एक जलीय घोल में सीओ के आंशिक दबाव के सीधे आनुपातिक है2 वातावरण में।[11] संतुलन बनाए रखने के लिए, सीओ के उच्च वायुमंडलीय आंशिक दबाव की स्थिति2 आणविक प्रसार द्वारा इस गैस के बढ़ते समुद्री आदान-प्रदान की ओर जाता है।
सतह के पानी में, भंग वायुमंडलीय कार्बन डाइऑक्साइड (CO2(aq)) कार्बोनिक एसिड बनाने के लिए पानी के अणुओं के साथ प्रतिक्रिया करता है (एच2सीओ3), एक कमजोर डिप्रोटिक एसिड। डिप्रोटिक एसिड में प्रत्येक अणु में दो आयनीकरण योग्य हाइड्रोजन परमाणु होते हैं।[12] एक जलीय घोल में, कार्बोनिक एसिड का आंशिक पृथक्करण एक हाइड्रोजन प्रोटॉन (H+) और बाइकार्बोनेट आयन (HCO3−), और बाद में, बाइकार्बोनेट आयन एक अतिरिक्त हाइड्रोजन प्रोटॉन और एक कार्बोनेट आयन (CO) में अलग हो जाता है32-).[13] इन अकार्बनिक कार्बन प्रजातियों के घुलने और अलग होने से हाइड्रोजन आयनों की सांद्रता में वृद्धि होती है और परिवेश की सतह के पीएच को विपरीत रूप से कम करता है। कार्बोनेट बफरिंग सिस्टम रासायनिक संतुलन में भंग अकार्बनिक कार्बन प्रजातियों को बनाए रखते हुए समुद्री जल की अम्लता को नियंत्रित करता है।
रासायनिक समीकरण में अभिकारक और उत्पाद होते हैं जो किसी भी दिशा में प्रतिक्रिया कर सकते हैं। एक प्रणाली में अधिक अभिकारकों को जोड़ने से अधिक उत्पाद उत्पादन होता है (रासायनिक प्रतिक्रिया दाईं ओर शिफ्ट होती है) और यदि अधिक उत्पाद जोड़े जाते हैं, तो अतिरिक्त अभिकारक बनेंगे, रासायनिक प्रतिक्रिया को बाईं ओर स्थानांतरित कर देंगे। इसलिए, इस मॉडल में, प्रारंभिक अभिकारक, कार्बन डाइऑक्साइड की एक उच्च सांद्रता, अंत-उत्पाद (एच) की बढ़ी हुई मात्रा का उत्पादन करती है।+ और सीओ32-), इस प्रकार पीएच को कम करता है और अधिक अम्लीय घोल बनाता है। समुद्र की प्राकृतिक बफरिंग प्रणाली कार्बोनेट आयनों के साथ अभिक्रिया करके क्षारीय वर्ण बनाने के लिए मुक्त अम्ल प्रोटॉनों द्वारा उत्पन्न अधिक बाइकार्बोनेट आयनों का उत्पादन करके पीएच में परिवर्तन का विरोध करती है।[14] हालांकि, बढ़ते वायुमंडलीय CO2 सांद्रता बफरिंग क्षमता सीमा से अधिक हो सकती है, जिसके परिणामस्वरूप समुद्र के अम्लीकरण की उच्च दर होती है। समुद्र के कार्बोनेट रसायन में बदलाव में कई तत्वों और यौगिकों के लिए समुद्री जैव-रासायनिक चक्रों में हेरफेर करने की क्षमता है, जिससे समुद्री पारिस्थितिक तंत्र पर गहरा प्रभाव पड़ता है। इसके अलावा, सीओ की घुलनशीलता2 तापमान निर्भर है; ऊंचा सतही पानी का तापमान CO को कम करता है2 घुलनशीलता। सीओ के वायुमंडलीय आंशिक दबाव में लगातार वृद्धि2 संभावित रूप से महासागर को सिंक (समुद्र की गहराई तक कार्बन का लंबवत परिवहन) के रूप में कार्य करने से एक स्रोत (सीओ) बनने में परिवर्तित कर सकता है2 समुद्र से गैस निकालना), वैश्विक तापमान में और वृद्धि।[15]
यह भी देखें
संदर्भ
- ↑ "हाइड्रोजन आयन - रसायन". britannica.com. Retrieved 18 March 2018.
- ↑ due to its extremely high charge density of approximately 2×1010 times that of a sodium ion
- ↑ Compendium of Chemical Terminology, 2nd edition McNaught, A.D. and Wilkinson, A. Blackwell Science, 1997 ISBN 0-86542-684-8, also online Archived 2005-12-12 at the Wayback Machine
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ W.S. Broecker, T. Takahashi (1997) Neutralization of fossil fuel CO2 by marine calcium carbonate
- ↑ P.N. Pearson, M.R. Palmer (2000) Atmospheric carbon dioxide concentrations over the past 60 million years Nature, 406, pp. 695-699
- ↑ C.L. Sabine, et al. (2004). The oceanic sink for anthropogenic CO2 Science, 305 (5682), pp. 367-371
- ↑ Lal R. (2008). Carbon sequestration. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 363(1492), 815–830. https://doi.org/10.1098/rstb.2007.2185
- ↑ Ben I. Mcneil & Richard J. Matear (2007). Climate change feedbacks on future oceanic acidification, Tellus B: Chemical and Physical Meteorology, 59:2, 191-198
- ↑ Hessen, D., Ågren, G., Anderson, T., Elser, J., & De Ruiter, P. (2004). Carbon Sequestration in Ecosystems: The Role of Stoichiometry. Ecology, 85(5), 1179-1192. Retrieved November 22, 2020, from http://www.jstor.org/stable/3450161
- ↑ Avishay DM, Tenny KM. Henry's Law. [Updated 2020 Sep 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK544301/
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ OpenStax, Chemistry. OpenStax CNX. Jun 20, 2016 http://cnx.org/contents/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.311.
- ↑ Middelburg, J. J., Soetaert, K., & Hagens, M. (2020). Ocean Alkalinity, Buffering and Biogeochemical Processes. Reviews of geophysics (Washington, D.C. : 1985), 58(3), e2019RG000681. https://doi.org/10.1029/2019RG000681
- ↑ Matsumoto, K. (2007). Biology-mediated temperature control on atmosphericpCO2and ocean biogeochemistry. Geophysical Research Letters, 34(20). doi:10.1029/2007gl031301