गैर-निर्दोष लिगैंड
रसायन विज्ञान में, एक (रिडॉक्स) गैर-निर्दोष लिगेंड एक धातु परिसर में एक लिगेंड होता है जहां ऑक्सीकरण अवस्था ज्ञात नहीं होती है। सामान्यतः, गैर-निर्दोष लिगेंड वाले परिसर हल्के विद्युत क्षमता पर रेडॉक्स सक्रिय होते हैं। अवधारणा मानती है कि धातु परिसरों में रेडॉक्स अभिक्रियाएं या तो धातु या लिगेंड स्थानगत होती हैं, जो अत्यधिक सरल है, यद्यपि उपयोगी है।[1]
सी.के. जार्जेंसन ने सबसे पहले लिगेंड् को निर्दोष और संदिग्ध के रूप में वर्णित किया: लिगेंड निर्दोष होते हैं जब वे केंद्रीय परमाणुओं के ऑक्सीकरण अवस्था को परिभाषित करने की अनुमति देते हैं। एक संदिग्ध लिगेंड का सबसे सरल मामला NO है...[2][3]
निर्दोष बनाम गैर-निर्दोष लिगेंड के परिसरों की रेडॉक्स अभिक्रियाएं
परंपरागत रूप से, समन्वय परिसरों की रेडॉक्स अभिक्रियाओं को धातु-केंद्रित माना जाता है। MnO4− से MnO42− में अपचयन को मैंगनीज के ऑक्सीकरण अवस्था में 7+ से 6+ में परिवर्तन द्वारा वर्णित किया गया है। ऑक्साइड लिगेंड 2- ऑक्सीकरण अवस्था में नहीं बदलते हैं, शेष ऑक्साइड एक निर्दोष लिगेंड है। [3] पारंपरिक धातु-केंद्रित रिडॉक्स युगल का एक और उदाहरण है, कोबाल्ट (III) हेक्सामाइन क्लोराइड|[Co(NH3)6]3+/[[Co(NH3)6]2+ इस परिवर्तन में अमोनिया निर्दोष है।[4]

- लिगेंड् के रेडॉक्स गैर-निर्दोष व्यवहार को निकिल बिस (स्टिलबेनेडिथियोलेट) ([Ni(S2C2Ph2)2]z) द्वारा चित्रित किया गया है। nd8 धातु आयनों के सभी बिस(1,2-डाइथियोलीन) परिसरों के रूप में, तीन ऑक्सीकरण अवस्थाओं की पहचान z = 2-, 1-, और 0 मे की जा सकती है। यदि लिगेंड को हमेशा द्विऋणायनी माना जाता है (जैसा कि औपचारिक ऑक्सीकरण में किया जाता है) , तो z = 0 के लिए आवश्यक है कि निकिल की औपचारिक ऑक्सीकरण अवस्था + IV हो। केंद्रीय निकिल परमाणु की औपचारिक ऑक्सीकरण स्थिति उपरोक्त परिवर्तनों में + II से + IV तक होती है (चित्र देखें)। यद्यपि, औपचारिक ऑक्सीकरण अवस्था (स्पेक्ट्रोस्कोपिक) धातु डी-इलेक्ट्रॉन विन्यास के आधार पर वास्तविक (स्पेक्ट्रोस्कोपिक) ऑक्सीकरण अवस्था से भिन्न होती है। स्टिलबेन-1,2-डाइथिओलेट एक रेडॉक्स गैर-निर्दोष लिगेंड के रूप में व्यवहार करता है, और ऑक्सीकरण प्रक्रिया वास्तव में धातु के अतिरिक्त लिगेंड में होती है। इससे लिगेंड रैडिकल जटिलों का निर्माण होता है। आवेश-न्यूट्रल जटिल(z = 0), एक आंशिक एकक द्विरैडिकल प्रकृति दिखा रहा है इसलिए रेडिकल ऋणायन S2C2Ph2•−. के Ni2+ यौगिक के रूप में वर्णित किया गया है। इस संकुल का प्रतिचुंबकत्व दो लिगन्ड रेडिकल्स के अयुग्मित इलेक्ट्रॉनों के बीच प्रतिलौहचुम्बकीय युग्मन से उत्पन्न होता है। एक अन्य उदाहरण डायमिडो फिनाइल लिगेंड के तांबे के परिसरों की उच्च ऑक्सीकरण अवस्था है जो आंतरआण्विक बहुकेंद्र हाइड्रोजन बंध द्वारा स्थिर होते है। [5][4]
विशिष्ट गैर-निर्दोष लिगेंड्स
- नाइट्रोसिल (NO) धातुओं को दो चरम ज्यामिति में से एक में बांधता है - झुके हुए जहां नाइट्रिक ऑक्साइड को स्यूडोहैलाइड (NO−) के रूप में माना जाता है−), और रैखिक, जहां NO को NO+ के रूप में माना जाता है।
- डाइऑक्सीजन निर्दोष हो सकता है, क्योंकि यह दो ऑक्सीकरण अवस्थाओं में उपस्थित है, सुपरऑक्साइड (O2−) और पेरोक्साइड(O22−).[6]
विस्तारित पाई- विस्थापन के साथ लिगेंड जैसे पॉरफाइरिन, फथलोसायनिन और कोरोलस [7] और लिगेंड सामान्यीकृत सूत्रों के साथ [D-CR=CR-D]n− (D = O, S, NR' और R, R' =एल्काइल या एरील) प्रायः निर्दोष नहीं होते हैं। इसके विपरीत,[D-CR=CR-CR=D]− जैसे कि NacNac या acac निर्दोष हैं।
- कैटेकोलेट्स और संबंधित 1,2- डाइऑक्सोलोन।[8]
- डाइथियोलेन्स, जैसे मेलोनिट्रिलेडिथिओलेट ( ऊपर [Ni(S2C2Ph2)2]n−का उदाहरण देखें)।
- 1,2-डायमाइन्स जैसे कि 1,2-डायमिडोबेंजीन, 2,2'-बिपिरिडीन और डाइमिथाइलग्लॉक्सिम के व्युत्पन्न। जटिल Cr(2,2'-bipyridine)3, Cr(III) का एक व्युत्पन्न है जो तीन बाइपिरिडीन1− लिगेंड से बंधा है। दूसरी ओर,[Ru(2,2'-bipyridine)3]2+ का एक-इलेक्ट्रॉन ऑक्सीकरण Ru पर स्थानीयकृत है और इस कार्य में बाइपिरिडीन एक सामान्य, निर्दोष लिगेंड के रूप में व्यवहार कर रहा है।
- फेरोसीन युक्त लिगेंड में उत्प्रेरक रूप से सक्रिय धातु केंद्र के बजाय फेरोसिन लौह केंद्र पर केंद्रित ऑक्सीकरण घटनाएं हो सकती हैं।[9]
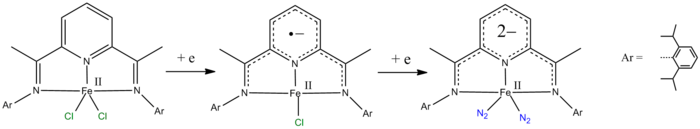
- पाइरिडीन-2,6-डायमाइन लिगेंड् को एक और दो इलेक्ट्रॉनों द्वारा अपचयित किया जा सकता है।[10][11]
जीव विज्ञान और सजातीय उत्प्रेरण में रेडॉक्स गैर-निर्दोष लिगेंड्स
कुछ एंजाइमैटिक प्रक्रियाओं में, रेडॉक्स गैर-निर्दोष सहकारक मेटलोएंजाइम के रेडॉक्स गुणों के पूरक के लिए रेडॉक्स समकक्ष प्रदान करते हैं। यद्यपि, प्रकृति में अधिकांश रेडॉक्स प्रतिक्रियाओं में निर्दोष प्रणालियां सम्मिलित होती हैं, उदा. [4Fe-4S] क्लस्टर हैं। रेडॉक्स गैर-निर्दोष लिगेंड द्वारा प्रदान किए गए अतिरिक्त रेडॉक्स समतुल्य का उपयोग सजातीय उत्प्रेरण को नियंत्रित करने वाले कारकों के रूप में भी किया जाता है। [12][13][14]
हेम्स

पोर्फिरीन लिगेंड निर्दोष (2-) या गैर निर्दोष(1-) हो सकते हैं। एंजाइम क्लोरोपरोक्सीडेज और साइटोक्रोम P450 में, पोर्फिरिन लिगेंड उत्प्रेरक चक्र के दौरान विशेष रूप से यौगिक के निर्माण मेंऑक्सीकरण को बनाए रखता है। अन्य हीम प्रोटीन में, जैसे कि मायोग्लोबिन, लिगेंड-केंद्रित रेडॉक्स नहीं होता है और पोर्फिरिन निर्दोष होता है।
गैलेक्टोज ऑक्सीडेज
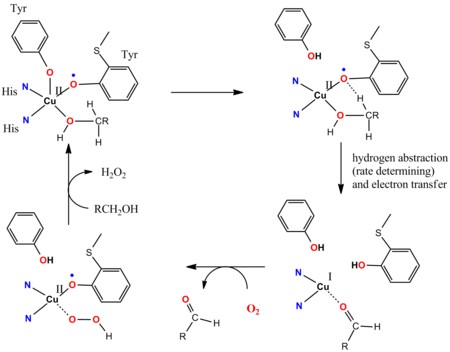
- गैलेक्टोज ऑक्सीडेज (GOase) का उत्प्रेरक चक्र गैर-निर्दोष लिगेंड्स की भागीदारी को दर्शाता है।[15][16] GOase प्राथमिक अल्कोहल को O2 का उपयोग करके एल्डिहाइड में ऑक्सीकृत करता है और H2O2जारी करता है. GOase एंजाइम की सक्रिय स्थल में CuII आयन से समन्वित एक टाइरोसिल होता है। उत्प्रेरक चक्र के प्रमुख चरणों में, एक सहयोगी ब्रोंस्टेड-क्षारकीय लिगेंड-स्थल अल्कोहल को डिप्रोटोनेट करता है, और बाद में टाइरोसिनिल रेडिकल के ऑक्सीजन परमाणु समन्वित अल्कोक्साइड क्रियाधार के अल्फा-सीएच कार्यक्षमता से एक हाइड्रोजन परमाणु का सार करता है। टाइरोसिनिल रेडिकल उत्प्रेरक चक्र में भाग लेता है: 1e-ऑक्सीकरण Cu(II/I) युगल द्वारा प्रभावित होता है और 1e ऑक्सीकरण टायरोसिल रेडिकल द्वारा प्रभावित होता है, जिससे समग्र 2e परिवर्तन होता है। रेडिकल पृथक्करण तेज है। टाइरोसिन रेडिकल लिगेंड और d9 CuII केंद्र के अप्रकाशित चक्रण के बीच प्रतिलोहचुंबकीय युग्मन, संश्लेषित नमूने के अनुरूप प्रतिचुम्बकीय मूल अवस्था को जन्म देती है।[17]
यह भी देखें
- विद्युतवाद
- समावयवता
- रिडॉक्स
संदर्भ
- ↑ Ganguly, Sumit; Ghosh, Abhik (2019-07-16). "Seven Clues to Ligand Noninnocence: The Metallocorrole Paradigm". Accounts of Chemical Research (in English). 52 (7): 2003–2014. doi:10.1021/acs.accounts.9b00115. ISSN 0001-4842. PMID 31243969.
- ↑ Jørgensen CK (1966). "Differences between the four halide ligands, and discussion remarks on trigonal-bipyramidal complexes, on oxidation states, and on diagonal elements of one-electron energy". Coordination Chemistry Reviews. 1 (1–2): 164–178. doi:10.1016/S0010-8545(00)80170-8.
- ↑ 3.0 3.1 Although a more careful examination of the electronic structure of the redox partners reveals however that the oxide ligands are affected by the redox change, this effect is minor and the formal oxidation state of oxygen stays the same.
- ↑ 4.0 4.1 Aragoni, M. Carla; Caltagirone, Claudia; Lippolis, Vito; Podda, Enrico; Slawin, Alexandra M. Z.; Woollins, J. Derek; Pintus, Anna; Arca, Massimiliano (2020-12-07). "Diradical Character of Neutral Heteroleptic Bis(1,2-dithiolene) Metal Complexes: Case Study of [Pd(Me2timdt)(mnt)] (Me2timdt = 1,3-Dimethyl-2,4,5-trithioxoimidazolidine; mnt2– = 1,2-Dicyano-1,2-ethylenedithiolate)". Inorganic Chemistry. 59 (23): 17385–17401. doi:10.1021/acs.inorgchem.0c02696. ISSN 0020-1669. PMC 7735710. PMID 33185438.
- ↑ Rajabimoghadam, Khashayar; Darwish, Yousef; Bashir, Umyeena; Pitman, Dylan; Eichelberger, Sidney; Siegler, Maxime A.; Swart, Marcel; Garcia-Bosch, Isaac (2018). "Catalytic Aerobic Oxidation of Alcohols by Copper Complexes Bearing Redox-Active Ligands with Tunable H-Bonding Groups". Journal of the American Chemical Society. 140 (48): 16625–16634. doi:10.1021/jacs.8b08748. PMC 6645702. PMID 30400740.
- ↑ Kaim W, Schwederski B (2010). "Non-innocent ligands in bioinorganic chemistry—An overview". Coordination Chemistry Reviews. 254. (13-14) (13–14): 1580–1588. doi:10.1016/j.ccr.2010.01.009.
- ↑ Ghosh, Abhik (2017-02-22). "Electronic Structure of Corrole Derivatives: Insights from Molecular Structures, Spectroscopy, Electrochemistry, and Quantum Chemical Calculations". Chemical Reviews (in English). 117 (4): 3798–3881. doi:10.1021/acs.chemrev.6b00590. ISSN 0009-2665.
- ↑ Zanello P, Corsini M (2006). "Homoleptic, mononuclear transition metal complexes of 1,2-dioxolenes: Updating their electrochemical-to-structural (X-ray) properties". Coordination Chemistry Reviews. 250 (15–16): 2000–2022. doi:10.1016/j.ccr.2005.12.017.
- ↑ Wang X, Thevenon A, Brosmer JL, Yu I, Khan SI, Mehrkhodavandi P, Diaconescu PL (August 2014). "Redox control of group 4 metal ring-opening polymerization activity toward L-lactide and ε-caprolactone". J. Am. Chem. Soc. 136 (32): 11264–7. doi:10.1021/ja505883u. PMID 25062499.
- ↑ de Bruin B, Bill E, Bothe E, Weyhermüller T, Wieghardt K (June 2000). "Molecular and electronic structures of bis(pyridine-2,6-diimine)metal complexes [ML2](PF6)n (n = 0, 1, 2, 3; M = Mn, Fe, Co, Ni, Cu, Zn)". Inorg Chem. 39 (13): 2936–47. doi:10.1021/ic000113j. PMID 11232835.
- ↑ Chirik PJ, Wieghardt K (February 2010). "Chemistry. Radical ligands confer nobility on base-metal catalysts". Science. 327 (5967): 794–5. doi:10.1126/science.1183281. PMID 20150476.
- ↑ Lyaskovskyy V, de Bruin B (2012). "Redox Non-Innocent Ligands: Versatile New Tools to Control Catalytic Reactions". ACS Catalysis. 2 (2): 270–279. doi:10.1021/cs200660v.
- ↑ Luca OR, Crabtree RH (February 2013). "Redox-active ligands in catalysis". Chem Soc Rev. 42 (4): 1440–59. doi:10.1039/c2cs35228a. PMID 22975722.
- ↑ Chirila, Andrei; Das, Braja Gopal; Kuijpers, Petrus F.; Sinha, Vivek; Bruin, Bas de (2018), "Application of Stimuli-Responsive and "Non-innocent" Ligands in Base Metal Catalysis", Non-Noble Metal Catalysis (in English), John Wiley & Sons, Ltd, pp. 1–31, doi:10.1002/9783527699087.ch1, ISBN 9783527699087
- ↑ Whittaker MM, Whittaker JW (March 1993). "Ligand interactions with galactose oxidase: mechanistic insights". Biophys. J. 64 (3): 762–72. Bibcode:1993BpJ....64..762W. doi:10.1016/S0006-3495(93)81437-1. PMC 1262390. PMID 8386015.
- ↑ Wang Y, DuBois JL, Hedman B, Hodgson KO, Stack TD (January 1998). "Catalytic galactose oxidase models: biomimetic Cu(II)-phenoxyl-radical reactivity". Science. 279 (5350): 537–40. Bibcode:1998Sci...279..537W. doi:10.1126/science.279.5350.537. PMID 9438841.
- ↑ Müller J, Weyhermüller T, Bill E, Hildebrandt P, Ould-Moussa L, Glaser T, Wieghardt K (March 1998). "Why Does the Active Form of Galactose Oxidase Possess a Diamagnetic Ground State?". Angew. Chem. Int. Ed. Engl. 37 (5): 616–619. doi:10.1002/(SICI)1521-3773(19980316)37:5<616::AID-ANIE616>3.0.CO;2-4. PMID 29711069.
अग्रिम पठन
- Dzik, W. I..; Zhang, X. P.; de Bruin, B. (2011). "Redox Noninnocence of Carbene Ligands: Carbene Radicals in (Catalytic) C-C Bond Formation". Inorganic Chemistry. 50 (20): 9896–9903. doi:10.1021/ic200043a. PMID 21520926.
- Büttner, T.; Geier, J.; Frison, G.; Harmer, J.; Calle, C.; Schweiger, A.; Schönberg, H.; Grützmacher, H. (2005). "A Stable Aminyl Radical Metal Complex". Science. 307. 307 (5707): 235–238. Bibcode:2005Sci...307..235B. doi:10.1126/science.1106070. PMID 15653498.
- Hetterscheid, D.G.H.; Kaiser, J.; Reijerse, E.; Peters, T.P.J.; Thewissen, S.; Blok, A.N.J.; Smits, J.M.M.; de Gelder, R.; de Bruin, B. (2005). "IrII(ethene): Metal or Carbon Radical?". Journal of the American Chemical Society. 127 (6): 1895–1905. doi:10.1021/ja0439470. PMID 15701024.
- Blanchard, S.; Derat, E.; Desage-El Murr, M.; Fensterbank, L.; Malacria, M; Mouriès-Mansuy, V. (2012). "Non-Innocent Ligands: New Opportunities in Iron Catalysis". European Journal of Inorganic Chemistry. 2012 (3): 376–389. doi:10.1002/ejic.201100985.
- Kaim, W. (2012). "The Shrinking World of Innocent Ligands: Conventional and Non-Conventional Redox-Active Ligands". European Journal of Inorganic Chemistry. 2012 (3): 343–348. doi:10.1002/ejic.201101359.