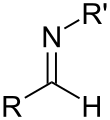
इमिने
कार्बनिक रसायन विज्ञान में, इमाइन एक कार्यात्मक समूह या कार्बनिक यौगिक है जिसमें कार्बन-नाइट्रोजन द्विबंध (C=N) होता है नाइट्रोजन परमाणु को हाइड्रोजन या कार्बनिक समूह (R) से जोड़ा जा सकता है। कार्बन परमाणु में दो अतिरिक्त एकल बंधन होते हैं।[1][2] इमाइन कृत्रिम और प्राकृतिक रूप से पाए जाने वाले यौगिकों में सामान्य हैं और ये कई अभिक्रियाओं में भाग लेता है।[3]
संरचना
केटामाइन और एल्डिमाइन् के लिए, क्रमशः पांच केंद्र परमाणु (C2C=NX and C(H)C=NX, X = H or C) समतलीय हैं। पारस्परिक रूप से दोहरे बंध वाले कार्बन और नाइट्रोजन परमाणुओं के sp2-संकरण से समतलता का परिणाम प्राप्त होता है। गैर-संयुग्मित इमाइनों के लिए C=N दूरी 1.29-1.31 Å और संयुग्मित इमाइनों के लिए 1.35 Å है। इसके विपरीत, एमाइन और नाइट्राइल में C-N दूरी क्रमशः 1.47 और 1.16 Å है।[4]C=N बंध के चारों ओर घूर्णन धीमा होता है। NMR स्पेक्ट्रोस्कोपी का उपयोग करते हुए, एल्डिमाइन् के E-और Z- समावयवी का पता लगाया गया है। त्रिविमविन्यासी प्रभावों के कारण, E समावयव सबसे अधिक पसंद किया जाता है।[5]
नामकरण और वर्गीकरण
इमाइन शब्द 1883 में जर्मन रसायनज्ञ अल्बर्ट लाडेनबर्ग द्वारा निर्मित किया गया था।[6] सामान्यतः इमाइन सामान्य सूत्र R2C = NR वाले यौगिकों को संदर्भित करता है, जैसा कि नीचे चर्चा की गई है।[7]प्राचीन साहित्य में, इमाइन एक एपॉक्साइड के एज़ा-एनालॉग को संदर्भित करता है। इस प्रकार, एथिलीनिमाइन तीन-सदस्यीय चक्र प्रजाति एज़िरिडीन C2H4NH है।[8] द्विबंध और एकल बंध वाले एमाइन से इमाइन के संबंध को इमाइड और एमाइड के साथ सहसंबद्ध किया जा सकता है, जैसा कि सक्सीनिमाइड बनाम एसिटामाइड में होता है।
NR समूह के साथ ऑक्सीजन के प्रतिस्थापन के द्वारा इमाइन कीटोन और एल्डिहाइड से संबंधित हैं। जब R = H, यौगिक प्राथमिक इमाइन होता है, जब R हाइड्रोकार्बिल होता है, तो यौगिक द्वितीयक इमाइन होता है। यदि यह समूह हाइड्रोजन परमाणु नहीं है, तो यौगिक को कभी-कभी शिफ क्षार के रूप में संदर्भित किया जा सकता है।[9] जब R3OH होता है, तो इमाइन को ऑक्सीम कहा जाता है, और जब R3NH2 होता है, तो इमाइन को हाइड्रोज़ोन कहा जाता है।।
प्राथमिक इमाइन जिसमें C दोनों हाइड्रोकार्बिल से जुड़ा होता है,और H प्राथमिक एल्डिमाइन कहलाता है; ऐसे समूहों के साथ द्वितीयक इमाइन को द्वितीयक एल्डिमाइन कहा जाता है।[10]प्राथमिक इमाइन जिसमें C दो हाइड्रोकार्बिल् से जुड़ा होता है उसे प्राथमिक केटामाइन कहा जाता है; ऐसे समूहों के साथ द्वितीयक इमाइन को द्वितीयक केटामाइन कहा जाता है ।[11]
N-सल्फिनियल इमाइन, नाइट्रोजन परमाणु से जुड़े एक सल्फिनियल समूह वाले इमाइन का एक विशेष वर्ग है।
इमाइन का संश्लेषण
कार्बोनिल-एमीन संघनन
इमाइन सामान्यतः प्राथमिक अमाइन और एल्डिहाइड या कीटोन के संघनन द्वारा तैयार किए जाते हैं।।[12][13] कीटोन एल्डिहाइड की तुलना में अलग अभिक्रियाओं से गुजरते हैं। क्रियाविधि के संदर्भ में, इस तरह की अभिक्रियाएं नाभिकरागी योग के माध्यम से आगे बढ़ती हैं, जो एक हेमीमिनल -C(OH)(NHR)-अन्तःस्थायी देती हैं, इसके बाद इमाइन उत्पन्न करने के लिए जल का निष्कासन होता है [14] इस अभिक्रिया में संतुलन सामान्यतः कार्बोनिल यौगिक और अमाइन के पक्ष में होता है, जिससे स्थिरक्वाथी आसवन या निर्जलन कारक का उपयोग, जैसे कि आणविक छलनी या मैग्नीशियम सल्फेट, इमाइन गठन के पक्ष में आवश्यक हो। आधुनिक वर्षों में, त्रित(2,2,2-ट्राइफ्लोरोइथाइल) बोरेट [B(OCH2CF3)3] पाइरोलिडाइन[15] या टाइटेनियम एथोक्साइड [Ti(OEt)4][16]जैसे कई अभिकर्मकों को गठन को उत्प्रेरित करने के लिए दिखाया गया है।
प्राथमिक अमाइन की तुलना में दुर्लभ अमोनिया का उपयोग प्राथमिक इमीन उत्पन्न करने के लिए होता है।[17] हेक्साफ्लोरोएसीटोन में, हेमियामिनल मध्यवर्ती को अलग किया जा सकता है।[18]
नाइट्राइल से
नाइट्राइल के साथ ग्रिग्नार्ड अभिक्रिया के माध्यम से प्राथमिक केटामाइन को संश्लेषित किया जा सकता है। इस विधि को मोरेउ-मिग्नोनैक केटामाइन संश्लेषण के रूप में जाना जाता है।[19] [20][21] उदाहरण के लिए, बेंजोफेनोन इमाइन को फेनिलमैग्नीशियम ब्रोमाइड के साथ बेंज़ोनाइट्राइल में मिलाकर सावधानीपूर्वक जल अपघटन द्वारा संश्लेषित किया जा सकता है (ऐसा न हो कि इमाइन जल अपघटित हो):[22]
- C6H5CN + C6H5MgBr → (C6H5)2C=NMgBr
- (C6H5)2C=NMgBr + H2O → (C6H5)2C=NH + MgBr(OH
विशिष्ट तरीके
इमीन् के संश्लेषण के लिए कई अन्य विधियां उपस्थित हैं।
- धातु कार्बेनोइड् (डायज़ोकार्बोनिल यौगिकों से उत्पादित) के साथ कार्बनिक एज़ाइड् की अभिक्रिया ।[23]
- नाइट्रोजन यौगिकों के साथ कार्बन अम्लों का संघनन।
- स्टिग्लिट्ज़ पुनर्व्यवस्था में ट्रिटाइल एन-हेलोमाइन् की पुनर्व्यवस्था।
- श्मिट अभिक्रिया में हाइड्रोजोइक अम्ल के साथ ऐल्कीनों की अभिक्रिया द्वारा।
- हॉश अभिक्रिया में एक नाइट्राइल, हाइड्रोक्लोरिक अम्ल और एक ऐरीन की अभिक्रिया द्वारा।
- एसिंगर अभिक्रिया में 3-थियाज़ोलिन का बहुघटक संश्लेषण।
- ऑक्सीम का ऊष्मीय अपघटन।[24]
अभिक्रियाएं

जल अपघटन
इमाइन की मुख्य अभिक्रिया अवांछनीय होती है, उनका जल अपघटन पुनः अमीन और कार्बोनिल पूर्ववर्ती में होता है।
- R2C=NR' + H2O ⇌ R2C=O + R'NH2
विषमचक्रों के पूर्ववर्ती
इमाइन व्यापक रूप से विषमचक्रीय संश्लेषण में मध्यवर्ती के रूप में उपयोग किया जाता है।
- पोवारोव अभिक्रिया में ऐरोमैटिक इमाइन एनोल ईथर से क्विनोलिन के साथ अभिक्रिया करता है।
- इमाइन् [2+2] साइक्लो योग में कीटोन के साथ स्टुडिंगर संश्लेषण में β-लैक्टम बनाने के लिए, ऊष्मीय रूप से अभिक्रिया करते हैं।[25] इसमें कई रूपों का वर्णन किया गया है।[26][27]
- इमाइन एक टेट्राहाइड्रोपाइरिडीन के लिए इमाइन डील्स -एल्डर अभिक्रिया में डायनेस के साथ अभिक्रिया करता है।
- एज़-बायलिस-हिलमैन अभिक्रिया में एलिलिक एमाइन देने के लिए टोसिलीमाइन α, β-असंतृप्त कार्बोनिल यौगिक के साथ अभिक्रिया करता है।
अम्ल-क्षार अभिक्रियाएँ
जनक ऐमीन की तरह, इमीनियम लवण देने के लिए इमाइन हल्के बुनियादी और विपरीत रूप से प्रोटोनित होते हैं:
R2C=NR' + H+ [R2C=NHR']+
वैकल्पिक रूप से, प्राथमिक इमीन् N- ऐल्किलन की अनुमति देने के लिए पर्याप्त रूप से अम्लीय होते हैं, जैसा कि बेंजोफेनोन इमाइन के साथ दर्शाया गया है:[28]
- (C6H5)2C=NH + CH3Li → (C6H5)2C=NLi + CH4
- (C6H5)2C=NLi + CH3I → (C6H5)2C=NCH3 + Li
लुईस अम्ल क्षार अभिक्रियाएं
समन्वय रसायन विज्ञान में इमाइन् लिगेंड हैं। विशेष रूप से लोकप्रिय उदाहरण सैलिसिलडिहाइड, सैलेन लिगैंड् से प्राप्त शिफ क्षार लिगेंड के साथ पाए जाते हैं। इस तरह के परिसरों के माध्यम से इमीन्स की धातु-उत्प्रेरित अभिक्रियाएं आगे बढ़ती हैं। शास्त्रीय समन्वय परिसर नाइट्रोजन के माध्यम से धातुओं को बांधता है कम- संकर्तृक धातुओं के लिए, η2-इमाइन लिगेंड देखे जाते हैं।
नाभिकरागी संयोजन
कीटोन और एल्डिहाइड के समान, प्राथमिक इमाइन कार्बनिक समकक्षों द्वारा हमला करने के लिए अतिसंवेदनशील होते हैं। यह विधि द्वितीयक अमाइन के संश्लेषण की अनुमति देती है:[29][30]
- R2C=NR' + R"Li → R2R"CN(Li)R'
- R2R"CN(Li)R' + H2O → R2R"CNHR' + LiOH
इमाइन अपचयन
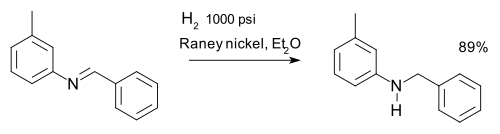
अपचयित एमिन के माध्यम से इमाइन को अपचयित किया जाता है। उदाहरण के लिए m-टॉलीबेन्ज़िलएमिन के संश्लेषण में हाइड्रोजनीकरण के माध्यम से एक इमाइन को एमाइन में अपचयित किया जा सकता है:[31]
- अन्य अपचायक कारक लिथियम एल्यूमीनियम हाइड्राइड और सोडियम बोरोहाइड्राइड हैं।[32]
रोडियम-DIOP उत्प्रेरक का उपयोग करके हाइड्रोसिलिलेशन द्वारा इमाइन का असममित अपचयन प्राप्त किया गया।[33] कई प्रणालियों की जांच की जा चुकी है।[34][35] उनकी बढ़ी हुई इलेक्ट्रॉनरागिता के कारण, इमिनियम व्युत्पन्न विशेष रूप से अमाइन अपचयन के लिए अतिसंवेदनशील होते हैं। इस तरह की कटौती स्थानांतरण हाइड्रोजनीकरण या सोडियम साइनोबोरोहाइड्राइड की स्टोइकोमेट्रिक क्रिया द्वारा प्राप्त की जा सकती है। चूँकि असममित कीटोन् से प्राप्त होने वाली इमीन् प्रोकाइरल हैं, इसलिए उनका अपचयन काइरल एमाइन के लिए एक मार्ग को परिभाषित करता है।।
बहुलकीकरण
जैसा कि मिथाइलमाइन और फॉर्मेल्डीहाइड के संघनन द्वारा चित्रित किया गया है, जो हेक्साहाइड्रो-1,3,5-ट्राईज़ीन देता है।
इमाइन बहुलक (पॉलीइमाइन) को बहुसंयोजक एल्डिहाइड और एमाइन से संश्लेषित किया जा सकता है।[36] कमरे के तापमान पर एल्डिहाइड और अमाइन एकलक को एक साथ मिलाने पर बहुलकीकरण अभिक्रिया आगे बढ़तीं है।अधिकांश स्थितियो में कम मात्रा में विलायक की आवश्यकता हो सकती है। विट्रीमर्स के रूप में उनके आवेदन के कारण पॉलीमाइन् विशेष रूप से अच्छी सामग्री हैं। इमाइन बंध की गतिशील सहसंयोजक प्रकृति के कारण, पॉलीमाइन को अपेक्षाकृत आसानी से पुनर्नवीनीकरण किया जा सकता है। इसके अतिरिक्त पॉलीमाइन अपने चिकित्सा व्यवहार के लिए जाने जाते हैं।[37][38]
विविध अभिक्रियाएं
पिनाकोल युग्मन के समान, इमाइन अपचायक युग्मन के लिए अतिसंवेदनशील होते हैं जो 1,2-डाई एमीन की ओर ले जाते हैं।[39]
इमाइन को मेटा-क्लोरोपरॉक्सीबेंजोइकअम्ल (mCPBA) के साथ ऑक्सीज़िरिडाइन देने के लिए ऑक्सीकृत किया जाता है।
एशवाइलर क्लार्क अभिक्रिया में फॉर्मिक अम्ल के साथ एमाइन के क्षारीकरण में इमाइन मध्यवर्ती हैं
कार्बोहाइड्रेट रसायन विज्ञान में एक अमादोरी पुनर्व्यवस्था जिसमें इमाइन सम्मिलित है
एक अस्थिर सल्फोनियम यलाइड द्वारा इमाइन की मेथिलीन स्थानांतरण अभिक्रिया एक एज़िरिडाइन प्रणाली दे सकती है। इमाइन पुडोविक अभिक्रिया और कबाचनिक-फील्ड् अभिक्रिया में डाईएल्काइल फॉस्फेट के साथ अभिक्रिया करता है
जैविक भूमिका
इमाइन प्रकृति में सामान्य हैं।[40][41] पाइरिडोक्सल फॉस्फेट-निर्भर एंजाइम (PLPएंजाइम) एल्डीमाइन (या शिफ क्षार) से जुड़ी असंख्य अभिक्रियाओं को उत्प्रेरित करते हैं।[42]

यह भी देखें
- एनमाइन
- शिफ क्षार
- कार्बोक्सिमिडेट
- ऑक्सीम
- ऑक्साजोलिडाइन
- C=N द्विबंध वाले अन्य कार्यात्मक समूह: ऑक्सीम्स, हाइड्रोज़ोन
- CN त्रिबंध वाले अन्य कार्यात्मक समूह: नाइट्राइल,सोनिट्रील
संदर्भ
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "imines". doi:10.1351/goldbook.I02957
- ↑ March, Jerry (1985). Advanced Organic Chemistry Reactions, Mechanisms and Structure (3rd ed.). New York: Wiley, inc. ISBN 0-471-85472-7. OCLC 642506595.
- ↑ Saul Patai, ed. (1970). Carbon–Nitrogen Double Bonds. John Wiley & Sons. doi:10.1002/9780470771204. ISBN 9780471669425. OCLC 639112179.
- ↑ C. Sandorfy (1970). "General and theoretical aspects". In Saul Patai (ed.). Carbon–Nitrogen Double Bonds. John Wiley & Sons. pp. 1–60. doi:10.1002/9780470771204.ch1. ISBN 9780470771204.
- ↑ Bjørgo, Johannes; Boyd, Derek R.; Watson, Christopher G.; Jennings, W. Brian; Jerina, Donald M. (1974). "E–Z-isomerism in Aldimines". J. Chem. Soc., Perkin Trans. 2 (9): 1081–1084. doi:10.1039/P29740001081.
- ↑ Ladenburg, A. (1883). "Ueber die Imine" [About imines]. Berichte der Deutschen Chemischen Gesellschaft (Reports of the German Chemical Society) (in Deutsch). 16: 1149–1152. doi:10.1002/cber.188301601259.
From p. 1150: Denn offenbar gehört auch das Piperidin in die Klasse der von mir gesuchten Verbindungen, für welche der Name Imine durch die bestehende Nomenklatur angezeigt ist.
[For obviously piperidine also belongs in the class of compounds that are sought by me, for which the name "imines" is indicated by the prevailing nomenclature.]{{cite journal}}: CS1 maint: url-status (link) - ↑ "Amines and Imines". Nomenclature of Organic Compounds. Advances in Chemistry. Vol. 126. 1974. pp. 180–188. doi:10.1021/ba-1974-0126.ch023. ISBN 9780841201910. OCLC 922539.
- ↑ "Ethylenimine". Organic Syntheses. 30: 38. 1950. doi:10.15227/orgsyn.030.0038.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Schiff base". doi:10.1351/goldbook.S05498
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "aldimines". doi:10.1351/goldbook.A00209.html
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "ketimines". doi:10.1351/goldbook.K03381.html
- ↑ G. Wittig, A. Hesse (1970). "Directed Aldol Condensations:b-Phenylcinnamaldehyde". Organic Syntheses. 50: 66. doi:10.15227/orgsyn.050.0066.
- ↑ Bigelow, Lucius A.; Eatough, Harry (1928). "बेंजालेनिलिन". Organic Syntheses. 8: 22. doi:10.15227/orgsyn.008.0022.
- ↑ Reeves, Jonathan T.; Visco, Michael D.; Marsini, Maurice A.; Grinberg, Nelu; Busacca, Carl A.; Mattson, Anita E.; Senanayake, Chris H. (2015-05-15). "A General Method for Imine Formation Using B(OCH2CF3)3". Organic Letters. 17 (10): 2442–2445. doi:10.1021/acs.orglett.5b00949. ISSN 1523-7060. PMID 25906082.
- ↑ Morales, Sara; Guijarro, Fernando G.; García Ruano, José Luis; Cid, M. Belén (2014-01-22). "A General Aminocatalytic Method for the Synthesis of Aldimines". Journal of the American Chemical Society. 136 (3): 1082–1089. doi:10.1021/ja4111418. ISSN 0002-7863. PMID 24359453.
- ↑ Collados, Juan F.; Toledano, Estefanía; Guijarro, David; Yus, Miguel (2012-07-06). "Microwave-Assisted Solvent-Free Synthesis of Enantiomerically Pure N-(tert-Butylsulfinyl)imines". The Journal of Organic Chemistry. 77 (13): 5744–5750. doi:10.1021/jo300919x. ISSN 0022-3263. PMID 22694241.
- ↑ Verardo, G.; Giumanini, A. G.; Strazzolini, P.; Poiana, M. (1988). "Ketimines From Ketones and Ammonia". Synthetic Communications. 18 (13): 1501–1511. doi:10.1080/00397918808081307.
- ↑ 18.0 18.1 Middleton, W. J.; Carlson, H. D. (1970). "Hexafluoroacetone imine". Org. Syntheses. 50: 81–3. doi:10.15227/orgsyn.050.0081.
- ↑ "Moureau-Mignonac Ketimine Synthesis". Comprehensive Organic Name Reactions and Reagents (in English). Hoboken, NJ, USA: John Wiley & Sons, Inc. 2010-09-15. pp. 1988–1990. doi:10.1002/9780470638859.conrr446. ISBN 9780470638859.
- ↑ Koos, Miroslav; Mosher, Harry S. (1993). "α-Amino-α-trifluoromethyl-phenylacetonitrile: A potential reagent for NMR determination of enantiomeric purity of acids". Tetrahedron. 49 (8): 1541–1546. doi:10.1016/S0040-4020(01)80341-0.
- ↑ Moureu, Charles; Mignonac, Georges (1920). "Les Cetimines". Annales de Chimie. 9 (13): 322–359. Retrieved 18 June 2014.
- ↑ Pickard, P. L.; Tolbert, T. L. (December 1961). "An Improved Method of Ketimine Synthesis". The Journal of Organic Chemistry (in English). 26 (12): 4886–4888. doi:10.1021/jo01070a025. ISSN 0022-3263.
- ↑ Mandler, Michael; Truong, Phong; Zavalij, Peter; Doyle, Michael (Jan 14, 2014). "Catalytic Conversion of Diazocarbonyl Compounds to Imines: Applications to the Synthesis of Tetrahydropyrimidines and β-Lactams". Organic Letters. 16 (3): 740–743. doi:10.1021/ol403427s. PMID 24423056.
- ↑ Arthur Lachman (1930). "Diphenylmethane Imine Hydrochloride". Organic Syntheses. 10: 28. doi:10.15227/orgsyn.010.0028.
- ↑ Hubschwerlen, Christian; Specklin, Jean-Luc (1995). "(3S,4S)-3-Amino-1-(3,4-Dimethoxybenzyl)-4-[(R)-2,2-Dimethyl-1,3-Dioxolan-4-Yl]-2-Azetidinone". Organic Syntheses. 72: 14. doi:10.15227/orgsyn.072.0014.
- ↑ Hegedus, Lous S.; McGuire, Michael A.; Schultze, Lisa M. (1987). "1,3-Dimethyl-3-Methoxy-4-Phenylazetidinone". Organic Syntheses. 65: 140. doi:10.15227/orgsyn.065.0140.
- ↑ Ian P. Andrews and Ohyun Kwon (2011). "PHOSPHINE-CATALYZED [3 + 2] ANNULATION: SYNTHESIS OF ETHYL 5-(tert-BUTYL)-2-PHENYL-1-TOSYL-3-PYRROLINE-3-CARBOXYLATE". Organic Syntheses. 88: 138. doi:10.15227/orgsyn.088.0138.
- ↑ Nottingham, Chris; Lloyd-Jones, Guy C. (2018). "Trimethylsilyldiazo[13C]methane: A Versatile 13C-Labelling Reagent". Organic Syntheses. 95: 374–402. doi:10.15227/orgsyn.095.0374.
- ↑ Hu, Anjing; Zhang, Zhan-Ming; Xiao, Yuanjing; Zhang, Junliang (2020). "Stereoselective Synthesis of Chiral Sulfinamide Monophosphine Ligands (Ming-Phos)(S, Rs)-M". Organic Syntheses. 97: 262–273. doi:10.15227/orgsyn.097.0262. S2CID 235020219.
- ↑ Vincent Rodeschini, Nigel S. Simpkins, and Fengzhi Zhang (2007). "Chiral Lithium Amide Base Desymmetrization of a Ring Fused Imide: Formation of (3aS,7aS)-2[2-(3,4-Dimethoxyphenyl)-ethyl]-1,3-dioxo-octahydro-isoindole-3a-Carboxylic Acid Methyl Ester". Organic Syntheses. 84: 306. doi:10.15227/orgsyn.084.0306.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ C. F. H. Allen and James VanAllan (1955). "m-Tolylbenzylamine". Organic Syntheses: 827.; Collective Volume, vol. 3
- ↑ For example: Ieva R. Politzer and A. I. Meyers (1988). "Aldehydes from 2-Benzyl-4,4,6-trimethyl-5,6-dihydro-1,3(4H)-oxazine: 1-Phenylcyclopentanecarboxaldehyde". Organic Syntheses.; Collective Volume, vol. 6, p. 905
- ↑ Langlois, N (1973). "Synthese asymetrique d'amines par hydrosilylation d'imines catalysee par un complexe chiral du rhodium". Tetrahedron Lett. 14 (49): 4865–4868. doi:10.1016/S0040-4039(01)87358-5.
- ↑ Kobayashi, Shū; Ishitani, Haruro (1999). "Catalytic Enantioselective Addition to Imines". Chem. Rev. 99 (5): 1069–94. doi:10.1021/cr980414z. PMID 11749440.
- ↑ J. Martens: Reduction of Imino Groups (C=N) in (G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann) Houben-Weyl Stereoselective Synthesis, Workbench Edition E21 Volume 7, S. 4199-4238, Thieme Verlag Stuttgart, 1996, ISBN 3-13-106124-3.
- ↑ Schoustra, Sybren K.; Groeneveld, Timo; Smulders, Maarten M. J. (2021). "The effect of polarity on the molecular exchange dynamics in imine-based covalent adaptable networks". Polymer Chemistry. 12 (11): 1635–1642. doi:10.1039/D0PY01555E.
- ↑ Schoustra, Sybren K.; Dijksman, Joshua A.; Zuilhof, Han; Smulders, Maarten M. J. (2021). "Molecular control over vitrimer-like mechanics – tuneable dynamic motifs based on the Hammett equation in polyimine materials". Chemical Science. 12 (1): 293–302. doi:10.1039/d0sc05458e. ISSN 2041-6520. PMC 8178953. PMID 34163597.
- ↑ Zhu, Jiaqi (2020). "A self-healing transparent polydimethylsiloxane elastomer based on imine bonds". European Polymer Journal. 123: 109382. doi:10.1016/j.eurpolymj.2019.109382. S2CID 214199868.
- ↑ Alexakis, Alex; Aujard, Isabelle; Kanger, Tonis; Mangeney, Pierre (1999). "(R,R)- and (S,S)-N,N'-Dimethyl-1,2-Diphenylethylene-1,2-Diamine". Organic Syntheses. 76: 23. doi:10.15227/orgsyn.076.0023.
- ↑ "Researchers look to nature to unearth the secrets of cyclic imine cleavage". EurekAlert! (in English). Retrieved 2021-07-22.
- ↑ Borchert, Andrew J.; Ernst, Dustin C.; Downs, Diana M. (2019). "Reactive Enamines and Imines in vivo: Lessons from the RidA Paradigm". Trends in Biochemical Sciences. 44 (10): 849–860. doi:10.1016/j.tibs.2019.04.011. ISSN 0968-0004. PMC 6760865. PMID 31103411.
- ↑ Eliot, Andrew C.; Kirsch, Jack F. (2004). "Pyridoxal Phosphate Enzymes: Mechanistic, Structural, and Evolutionary Considerations". Annual Review of Biochemistry. 73: 383–415. doi:10.1146/annurev.biochem.73.011303.074021. PMID 15189147.